El carcinoma escamocelular de la cabeza y el cuello afecta un número muy importante de personas en el mundo, ahora con mayor frecuencia a menores de 40 años. Tradicionalmente, se han manejado con cirugía del tumor primario más disección ganglionar de cuello selectiva, especialmente en los tumores T1 y T2. La anatomía linfática de cuello es compleja y las áreas comprometidas usualmente tienen más de un sitio de drenaje, por lo que es importante retirar los ganglios con micrometástasis, mediante la disección electiva de cuello (DEC). Pero ahora se puede practicar, con menor morbilidad y de forma oncológica segura, la disección ganglionar superselectiva radioguiada (DGSSR), previo mapeo linfático con SPECT/CT. Derivado de esto, por primera vez en nuestra institución y en Colombia, hasta donde tenemos conocimiento, se ha tratado a una paciente de 38 años con un carcinoma escamocelular de lengua oral T1 N0 M0, EI, con la técnica mencionada.
Squamous cell carcinoma of the head and neck affects very significant number of people worldwide, as is now being seen more often in those less than 40 years-old. They have traditionally been managed with surgery of the primary tumor plus selective dissection of neck nodes, particularly in T1 and T2 tumors. The lymphatic anatomy of the neck is complicated and the compromised areas usually have more than one drainage site; therefore it is important to remove the nodes with micrometastases by selective neck dissection. This can be now done by radioguided super-selective node dissection by prior lymphatic mapping with SPECT/CT, with a lower morbidity and with oncological safety. Using this, and as far as we know, for the first time in our Institute and in Colombia, a 38 year-old patient with oral squamous cell carcinoma of the tongue (T1 N0 M0, EI) has been treated using this technique.
Introducción
El cáncer escamocelular de la cavidad oral y la orofaringe se encuentran entre los más frecuentes en el mundo, con 250 millones de casos nuevos por año1. Según estadísticas del Instituto Nacional de Cancerología de Colombia (INC), el número de nuevos casos de este tumor atendidos por la institución en el 2009 fue de 59. Su gran mayoría, 48, eran de la cavidad oral2. Durante la planeación del tratamiento de pacientes que sufren este tipo de enfermedad, el cirujano se enfrenta al dilema de cómo manejar los relevos ganglionares; más aún cuando los linfáticos comprometidos por metástasis marcan el pronóstico y las decisiones terapéuticas3,4.
Tradicionalmente, el método para establecer la presencia de metástasis ocultas a ganglios en carcinomas escamocelulares de cavidad oral ha sido la disección electiva o profiláctica de cuello. Sin embargo, en los tumores con estadios tempranos (T1/T2 N0) es mucho más difícil definir la necesidad de esta cirugía. Existen estadísticas contradictorias acerca del porcentaje de metástasis ocultas a nodos linfáticos, que puede oscilar entre el 13 y el 33% en tumores T1, y entre el 35 y el 53% en tumores T2 escamocelulares de lengua oral5-7. Si el riesgo de metástasis oculta a ganglios es mayor al 20%, se considera aceptable practicar disección profiláctica de cuello8.
A pesar de lo anterior, existe la necesidad de implementar un método menos invasivo y de menor morbilidad para clasificar el compromiso de metástasis ocultas a ganglios linfáticos. Por eso se ha aprovechado la experiencia previa de la cirugía mínimamente invasiva, utilizada en el manejo de los cánceres de seno y melanomas de piel, para estadificar los ganglios de cuello en los pacientes con cáncer escamocelular de cabeza y cuello9. Dicha técnica se conoce como la biopsia de ganglio linfático centinela (BGLC), denominada así porque es el primer ganglio que recibe el drenaje de un tumor primario con probabilidad de micrometástasis5. El procedimiento se basa en la teoría que describe un drenaje linfático ordenado; si este primer ganglio es negativo, no es necesario el retiro de otros niveles ganglionares distantes a este.
En la cabeza y cuello el drenaje linfático es complejo, incluso un sitio anatómico puede tener diferentes vías de diseminación, lo que conlleva la demostración de más de un ganglio linfático centinela (GLC). Adicionalmente, la cercanía del primer relevo ganglionar al sitio primario puede dificultar su detección, lo cual obstaculiza la disección selectiva de los ganglios. La identificación preoperatoria del GLC en esta zona del cuerpo facilita el procedimiento quirúrgico; para ello se cuenta con el mapeo linfático, que se practica mediante la linfogammagrafía con SPECT/CT10,11 (tomografía computarizada por emisión de fotones individuales/tomografía computarizada; SPECT por sus siglas del inglés, single photon emission computed tomography).
La SPECT/CT produce una imagen dinámica, funcional y anatómica que, entre otras ventajas, permite la identificación de posibles metástasis en tránsito, ganglios centinelas primarios, secundarios o aberrantes, lo que facilita la intervención quirúrgica, asegurando la extirpación del tejido que podría estar afectado por la enfermedad10.
Previo consentimiento escrito de la paciente, por primera vez en nuestra institución y en Colombia, hasta donde tenemos conocimiento, se ha practicado mapeo linfático mediante linfogammagrafía con SPECT/CT y tratamiento quirúrgico con disección ganglionar superselectiva radioguiada (DGSSR) en una paciente con un carcinoma escamocelular de lengua oral en estadio temprano (T1 N0 M0, EI).
Caso clínico
El caso se refiere a una mujer de 38 años con cuadro de once meses de evolución de lesión en la cara lateral derecha de la lengua, lesión que fue extirpada mediante resección local amplia y cuya patología demostró ser inflamatoria sin hallazgos de malignidad. Dicha lesión reapareció seis meses después, por lo que se practicó una nueva biopsia, la cual demostró un carcinoma escamocelular infiltrante y ulcerado bien diferenciado de célula grande queratinizante, con infiltración de hasta 2 mm del estroma. Sin invasión linfovascular ni perineural y con borde de sección profundo libre.
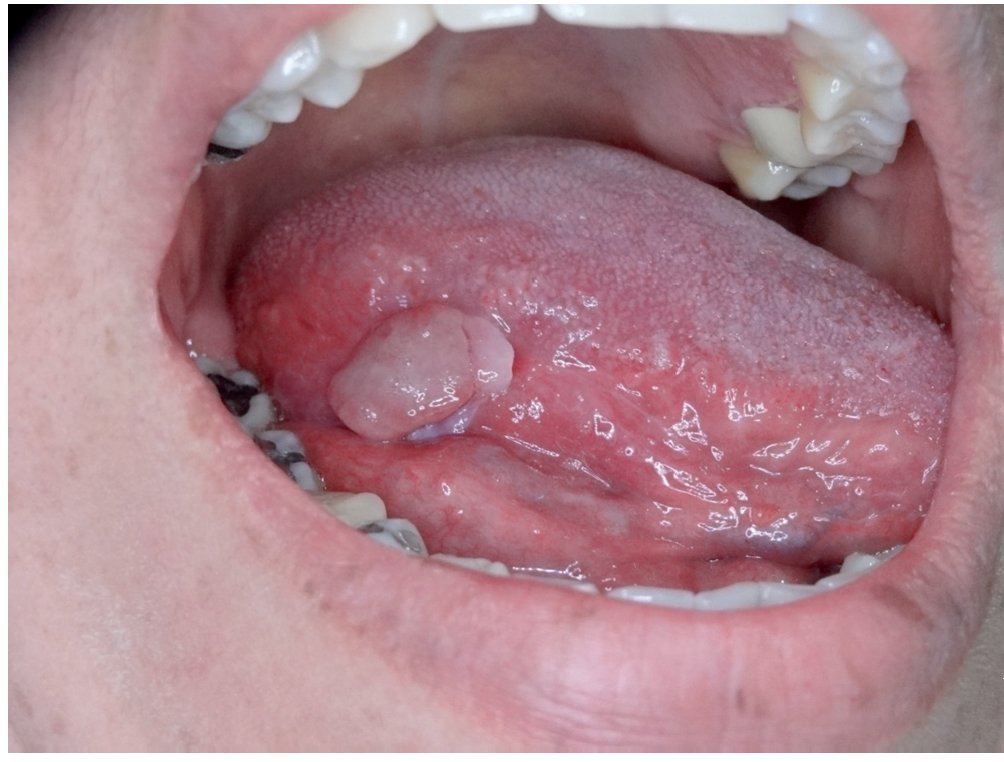
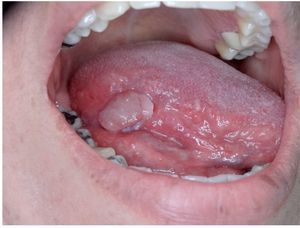
En examen físico se detectó una lesión de 10 × 10 mm, localizada en el tercio medio de la cara lateral de la lengua derecha, levantada, y a la palpación sin evidencia de infiltración profunda de la lengua. Exploración de cuello sin presencia de adenopatías palpables de cuello, radiografía de tórax sin evidencia de metástasis pulmonares. Por lo anterior, se estadificó como un carcinoma escamocelular de lengua T1 N0 M0, estado I (fig. 1).
Figura 1. Lesión exofítica de cara lateral de lengua de 10 mm de diámetro, carcinoma escamocelular T1 N0 M0, estado I.
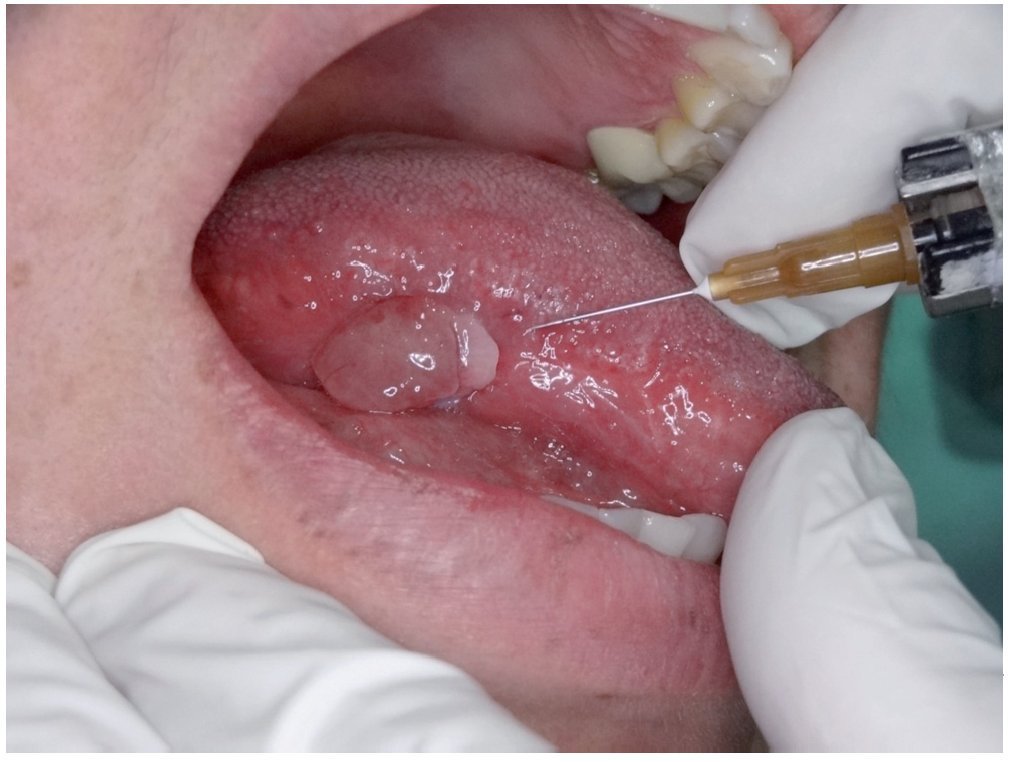
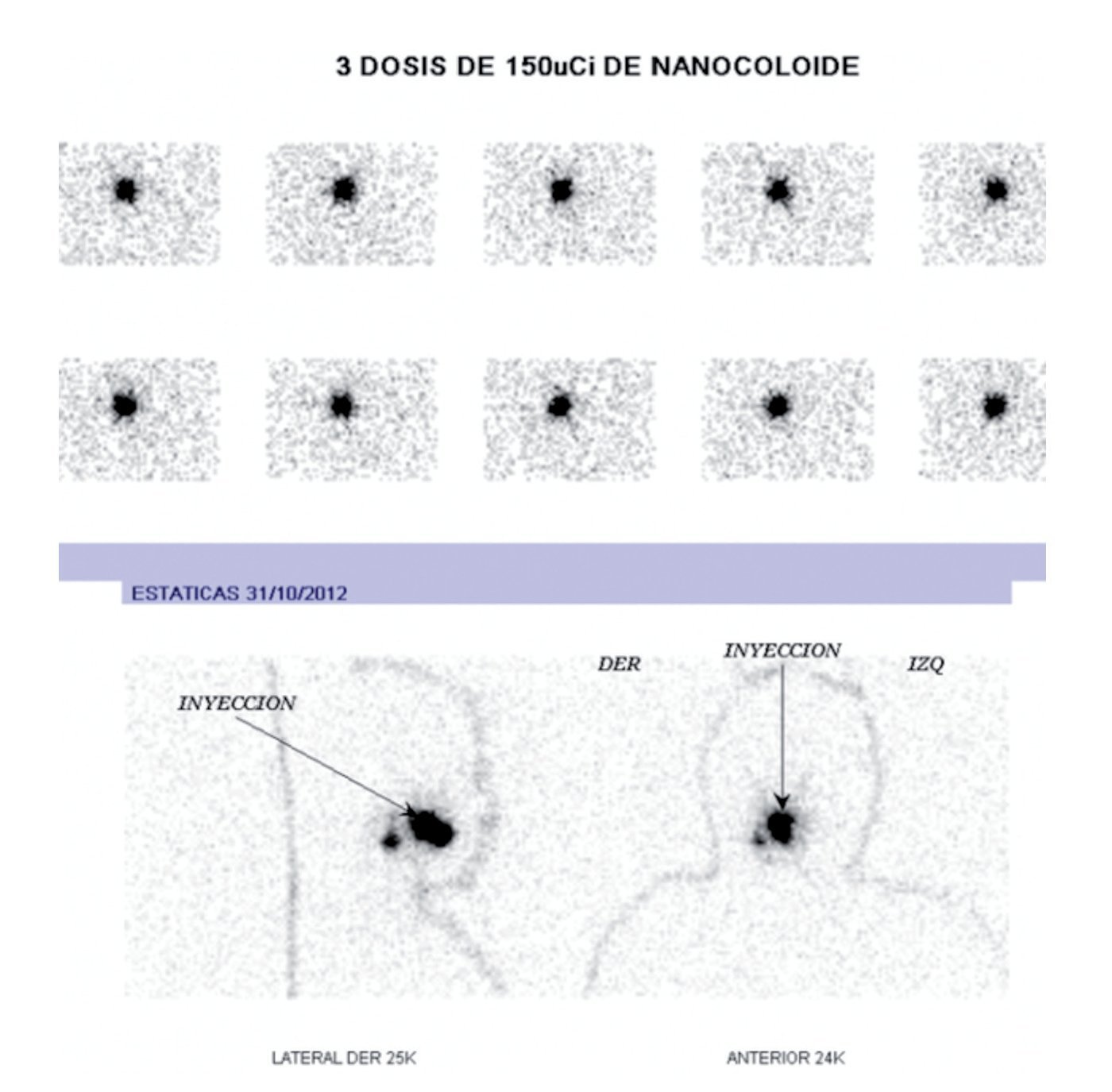
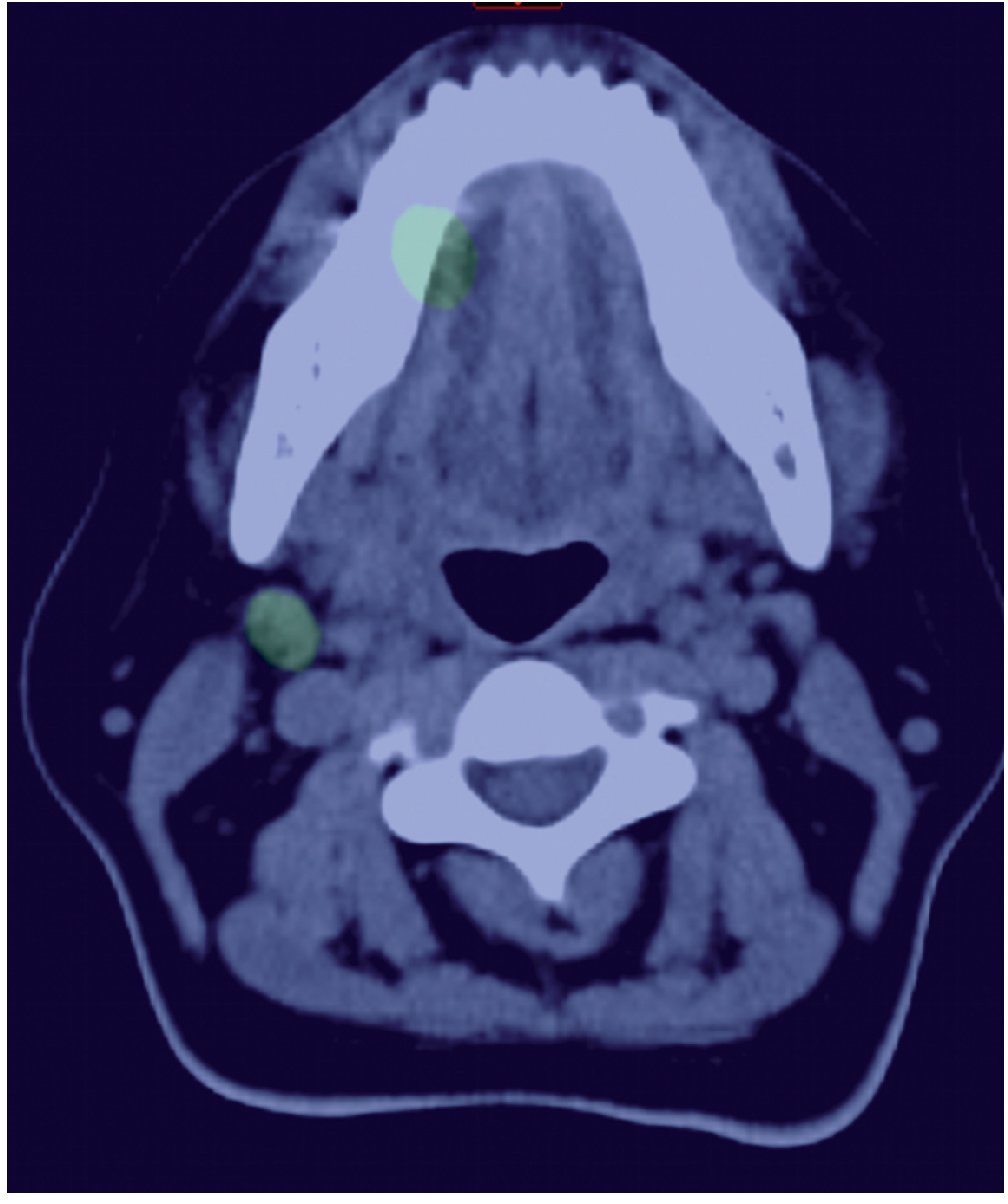
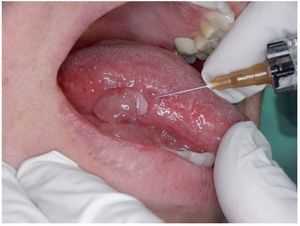
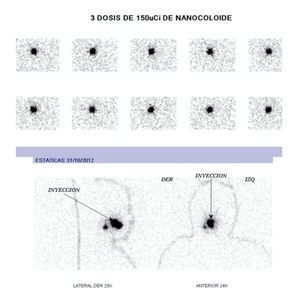
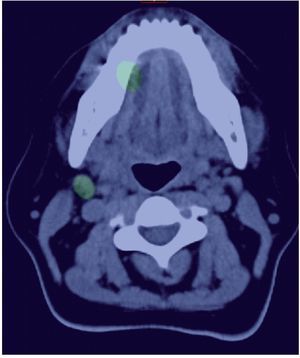
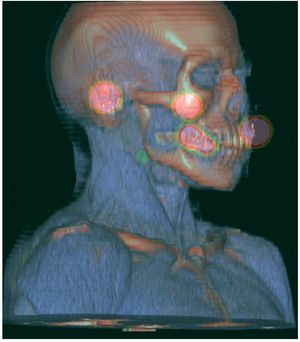
Teniendo en cuenta que se trataba de un estadio temprano de carcinoma escamocelular de lengua, se decidió practicar estatificación de ganglios con mapeo linfático. Dicho estudio se hizo por la técnica de SPECT/CT, con inyección a 8 mm de los bordes tumorales, de 3 dosis de 150 microcurios (μCi), cada una de Tc-99 m nanocoloide (fig. 2). Se practicó linfogammagrafía planar, donde se verificó migración solitaria a la parte alta del cuello (fig. 3), después de lo cual se hizo TAC de cuello simple y fusión de imágenes con SPECT/ CT; con ello se definió en forma precisa la migración del Tc-99 m nanocoloide al nivel IIA derecho. Este se interpretó como un ganglio centinela único (figs. 4 y 5).
Figura 2. Inyección a 8 mm de los bordes tumorales, con 3 dosis de 150 microcurios (μCi) cada una de Tc-99m nanocoloide.
Figura 3. Linfogammagrafía planar: sitio de inyección en la cavidad oral y un sitio puntual de drenaje a la parte alta del cuello.
Figura 4. Mapeo linfático mediante linfogammagrafía con SPECT/CT: sitio de inyección en el tercio medio de la cara lateral derecha de la lengua, captación de ganglio de cuello nivel IIA derecho.
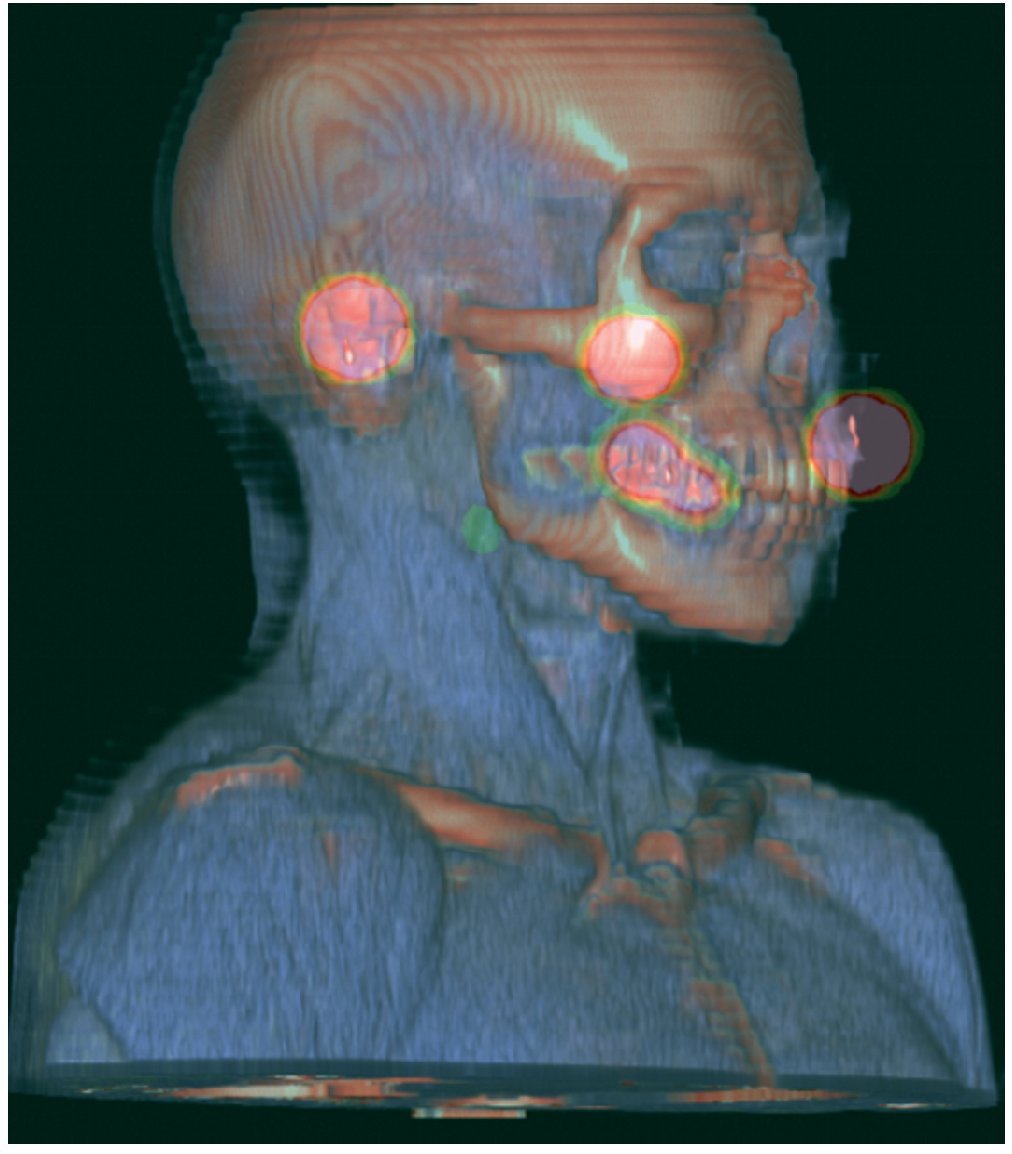
Figura 5. Reconstrucción tridimensional de mapeo linfático con SPECT/CT: puntos de reparo de conductos auditivos y espina nasal anterior (en color naranja), tumor primario de la cara lateral derecha de la lengua (en color naranja), captación de ganglio centinela nivel IIA derecho (captación en color verde).
Por esta razón, se decidió tratar quirúrgicamente a la paciente con una resección local amplia de la lengua, con un margen de 10 mm, acompañada de una disección ganglionar superselectiva radioguiada (DGSSR) de los niveles IIA y IIB. Previamente, se inyectó el Tc-99m nanocoloide con la misma técnica del mapeo linfático; y el mismo día, mediante una incisión en cuello de 2 cm, se extirpó el ganglio linfático centinela (GLC) del nivel IIA derecho con ayuda de una gammacámara portátil Europrobe 3®, además de la resección local amplia del tumor de la lengua. Seguidamente, se procedió a completar la DGSSR de los niveles anteriormente mencionados. La evolución postoperatoria fue satisfactoria y sin complicaciones; se le dio de alta al día siguiente.
La patología definitiva demostró la resección local amplia libre de tumor con márgenes de sección negativos para malignidad y la disección de los niveles IIA y IIB, un total de 15 ganglios, todos libres de enfermedad metastásica.
Discusión
Las metástasis a ganglios linfáticos de cuello es el principal factor pronóstico en pacientes con carcinomas escamocelulares de cabeza y cuello, cuando están presentes disminuyen la supervivencia en un 50%12. Debido a lo anterior, es de suma importancia conocer si existen metástasis a los nodos linfáticos de cuello, por ello tradicionalmente se ha practicado disección de cuello en estos pacientes simultáneamente con la resección local del tumor primario. Regularmente, en el tratamiento de las lesiones tumorales de la cavidad oral se practica la disección electiva supraomohiodea, incluso en los tumores tempranos5,10,13 (T1, T2, N0, EI). En general, en las disecciones electivas de cuello (DEC), la prevalencia de metástasis ocultas es entre el 20 y el 40%, pero la mayoría de los pacientes no obtienen ningún beneficio terapéutico, aunque sí aumento en la morbilidad relacionada con el procedimiento11.
Consecuentemente, en los últimos años la tendencia mundial ha cambiado a manejos menos radicales, retirando la menor cantidad de tejido y extirpando solo los ganglios linfáticos que puedan tener micrometástasis, siempre bajo parámetros oncológicos seguros. La biopsia del ganglio linfático centinela (BGLC) ha demostrado beneficios en las pacientes con tumores de la mama, así como en los pacientes con melanomas de piel; esto ha llevado a que se inicie el uso de esta técnica en pacientes con carcinomas escamocelulares del tubo digestivo superior.
Keski-Säntti y colaboradores, en su estudio de 47 casos, encontraron al menos un solo GLC en pacientes con cáncer escamocelular oral, con una sensibilidad para detectar metástasis ocultas del 67%. Analizan que el uso de la BGLC podría limitarse solo a aquellos con lesiones T1 N0 o T2 N0 pequeños5.
Haerle Stephan y Stoeckli Sandro proponen la BGLC en pacientes con carcinomas escamocelulares de orofaringe y cavidad oral, con estadios tempranos I y II, en ausencia de adenopatías palpables y sin evidencia radiológica (ecografía, TAC, RMN) de compromiso ganglionar metastásico11. Es de suma importancia definir qué individuos no se beneficiarían de la aplicación de este novedoso tratamiento; por eso, Soo-young An y colaboradores descartan este manejo a pacientes con tumores T2 N0 y T1 N0 con grado histológico alto, invasión mayor a 3 mm o compromiso a músculos intrínsecos, y recomiendan en ellos la disección electiva de cuello14.
El uso de la BGLC busca disminuir el número de disecciones innecesarias en pacientes con este tipo de lesiones; sin embargo, en la cabeza y el cuello es mucho más difícil practicarlo, debido a la anatomía compleja del área y a que los sitios de drenaje de esta zona del cuerpo suelen tener diferentes rutas, con inconsistencia en los patrones de drenaje15,16. Uno de los grandes aportes de la medicina nuclear a la cirugía oncológica de cabeza y cuello en los últimos tiempos es el uso de materiales radioactivos que definen en forma precisa las rutas de drenaje linfático, inicialmente mediante la linfogammagrafía planar y ahora con la SPECT/ CT, que determina en forma precisa los nodos linfáticos centinelas17-19.
Inicialmente, en la BGLC para melanomas de piel se propuso hacer congelación intraoperatoria para definir si existían micrometástasis, y de esta forma proceder en el mismo acto operatorio a disección completa de los relevos ganglionares; sin embargo, este procedimiento se abandonó rápidamente. Ello es aún es más delicado en los carcinomas escamocelulares orales, como lo confirman Trivedi y colaboradores, quienes hacen una correlación de la biopsia por congelación, la citología por impronta y la patología por hematoxilina eosina más inmunohistoquímica; así, concluyen que solo el último método es efectivo para determinar si existen micrometástasis en estos pacientes20.
Como se ha anotado, la BGLC tiene una sensibilidad del 67% para detectar metástasis ocultas a ganglios linfáticos, dejando un porcentaje importante de pacientes con posible enfermedad residual en el cuello5. Por ello, en contraposición, se puede plantear la disección profiláctica de cuello de los posibles niveles afectados. Sin embargo, la morbilidad y defectos funcionales y cosméticos derivados de este tipo de procedimientos ha llevado a plantear intervenciones mucho más limitadas, como son las disecciones superselectivas de cuello (DSSC), que propenden por el retiro de uno o máximo dos grupos ganglionares con posibilidad de compromiso metastásico21.
Sumada a esta conducta y una vez identificada la ruta linfática, mediante la SPECT/CT en los cánceres tempranos (T1 N0, M0, EI) de la cavidad oral, sin factores de mal pronóstico, como son el grado histológico alto, la invasión mayor a 3 mm o la presencia de compromiso a músculos intrínsecos, podemos sugerir el manejo quirúrgico del cuello con disección ganglionar superselectiva radioguiada (DGSSR) del nivel o niveles centinelas.
Adicionalmente, hemos podido corroborar las ventajas del uso de esta técnica quirúrgica en el presente caso, cuando practicamos el mapeo linfático con la SPECT/CT y obtuvimos de forma exacta la información del ganglio linfático centinela (GLC); ello nos dio argumentos para hacer una intervención limitada y a la vez oncológicamente segura, con la menor morbilidad posible.
Recibido el 14 de enero de 2013;
aceptado el 9 de abril de 2013.
* Autor para correspondencia.
Correo electrónico:
enriquecadena2005@yahoo.com (E. Cadena).