La obesidad es una enfermedad crónica, no transmisible, que recientemente ha tenido una connotación especial debido al aumento de su prevalencia en países en vía de desarrollo. Este incremento está relacionado con un aumento en la aparición de enfermedades metabólicas y el riesgo cardiovascular.
Si bien la prevalencia de obesidad está aumentando en todos los países del mundo, existen diferencias regionales tanto en la prevalencia como en las tendencias de la obesidad. Por consiguiente, comprender los impulsores de estas diferencias regionales podría ayudar a proporcionar orientación para las estrategias de intervención más prometedoras.
A pesar de considerarse una eventualidad simple en una proporción de lo que se ingiere y lo que se gasta, existen muchos factores que regulan esta enfermedad. No es sencillo encontrar medidas terapéuticas para la obesidad, pues sus causas son múltiples. En forma reciente, ha despertado un especial interés la caracterización funcional de los adipocitos, específicamente de los adipocitos beige, dado que su función está íntimamente relacionada con las circunstancias externas del ambiente y tienen una flexibilidad que les permite producir energía y mejorar muchos de los parámetros metabólicos en los individuos.
En este manuscrito se hará énfasis en las características de las células adiposas y su influencia en el riesgo cardiovascular.
Obesity is a chronic non-transmissible disease that has recently had a special connotation due to the increase of its prevalence in developing countries. The increase in obesity is related to an expansion in the appearance of metabolic diseases and cardiovascular risk. Although the prevalence of obesity is increasing in all countries of the world, there are regional differences in both the prevalence and trends of obesity. Therefore, understanding the circumstances of these regional differences could help provide guidance for the most promising intervention strategies. Despite being considered a simple outcome in a proportion of what is ingested and what is spent, there are many factors that regulate this disease. It is not easy to find therapeutic measures for obesity, because their causes are multiple. Recently, the functional characterization of adipocytes, especially Beige adipocytes, has been of particular interest since their function is intimately related to the external circumstances of the environment and they have a flexibility that allows them to produce energy and improve many of the metabolic parameters in individuals. In the present manuscript we will focus on the characteristics of fat cells and their influence on cardiovascular risk.
La obesidad es una enfermedad crónica y multifactorial que se ha convertido en problema de salud pública, especialmente en los países en vía de desarrollo. La relación causal entre el aumento del peso y el riesgo cardiovascular está configurada por varias condiciones que, progresivamente, van deteriorando la funcionalidad del sistema cardiovascular, entre ellas un estado inflamatorio crónico, resistencia a la insulina, elevación de los lípidos y aumento de la presión arterial. Esta relación puede explicarse por efectos directos mediados por adaptaciones funcionales en el sistema cardiovascular, disregulación de adipoquinas, liberación de ácidos grasos libres, estrés oxidativo y efectos en la homeostasis vascular1.
En la actualidad, la obesidad es identificada como una enfermedad crónica epidémica. Cifras concernientes a la prevalencia de obesidad manifiestan que en el año 2016, 39% de los adultos tenían sobrepeso y 13% obesidad; adicionalmente, se pronostica que para el año 2025 la obesidad tendrá una prevalencia del 21 y del 18% para los sexos femenino y masculino, respectivamente2. Se han encontrado, así mismo, diferencias étnicas y culturales únicas asociadas con etiología, tipo y consecuencias de la obesidad. En Colombia, mediante la Ley 1355 del 2009 se definió la obesidad como una enfermedad crónica no transmisible, catalogándose como prioridad de salud pública, lo que, en teoría, favorece la promoción de medidas para su control, atención y prevención3. De acuerdo con las cifras de ENSIN 2015, uno de cada tres jóvenes y adultos tiene sobrepeso (37,7%), mientras que uno de cada cinco es obeso (18,7%). En este sentido, el 56,4% de la población presenta exceso de peso, lo que significa un incremento de 5,2 puntos porcentuales respecto al año 2010. Al igual que en muchos lugares, en Colombia la obesidad es más frecuente en las mujeres, 22,4%, que en los hombres, 14,4%, y esta variación está muy relacionada con el piso térmico; de hecho, en regiones de trópico bajo, la obesidad es mayor que en zonas más altas4.
La obesidad tiene varios desencadenantes que están vinculados con eventos que regulan el balance energético. Algunos de estos factores están relacionados con el control del consumo de alimentos a nivel del hipotálamo, otros con la producción de energía en las células musculares o la absorción de nutrientes en el intestino con la influencia de la microbiota y, por último, el que se desarrollará en este manuscrito, la regulación del almacenamiento de calorías en las células adiposas5.
El conocimiento acerca de la fisiología de la célula adiposa ha adquirido un especial desarrollo en los últimos años. Es así como, adicional al reconocido tejido adiposo blanco que acumula energía en forma de triglicéridos y al tejido adiposo café con mayor producción de energía en forma de calor, se ha identificado el tejido adiposo beige/brite, que se podría clasificar como un adipocito flexible, con la facultad de producir energía en casos de baja temperatura o en condiciones especiales como ejercicio6.
Características de los diferentes tipos de células adiposasFenotípicamente, el tejido adiposo blanco cuenta con una simple inclusión citoplasmática; se encarga del almacenamiento de triglicéridos como consecuencia del proceso de lipogénesis y se caracteriza por una gran plasticidad y capacidad de expandirse o retraerse según la tasa energética de la persona7. Según el estímulo, se liberan ácidos grasos como resultado del proceso de lipólisis el cual es regulado por el sistema nervioso simpático, principalmente por la norepinefrina.
Por el contrario, los adipocitos café presentan múltiples inclusiones lipídicas citoplasmáticas y numerosas mitocondrias. desde el punto de vista metabólico, dada su mayor vascularización y gran actividad metabólica, los ácidos grasos son metabolizados rápidamente, lo cual favorece un óptimo consumo de oxígeno y producción de calor. Muchos estímulos ambientales o moleculares pueden incrementar la aparición de los adipocitos café. No obstante, el principal estímulo es la exposición al frío8.
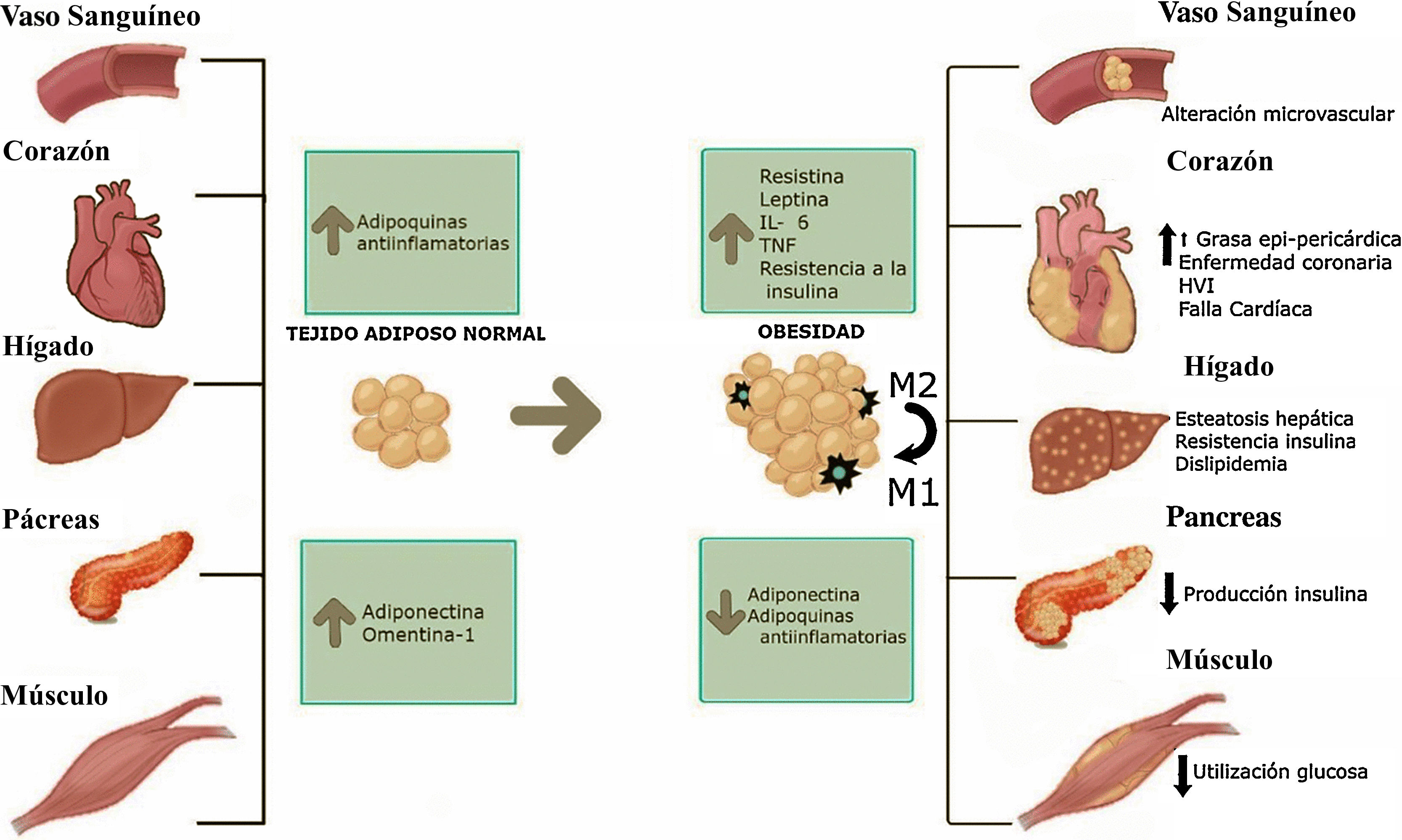
Por otro lado, el tejido adiposo beige tiene características morfológicas en común con los tejidos adiposos blanco y café. La naturaleza de estas células es controversial, aunque se cree que su origen es secundario a la diferenciación desde los adipocitos blancos o por diferenciación desde el mismo precursor celular. Cuenta con una inclusión lipídica simple, similar a la de los adipocitos blancos, pero ante estímulos como la exposición al frío su comportamiento es similar al del adipocito café. La capacidad termogénica y su posible rol en la regulación de la obesidad y resistencia a la insulina son motivo de estudio en la actualidad6,9,10. El tejido adiposo se puede considerar el órgano endocrino más grande, con capacidad de sintetizar hormonas de acuerdo con su fenotipo y localización. En un organismo con balance energético normal, los adipocitos secretan adipoquinas que esgrimen un papel antiinflamatorio; este es el caso de la adiponectina, el factor de crecimiento transformante (TGF-β1), la interleuquina 10 (IL-10), el óxido nítrico, entre otros, los cuales promueven la sensibilidad a la insulina, conservan la función endotelial y estimulan factores antiaterogénicos11. Por otro lado, en condiciones de hipertrofia los adipocitos tienen la capacidad de producir adipoquinas proinflamatorias, como el factor de necrosis tumoral alfa (TNF-α), la interleuquina 6 (IL-6), la resistina, la interleuquina 1 (IL-1), que promueven efectos aterogénicos, aumentan la presión arterial y producen disfunción endotelial. Además de estos procesos, que podemos llamar endocrinos, ocurre una disminución de vascularización del tejido, lo cual induce hipoxia y apoptosis, y estimula la infiltración de células inmunes, principalmente macrófagos tipo I, iniciando un círculo permanente de respuesta inflamatoria12.
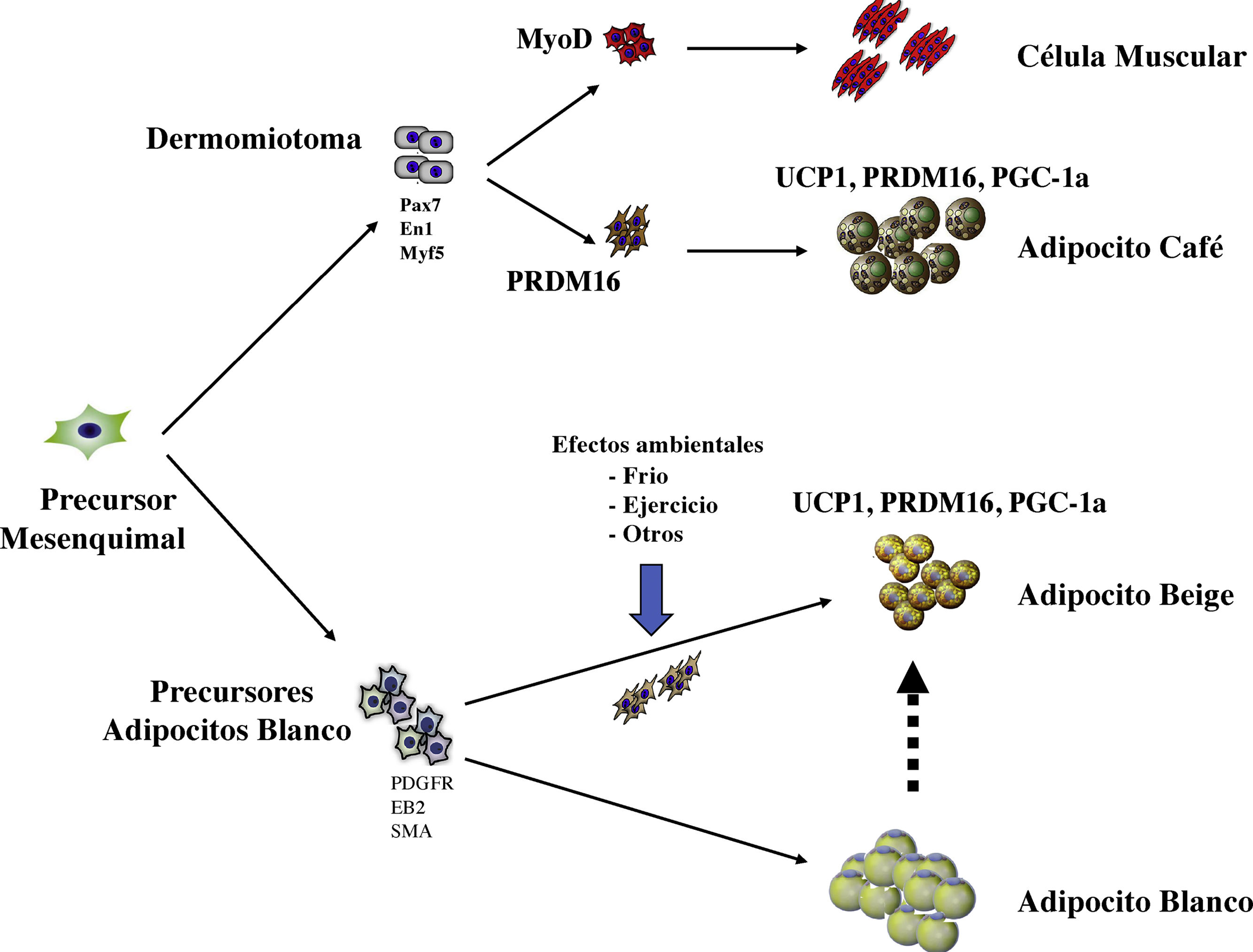
Estas variaciones de la estructura y función de los adipocitos han desarrollado la investigación de la obesidad y el riesgo cardiovascular con relación a los factores genéticos que controlan la fisiología de estas células. Si bien todos los adipocitos son de origen mesenquimal, una diversidad apreciable surge durante el proceso de diferenciación. De hecho, el adipocito café, de alguna manera tiene más en común con células musculares de origen mesenquimal que con los adipocitos blancos13. Además, las células precursoras del tejido adiposo blanco pueden modificarse con diferentes factores para dar lugar al tejido adiposo beige que es más activo energéticamente14. Múltiples factores pueden modular el proceso de diferenciación de los adipocitos beige de las células precursoras de adipocitos. Las señales extracelulares incluyen la activación del sistema nervioso simpático, las células del sistema inmunitario y las variaciones de la epigenética determinadas por otros aspectos ambientales que influyen en la transcripción de genes específicos15,16. Con la descripción del adipocito beige en los humanos, una especial atención a su funcionalidad con posibles fines terapéuticos ha despertado el interés de los investigadores, debido a su regulación por factores ambientales y el posible modelo de una vía terapéutica para la lucha contra la obesidad17.
Los adipocitos café tienen un desarrollo embrionario anterior al de los otros adipocitos, probablemente por su papel importante en la regulación de la temperatura en el recién nacido. Se han caracterizado por la expresión de factores de la transcripción específicos, incluyendo proteína pareada box 7 (Pax7), proteína engraile 1(En1) y factor miogénico 5 (Myf5). Un marcador común en los adipocitos café y beige es la expresión de proteína desacopladora 1 (UCP1), el coactivador de PPARg (PGC1alfa) y la proteína con dominio PR16 (PRDM16) (fig. 1).
Efecto de la obesidad sobre diferentes tejidos del organismo. Los tejidos más importantes que están relacionados con el riesgo cardiovascular pueden ser afectados por la acumulación exógena de grasa. Con el aumento de peso, la célula grasa tiene un proceso de hipertrofia y un consecuente incremento de la producción de adipoquinas proinflamatorias. Aumento de la acumulación de macrófagos tipo 2.
Adicional a la diferencia funcional determinada por las características fenotípicas de los adipocitos, hay que agregar la diferencia funcional de los adipocitos blancos de acuerdo con su localización corporal18,19. Los adipocitos blancos, localizados a nivel visceral, contienen unos rasgos que determinan un mayor riesgo cardiovascular que los adipocitos blancos localizados a nivel subcutáneo. La obesidad con predominio de acumulación grasa en la región visceral está asociada con la resistencia a la insulina y el aumento del riesgo de enfermedad metabólica, mientras que la obesidad periférica debida a la acumulación excesiva de grasa subcutánea puede, incluso, ser protector del síndrome metabólico20,21.
A nivel molecular, los preadipocitos y adipocitos blancos de diferentes regiones y cultivados en condiciones idénticas, conservan diferencias distintivas en los patrones de expresión génica; incluso después de muchas generaciones en platos de cultivo los adipocitos viscerales son diferentes a los subcutáneos22. Algunas proteínas que participan en procesos de desarrollo tienen un alto contenido en los adipocitos viscerales. Es así como Homeobox A5 [HoxA5], Homeobox A4 [HoxA4], Homeobox C8 [HoxC8], Glypican 4 [Gpc4] y la subfamilia de receptores nucleares del grupo F1 [Nr2f1] están elevados en los adipocitos viscerales blancos, mientras que Homeobox A10 [Hox10], Homeobox C9 [HoxC9], T-box [Tbx15], Homeobox de baja estatura 2 [Shox2], Engrailed 1 [En1] y proteína 2 relacionada con frizzled [Sfpr2] son altos en grasa subcutánea22. Los autores de este artículo encontraron que los adipocitos periaórticos a nivel del tórax tienden a ser metabólicamente más activos en relación con los subcutáneos23. De hecho, en la medida que las personas aumentan el peso corporal la característica energética de estas células adiposas se va reduciendo24. La identificación de los adipocitos blancos en relación con su localización ha definido un posible cuadro fisiopatológico para el riesgo cardiovascular y un potencial marco para descubrir los detalles de los factores que regulan su distribución corporal. El efecto de las hormonas sexuales en la distribución de la grasa es un ámbito interesante que determina una divergencia en el riesgo cardiovascular en los seres humanos. Es reconocido que los estrógenos son un factor protector, en contraposición a los andrógenos; las mujeres tienen menor riesgo cardiovascular durante el periodo fértil, hecho que cambia luego de la menopausia. Las diferencias raciales en la distribución de la grasa corporal, el papel de los depósitos de grasa perivasculares y la regulación con las hormonas gastroentéricas con el microbioma son otros factores que requieren profundización para determinar su influencia.
Desde el punto de vista clínico, hay varios factores específicos que pueden incrementar el riesgo cardiovascular y pueden actuar en forma indirecta. El aumento de peso reduce la capacidad ventilatoria e induce el síndrome de apnea del sueño en el cual hay un estado de hipoxia y acidosis crónica que precipita al desarrollo de hipertensión pulmonar y la hipertrofia ventricular25. La obesidad con predominio de grasa visceral incrementa la resistencia a la insulina e induce un aumento en el tono simpático y eleva la actividad del eje renina-angiotensina-aldosterona, aumentando la reabsorción de sodio y la disfunción endotelial, factores que finalmente producen hipertensión arterial.
Otra alteración relacionada con la obesidad es la disfunción endotelial. Varios estudios han determinado el grosor de la capa íntima de la carótida con la obesidad, y han encontrado una asociación entre mayor masa libre de grasa como un factor independiente para el engrosamiento de la íntima carotídea26. Esto evidencia la importancia de la valoración de la masa libre de grasa en relación con la grasa corporal total como un predictor fuerte de riesgo cardiovascular, más que estas variables medidas por separado27 (fig. 2).
Desarrollo embrionario de las células adiposas. Los adipocitos provienen de un precursor común de origen mesenquimal. En el caso de los adipocitos café, su aparición es más temprana y provienen del dermomiotoma en forma común con las células musculares. El factor de transcripción PRMD16 diferencia los precursores adipocitos café de las células musculares. El adipocito café cuenta con moléculas que producen energía en forma de calor, como UCP-1, PGC1alfa. Los adipocitos blancos cuentan con unos marcadores específicos, que, con la modificación ejercida por el ambiente, pueden generar adipocitos beige, los que pueden desarrollar la expresión de moléculas similares a la de los adipocitos café y producir calor.
Otra implicación de la obesidad en la enfermedad cardiovascular es el desarrollo de microangiopatía; algunos estudios han medido la incorporación capilar por técnicas de capilaroscopia en pacientes obesos versus un peso adecuado, encontrando alteraciones microvasculares en los pacientes obesos con datos estadísticamente significativos, en relación también con el desarrollo de hipertensión arterial y resistencia a la insulina28.
Numerosos estudios epidemiológicos han demostrado que la obesidad está fuertemente asociada con un mayor riesgo de mortalidad cardiovascular y mortalidad por todas las causas. La mayoría de ellos han relacionado el IMC y su impacto en los desenlaces cardiovasculares (definidos según la clasificación internacional de las enfermedades, novena y décima revisión, códigos 390-448)29; no obstante, uno de los estudios más controvertidos acerca de obesidad y enfermedad cardiovascular fue el metaanálisis realizado por Flegal et al. (2013)30, quienes observaron una disminución de riesgo cardiovascular en las personas que presentaban obesidad grado 1 (IMC 30-35) en relación con personas de un peso normal31. Además de todos los cuestionamientos de índole metodológico, estadístico, entre otros, uno de los puntos para evaluar en este estudio es si el IMC es la medida óptima para determinar el riesgo cardiovascular. Esta escala de medición subestima muchos parámetros que son los causantes de los problemas cardiovasculares, como la distribución de grasa, el porcentaje de grasa corporal y la masa muscular32. En relación con estas observaciones y a pesar de la evidencia de riesgo cardiovascular en pacientes obesos, algunos estudios mencionan la existencia de una singularidad en los pacientes con IMC en niveles de obesidad. Por tal motivo, se ha mencionado de forma controversial el término “obeso metabólicamente sano”, el cual hace parte de la llamada paradoja de la obesidad, en la que se plantea un índice de masa corporal en rango de sobrepeso u obesidad como un factor protector en cierto tipo de población. Son varios los metaanálisis que han buscado evaluar la mortalidad por todas las causas en relación con el sobrepeso y la obesidad grado I33. Pese a ello, se necesitan más estudios prospectivos y precisos para dilucidar mejor la importancia clínica de la paradoja de la obesidad. Lo importante es tener en cuenta que cuando la pérdida de peso es funcional para reducir la hipertensión y el riesgo cardiovascular, debe fomentarse, mientras que una pérdida de peso involuntaria en un paciente con enfermedades crónicas puede indicar un curso desfavorable34.
En conclusión, la obesidad produce un aumento del riesgo cardiovascular debido a factores directos, como un estado crónico inflamatorio, resistencia a la insulina, elevación de los lípidos, aumento de la presión arterial. Se necesitan más estudios para reconocer la diferencia funcional de las células adiposas blancas de acuerdo con su localización. La presencia de adipocitos beige en humanos puede constituirse en un posible blanco terapéutico para la obesidad.
Conflicto de interesesNinguno.