Los pacientes diabéticos tipo 2 tienen mayor riesgo de desarrollar complicaciones cardiovasculares y renales. La evidencia científica respecto a cómo se debe abordar de manera integral al paciente diabético para prevenir complicaciones cardiorrenales sigue cambiando con rapidez. En los estudios de seguridad cardiovascular los nuevos medicamentos antidiabéticos han demostrado que reducen el desenlace cardiovascular combinado y el deterioro de la función renal. Otros antidiabéticos reducen también el riesgo de hospitalizaciones por insuficiencia cardiaca. Este documento plantea la posición de cuatro sociedades científicas a través de sus expertos delegados, que se encargaron de responder a quince preguntas relacionadas con la prevención y el tratamiento del riesgo cardiorrenal en los pacientes con diabetes mellitus tipo 2.
Patients with type 2 diabetes mellitus have a higher risk of developing cardiovascular and renal problems. The scientific evidence as regards how this must be approached in the diabetic patient in an integrated manner in order to prevent complications continues changing rapidly. In cardiovascular safety studies, the new anti-diabetic drugs have demonstrated that they reduce the combined cardiovascular outcome and deterioration of kidney function. Other anti-diabetic drugs also the risk of hospital admission due to heart failure. This document sets out the position of four scientific societies through their expert committees, who were also responsible for replying to fifteen questions related to cardiovascular and kidney risk in patients with type 2 diabetes mellitus.
El número de pacientes con diabetes en el mundo entero continúa en crecimiento. Según la Federación Internacional de Diabetes, para el año 2019 existían alrededor de 32 millones de diabéticos en Centro y Suramérica, lo que implica una prevalencia promedio del 9.4%. Esta cifra puede incrementarse a más de 49 millones de personas diagnosticadas con diabetes para el año 20451.
Los pacientes con diabetes mellitus continúan teniendo un riesgo significativamente más elevado de complicaciones cardiovasculares en comparación con los individuos no diabéticos. La existencia de diabetes aumenta dos a cuatro veces el riesgo de desarrollar una enfermedad cardiovascular, en cuyo caso, es la principal causa de mortalidad entre los pacientes con diabetes, especialmente en diabetes mellitus tipo 22. Cerca de dos terceras partes de todas las muertes en pacientes diabéticos son atribuidas a enfermedades cardiovasculares, específicamente a enfermedad isquémica coronaria e insuficiencia cardiaca3. La diabetes se asocia con un estado inflamatorio y protrombótico que exacerba el desarrollo de las placas ateroscleróticas. La resistencia a la insulina y la hiperglucemia contribuyen a la disfunción endotelial y al incremento del estrés oxidativo, que acelera el proceso aterosclerótico. Varias de estas alteraciones pueden hacerse evidentes desde la etapa de prediabetes4,5. Por este motivo, no es extraño que entre el 15 y el 35% de los pacientes admitidos por un evento coronario agudo tengan diagnóstico de diabetes, y que más de dos terceras partes de los pacientes con antecedente de infarto de miocardio tengan diabetes o prediabetes, incluyendo intolerancia a la glucosa o aumento de la glucosa en ayunas6,7.
Diferentes estudios, como DCCT, ACCORD, ADVANCE y VADT, han demostrado que la intensificación del control glucémico puede reducir las complicaciones microvasculares tanto en diabéticos tipo 1 como tipo 2; infortunadamente, no se ha observado igual magnitud en los beneficios sobre la tasa de enfermedad macrovascular8.
En los últimos años se ha publicado nueva evidencia científica respecto al abordaje integral de los pacientes con diabetes mellitus, incluyendo los resultados de los estudios de seguridad cardiovascular de agentes antidiabéticos modernos que han demostrado reducir desenlaces cardiovasculares combinados, deterioro de la función renal, y en otros casos, las hospitalizaciones por insuficiencia cardiaca. Por tal razón, la Sociedad Colombiana de Cardiología y Cirugía Cardiovascular, la Asociación Colombiana de Endocrinología, la Asociación Colombiana de Nefrología y la Asociación Colombiana de Medicina Interna decidieron elaborar un documento conjunto que refleje la posición de las cuatro agremiaciones respecto al tratamiento del riesgo cardiorrenal en pacientes con diabetes mellitus tipo 2.
Se identificaron quince preguntas de trabajo, de particular interés para los clínicos y en las que se plantean algunas dudas debido a los cambios que se han presentado en los últimos años. Estas preguntas fueron distribuidas entre los expertos delegados por cada sociedad científica quienes revisaron la literatura disponible y dieron respuesta a las mismas con una posición concreta, inicialmente, y luego con el sustento ampliado de la misma. Luego, todos los autores realizaron la revisión del borrador e hicieron los ajustes y las modificaciones que consideraron, hasta llegar a la elaboración del documento final.
Este documento es el resultado de la opinión de expertos delegados por las cuatro sociedades científicas ya mencionadas, y pretende actualizar las recomendaciones más importantes basadas en la evidencia científica disponible a la fecha para reducir complicaciones cardiovasculares, metabólicas y renales en los pacientes con diabetes mellitus tipo 2.
PREGUNTA 1. En un paciente diabético tipo 2 y asintomático desde el punto de vista cardiovascular, ¿es recomendable la realización de pruebas para detectar aterosclerosis asintomática en prevención primaria?No se recomienda de manera rutinaria la realización de pruebas de estratificación en la mayoría de los pacientes asintomáticos con diabetes mellitus tipo 2 y sin diagnóstico previo de enfermedad aterosclerótica. Sin embargo, en pacientes de muy alto riesgo cardiovascular puede ser recomendable la realización de estudios especiales para detectar enfermedad arterial aterosclerótica subclínica.
JustificaciónEl tamizaje para enfermedad coronaria subclínica en este tipo de pacientes es aún materia de controversia. La Asociación Americana de Diabetes9 no recomienda la búsqueda de aterosclerosis subclínica en un paciente con diabetes tipo 2, excepto en los siguientes casos:
- •
Síntomas atípicos, como disconfort torácico o disnea de causa no clara
- •
Signos o síntomas de enfermedad en cualquier otro lecho vascular
- •
Anormalidades electrocardiográficas que puedan sugerir isquemia
De igual manera, la Sociedad Europea de Cardiología y la Asociación Europea para el estudio de la Diabetes no recomiendan de forma rutinaria las pruebas de tamizaje para enfermedad coronaria subclínica en diabéticos asintomáticos, aunque sugieren que en pacientes de riesgo cardiovascular muy alto sí puede ser recomendable la realización de pruebas de estrés (por ejemplo, prueba de esfuerzo o ecocardiograma de estrés) o una angiotomografía de arterias coronarias10. Entre esos pacientes diabéticos de muy alto riesgo cardiovascular incluyen aquellos con enfermedad arterial periférica conocida, un puntaje de score de calcio elevado, proteinuria positiva o enfermedad renal crónica.
La razón para no recomendar el tamizaje rutinario en estos pacientes radica en que los diferentes estudios clínicos que han evaluado el impacto del tamizaje, no han mostrado diferencias en la tasa de muerte cardíaca ni angina inestable durante el seguimiento en aquellos que se sometieron a pruebas de estrés o angiotomografía de arterias coronarias, en comparación con las recomendaciones actuales de tratar y controlar agresivamente todos los factores de riesgo11. Un metaanálisis de Clerc et al. que incluyó cinco estudios con 3.299 sujetos asintomáticos con diabetes (la mayoría con diabetes tipo 2), mostró que las pruebas invasivas para detección de enfermedad coronaria (prueba de esfuerzo, ecocardiograma de estrés, estudio de perfusión miocárdica de medicina nuclear, angiotomografía coronaria o score de calcio) no redujeron de manera significativa la tasa de infarto del miocardio no fatal ni de hospitalización por insuficiencia cardiaca12. Todos estos datos sugieren que la realización de pruebas diagnósticas en todos los pacientes diabéticos no resulta ser una estrategia costo-efectiva, especialmente hoy en día cuando el control agresivo de los factores de riesgo cardiovascular es una conducta aceptada ampliamente en los pacientes con diabetes.
En resumen, los pacientes con diabetes tipo 2 y asintomáticos desde el punto vista cardiovascular se pueden beneficiar de una prueba para buscar aterosclerosis subclínica cuando presentan evidencia de compromiso en otro lecho vascular, alteraciones electrocardiográficas sugestivas de isquemia o riesgo cardiovascular muy alto. En esos casos la realización de una prueba de estrés (prueba de esfuerzo o ecocardiograma de estrés), un score de calcio coronario o incluso una angiotomografía de arterias coronarias pueden ser recomendables.
PREGUNTA 2. ¿Existen diabéticos tipo 2 de bajo riesgo cardiovascular?No; el sólo hecho de ser diabético hace que el paciente tenga al menos un riesgo cardiovascular moderado.
JustificaciónDiferentes sociedades científicas internacionales han realizado sus modelos de clasificación de riesgo para los pacientes con diabetes mellitus tipo 2 pero algunas veces no resultan sencillos de aplicar en la práctica diaria. Otros han sido evaluados solamente en poblaciones específicas y no han sido validados en otros grupos étnicos9,13. Los estudios de seguridad cardiovascular de los diferentes antidiabéticos no han definido de manera homogénea al grupo de los pacientes diabéticos “de alto riesgo” o con “factores de riesgo asociados”. Incluso la edad considerada para ser un diabético de “alto riesgo” fue diferente en los estudios; el estudio CANVAS determinó una edad ≥ 50 años para considerarlos de riesgo, LEADER ≥ 60 años y DECLARE ≥ 55 años para hombres y ≥ 65 años para mujeres, por mencionar solo algunos ejemplos.
Este consenso propone cuatro grupos de riesgo cardiovascular en la población general: bajo, moderado, alto o muy alto. El sólo hecho de tener diabetes hace que el paciente sea, al menos, de riesgo moderado. En otras palabras, no se recomienda hablar de pacientes diabéticos tipo 2 de bajo riesgo cardiovascular. La mayoría de los diabéticos quedarán incluidos en la categoría de alto riesgo10. La tabla 1 resume las características de cada grupo en los pacientes con diabetes mellitus tipo 2.
Estratificación del riesgo de los pacientes con diabetes mellitus tipo 2
| Muy alto riesgo | • Diabetes mellitus 2 con enfermedad cardiovascular establecida (evento agudo previo o documentación de aterosclerosis clínicamente relevante en cualquier lecho vascular)• Diabetes mellitus 2 y proteinuria o tasa de filtración glomerular < 30 ml/min• Diabetes mellitus 2 y al menos tres de los siguientes factores de riesgo cardiovascular: edad> 60 años, hipertensión arterial, dislipidemia, tabaquismo y obesidad |
| Alto riesgo | Todos los pacientes con diabetes mellitus 2 que no cumplan criterios de muy alto riesgo ni de riesgo moderado |
| Moderado riesgo | • Diabetes mellitus 2 que cumpla los siguientes tres criterios:• Ausencia de algún factor de riesgo cardiovascular adicional• Edad < 50 años• Duración de la diabetes < 10 años |
| Bajo riesgo | No existen diabéticos tipo 2 de bajo riesgo |
Una reducción del peso corporal al menos del 5%, la adopción de una dieta balanceada, similar a la dieta mediterránea, realizar como mínimo 150 minutos de actividad física de intensidad moderada a la semana y eliminar el tabaco son acciones altamente deseables en todo diabético tipo 2. Todo médico que atienda pacientes diabéticos debe hacer suficiente énfasis durante la consulta en la importancia de adoptar estas recomendaciones no farmacológicas como una estrategia fundamental para lograr el éxito en el tratamiento.
JustificaciónEl estudio Look AHEAD ha sido el ensayo más prolongado que ha evaluado una estrategia para disminuir de peso a través de la adopción de una intervención intensiva sobre el estilo de vida. Después de un seguimiento de 9.6 años no se observó reducción en la tasa de eventos cardiovasculares en diabéticos tipo 2 con obesidad o sobrepeso14, a pesar de obtenerse mayor reducción de peso y de hemoglobina glucosilada, así como mejoría en el acondicionamiento físico y en todos los factores de riesgo cardiovascular en el brazo de intervención intensiva. Sin embargo, un análisis observacional post-hoc mostró que aquellos pacientes que perdieron al menos un 10% del peso durante el primer año, tuvieron una disminución significativa en los desenlaces primario y secundario15. El brazo de intervención intensiva del Look AHEAD mostró también disminución significativa en la aparición de enfermedad renal diabética de alto riesgo en un 31%, atribuible, parcialmente, a reducciones de peso, HbA1c y presión arterial sistólica16.
La asignación de una dieta mediterránea suplementada con aceite de oliva extravirgen o nueces, en comparación con una dieta baja en grasa en personas con alto riesgo cardiovascular, pero sin enfermedad aterosclerótica establecida, redujo la incidencia de enfermedad cardiovascular en un 30% aproximadamente17. Básicamente, la dieta mediterránea consiste en consumir diariamente vegetales, verduras, frutas, granos enteros y grasas saludables (aceite de oliva, frutos secos y semillas); ingerir semanalmente pescado, aves, fríjoles y huevos, y limitar el consumo de productos lácteos y carnes rojas. En los pacientes diabéticos es importante individualizar el plan de alimentación con miras a reducir la ingesta total de carbohidratos, lo cual conduce a un mejor control glucémico18. Es recomendable una reducción de peso al menos del 5%.
Respecto a la actividad física, Sluik et al. realizaron un estudio prospectivo y un metaanálisis incluyendo 12 estudios de cohorte; este trabajo mostró una reducción en la mortalidad en los pacientes que realizan actividad física en comparación con quienes no la practican19. Las guías de la Asociación Americana de Diabetes 2020 recomiendan que los pacientes diabéticos deben realizar, al menos, 150 minutos semanales de actividad física moderada a severa, con no más de dos días consecutivos sin actividad18. También recomiendan realizar ejercicio de resistencia dos a tres veces cada semana, así como entrenamiento en flexibilidad y equilibrio.
En general, puede decirse que los cambios terapéuticos del estilo de vida que incluyen adoptar una nutrición adaptada y apropiada al individuo y su entorno —idealmente estilo mediterráneo—, evitar el sedentarismo, realizar actividad física y evitar el tabaco, se han asociado a un mejor control de la glucemia, mantenimiento y/o disminución de peso y reducción de factores de riesgo cardiovascular y, por tanto, se entienden como la base terapéutica de cualquier individuo que presente diabetes.
PREGUNTA 4. ¿Cuáles son las recomendaciones para el control de la presión arterial en el paciente diabético?El paciente diabético sin hipertensión arterial no requiere ningún tratamiento farmacológico antihipertensivo, pero sí el control estricto de los otros factores de riesgo. Los diabéticos hipertensos requieren tratamiento farmacológico para lograr una meta de 130/80, o incluso menor, si los medicamentos son bien tolerados y no generan hipotensión. Los antihipertensivos recomendados son los inhibidores de la enzima convertidora de angiotensina, los bloqueadores del receptor de angiotensina 2, los antagonistas de los canales de calcio dihidropiridínicos (ejemplo: amlodipino) y los diuréticos similares a las tiazidas (preferiblemente indapamida).
JustificaciónEstá claramente comprobado que las intervenciones no farmacológicas mejoran el control metabólico y reducen la presión arterial20. Por consiguiente, se deben implementar y cumplir en todos los pacientes diabéticos, sean o no hipertensos. No hay evidencia suficiente para recomendar el uso de agentes antihipertensivos en pacientes diabéticos no hipertensos.
Estudios como el ACCORD y varios metaanálisis publicados recientemente, han demostrado una disminución de la morbimortalidad con la reducción de la presión arterial elevada en diabéticos con diagnóstico concomitante de hipertensión arterial21–23. En el mismo sentido, se ha evidenciado disminución de enfermedad renal terminal, retinopatía y aparición de albuminuria24,25. El estudio UKPDS demostró que el tratamiento estricto de la presión arterial (promedio de 144/82mm Hg) comparado con el grupo de tratamiento estándar de forma menos estricta (promedio 154/87mm Hg), se asoció con disminución del 21% en infarto agudo de miocardio, 44% menos ataques cerebrovasculares y 49% menos enfermedad arterial oclusiva de miembros inferiores. Todo esto generó una reducción del 32% en la mortalidad relacionada con diabetes26,27.
Varios metaanálisis que han incluido estudios clínicos controlados evidencian el beneficio de la reducción de eventos cerebrovasculares, coronarios y menos enfermedad renal con reducciones de presión arterial sistólica <140mm Hg y diastólica <90mm Hg23,28. Sin embargo, hay evidencia creciente derivada de nuevos metaanálisis, que permite recomendar metas de presión arterial sistólica <130mm Hg y diastólica < 80mm Hg para la mayoría de pacientes (e incluso cifras menores si son adecuadamente toleradas), pero nunca menores a 120mm Hg de presión arterial sistólica, ni menores de 70mm Hg de presión arterial diastólica10,27. En pacientes mayores de 65 años la meta de presión arterial sistólica es 130-139mm Hg si hay tolerancia al tratamiento10,29.
Si la presión arterial es mayor de 140/90mm Hg se requiere, adicional al manejo no farmacológico, el uso de terapia antihipertensiva. Como primera línea, se pueden utilizar todos los agentes, excepto los betabloqueadores; sin embargo, se prefiere el uso de los inhibidores de la enzima convertidora de angiotensina (ECA), los bloqueadores del receptor de angiotensina 2, los antagonistas de los canales de calcio dihidropiridínicos (ejemplo: amlodipino) y los diuréticos similares a las tiazidas (preferiblemente indapamida)30.
Los inhibidores de la ECA y los bloqueadores del receptor de angiotensina 2 han demostrado reducir la albuminuria y la progresión de nefropatía diabética en forma más efectiva que otros agentes27. Se recomienda iniciar de primera línea con un inhibidor de ECA o un bloqueador del receptor de angiotensina 2 en caso de albuminuria, hipertrofia ventricular izquierda o alto riesgo cardiovascular10.
Finalmente, lo cierto es que la mayoría de los diabéticos hipertensos requerirán más de un medicamento para alcanzar las metas propuestas de presión arterial. En esos casos se sugiere dejar un inhibidor de la ECA o un bloqueador del receptor de angiotensina 2, combinado con un antagonista de los canales de calcio, como amlodipino, o un diurético similar a las tiazidas, e intensificar el tratamiento según la necesidad. Al utilizar un diurético similar a las tiazidas, puede ser preferible indapamida en lugar de clortalidona dado su mejor perfil de seguridad. No se deben formular simultáneamente un inhibidor de la ECA y un bloqueador del receptor de angiotensina29,31.
PREGUNTA 5. ¿Cuál es la recomendación para el tratamiento de los lípidos en el paciente con diabetes mellitus tipo 2?Los pacientes diabéticos se benefician de la terapia con estatinas para reducir los niveles de colesterol LDL. El objetivo es lograr un LDL < 100mg/dl en los diabéticos sin enfermedad cardiovascular de riesgo intermedio, LDL < 70mg/dl en los de riesgo alto y LDL < 55mg/dl en los de riesgo muy alto, especialmente aquellos con enfermedad cardiovascular establecida. Para lograr dichas metas puede ser necesario adicionar ezetimibe o, en algunos casos, un inhibidor de PCSK9.
JustificaciónSe ha demostrados que las medidas no farmacológicas, como el control del peso, la adopción de la dieta mediterránea o de la dieta DASH y el incremento de la actividad física, benefician el control lipídico y reducen la enfermedad cardiovascular aterosclerótica en pacientes con diabetes32. Un metaanálisis que incluyó 18.686 pacientes diabéticos, demostró que la reducción de 1 mmol/L (aproximadamente 39mg/dl) en los niveles de colesterol LDL mediante el tratamiento con estatinas, se asoció con una reducción del 9% de la mortalidad total y del 21% en la incidencia de eventos cardiovasculares mayores33.
Las estatinas son los medicamentos de primera línea para tratar el colesterol LDL en los pacientes diabéticos. La tabla 2 muestra las metas actuales recomendadas de LDL por la Sociedad Europea de Cardiología34, según el nivel de riesgo cardiovascular de los pacientes con diabetes.
Meta de colesterol LDL según el nivel de riesgo cardiovascular34
| Nivel de riesgo | Meta de colesterol LDL |
|---|---|
| Riesgo moderado | <100 mg/dl |
| Riesgo alto | <70 mg/dl |
| Riesgo muy alto | <55 mg/dl |
| Enfermedad cardiovascular establecida | <55 mg/dl |
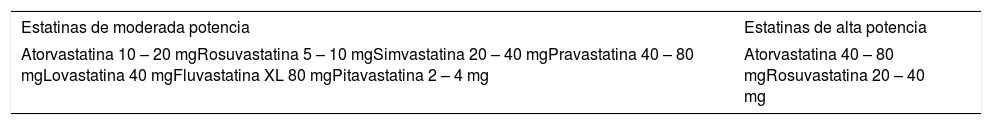
En pacientes sin enfermedad cardiovascular y riesgo moderado, las guías del Colegio Americano de Cardiología y de la Asociación Americana del Corazón para el manejo del colesterol, recomiendan iniciar estatinas de potencia moderada. En los de riesgo alto o muy alto riesgo se debe iniciar con una estatina de alta potencia35. La tabla 3 muestra las diferentes estatinas con las dosis que se consideran de moderada y alta potencia.
Potencia de las terapias con estatinas35
| Estatinas de moderada potencia | Estatinas de alta potencia |
|---|---|
| Atorvastatina 10 – 20 mgRosuvastatina 5 – 10 mgSimvastatina 20 – 40 mgPravastatina 40 – 80 mgLovastatina 40 mgFluvastatina XL 80 mgPitavastatina 2 – 4 mg | Atorvastatina 40 – 80 mgRosuvastatina 20 – 40 mg |
Los pacientes diabéticos con riesgo cardiovascular alto o muy alto que no alcancen la meta propuesta de colesterol LDL con la estatina de alta potencia, deben iniciar tratamiento concomitante con ezetimibe 10mg/dl, el cual puede reducir el LDL hasta un 24% adicional34,35. El ezetimibe junto a una estatina parece ser particularmente eficaz en los pacientes diabéticos gracias a una reducción relativa del riesgo del 15% y una reducción absoluta del riesgo del 5.5%36. Si, a pesar de la combinación de estatina de alta potencia con ezetimibe, el paciente persiste con metas de LDL por encima de las esperadas, especialmente aquellos con enfermedad cardiovascular establecida, se recomienda el uso de un inhibidor de la PCSK9 (evolocumab o alirocumab)34,35,37,38.
PREGUNTA 6. ¿Cuál es la recomendación para el uso de fibratos o de omega 3 en el paciente diabético?Los fibratos pudieran ofrecer algún beneficio en diabéticos que ya reciben estatinas y están en metas de LDL, y que persisten con niveles de triglicéridos> 200mg/dl y colesterol HDL ≤ 35mg/dl, aunque no hay evidencia directa de dicho beneficio. Respecto a los ácidos grasos omega 3, sólo se debería emplear etil icosapentano en dosis de 2 gramos dos veces al día en pacientes con riesgo cardiovascular alto o muy alto y niveles de triglicéridos entre 135 y 499mg/dl.
JustificaciónLos beneficios clínicos alcanzados por el tratamiento de altos niveles de triglicéridos junto con bajos niveles de colesterol HDL son aún materia de debate. Tanto el estudio FIELD como el ACCORD no mostraron reducción del desenlace cardiovascular combinado en los pacientes diabéticos tratados con fenofibrato39,40. Sin embargo, al analizar los pacientes del ACCORD que tuvieron niveles de triglicéridos ≥ 204mg/dl y, al mismo tiempo, colesterol HDL ≤ 34mg/dl, se observó beneficio en quienes recibieron fenofibrato adicional a la simvastatina. Saha et al. publicaron un metaanálisis de fibratos en prevención cardiovascular que incluyó 11.590 pacientes con diabetes y mostró que el uso de fibratos se asoció con menor tasa de infarto no fatal (disminución significativa del riesgo relativo del 21%), pero sin ningún beneficio en la reducción de mortalidad coronaria o mortalidad total41. En la actualidad está en curso el estudio PROMINENT con pemafibrato en pacientes diabéticos con dislipidemia aterogénica que reciben terapia con estatinas42. Este estudio dará mayor claridad acerca de la utilidad de los fibratos en este grupo de pacientes, pero por el momento la evidencia clínica indirecta sugiere que adicionar un fibrato (por ejemplo, fenofibrato) a la terapia con estatinas en pacientes con niveles de triglicéridos por encima de 200mg/dl y HDL bajo (menor de 35mg/dl) pudiera ofrecer algún beneficio para los pacientes. Sin embargo, las guías más recientes de la Asociación Americana de Diabetes no recomiendan el empleo de fibrato junto a estatina en la mayoría de pacientes diabéticos9.
Los ácidos grasos omega 3 (ácido eicosapentaenoico [EPA] y ácido docosahexaenoico [DHA]) reducen los niveles de triglicéridos, por lo que se han estudiado ampliamente para evaluar su posible beneficio cardiovascular. Aung et al. publicaron un metaanálisis que incluyó diez estudios previos con ácidos grasos omega 3 (9 de ellos consistían en combinación de EPA + DHA y solo uno empleó una dosis superior a 2 gramos al día). Este metaanálisis, con más 77.000 pacientes, no mostró reducción de eventos vasculares ni enfermedad coronaria fatal o no fatal43. A finales del 2018 se presentaron los resultados del estudio REDUCE-IT44, el cual evaluó el posible beneficio de dosis altas de ácido etil icosapentano (un tipo de EPA altamente purificado y estable) 2g dos veces al día en cerca de 8.000 pacientes con enfermedad cardiovascular establecida o pacientes diabéticos con al menos un factor de riesgo, que tuvieran, además, niveles de triglicéridos entre 135 y 499mg/dl. Todos los pacientes estaban tratados con estatinas. El estudio demostró reducción cercana al 25% en la tasa de eventos adversos cardiovasculares mayores, incluida la mortalidad cardiovascular. Los autores sugieren que es posible que el beneficio obtenido no se deba sólo a la reducción de los triglicéridos, pues los resultados favorables se observaron incluso en aquellos pacientes con niveles basales de triglicéridos <150mg/dl.
Las guías para el tratamiento de la dislipidemia de la Sociedad Europea de Cardiología y la Sociedad Europea de Aterosclerosis publicadas en 2019, recomiendan que en pacientes con riesgo cardiovascular alto o muy alto y con niveles de triglicéridos entre 135 y 499mg/dl a pesar de tener el LDL controlado con estatinas, debe iniciarse ácido etil icosapentano 2 gramos 2 veces al día (Recomendación clase II a, nivel de evidencia B)34. Igualmente, la guía 2020 de la Asociación Americana de Diabetes hace la misma recomendación y aclara que es exclusivamente para las dosis altas de ácido etil icosapentano y que no pueden extrapolarse a otro tipo de ácidos grasos omega 3, como aquellas combinaciones con DHA9.
PREGUNTA 7. ¿Cuál es la recomendación acerca del uso de aspirina en los pacientes diabéticos?La aspirina debe emplearse en todo paciente diabético con enfermedad cardiovascular. Si no existen contraindicaciones, pudiera emplearse con precaución en diabéticos seleccionados, de riesgo cardiovascular alto y muy alto, junto con un inhibidor de la bomba de protones. En diabéticos de riesgo moderado no está justificado su uso.
JustificaciónEl estudio ASCEND45 evaluó el uso de aspirina en dosis bajas en prevención primaria en 15.480 pacientes con diabetes durante un periodo de seguimiento promedio de 7.4 años. Las complicaciones cardiovasculares fueron 12% menores en el brazo de aspirina, pero con un incremento en la tasa de sangrado mayor del 29%, especialmente gastrointestinal. En este estudio, el beneficio absoluto fue contrarrestado por el riesgo de sangrado.
Un metaanálisis sobre el uso de aspirina en prevención primaria46, evaluó un total de 30.361 pacientes de los cuales el 19% eran diabéticos. En este estudio no se encontró reducción del desenlace cardiovascular compuesto ni de los resultados cardiovasculares secundarios en los pacientes que tomaron aspirina, pero sí un incremento en la tasa de sangrado mayor del 29% y de sangrado mayor de origen gastrointestinal del 35%.
Por tales motivos, las guías internacionales de diabetes recomiendan el uso de aspirina como estrategia de prevención secundaria en diabéticos con historia de enfermedad cardiovascular, pero contraindican su uso en diabéticos de riesgo moderado. Para algunos diabéticos de riesgo alto o muy alto puede considerarse el uso de aspirina (75 a 100mg/d) después de discutir ampliamente el riesgo del sangrado con el paciente y en ausencia de otras contraindicaciones (recomendación clase II b en las guías europeas); en caso de usarla, se debe considerar el empleo de un inhibidor de la bomba de protones para reducir el sangrado gastrointestinal9,10.
PREGUNTA 8. ¿Cuál es la recomendación respecto al uso de la terapia antidiabética en pacientes con diabetes tipo 2 y enfermedad cardiovascular?
Todo paciente diabético tipo 2, con historia de enfermedad cardiovascular, debe recibir tratamiento farmacológico con metformina y un agonista de los receptores de GLP-1 o un inhibidor de SGLT2 con evidencia demostrada en cuanto a reducción de las complicaciones cardiovasculares.
JustificaciónEn los últimos años, las diferentes sociedades científicas han empezado a incluir la existencia de enfermedad cardiovascular previa como un determinante a la hora de seleccionar la terapia antidiabética preferida9,10,13,47–49. Los estudios de seguridad cardiovascular de los nuevos antidiabéticos publicados desde el 2013, han demostrado que algunos de estos medicamentos pueden reducir la incidencia de complicaciones cardiovasculares (3P-MACE: muerte cardiovascular + infarto de miocardio no fatal + ataque cerebrovascular no fatal) y la mortalidad cardiovascular.
Los estudios con inhibidores de la dipeptidil peptidasa-4 (DPP-4) demostraron que saxagliptina50, alogliptina51, sitagliptina52 y linagliptina53 fueron seguros, desde el punto de vista cardiovascular, contra placebo (efecto neutro sobre el 3-P MACE). Saxagliptina, en el estudio SAVOR TIMI-53, mostró un incremento del 27% en las hospitalizaciones por insuficiencia cardiaca50.
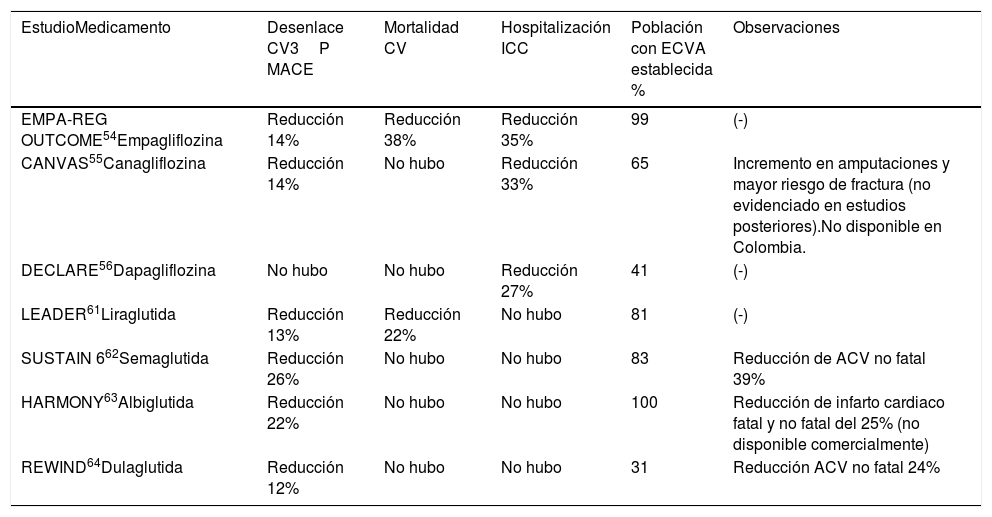
La tabla 4 muestra los estudios y resultados con los inhibidores del cotransportador de sodio-glucosa tipo 2 (inhibidores de SGLT2) y los agonistas de los receptores del péptido similar a la glucosa tipo 1 (agonistas de los receptores de GLP-1) que tuvieron algún desenlace estadístico favorable. Como se observa en dicha tabla, el porcentaje de pacientes diabéticos con enfermedad cardiovascular establecida fue diferente en cada uno de los estudios.
Estudios de seguridad cardiovascular de los nuevos antidiabéticos con desenlaces positivos
| EstudioMedicamento | Desenlace CV3P MACE | Mortalidad CV | Hospitalización ICC | Población con ECVA establecida % | Observaciones |
|---|---|---|---|---|---|
| EMPA-REG OUTCOME54Empagliflozina | Reducción 14% | Reducción 38% | Reducción 35% | 99 | (-) |
| CANVAS55Canagliflozina | Reducción 14% | No hubo | Reducción 33% | 65 | Incremento en amputaciones y mayor riesgo de fractura (no evidenciado en estudios posteriores).No disponible en Colombia. |
| DECLARE56Dapagliflozina | No hubo | No hubo | Reducción 27% | 41 | (-) |
| LEADER61Liraglutida | Reducción 13% | Reducción 22% | No hubo | 81 | (-) |
| SUSTAIN 662Semaglutida | Reducción 26% | No hubo | No hubo | 83 | Reducción de ACV no fatal 39% |
| HARMONY63Albiglutida | Reducción 22% | No hubo | No hubo | 100 | Reducción de infarto cardiaco fatal y no fatal del 25% (no disponible comercialmente) |
| REWIND64Dulaglutida | Reducción 12% | No hubo | No hubo | 31 | Reducción ACV no fatal 24% |
Entre los inhibidores de SGLT2, el estudio EMPA-REG OUTCOME54 que incluyó sólo diabéticos tipo 2 con enfermedad cardiovascular establecida, fue el primero en demostrar reducción de complicaciones cardiovasculares: disminución del 14% del 3-P MACE, del 38% en la mortalidad de origen cardiovascular y del 35% en la tasa de hospitalizaciones por insuficiencia cardiaca en el brazo de empagliflozina. El estudio CANVAS55 redujo el 3-P MACE un 14% y la tasa de hospitalizaciones por insuficiencia cardiaca en 33% en el grupo de canagliflozina. Finalmente, el estudio DECLARE56, con dapagliflozina, que incluyó un porcentaje mucho mayor de pacientes sin enfermedad cardiovascular, no demostró reducción del desenlace cardiovascular combinado, pero sí una disminución del 27% de las hospitalizaciones por insuficiencia cardiaca y del 17% del desenlace combinado de muerte cardiovascular y hospitalizaciones por falla cardiaca.
Específicamente, en el subgrupo de los pacientes con enfermedad cardiovascular establecida, dos metaanálisis demostraron que el desenlace cardiovascular compuesto (3-P MACE), la mortalidad cardiovascular, las tasas de hospitalización por insuficiencia cardiaca y las tasas de hospitalización por complicaciones renales (con o sin macroalbuminuria) se redujeron en los pacientes que recibieron un inhibidor de SGLT257,58.
Respecto a los agonistas de GLP-1, dos estudios demostraron ser neutros desde el punto de vista cardiovascular: el ELIXA59, con lixisenatide, y el EXSCEL60, con exenatide de administración semanal. Por su parte, el estudio LEADER61 demostró una reducción del 13% del 3-P MACE en los pacientes que recibieron liraglutida y del 22% en la mortalidad cardiovascular. El SUSTAIN-662, que evaluó la seguridad de semaglutida de aplicación subcutánea semanal, redujo en 26% el 3-P MACE y en 39% la aparición de ataque cerebrovascular no fatal. Otro agonista de GLP-1 no disponible comercialmente, albiglutida, demostró en el estudio HARMONY63 una reducción del 22% en el 3-P MACE. Finalmente, el estudio REWIND con dulaglutida64 demostró reducción del 12% del 3-P MACE. Ninguna de estas últimas dos moléculas tuvo impacto sobre la mortalidad cardiovascular. En los estudios mencionados con agonistas de los receptores de GLP-1 no se observó disminución de la tasa de hospitalizaciones por insuficiencia cardiaca.
Un gran adelanto en el tratamiento de la diabetes es el desarrollo del primer análogo de GLP-1 oral: semaglutida. El estudio PIONEER-665 evaluó la seguridad cardiovascular de semaglutida oral contra placebo, y demostró no inferioridad. Actualmente, está en curso el estudio SOUL66 con más de 9.000 pacientes diabéticos tipo 2 y enfermedad cardiovascular establecida o enfermedad renal crónica (tasa de filtración glomerular <60ml/min/1.73 m2), en el que se pretende examinar el efecto cardiovascular de semaglutida oral a largo plazo.
Kristensen et al. publicaron un metaanálisis67 que incluyó los siete estudios con agonistas de receptores de GLP-1: ELIXA, EXSCEL, LEADER, SUSTAIN-6, HARMONY, REWIND y PIONEER-6, y encontró 12% de reducción del 3-P MACE en el brazo de pacientes tratados con agonistas de GLP-1 frente a placebo, 12% de reducción en la muerte de causa cardiovascular y 16% en la aparición de eventos cerebrovasculares fatales y no fatales.
Respecto a las insulinas, el estudio ORIGIN evaluó la seguridad cardiovascular de insulina glargina frente a terapia estándar sin demostrar ninguna diferencia en los desenlaces cardiovasculares68. Por su parte, pese a que el estudio DEVOTE, que comparó insulina degludec vs. insulina glargina, encontró menor incidencia de hipoglucemia con insulina degludec, no halló diferencias en cuanto a la seguridad cardiovascular entre ambas insulinas69.
Con los resultados de estos estudios de seguridad cardiovascular, la guía de la Asociación Americana de Diabetes 20209, las guías europeas de diabetes y prediabetes publicadas en 201910 y la guía conjunta de la Asociación Americana de Diabetes con la Asociación Europea para el Estudio de la Diabetes de 201847 y su actualización del 201948, recomiendan que todo paciente diabético con enfermedad cardiovascular establecida debe recibir un agonista de los receptores de GLP-1 o un inhibidor de SGLT2 con evidencia demostrada en reducción de complicaciones cardiovasculares (preferiblemente iniciar con un agonista de GLP-1). Los agonistas de GLP-1 con beneficio cardiovascular son liraglutida, semaglutida y dulaglutida (albiglutida no está disponible en el país). Los inhibidores de SGLT2 con beneficio cardiovascular son empagliflozina, dapagliflozina y canagliflozina.
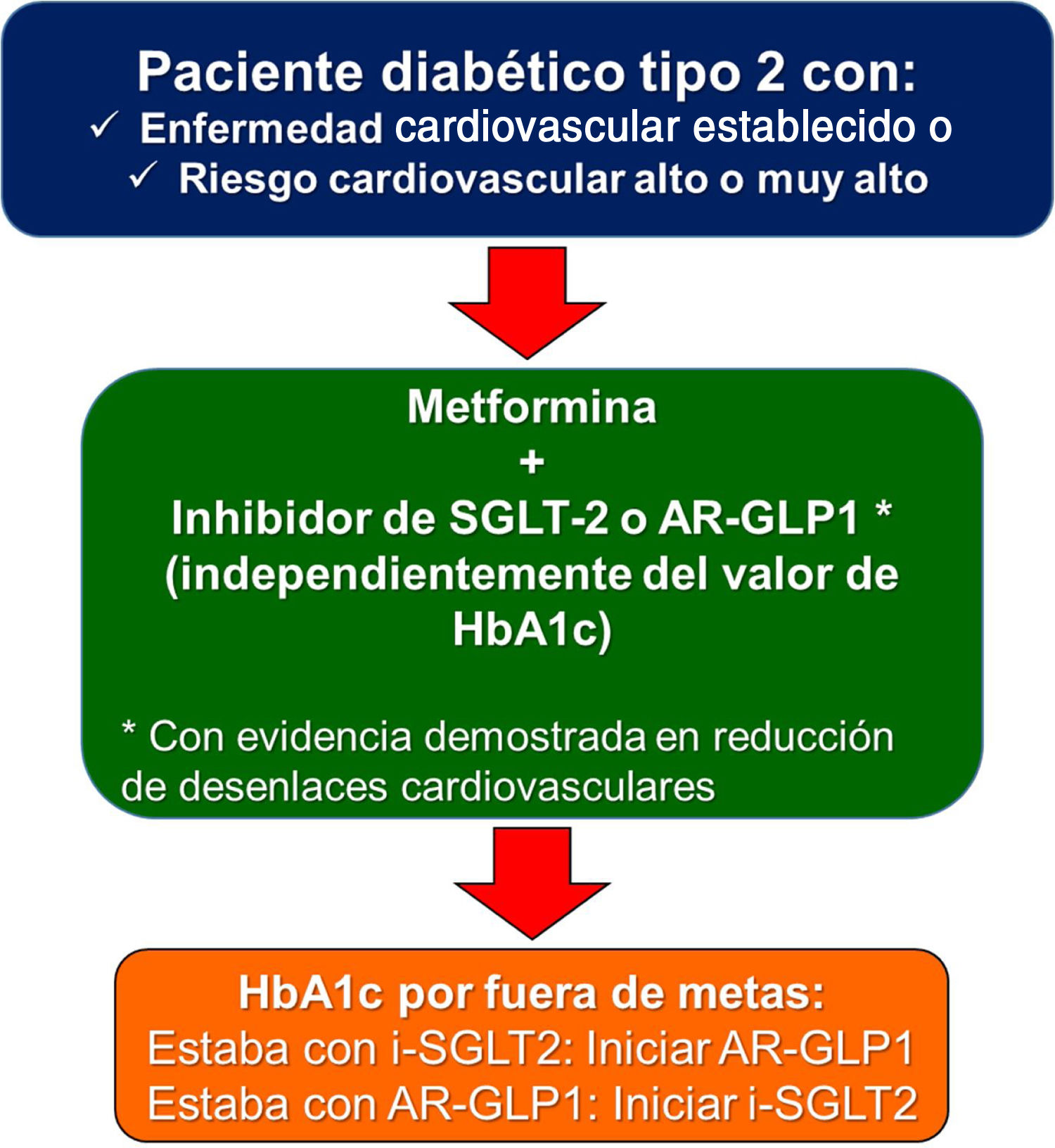
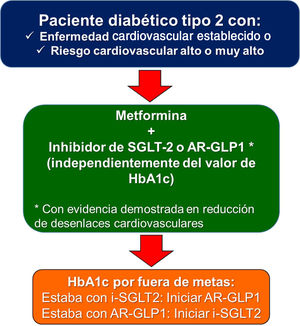
Uno de los puntos polémicos introducido en la guía europea de diabetes y prediabetes10 es si en los diabéticos con enfermedad cardiovascular existente que no recibían ningún antidiabético previamente, se debería empezar con un inhibidor de SGLT2 o un agonista de GLP-1 antes de iniciar metformina. La realidad es que en los estudios de seguridad cardiovascular de los antidiabéticos mencionados anteriormente, la mayoría de los pacientes ya recibían metformina (desde el 73% en el HARMONY y en el SUSTAIN-6, hasta el 82% en el DECLARE). Por tal razón, la recomendación de este consenso es iniciar con los dos medicamentos de manera simultánea (metformina + inhibidor de SGLT2, o metformina + agonista de GLP-1) independientemente del valor de hemoglobina glucosilada, ya que el riesgo de hipoglucemia es bajo. Esta misma estrategia ha sido avalada en 2020 también por la Asociación Americana de Endocrinólogos Clínicos 13. Es muy importante resaltar que no se requiere que el paciente esté por fuera de la meta de hemoglobina glucosilada deseada para iniciar con estos medicamentos.
En conclusión, todo paciente diabético tipo 2 con enfermedad cardiovascular establecida, debe recibir tratamiento con un agonista de GLP-1 o un inhibidor de SGLT2 junto a metformina, siempre y cuando no existan contraindicaciones para la administración de alguno de los medicamentos, especialmente, compromiso importante de la función renal.
PREGUNTA 9. ¿Cuál es la recomendación respecto al uso de la terapia antidiabética en pacientes con diabetes tipo 2 sin historia de enfermedad cardiovascular, pero con alto o muy alto riesgo?Todo diabético tipo 2 de riesgo alto o muy alto, pero sin historia de enfermedad cardiovascular establecida, se beneficia también de recibir tratamiento farmacológico con metformina junto con un inhibidor de SGLT2 o un agonista de los receptores de GLP-1 con evidencia cardiovascular demostrada.
JustificaciónLos mismos metaanálisis mencionados previamente han evaluado el impacto de los nuevos antidiabéticos en pacientes con múltiples factores de riesgo y sin historia de enfermedad cardiovascular establecida57,58,67.
En este subgrupo de pacientes, ninguna clase terapéutica ha demostrado reducción de la mortalidad cardiovascular ni del desenlace cardiovascular combinado (3-P MACE). En el estudio REWIND64, con dulaglutida, casi un 69% del total de pacientes incluidos, no tenía enfermedad cardiovascular establecida; en este estudio la reducción del 3-P MACE fue del 12% en el brazo de dulaglutida sin alteraciones en la “p” de interacción entre aquellos que tenían y los que no tenían enfermedad aterosclerótica previa. Sin embargo, aunque los inhibidores de SGLT2 no demostraron reducción de desenlaces cardiovasculares en esta población, sí se asociaron con reducción en la tasa de hospitalizaciones por insuficiencia cardiaca y del desenlace renal combinado57. Los agonistas de GLP-1 también se asociaron con disminución de la macroalbuminuria sin presentar alteración en las hospitalizaciones por insuficiencia cardiaca58.
La guía europea de diabetes y prediabetes de la Sociedad Europea de Cardiología y la Asociación Europea para el estudio de la Diabetes10, recomendó, por primera vez en 2019, que en pacientes diabéticos con riesgo cardiovascular alto o muy alto, el tratamiento farmacológico debería ser igual que en aquellos con enfermedad cardiovascular establecida (fig. 1). La decisión tampoco depende del cumplimiento o no de la meta de hemoglobina glucosilada.
Las otras clases de antidiabéticos, incluyendo insulinas, sulfonilúreas, inhibidores de DPP4 y tiazolidinedionas, no se asocian con beneficios cardiovasculares o renales independientes en este grupo de pacientes.
En resumen, las personas con diabetes tipo 2 sin enfermedad aterosclerótica establecida, pero de riesgo cardiovascular alto o muy alto, deberían recibir tratamiento con metformina, sumado a un inhibidor de SGLT2 o a un agonista de GLP-1.
PREGUNTA 10. ¿Cuál es la recomendación respecto al uso de la terapia antidiabética en pacientes diabéticos de riesgo moderado?Metformina debe ser la primera opción de manejo. Si no se alcanza la meta de hemoglobina glucosilada se recomienda adicionar un segundo medicamento, que puede ser un inhibidor de SGLT2, un agonista de los receptores de GLP-1, un inhibidor de DPP4, una sulfonilúrea de segunda generación (glimepiride) y, por último, insulina. Idealmente, deben elegirse fármacos que faciliten el logro de la triple meta: reducción de hemoglobina glucosilada, sin riesgo de hipoglucemia y que generen pérdida de peso o al menos tengan un efecto neutro sobre el mismo.
JustificaciónLa mayoría de las guías internacionales para el manejo de la diabetes mellitus tipo 2 considera los cambios terapéuticos de estilo de vida junto a la metformina como el tratamiento inicial9,13,48. Los inhibidores de SGLT2 o los agonistas de GLP-1 siguen siendo opciones válidas adicionales a la metformina en pacientes diabéticos tipo 2 con riesgo moderado. Los estudios de vida real han permitido evaluar el comportamiento de estos medicamentos en poblaciones de más bajo riesgo que el examinado en los estudios de seguridad cardiovascular. El estudio CVD-REAL 270, comparó más de 249.000 pacientes diabéticos que iniciaron tratamiento con un inhibidor de SGLT2 vs. otras terapias antidiabéticas en Japón, Corea del Sur, Singapur, Israel, Australia y Canadá, incluyendo más del 70% de pacientes sin enfermedad cardiovascular conocida y de menor riesgo, en comparación con los pacientes incluidos en los estudios de seguridad cardiovascular. En este estudio, la utilización de un inhibidor de SGLT2 se asoció con menor mortalidad, menor tasa de insuficiencia cardiaca, e incluso, menos riesgo de infarto de miocardio y de ataque cerebrovascular. Por consiguiente, aún en pacientes diabéticos con riesgo moderado, los inhibidores de SGLT2 o los agonistas de GLP-1 siguen siendo los antidiabéticos preferidos después de la metformina.
Un agonista de GLP-1 (por ejemplo, liraglutida o semaglutida) puede ser preferible por encima del inhibidor de SGLT2, en especial si la hemoglobina glucosilada está muy por encima de metas (por ejemplo> 10.0%) o en casos de obesidad o sobrepeso9,48.
Si, en definitiva, se considera que el riesgo cardiorrenal en este grupo de pacientes no es tan importante, se puede seleccionar la terapia antidiabética de acuerdo con las guías institucionales o nacionales, buscando la triple meta, la cual consiste en disminuir la hemoglobina glucosilada, no producir hipoglucemia y reducir el peso (o al menos tener un efecto neutro sobre el mismo).
PREGUNTA 11. ¿Cómo prevenir el deterioro renal en el paciente con diabetes tipo 2?La determinación de la tasa de filtración glomerular efectiva por la fórmula CKD-EPI y la medición de la relación albuminuria/creatinuria, se deben realizar periódicamente en todo paciente diabético. El control de los factores de riesgo, como la hipertensión arterial, la dislipidemia y la glucemia elevada, es fundamental para evitar la progresión del daño renal. El uso de inhibidores de SGLT2 y agonistas de los receptores de GLP-1ha demostrado disminuir los desenlaces renales combinados.
JustificaciónLa búsqueda activa de enfermedad renal diabética (ERD) debe realizarse al momento del diagnóstico de diabetes mellitus tipo 2 y después cada año (o cada 5 años para diabetes tipo 1)71. Hasta el 25% de los pacientes recién diagnosticados con diabetes tipo 2 ya tiene complicaciones microvasculares, y a menudo hay un retraso de 4 a 7 años entre el inicio de la diabetes y el diagnóstico de la enfermedad. La detección temprana, la estadificación y el seguimiento de la progresión de la ERD son los pilares más importantes y la estrategia más costo-efectiva para prevenir y retrasar el desarrollo de deterioro de la función renal en pacientes con diabetes tipo 2 y función renal normal o levemente comprometida72,73.
Para diagnosticar ERD se deben hacer dos pruebas básicas: la determinación de la tasa de filtración glomerular efectiva (TFGe) y la medición de albuminuria. La TFGe se determina mediante la creatinina sérica; en adultos, las guías KDIGO recomiendan la ecuación CKD-EPI, por ser más precisa que otras ecuaciones de estimación74. La albuminuria se puede determinar mediante una prueba de orina ocasional tomada a primera hora de la mañana (para excluir la proteinuria ortostática), realizando una relación albuminuria/creatinuria, o una recolección de orina en 24 horas para medir la tasa de excreción de albúmina. La relación albuminuria/creatinuria es el método recomendado para detectar albuminuria en personas con diabetes, ya que se correlaciona estrechamente con la albuminuria de 24 horas. La albuminuria no debe medirse durante una enfermedad intercurrente o en presencia de infección del tracto urinario, insuficiencia cardíaca congestiva, enfermedad febril aguda, menstruación o flujo vaginal, ejercicio dentro de las 24 horas previas al examen, hiperglucemia marcada, hipertensión no controlada y dieta alta en proteínas. La ecografía renal no hace parte del diagnóstico de ERD de manera rutinaria72.
Los factores de riesgo que promueven el desarrollo y la progresión de la ERD pueden ser modificables (mal control glucémico, hipertensión arterial, nivel de albuminuria, obesidad, dislipidemia, tabaquismo y presencia de otras complicaciones microvasculares) y no modificables (género masculino, edad avanzada, factores genéticos, raza y tiempo de duración de la diabetes)75.
El control de la presión arterial impacta significativamente la aparición y progresión de la ERD. El bloqueo del sistema renina-angiotensina-aldosterona sigue siendo la herramienta de renoprotección más aceptada para evitar la progresión de la ERD, especialmente en presencia de albuminuria. Los estudios también han demostrado que el aumento del nivel de hemoglobina glucosilada se correlaciona con daño renal y pérdida de la función renal, por lo que el control glucémico es otra estrategia fundamental en el control de la ERD. No hay datos suficientes en cuanto al objetivo glucémico ideal en pacientes con TFGe <60ml/min/1,73 m2 (ERC estadio G3 o más); por tanto, en este subgrupo los objetivos de reducción de hemoglobina glucosilada deben ser menos estrictos, sobre todo si hay riesgo de hipoglucemia71,72. Por su parte, la dislipidemia contribuye al desarrollo y la progresión de la ERD al causar aterosclerosis intrarrenal o toxicidad glomerular y tubulointersticial directa. Hay evidencia que sugiere que la disminución de los lípidos reduce el nivel de proteinuria, preserva la TFGe y retrasa la progresión de la ERD.
Los nuevos medicamentos antidiabéticos, como los inhibidores de SGLT2 y los agonistas de los receptores de GLP-1, han demostrado tener un efecto benéfico en los riñones y se consideran como de primera línea en el tratamiento de los diabéticos con ERD76,77. La tabla 5 muestra los principales desenlaces renales de los estudios de seguridad cardiovascular de los nuevos antidiabéticos.
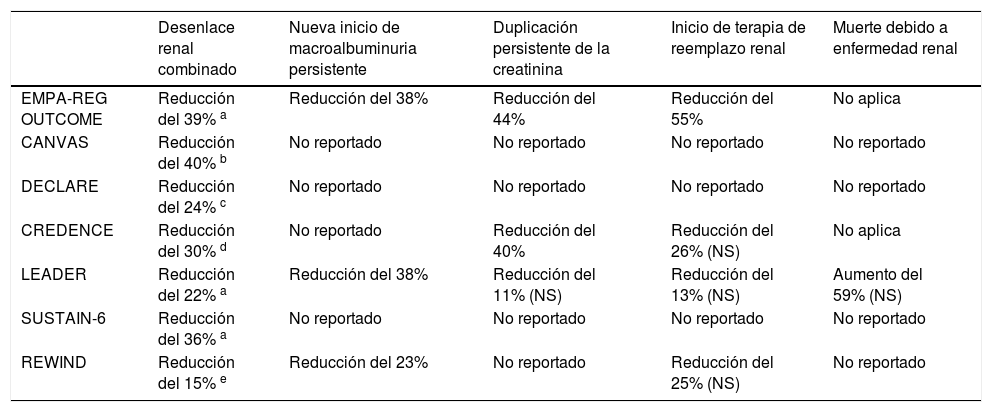
Principales desenlaces renales en estudios de seguridad cardiovascular de nuevos antidiabéticos
| Desenlace renal combinado | Nueva inicio de macroalbuminuria persistente | Duplicación persistente de la creatinina | Inicio de terapia de reemplazo renal | Muerte debido a enfermedad renal | |
|---|---|---|---|---|---|
| EMPA-REG OUTCOME | Reducción del 39% a | Reducción del 38% | Reducción del 44% | Reducción del 55% | No aplica |
| CANVAS | Reducción del 40% b | No reportado | No reportado | No reportado | No reportado |
| DECLARE | Reducción del 24% c | No reportado | No reportado | No reportado | No reportado |
| CREDENCE | Reducción del 30% d | No reportado | Reducción del 40% | Reducción del 26% (NS) | No aplica |
| LEADER | Reducción del 22% a | Reducción del 38% | Reducción del 11% (NS) | Reducción del 13% (NS) | Aumento del 59% (NS) |
| SUSTAIN-6 | Reducción del 36% a | No reportado | No reportado | No reportado | No reportado |
| REWIND | Reducción del 15% e | Reducción del 23% | No reportado | Reducción del 25% (NS) | No reportado |
NS: no significativo. Los desenlaces renales combinados son diferentes para cada estudio:
Macroalbuminuria persistente de nuevo inicio, duplicación persistente de la creatinina y TFG <45ml/min/1.73 m2, necesidad de terapia de reemplazo renal.
40% de reducción en la TFG, necesidad de terapia de reemplazo renal o muerte debido a enfermedad renal.
≥ 40% de reducción de la TFG a menos de 60ml/min/1.73 m2, nuevos casos de enfermedad renal terminal, muerte de causa renal o cardiovascular.
Enfermedad renal terminal, duplicación persistente de la creatinina, muerte de causa renal o cardiovascular.
Macroalbuminuria persistente de nuevo inicio, disminución persistente de la TFG> 30%, necesidad de terapia de reemplazo renal crónica.
Adaptada de: García-Carro C, et al. J Clin Med. 2019 Jun 17;8(6). pii: E864. doi: 10.3390/jcm806086478.
El tratamiento con empagliflozina en el EMPA-REG OUTCOME se asoció con 39% de reducción de empeoramiento o nuevos casos de nefropatía, así como menor progresión a macroalbuminuria y menor necesidad de terapia de reemplazo renal54. Canagliflozina en el estudio CANVAS redujo el desenlace combinado renal, así como la progresión de la albuminuria55. En el estudio DECLARE, dapagliflozina también redujo el desenlace compuesto renal en un 24%, y, de manera interesante, la renoprotección observada fue independiente de la presencia de enfermedad cardiovascular establecida56. El estudio CREDENCE, con canagliflozina, evaluó específicamente el desenlace combinado renal en diabéticos tipo 2 con TFG entre 30 y 89ml/min, pero con existencia de albuminuria documentada. En el momento de la suspensión del estudio, los pacientes en el brazo de canagliflozina tuvieron una reducción del 30% en el desenlace renal combinado respecto al brazo placebo, pero además tuvieron menor incidencia de complicaciones cardiovasculares y hospitalizaciones por insuficiencia cardiaca79.
Un metaanálisis publicado a finales de 2019 por Neuen et al. en el que se incluyeron 38.723 pacientes de los estudios EMPA-REG OUTCOME, CANVAS, CREDENCE y DECLARE, demostró reducción del 33% del desenlace compuesto de diálisis, trasplante o muerte, a consecuencia de nefropatía. Este beneficio se observó incluso en pacientes con tasa de filtración glomerular estimada inicial por debajo de 45ml/min/1,73 m2 e independientemente de la existencia de albuminuria previa80. Aunque los beneficios desde el punto de vista renal en pacientes con ERD parecen corresponder a un efecto de clase, sólo se tendrá certeza de esto cuando sean publicados los resultados del DAPA-CKD (con dapagliflozina) y del EMPA-KIDNEY (con empagliflozina)81.
Por su parte, los agonistas de GLP-1 también han demostrado disminuir significativamente los desenlaces renales. En el estudio LEADER61 hubo menor incidencia de macroalbuminuria de nueva aparición en el brazo de liraglutida, así como menor incremento de la relación albúmina/creatinina, en comparación con el placebo. Un análisis secundario del LEADER demostró una reducción del desenlace renal secundario, dada especialmente por una menor incidencia de macroalbuminuria persistente82. Semaglutida en el SUSTAIN-662 y dulaglutida en el REWIND83, se asociaron con menor incidencia del desenlace renal combinado. En general, los agonistas de los receptores de GLP-1 han demostrado efectos benéficos sobre el desenlace renal combinado, especialmente en la aparición de macroalbuminuria, lo cual puede deberse a la supresión de vías metabólicas relacionadas con la inflamación78. Estudios en modelos experimentales en diabéticos y no diabéticos sugieren que los agonistas de GLP-1 pueden ejercer su protección reno-cardiovascular por mecanismos completamente independientes del control glucémico84.
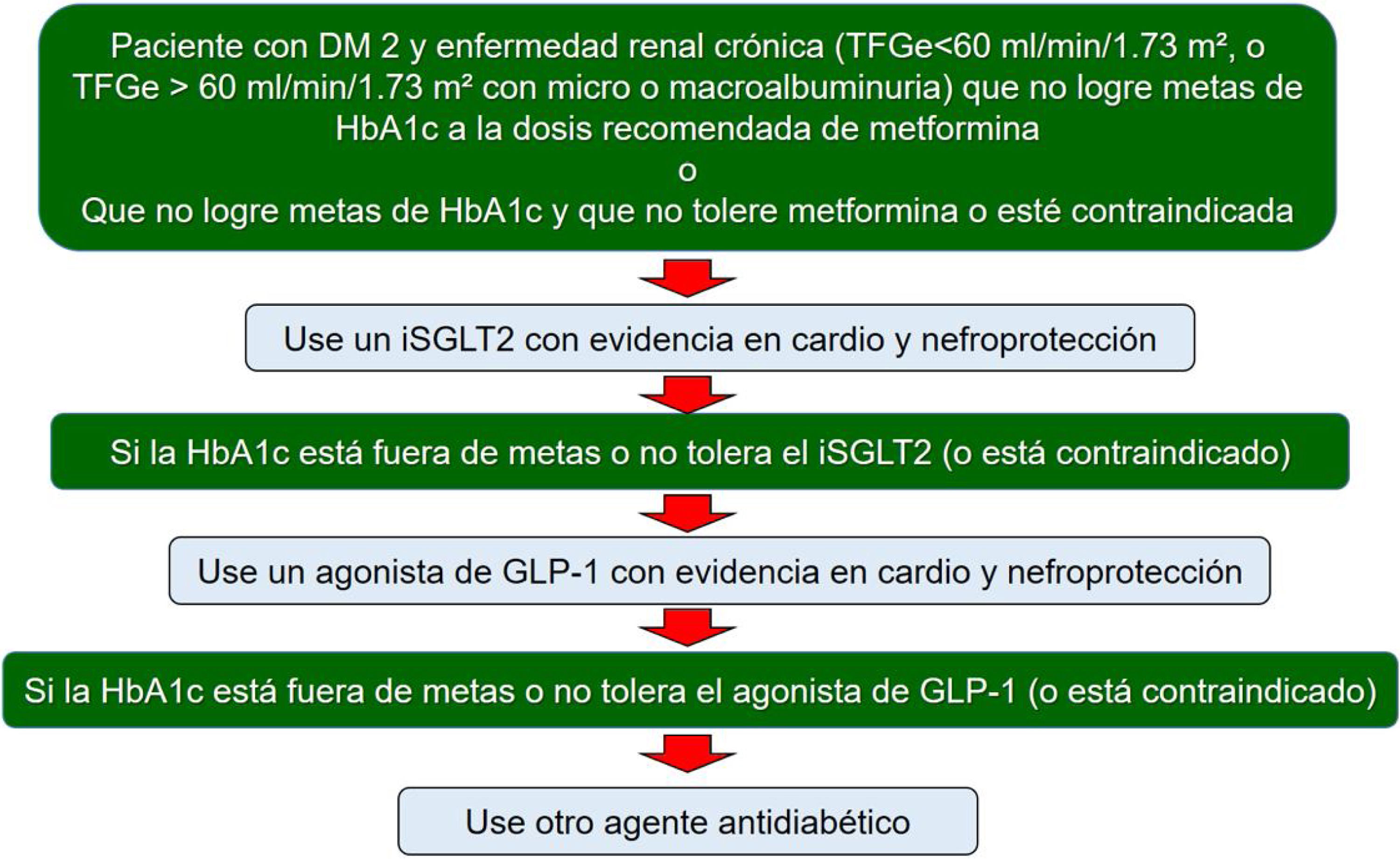
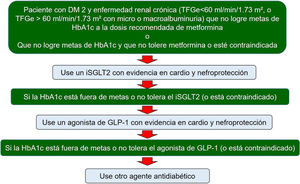
La Asociación Europea de Nefrología y la Asociación Europea de Diálisis y Trasplante, proponen el uso de inhibidores de SGLT2 como segunda opción en todo paciente diabético con evidencia de ERD que no esté en metas de hemoglobina glucosilada con metformina. En caso de estar contraindicado o no tolerar el inhibidor de SGLT-2, se recomienda el uso de un agonista de GLP-176 (fig. 2).
Recomendaciones para el uso de inhibidores de SGLT-2 y AR-GLP1 en diabéticos tipo 2 con enfermedad renal diabética que no está en metas de HbA1c. Adaptada de Sarafidis P, et al. Nephrol Dial Transplant. 2019;34:208-3076.
La principal recomendación es tratar adecuadamente los factores de riesgo cardiovascular, incluyendo el control de la hemoglobina glucosilada y las comorbilidades; aun así, el riesgo de desarrollar insuficiencia cardiaca es elevado entre los diabéticos. A la fecha, la terapia con inhibidores de SGLT2 es la única que reduce la tasa de hospitalizaciones en diabéticos con o sin enfermedad cardiovascular previa.
JustificaciónLa insuficiencia cardiaca es una complicación frecuente en los pacientes con diabetes mellitus tipo 285. La prevalencia puede estar subestimada ya que existen pacientes con disfunción ventricular izquierda completamente asintomáticos. El estudio SOLVD-P examinó el comportamiento de más de 4.000 pacientes con disfunción ventricular izquierda asintomática, entre ellos 647 diabéticos. Los pacientes con diabetes eran de mayor edad, peso, presión arterial sistólica y frecuencia cardiaca que los no diabéticos. Durante un período de seguimiento de 36 meses, los pacientes diabéticos tuvieron mayor riesgo de hospitalizarse por insuficiencia cardiaca y tuvieron un 48% mayor riesgo de presentar el desenlace combinado de desarrollar insuficiencia cardiaca o morir por causa cardiovascular86.
La pregunta es cómo poder identificar aquellos pacientes diabéticos que tienen disfunción ventricular izquierda asintomática, o aquellos diabéticos con alto riesgo de desarrollar insuficiencia cardiaca en los próximos meses o años, y lo más importante, si tratar la disfunción ventricular asintomática en los diabéticos se reflejará en una disminución de los desenlaces cardiovasculares a futuro. El estudio PONTIAC estudió 300 diabéticos tipo 2 con NT-pro BNP> 125 pg/ml, pero libres de enfermedad cardiaca y se aleatorizaron a recibir tratamiento en los centros convencionales de diabetes o en un centro ambulatorio de cardiología donde se optimizaba el manejo con antagonistas del sistema renina–angiotensina–aldosterona y con betabloqueadores. A los 12 meses de tratamiento, el desenlace primario (hospitalización o muerte por causa cardiovascular) fue significativamente más bajo en los diabéticos tratados en el centro cardiológico con titulación de antagonistas del sistema renina-angiotensina-aldosterona y de betabloqueadores87. Rawshani et al. analizaron más de 270.000 pacientes diabéticos del Registro Sueco Nacional de Diabetes y los compararon con cerca de 1’356.000 controles. Evaluaron la presencia de cinco factores de riesgo: hemoglobina glucosilada elevada, colesterol LDL elevado, albuminuria positiva, tabaquismo y presión arterial alta. El estudio demostró un marcado incremento de los desenlaces adversos cardiovasculares, a mayor número de factores de riesgo presentes. Pero, lo más interesante fue que el riesgo de infarto de miocardio, evento cerebrovascular y mortalidad era similar entre los diabéticos y la población general si no existían factores de riesgo adicionales. No obstante, el riesgo de desarrollar insuficiencia cardiaca fue mayor entre la población diabética, aunque tuvieran todos los cinco factores de riesgo controlados 88.
El Colegio Americano de Cardiología, la Asociación Americana del Corazón y la Sociedad Americana de Falla cardiaca recomendaron por primera vez en sus guías de 2017, la realización de péptidos natriuréticos como tamizaje en aquellas personas en riesgo de desarrollar insuficiencia cardiaca (recomendación clase IIa)89.
Si bien existen pacientes diabéticos sin enfermedad isquémica aterosclerótica y sin hipertensión arterial que desarrollan insuficiencia cardiaca (miocardiopatía diabética), lo cierto es que la mayoría de los diabéticos que terminan con insuficiencia cardiaca lo hacen debido a estas dos causas, por lo que podemos decir que la mejor manera de prevenir esta complicación es con el tratamiento adecuado de los factores de riesgo.
Los resultados de los tres estudios con inhibidores de SGLT2 que incluyeron, en su mayoría, pacientes sin historia conocida de insuficiencia cardiaca, reportaron, de manera concluyente, una disminución en la tasa de hospitalización por falla cardiaca. Igualmente, los registros de vida real CVD-REAL90 y CVD-REAL 270, que incluyeron más de 500.000 diabéticos que iniciaron terapia con inhibidores de SGLT2 vs. otros antidiabéticos en países de diferentes continentes y, por consiguiente, de diferentes razas, también demostraron la reducción de las hospitalizaciones por insuficiencia cardiaca en el brazo de los inhibidores de SGLT2. En conclusión, los inhibidores de SGLT2 reducen el riesgo de hospitalización por falla cardiaca en diabéticos con y sin enfermedad cardiovascular establecida, y con o sin insuficiencia cardiaca de base, y deberían ser la primera línea de tratamiento para reducir hospitalizaciones por insuficiencia cardiaca en los pacientes con diabetes tipo 291,92.
PREGUNTA 13. ¿Cómo se debe tratar al paciente diabético tipo 2 con insuficiencia cardiaca con fracción de eyección reducida?Los inhibidores de SGLT2 son los antidiabéticos recomendados en los pacientes diabéticos con diagnóstico conocido de insuficiencia cardiaca con fracción de eyección reducida. La mayoría de los otros grupos de antidiabéticos tienen un efecto neutro, con excepción de las tiazolidinedionas y la saxagliptina, que están contraindicados en el diabético con insuficiencia cardiaca.
JustificaciónExiste una relación de doble vía entre la diabetes mellitus y la insuficiencia cardiaca; la existencia de la una aumenta el riesgo de desarrollar la otra93,94. En diferentes estudios y registros de insuficiencia cardiaca, la prevalencia de diabetes varía entre 10 y 47%95. Cuando se revisa la prevalencia de diabetes entre los pacientes hospitalizados por insuficiencia cardiaca, esta generalmente supera el 40%96. Al analizar las cohortes de diabéticos tipo 2, la prevalencia de insuficiencia cardiaca es del 9 al 22%, la cual es 4 veces mayor que la observada en la población general95.
La mayoría de las terapias antidiabéticas han demostrado ser seguras en los pacientes con insuficiencia cardiaca, a excepción de las tiazolidinedionas97,98 y la saxagliptina99. Debido a los resultados de los estudios clínicos con estas moléculas, el uso de tiazolidinedionas o de saxagliptina está contraindicado en los diabéticos con diagnóstico conocido de insuficiencia cardiaca100. La metformina puede emplearse con seguridad en este grupo, pero se sugiere suspenderla durante condiciones agudas que se asocien con acidosis láctica, como choque cardiogénico o choque distributivo95. Aunque existe información contradictoria, en general, las sulfonilúreas no se asocian con mayor tasa de hospitalización por insuficiencia cardiaca. Recientemente, el estudio CAROLINA no mostró diferencias en la tasa de hospitalización por falla cardiaca entre los pacientes que recibieron una sulfonilúrea (glimepirida) o un inhibidor de DPP4 (linagliptina)101. Otros medicamentos inhibidores de DPP4, como sitagliptina, al igual que los agonistas de GLP-1, han demostrado ser seguros, sin incrementar la tasa de hospitalizaciones por insuficiencia cardiaca. Algunos modelos en animales sugieren que la administración de un agonista de los receptores de GLP-1 puede mejorar la contractilidad del ventrículo izquierdo, reducir la hipertrofia, atenuar el estrés oxidativo y mejorar la sobrevida102, pero esto no se ha visto reflejado en los desenlaces clínicos de los estudios.
El estudio EMPAREG-OUTCOME, con empagliflozina en dosis de 10 y de 25mg al día, sorprendió tanto por la reducción en la tasa de hospitalizaciones por insuficiencia cardiaca en un 35%, como por la clara diferenciación de las curvas a favor del brazo de empagliflozina desde las primeras semanas de tratamiento54. Los estudios del programa CANVAS mostraron también una reducción del 33% en la tasa de hospitalizaciones por IC en los pacientes que recibieron canagliflozina en comparación con placebo55. Análisis posteriores del CANVAS sugieren que se obtienen mayores beneficios sobre la morbimortalidad en aquellos pacientes diabéticos con insuficiencia cardiaca previa103. Finalmente, el estudio DECLARE-TIMI 58, también mostró reducción en la tasa de hospitalizaciones por IC del 27% en los pacientes tratados con dapagliflozina 10mg/d vs. placebo56.
Aunque estos estudios incluyeron, en su mayoría, pacientes diabéticos sin diagnóstico previo de insuficiencia cardiaca, lo cierto es que los resultados sugieren un beneficio claro de los inhibidores de SGLT2 también en aquellos pacientes con diagnóstico ya confirmado de insuficiencia cardiaca. El estudio DAPA-HF104 evaluó la eficacia y la seguridad de dapagliflozina en más de 4.700 pacientes con diagnóstico comprobado de insuficiencia cardiaca con fracción de eyección menor o igual al 40% e incluyó pacientes con y sin diabetes. Los pacientes que recibieron dapagliflozina tuvieron una reducción del 26% en el desenlace primario compuesto por muerte cardiovascular, hospitalización por falla cardiaca y visitas a los servicios de urgencias, en comparación con aquellos que recibieron terapia óptima para falla cardiaca sin el inhibidor de SGLT2. Además, también hubo una reducción de la mortalidad cardiovascular del 18% en el brazo de dapagliflozina. Los resultados con dapagliflozina fueron superiores tanto en los pacientes diabéticos como en pacientes sin diabetes tipo 2. Está en curso el estudio EMPEROR – REDUCED que pretende evaluar la eficacia de empagliflozina en pacientes con insuficiencia cardiaca y fracción de eyección reducida en diabéticos y no diabéticos105.
Hasta el momento no hay evidencia de beneficio de estos medicamentos en pacientes diabéticos con insuficiencia cardiaca con fracción de eyección preservada.
En la actualidad, diferentes sociedades internacionales norteamericanas y europeas recomiendan en sus guías el uso de inhibidores de SGLT2 junto a metformina, en todo paciente diabético tipo 2 con insuficiencia cardiaca y fracción de eyección reducida con el objetivo de disminuir las hospitalizaciones por falla cardiaca9,10,47,48.
PREGUNTA 14. ¿Cuál es el impacto de la hipoglucemia sobre el riesgo cardiovascular?Evitar la hipoglucemia es uno de los objetivos en el tratamiento de todo paciente diabético. Evitar hipoglucemias severas puede ser importante para prevenir complicaciones cardiovasculares, aunque no se ha confirmado una relación de causalidad.
JustificaciónEl tratamiento intensivo de la hiperglucemia, en particular cuando se pretende alcanzar metas más bajas de hemoglobina glucosilada, se asocia con mayor riesgo de desarrollar hipoglucemia. En el estudio ACCORD106 se evidenció un aumento en la mortalidad en el brazo de terapia intensiva, en el cual el número de hipoglucemias severas fue mayor. Esto generó la hipótesis de una potencial asociación causal entre hipoglucemia y desenlaces cardiovasculares. Sin embargo, un análisis post hoc de los datos del ACCORD, sugiere que no fue la hipoglucemia la causa primaria de dicho aumento de mortalidad pues al analizar los casos de hipoglucemia severa en los dos brazos (terapia intensiva vs. terapia convencional), el riesgo de muerte fue menor en el brazo intensivo107.
En el estudio ADVANCE no se observaron diferencias en desenlaces cardiovasculares en los grupos de intervención, pero la presencia de hipoglucemia severa se asoció con un incremento significativo de eventos macrovasculares mayores, mortalidad por causa cardiovascular y mortalidad por cualquier causa, independientemente del grupo de terapia asignado108.
El estudio DEVOTE comparó la seguridad cardiovascular de la insulina Degludec vs insulina Glargina69. En un análisis secundario de dicho estudio, el DEVOTE-3, se evaluaron los efectos temporales de la hipoglucemia severa sobre los desenlaces cardiovasculares. No se encontraron diferencias en el 3P-MACE, pero sí en la mortalidad por cualquier causa109. Los autores concluyen que el estudio no logra responder a la pregunta si la hipoglucemia severa es un marcador de riesgo para desenlaces adversos o si tiene un efecto causal directo.
Un metaanálisis de estudios de cohorte110 evaluó la asociación de hipoglucemia severa con eventos cardiovasculares en diabéticos tipo 2, y encontró una fuerte asociación. Adicionalmente, en una cohorte de 143.000 pacientes diabéticos también se encontró una asociación entre hipoglucemia global (diversos grados) y desenlaces cardiovasculares adversos111.
Hoy en día, es incierto si los eventos hipoglucémicos severos pueden desencadenar por sí solos complicaciones cardiovasculares, aunque se han postulado diferentes mecanismos posibles que involucran especialmente un mayor riesgo de arritmias cardiacas. La falta de estudios prospectivos de cohorte diseñados específicamente para responder esta inquietud, contribuye mucho más a las dificultades en la interpretación del real impacto del fenómeno hipoglucémico sobre el riesgo cardiovascular.
PREGUNTA 15. ¿Cuáles son los posibles mecanismos de protección cardiorrenal de los inhibidores de SGLT2 y de los agonistas de receptores de GLP-1?Diferentes mecanismos en los campos hemodinámico, renal y metabólico se han postulado para los inhibidores de SGLT2, así como un efecto antiaterosclerótico para los agonistas de GLP-1. La evidencia actual sugiere que los mecanismos de protección cardiorrenal son independientes de la reducción de la glucemia.
JustificaciónA pesar de los importantes hallazgos en los estudios de seguridad cardiovascular a favor de los inhibidores de SGLT2 y de los agonistas de los receptores de GLP-1 sobre diferentes desenlaces clínicos, sólo recientemente se han empezado a entender los mecanismos subyacentes que explicarían estos beneficios cardiovasculares.
Respecto a los inhibidores de SGLT2, la reducción del desenlace cardiovascular combinado parece estar limitada a los pacientes diabéticos con enfermedad cardiovascular establecida, mientras que el beneficio de reducir las hospitalizaciones por insuficiencia cardiaca o la progresión de enfermedad renal fue evidente en prevención primaria en poblaciones sin enfermedad cardiovascular aterosclerótica previa57. Hoy, se plantean varias hipótesis respecto a los probables mecanismos por los que los inhibidores de SGLT2 mejoran los desenlaces cardiovasculares, y son tres los más aceptados hasta el momento112:
- 1.
Mejoría en las condiciones de carga del ventrículo izquierdo secundaria a la diuresis osmótica y la natriuresis.
- 2.
Alteración en el sustrato energético del cardiomiocito y en el metabolismo cardiaco.
- 3.
Efecto de los inhibidores de SGLT2 sobre el intercambiador de sodio/hidrógeno en las membranas de los cardiomiocitos.
Debido al bloqueo de los receptores de SGLT2, la glucosa que llega al túbulo renal no puede ser reabsorbida y permanece en el túbulo arrastrando agua a través del gradiente osmótico. Esto genera, además de la glucosuria, la diuresis de agua libre de electrolitos. Varios estudios han demostrado disminución del volumen plasmático total y del contenido total de sodio con el empleo de inhibidores de SGLT2, lo que parece confirmar el efecto natriurético. La diuresis osmótica y la natriuresis disminuyen la precarga y las presiones de llenado del ventrículo izquierdo, lo cual es particularmente importante en pacientes con insuficiencia cardiaca y sobrecarga de volumen. A diferencia de las tiazidas y los diuréticos de asa, los inhibidores de SGLT2 generan, proporcionalmente, mayor reducción del volumen intersticial y no tanto del volumen plasmático; esto puede reducir la activación neurohumoral refleja que ocurre en respuesta a la contracción del volumen intravascular con los diuréticos convencionales y contribuir con los beneficios cardiovasculares113. Además, estos medicamentos también reducen la postcarga mediante la disminución de la rigidez arterial y de la presión arterial112.
El segundo mecanismo se relaciona con los cambios metabólicos propios que ocurren en los pacientes diabéticos. En condiciones normales, el cardiomiocito es capaz de usar diferentes sustratos metabólicos para mantener sus demandas de ATP, incluyendo ácidos grasos libres, glucosa, cuerpos cetónicos y aminoácidos. En los pacientes diabéticos, debido a la resistencia a la insulina hay un incremento en los niveles de ácidos grasos libres y una reducción en la oxidación de la glucosa, lo cual lleva a una mayor utilización de los ácidos grasos como fuente de energía que a la larga produce lipotoxicidad y aumento de las especies reactivas de oxígeno (ROS). El empleo de inhibidores de SGLT2 aumenta la síntesis de cuerpos cetónicos y, en particular, de beta-hidroxibutirato debido a la disminución de la producción de insulina y el aumento en los niveles de glucagón114. Es posible que el beta-hidroxibutirato pase a convertirse en el principal sustrato energético mejorando la contractilidad miocárdica115.
Finalmente, el tercer mecanismo está relacionado con los niveles de sodio dentro de las células miocárdicas. En los corazones de pacientes diabéticos la concentración intracelular de sodio se encuentra aumentada, lo cual puede reducir los niveles de calcio en las mitocondrias debido al intercambiador mitocondrial de sodio/calcio. Los inhibidores de SGLT2 inhiben la isoforma 1 del intercambiador de sodio/hidrógeno en la membrana del cardiomiocito, produciendo una disminución de los niveles intracelulares de sodio y calcio, pero un incremento del calcio intramitocondrial, lo cual lleva a una disminución del estrés oxidativo y del riesgo de arritmias112,115. Uthman et al. demostraron inhibición directa de la isoforma 1 del intercambiador de sodio/hidrógeno expresados en los cardiomiocitos con el uso de inhibidores de SGLT2. Como los receptores de SGLT2 no se expresan en el corazón, el mecanismo de los efectos cardiacos directos no ha sido aclarado hasta ahora. Por el momento, se piensa que son efectos directos que ocurren a través de la vía renal donde se expresan los receptores de SGLT2116.
Por su parte, el GLP-1 modula el sistema cardiovascular y tiene efectos sobre la reducción de la presión arterial, mejoría de la función endotelial, disminución de la aterosclerosis, isquemia miocárdica e inflamación117. Los agonistas de los receptores de GLP-1 promueven la secreción de insulina por parte de las células betapancreáticas y suprimen la secreción de glucagón por las células alfa118. Además, retardan el vaciamiento gástrico y promueven la sensación de saciedad a nivel cerebral, lo cual los convierte en los antidiabéticos más eficaces en la reducción de peso.
Dos tipos de medicamentos aumentan los niveles de GLP-1: agonistas de GLP-1 e inhibidores de DPP4. Sin embargo, el impacto favorable sobre los desenlaces cardiovasculares sólo se ha evidenciado en los primeros. Es posible que, en parte, se deba a que los inhibidores de DPP4 también potencian la expresión de otros péptidos que pueden tener efectos cardiovasculares adversos, como el factor 1 derivado de células estromales (SDF-1), que lleva a inflamación cardiaca y fibrosis119. Es importante anotar que no todos los agonistas de GLP-1 han demostrado protección cardiovascular; aquellos medicamentos con la mayor vida media y la mayor similitud con el GLP-1 humano, como liraglutida, semaglutida y dulaglutida, son los que han demostrado reducción en los desenlaces cardiovasculares combinados respecto al placebo61,62,64.
Uno de los aspectos interesantes de los estudios de seguridad cardiovascular de los agonistas de GLP-1, es que el beneficio observado está particularmente relacionado con eventos ateroscleróticos: infarto de miocardio y evento cerebrovascular, sin demostrar beneficio en la reducción de hospitalizaciones por insuficiencia cardiaca. Este desenlace, sumado al mayor tiempo en que se nota separación de las curvas entre el grupo de intervención vs. placebo al compararlo con los estudios de los inhibidores de SGLT2, sugiere que mecanismos antiateroscleróticos y antiinflamatorios pueden ser los principales responsables de los resultados observados. El efecto de los agonistas de GLP-1 sobre los lípidos es frecuente: disminución de los triglicéridos, incremento del colesterol HDL y una pequeña pero consistente reducción en el colesterol LDL119. También es evidente la reducción en la presión arterial sistólica (2mm Hg) y en el peso corporal (de 2 a 4kg en promedio), por lo que algunos autores postulan que el real beneficio de los agonistas de los receptores de GLP-1 radica en la reducción de los factores de riesgo adicionales que tienen los pacientes diabéticos. Sin embargo, esta hipótesis parece ser poco probable por la rapidez con la que se han observado estos resultados (en promedio antes de tres años)120.
ConclusionesLos estudios de seguridad cardiovascular de nuevos medicamentos antidiabéticos han demostrado que es posible reducir complicaciones cardiovasculares, muerte cardiovascular, hospitalizaciones por insuficiencia cardiaca y desenlaces renales adversos con algunas de estas moléculas. Particularmente, los inhibidores del cotransportador de sodio-glucosa tipo 2 (SGLT2) y los agonistas de los receptores del péptido similar a la glucosa tipo 1 (GLP-1) son los grupos de antidiabéticos más recomendados hoy en día en los diabéticos tipo 2 con enfermedad cardiovascular establecida y en aquellos con riesgo cardiovascular alto o muy alto. Los cambios terapéuticos del estilo de vida siguen constituyendo el pilar del tratamiento del riesgo cardiometabólico en los pacientes con diabetes. El tratamiento adecuado de la hipertensión arterial, así como el uso de estatinas de potencia moderada o alta, es indispensable para reducir las complicaciones cardiovasculares. Algunos pacientes diabéticos que ya tienen el colesterol LDL en metas adecuadas con estatina, pero con niveles de triglicéridos por encima de 135mg/dl, pueden beneficiarse de un ácido graso omega 3 altamente purificado (ácido etil icosapentano, 2 gramos, dos veces al día). En diabéticos sin enfermedad cardiovascular, pero con alto riesgo de complicaciones ateroscleróticas y bajo riesgo de sangrado, puede considerarse el uso de aspirina. Finalmente, se recomienda evitar las hipoglucemias severas durante el tratamiento pues se han asociado con incremento en las complicaciones cardiovasculares.
Conflictos de interés| Autor | Honorarios como conferencista | Honorarios como investigador |
|---|---|---|
| Gilberto Amed Castillo | Boehringer-IngelheimBayerPfizerAstraZenecaNovo NordiskSanofiAbbottNovartis | BayerBoehringer-Ingelheim |
| Gustavo Aroca | No | No |
| Jannes Buelvas | PfizerNovo NordiskAstraZenecaLegrand | No |
| Andrés F. Buitrago | NovartisBayerPTCAmgen | NovartisAmgenPTCBayer |
| Virgil Carballo | AmgenSanofiNovo NordiskAbbott | Amgen |
| Juan Mauricio Cárdenas | Boehringer-IngelheimAstraZenecaNovo NordiskBayerServier | No |
| Efraín Gómez | NovartisAmgenAbbottBoehringer-IngelheimTecnofarmaAstellas | NovartisAmgen |
| Karen Fériz | MedtronicNovo NordiskBoehringer-IngelheimAstraZenecaAbbott | No |
| John Mauricio Lopera | Novo NordiskShireTakeda | No |
| Enrique Melgarejo | ServierMenariniBoehringer-IngelheimAbbott | Servier |
| Katherine Restrepo | Boehringer-IngelheimAstraZenecaNovoNordiskSanofi | No |
| Juan Diego Montejo | Novo NordiskBoehringer-IngelheimSanofi | No |
| Juan Bernardo Pinzón | AstraZenecaBoehringer-IngelheimNovo NordiskSanofi | No |
| Adalberto Quintero | Novo NordiskAstraZenecaOmronLegrandProcapsNovartisPfizer | Amgen |
| Jorge E. Rico | Novo NordiskBoehringer-IngelheimMerck Sharp & DohmeAstraZenecaAlexion Pharma Colombia | No |
| Ricardo Rosero | Novo NordiskAbbottBoehringer-Ingelheim | Bayer |