la diabetes y la insuficiencia cardiaca son dos enfermedades altamente prevalentes. Desde 1972 existen publicaciones que demuestran cómo los pacientes con diabetes pueden desarrollar insuficiencia cardiaca, independiente de la presencia de otras causas, como la enfermedad coronaria o la hipertensión.
Objetivorealizar una revisión sistemática de la literatura sobre la cardiopatía diabética.
Metodologíase utilizaron los términos MESH diabetes e insuficiencia cardiaca y se consultó la base de datos PUBMED. Finalmente, se incluyeron los artículos publicados en inglés y español.
Resultadosla cardiopatía diabética es una enfermedad que ocurre como consecuencia de la hiperinsulinemia y la hiperglicemia. Los mecanismos fisiopatológicos que la originan son los cambios metabólicos en la célula miocárdica que generan oxidación, apoptosis y necrosis. Puede manifestarse como fenotipo dilatado o restrictivo. Los inhibidores del cotransportador de sodio glucosa tipo 2 (I-SGLT2) podrían tener un efecto benéfico en el tratamiento de la enfermedad.
Conclusiónla cardiopatía diabética es una de las consecuencias de la diabetes mal controlada. Esta relación entre ambas enfermedades resalta la importancia de tratar adecuadamente la diabetes para prevenir el desarrollo de insuficiencia cardiaca.
Diabetes and heart failure are two highly prevalent diseases. Since 1972, there have been publications that have demonstrated how patients with diabetes can develop heart failure, independently of the presence of other causes, like coronary disease or hypertension.
ObjectiveTo perform a systematic review of the literature on diabetic heart disease.
Material and MethodsThe PubMed data base was consulted using the MESH terms, diabetes and heart failure, with articles in English and Spanish being finally included.
ResultsDiabetic heart disease is an illness that occurs due to high blood insulin and glucose levels (hyperinsulinaemia and hyperglycaemia). The pathophysiological mechanisms that give rise to it are the metabolic changes in the myocardial cell that lead to oxidation, apoptosis, and necrosis. It can be express as a dilated or restrictive phenotype. The sodium-glucose cotransporter-2 (SGLT2) inhibitors could have beneficial effects in the treatment of the disease.
ConclusionDiabetic heart disease is one of the consequences of poorly controlled diabetes. This relationship between both diseases highlights the importance of adequately treating the diabetes in order to prevent the development of heart failure.
La insuficiencia cardiaca y la diabetes mellitus tipo 2 son dos enfermedades altamente prevalentes, que con frecuencia están presentes en el mismo individuo. Tradicionalmente se ha considerado que la alta prevalencia de enfermedad coronaria en los pacientes con diabetes explica la mayoría de los casos de insuficiencia cardiaca; sin embargo, desde hace más de cuarenta años existen reportes en la literatura de estudios posmortem en pacientes diabéticos, en quienes se describió cardiopatía estructural en ausencia de enfermedad coronaria o valvular1. Estos hallazgos de gran relevancia han permitido identificar la hiperglicemia y la hiperinsulinemia como los disparadores del proceso de remodelado cardiaco que pueden producir disfunción ventricular2,3.
Definición de miocardiopatía diabéticaLa primera vez que se mencionó el término miocardiopatía diabética fue en 1972, en la publicación de Rubler et al., en la que se describió un nuevo tipo de cardiopatía en pacientes diabéticos, que se asociaba a esclerosis glomerular. A su vez, en 1974, Hamby et al. demostraron la presencia de lesiones de Kimmelstein-Wilson asociadas a hipertrofia y fibrosis miocárdica4,5. Posteriormente, Fang et al. reportaron insuficiencia cardiaca en los diabéticos como una entidad independiente de la hipertensión y la enfermedad coronaria6. En el 2013, la Sociedad Europea de Cardiología y la Asociación Europea para el Estudio de la Diabetes (EASD) realizaron una publicación conjunta en la que resaltan la importancia de excluir otras causas de insuficiencia cardiaca para poder considerar que la disfunción ventricular está explicada por la diabetes7; no obstante, existe debate al respecto y otros autores plantean que por la alta prevalencia de enfermedades, como la hipertensión y la ateroesclerosis coronaria en los diabéticos, es muy difícil excluir su contribución al desarrollo de la insuficiencia cardiaca, y sugieren que la definición de miocardiopatía diabética debería considerarse en pacientes con anormalidades cardiacas no explicadas completamente por otras comorbilidades cardiovasculares y no cardiovasculares y que se explican quizá por la diabetes. Esta definición tiene en cuenta que la cardiopatía diabética puede ocurrir de manera concomitante con otras condiciones cardiovasculares, caso en el cual la diabetes es el mecanismo disparador principal del daño miocárdico8.
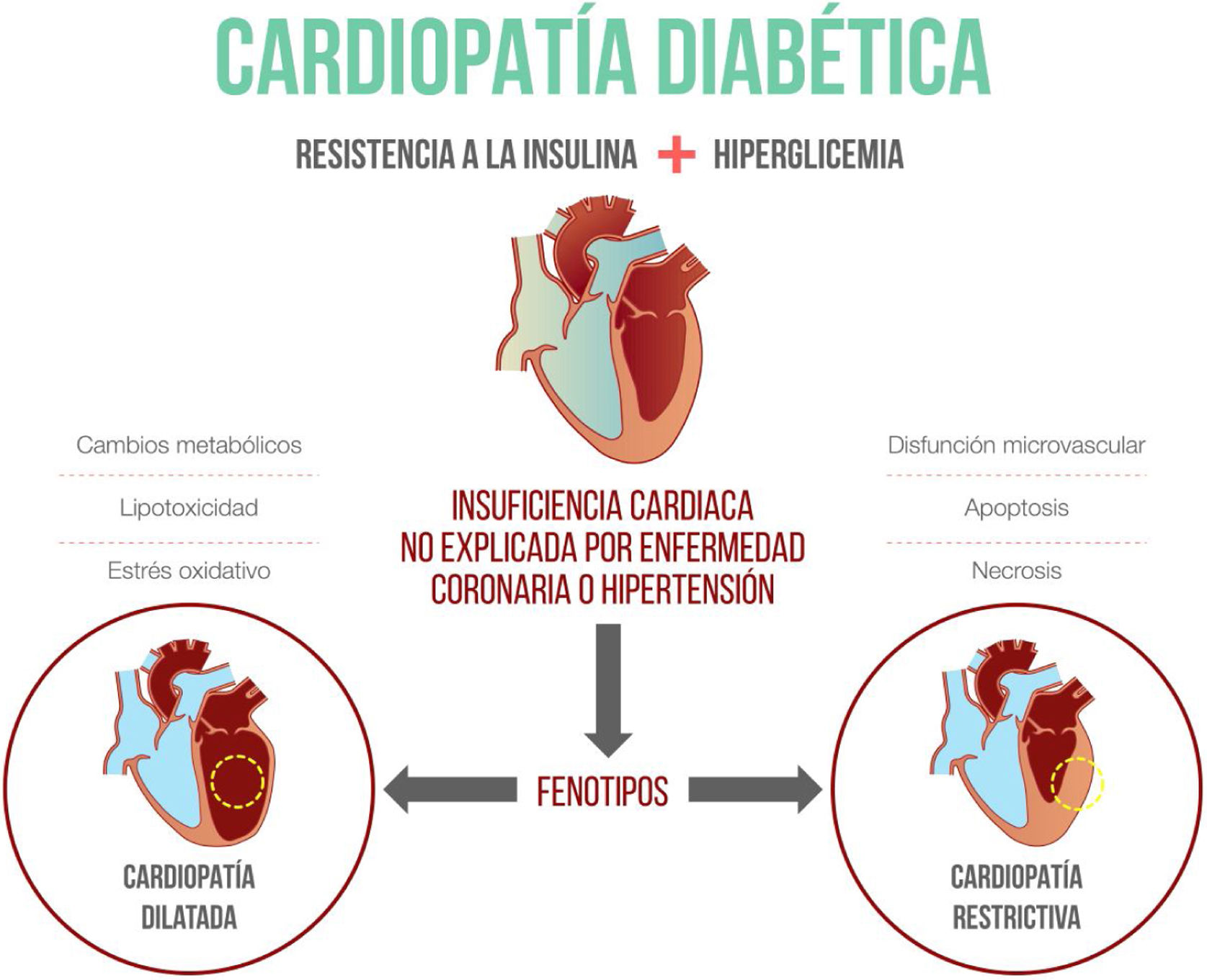
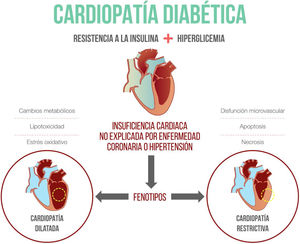
Miocardiopatía diabética: mecanismos molecularesLa mayoría de la información disponible sobre la fisiopatología de la miocardiopatía diabética proviene de modelos animales en los que se han identificado varias alteraciones, como la presencia de enfermedad microvascular, fibrosis, inflamación y cambios en el metabolismo de las células miocárdicas, como mecanismos principales9. A continuación se describe, en detalle, la importancia de cada uno de ellos (fig. 1).
Productos avanzados de la glicosilación (PAG)Son proteínas o lípidos que se someten a un proceso de glicosilación como consecuencia de su exposición a la hiperglicemia. Estas sustancias han sido identificadas en las biopsias endomiocárdicas de pacientes con diabetes mellitus tipo 2 e insuficiencia cardiaca y se han relacionado como inductores de fibrosis al impedir la degradación del colágeno en la matriz extracelular cardiaca. Adicionalmente, incrementan el estrés oxidativo y estimulan la activación del factor nuclear κB que induce la aparición de cadenas de miosina pesadas tipo β y altera la recaptación de calcio por parte del retículo sarcoplásmico. Todas estas alteraciones han sido relacionadas con la aparición de disfunción diastólica y sistólica10–13.
FibrosisLa presencia de fibrosis perivascular e intermiofibrilar ha sido demostrada en humanos y en animales con diabetes, hallazgo que se explica por el aumento en la producción de colágeno y por la alteración en la degradación de la matriz extracelular que se produce por la disminución de la expresión de la metaloproteinasa de matriz tipo 214,15.
InflamaciónLa diabetes es un estado proinflamatorio en el que se ha demostrado aumento en las moléculas de adhesión ICAM 1 y VCAM 1, infiltración miocárdica de células inflamatorias y elevación de los niveles circulantes de interleuquinas 1, 6 y 8, del factor de crecimiento tumoral α y del factor transformador de crecimiento -β116.
ApoptosisEl incremento de la muerte celular de los miocitos se observa en pacientes con diabetes tipos 1 y 2, mientras que el aumento de las especies reactivas de óxido nítrico y de las citoquinas inflamatorias es el mecanismo que se ha relacionado con este fenómeno, que ocasiona muerte por apoptosis y por necrosis17,18.
LípidosEstudios de resonancia cardiaca y biopsia endomiocárdica han demostrado que los pacientes con diabetes tienen mayor contenido de triglicéridos y colesterol en el tejido miocárdico, fenómeno que es más frecuente en los pacientes obesos. La acumulación de estas sustancias induce lipotoxicidad, que a su vez genera muerte celular19.
Alteraciones metabólicasEl sustrato energético de las células miocárdicas de los pacientes con diabetes tipos 1 y 2 se modifica como adaptación a la enfermedad y se caracteriza por incremento en el uso de los ácidos grasos y disminución en la oxidación de la glucosa como sustrato energético. Este cambio en el sustrato energético incrementa el consumo de oxígeno, disminuye la eficiencia cardiaca y genera desacoplamiento mitocondrial, que causa depleción de energía e induce estrés oxidativo que generará consecuencias deletéreas en la función del músculo cardiaco20,21.
Fenotipos de la miocardiopatía diabéticaTradicionalmente se ha considerado que los pacientes con miocardiopatía diabética presentan cardiopatía dilatada. Sin embargo, Seferovic et al. describieron en 2015 el fenotipo restrictivo, en el cual predomina el remodelado concéntrico y la disfunción diastólica. Ambos fenotipos no son estadios sucesivos de la misma enfermedad y evolucionan a insuficiencia cardiaca con función reducida en los pacientes con cardiopatía dilatada o a insuficiencia cardiaca con función preservada en el fenotipo restrictivo. Esta clasificación en fenotipos es importante a la hora de considerar el tratamiento para la insuficiencia cardiaca, pues en el fenotipo dilatado existen múltiples alternativas terapéuticas, mientras que para el fenotipo restrictivo, hasta la fecha, solo se recomienda el control de los factores de riesgo, el cambio del estilo de vida y los diuréticos para mejorar los síntomas de congestión22.
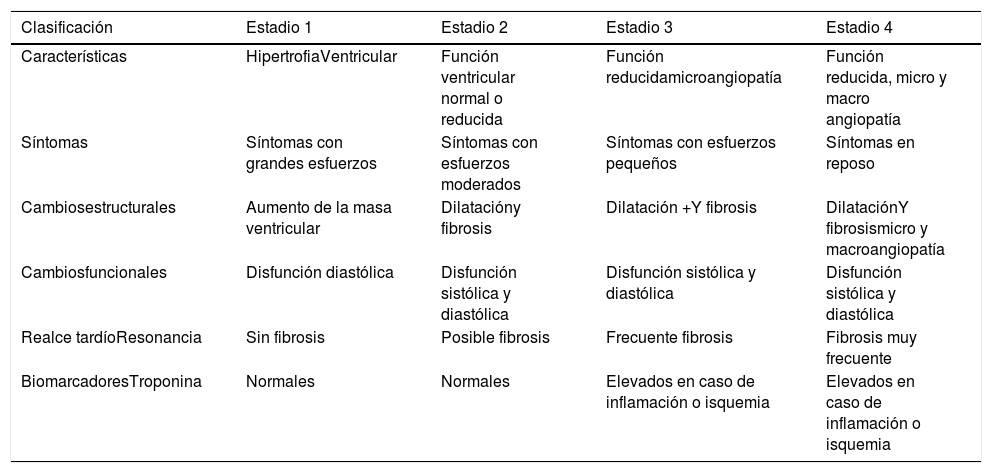
Estadios de la miocardiopatía diabéticaLa miocardiopatía diabética se ha clasificado en cuatro estadios que van desde los hallazgos tempranos iniciales de la enfermedad hasta la fase tardía donde se observa daño irreversible6. Cada estadio de la enfermedad se caracteriza por diferentes cambios estructurales, síntomas y variaciones en el perfil de los biomarcadores. Los estadios de la cardiopatía diabética y sus características se describen en la tabla 1.
Estadios de la cardiopatía diabética
| Clasificación | Estadio 1 | Estadio 2 | Estadio 3 | Estadio 4 |
|---|---|---|---|---|
| Características | HipertrofiaVentricular | Función ventricular normal o reducida | Función reducidamicroangiopatía | Función reducida, micro y macro angiopatía |
| Síntomas | Síntomas con grandes esfuerzos | Síntomas con esfuerzos moderados | Síntomas con esfuerzos pequeños | Síntomas en reposo |
| Cambiosestructurales | Aumento de la masa ventricular | Dilatacióny fibrosis | Dilatación +Y fibrosis | DilataciónY fibrosismicro y macroangiopatía |
| Cambiosfuncionales | Disfunción diastólica | Disfunción sistólica y diastólica | Disfunción sistólica y diastólica | Disfunción sistólica y diastólica |
| Realce tardíoResonancia | Sin fibrosis | Posible fibrosis | Frecuente fibrosis | Fibrosis muy frecuente |
| BiomarcadoresTroponina | Normales | Normales | Elevados en caso de inflamación o isquemia | Elevados en caso de inflamación o isquemia |
Los síntomas de insuficiencia cardiaca asociados a la elevación de los péptidos natriuréticos deben alertar al clínico sobre la probabilidad de cardiopatía en el paciente diabético. La ecocardiografía es el paso a seguir con el fin de valorar las alteraciones estructurales y la función sistólica y diastólica. Los hallazgos ecocardiográficos tempranos de la enfermedad serán tratados a profundidad en otro capítulo de este suplemento.
La detección de la disfunción ventricular subclínica ha sido un tema de investigación reciente de gran interés. El estudio PONTIAC evaluó la estrategia de la medición rutinaria del NT pro BNP en pacientes diabéticos de alto riesgo cardiovascular para la detección temprana de la disfunción ventricular. Aquellos que tenían valores mayores a 125 pg/ml recibieron tratamiento temprano para la insuficiencia cardiaca y seguimiento especializado, y lograron demostrar una disminución en la muerte y en las hospitalizaciones por causas cardiovasculares23.
Tratamiento de la miocardiopatía diabéticaEl uso de terapias específicas en pacientes con miocardiopatía diabética es un campo de investigación inexplorado hasta ahora. Sin embargo, hasta la fecha los hallazgos de los estudios publicados con inhibidores del cotransportador de sodio glucosa 2 (I-SGLT2) han demostrado disminuir las hospitalizaciones por insuficiencia cardiaca en diabéticos24–27. Es importante resaltar que la disminución en las hospitalizaciones por falla cardiaca es un desenlace que no ha sido favorable en los estudios con otras moléculas antidiabéticas, como los agonistas del receptor de GLP1 y los inhibidores de la DPP-428–31.
ConclusiónLa miocardiopatía diabética se define como la presencia de alteración de la función cardiaca en ausencia de otras causas que expliquen la disfunción ventricular en un paciente con diabetes. Existen múltiples mecanismos fisiopatológicos en su desarrollo, como la presencia de fibrosis, apoptosis, inflamación, lipotoxicidad, y cambios en el sustrato energético de la célula miocárdica. Existen dos fenotipos principales: el restrictivo y el dilatado. Pese a que no hay una terapia específica para tratar la enfermedad, los I-SGLT2 parecen ser una terapia promisoria por sus beneficios en la disminución de hospitalizaciones por falla cardiaca.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.