El trastorno por déficit de atención e hiperactividad (TDAH) es una perturbación con elevada prevalencia en población infantil de Bogotá. Entre las causas de este trastorno se encuentran factores genéticos y ambientales, pero pocos estudios han tratado de abordar el componente genético en población colombiana.
ObjetivosRealizar un estudio de asociación genética entre diferentes polimorfismos y el TDAH en la población de Bogotá.
MétodosMúltiples polimorfismos de los genes DAT1, SERT, COMT y BDNF fueron genotipificados empleando las técnicas de PCR convencional y RFLP en 97 tríos de Bogotá. El test de desequilibrio de trasmisión (TDT) se empleó para determinar la asociación entre las diferentes variantes y el TDAH.
ResultadosEl análisis de TDT no identificó una transmisión preferencial de alelos de ninguna de las variantes estudiadas.
ConclusionesNuestros resultados indican que la etiología del TDAH es heterogénea e involucra diversos factores genéticos. Futuros estudios enfocados en otros polimorfismos candidatos en una muestra más grande ayudarán a comprender el TDAH en la población colombiana.
Attention deficit and hyperactive disorder (ADHD) is highly prevalent among children in Bogota City. Both genetic and environmental factors play a very important role in the etiology of ADHD. However, to date few studies have addressed the association of genetic variants and ADHD in the Colombian population.
ObjectivesTo test the genetic association between polymorphisms in the DAT1, HTTLPR, COMT and BDNF genes and ADHD in a sample from Bogota City.
MethodsWe genotyped the most common polymorphisms in DAT1, SERT, COMT and BDNF genes associated with ADHD using conventional PCR followed by restriction fragment length polymorphism (RFLP) in 97 trios recruited in a medical center in Bogota. The transmission disequilibrium test (TDT) was used to determine the association between such genetic variants and ADHD.
ResultsThe TDT analysis showed that no individual allele of any variant studied has a preferential transmission.
ConclusionsOur results suggest that the etiology of the ADHD may be complex and involves several genetic factors. Further studies in other candidate polymorphisms in a larger sample size will improve our knowledge of the ADHD in Colombian population.
El Manual Diagnóstico y Estadístico de los Trastornos Mentales (DSM) define el trastorno por déficit de atención e hiperactividad (TDAH) como la dificultad para mantener la concentración y prestar atención y controlar el comportamiento y la hiperactividad, entre otros1. El TDAH es uno de los trastornos neuroconductuales más comunes en la infancia y puede prevalecer hasta la adultez. El TDAH es un síndrome complejo y heterogéneo y su etiología es multifactorial2.
La prevalencia mundial de este trastorno es de un 5,29% en edad escolar3. En Colombia, en las ciudades de Manizales y Medellín, la prevalencia es mayor, un 16% de la población general4. La incidencia del TDAH puede aumentar debido a factores de riesgo como la extrema pobreza, la desintegración familiar, la violencia intrafamiliar y la baja cobertura en servicios de salud, entre otros4,5.
Estudios en gemelos monocigotos y dicigotos con TDAH en diferentes países han reportado altos índices de heredabilidad (del 60 al 90%)6. Las estimaciones de heredabilidad no solo incluyen influencias genéticas, sino también efectos de interacción entre gen y ambiente7 que, al parecer, tienen un papel crucial en el desarrollo de la enfermedad. Entre los factores ambientales asociados a la etiología del TDAH, se encuentran riesgos prenatales, perinatales y posnatales, nutrición, estrés, infecciones y exposición a componentes tóxicos durante la gestación, que pueden afectar al desarrollo cerebral en regiones relevantes para el TDAH8. Dada la evidencia previa de la alta heredabilidad en TDAH, recientes estudios de genética molecular se han enfocado en la identificación de genes específicos asociados al TDAH. Inicialmente, estos estudios se han centrado principalmente en genes involucrados en la neurotransmisión, específicamente en la vía dopaminérgica9,10. El gen del transportador de dopamina DAT1 (dopamine active transporter o SLC6A3) es uno de los asociados a TDAH y, por lo tanto, blanco de múltiples investigaciones11–14. El DAT1 se ubica en el cromosoma 5 (5p15) y es importante en la regulación de la neurotransmisión dopaminérgica, pues modula la recaptación de la dopamina por el terminal presinapáico. A pesar de que diferentes polimorfismos en DAT1 o próximos muestran asociación con el TDAH o trastornos similares15,16, el polimorfismo más estudiado es una variación de número de repeticiones en tándem (variable number tandem repeat [VNTR]) de 40 nucleótidos localizado en la región no traducida 3′ (3′UTR) del gen17. Los alelos de 10 repeticiones (10R) y 9 repeticiones (9R) son los más comunes, con frecuencias del 71,9 y el 23,4% respectivamente18,19.
Además, genes involucrados en la vía serotoninérgica también están asociados al TDAH. El gen transportador de serotonina (SERT, SLC6A4), ubicado en el brazo largo del cromosoma 17, es uno de los más estudiados. Este gen codifica para una proteína integral de membrana, la cual transporta la serotonina desde el espacio sináptico a las neuronas presinápticas20,21, de modo que es un mecanismo importante para la regulación de la actividad serotoninérgica en el cerebro. El polimorfismo 5HTTLPR (serotonin-transporter-linked polymorphic region) se ha estudiado con el propósito de determinar su asociación con la depresión y trastornos similares22, así como con el TDAH23,24. El 5HTTLPR es un polimorfismo de inserción/deleción de 44 pb en la región promotora del gen SERT, el cual está asociado con cambios en los niveles de transcripción de ARN mensajero y las concentraciones de la proteína25. El alelo largo (L) consiste en 16 repeticiones y el alelo corto (S), en 1426. La variante homocigota del alelo L se relaciona con el incremento de la actividad transcripcional del promotor de 5HTTLPR, lo que incrementa la expresión de SERT y la recaptación de serotonina en relación con la variante S25.
Por otro lado, el gen del factor neurotrófico derivado del cerebro (BDNF), ubicado en el cromosoma 11 (11p13)27, pertenece a la familia de proteínas denominadas neurotrofinas y está involucrado en diferentes mecanismos como la supervivencia neuronal en el sistema nervioso central y la plasticidad sináptica28,29. Diferentes estudios han identificado y relacionado una sustitución animoacídica de valina por metionina (Val66Met) en el codón 66 del gen BDNF, la cual puede influir en el tráfico intracelular y la secreción de BDNF en el cerebro30,31. En cuanto al TDAH, el alelo G o Val se considera de riesgo30,32.
Finalmente, el gen catecol-o-metiltrasferasa (COMT), localizado en el cromosoma 22 (22q11)33, codifica para una enzima encargada de catalizar la transferencia de un grupo metilo de la S-adenosilmetionina a las catecolaminas, incluyendo neurotransmisores de dopamina, epinefrina y norepinefrina34. La mayoría de los estudios realizados con el objetivo de determinar una asociación ente COMT y TDAH se han enfocado en el análisis del polimorfismo rs4680, el cual produce una sustitución de valina a metionina en el codón 158 (Val158Met) ubicado en el exón 4 de COMT35. Este polimorfismo se relaciona con la variación en la actividad de la enzima COMT, donde los homocigotos para Met muestran una reducción de 3-4 veces la actividad enzimática en comparación con los homocigotos Val35.
Recientemente se han realizado estudios con el objetivo de determinar la contribución de polimorfismos localizados en diferentes genes en el desarrollo del TDHA en la población colombiana36–38. En el presente estudio, se analizaron los polimorfismos más comunes de los genes DAT1, SERT, COMT y BDNF con el objetivo de determinar su posible asociación con el TDAH en un contexto familiar en una muestra de la población de Bogotá.
MétodosParticipantesNiños (83,01%) y niñas (16,99%), con edad promedio de 10 años, que asistieron a consulta en el Hospital Pediátrico de la Misericordia. El diagnóstico claramente establecido por un psiquiatra de niños y adolescentes de acuerdo con los criterios de TDAH del DSM-IV-TR. La muestra de sangre de pacientes y familiares se tomó previo consentimiento informado y con la aprobación del Comité de Ética de la Facultad de Medicina de la Universidad Nacional de Colombia. Los niños dieron su asentimiento para que sus datos se incluyeran en este estudio. La muestra total fue de 97 familias conformadas por padre, madre e hijo afectado (291 individuos).
GenotipificaciónLas muestras de sangre de pacientes y controles se procesaron mediante el método de salting out39. La reacción en cadena de la polimerasa (PCR) se empleó para la identificación de variaciones en el número de copias (VNTR) de los polimorfismos 5HTTLPR y DAT1. La asignación de los genotipos se realizó por medio de geles de agarosa al 1,5% teñidos con SYBR® Safe DNA Gel y posteriormente se visualizaron con luz ultravioleta. Para los polimorfismos de nucleótido simple (SNP) de los genes BDNF (rs6265) y COMT (rs4680), además de PCR convencional se realizó la metodología de polimorfismos de longitud de fragmentos de restricción (RFLP) usando la enzima de restricción Hin1ll (NlaIII). Los resultados se analizaron en geles de agarosa al 2,5%, teñidos con SYBR® Safe DNA Gel y se visualizaron con luz ultravioleta.
Análisis estadísticoLos diferentes alelos y genotipos obtenidos de cada individuo estudiado se dispusieron en formato estándar PED y MAP para su posterior análisis con el software PLINK40. El equilibro de Hardy-Weinberg (HWE) se determinó usando un test ×2. La odds ratio (OR) de las diferentes variantes se calculó usando el test de desequilibrio de trasmisión (TDT), con un intervalo de confianza del 95% (IC95%) y significación estadística si p < 0,05.
ResultadosCaracterísticas clínicasEn total se evaluaron 97 tríos procedentes en su mayoría de la ciudad de Bogotá (92,45%). La media de edad de los niños era 10,17 años. El 83,01% eran varones. En cuanto al nivel de escolaridad, el 62% de los niños analizados se encontraban en primaria; el 39%, en secundaria y el 4%, en preescolar. La mayoría de los niños estudiados pertenecían a los estratos 3 (48%) y 2 (36%), seguidos de los estratos 4 (12%) y 1 (8%).
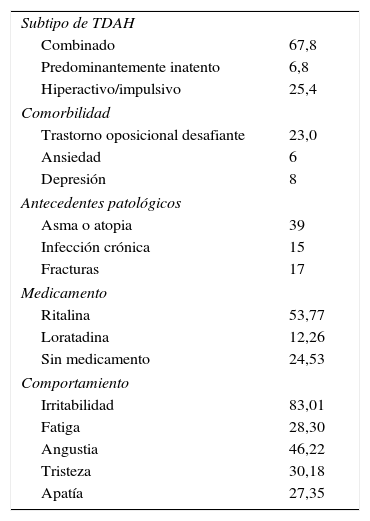
La tabla 1 muestra las características clínicas de la población estudiada. Todos los porcentajes se obtuvieron a partir de la historia clínica y la observación durante las consultas. De los subtipos del TDAH observados en nuestra muestra, el combinado tenía la mayor frecuencia (67,8%), seguido del hiperactivo/impulsivo (25,4%) y el inatento (6,8%). La mayor comorbilidad acompañante del TDAH encontrada en la muestra fue el trastorno oposicional desafiante (23%). Los antecedentes patológicos más frecuentes son asma o atopia (39%), infección crónica (15%) y fracturas (17%). La mayoría de los niños del estudio estaban medicados con metilfenidato (Ritalina®) (53,77%) como tratamiento para el TDAH o loratadina (12,26%) para las alergias.
Características clínicas de la población estudiada
| Subtipo de TDAH | |
| Combinado | 67,8 |
| Predominantemente inatento | 6,8 |
| Hiperactivo/impulsivo | 25,4 |
| Comorbilidad | |
| Trastorno oposicional desafiante | 23,0 |
| Ansiedad | 6 |
| Depresión | 8 |
| Antecedentes patológicos | |
| Asma o atopia | 39 |
| Infección crónica | 15 |
| Fracturas | 17 |
| Medicamento | |
| Ritalina | 53,77 |
| Loratadina | 12,26 |
| Sin medicamento | 24,53 |
| Comportamiento | |
| Irritabilidad | 83,01 |
| Fatiga | 28,30 |
| Angustia | 46,22 |
| Tristeza | 30,18 |
| Apatía | 27,35 |
TDAH: trastorno por déficit de atención e hiperactividad.
Los valores expresan porcentajes.
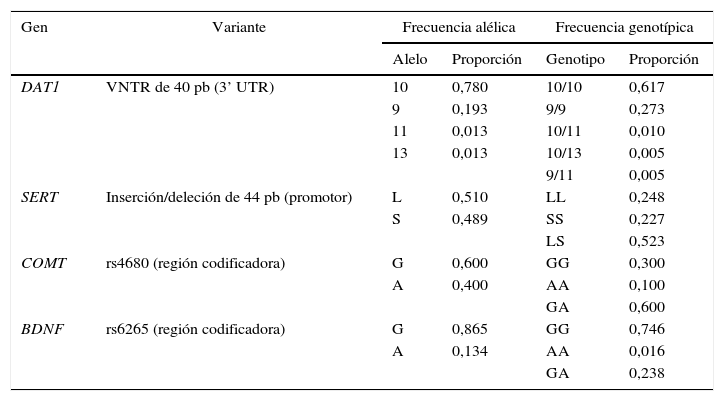
Las frecuencias alélicas y genotípicas de las variantes analizadas se muestran en la tabla 2. Para el VNTR del gen DAT1, se identificaron cuatro alelos, pero los alelos de 10 y 9 repeticiones fueron los más frecuentes. En el caso del polimorfismo de inserción/deleción de 44 pb en la región promotora del SERT, únicamente los alelos L y S se observaron en frecuencias similares. De los dos alelos identificados en los genes COMT y BDNF, el G presenta mayor frecuencia en ambos casos. Todos los polimorfismos estudiados se encuentran en equilibrio de Hardy-Weinberg.
Frecuencias alélicas y genotípicas
| Gen | Variante | Frecuencia alélica | Frecuencia genotípica | ||
|---|---|---|---|---|---|
| Alelo | Proporción | Genotipo | Proporción | ||
| DAT1 | VNTR de 40 pb (3’ UTR) | 10 | 0,780 | 10/10 | 0,617 |
| 9 | 0,193 | 9/9 | 0,273 | ||
| 11 | 0,013 | 10/11 | 0,010 | ||
| 13 | 0,013 | 10/13 | 0,005 | ||
| 9/11 | 0,005 | ||||
| SERT | Inserción/deleción de 44 pb (promotor) | L | 0,510 | LL | 0,248 |
| S | 0,489 | SS | 0,227 | ||
| LS | 0,523 | ||||
| COMT | rs4680 (región codificadora) | G | 0,600 | GG | 0,300 |
| A | 0,400 | AA | 0,100 | ||
| GA | 0,600 | ||||
| BDNF | rs6265 (región codificadora) | G | 0,865 | GG | 0,746 |
| A | 0,134 | AA | 0,016 | ||
| GA | 0,238 | ||||
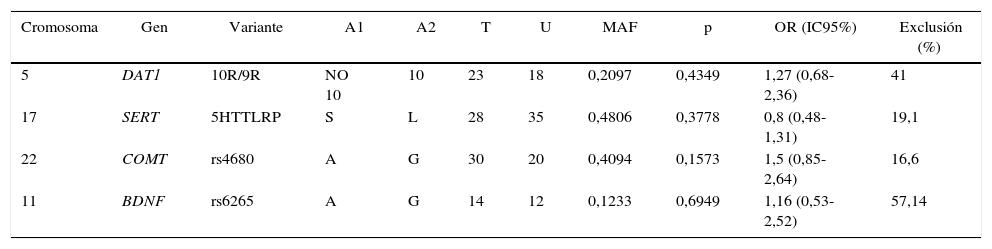
El TDT implementado en el programa PILNK40 se empleó con el propósito de determinar la posible transmisión preferencial de alelos de las variantes en los genes SERT, DAT1, BDNF (rs6265) y COMT (rs4680) en los tríos de la población de Bogotá analizados (tabla 3). Los dos alelos más frecuentes de cada variante fueron los empleados para realizar los análisis. No se detectó una evidente transmisión preferencial de ninguno de los alelos de los padres heterocigotos a sus respectivos descendientes. Este resultado puede deberse al alto porcentaje de exclusión tanto de tríos homocigotos como de aquellos con uno de sus padres sin genotipificar, lo cual causa una reducción del tamaño de la muestra para el análisis de TDT (tabla 3). Sin embargo, para los polimorfismos de DAT1, COMT y BDNF, se observó OR > 1, pero sin significación estadística.
Test de desequilibrio de trasmision (TDT)
| Cromosoma | Gen | Variante | A1 | A2 | T | U | MAF | p | OR (IC95%) | Exclusión (%) |
|---|---|---|---|---|---|---|---|---|---|---|
| 5 | DAT1 | 10R/9R | NO 10 | 10 | 23 | 18 | 0,2097 | 0,4349 | 1,27 (0,68-2,36) | 41 |
| 17 | SERT | 5HTTLRP | S | L | 28 | 35 | 0,4806 | 0,3778 | 0,8 (0,48-1,31) | 19,1 |
| 22 | COMT | rs4680 | A | G | 30 | 20 | 0,4094 | 0,1573 | 1,5 (0,85-2,64) | 16,6 |
| 11 | BDNF | rs6265 | A | G | 14 | 12 | 0,1233 | 0,6949 | 1,16 (0,53-2,52) | 57,14 |
A1: alelo de menor frecuencia; A2: alelo de mayor frecuencia; IC95%: intervalo de confianza del 95%; MAF: frecuencia del alelo menor; OR: odds ratio; T: transmisión de alelo de menor frecuencia; U: sin transmisión del alelo de menor frecuencia.
El presente estudio se basó en 97 tríos, en los que la edad de los hijos afectados variaba entre los 6 y los 17 años. Otro estudio previo en población colombiana identificó que la mayor prevalencia de la enfermedad se encuentra entre los 12 y los 17 años (36,9%), seguida de la de los grupos de 4-5 años (33,1%) y 6-11 años (30%)5. Por otro lado, la relación varones:mujeres detectada concuerda con la de estudios en otras poblaciones, con relaciones de 6:1 a 12:1 en muestras clínicas y 3:1 en muestras poblacionales41. Además, nuestros resultados son similares a los obtenidos en estudios previos en población colombiana, en los que el sexo masculino se comportó como factor de riesgo de diagnóstico de TDAH4. La mayor prevalencia de este trastorno se observó en niños de primaria con estratos socioeconómicos bajos, al igual que lo hallado en otros estudios5,42. Los factores relacionados con la procedencia socioeconómica y cultural probablemente impliquen una serie de carencias para el adecuado desarrollo de las habilidades de los niños, como la capacidad de centrar la atención42.
En cuanto a los factores genéticos, diversos estudios realizados en los últimos años han puesto en evidencia la importancia de diferentes variantes génicas en el desarrollo del TDAH43,44. Estos estudios han permitido identificar polimorfismos (SNP y VNTR) localizados en la región codificadora y reguladora de genes candidatos, ubicados principalmente en las vías dopaminérgica y serotoninérgica, que se asocian con este trastorno9,12,17,23,24. En el presente estudio se analizaron los polimorfismos más comunes de los genes DAT1, SERT, COMT y BDNF con el objetivo de determinar la posible asociación de estos polimorfismos con el TDAH en un contexto familiar en población de Bogotá. Los resultados obtenidos por medio del TDT indican que ninguna de las variantes genéticas analizadas presentaba una transmisión preferencial de padres a hijo de ninguno de los alelos. Se han descrito resultados similares en otras poblaciones, donde se evidencia la asociación no significativa entre estas variantes y el TDAH. En el caso del gen COMT, análisis dirigidos al polimorfismo val/met (rs4680) en el exón 445,46 y otras variantes15,47 han reportado resultados negativos de asociación con el TDAH. No obstante, la variante Val158Met se ha asociado con la buena respuesta del metilfenidato (MPH) para los síntomas de hiperactividad e impulsividad en niños48. También hay evidencia de una reducción de los síntomas con metilfenidato, hasta en un 62,5% con el genotipo val/val, respecto a otros genotipos después de 8 semanas de tratamiento49. Por otro lado, a pesar de que se ha demostrado que la concentración plasmática de BDNF se asocia con la gravedad de los síntomas de falta de atención50, no se ha podido replicar la asociación detectada entre el polimorfismo rs6265 de BDNF y el TDAH observada previamente44, al igual que en nuestro estudio. Para el gen DAT1, los análisis enfocados en el VNTR ubicado en la región 3′UTR y otras variantes indican un patrón heterogéneo11,13,14. Además, la baja razón de probabilidad reportada (OR = 1,10) en un metanálisis de la variante 3′UTR VNTR indica un efecto relativamente pequeño de este VNTR44. A pesar de la asociación no significativa detectada en nuestro estudio, la OR = 1,27 es muy similar al obtenido en estudios previos realizados por Gizer et al. en 200944, lo que contribuye a la heterogeneidad reportada entre esta variante y el TDAH. De modo similar, hay evidencia de la asociación significativa entre el polimorfismo 5HTTLPR del gen SERT y el TDAH23,51, mientras que otros no han podido reproducir dicha asociación24,52. Los resultados obtenidos en el presente estudio de la falta de asociación con la variante 5HTTLPR también contribuyen a la discrepancia reportada.
Nuestros hallazgos y los obtenidos en estudios previos de asociación de las variantes analizadas de los genes DAT1, SERT, COMT y BDNF y el TDAH indican que la etiología de este trastorno es compleja y no depende de un único factor genético o ambiental. Futuros estudios centrados en otras variantes genéticas candidatas de estos y otros genes involucrados en neurotransmisión y/o funciones similares —como DRD4, DRD5, HTR1B, SNAP-25, LPHN3 y NOS153—, en combinación con análisis clínicos más robustos y una muestra poblacional más grande, podrán contribuir a una mejor compresión del TDAH en la población colombiana.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
FinanciaciónEste trabajo fue financiado por la Fundación para la Promoción de la Investigación y la Tecnología (FPIT) del Banco de la República de Colombia, el Departamento Administrativo de Ciencia, Tecnología e Innovación (COLCIENCIAS) código 110165745043 y la Facultad de Medicina de la Universidad Nacional de Colombia, por medio de una estancia posdoctoral corta a C.E. Arboleda-Bustos (Código: 30041).
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses.