La enfermedad intersticial pulmonar es una complicación importante en las enfermedades autoinmunes. La extensión del compromiso es fundamental para determinar el inicio y la respuesta al tratamiento. Existen métodos computarizados poco disponibles para este cálculo, por lo cual suelen ser más empleados métodos manuales como el de Goh. Sin embargo, este tiene problemas, como el presumir que las áreas en todo el pulmón son equivalentes e influyen igualitariamente en el cálculo. El objetivo del estudio es corroborar estas dificultades y hallar una forma de corrección matemática.
Materiales y métodosSe obtuvieron imágenes de tomografía de tórax de alta resolución de pacientes con y sin enfermedad pulmonar intersticial difusa (EPID). Se analizaron y compararon las áreas pulmonares en los cortes referidos en el método de Goh. Se buscó, mediante un análisis geométrico de la estructura pulmonar, el corte pulmonar más cercano al promedio de sus áreas, sobre el cual se compararon las otras mediciones. Con base en ello, se formuló una ecuación de corrección, en tanto que el grado de variación se determinó mediante una simulación de diferentes patrones de compromiso intersticial.
ResultadosSe analizaron las imágenes de 80 pacientes, la mayoría mujeres con diagnóstico de esclerosis sistémica. Se encontró que las áreas apicales (cortes 1 y 2) y la sumatoria de las áreas pulmonares del lado izquierdo eran 20% más pequeñas en comparación con las áreas basales y derechas, respectivamente. La simulación con diferentes componentes de compromiso encontró que la enfermedad apical o izquierda sobreestima la extensión entre 5 y 10%, más aún cuando supera el 15%. Se determinó que el tercer corte era el más cercano al promedio de las áreas y a partir de este se fabricó una fórmula de corrección.
ConclusionesEl método de Goh asume de manera errónea la equivalencia de las áreas pulmonares, lo que puede afectar el cálculo. Proponemos una corrección matemática para tal fin.
Interstitial lung disease is a significant complication in autoimmune diseases. The extent of involvement is crucial in determining both onset and treatment response. While there are computational methods for this calculation, manual methods, such as the Goh method, remain the most commonly used. However, it has some disadvantages, such as presuming that areas across the lung are equivalent and thus influence the calculation equally. The aim of this study is to analyse these difficulties and find a mathematical correction method.
Materials and MethodsHigh-resolution chest tomography images were obtained from patients with and without ILD. Pulmonary areas were analysed and compared in the slices referenced in the Goh method. Through geometric analysis of lung structure, the slice closest to the average of its areas was identified for comparison with other measurements. Based on this, a correction equation was formulated, and through simulation of various interstitial involvement patterns, the degree of variation was determined.
ResultsImages from 80 patients were analysed, mostly women diagnosed with systemic sclerosis. It was found that apical areas (slices 1 and 2) and the sum of left-sided pulmonary areas were 20% smaller compared to basal and right-sided areas, respectively. Simulation with different involvement components found that apical or left-sided disease overestimates extension by 5% to 10%, especially when it exceeds 15%. The third slice was determined to be closest to the average of the areas, and a correction formula was devised based on this.
ConclusionsThe Goh method incorrectly assumes the equivalence of pulmonary areas, which can impact calculations. We propose a mathematical correction for this purpose.
La enfermedad pulmonar intersticial es una de las principales complicaciones de las enfermedades autoinmunes, con un aumento en la morbilidad y la mortalidad, siendo uno de los factores de peor pronóstico1. La incidencia varía dependiendo de la enfermedad, desde un 45% en esclerosis sistémica (con mayor incidencia en variedad difusa) hasta un 2 a 5% en lupus eritematoso sistémico1.
La tomografía de tórax es la principal herramienta de diagnóstico y detección temprana, dado el bajo rendimiento de otros estudios como la radiografía de tórax2, o las pruebas de función pulmonar que se encuentran anormales en estadios más avanzados de la enfermedad. Por tal razón, es el estudio de elección según guías internacionales y recomendaciones de expertos.
Aparte de su papel diagnóstico, la tomografía ha cobrado importancia al ser posible cuantificar la extensión de la enfermedad, reconocida como un factor pronóstico que influye en la toma de decisiones dirigidas al inicio del tratamiento, o al definir si existe falla en caso de que se establezca un aumento del área pulmonar comprometida3. Esto ha sido particularmente útil para entidades como la esclerosis sistémica, la artritis reumatoide4 o miopatías inflamatorias5 y, adicionalmente, como criterio de la variante fibrosante progresiva en enfermedad pulmonar intersticial difusa (EPID)6, que conlleva un mayor riesgo de mortalidad a estos pacientes e implicaciones terapéuticas especiales.
Existen varias maneras de cuantificar la extensión de la enfermedad pulmonar intersticial, con base en métodos computacionales o manuales realizados por los médicos, los cuales han sido comparados con buena correlación6. Sin embargo, estos últimos son los más difundidos y recomendados, teniendo en cuenta su fácil implementación y el ahorro de costos.
El método de Goh, propuesto en 20087, es un sistema de cuantificación de la extensión que se lleva a cabo de manera manual por parte del médico (generalmente reumatólogo, neumólogo o radiólogo). Este método requiere algún grado de entrenamiento en la visualización de imágenes del tórax con esta patología, mediante la obtención de cortes específicos (cinco en total desde los ápices hasta las bases), y el cálculo de la extensión de algunas anormalidades en cada uno, para la obtención de un promedio final. Esto permite, asimismo, sobre todo en pacientes con esclerosis sistémica, estratificar de manera simple a los pacientes en dos grupos (alto riesgo y bajo riesgo) de mortalidad, de acuerdo con la extensión medida manualmente en cinco cortes de tomografía de alta resolución, tomando como límite el 20% de la extensión, que para esta patología demostró ser un factor predictor de mortalidad7.
Este método ha sido empleado y recomendado para su uso rutinario, especialmente en pacientes con esclerodermia, a efectos de definir el requerimiento de tratamiento inmunosupresor3, en conjunto con las pruebas de función pulmonar, sin embargo, se ha usado en otras patologías como la artritis reumatoide8,9 y la miopatía inflamatoria10.
Si bien el método de Goh ha sido una herramienta muy útil en la práctica clínica y en ensayos clínicos7, presenta problemas, entre los que se encuentra el considerar iguales las áreas pulmonares de los cortes basales y apicales, así como las áreas derechas e izquierdas. Por tanto, para el cálculo final es equivalente tener un porcentaje de los ápices comprometidos o de las bases, lo cual supone un error dado que las áreas no son homogéneas a través del pulmón. Estas sobreestimaciones o subestimaciones, según sea el caso, pueden influir en las decisiones terapéuticas.
Consideramos que, ante lo mencionado, es posible hacer algunas correcciones a este cálculo. El objetivo de este estudio fue determinar las diferencias entre las áreas pulmonares, de los cortes usados por el método de Goh, y mediante el análisis de estas diferencias obtener un método de corrección según se determine cuáles son mayores o menores.
MétodosSujetosSe obtuvieron datos de pacientes adultos que asistían a una consulta externa de reumatología, con diagnóstico de enfermedad autoinmune determinado por médico reumatólogo, durante el periodo de un año, a quienes se realizó previamente una tomografía de tórax de alta resolución para el estudio de enfermedad pulmonar intersticial, y por tanto sin tratamiento para tal fin, asociada a su patología autoinmune, o por cualquier otra razón. Fueron excluidos quienes tenían causas de alteración de la arquitectura pulmonar, como antecedente de trauma intratorácico, cirugía cardiaca o torácica, pacientes con derrames pleurales o pericárdicos, atelectasias, neumotórax o neumomediastino, alteraciones diafragmáticas, hernias diafragmáticas, alteraciones congénitas de la anatomía torácica, en estudio de masas mediastinales o pulmonares, y tomografías de mala calidad que no permitieran una adecuada valoración por no cumplir los requisitos técnicos o por determinación propia del experto.
ObjetivosEl objetivo principal fue determinar las diferencias en la medición de las áreas pulmonares en los distintos cortes usados por el método de Goh y, a partir del análisis de las diferencias, obtener un método de corrección. El objetivo secundario fue determinar si existe relación entre algunas variables clínicas de los pacientes, como el antecedente de fumador, la enfermedad pulmonar obstructiva crónica (EPOC), el sexo y la edad, y las áreas pulmonares.
Imágenes y cálculo de áreasSe obtuvieron imágenes de tomografía de tórax de alta resolución que cumplieran con los requisitos técnicos suficientes para su análisis, como grosor de corte de 0,5-1mm, posición supina y tiempo de rotación de 300-500 mseg sin contraste. No se consideró que el equipo de toma de imágenes influyera en el cálculo de las áreas, pero sí que estas deben ser en inspiración máxima.
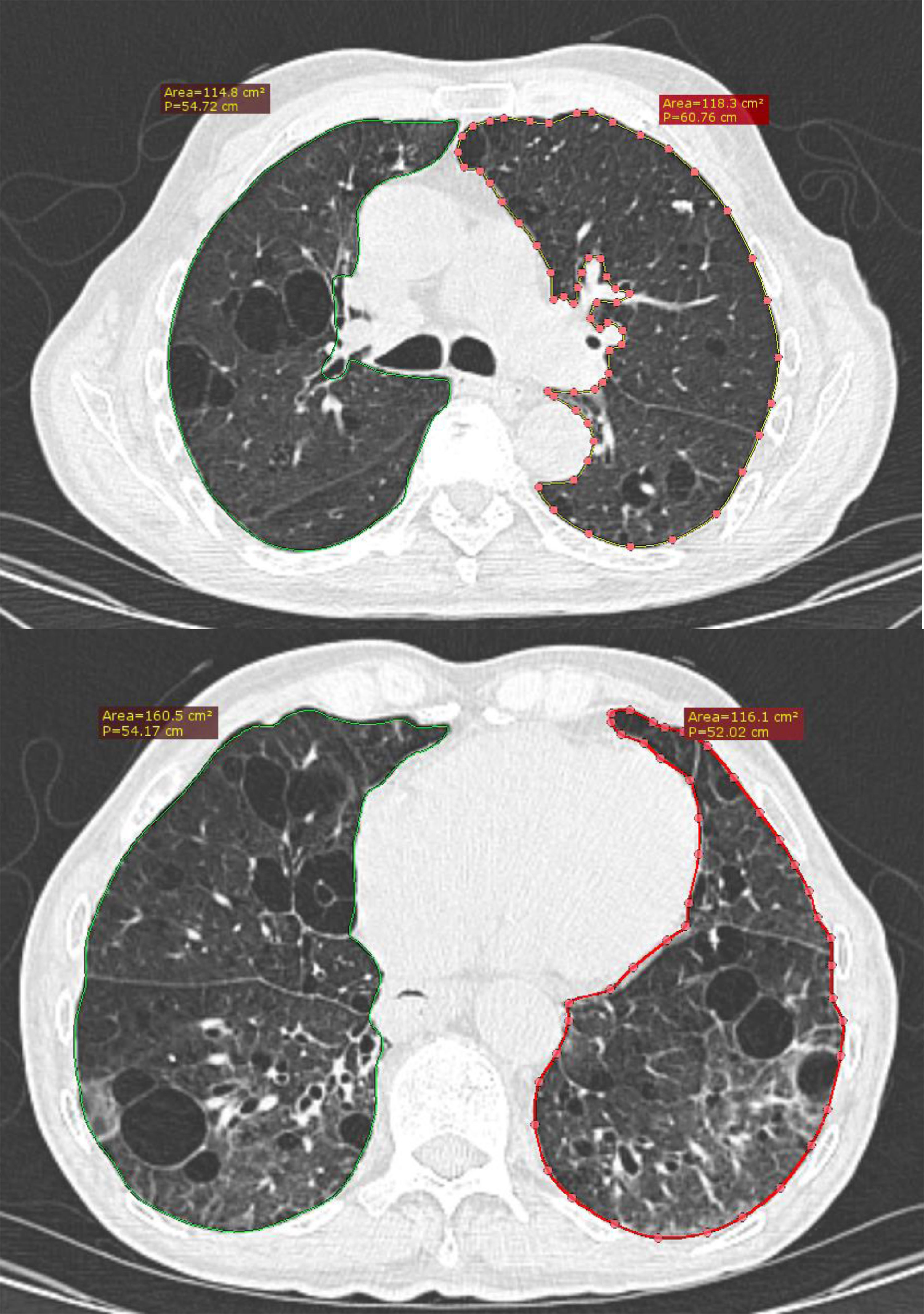
Se extrajeron los cinco cortes necesarios para la cuantificación de la extensión de la enfermedad descritos por Goh: 1) salida de los grandes vasos, 2) nivel de la carina, 3) confluencia de las venas pulmonares, 4) en la mitad entre el 3 y el 5, y 5) inmediatamente superior al hemidiafragma derecho11. En cada punto se llevó a cabo la medición del área pulmonar por el reborde pleural, exceptuando la silueta cardiaca, los grandes vasos arteriales, los venosos y la vía aérea de gran tamaño como bronquios fuente. Los valores se determinaron en centímetros cuadrados.
De acuerdo con imágenes de la tomografía, se estimó el índice cardiotorácico según el diámetro torácico total, en las bases por encima de los diafragmas, y la distancia cardiaca entre la aurícula derecha en su punto más derecho y el ápex cardiaco. La revisión de imágenes y la extracción de cortes fue llevada a cabo por médico con entrenamiento por más de dos años en enfermedad pulmonar intersticial.
Determinación del punto medioPara el desarrollo del objetivo principal, es necesario determinar el punto sobre el cual se realizará la comparación del resto de los cortes de tomografía. Para ello, en primer lugar, se analizó, con base en el estudio geométrico, el punto sobre el cual la estructura pulmonar, extrapolada a un cono por su similitud, pudiera ser dividida en dos partes iguales de volumen, mediante la medición de los radios inferiores, superiores y la altura pulmonar. Al obtener tal nivel, este sería tomado como el punto de referencia inicial, donde el área pulmonar es la más cercana al promedio, y sobre el cual, en segundo lugar, se compararon cada una de las áreas pulmonares obtenidas de los cortes del método de Goh para conocer cuál sería las más cercana. En tercer lugar, ya reconocido cuál área pulmonar (cinco de pulmones derechos y cinco de izquierdos) es la más cercana al promedio, se hizo la comparación y el ajuste mediante una fórmula matemática que ponderara cada uno de los cortes. Este análisis se llevó a cabo en un menor número de estudios y según los resultados se extrapoló al resto de la población de estudio.
Análisis estadísticoLas variables cualitativas se describieron como medias con sus desviaciones estándar (DE), o medianas con su rango intercuartílico (RIC), según su naturaleza normal o no, respectivamente, y las variables categóricas con sus frecuencias relativas y absolutas. De acuerdo con la naturaleza de las variables para determinación de la relación con las áreas, se usaron las pruebas estadísticas de Mantel Haenszel o regresión lineal.
Para la determinación del objetivo primario, se calcularon los promedios de las áreas en cada corte, y con base en la comparación con el punto medio se ajustó cada uno para determinar una ecuación final de corrección. Posteriormente, se hizo una simulación a partir de diferentes posibilidades de compromiso pulmonar en distintos segmentos o regiones, fueran basales, apicales, derechas o izquierdas, para determinar las variaciones entre las cuantificaciones de extensiones calculadas, con el método de Goh y con la corrección mediante el uso del programa STATA 17.
Consideraciones éticasEl presente estudio cumple con los requerimientos estipulados por la legislación colombiana y tiene aval de comité de ética. Los datos obtenidos y las imágenes usadas tienen consentimiento informado por parte de los pacientes. Los datos fueron tratados de forma anónima y están solo a disposición de los investigadores.
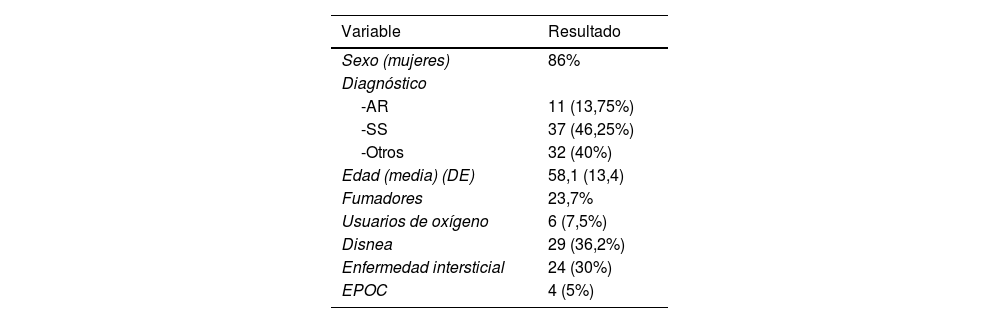
ResultadosSe analizaron las imágenes de 80 pacientes, la mayoría de ellos mujeres con diagnóstico de esclerosis sistémica, seguido de artritis reumatoide. El resto de los diagnósticos fueron agrupados debido a la baja frecuencia (lupus eritematoso sistémico, síndrome de Sjögren, enfermedad mixta del tejido conectivo, miopatías inflamatorias). De forma relevante, una tercera parte de los pacientes estudiados tenían enfermedad pulmonar intersticial, así como disnea, y casi un tercio también eran fumadores. La mayoría de los pacientes no eran sintomáticos para patología respiratoria y no se encontraron alteraciones pulmonares en las imágenes. Las características de los pacientes se encuentran en la tabla 1.
Descripción de la población
| Variable | Resultado |
|---|---|
| Sexo (mujeres) | 86% |
| Diagnóstico | |
| -AR | 11 (13,75%) |
| -SS | 37 (46,25%) |
| -Otros | 32 (40%) |
| Edad (media) (DE) | 58,1 (13,4) |
| Fumadores | 23,7% |
| Usuarios de oxígeno | 6 (7,5%) |
| Disnea | 29 (36,2%) |
| Enfermedad intersticial | 24 (30%) |
| EPOC | 4 (5%) |
AR: artritis reumatoide; SS: esclerosis sistémica; DE: desviación estándar; EPOC: enfermedad pulmonar obstructiva crónica.
Los cálculos de las áreas de cada corte en centímetros cuadrados fueron las siguientes: primero izquierdo (83,8 ± 24), primero derecho (80 ± 20,4), segundo derecho (116,5 ± 18,4), segundo izquierdo (105,5 ± 16,9), tercero derecho (127,4 ± 20), tercero izquierdo (101,7 ± 23,2), cuarto derecho (134,2 ± 22,4), cuarto izquierdo (98,5 ± 20,7), quinto derecho (142,3 ± 23,7) y quinto izquierdo (98,7 ± 22,4).
Con base en esto, encontramos que las áreas de las ventanas apicales consideradas la 1 y 2, tenían 20% menos área, en comparación con las basales 4 y 5. De la misma forma, la suma de las áreas derechas fue 20% mayor en comparación con las áreas izquierdas (fig. 1).
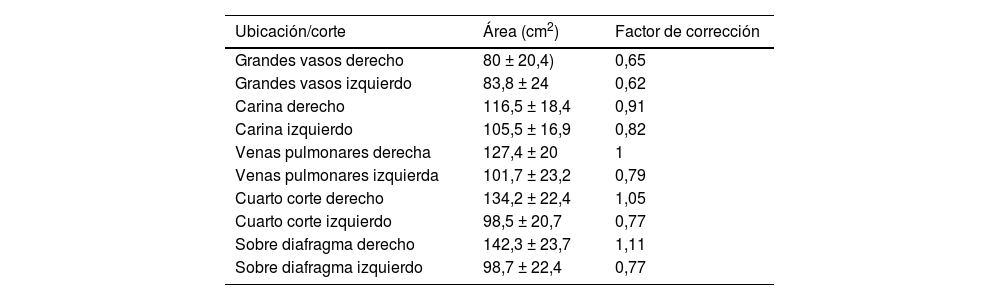
Con respecto a la búsqueda del punto de comparación necesario para el ajuste de la fórmula, se hizo un análisis de volumen en varias tomografías (20 estudios), extrapolando las mediciones pulmonares a un cono, como se mencionó previamente. De acuerdo con sus radios y alturas, se encontró que en todos estos estudios el tercer punto es el más cercano a la división en partes iguales del volumen de la estructura pulmonar, siendo el total entre 900 y 1.000 cm3, por lo que se extrapoló al resto. El volumen basal o inferior, partiendo la estructura desde el punto número 3, fue de 550 a 650 cm3, muy cercano a la mitad. Teniendo esto último en consideración, se desarrolló una ecuación para la corrección de las áreas según sus diferencias, con la referencia del tercer corte, y se obtuvo la siguiente: Área de extensión corregida = (corte 1 derecho *0,65) + (corte 1 izquierdo *0,62) + (corte 2 derecho *0,91) + (corte 2 izquierdo *0,82) + tercero derecho + (corte 3 izquierdo *0,79) + (corte 4 derecho *1,05) + (corte 4 izquierdo *0,77) + (corte 5 derecho * 1,11) + (corte 5 izquierdo *0,77)
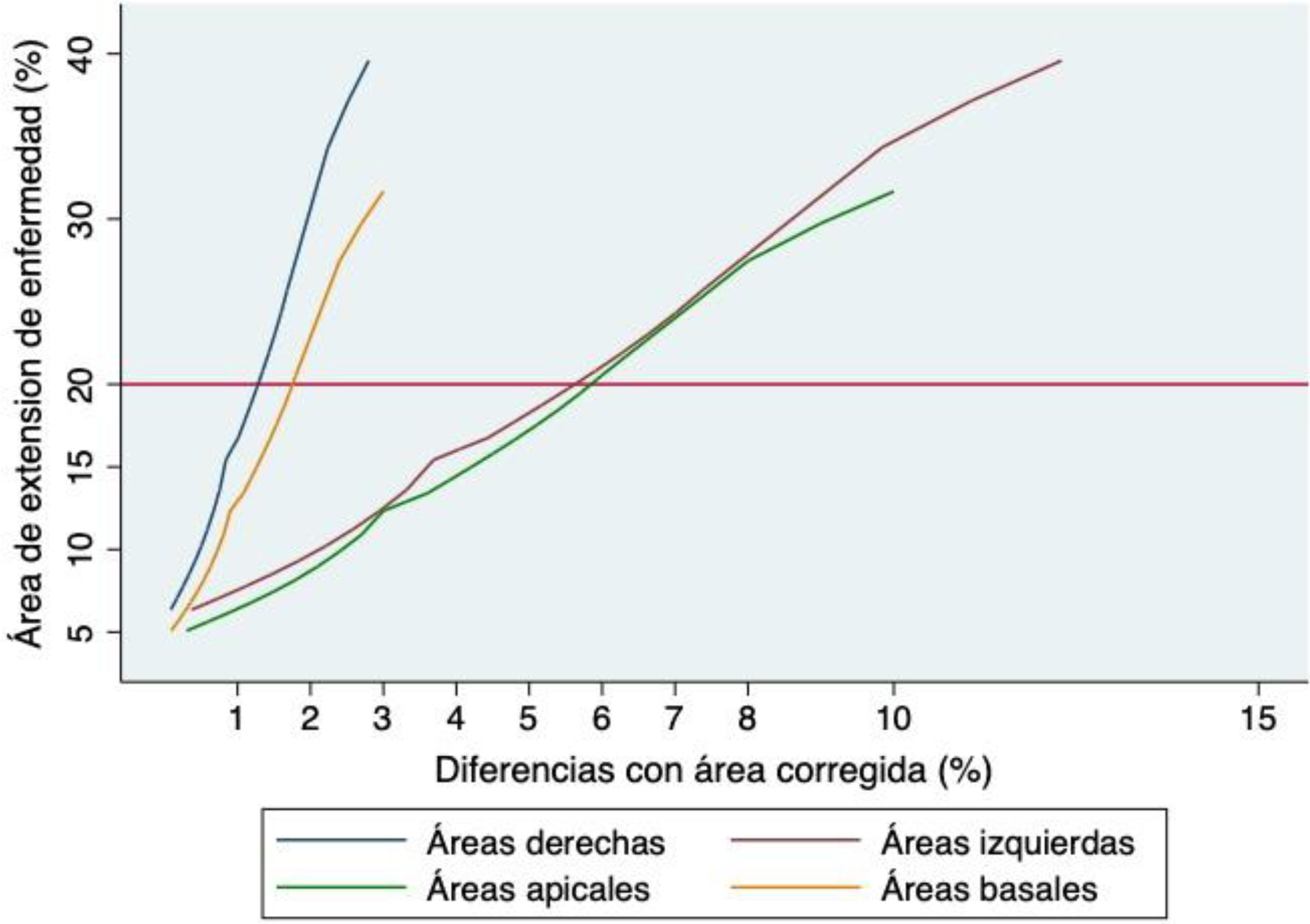
En la tabla 2 se resumen las áreas de cada uno y los factores de corrección. Se hicieron varias simulaciones del cálculo de la extensión, según si la enfermedad era predominantemente izquierda, derecha, apical por los cortes 1 y 2, o basal si era en los cortes 4 y 5. Los hallazgos se representan en la figura 2.
Áreas promedio de cada corte y su factor de corrección en comparación con la referencia
| Ubicación/corte | Área (cm2) | Factor de corrección |
|---|---|---|
| Grandes vasos derecho | 80 ± 20,4) | 0,65 |
| Grandes vasos izquierdo | 83,8 ± 24 | 0,62 |
| Carina derecho | 116,5 ± 18,4 | 0,91 |
| Carina izquierdo | 105,5 ± 16,9 | 0,82 |
| Venas pulmonares derecha | 127,4 ± 20 | 1 |
| Venas pulmonares izquierda | 101,7 ± 23,2 | 0,79 |
| Cuarto corte derecho | 134,2 ± 22,4 | 1,05 |
| Cuarto corte izquierdo | 98,5 ± 20,7 | 0,77 |
| Sobre diafragma derecho | 142,3 ± 23,7 | 1,11 |
| Sobre diafragma izquierdo | 98,7 ± 22,4 | 0,77 |
Evidenciamos que, sobre todo en los casos de enfermedad predominantemente izquierda o apical, existe una sobreestimación de la extensión, diferencia importante al corregir las áreas con la fórmula entre el 5 y 6% absoluto cuando la extensión es del 20%, que casi se duplica cuando el compromiso es cercano al 30%, a diferencia de cuando la enfermedad es predominantemente derecha o basal, caso en el cual la corrección es poca aun con grandes extensiones.
Adicionalmente, se analizó la relación de otras variables con las áreas pulmonares, y no se encontró asociación con el índice cardiotorácico, la edad o el diagnóstico de EPOC, de forma relevante. Sin embargo, encontramos una relación significativa según el sexo, siendo 20% mayor el área pulmonar en los hombres (p=0,004); el antecedente de fumador, con 10% más de área pulmonar que en los no fumadores (p=0,049); el diagnóstico de EPID, con 9% inferior el área pulmonar en comparación con aquellos en quienes no se encontraron alteraciones intersticiales (p=0,01); la talla (p<0,005) y el peso (p=0,001).
DiscusiónAunque se han desarrollado programas específicos para la cuantificación de la enfermedad intersticial, los cuales tienen la propiedad de delimitar las áreas afectadas y el tipo de afección, estos han sido comparados con los métodos manuales con buena correlación7.
Es claro que si bien existe un componente subjetivo en la valoración por métodos manuales que la harían menos exacta, pueden existir otras dificultades inherentes al sistema de puntuación. En este estudio evidenciamos otros inconvenientes del método descrito por Goh, como lo son una diferencia importante entre las áreas pulmonares de cortes superiores o inferiores, o derechos e izquierdos, de aproximadamente 20%, lo cual no está contemplado en el cálculo final. Con base en ello, desarrollamos una fórmula de corrección que pudiera ser de utilidad para subsanar estos problemas, y encontramos que, al corregir las áreas en relación con una referencia media, que en este caso sería el tercer punto, la cuantificación puede variar sustancialmente en áreas cercanas al 20%, pudiendo ser aún más pronunciado a mayores valores. Lo anterior, sobre todo cuando la enfermedad es predominantemente apical o de los campos pulmonares izquierdos, donde el cálculo convencional sobreestima la enfermedad, dado que considera estas áreas como equivalentes a sus opuestos, cuando en realidad son más pequeñas.
Esto impactaría de forma directa la toma de decisiones terapéuticas. Como sabemos por datos previos, una enfermedad mayor al 20% se ha relacionado con un aumento de la mortalidad7 y complicaciones, por tanto, es indicativo de inicio de medicación3, aun en ausencia de otras alteraciones, puntualmente en la función pulmonar, en el caso de pacientes con diagnóstico de esclerosis sistémica.
Asimismo, el método supondría que un aumento en la extensión de la enfermedad es más pronunciado cuando se valora en zonas basales o derechas donde las áreas son mayores, lo que quiere decir que no puede interpretarse de la misma forma un deterioro desde el punto de vista de la imagen cuando es derecho o basal, pues podrían ser más severos que lo que el cálculo aparenta.
De acuerdo con ello, consideramos que el uso de una fórmula de corrección de las áreas puede hacer el cálculo más exacto, evitando la sobreestimación de algunas distribuciones de enfermedades, lo cual afecta la toma de decisiones.
Con relación al estudio de factores que influyen en el área pulmonar, el índice cardiotorácico, el diagnóstico de EPOC o la edad no tuvieron relación, aunque fueron pocos pacientes. Sin embargo, el sexo, el estado de fumador y el diagnóstico de EPID sí tenían relación estadísticamente significativa. Aunque ello no interfiere por el momento en el cálculo de la extensión de la enfermedad por este método, se podría inferir que una extensión de enfermedad determinada puede tener mayor impacto que en otras, o puede ser motivo de investigación posterior.
Hallamos algunas limitaciones en el desarrollo del estudio, fundamentalmente en la puesta en funcionamiento de la fórmula de corrección en el ámbito clínico real, teniendo en cuenta que en una gran parte de los pacientes la enfermedad es simétrica y poco heterogénea, lo que hace que la corrección sea menor a la esperada. Además, esta sería más útil en pacientes con enfermedad extensa, la cual se presenta en una minoría. Sería importante estudiar su impacto en un grupo de pacientes con enfermedad intersticial pulmonar en la práctica clínica diaria, de lo cual no se ha dado cuenta hasta el momento en la literatura.
Concluimos que las diferencias encontradas entre las mediciones de las áreas en diferentes cortes por el método de Goh aportan una posible corrección matemática a este problema, y que este método puede ser relevante principalmente en enfermedad extensa apical izquierda cuando se sobreestima el cálculo.
Conflicto de interesesLos autores declaran que no tienen conflicto de intereses para el desarrollo del presente artículo.