En pacientes con lupus eritematoso sistémico (LES) y fiebre, las causas son infección o actividad. Se determinaron las propiedades de la proteína C reactiva (PCR) y de la velocidad de sedimentación globular (VSG) para discernir estas causas.
Materiales y métodosSe revisaron las historias clínicas de los pacientes con LES y fiebre hospitalizados durante el periodo 2010-2019. Con base en 2 categorías de causa de fiebre (infección c/s actividad versus actividad sola), se determinaron curvas ROC, áreas bajo la curva (ABC) y el mejor punto de corte para VSG, VSG parámetro, PCR y razón VSG/PCR. Además, se calculó la sensibilidad, la especificidad y los valores predictivos.
ResultadosSe incluyeron 40 casos (34 mujeres) con 35,5 años en promedio. La principal causa de fiebre fue la coexistencia de infección y actividad (17/40; 43%), seguida de fiebre solo por actividad (14/40; 35%). La infección más frecuente fue neumonía (10/40; 25%) y la actividad más común fue renal (21/40; 53%). Para diagnosticar «fiebre por infección con o sin actividad», comparado con «fiebre solo por actividad», la PCR tuvo un ABC: 0,86 (IC 95%: 0,75-0,97) con 5,4mg/dl como mejor punto de corte (S: 76,9%; E: 85,7%; VPP: 90,9; VPN: 66,6%). Para diagnosticar «fiebre solo por actividad», comparado con «fiebre por infección c/s actividad», la razón VSG/PCR tuvo ABC: 0,83 (IC 95%: 0,68-0,98), con 21,42 como mejor corte (S: 78,6%; E: 84,6%; VPP: 73,3%; VPN: 88,0%).
ConclusiónLa PCR y la razón VSG/PCR, que son pruebas de rutina en estos casos, son potencialmente útiles para discernir causas de fiebre en pacientes con LES. Estos hallazgos deben confirmarse en futuros estudios.
In patients with systemic lupus erythematosus (SLE) and fever, the causes are infection and/or activity. We assessed the diagnostic accuracy of C-reactive protein (CRP) and erythrocyte sedimentation rate (ESR) to discern these causes.
Materials and methodsWe reviewed medical records of patients with SLE and fever hospitalized from 2010-2019. Based on two categories of cause of fever (infection with-or-without activity versus activity alone), we computed ROC curves, areas under the curve (AUC) and best cut-off values for ESR, parameter ESR, CRP and ESR/CRP ratio. In addition, we calculated sensitivity, specificity, and predictive values.
ResultsWe included 40 cases (34 women) with an average age of 35.5 years. The main cause of fever was the coexistence of infection and activity (17/40; 43%), followed by fever only due to activity (14/40; 35%). The most frequent infection was pneumonia (10/40; 25%) and the most common activity was renal (21/40; 53%). To diagnose”fever due to infection with-or-without activity”, compared to “fever only due to activity”, CRP had an AUC: .86 (95% CI: .75-.97) with 5.4mg/dl as the best cut-off value (Se: 76.9%; Sp: 85.7%; PPV: 90.9; NPV: 66.6%). To diagnose “fever due to activity only”, compared to “fever due to infection with or without activity”, the ESR/CRP ratio had an AUC: .83 (95% CI: .68-.98) with 21.42 as the best cut-off value (Se: 78.6%; Sp: 84.6%; PPV: 73.3%; NPV: 88.0%).
ConclusionCRP and ESR/CRP ratio, which are routine tests in these cases, are potentially useful in discerning causes of fever in SLE patients. These findings should be confirmed in future studies.
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune de compromiso multiorgánico y curso crónico1. En el Perú se estima que existían aproximadamente 50 casos por cada 100.000 habitantes para el año 20092. Su fisiopatología se caracteriza por la muerte celular y la expresión del material genético que estimula al linfocito B y a las células dendríticas, lo que conlleva la formación de autoanticuerpos y citoquinas y la eventual pérdida de la autotolerancia3, siendo la interleucina 6 (IL-6) la que complementa el daño tisular4. Junto con la IL-6, se presenta la interleucina 1β (IL-1β) y el factor de necrosis tumoral (FNT), los cuales estimulan la producción hepática de la proteína C reactiva (PCR)5. Además, durante el proceso inflamatorio hay aumento de proteínas plasmáticas (inmunoglobulinas, fibrinógeno y alfa globulina), las cuales elevan la velocidad de sedimentación globular (VSG)6. Tanto la PCR como la VSG son reactantes de fase aguda (RFA) presentes en esta y otras enfermedades, incluyendo también procesos infecciosos.
Durante la fiebre por actividad lúpica existe un mayor aumento de la VSG que de la PCR, y durante la fiebre por infección el aumento de la PCR es superior al de la VSG7, lo que se explica por la supresión directa de la PCR por el interferón alfa8, por la disminución de producción de la PCR por los hepatocitos9, por los anticuerpos anti-PCR10 y por los polimorfismos de la PCR relacionados con el LES11. Algunos estudios han empleado los valores de la PCR y la VSG para diferenciar los procesos infecciosos de los inflamatorios en pacientes con LES. En un estudio realizado en los Países Bajos en 1990 se reportó que la PCR mayor a 6mg/dl durante la actividad del LES sin serositis asociada, era indicativa de infección en todos los casos (2 años de seguimiento de 71 pacientes con LES)12. Otro estudio, llevado a cabo en Los Ángeles, California en el año 2011, demostró que una PCR mayor a 6mg/dl era también indicativa de infección, con una especificidad del 84% y sensibilidad del 55%13, mientras que, en un estudio realizado en Michigan en el año 2018, la razón de VSG/PCR menor o igual a 2 estuvo asociada con infección, y la mayor o igual a 15 con actividad14. En cuanto a la actividad, en el año 2018 se reportó en Alemania que un VSG parámetro (VSGp) mayor o igual a 2 tiene una especificidad del 85% para detectar actividad de enfermedad15, usando la fórmula VSG/(edad/2) para los varones y VSG/([edad+10]/2) para las mujeres.
Hasta el momento, en el Perú no se han encontrado evidencias documentadas o un estudio con diseño metodológico orientado a valorar el uso de PCR y VSG para diferenciar infección versus actividad en pacientes con LES y fiebre. Es relevante estudiar esto en la población peruana, por los polimorfismos genéticos existentes que pueden traducirse en manifestaciones de los RFA diferentes a lo reportado previamente en otras latitudes. Estos nuevos resultados complementarían la evidencia internacional disponible y permitirían ofrecer una herramienta diagnóstica acorde con la población peruana, a fin de guiar mejor el tratamiento. Por ello, se plantea este estudio de precisión diagnóstica en pacientes con LES y fiebre hospitalizados, con el objetivo de determinar la utilidad de la PCR y la VSG para discriminar infección versus actividad de LES.
MetodologíaContexto y generalidades del estudioPara esta investigación de precisión diagnóstica se revisaron las historias clínicas de pacientes hospitalizados durante el periodo 2010-2019 en el Servicio de Reumatología del Hospital Nacional Edgardo Rebagliati Martins (HNERM) en Lima, Perú. El HNERM es uno de los hospitales de mayor complejidad dentro del sistema de salud de la Seguridad Social en el Perú (EsSalud), y está localizado en el distrito de Jesús María en Lima Metropolitana. Es sede de programas de especialización y subespecialización médica y quirúrgica, incluyendo medicina interna, reumatología e infectología. Esta investigación no fue financiada por la industria. Este artículo se redactó con base en las pautas STARD 201516.
Procesos de generación y extracción de datosLa extracción de los datos se realizó en forma retrospectiva, es decir, que fue planificada y ejecutada después de que los diagnósticos finales y los resultados de laboratorios estuvieran disponibles en las historias clínicas. Como regla general, el paciente con LES y fiebre es hospitalizado y se somete a un protocolo de evaluaciones clínicas, de laboratorio e imágenes, luego de lo cual se emite como veredicto el diagnóstico definitivo sobre la causa de la fiebre, sea esta «actividad», «infección» o «ambas». En este hospital el estándar de referencia es la valoración global del paciente con base en la revisión de la evolución clínica y el juicio de cada una de las pruebas diagnósticas sucedidas dentro de los 10 primeros días de investigación y hospitalización. Esto lo lleva a cabo el equipo médico tratante hacia, en promedio, el día 10. Sin embargo, debe indicarse que en los primeros días el énfasis está en detectar y descartar infección si esta existe, con la finalidad de no subdiagnosticarlas ni omitir el tratamiento antibiótico.
Muestra y criterios de elegibilidadDurante nuestra revisión de historias clínicas en forma cronológica retrospectiva, los casos se incluyeron secuencialmente según eran identificados y por su disponibilidad de datos para el periodo 2010-2019. No se realizó un cálculo de muestra a priori. Se incluyeron casos hospitalizados con diagnóstico de LES según la Systemic Lupus International Collaborating Clinics Classification Criteria for Systemic Lupus Erythematosus17, y con temperatura >37,5°C axilar o >38°C oral18. Se excluyeron aquellos pacientes cuyos resultados de PCR o VSG no estaban disponibles o no correspondían a los 3 días próximos al pico febril, como también aquellos cuyo diagnóstico de infección, actividad de enfermedad, o ambos, no era claro, aquellos con diagnóstico concurrente de neoplasia y a los menores de 14 años.
Variables del estudioLa causa de fiebre (por infección, actividad o ambas) es la principal variable y se obtuvo según lo registrado en la historia clínica tras completar el plan de trabajo local para descarte de infección (hasta 10 días luego del pico febril). Inicialmente, incluyó a 3 subgrupos: a) «fiebre solo por infección», b) «fiebre solo por actividad» y c) «fiebre por infección y actividad». Posteriormente, para el análisis de precisión diagnóstica se reagruparon en 2 categorías: I) fiebre con infección (incluye grupo a: «fiebre solo por infección», y c: fiebre por infección y actividad») y II) fiebre sin ninguna infección (corresponde al grupo b: «fiebre solo por actividad»). Esta recategorización se guió por los siguientes criterios: necesidad de un evento dicotomizado por los análisis implementados, priorización de la detección de infección, reducido tamaño de muestra y minimización del desbalance entre «casos» y «no casos» en las valoraciones de precisión diagnóstica.
Otras variables de estudio fueron: edad, sexo, PCR (mg/dl), VSG (mm/h), VSGp (mm/h) (según las fórmulas VSG/[edad/2] para varones y VSG/[edad+10)/2] para mujeres), razón VSG/PCR (división de VSG entre PCR), complemento 3 (C3) (mg/dl), complemento 4 (C4) (mg/dl), leucocitos (células/ml), neutrófilos (células/ml), linfocitos (células/ml), tipo de infección y órgano afectado por actividad de LES.
Análisis estadísticoSe calcularon medianas con rangos intercuartílicos, así como promedios con desviaciones estándar para describir las variables numéricas y los valores absolutos y los porcentajes relativos para las variables categóricas. Todas las variables se compararon entre los 3 subgrupos iniciales según causa de fiebre, utilizando la prueba de rangos de Wilcoxon y la prueba exacta de Fisher. El mismo procedimiento analítico se repitió para comparar las 2 categorías finales de la causa de la fiebre. Los niveles PCR, VSG, VSGp y razón VSG/PCR se presentan como gráficos de cajas y bigotes para cada subgrupo y categoría de causa de fiebre. Para estas mismas 4 variables se presenta su correspondiente curva ROC con respecto a la variable fiebre dicotomizada. Esta variable fiebre tuvo dos versiones, según la forma como se codificaron sus categorías bajo el sistema binario (0 y 1 para cada categoría). Para cada una de las 8 curvas ROC resultantes (4 RFA por 2 versiones de variable fiebre) se calculó su área bajo la curva, con su respectivo intervalo de confianza al 95%, y en los casos en que era justificable se determinó en forma exploratoria el mejor punto de corte, con base en el método de la minimización de la distancia geométrica (índice euclidiano) entre la curva ROC y la esquina superior izquierda del espacio ROC total19. También se calcularon y se presentaron valores de sensibilidad, especificidad, valores predictivos y porcentaje de correcta clasificación para estos mejores puntos de corte determinados. Los datos perdidos en variables específicas no se consideraron para sus respectivos análisis. Todos los análisis se llevaron a cabo en el programa Stata® versión 15.1 para Windows.
Consideraciones éticasEl protocolo del estudio, sus procedimientos e instrumentos fueron revisados y aprobados por el Comité de Ética del HNERM, según consta en la carta número 276-GRPR-ESSALUD-2020. Durante la revisión de las historias clínicas no se extrajo información identificatoria o personal; los autores se limitaron a la verificación de los criterios de elegibilidad y extracción de los datos clínicos relevantes para el estudio. Esta investigación cumple con las normativas y las pautas vigentes sobre ética de la investigación en ciencias de la salud.
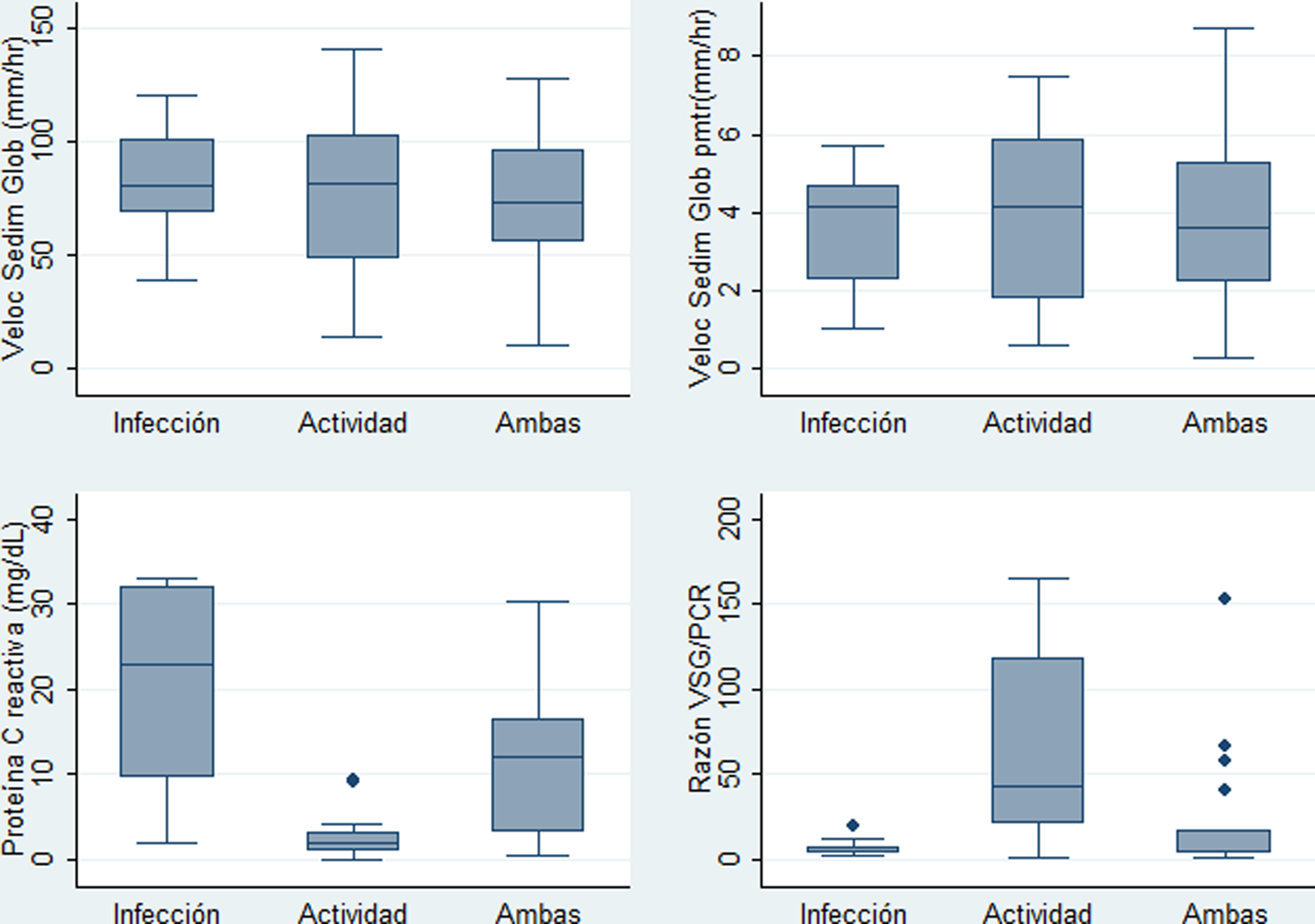
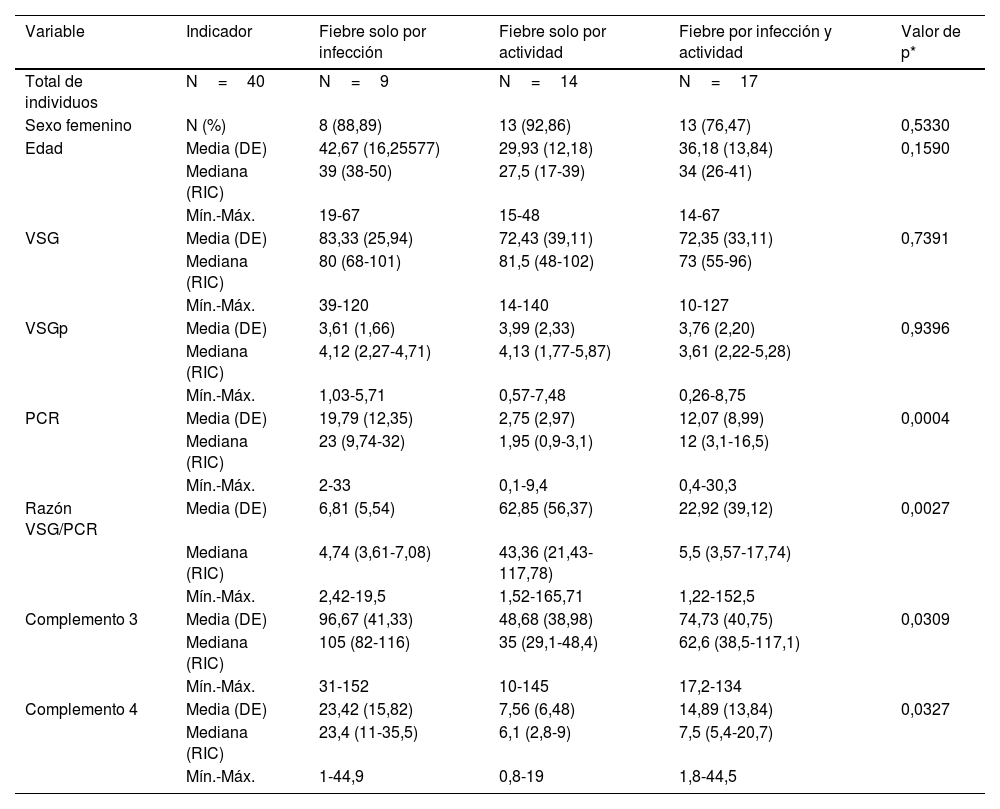
ResultadosDescripción de la población de estudio y causas de la fiebreSe identificaron 47 casos cuyas historias clínicas se recuperaron. De estos, se incluyeron 40 (34 mujeres). Se excluyó a un paciente por no tener PCR, a 2 por no tener VSG, a uno por neoplasia, a otro por no tener diagnóstico claro de infección y a 2 por ser menores de 14 años. La media de la edad fue de 35,5 años con una desviación estándar (DE) de 14,3 años. En la tabla 1 se muestran las características comparadas de los 3 subgrupos originales según causa de fiebre. Los niveles más altos de PCR correspondían al grupo de fiebre solo por infección, en tanto que los niveles más altos de razón VSG/PCR correspondían al grupo de fiebre solo por actividad. En la figura 1 se presentan gráficos de cajas y bigotes de los 4 RFA comparados entre estas causas de fiebre. Entre los 40 casos, el 22,5% (9/40) tuvo fiebre por infección, en el 35% (14/40) fue por actividad y el 42,5% (17/40) restante tuvo concurrencia de infección y actividad. La actividad más frecuente fue de origen renal, en el 52,5% (21/40) de los casos, mientras que la infección más frecuente fue la neumonía, en el 25,0% de los sujetos (10/40). Todas las causas específicas de fiebre (58 diagnósticos en 40 pacientes) se muestran en la tabla 2.
Distribución de los valores paraclínicos en 40 pacientes con LES y fiebre por infección (n=9), por actividad (n=14) o por ambas causas (n=17) en un hospital de la Seguridad Social de Lima, Perú, 2010-2019
| Variable | Indicador | Fiebre solo por infección | Fiebre solo por actividad | Fiebre por infección y actividad | Valor de p* |
|---|---|---|---|---|---|
| Total de individuos | N=40 | N=9 | N=14 | N=17 | |
| Sexo femenino | N (%) | 8 (88,89) | 13 (92,86) | 13 (76,47) | 0,5330 |
| Edad | Media (DE) | 42,67 (16,25577) | 29,93 (12,18) | 36,18 (13,84) | 0,1590 |
| Mediana (RIC) | 39 (38-50) | 27,5 (17-39) | 34 (26-41) | ||
| Mín.-Máx. | 19-67 | 15-48 | 14-67 | ||
| VSG | Media (DE) | 83,33 (25,94) | 72,43 (39,11) | 72,35 (33,11) | 0,7391 |
| Mediana (RIC) | 80 (68-101) | 81,5 (48-102) | 73 (55-96) | ||
| Mín.-Máx. | 39-120 | 14-140 | 10-127 | ||
| VSGp | Media (DE) | 3,61 (1,66) | 3,99 (2,33) | 3,76 (2,20) | 0,9396 |
| Mediana (RIC) | 4,12 (2,27-4,71) | 4,13 (1,77-5,87) | 3,61 (2,22-5,28) | ||
| Mín.-Máx. | 1,03-5,71 | 0,57-7,48 | 0,26-8,75 | ||
| PCR | Media (DE) | 19,79 (12,35) | 2,75 (2,97) | 12,07 (8,99) | 0,0004 |
| Mediana (RIC) | 23 (9,74-32) | 1,95 (0,9-3,1) | 12 (3,1-16,5) | ||
| Mín.-Máx. | 2-33 | 0,1-9,4 | 0,4-30,3 | ||
| Razón VSG/PCR | Media (DE) | 6,81 (5,54) | 62,85 (56,37) | 22,92 (39,12) | 0,0027 |
| Mediana (RIC) | 4,74 (3,61-7,08) | 43,36 (21,43-117,78) | 5,5 (3,57-17,74) | ||
| Mín.-Máx. | 2,42-19,5 | 1,52-165,71 | 1,22-152,5 | ||
| Complemento 3 | Media (DE) | 96,67 (41,33) | 48,68 (38,98) | 74,73 (40,75) | 0,0309 |
| Mediana (RIC) | 105 (82-116) | 35 (29,1-48,4) | 62,6 (38,5-117,1) | ||
| Mín.-Máx. | 31-152 | 10-145 | 17,2-134 | ||
| Complemento 4 | Media (DE) | 23,42 (15,82) | 7,56 (6,48) | 14,89 (13,84) | 0,0327 |
| Mediana (RIC) | 23,4 (11-35,5) | 6,1 (2,8-9) | 7,5 (5,4-20,7) | ||
| Mín.-Máx. | 1-44,9 | 0,8-19 | 1,8-44,5 |
LES: lupus eritematoso sistémico.
Etiologías especificas (n=58) en 40 pacientes con LES y fiebre por infección (n=9), por actividad (n=14) o por ambas causas (n=17) en un hospital de la Seguridad Social de Lima, Perú, 2010-2019
| Distribución por tipo de infeccióna | N.° (%) |
|---|---|
| Neumonía | 10 (25,00) |
| Cutáneo y musculoesquelético (no herpética ni tuberculosa) | 4 (10,00) |
| Tuberculosis (pulmonar y extrapulmonar) | 3 (7,50) |
| Infección del tracto urinario | 2 (5,00) |
| Herpes | 2 (5,00) |
| Otros | 5 (12,50) |
| Distribución por el tipo de actividad, N.° (%)b | |
| Renal | 21 (52,50) |
| Serosa | 9 (22,50) |
| Articular | 7 (17,50) |
| Sistema nervioso | 6 (15,00) |
| Hematológica | 5 (12,50) |
| Vascular | 2 (5,00) |
| Pulmonar | 1 (2,50) |
LES: lupus eritematoso sistémico.
Incluye a todos los pacientes con actividad, con o sin coexistencia de infección.
a,b La sumatoria de porcentajes de cada actividad sobrepasa el 100%, por presencia simultánea de diferentes tipos de actividad y/o infección en un mismo paciente. Hubo 58 diagnósticos en 40 pacientes.
Fuente: elaboración propia.
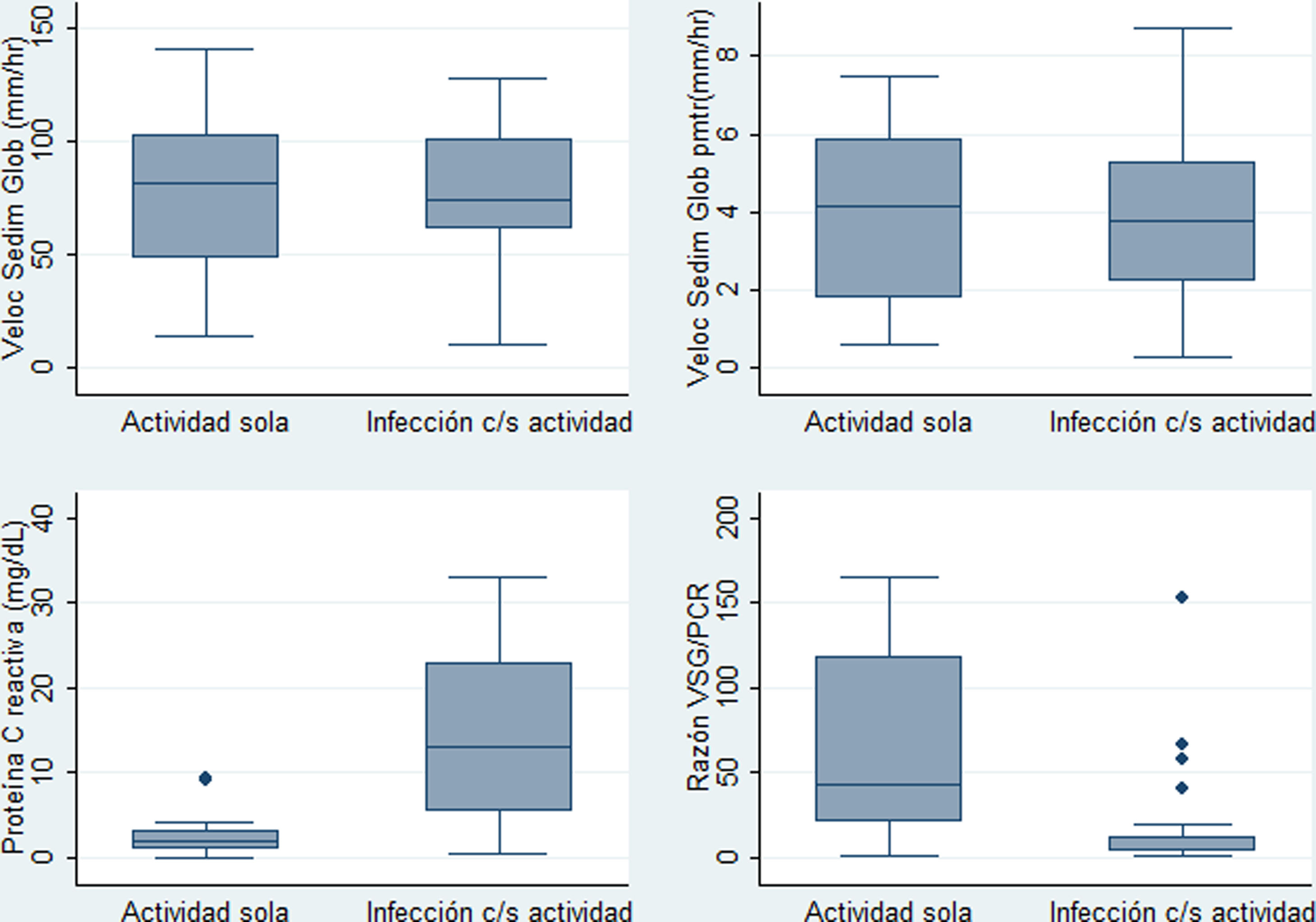
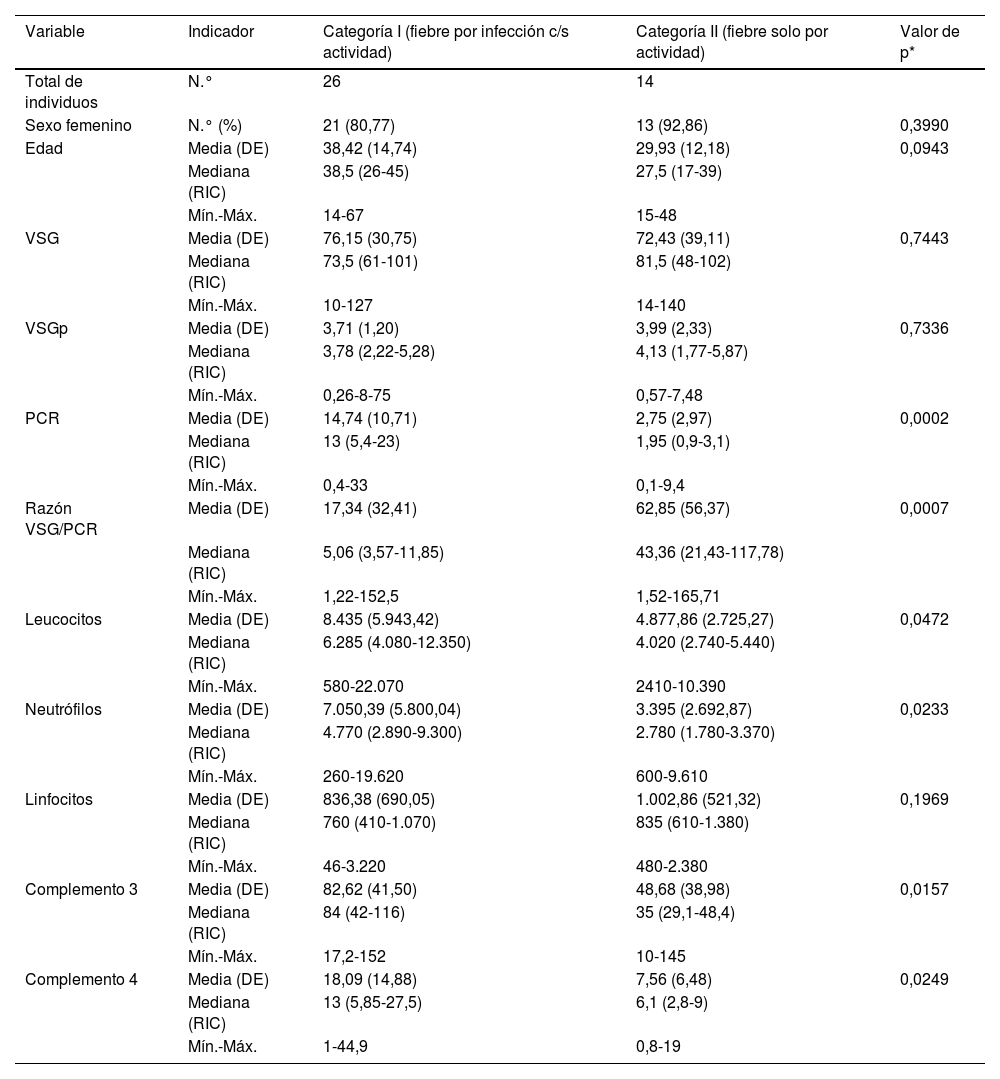
Para los siguientes análisis comparativos y de precisión diagnóstica la variable fiebre fue analizada con base en 2 categorías previamente descritas: I) fiebre con infección (incluye grupo a: «fiebre solo por infección», y c: «fiebre por infección y actividad»), y II) fiebre sin ninguna infección (corresponde al grupo b: «fiebre solo por actividad»). Las características comparadas de estas 2 categorías se muestran en la tabla 3. Los niveles más altos de PCR correspondían al grupo de fiebre por infección con/sin actividad, y los niveles más altos de razón VSG/PCR correspondían al grupo de fiebre solo por actividad. En la figura 2 se presentan gráficos de cajas y bigotes de los 4 RFA comparados entre estas mismas 2 categorías.
Distribución de valores paraclínicos en 40 pacientes con LES y fiebre por infección con o sin actividad (n=26) o solo por actividad (n=14) en un hospital de la Seguridad Social de Lima, Perú, 2010-2019
| Variable | Indicador | Categoría I (fiebre por infección c/s actividad) | Categoría II (fiebre solo por actividad) | Valor de p* |
|---|---|---|---|---|
| Total de individuos | N.° | 26 | 14 | |
| Sexo femenino | N.° (%) | 21 (80,77) | 13 (92,86) | 0,3990 |
| Edad | Media (DE) | 38,42 (14,74) | 29,93 (12,18) | 0,0943 |
| Mediana (RIC) | 38,5 (26-45) | 27,5 (17-39) | ||
| Mín.-Máx. | 14-67 | 15-48 | ||
| VSG | Media (DE) | 76,15 (30,75) | 72,43 (39,11) | 0,7443 |
| Mediana (RIC) | 73,5 (61-101) | 81,5 (48-102) | ||
| Mín.-Máx. | 10-127 | 14-140 | ||
| VSGp | Media (DE) | 3,71 (1,20) | 3,99 (2,33) | 0,7336 |
| Mediana (RIC) | 3,78 (2,22-5,28) | 4,13 (1,77-5,87) | ||
| Mín.-Máx. | 0,26-8-75 | 0,57-7,48 | ||
| PCR | Media (DE) | 14,74 (10,71) | 2,75 (2,97) | 0,0002 |
| Mediana (RIC) | 13 (5,4-23) | 1,95 (0,9-3,1) | ||
| Mín.-Máx. | 0,4-33 | 0,1-9,4 | ||
| Razón VSG/PCR | Media (DE) | 17,34 (32,41) | 62,85 (56,37) | 0,0007 |
| Mediana (RIC) | 5,06 (3,57-11,85) | 43,36 (21,43-117,78) | ||
| Mín.-Máx. | 1,22-152,5 | 1,52-165,71 | ||
| Leucocitos | Media (DE) | 8.435 (5.943,42) | 4.877,86 (2.725,27) | 0,0472 |
| Mediana (RIC) | 6.285 (4.080-12.350) | 4.020 (2.740-5.440) | ||
| Mín.-Máx. | 580-22.070 | 2410-10.390 | ||
| Neutrófilos | Media (DE) | 7.050,39 (5.800,04) | 3.395 (2.692,87) | 0,0233 |
| Mediana (RIC) | 4.770 (2.890-9.300) | 2.780 (1.780-3.370) | ||
| Mín.-Máx. | 260-19.620 | 600-9.610 | ||
| Linfocitos | Media (DE) | 836,38 (690,05) | 1.002,86 (521,32) | 0,1969 |
| Mediana (RIC) | 760 (410-1.070) | 835 (610-1.380) | ||
| Mín.-Máx. | 46-3.220 | 480-2.380 | ||
| Complemento 3 | Media (DE) | 82,62 (41,50) | 48,68 (38,98) | 0,0157 |
| Mediana (RIC) | 84 (42-116) | 35 (29,1-48,4) | ||
| Mín.-Máx. | 17,2-152 | 10-145 | ||
| Complemento 4 | Media (DE) | 18,09 (14,88) | 7,56 (6,48) | 0,0249 |
| Mediana (RIC) | 13 (5,85-27,5) | 6,1 (2,8-9) | ||
| Mín.-Máx. | 1-44,9 | 0,8-19 |
DE: desviación estándar; LES: lupus eritematoso sistémico; PCR: proteína C reactiva; VSG: velocidad de sedimentación globular; VSGp: velocidad de sedimentación globular parámetro.
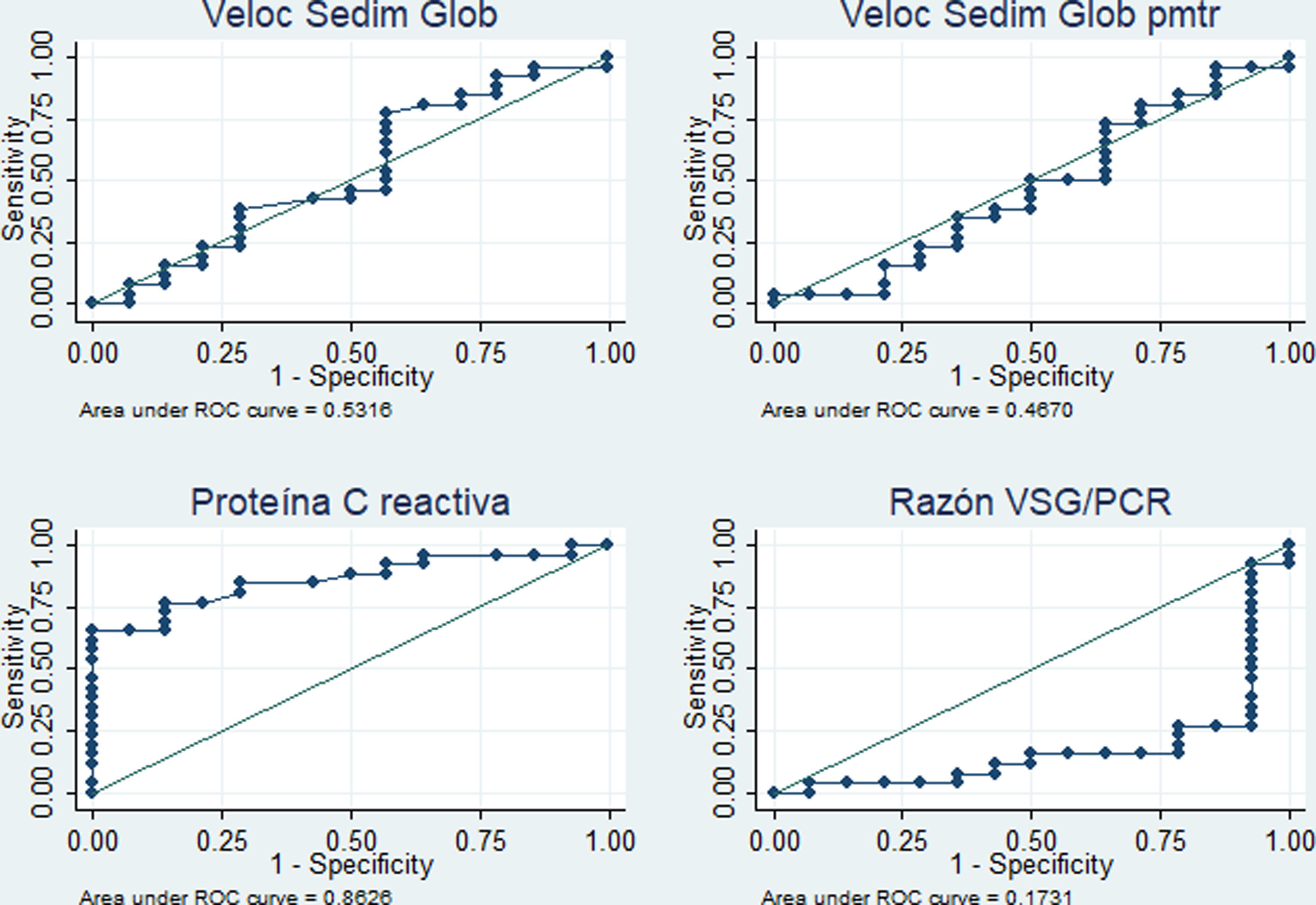
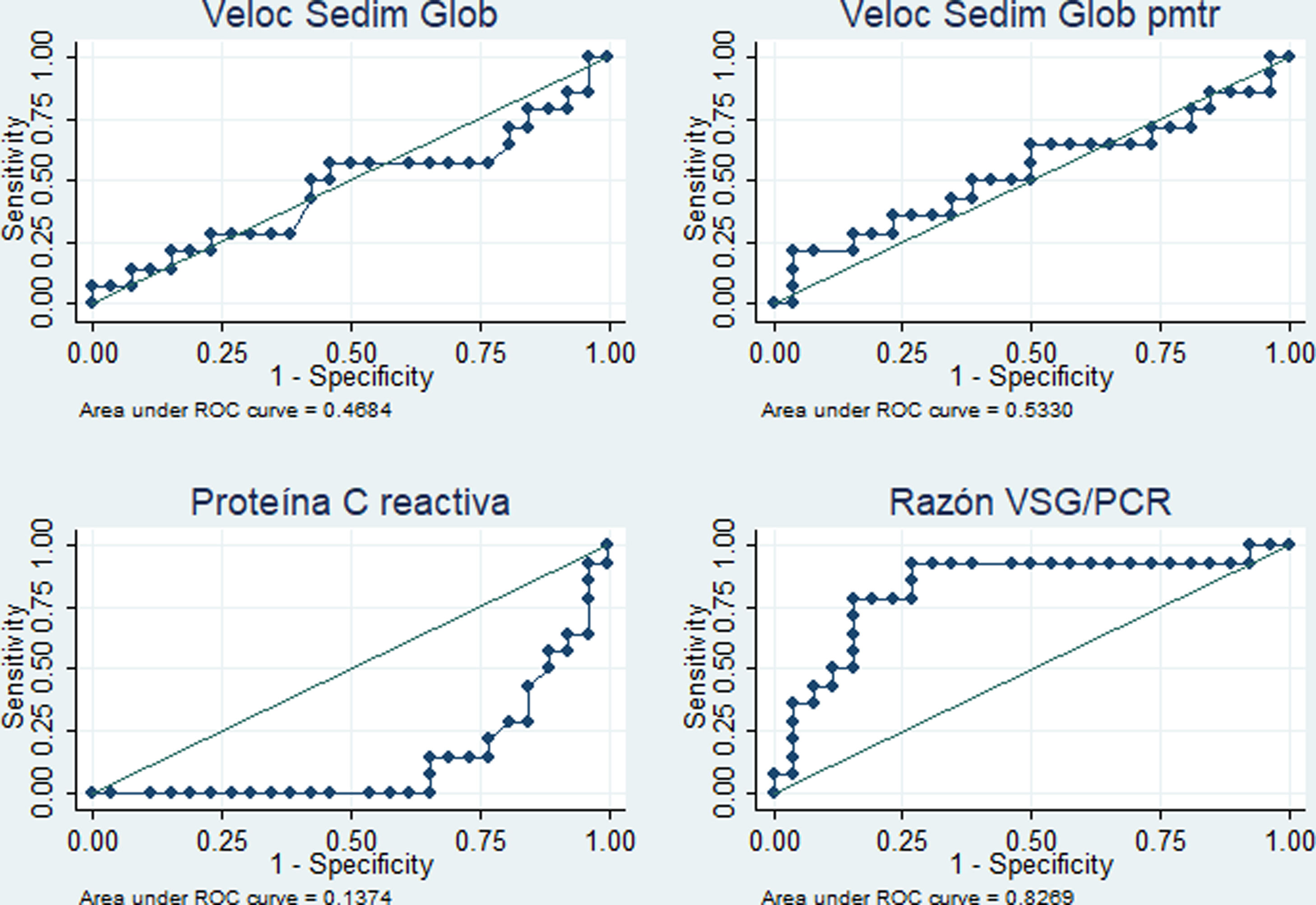
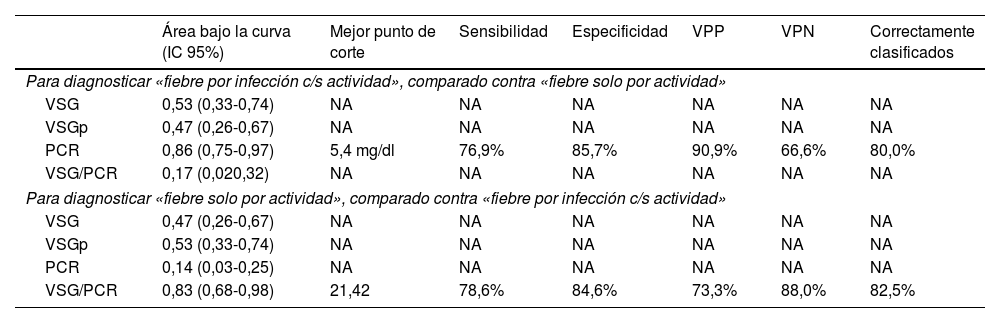
El desempeño diagnóstico de los cuatro RFA se muestra en la tabla 4. Destacan las áreas bajo la curva superiores al 80% para el PCR (diagnóstico de fiebre por infección c/s actividad) y para la razón VSG/PCR (diagnóstico de fiebre solo por actividad) y similares porcentajes de correcta clasificación para los mejores puntos de corte identificados (5,4mg/dl en PCR y 21,42 en la razón VSG/PCR). En las figuras 3 y 4 se muestran las curvas ROC correspondientes.
Desempeño de reactantes de fase aguda para diferenciar la fiebre solo por la actividad (n=14) versus fiebre por la infección c/s actividad (n=26) en 40 pacientes con LES y fiebre en un hospital de la Seguridad Social de Lima, Perú, 2010-2019
| Área bajo la curva (IC 95%) | Mejor punto de corte | Sensibilidad | Especificidad | VPP | VPN | Correctamente clasificados | |
|---|---|---|---|---|---|---|---|
| Para diagnosticar «fiebre por infección c/s actividad», comparado contra «fiebre solo por actividad» | |||||||
| VSG | 0,53 (0,33-0,74) | NA | NA | NA | NA | NA | NA |
| VSGp | 0,47 (0,26-0,67) | NA | NA | NA | NA | NA | NA |
| PCR | 0,86 (0,75-0,97) | 5,4 mg/dl | 76,9% | 85,7% | 90,9% | 66,6% | 80,0% |
| VSG/PCR | 0,17 (0,020,32) | NA | NA | NA | NA | NA | NA |
| Para diagnosticar «fiebre solo por actividad», comparado contra «fiebre por infección c/s actividad» | |||||||
| VSG | 0,47 (0,26-0,67) | NA | NA | NA | NA | NA | NA |
| VSGp | 0,53 (0,33-0,74) | NA | NA | NA | NA | NA | NA |
| PCR | 0,14 (0,03-0,25) | NA | NA | NA | NA | NA | NA |
| VSG/PCR | 0,83 (0,68-0,98) | 21,42 | 78,6% | 84,6% | 73,3% | 88,0% | 82,5% |
IC 95%: intervalo de confianza del 95%; LES: lupus eritematoso sistémico; NA: no aplica su cálculo; PCR: proteína C reactiva; VPN: valor predictivo negativo; VPP: valor predictivo positivo; VSG: velocidad de sedimentación globular; VSGp: velocidad de sedimentación globular parámetro.
Fuente: elaboración propia.
Se estudiaron 4 reactantes de fase aguda (VSG, VSGp, PCR y razón VSG/PCR) para determinar sus propiedades de precisión diagnóstica y diferenciar procesos infecciosos de inflamatorios en pacientes con LES y fiebre. Hasta donde se sabe, se trata del primer estudio de este tipo en el medio peruano.
El porcentaje de población femenina (85%) fue similar al reportado en metaanálisis previos (86,57%)20, lo que demuestra que la población peruana es similar a la de otros medios. En este estudio se encontró que la PCR más alta perteneció al grupo de fiebre solo por infección, con media de 19,79mg/dl (DE: 12,35), hallazgo compatible con reportes previos realizados en diferentes poblaciones: Michigan en el 201814, California en el 201113 y Corea del Sur en el 201221, los cuales también demostraron un aumento de PCR en LES con infección. Esto se explica porque los agentes patógenos externos estimulan el aumento de la IL-6, lo que aumenta la producción hepática de la PCR5. La razón VSG/PCR más alta perteneció al grupo de fiebre solo por actividad, hallazgo compatible con un estudio realizado en Alemania en el 201715. En el presente estudió se adoptó la hipótesis de que durante la actividad de LES se producen anticuerpos anti-PCR (que lo inhiben), y el aumento de proteínas plasmáticas inflamatorias hace que se incremente la VSG8–11. Los complementos C3 y C4 fueron significativamente más bajos en el grupo de fiebre solo por actividad, hallazgo ampliamente conocido.
La actividad más frecuente fue renal (52,5%), seguida de serosa (22,5%), lo que difiere de la literatura, en la que predominan la cutánea (69,8%) y la articular (58,4%)22. La infección más frecuente fue la neumonía (25%), seguida de cutánea y musculoesquelética (10%), diferente de la infección urinaria, reportada como la principal en estudios similares23. La diferencia se debe a que solamente se incluyó a pacientes hospitalizados, lo cual excluye cualquier actividad o infección menor (que no comprometa órgano blanco). La mayoría de los pacientes correspondió al grupo de fiebre por infección y actividad (42,5%), hallazgo que se sustenta con la hipótesis de un mecanismo pivotal propuesto por A. Doria (Italia, 2008), de acuerdo con la cual la infección es una causante de actividad de LES, pero también constituye una complicación del LES24. Por un lado, la infección gatilla la inmunidad mediante mimetismo molecular, como por ejemplo en el caso del Epstein-Barr virus25, producción de superantígenos y alteración de la apoptosis, entre otros26,27. Por otro lado, la baja expresión del receptor de complemento en eritrocitos, células B y neutrófilos, así como el déficit de la lecitina de unión a manosa y el empleo de inmunosupresores, confieren susceptibilidad a infecciones24 de diferentes tipos, entre estas, comunes, crónicas y oportunistas28.
En este estudio, con referencia al análisis comparativo con la causa de fiebre dicotomizada, se encontró que la PCR≥5,4mg/dl tiene un área bajo la curva de 0,86 (especificidad del 85,7% y sensibilidad del 76,9%) para identificar procesos infecciosos con o sin actividad como causa de fiebre, en tanto que la razón VSG/PCR≥21,42 tiene un área bajo la curva de 0,83 (especificidad del 84,6% y sensibilidad del 78,6%) para identificar a una actividad de LES. En cuanto a la PCR, nuestro resultado tuvo mejor desempeño que el reportado en California (2011) con valor para infección >6mg/dl (área bajo la curva de 0,75, sensibilidad del 55% y especificidad del 84%)13. En este último estudio admitieron resultados de VSG y PCR dentro de la misma semana y no limitaron la muestra a solo pacientes febriles. Es de suponer que la inclusión de pacientes exclusivamente con fiebre y resultado de PCR y VSG dentro de los 3 días próximos a la infección optimizó el resultado del presente estudio. Se obtuvo un punto de corte de PCR para infección más bajo que el reportado en Alemania (2017) —PCR 7,2mg/dl15—, en los Países Bajos (1990) —PCR 6mg/dl12— y en Michigan (2014) —PCR 11,2mg/dl14—, y una razón VSG/PCR más alta que en Michigan (≥15 para actividad de LES14).
El menor punto de corte de PCR se podría explicar porque se incluyó a pacientes con coexistencia de infección y actividad dentro de la categoría de pacientes «con infección». Esto apoya la teoría de inhibición de PCR en caso de actividad y su relación con la etiopatogenia de la enfermedad29. Adicionalmente, ningún paciente con serositis en la casuística de este estudio perteneció al grupo de «fiebre solo actividad», lo que probablemente redujo el valor global de la PCR en ellos30. Además, el análisis empleó la variable de fiebre dicotomizada, con la finalidad de priorizar la detección de infección con o sin actividad, ya que ello implica un cambio terapéutico que incluye antibiótico y orienta la necesidad inmediata del empleo de inmunosupresores.
Por otro lado, el desempeño de VSG y VSGp fue pobre (área bajo la curva de 0,53 y 0,47, respectivamente) para identificar el proceso infeccioso. En cuanto a la VSG, en la literatura no se encuentra consenso sobre su utilidad. En Alemania, en el año 2017, no se encontró variación significativa de la VSG con infección, actividad o ambas en el LES15; en Israel se encontró un aumento del VSG durante la actividad31; en Maryland (2013) se observó una asociación entre el aumento de VS≥25mm/h y aumento del Sytemic Lupus Erythematosus Disease Activity Index (Sledai)32, y en Corea del Sur se presentó aumento de la VSG asociado con infección versus actividad (41,26 versus 25,21mm/h)21. En cuanto a la VSGp, en Alemania se demostró que el VSGp>1,1 tenía una sensibilidad del 68,2% y una especificidad del 62,5% para identificar actividad de LES15. Queda demostrado que el VSG tiene resultados muy dispersos y poco consistentes. Esto se debe a que se trata de un reactante de fase aguda que varía según la edad33, la raza34, las proteínas plasmáticas35 y la anemia, entre otros36. El número de sujetos incluido impidió parear la variable con los mencionados factores confusores.
La búsqueda de nuevas herramientas para discriminación diagnóstica conlleva muchos desafíos y exhibe varios vacíos. Por ejemplo, debido tanto a la heterogeneidad biológica de las manifestaciones de las causas de fiebre en estos pacientes, como a que ningún sistema de clasificación es 100% perfecto, siempre se encuentran casos de pacientes con LES que no elevan la PCR estando infectados, como también aquellos que la elevan sin tener infecciones. Esto se manifiesta en que ninguno de los indicadores evaluados (sensibilidad, especificidad y valores predictivos) alcanza el 100% y representa parte de las dificultades para discriminar infección de actividad. En otro ejemplo, en una revisión sistemática del año 2017, a pesar de los resultados alentadores para anti-DNA de doble cadena, anticuerpos anti-C1q y estimulador de linfocito B, no se pudo obtener conclusiones consistentes para definir cuál es el mejor de ellos37; además, su disponibilidad es limitada en nuestro entorno. En cuanto al C3 y al C4, con sugerentes hallazgos en el presente estudio, algunos autores señalan que su utilidad como biomarcador de actividad es inconsistente38, lo que hace necesario buscar otras alternativas como la razón VSG/PCR.
El presente estudio tiene limitaciones y fortalezas. Entre las principales limitaciones se reconoce inicialmente el tamaño de la muestra, así como usar datos de historias clínicas. Estos últimos no sesgan en forma importante los resultados y, por el contrario, se vinculan con el amplio periodo estudiado (10 años), involucrando un equipo médico con amplia experiencia en uno de los principales hospitales de referencia del Perú, que son definitivamente fortalezas del estudio. Con respecto a la población estudiada (dividida en casos con fiebre por algún proceso infeccioso c/s actividad y casos con fiebre solo por actividad), esta solo incluyó a pacientes hospitalizados, lo que inevitablemente perfila que los casos exhiban una infección o actividad más severas, con mayor respuesta inflamatoria y, en consecuencia, potencialmente polarizando los valores de PCR y VSG para infección y actividad, respectivamente. La no existencia de sujetos con serositis en el grupo de fiebre solo por actividad también podría acentuar esta polarización y diferencia entre ambos grupos y es también una limitación. Sin embargo, es la propia condición de paciente hospitalizado lo que permitió medir oportunamente el PCR y el VSG, lo cual se convierte a su vez en una fortaleza del estudio. Finalmente, una fortaleza adicional del estudio es el hallazgo de ciertos marcadores de discriminación que ameritan seguir explorándose en futuras investigaciones clínicas, como es el caso de los complementos C3 y C4.
En conclusión, con los hallazgos presentados se ofrece, en el contexto peruano, una nueva ayuda al diagnóstico para paciente con LES y fiebre admitidos para estudio y manejo. Se sugiere hacer una búsqueda activa de infección oculta en cualquier paciente con LES y fiebre, especialmente si cuenta con PCR≥5,4mg/dl. Del mismo modo, se sugiere valorar el oportuno manejo de inmunosupresores si la razón de VSG/PCR≥21,4.
Disponibilidad de los datosLas bases de datos generadas o analizadas durante esta investigación se encuentran disponibles mediante el autor corresponsal, por medio de solicitud razonable y justificada.
FinanciaciónEsta investigación fue financiada por los investigadores mediante recursos propios o el apoyo de las instituciones a las cuales están vinculados. Dichas instituciones no tuvieron injerencia en el diseño del estudio, la recolección de datos, el análisis y la interpretación de los datos, la redacción del artículo o la decisión de enviarlo para su publicación.
Conflicto de interesesLos autores declaran que no tienen ningún conflicto de intereses.
Los autores desean expresar su agradecimiento al HNERM que, mediante sus representantes y autoridades, brindó acceso, facilidades y autorización para la ejecución de esta investigación. También agradecen a la Universidad de Huánuco por el apoyo académico y administrativo. Finalmente, agradecen al doctor José Chávez Corrales por las contribuciones brindadas inicialmente.