Las enfermedades autoinmunes son un grupo de patologías crónicas en las que factores genéticos, ambientales y hormonales contribuyen a su aparición. Además de tener un amplio espectro clínico, la interpretación de los diversos autoanticuerpos y técnicas utilizadas en el laboratorio también son un reto clínico. Dada la complejidad de estas enfermedades, es muy importante apoyarse en las pruebas de laboratorio para establecer un correcto diagnóstico, seguimiento y, en algunos casos inclusive, establecer pronósticos o predicción de la posible aparición de autoinmunidad. Con todo esto se pretende mejorar la calidad de vida de los pacientes disminuyendo la gran morbimortalidad de este grupo de enfermedades, especialmente al diagnosticarlas en etapas tempranas. La mayoría de las enfermedades reumatológicas se caracterizan por la alta producción de autoanticuerpos y reactantes de fase aguda, los cuales están implicados en su fisiopatología produciendo daño directo a nivel sistémico. Entre estas, el lupus eritematoso sistémico, la artritis reumatoide y el síndrome de Sjögren son las más reconocidas. Por tales motivos, el objetivo de este trabajo es hacer una revisión que permita guiar tanto a médicos como a personal de laboratorio en la interpretación de los diferentes autoanticuerpos en enfermedades autoinmunes.
Autoimmune diseases are a group of chronic diseases in which genetic, environmental, and hormonal factors contribute to their appearance. In addition to having a broad clinical spectrum, the interpretation of the various autoantibodies and techniques used in the laboratory is also a clinical challenge. Given the complexity of these diseases, it is very important to rely on the results of laboratory tests to establish a correct diagnosis and follow-up and, in some cases even to establish a prognosis or prediction of autoimmunity. Taking all this into account, it is intended to improve the quality of life of patients by decreasing the increased morbidity and mortality in this group of diseases, especially by early diagnosis. Most rheumatological diseases are characterised by the high production of autoantibodies and acute phase reactants, which are involved in their pathophysiology, leading to systemic involvement. Among these, the most recognised are, systemic lupus erythematosus, rheumatoid arthritis, and Sjögren's syndrome. For these reasons, the objective of this project is to present a review that will help both physicians and laboratory personnel in the interpretation of the different autoantibodies in autoimmune diseases.
Las enfermedades autoinmunes son un grupo complejo y heterogéneo de patologías, que son el resultado de la interacción entre factores genéticos, epigenéticos, inmunológicos y medioambientales. Cerca del 5% de la población mundial se ve afectada por enfermedades autoinmunes órgano-específicas y sistémicas1. Se ha planteado que existen distintas fases antes de que ocurra la enfermedad autoinmune y la investigación de estas apunta a un futuro en donde se pueda realizar prevención primaria que pueda retrasar o posponer la aparición de la enfermedad, basados en modelos de predictibilidad fundamentada en la determinación de autoanticuerpos1,2. Es así como se considera que la aparición de autoanticuerpos tiene un rol importante en la evolución hacia la presentación clínica de distintas enfermedades autoinmunes.
Los autoanticuerpos encontrados en enfermedades autoinmunes son el resultado de errores en los mecanismos de regulación o de un aumento considerable en los autoantígenos por alteración en los mecanismos de regulación. Dentro del gran abanico de autoanticuerpos que se han estudiado, la gran mayoría de los que determinamos en la práctica clínica tienen un importante rol como marcador de autoinmunidad y de diagnóstico en un contexto clínico determinado. Por el contrario, dentro de este grupo de pruebas, muy pocos son indicadores de actividad de enfermedad (por ejemplo los anticuerpos anti-ADN de doble cadena en el lupus sistémico) y patogénicos3. En este artículo realizaremos una descripción de los anticuerpos más importantes y comúnmente utilizados en el contexto clínico, resaltando las características más relevantes y el rol que desempeñan en el diagnóstico, predicción, seguimiento y pronóstico de las diferentes enfermedades autoinmunes.
MétodosMétodos de búsqueda de la literaturaSe realizó una búsqueda sistemática de la literatura desde junio de 2017 hasta octubre de 2017, incluyendo artículos publicados desde 1970 hasta el 2017. Se consultaron diferentes bases de datos online como: Medline, Google Scholar, Scielo, Clinical Trials, Academic Search Ultimate, Clinics Review Article y Embase. La búsqueda realizada en Pubmed se hizo a través de términos MeSH: Autoinmunidad, Autoanticuerpos, Lupus eritematoso sistémico, Artritis reumatoide, Síndrome de Sjögren, Inmunofluorescencia indirecta, Enzimoinmunoanálisis. Estos términos fueron enlazados con el conector booleano AND. Aquellos artículos publicados antes de 1970 fueron excluidos; solo se incluyeron artículos publicados en inglés o español.
Selección de artículos y extracción de informaciónLos artículos seleccionados fueron guardados en una base de datos electrónica; inicialmente se tuvieron en cuenta aquellos artículos que tuvieran las pablaras clave incluidas en el abstract o en el título. Posterior a esto se descartaron aquellos artículos que no cumplían con los criterios de inclusión o con la calidad metodológica, y se realizó un comité entre los diferentes autores para unificar la base de datos y escoger aquellos artículos que fueran relevantes para esta publicación.
Criterios de inclusión- 1.
Tipos de estudio: Revisiones de tema, casos y control, estudios aleatorizados y no aleatorizados, estudios de cohorte, reportes de caso y protocolos institucionales.
- 2.
Tipo de población: Pacientes adultos sanos y con autoinmunidad.
- 3.
Intervención: Estudios que describieran historia, técnicas de laboratorio, aplicabilidad y función clínica de los anticuerpos.
- 1.
Artículos sin acceso a texto completo.
- 2.
Artículos duplicados.
- 3.
Estudios que no fueran realizados en humanos.
- 4.
Artículos publicados antes de 1970.
Al finalizar la búsqueda, un total de 124 artículos fueron encontrados por todos los investigadores. Excluyendo aquellos duplicados o que no tuvieran acceso, se obtuvieron un total de 77 artículos. Debido a la gran cantidad de literatura que actualmente existe y a los nuevos cambios en la interpretación de los diferentes patrones de anticuerpos antinucleares (ANA) se decidió realizar este trabajo, con el objetivo de unificar la literatura más relevante alrededor de este tema y guiar tanto a médicos como a personal de laboratorio en la interpretación de los diferentes autoanticuerpos en enfermedades autoinmunes.
DiscusiónAnticuerpos antinuclearesLos ANA son un amplio grupo de autoanticuerpos que reconocen macromoléculas integradas en la estructura del núcleo celular y algunos componentes citoplasmáticos4. En 1948, el hematólogo Malcolm Hargraves describió un hallazgo observacional presente en células de médula ósea de pacientes con lupus eritematoso sistémico (LES), las cuales nombró «células LE»5. Este sería el primer paso para la investigación de este fenómeno y posteriores avances en técnicas de identificación de anticuerpos. Inicialmente se identificaron los ANA usando tejido hepático de ratones por medio de inmunofluorescencia; sin embargo, estos primeros intentos de identificación no fueron exitosos, debido a la presencia de dificultades técnicas tales como la autofluorescencia de los tejidos usados y la variabilidad de los patrones de inmunofluorescencia, entre otros. No fue hasta 1970 cuando las células HEp-2, líneas epiteliales humanas derivadas de carcinoma laríngeo5, se comenzaron a utilizar en esta prueba, ya que permitían un mejor desempeño de la inmunofluoresencia indirecta para la detección de los ANA.
Los ANA se pueden clasificar dependiendo de las distintas estructuras que reconozcan: nucleosoma, proteínas no histonas asociadas al ADN, proteínas no histonas asociadas al ARN o antígenos extraíbles del núcleo (ENA), nucléolo y antígenos citoplasmáticos6.
El método que se utiliza para la identificación de los ANA en células HEp-2 es por convención, la inmunofluorescencia indirecta (IFI), aunque actualmente se han desarrollado nuevas técnicas para la detección de estos anticuerpos, la primera se sigue considerando el estándar de oro7. La IFI es un método accesible en muchos laboratorios y fácil de reproducir. Para esta prueba se requiere del suero del paciente, el cual se diluye inicialmente en 1/40 o más, este se agrega sobre la preparación de las células HEp-2 permitiendo de esta forma que los anticuerpos del paciente se unan con los antígenos diana presentes en estas células. Después se realiza un lavado con una solución buffer y se aplica una solución con IgG antihumana acoplada a un fluorocromo que se une al complejo antígeno/anticuerpo presente en la muestra. Finalmente, después de un segundo lavado que retire los anticuerpos fluorescentes que no se unieron, se podrá observar el resultado mediante un microscopio de luz ultravioleta. Las células HEp-2 son ideales para este tipo de prueba, ya que tienen facilidad de crecimiento y crecen en forma de monocapa, lo que permite la visualización de las mismas a través del microscopio de fluorescencia. Además, tienen un núcleo más grande que cualquier célula epitelial normal lo que hace más fácil la visualización de los patrones nucleares y citoplasmáticos. Adicionalmente, estas células permiten detectar anticuerpos contra antígenos que dependen del ciclo celular. Sin embargo, es importante tener en cuenta que la detección de ANA mediante IFI es un tamizaje, que tras ser positivo requiere una segunda prueba que aumente su especificidad, por medio de radioinmunoanálisis, ELISA, electroinmunotransferencia o Western blot, con el fin de determinar la especificidad antigénica a la cual están dirigidos los anticuerpos8,9.
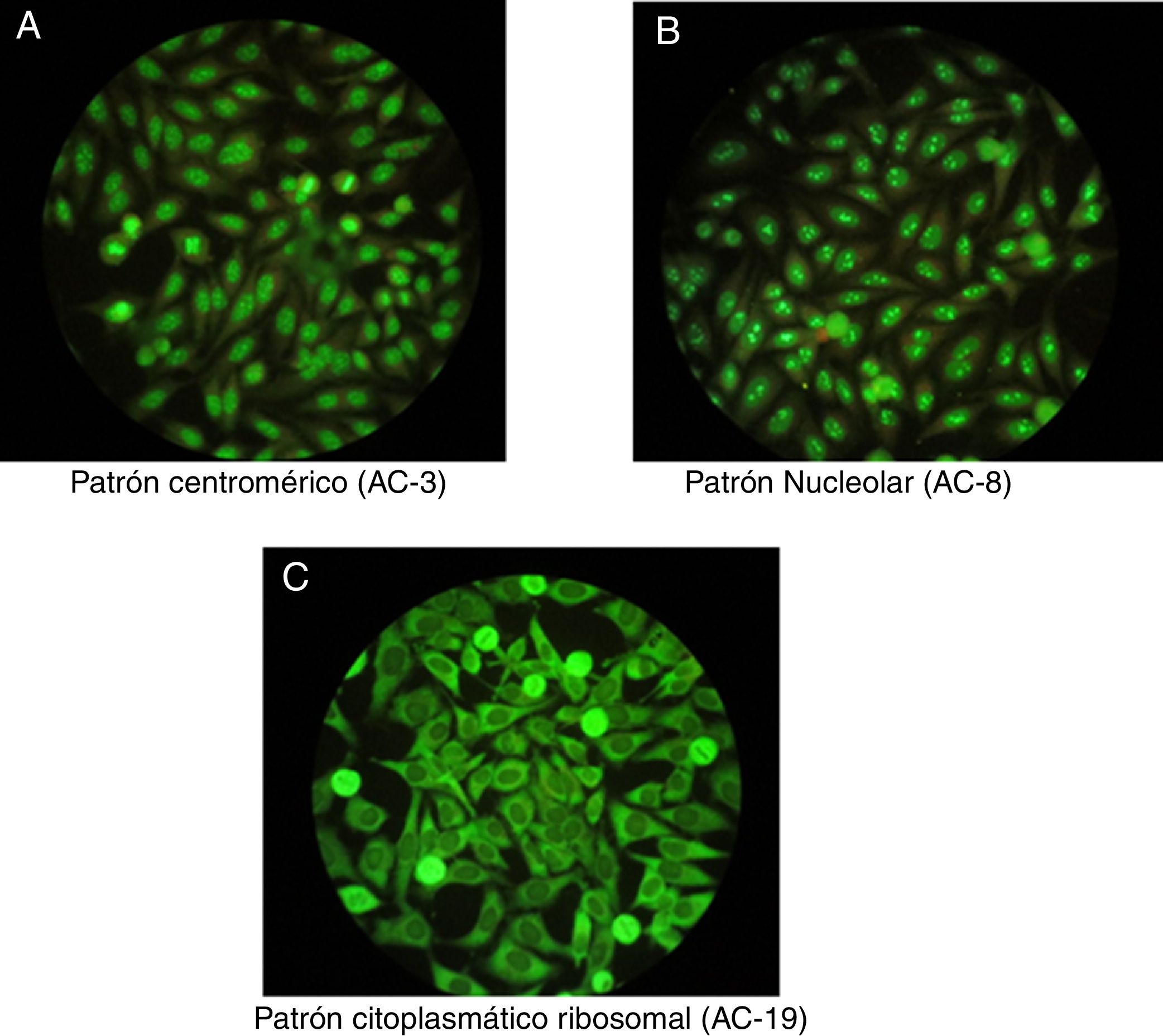
Una de las características importantes de la prueba con IFI es que permite identificar diferentes patrones convencionales que guiarán la interpretación clínica de la prueba y la conducta a seguir. Debido a la gran variedad de patrones y a la complejidad de algunos, en 2016 un consenso de expertos se reunió para discutir una nomenclatura universal que permita estandarizar la lectura e interpretación de los ANA por el método IFI. La tabla 1 resume los patrones más importantes basados en este consenso, que da una numeración a cada uno de ellos de AC-1 (anti-cell) hasta AC-28, separados en patrones nucleares, citoplasmáticos y mitóticos10. Entre los patrones más comunes están: 1) el patrón homogéneo o difuso, en el que se observa una tinción homogénea en el núcleo de la célula; cuando este patrón se presenta se debe a la presencia, por lo general, de anticuerpos contra la desoxi-ribonucleoproteína o histonas6; 2) el patrón periférico, donde se observa una tinción que es regular alrededor del núcleo y el centro es menos teñido en comparación con la periferia; este patrón indica, por lo general, la presencia de anticuerpos anti-ADN de doble cadena, el cual presenta una alta especificidad para LES6; 3) el patrón moteado es el más común y existen 2 tipos, el patrón moteado grueso y el patrón moteado fino que indica la presencia de anticuerpos anti-ENA8; 4) el patrón nucleolar tiñe de forma característica intensamente los nucléolos celulares e indica la presencia de anticuerpos contra los componentes del nucléolo; los posibles antígenos a tener en cuenta son: Scl-70 y las ARN polimerasa i, ii y iii. Este patrón tiene relevancia clínica ya que es más frecuente en las formas difusas de escleroderma y se asocia con mayor compromiso renal y pulmonar11; 5) el patrón citoplasmático indica la presencia de anticuerpos contra componentes del citoplasma como lo son las mitocondrias, los ribosomas y las proteínas del citoesqueleto. Por último, 6) el patrón centromérico que se asocia principalmente a la forma de esclerodermia limitada conocida anteriormente como síndrome de CR.
Patrones convencionales de ANA y su relación con autoanticuerpos según el primer consenso internacional de nomenclatura estandarizada
| Patrón | Antígeno específico relacionado | Enfermedad o condición clínica relacionada |
|---|---|---|
| Nuclear | ||
| Homogéneo (AC-1) | ADN de doble cadena, cromatina, histonas, nucleosomas | LES, lupus inducido por medicamentos, artritis idiopática juvenil |
| Moteado (AC-2, 4, 5) | ||
| Moteado denso fino (AC-2) | DFS-70, LEDGF | Prevalente en individuos sanos |
| Moteado fino (AC-4) | SS-A/Ro, SS-B/La, ARN polimerasa ii y iii, Ku, Ki, Mi-2, topo 1(Scl-70) | LES, SS, SSc, miopatías inflamatorias, EMTC |
| Moteado grueso (AC-5) | hnRNP, U1RNP, Sm, ARN polimerasa iii | LES, EMTC, SSc |
| Puntos nucleares discretos | ||
| Centromérico (AC-3) | Anticentrómero CENP-A y CENP-B | Esclerosis cutánea limitada, CBP |
| Múltiples puntos nucleares (AC-6) | Sp100, proteína de leucemia promielocítica | CBP, enfermedades autoinmunes sistémicas, polimiositis, dermatomiositis |
| Pocos puntos nucleares (AC-7) | p80 coilina, SMN | LES, SSc, polimiositis, SS, individuos asintomáticos |
| Nucleolar (AC-8, 9, 10) | ||
| Homogéneo (AC-8) | PM/Scl-75, PM/Scl-100, Th, To, nucleolina, U3-snoRNP/fibrilarina | SSc, polimiositis con sobreposición de SSc |
| Grumoso (AC-9) | U3-snoRNP/fibrilarina | SSc |
| Punteado (AC-10) | ARN polimerasa I | SS, SSc |
| Membrana nuclear (AC-11, 12) | ||
| Membrana lisa nuclear (AC-11) | Lámina A, B, C nuclear o proteínas asociadas a láminas | LES, SS, artritis seronegativa |
| Membrana punteada nuclear (AC-12) | Proteínas asociadas al poro nuclear | CBP |
| Pleomórficos (AC-13, 14) | ||
| PCNA-like (AC-13) | PCNA | LES |
| CENP-F-like (AC-14) | CENP-F | Cáncer |
| Citoplasmáticos | ||
| Fibrilar (AC-15, 16, 17) | ||
| Actina/lineal (AC-15) | Actina, miosina no relacionada con el músculo | EMTC, hepatitis crónica activa, cirrosis hepática, miastenia gravis, enfermedad de Crohn, CBP, hemodiálisis |
| Filamentoso/microtúbulos (AC-16) | Vimentina, citoqueratina | Condiciones inflamatorias o infección, hemodiálisis, hepatopatía alcohólica, psoriasis, controles sanos |
| Segmentario (AC-17) | Alfa-actina, vinculina, tropomiosina | Miastenia gravis, enfermedad de Crohn, colitis ulcerativa |
| Moteado (AC-18, 19, 20) | ||
| Puntos discretos (AC-18) | GW182, Su/Ago2, Ge-1 | CBP, enfermedades autoinmunes del SNC |
| Moteado denso fino (AC-19) | PL-7, PL-12, proteína p ribosomal | Síndrome antisintetasa, polimiositis, dermatomiositis, LES, lupus neuropsiquiátrico |
| Moteado fino (AC-20) | Jo-1/histidil-ARNt sintetasa | Síndrome antisintetasa, polimiositis, dermatomiositis, esclerosis cutánea limitada |
| Reticular/AMA (AC-21) | PDC-E2/M2, BCOADC-E2, OGDC-E2, E3BP/proteína X | CBP, SSc |
| Polar/Golgi-like (AC-22) | Giantin/macrogolgin, golgin-95/GM130, golgin-160, golgin-97, golgin-245 | SS, LES, AR, EMTC, ataxia cerebelar idiopática, infecciones virales |
| Barras y anillos (AC-23) | IMPDH2 | Hepatitis C posterapia con IFN/rivabirina, LES, tiroiditis de Hashimoto |
| Mitóticos | ||
| Centrosoma (AC-24) | Pericentrina, nineina, Cep250, Cep110, enolasa | SSc, fenómeno de Raynaud, infecciones (virales y micoplasma) |
| Fibras del huso (AC-25) | HsEg5 | SS, LES |
| NuMA-like (AC-26) | Centrofilina | SS, LES, otros |
| Puente intracelular (AC-27) | Aurora cinasa B, CENP-E, MSA-2, KIF-14, MKLP-1 | SSc, fenómeno de Raynaud, malignidad |
| Capa del cromosoma mitótico (AC-28) | Histona modificada H3, MCA-1 | Lupus discoide, leucemia linfocítica crónica, SS, polimialgia |
AR: artritis reumatoide; CBP: cirrosis biliar primaria; EMTC: enfermedad mixta del tejido conectivo; IFN: interferón; LES: lupus eritematoso sistémico; SNC: sistema nervioso central; SS: síndrome de Sjögren; SSc: esclerosis sistémica.
Una vez se detectan ANA positivos en un paciente se debe abordar no solo su presencia y especificidad, sino también sus títulos y asociarlos a la clínica que presenta el paciente. Es importante resaltar que ciertos ANA tienen tan alta especificidad que se consideran predictivos para ciertas enfermedades autoinmunes, incluso antes de desarrollar signos o síntomas, como lo es el patrón nucleolar que se suele encontrar en esclerosis sistémica en su forma difusa12. Además, hay que tener en consideración que la población general sana presenta ANA positivos hasta en un 32% con títulos 1:40, un 13% con títulos 1:80 y un 5% con títulos 1:160 para interpretar los datos de la prueba3,7,12, razón por la cual el «American College of Rheumatology (ACR)» considera los títulos superiores a 1:160 como positividad13. La figura 1 muestra algunos patrones por IFI.
Anticuerpos anti-ADN de doble cadenaLos anticuerpos anti-ADN son inmunoglobulinas dirigidas contra el ADN puro o en complejo con proteínas como lo son las histonas. Estos anticuerpos son un grupo heterogéneo de inmunoglobulinas que tienen distintas especificidades, se clasifican en anti-ssADN (ADN de cadena simple) y anti-dsADN (ADN de cadena doble). Los anticuerpos anti-ssADN son los que más comúnmente se identifican, sin embargo, debido a su baja especificidad tienen muy poca relevancia clínica. De esta manera, los anticuerpos anti-dsADN tienen mayor importancia dada por su alta especificidad en el diagnóstico de LES, específicamente en aquellos con nefritis lúpica14,15.
Para la detección de estos anticuerpos se han desarrollado distintas técnicas especiales, entre ellas las más utilizadas son la IFI utilizando el organismo flagelado Crithidia luciliae (CLIFT), inmunoprecipitación de Farr y ELISA. Cada una de estas pruebas tiene distinta sensibilidad y especificidad, siendo CLIFT la más específica (97,2%), pero con la menor sensibilidad (33,6%). La prueba por ELISA presenta una sensibilidad intermedia (55,8%) con la menor especificidad (92,5%) y, por su parte, la inmunoprecipitación de Farr tiene la más alta sensibilidad (hasta 85%) y una especificidad relativamente comparable con la de CLIFT (96,7%)16–20. A pesar de esto en muchos laboratorios se prefiere el uso de CLIFT por la facilidad de realizar esta prueba en un laboratorio equipado para pruebas serológicas autoinmunes, además permite determinar las clases de anticuerpos anti-ADN y no produce reacción cruzada con anticuerpos anti-ssADN5. Debido a las diferencias en las técnicas, con resultados variables en términos de sensibilidad y especificidad, es recomendable la determinación de estos anticuerpos por lo menos mediante 2 técnicas21. La utilidad clínica del anti-dsADN se fundamenta en el apoyo diagnóstico frente a un paciente con sospecha de LES, como método de seguimiento o como marcador de futuras recaídas de la enfermedad3. Por lo anterior, un paciente con sospecha de LES y con un resultado de ANA positivo requiere de una prueba de especificidad en el que se evalúen anticuerpos anti-dsADN, los cuales pueden estar presentes en 2 tercios de los pacientes (60-83%) con LES. Otro aspecto a tener en cuenta dentro de la utilidad clínica de estos anticuerpos es que pueden estar presentes hasta un año antes o más de las primeras manifestaciones clínicas. Además, tienen una alta asociación con la actividad de la enfermedad, especialmente con la nefritis lúpica, compromiso hepático y neurológico21–23.
Anticuerpos anti-P ribosomalLos anticuerpos anti-P ribosomal están dirigidos contra 3 tipos de fosfoproteínas (P0, P1 y P2) las cuales se encuentran en la subunidad 60S ribosomal22. Estos anticuerpos se consideran específicos para LES y se detectan en el 12-16% de pacientes con esta enfermedad, incluyendo un subgrupo de pacientes con anti-dsADN negativos23. Existen distintos métodos para la detección de estos anticuerpos como ELISA, IFI, análisis de anticuerpos en fase sólida y Western blot. Es importante hacer énfasis en que estas distintas pruebas, como ELISA e IFI que son las más usadas, no se pueden comparar entre sí y son dependientes de los títulos de estos anticuerpos, es así como a mayores títulos mayor correlación entre distintos métodos. Los anticuerpos anti-P ribosomal están especialmente relacionados con la presencia de manifestaciones neuropsiquiátricas del LES, tales como psicosis y depresión24. En 1987 Bonfa et al. documentaron la asociación entre este anticuerpo y manifestaciones psiquiátricas en pacientes con psicosis secundaria a LES21. A partir de esta primera descripción, múltiples estudios han confirmado esta asociación. Además de la relación con psicosis, este anticuerpo se asocia a un riesgo aumentado a futuro de psicosis lúpica en pacientes recién diagnosticados24. También se ha reportado una relación de este anticuerpo con nefritis lúpica, especialmente cuando este anticuerpo se encuentra positivo junto con el anticuerpo anti-dsADN y en pacientes que tienen un inicio de la enfermedad a edades tempranas22. Aunque se ha reportado asociación de este anticuerpo con enfermedad hepática, la literatura es escasa y se requiere más investigación con respecto a este tema.
Anticuerpos antiantígenos extraíbles del núcleoLos anticuerpos ENA tienen su nombre debido a que inicialmente la identificación de los ANA se realizó purificando proteínas nucleares mediante técnicas de extracción que usaban soluciones salinas. De este grupo existen más de 100 antígenos identificados, pero los que tienen mayor relevancia clínica son el SSA (anti-Ro), SSB (anti-La), RNP-U1/Sm, Sm, Scl70 y Jo-13,25. Estos anticuerpos tienen como característica orientar al clínico para discriminar entre distintos tipos de enfermedades autoinmunes sistémicas y así llegar al diagnóstico e incluso, en algunos casos, brindar información acerca del pronóstico del paciente26.
Anticuerpos anti-RoLos anticuerpos anti-Ro o SSA (por sus siglas en inglés «anti-Sjögren's syndrome related antigen A») son inmunoglobulinas contra proteínas de 52kD y 60kD asociadas a ARN3,9. Estos autoanticuerpos se encuentran en varias enfermedades autoinmunes como el síndrome Sjögren (SS), LES, artritis reumatoide (AR), entre otras. El anticuerpo anti-Ro se encuentra en aproximadamente el 40-95% de pacientes con SS, principalmente son contra el antígeno 52kD, el cual hace parte de los criterios de clasificación de esta enfermedad autoinmune26. Por otro lado, en pacientes con LES se encuentra presente en el 25-50% de los mismos3 y se relaciona con la presencia de lupus cutáneo subagudo, síndrome sicca, nefritis y citopenias. Por otro lado, los pacientes con AR que presentan este anticuerpo tienen un mayor riesgo de síndrome sicca. Estos anticuerpos también se encuentran asociados a lupus neonatal ya que se han encontrado positivos hasta en el 100% de las madres que presentan esta complicación6. También se asocia a bloqueo auriculoventricular congénito, por lo que es recomendable que a las pacientes con enfermedades autoinmunes en embarazo se les realice este tamizaje. Afortunadamente la probabilidad de presentar esta complicación es muy baja, alrededor del 2-3% de los casos6,27.
Anticuerpo anti-LaEl anticuerpo anti-La o SSB es una inmunoglobulina contra la proteína La de 45kD, que hace parte del complejo antigénico Ro/La, que se constituye por 52kD Ro, 60kD Ro y 45kD La. La función biológica de la proteína La es actuar como chaperona del ARN y participar en el metabolismo del mismo, especialmente en la terminación de la ARN polimerasa iii. Estos autoanticuerpos se asocian principalmente a SS y se encuentran entre el 50% y el 87% de los pacientes. En LES se asocian a un menor porcentaje, de un 10-20%, y en otras enfermedades del tejido conectivo es mucho menos frecuente22–28. Cabe resaltar que estos anticuerpos rara vez se encuentran solos, ya que en la mayoría de los casos se presentan positivos junto con el anti-Ro, generados por una respuesta inmune con dispersión del epítope. Es por esto que está indicada la toma de estos anticuerpos cuando hay deseo de concepción por parte de mujeres con diagnóstico de LES, así como en pacientes con sospecha de LES con ANA negativo o sospecha de SS.
Anticuerpo anti-Sm y anti-RNPEl anticuerpo anti-Sm es una inmunoglobulina dirigida contra ribonucleoproteínas nucleares pequen¿as (snRNP) que forman parte del espliceosoma (complejo multiproteico encargado del empalme del ARN). Se ha encontrado que este es el anticuerpo más específico para LES, con una especificidad cercana al 97%3. Sin embargo, solo se encuentra en el 5-30% de los pacientes con esta enfermedad, por lo que su ausencia no descarta la misma9. Por su alta especificidad hace parte de los criterios de clasificación del «Systemic Lupus International Collaborating Clinics (SLICC)», así como los criterios del ACR para la clasificación de LES13. Estos anticuerpos se consideran clínicamente relevantes en el contexto de un paciente con sospecha de LES y quien presenta un anti-dsADN negativo5. En la mayoría de los casos estos anticuerpos se encuentran positivos junto con los anti-RNP.
Los anticuerpos anti-RNP reaccionan contra proteínas asociadas como U1RNA y la forma U1 snRNP, que también forman parte del espliceosoma29. Estos anticuerpos se encuentran en el 25-50% de los pacientes con LES, pero se pueden encontrar en diversas enfermedades autoinmunes también. Sin embargo, se considera que títulos altos de este autoanticuerpo se asocian a enfermedad mixta del tejido conectivo (EMTC), especialmente cuando se ha descartado la presencia de algún otro autoanticuerpo, haciendo parte de los criterios de clasificación de dicha entidad. Por otro lado, se ha encontrado asociación de este autoanticuerpo con el síndrome de Raynaud, edema en los dedos de las manos y leucopenia30.
Anticuerpo anti-Scl-70 o topoisomerasa iLos anticuerpos anti-topoisomerasa i o Scl-70 son un subtipo de ENA, que se describen desde el año 1979, los cuales se caracterizan por estar dirigidos contra una proteína nuclear no histona de 70kD31. Producen un patrón nucleolar o moteado fino mediante la medición de ANA por IFI4. Su importancia clínica radica en encontrarse en pacientes con esclerosis sistémica de la forma difusa en un 40-64%, así como en su forma limitada, el síndrome de CREST en un 10-34%. Por lo tanto, son de gran ayuda en el diagnóstico de esta enfermedad, ya que presenta una alta especificidad para esta (99,6%)5,32. Adicionalmente, se ha asociado a otras manifestaciones dentro de la entidad como la fibrosis pulmonar, síntomas intestinales, bloqueo cardiaco, disfunción diastólica y crisis renal de la esclerosis31,32. Este anticuerpo está asociado a mal pronóstico y mayor mortalidad debido a falla cardiaca derecha secundaria a fibrosis pulmonar y enfermedad pulmonar restrictiva3.
Anticuerpos anti-Jo-1El anticuerpo anti-Jo-1 está dirigido contra la enzima histidil-ARNt transferasa. Dicho anticuerpo, asociado a la presencia de otros anticuerpos anti-ARNt sintetasa se encuentra en pacientes con miositis que se caracterizan por presentar artritis, fenómeno de Raynaud, fiebre y enfermedad pulmonar intersticial, definiendo un subtipo de patología conocido como síndrome antisintetasa33. Este último ha venido siendo reconocido en los últimos años como una importante causa de miopatías inflamatorias. Usualmente la gravedad y la extensión de la enfermedad varían, siendo la miositis un poco menos severa en ausencia de este síndrome. Esta enfermedad es más frecuente en mujeres, con un promedio de edad de inicio a los 45 años. La morbimortalidad usualmente depende del compromiso pulmonar34. En la tabla 2 se describen los anticuerpos más importantes relacionados con este síndrome y sus respectivos antígenos.
Factor reumatoideEl factor reumatoide (FR) es un autoanticuerpo dirigido contra la porción Fc de las inmunoglobulinas IgG. Aunque se han descrito varios isotipos, incluyendo IgG, IgA, IgE, IgD e IgM, es el isotipo IgM el más comúnmente medido en la práctica clínica, y corresponde al FR clásico. Inicialmente el FR fue detectado en pacientes con AR por lo que recibieron su nombre, sin embargo, posteriormente se encontraron en pacientes con otras enfermedades autoinmunes, no autoinmunes e incluso en sujetos sanos35. En la tabla 3 se muestran las diferentes enfermedades que cursan con positividad de FR35.
Frecuencia del factor reumatoide positivo en diferentes condiciones clínicas
| Enfermedad | Frecuencia, % |
|---|---|
| Artritis | |
| Artritis reumatoide | 70-90 |
| Artritis psoriásica | <15 |
| Artritis reactiva | <5 |
| Otras EMTC | |
| SSp | 75-95 |
| LES | 15-25 |
| EMTC | 50-60 |
| SSc | 20-30 |
| Dermato/polimiositis | 20 |
| Vasculitis sistémicas | 5-20 |
| Infecciones | |
| Bacterianas | |
| TB | 15 |
| Sífilis primario-terciario | 8-37 |
| Klebsiella pneumoniae | 40 |
| Virales | |
| Dengue | 10 |
| Hepatitis A, B, C | 25 |
| Herpes | 10-15 |
| VIH | 10-20 |
| Parásitos | |
| Chagas | 15-25 |
| Malaria | 15-18 |
| Toxoplasma | 10-12 |
| Otras | |
| Cirrosis hepática | 25 |
| CBP | 45-70 |
| Malignidad | 5-25 |
CBP: cirrosis biliar primaria; EMTC: enfermedad mixta del tejido conectivo; LES: lupus eritematoso sistémico; SSc: esclerosis sistémica; SSp: síndrome de Sjögren primario; TB: tuberculosis; VIH: virus de la inmunodeficiencia humana.
En condiciones fisiológicas, los anticuerpos con actividad FR cumplen funciones como aclaramiento de complejos inmunes, mejoran la presentación de antígenos y neutralizan ciertos patógenos (herpes símplex virus y tripanosoma)36. En pacientes sanos la prevalencia puede ser tan alta como del 30%, aunque varía según la población racial. En la población sana, los títulos de FR son bajos y son producidos principalmente por linfocitos B (LB) CD5 de baja afinidad35.
En condiciones no autoinmunes, donde se detecta un FR positivo, como en algunas infecciones agudas y crónicas, el FR detectado es transitorio y no perjudicial. Se atribuye al hecho de que en condiciones fisiológicas, estos anticuerpos tienen la habilidad de aumentar la depuración de complejos inmunes y los LB productores de FR se pueden comportar como células presentadoras de antígenos como respuesta a microorganismos infecciosos. El agente infeccioso que más se ha relacionado con niveles altos de FR es el virus de la hepatitis C35. Aunque otros microorganismos relacionados con la presencia de FR son tuberculosis, sífilis y lepra37.
Además, se ha visto implicado en la patogénesis de varias enfermedades autoinmunes debido a que forma inmunocomplejos y activa eficientemente el complemento36. Las enfermedades autoinmunes donde se ha documentado la presencia de FR son: el SS, la crioglobulinemia, el LES, la EMTC, entre otras. Las enfermedades autoinmunes que más frecuentemente se asocian a títulos altos de FR, además de la AR, son la crioglobulinemia mixta y el SS. Incluso, se cree que la activación de clonas de LB productores de FR está involucrada en la patogénesis del desarrollo de desórdenes linfoproliferativos en cerca del 5% de los pacientes con esta última condición38.
En AR el FR tiene una sensibilidad del 60-90% y una especificidad del 75%35. En los pacientes que padecen esta enfermedad autoinmune se pueden detectar los 3 isotipos (IgM, IgA e IgG) hasta en un 52%, pero en otras enfermedades del tejido conectivo están presentes solo en el 5% de los pacientes. La presencia de FR de isotipo IgA e IgG en ausencia de IgM es más prevalente en la EMTC que en la AR. Por otra parte, la presencia de FR de ambos isotipos IgM e IgA es casi algo exclusivo de la AR35.
En cuanto a la AR, se han detectado diferentes aspectos en los que la medición de títulos de FR ha impactado clínicamente. Los cuales son:
- •
La presencia de títulos altos de FR se correlaciona con un mayor riesgo de desarrollar AR. El riesgo puede aumentar hasta 26 veces si los títulos iniciales fueron>100UI/mL39.
- •
La presencia del isotipo IgA se relaciona con manifestaciones extraarticulares, incluyendo vasculitis39.
- •
La presencia de FR en pacientes con AR se relaciona con formas más agresivas de la enfermedad, con mayor severidad en la discapacidad funcional, dada por enfermedad más erosiva y presencia de nódulos reumatoides39.
- •
Algunos estudios han demostrado que la terapia inmunosupresora puede descender los niveles de FR, pero clínicamente es inútil medir los títulos de FR como seguimiento de la enfermedad35,39.
- •
Medir los títulos de FR para predecir la respuesta al tratamiento se considera limitado y se ha encontrado variabilidad entre distintos estudios por lo que continúa en investigación40,41.
- •
Pacientes con títulos altos de FR se benefician de la terapia reductora de LB, como rituximab35,42.
Debido al gran número de enfermedades donde se puede encontrar la presencia de FR, es importante tener claro los escenarios clínicos en los cuales se debe solicitar la prueba; y solo realizarla en un contexto clínico3. Se debe realizar la prueba en un paciente con:
- •
Artritis inflamatoria temprana sin una causa aparente.
- •
Sospecha clínica de AR.
- •
Antes de iniciar la terapia anti-LB en un paciente con AR.
- •
Síntomas secos (síndrome seco).
- •
Paciente pediátrico con poliartritis crónica.
Para la medición de FR existen varios métodos. Inicialmente se usaron las técnicas de aglutinación, entre las cuales la más usada era la prueba de aglutinación con látex. La prueba de aglutinación con látex es una prueba económica y fácil de realizar que proporciona información cualitativa. Posteriormente, se desarrollaron métodos que proporcionan información cuantitativa, como lo son la medición por nefelometría, turbidimetría y ELISA. La nefelometría y turbidimetría no permiten identificar isotipos, a diferencia de la medición por ELISA que sí deja identificar los diferentes isotipos de inmunoglobulinas. Sin embargo, la prueba por ELISA alcanza una sensibilidad del 53% y una especificidad del 99% en el diagnóstico de AR43.
Actualmente se han desarrollado nuevos métodos diagnósticos que utilizan técnicas de inmunoanálisis. Dentro de estas se encuentra la medición de FR por electroquimioluminiscencia, el cual proporciona una medición rápida, una alta sensibilidad y especificidad, un amplio rango de medición, con un volumen reducido de muestra.
El resultado de la medición de FR depende de la técnica con la que se realice la medición, la cual varía según el laboratorio. Sin embargo, la Organización Mundial de la Salud sugirió estandarizar el resultado, y todo laboratorio debe reportar el resultado en unidades internacionales: con valores por encima de 20UI/mL es positivo y valores por encima de 50UI/mL se consideran altos3. Pero en la actualidad, la interpretación de los resultados depende del laboratorio y los reactivos utilizados teniendo valores normales hasta 14UI/mL y en otros laboratorios<8UI/mL.
Anticuerpos contra péptido citrulinado cíclicoConsiderando que la AR es una enfermedad autoinmune, crónica, que afecta al 1-2% de la población mundial y tiene un alto impacto en la morbimortalidad de las personas que la padecen, es necesario tener un diagnóstico acertado y oportuno44. Inicialmente se contaba con el FR como única prueba de laboratorio diagnóstica para la enfermedad. Sin embargo, debido a las dificultades asociadas a la interpretación del FR, mencionadas anteriormente (principalmente la baja especificidad), se comenzó desde los años 60 del siglo pasado a buscar anticuerpos con mayor especificidad para el diagnóstico de esta condición. De esta forma, y luego de varios anticuerpos que mostraban una mayor especificidad (como el factor antiperinuclear y los anticuerpos antiqueratina), en 1998 se describió que en los pacientes con AR se encontraba la producción de anticuerpos contra proteínas con alto contenido de citrulina (que correspondían al antígeno de los anticuerpos mencionados previamente). Estas descripciones permitieron el desarrollo de una prueba diagnóstica más específica utilizando péptido cíclico citrulinado sintético por medio de la técnica de ELISA, razón por la que se denominaron anticuerpos antipéptido citrulinado cíclico (CCP). Estos anticuerpos pueden ser detectados en el 80% de los pacientes con AR con una especificidad mayor del 98%44. Los anti-CCP son anticuerpos dirigidos contra proteínas citrulinadas como la filagrina, la vimentina, la enolasa A, el fibrinógeno, el colágeno tipo i y ii, la actina, las histonas y las proteínas de choque térmico HSP90 (heat shock protein), entre otras45. Los anti-CCP son anticuerpos de isotipo IgG en su mayoría, aunque también se pueden encontrar isotipos IgA, IgM e IgE46,47.
La primera prueba anti-CCP que se creó usaba como antígeno un péptido cíclico derivado de la filagrina, pero este no estaba presente en las articulaciones inflamadas. Por ello se creó la prueba anti-CCP de segunda generación, en la cual se aislaron del suero de pacientes con AR cerca de 12 millones de péptidos, escogieron los mejores péptidos citrulinados generando de esta manera la prueba. Posteriormente, se introdujo el término de anticuerpos contra péptidos citrulinados (ACPA), el cual hace referencia a los autoanticuerpos de AR para los cuales se realizó la detección usando proteínas/péptidos citrulinados de autoantígenos putativos asociados a AR en lugar de filagrina. En la prueba anti-CCP de segunda generación se pueden detectar por medio de ELISA la gran mayoría de los ACPA presentes en pacientes con AR48. Sin embargo se han desarrollado otras pruebas que miden ACPA específicos, como lo es el anti-MCV (anticuerpos dirigidos contra la vimentina citrulinada mutada), anti-CCP3, entre otros. A pesar de que se hayan desarrollado nuevas pruebas ACPA, la prueba anti-CCP de segunda generación continúa teniendo la más alta sensibilidad y especificidad, por lo que se considera el estándar de oro y se prefiere para el diagnóstico de AR49,50.
El impacto clínico que tienen estos anticuerpos es tan relevante que han sido incluidos dentro de los criterios clasificatorios del 2010 para AR y forman parte de una clasificación de los pacientes con AR: pueden ser clasificados en ACPA positivo y ACPA negativo45,49,50. Sin embargo, trabajos recientes indican que aunque el anti-CCP tiene una alta especificidad para el diagnóstico de AR, puede ser factor pronóstico en otras enfermedades cuya evolución clínica conlleva a enfermedades del tejido conectivo, como es el caso del reumatismo palindrómico, en el cual aproximadamente el 30-50% de los pacientes evolucionan hacia AR44. De esta misma forma se ha encontrado una prevalencia hasta del 15% en una cohorte de pacientes con esclerodermia51.
Como se mencionó anteriormente, la utilidad clínica que tiene la detección de los ACPA va desde el diagnóstico oportuno y la elección del tratamiento hasta el pronóstico en los pacientes que padecen AR. Se han descrito varias características que le confieren la gran importancia clínica que tiene la detección de estos anticuerpos en el espectro de esta enfermedad. En primer lugar, la característica más significativa desde el punto de vista clínico que tiene la presencia de estos anticuerpos es la aparición temprana44. La diversificación de los ACPA es un acontecimiento temprano en la fisiopatología de la AR, que ocurre antes de que la enfermedad sea reconocida clínicamente en muchos casos44,45,48,52. Se ha descrito que el 40-70% de los pacientes con signos y síntomas de artritis, con menos de 12 semanas de evolución, presentan los anticuerpos anti-CCP positivos en la consulta con reumatología44. Además, se asocia a una rápida progresión a AR durante el primer año de seguimiento, cuando se detecta en pacientes con artritis indiferenciada45. Se ha visto que entre los pacientes con artralgias sin diagnóstico de AR que tienen un anti-CCP positivo, más del 90% desarrollan AR en los siguientes 3 años48.
Otra característica clínica que se ha descrito es que la presencia de anti-CCP en los pacientes con AR diagnosticada se asocia al desarrollo de una enfermedad más erosiva, según hallazgos radiográficos45,48. Anteriormente se había establecido una relación entre la positividad de FR IgM como predictor de la progresión radiográfica de erosiones óseas, sin embargo, hoy en día se ha demostrado que el FR positivo está coexpresado con ACPA positivo y es el ACPA positivo el que se asocia con un curso erosivo48. El FR por sí solo no contribuye a la progresión de la enfermedad, comparado con los ACPA que sí contribuyen por sí solos.
Por otro lado, la presencia de ACPA en los pacientes con AR, se ha asociado con polimorfismos del gen HLA-DRB1*04 (principal factor de riesgo genético implicado en AR) y a la presencia de anticuerpos anti-peptidil arginina desaminasa (PAD)445,53. La PAD es la enzima que se encarga de citrulinizar las proteínas extracelulares que contengan arginina. Se relaciona con la patogénesis de la AR, debido a que durante un estado inflamatorio las células sufren apoptosis o necrosis, liberando proteínas que son susceptibles del efecto de la PAD. La presencia de anticuerpos anti-PAD4 se pueden detectar hasta en el 20-40% de los pacientes con AR anti-CCP positivo. Además, se ha visto que el riesgo de desarrollar ACPA se asocia a factores medioambientales como el consumo de tabaco y que la presencia de los anticuerpos, a su vez, aumenta el riesgo de desarrollar enfermedad coronaria isquémica48,54,55.
Dentro de la última característica de utilidad clínica, está la capacidad de los anti-CCP de predecir el pronóstico de la AR. Ciertos estudios confirman que pacientes con AR ACPA positivo tienen mayores tasas de remisión cuando son tratados con metotrexate comparados con los pacientes ACPA negativo45,48. Los ACPA son los más potentes predictores del pronóstico de la AR, por lo que existen al menos 4 razones por las que se debe realizar y comparar la prueba: debido a que tienen la habilidad de confirmar y predecir el desarrollo a AR, la progresión radiográfica, la remisión y la respuesta al tratamiento modificador sintético y biológico. La capacidad de predecir el pronóstico en pacientes con AR es posible debido a que se ha descrito que en pacientes con AR anti-CCP positivos hay presencia de más centros germinales en infiltrados de tejido sinovial48. Por lo que los pacientes con AR anti-CCP positivo se asocian a un peor pronóstico, comparado con anti-CCP negativo.
En resumen, el impacto clínico que los ACPA han tenido en el escenario de la AR ha sido muy significativo, por lo que fueron incluidos dentro de los criterios de clasificación de AR del ACR/EULAR del 201049,50. Los aspectos que se deben tener en cuenta al medir estos anticuerpos son:
- •
Los ACPA son los anticuerpos más específicos para el diagnóstico de AR.
- •
Su presencia es útil para el diagnóstico y clasificación de la AR y no es útil para seguimiento. Por lo que no debe solicitarse nuevamente, una vez la prueba sea positiva.
- •
Los títulos no se correlacionan con la actividad de la enfermedad.
Los anticuerpos anticitoplasma de neutrófilo (ANCA) fueron inicialmente descritos en pacientes con glomerulonefritis pauciinmune en 198256. Sin embargo, su importancia clínica radica en su asociación con 3 enfermedades: la granulomatosis con poliangitis, la poliangitis microscópica, también se ha visto asociada a un gran porcentaje de pacientes con granulomatosis eosinofílica con poliangitis (síndrome de Churg-Strauss).
Estos anticuerpos están dirigidos contra antígenos presentes en los gránulos del citoplasma de los neutrófilos y los lisosomas de los monocitos; aunque existen varios antígenos, aquellos que tienen importancia clínica son la mieloperoxidasa (MPO) y la proteinasa 3 (PR3)57.
Durante varias décadas se había cuestionado sobre la capacidad patogénica de los ANCA, sin embargo, en varios estudios se ha logrado demostrar esta propiedad. Lo que se ha visto es que cuando los ANCA se unen a su antígeno diana activan los neutrófilos e inducen degranulación, con la consiguiente liberación de enzimas, citoquinas proinflamatorias y la generación de un estallido respiratorio conduciendo al daño endotelial y, eventualmente, al proceso vasculítico58.
La prueba para medición de ANCA se debe realizar solo mientras haya una sospecha clínica, de lo contrario la prueba tiene muy baja sensibilidad. Por lo anterior, la guía «Clinical ANCA Test-ordering Guidelines» propone como parte de la declaración del consenso internacional en la toma y reporte de pruebas ANCA del 2003 la toma de la prueba en los pacientes que por lo menos cumplan una de las condiciones clínicas propuestas en los criterios (tabla 4)57,59. Al realizar la prueba solo a los pacientes que cumplan con alguno de los criterios descritos, la sensibilidad y la especificidad para la detección de las vasculitis asociadas a ANCA aumentan al 95% y al 90%, respectivamente60.
Indicaciones clínicas para la medición de los anticuerpos anticitoplasma de neutrófilo
| Glomerulonefritis, especialmente la glomerulonefritis rápidamente progresiva |
| Hemorragia pulmonar, especialmente en el síndrome pulmón-riñón |
| Vasculitits cutánea con características sistémicas |
| Múltiples nódulos pulmonares |
| Enfermedad destructiva crónica de las vías respiratorias superiores |
| Sinusitis u otitis de larga duración |
| Estenosis traqueal subglótica |
| Mononeuritis múltiple u otra neuropatía periférica |
| Masa retroorbital |
Existen 2 técnicas por las que se puede hacer la medición de los anticuerpos: IFI y ELISA. Teniendo en cuenta que la prueba por IFI es más sensible y por ELISA es más específica, las guías recomiendan la combinación de ambas pruebas para la detección de la presencia de ANCA en pacientes con sospecha de vasculitis asociadas a ANCA60. Cuando se realiza la prueba con la técnica IFI se permite identificar ciertos patrones específicos, que se han asociado al antígeno específico que reconoce el anticuerpo. El patrón citoplasmático (c-ANCA), el cual se observa al microscopio de fluorescencia como una tinción difusa de los gránulos presentes en el citoplasma de la célula, que es más prominente en el centro entre cada lóbulo del neutrófilo, se asocia a la presencia de anticuerpos anti-PR3. Por otro lado, el patrón perinuclear (p-ANCA), muestra la tinción perinuclear a lo largo de todo el núcleo de la célula y se asocia con la presencia de anticuerpos anti-MPO. También se ha visto un patrón atípico (a-ANCA), el cual se describe como una tinción perinuclear que no involucra toda la extensión del núcleo o como una tinción citoplasmática plana difusa, pero es la combinación de ambos patrones, perinuclear y citoplasmático61. El patrón identificado por medio de la técnica de IFI se relaciona a un anticuerpo específico el cual se logra identificar con la técnica de ELISA: anti-MPO para p-ANCA y anti-PR3 para c-ANCA. En el contexto clínico, la identificación de cada patrón se ha visto asociada a una enfermedad específicamente. Por ejemplo, la granulomatosis con poliangitis, anteriormente conocida como granulomatosis de Wegener, se ha visto asociada con c-ANCA en un 90% cuando la enfermedad está activa y de forma sistémica (40% de la forma localizada), mientras la poliangitis microscópica y la granulomatosis eosinofílica con poliangitis se han visto asociadas a p-ANCA61. Por otra parte, los a-ANCA no se asocian a vasculitis, sino que se han visto asociados a exposición a fármacos, enfermedad inflamatoria intestinal y AR; y al realizar la prueba por medio de ELISA, no hay presencia de antígenos específicos61.
El consenso internacional establecido para la toma de pruebas y reporte de los ANCA recomienda tomar ambas pruebas, debido a que, aunque haya una concordancia de hasta el 85% entre las 2 pruebas, un 10% de los pacientes son positivos solo por IFI y un 5% solo por ELISA57.
Además del valor diagnóstico que tiene la realización de la prueba, se ha estudiado la posibilidad de que tenga utilidad clínica en la detección de actividad de la enfermedad, una vez se haya realizado el diagnóstico. Algunos estudios hacen referencia a la relación que existe entre el aumento en los títulos de los ANCA y la recaída de la enfermedad, sin embargo, se requiere de más estudios para corroborar esta relación62,63. A pesar de ello, actualmente se cuenta con un score clínico llamado BVAS, el cual es de gran utilidad para detectar la actividad de la enfermedad64.
Anticuerpos antifosfolípidosLos anticuerpos antifosfolípidos (aPL) son un grupo heterogéneo de anticuerpos de isotipo IgG, IgM e IgA dirigidos contra fosfolípidos, complejos de fosfolípido-proteínas o proteínas de unión a fosfolípidos, localizados en la membrana de células endoteliales, plaquetas y demás células involucradas en la cascada de la coagulación65,66. Dentro de los antígenos que son reconocidos por estos anticuerpos se encuentran: la beta-2-glucoproteína i, las cardiolipinas, la protrombina, la fosfatidilserina, el fosfatidilinositol, la anexina v, la proteína C, la proteína S, el activador del plasminógeno tisular, el factor vii, factor xi, factor xii, componente del complemento C4 y el factor del complemento H67.
Los aPL forman parte de la patogénesis del síndrome de anticuerpos antifosfolípidos (SAF), una enfermedad sistémica autoinmune, caracterizada por trombosis recurrente y morbilidad del embarazo en pacientes con aPL.
La presencia de estos anticuerpos es fundamental para el diagnóstico de SAF, debido a que se requiere tener al menos un criterio clínico y un criterio de laboratorio para considerar el diagnóstico de la enfermedad. De los anticuerpos, mencionados anteriormente, que están incluidos en los criterios internacionales de clasificación para el SAF, son aquellos dirigidos contra la beta-2 glicoproteína i y cardiolipinas de isotipo IgG e IgM. Además de una prueba de coagulación modificada, llamada anticoagulante lúpico (AL)59. El SAF se clasifica en primario, cuando no existe otra enfermedad autoinmune relacionada, y secundario cuando se relaciona con otras enfermedades autoinmunes como LES, esclerosis sistémica, SS, AR, púrpura trombocitopénica idiopática, entre otras67,68.
Aunque, se debe tener en cuenta que los aPL también se pueden encontrar en personas sin manifestaciones clínicas. Se ha visto que los anticuerpos anticardiolipinas (aCL) se encuentran a títulos bajos y transitorios, se pueden hallar hasta en un 10% de donantes de sangre normales69, pero también se puede encontrar la presencia de anticuerpos persistentes a títulos moderados o altos, contra cardiolipina/B2GPI o AL en menos del 1% de pacientes sanos. La prevalencia de aPL positivos aumenta con la edad. Se ha documentado que en pacientes asintomáticos que tienen unos aPL positivos persistentemente por décadas, la probabilidad de que se desarrolle el SAF es relativamente baja70.
El primer antígeno blanco de los aPL que se identificó fue la cardiolipina en 194168. Sin embargo, en 1990 se reportó que los aCL están dirigidos contra el complejo B2GPI/cardiolipina y no contra la cardiolipina sola71. Aunque los aCL son positivos en el 80% de los pacientes con SAF, también se pueden encontrar en enfermedades infecciosas, como sífilis, fiebre Q e infección por VIH. En estas condiciones infecciosas, los títulos suelen ser bajos, el isotipo dominante es IgM y generalmente no se asocian a fenómenos trombóticos67. El método utilizado para la medición de estos anticuerpos es por medio de ELISA, la prueba es sensible pero no específica para el diagnóstico de SAF. Aunque sigue teniendo una gran relevancia clínica, por lo que están incluidos dentro de los criterios clasificatorios, la presencia de aCL de isotipo IgG e IgM, en títulos medio o altos (>40GPL o MPL, o por encima del percentil 99) no debe sustituir la medición de los anti-B2GPI59.
Además de los criterios para SAF, también son útiles clínicamente debido a que están incluidos en los criterios para LES del SLICC, incluyendo el isotipo IgA13. Debido a que la presencia de aCL de isotipo IgA en los pacientes con enfermedad autoinmune sistémica indica que se encuentran en un subgrupo de pacientes en riesgo de desarrollar unas manifestaciones clínicas específicas. Está asociado a manifestaciones como: trombocitopenia, úlceras orales y vasculitis59,72. Con respecto a los aCL de isotipo IgA y el diagnóstico de SAF, aunque no estén incluidos dentro de los criterios internacionales de clasificación, son útiles clínicamente cuando se tiene un paciente con una alta sospecha clínica de SAF pero con AL, anti-B2GPI IgG e IgM, y aCL IgG e IgM negativos en varias ocasiones, condición en la que está indicado realizar la prueba57.
Con relación al AL, este término se utilizó por primera vez en el año 1972, pero el fenómeno se viene estudiando desde 1952, cuando Conley y Hartmann reportaron la prolongación del tiempo de protrombina en pacientes con LES71. En 1972, se describió como un inhibidor directo contra los fosfolípidos de la cascada de coagulación, que afectaba principalmente la conversión de protrombina a trombina72. En 1983, se describió en detalle un síndrome que incluye trombosis o morbilidad del embarazo que ocurre en pacientes con evidencia de laboratorios de la presencia de aPL, descripción oficial del SAF73. Desde entonces se han descrito varios datos que confirman la importancia de este anticuerpo en la patogénesis, diagnóstico y pronóstico del SAF. El AL es la prueba de aPL más fuerte en predecir complicaciones del embarazo y un predictor de trombosis más específico al compararlo con aCL67. A diferencia de las demás pruebas de aPL que se realizan por medio de ELISA, la medición del AL es una prueba funcional que utiliza plasma en lugar de suero y requiere un proceso de 4 pasos: 1) la demostración de una prueba de coagulación dependiente de fosfolípidos prolongada, como un tiempo parcial de tromboplastina) o la prueba de veneno de víbora de Russell diluido; 2) no corrección de la prueba de coagulación prolongada al adicionar plasma normal pobre en plaquetas, lo que demuestra la presencia de un inhibidor; 3) la corrección de la prueba de coagulación prolongada, al adicionar plasma rico en plaquetas (las plaquetas tienen fosfolípidos en su membrana, lo que demuestra la dependencia de fosfolípidos del inhibidor que prolonga los tiempos de coagulación); y por último, 4) se deben excluir otros inhibidores74. Teniendo en cuenta que se trata de un procedimiento complejo y minucioso, por lo que es susceptible de errores que afectan el resultado, la sociedad internacional de trombosis y homeostasis, creó en 1995 las guías de detección de la presencia de AL, para estandarizar la prueba y disminuir los posibles errores75.
Se debe considerar que existe la posibilidad de obtener falsos positivos y falsos negativos, cuando el paciente está en terapia anticoagulante con heparina o warfarina. Aunque no existe una guía que determine el valor de positividad de la prueba y esta difiere entre los diferentes laboratorios, los criterios de clasificación internacionales del SAF mencionan un tiempo de coagulación (test/control)>1,1 para dRVTt y >1,2 para el tiempo de coagulación de kaolín, estos valores son aceptados por muchos laboratorios59.
La última prueba de aPL en ser incluida dentro de los criterios internacionales de SAF, fue la medición de anticuerpos anti-B2GPI en el 2006. Sin embargo, desde 1990 se sabe sobre el antígeno B2GPI y cómo al unirse con la cardiolipina forma complejos que son reconocidos por aPL76,77. El antígeno B2GPI en condiciones fisiológicas participa como inhibidor de la activación de la vía intrínseca de la cascada de coagulación, participa en la agregación plaquetaria, afecta la fibrinólisis, angiogénesis, apoptosis y aterogénesis78. Por lo que al existir anticuerpos que actúan en contra de este antígeno, se puede conocer algo de la patogénesis de las enfermedades ya mencionadas anteriormente. En criterios de clasificación internacionales del SAF, se identifica al B2GPI como el autoantígeno más importante clínicamente en el SAF59, debido a que representa un factor de riesgo independiente para trombosis y complicaciones durante el embarazo. Los anticuerpos anti-B2GPI se miden por medio de análisis inmunológicos (como ELISA o quimioluminiscencia) y se pueden identificar 3 isotipos: IgA, IgG e IgM. Según los criterios internacionales de SAF, están incluidos los isotipos IgG e IgM y se consideran positivos cuando están por encima del percentil 9959. En cuanto al isotipo IgA, se ha reconocido su importancia clínica y, aunque no haya sido incluido dentro de los criterios para SAF, se debe medir cuando el paciente tiene una clínica altamente sugestiva de esta condición y el AL, aCL IgM e IgG, y los anti-B2GPI IgM e IgG son negativos57,59. Además, estos anticuerpos han ganado relevancia clínica en el diagnóstico de LES, incluso fueron incluidos dentro de los criterios de clasificación del SLICC en el 201213.
Después de mencionar las 3 pruebas incluidas dentro de los criterios de SAF, es importante recalcar que se deben realizar los 3 procedimientos para confirmar la presencia de aPL. Además, las guías, mencionadas anteriormente hacen énfasis en repetir la prueba 12 semanas después, debido a que estos anticuerpos pueden estar presentes en enfermedades no autoinmunes como infecciones, llevando a un diagnóstico erróneo. Y al igual que en los anteriores anticuerpos mencionados en el artículo, es de suma importancia que se realicen las pruebas de medición de aPL en un contexto clínico59,75. Las condiciones clínicas en las cuales se deben solicitar las pruebas para aPL son:
- 1.
Pérdidas fetales recurrentes.
- 2.
Trombosis venosa sin causa aparente.
- 3.
Trombosis arterial sin causa aparente.
- 4.
Todo paciente con LES.
- 5.
Hallazgo incidental de prolongación del tiempo parcial de tromboplastina en pacientes asintomáticos.
El término SAF seronegativo ha sido un tema muy controversial desde hace un tiempo. El término se emplea para definir a los pacientes con hallazgos clínicos sugestivos de un SAF, pero en los cuales las pruebas de rutina usadas para la medición de aPL son persistentemente negativas. En estos pacientes no se detectan los anticuerpos incluidos en los criterios diagnósticos, pero sí se encuentran otros anticuerpos como B2GPI de isotipo IgA, aCL de isotipo IgA, anticuerpos antifosfatidilserina o antifosfatidilcolina, entre otros66.
Conclusión: puntos clave sobre la correcta interpretación de los anticuerpos en autoinmunidad y enfermedades autoinmunes- 1.
Los ANA son un grupo de autoanticuerpos que reconocen macromoléculas integradas en la estructura del núcleo celular y algunos componentes citoplasmáticos.
- 2.
Para la interpretación correcta de los ANA se debe tener en cuenta el consenso internacional de nomenclatura estandarizada (2016).
- 3.
Los anticuerpos anti-dsADN tienen una gran importancia en el diagnóstico y seguimiento de los pacientes con LES dada su alta especificidad (>95%).
- 4.
Los anticuerpos anti-P ribosomal se relacionan con manifestaciones neuropsiquiátricas del LES; así como con nefritis lúpica cuando se encuentra positivo junto con el anti-dsADN.
- 5.
Los anticuerpos anti-Ro o SSA se encuentran principalmente en SS por lo que hacen parte de los criterios clasificatorios de esta. Además se relacionan con bloqueo cardiaco congénito.
- 6.
El anticuerpo anti-La o SSB también se halla principalmente asociado a SS. En la mayoría de los casos se encuentra junto con el anti-Ro, generados por una respuesta inmune con dispersión del epítope.
- 7.
El anticuerpo anti-Sm, a pesar de no encontrarse sino en hasta un 30% de los pacientes aproximadamente, es el más específico para LES, con una especificidad cercana al 97%.
- 8.
El anticuerpo anti-RNP también se ha asociado a pacientes con LES, sin embargo, títulos altos se asocian a EMTC, haciendo parte de los criterios de clasificación de dicha condición.
- 9.
Los anticuerpos anti-Scl70 tienen una alta especificidad especialmente en esclerosis sistémica de la forma difusa, limitada y síndrome de CREST; así como con ciertas manifestaciones clínicas especialmente pulmonares.
- 10.
El anticuerpo anti-jo1 se ha asociado a un subtipo de patología de miopatía inflamatoria conocido como el síndrome antisintetasa.
- 11.
El FR puede encontrase a títulos bajos en población sana. Enfermedades no autoinmunes pueden elevar el FR de manera transitoria; la enfermedad autoinmune donde tiene mayor utilidad clínica es la AR.
- 12.
Los anti-CCP, por su alta especificidad en AR, hacen parte de los criterios clasificatorios, sobre todo porque su presencia se relaciona con aparición temprana de la enfermedad y mayor erosión ósea.
- 13.
La sensibilidad y especificidad de los ANCA (MPO y PR3) es bastante alta cuando clínicamente existe la sospecha de una vasculitis asociada.
- 14.
Los aPL pueden encontrarse a títulos bajos en personas sanas. Además de formar parte de los criterios clasificatorios del SAF, se debe recordar que estos anticuerpos se deben repetir 12 semanas después ya que ciertas enfermedades no autoinmunes pueden elevarlo.
Ninguno de los autores declara conflicto de intereses.