Obtener continuidad ósea en un modelo experimental de resección segmentaria en la diáfisis del fémur mediante tratamiento con células mesenquimáticas indiferenciadas comprometidas al linaje osteogénico.
Material y métodoSe obtuvieron células mesenquimáticas indiferenciadas a partir de médula ósea de ratas Wistar singénicas, se diferenciaron al linaje osteogénico y se embebieron en bloques de hidroxiapatita. Se implantaron en una resección segmentaria en la diáfisis del fémur, que se sintetizó con una placa de 1,5mm de grosor. Se calcularon distribuciones binomiales estableciéndose un grupo experimental y 3 de control, constituidos por 8 elementos cada grupo. Grupo I, relleno con aloinjerto; grupo ii, con hidroxiapatita; grupo iii, con hidroxiapatita embebida con células osteocomprometidas; grupo iv con células osteocomprometidas mediante cultivo tridimensional. Se realizó estadística descriptiva con distribución de frecuencias mediante la prueba de Fisher, considerándose significativo el valor de p<0,05.
ResultadosEl grupo i presentó buena consolidación, sin rotura de placas. El grupo ii mostró tejido fibroso y rotura de todas las placas. El grupo iii mostró tejido óseo, pero en todos los casos se rompieron las placas. El grupo iv mostró consolidación sin rotura de placas.
ConclusiónLa terapia mediante células mesenquimáticas indiferenciadas en cultivos tridimensionales produce tejido óseo y asegura una estabilización mecánica permanente. Limitaciones: antes de la inferencia humana es necesario realizar el experimento en grupos con más elementos.
To achieve bone continuity in an experimental model of segmental resection of femur bone by applying a treatment with committed to osteogenic bone linage mesenchymal stem cells.
Material and methodBone marrow mesenchymal stem cells, obtained from syngeneic Wistar murine, were committed into osteogenic lineage and embedded within a hydroxipatite block. They were implanted in an experimentally created diaphyseal femur resection model. The diaphysis was synthetized with a 1.5mm thick plate. In order to calculate binomial distributions, we stablished one experimental and 3 control groups of 8 elements each: Group I, filling the gap with allograft; group ii, filling with a hydroxyapatite block without cells; group iii, filling with the hydroxyapatite block embedded with committed cells, and group iv, with the hydroxyapatite embedded with osteoinduced cells in a 3 dimensions TRAP culture. Descriptive analysis was performed by frequency distribution and Fisher statistic test. Level of statistical significance was considered at P<.05.
ResultsGroup I presented good bone consolidation and no plate breakage. Group II showed fibrous but non-bone tissue, with rupture of all plates. Group III showed bone tissue in all cases, but the plates broke in all of them, while in group iv bone consolidation was achieve without any plate rupture.
ConclusionCell therapy with mesenchymal stem cells, trained in a 3 dimensions cell culture, produces bone tissue and ensures the permanence of the mechanical stabilization performed in a segmental resection model. Limitations: A study with a larger sample size is necessary before planning the human inference.
En EE. UU. se utilizan anualmente más de 200.000 casos con aloinjertos1. La falta de morbilidad del sitio donante, el éxito general de los resultados y la disminución de los tiempos quirúrgicos hacen del aloinjerto una alternativa atractiva al autoinjerto2,3. Sin embargo, los altos costes y los riesgos como la transmisión viral hacen del aloinjerto un sustituto imperfecto4.
La ingeniería tisular se presenta como una alternativa a los autoinjertos y aloinjertos para la obtención de hueso con el objetivo de llevar a cabo alguna acción terapéutica5.
El desarrollo de un sistema de cultivo de células de médula ósea (MO) en un gel de colágeno permite aislar, amplificar e inducir hacia el linaje condroosteogénico una población de células que expresan marcadores de tales tejidos in vitro y forman cartílago y hueso ectópicos cuando se las implanta in vivo6.
En modelos animales de osteogénesis, se ha demostrado que la administración de factores de crecimiento transformador-beta 1 (TGF-β1) estimula la actividad de los osteoblastos, provocando la formación de nuevo tejido óseo, y que están influidos por el estado de diferenciación de las células diana, las citocinas del microambiente y las condiciones del cultivo6.
Como fuente celular para la formación de tejido osteocartilaginoso se utilizan las células madre mesenquimales (MSC) indiferenciadas o pluripotentes7. Estas células, en virtud de algunos estímulos con mediadores moleculares, pueden diferenciarse a un fenotipo osteocondroide, entre los que se encuentran la utilización de un medio de cultivo sin suero o la adición de dexametasona, ascorbato, TGF-β o las proteínas morfogenéticas de hueso (BMP), siendo el método de cultivo tridimensional a alta densidad uno de los más empleados para este fin8,9.
Las MSC deben cumplir una serie de condiciones: ser adherentes en cultivo plástico, ser capaces de diferenciarse a hueso, cartílago y grasa, y ser fenotípicamente positivas para CD105, CD73 y CD90, y negativas para CD45, CD34, CD11b, CD14, CD79a y HLA-DR10.
Las BMP fueron identificadas originalmente por Urist como componentes orgánicos encontrados en la matriz ósea que podrían inducir la formación de hueso ectópico11. La BMP-2 es una de las citocinas osteoinductoras más potentes y se ha demostrado que aumenta la formación de cartílago y hueso. La TGF-β1, en combinación con BMP-2, mejora fuertemente la formación de hueso ectópico, con un volumen óseo resultante 5 veces mayor que el inducido por BMP-2 en modelos animales12.
La utilización en cultivos experimentales de factores con dominios de unión al colágeno nos permite controlar selectivamente el proceso de cultivo celular y, de manera específica, la línea condroosteogénica13.
A partir de MO de múridos se puede seleccionar en cultivo, mediante la adición adecuada de rhTGF-ß1-F2 y rhBMP-2, una población celular que expresa marcadores de diferenciación osteogénica y que presentan capacidad de formar hueso ectópico in vivo. En nuestro conocimiento, no existen estudios publicados en la bibliografía internacional donde se haya empleado la capacitación celular aquí determinada, ni su asociación con un biomaterial como la hidroxiapatita (HA), como elemento terapéutico en la reparación de fracturas en huesos largos14.
Entre los materiales de mayor interés para reconstruir defectos óseos se encuentran los biomateriales cerámicos, debido a sus reconocidas propiedades osteoconductivas, biocompatibilidad, capacidad de biodegradación, disponibilidad cuantitativa ilimitada y condiciones apropiadas para ser empleados como moldes para la ingeniería de tejidos. A este grupo pertenece la HA coralina15.
El objetivo de este estudio es evaluar, mediante un estudio prospectivo, la utilidad de las MSC, procedentes de MO, capacitadas in vitro y adsorbidas en piezas de HA, tras su implantación en resecciones segmentarias de fémur. Este objetivo general se concreta en una posible inferencia a las poblaciones humanas aquejadas de situaciones clínicas en las que se precisa promoción osteogénica.
Material y métodosPretendemos llevar las células capacitadas in vitro para reponer pérdidas importantes de hueso, en concreto en resecciones segmentarias de fémur. Se pretende aplicar una técnica de ingeniería tisular, con MSC cultivadas y osteoinducidas en un modelo biomecánico de fractura con defecto óseo de 5mm, en un fémur de múrido, estabilizando la fractura según el principio de neutralización, con una placa de osteosíntesis y rellenando el defecto alternativamente con aloinjerto, bloque de HA o HA con MSC osteoinducidas en cultivo convencional y en cultivo tridimensional con gel de colágeno.
Hemos utilizado ratas por ser un modelo viable para implantar placas de osteosíntesis, con un modelo de resección femoral de 5mm, que ya se ha demostrado en la literatura que no consolida espontáneamente.
Obtención y procesamiento de la médula óseaComo fuente de MSC se utilizó la MO obtenida de ratas Wistar singénicas hembras de 8 semanas de edad (Charles River, Barcelona, España), sacrificadas para la extracción de sus fémures. Una vez en el laboratorio de cultivos celulares, las muestras en condiciones de esterilidad y frío se pasaron a un nuevo medio de cultivo alpha-MEM con antibióticos (100μg/ml de penicilina G [Sigma], 50μg/ml de gentamicina [Sigma] y 0,3μg/ml de anfotericina B [Flow-ICN]). A continuación, la MO se disgregó mediante repetidos pipeteos, centrifugándose a 1.800rpm durante 5min.
Aislamiento y cultivo de las célulasLos cultivos se realizaron en placas de 48 pocillos (Falcon®) a una concentración de 2×106 células/pocillo/150ml de colágeno. Las placas de cultivo se llevaron al incubador (37°C) durante 30min para permitir la formación de geles de colágeno. Finalmente, sobre los geles se añadieron 200μl de medio de cultivo bajo en suero por pocillo, conteniendo el factor de crecimiento (este se omitió en la situación control). El medio de cultivo se renovó cada 3-4 días, añadiendo factor de crecimiento fresco. Todos los cultivos se mantuvieron en una atmósfera con 95% de aire y 5% de CO2, a 37°C de temperatura y 100% de humedad relativa.
En el caso de los cultivos tridimensionales, durante los 10 primeros días las células se cultivaron a muy baja concentración de suero (0,5% FBS), en el denominado período de selección, con el propósito de eliminar la mayor parte de las células de la línea hematopoyética. La presencia del rhTGF-ß1-F2 permite mantener viva de manera selectiva la población de células madre osteoprogenitoras que se pretendieron seleccionar.
En el día 11 de cultivo se inició el período de amplificación e inducción, que consiste en cambiar a medio de cultivo completo (10% FBS) durante 7 días. En los 3 últimos días de este período, se añadió el rhBMP-2 (50ng/ml, R&D Systems) en vez del rhTGF-ß1-F2, para aprovechar la capacidad de inducción osteogénica de aquel factor. Asimismo, se añadió dexametasona 10-8M (Sigma) y beta-glicerofosfato 2mM (Sigma) (fig. 1). Mediante citrometría de flujo se identificaron los distintos marcadores de superficie que permitieron identificar y aislar MSC, como CD29, CD44, CD73, CD90, CD105, CD166, HLA-I y STRO-1 (fig. 2).
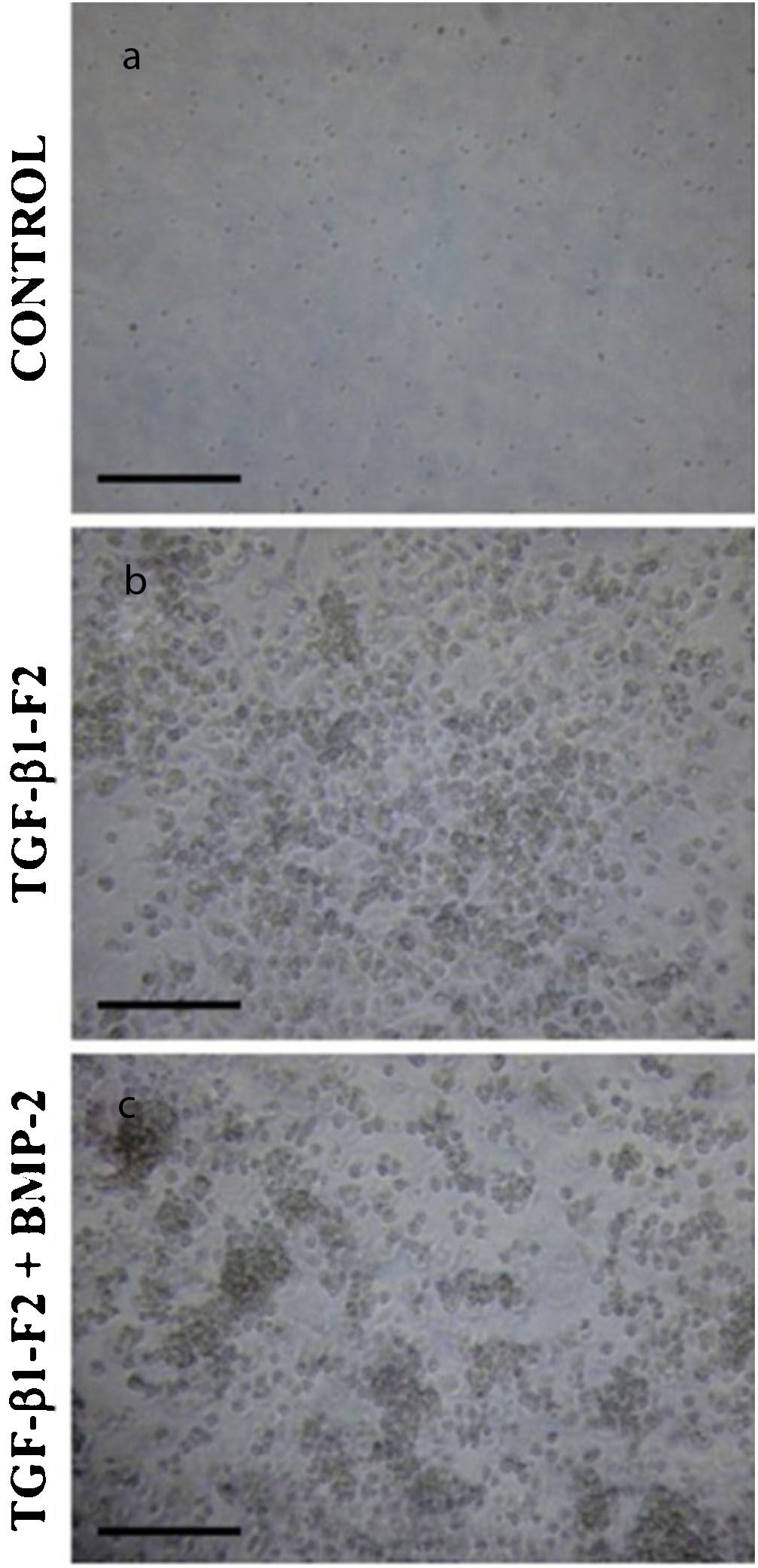
Morfología celular tridimensional de la matriz de colágeno al final del período de diferenciación (día 16). (a) Los cultivos de control en ausencia del factor de crecimiento. (b) Los cultivos de células en presencia de rhTGF-β1-F2. (c) Los cultivos de células en presencia de rhTGF-β1-F2 y el pulso de rhBMP-2.
Al final del período de selección (10 días de cultivo) se realizó un análisis bioquímico, para la determinación de ADN en los geles de colágeno, a fin de conocer el número de células y las mediciones de fosfatasa alcalina, una enzima de mineralización de la ruta de diferenciación preosteoblástica, así como de osteocalcina, una enzima específica de diferenciación osteoblástica.
Tras el período de amplificación e inducción (7 días más de cultivo) se volvió a realizar un análisis bioquímico de ADN y fosfatasa alcalina en los geles de colágeno. La osteocalcina se midió en los geles y también en el medio de cultivo, pues en este momento el nivel de osteocalcina, como proteína soluble que se libera al medio, debía ser suficientemente elevado como para ser detectado.
Para las muestras procedentes del TRAP fue necesario disgregar el gel de colágeno para liberar las células. Esto se realizó incubando con el mismo volumen de colagenasa al 0,05% durante 10min a 37°C. Transcurrido este tiempo se paró la reacción con DMEM, añadiendo el doble del volumen usado de colagenasa (Gibco®). En este punto, las muestras se pueden congelar a −20°C hasta el momento del análisis.
Implantación celularEn el caso de los cultivos adherentes, y una vez alcanzada la semiconfluencia indicada, las células se despegaron y transfirieron a otros frascos de cultivo en idénticas condiciones a las descritas anteriormente, hasta alcanzar un pase de cultivo 1 (cultivo primario), que es el utilizado para implantar.
Respecto a los cultivos tridimensionales, transcurridos los 17 días de cultivo se procedió a la implantación de las células en los múridos (período de implantación). Una vez liberadas las células de los geles de colágeno, se centrifugaron a 500rpm durante 10min, se contaron y se resuspendieron en medio de cultivo sin suero.
Grupos experimentalesSe usaron ratas Wistar (Charles River, Barcelona, España) de 15 semanas de edad y 300g de peso, distribuidas en 4 grupos experimentales de 8 animales. Se les realizó el procedimiento quirúrgico utilizando, para reponer el segmento resecado, segmentos equivalentes de hueso alogénico (de otro elemento singénico), mantenidos a −80°C.
Grupo I: se les realizó el procedimiento quirúrgico utilizando, para reponer el segmento reseccionado, segmentos equivalentes de hueso alogénico (de otra rata singénica), mantenidos a −80°C.
Grupo II: se les realizó el procedimiento quirúrgico, utilizando segmentos equivalentes de HA de 2×5mm (Prosteon® 500R, Interpore, Zimmer Biomet, Warsaw, IN, EE. UU.), y un tamaño de poro de 500μ.
Grupo III: se les realizó el procedimiento quirúrgico utilizando segmentos equivalentes de HA, previamente adsorbidas las MSC en cultivo primario, siendo 2,4×106 células por bloque de biomaterial.
Grupo IV: se les realizó el procedimiento quirúrgico utilizando segmentos equivalentes de HA de 2×5mm, previamente adsorbidas de células capacitadas por el TRAP sinérgico (rhTGF-ß1-F2+rhBMP-2), 2,4×106 células por bloque de biomaterial.
En los 4 grupos, los elementos se identificaron marcando la oreja derecha o la izquierda, realizando de uno a 4 agujeros.
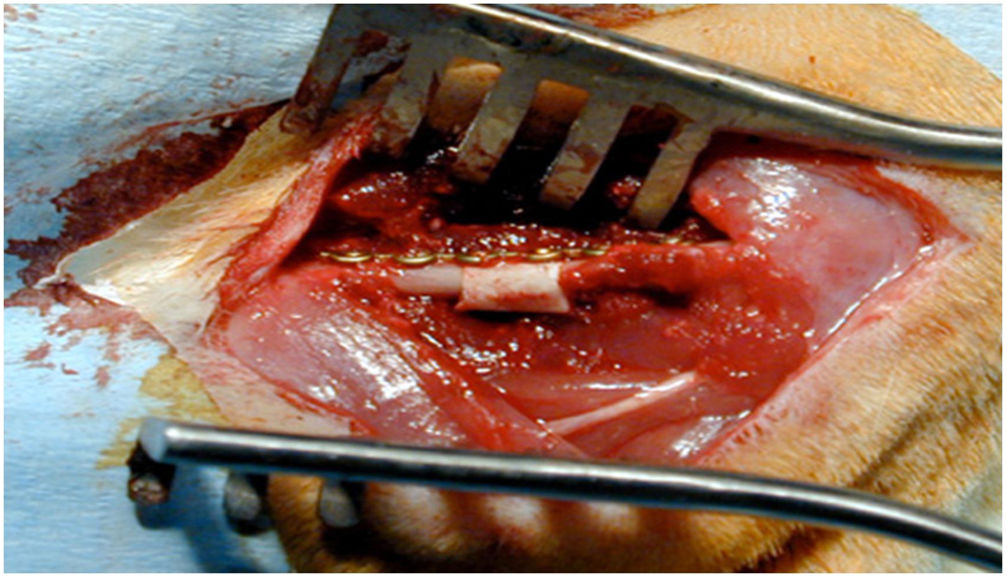
Técnica quirúrgicaUna vez anestesiados los animales de experimentación, se posicionaron en decúbito lateral derecho y se procedió a rasurar la zona a incidir ?lateral al fémur izquierdo? para realizar un acceso anterolateral entre el vasto lateral y el bíceps femoral, con disección por planos y hemostasia, llegando a la diáfisis femoral. Con una microsierra oscilante a 2 cortes, se procedió a extraer un segmento de hueso de 5mm. A continuación, se procedió a implantar el segmento de aloinjerto previamente tallado o el bloque de HA, en su caso. Posteriormente, se estabilizó el sistema con una placa de osteosíntesis de 1,2mm y 4 tornillos (TIT Profyle®, Stryker Orthopedics, Mahwah, NJ, EE. UU.). Seguidamente, se procedió al cierre de la herida por planos, utilizando grapas estériles para la piel. Los animales de experimentación recibieron metamizol en su agua potable para el tratamiento del dolor en los días posteriores, alojándolos durante 12 semanas en condiciones y nutrición estándares. Tras ello, fueron sacrificadas y se obtuvieron todos los fémures para su estudio histológico en el laboratorio.
Estudio radiográficoTras el procedimiento quirúrgico se tomaron radiografías a intervalos de 4 semanas, hasta un total de 12 semanas, tiempo que se considera suficiente para evaluar una posible regeneración ósea en este modelo animal. Se reflejó si hubo o no rotura de la placa de osteosíntesis en todas las ratas.
Tratamiento de datos y análisis estadísticoPara calcular el tamaño muestral se utilizó un procedimiento de cálculo de distribuciones binomiales, el Binomial Power Calculations de la Universidad de California, Los Ángeles, a través de su portal de Internet (http:/ebook.stat.ucla.edu/calcual.../b-2arcsine/b-2arscine-samp.htlm). Se aceptó una potencia de 0,80 (probabilidad de aceptación de la hipótesis alternativa siendo cierta) para distintos porcentajes de éxito del procedimiento experimental. Se realizó un análisis descriptivo mediante distribución de frecuencias. Se compararon los grupos (i vs. ii, i vs. iii, i vs. iv) según variables de formación de hueso, consolidación y tipo de consolidación, mediante el estadístico de Fisher, y estableciendo el nivel de significación estadística en p<0,05.
TincionesTodas las muestras histológicas se trataron con estas tinciones para la identificación de cartílago y hueso.
Hematoxilina y eosina.
Picrosirio.
Tricrómico de Goldner.
ResultadosNo se observó ninguna complicación como infección o necrosis cutánea.
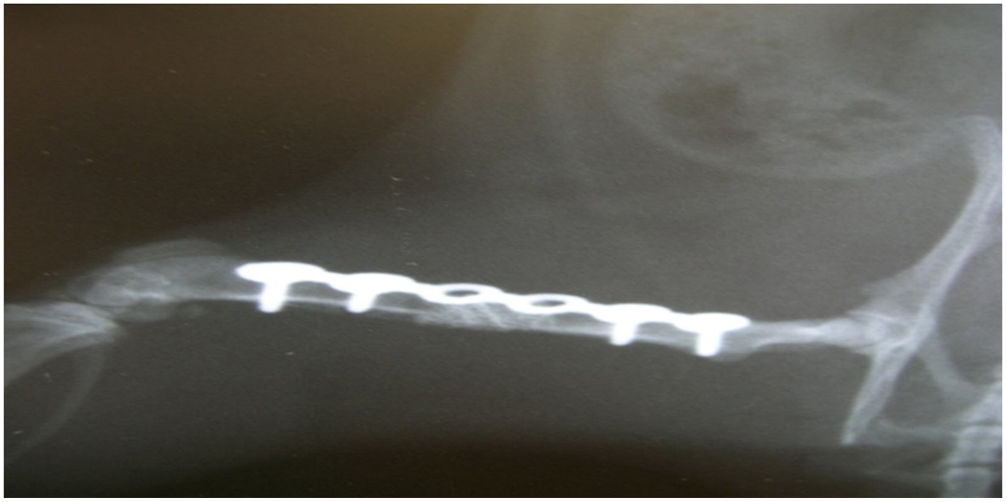
En el grupo i se observó radiológicamente una buena osteointegración, sin ningún fracaso biomecánico, a la duodécima semana en todos los elementos. La estadística descriptiva muestra un 100% de consolidación y un 100% de integridad de la placa de osteosíntesis.
En el grupo ii, a la duodécima semana se produjo un fracaso biomecánico en todos los casos, con rotura de todas las placas de osteosíntesis. Histológicamente se observó un tejido fibrótico en todas las muestras, característico de una no consolidación (fig. 3). Hubo diferencias significativas entre los grupos i y ii en relación con la consolidación (test de Fisher, p=0,002).
En el grupo iii, se apreció un comportamiento biológico satisfactorio, con formación de tejido óseo intercalado con tejido fibroso en todas las muestras, a diferencia del grupo ii, en el que fueron todas con tejido fibroso. Histológicamente, en todas las muestras se observó tejido osteoide. Sin embargo, los resultados biomecánicos mostraron un fracaso de las osteosíntesis, pues se rompieron todas las placas, sin formación suficiente de hueso para obtener una consolidación plena del defecto óseo; la respuesta biológica no fue suficiente. En el estudio estadístico descriptivo no hubo diferencias entre el grupo i y el iii en relación con la formación de hueso, pero sí en relación con la consolidación (test de Fisher, p=0,002). La imagen radiológica es pobre en hueso.
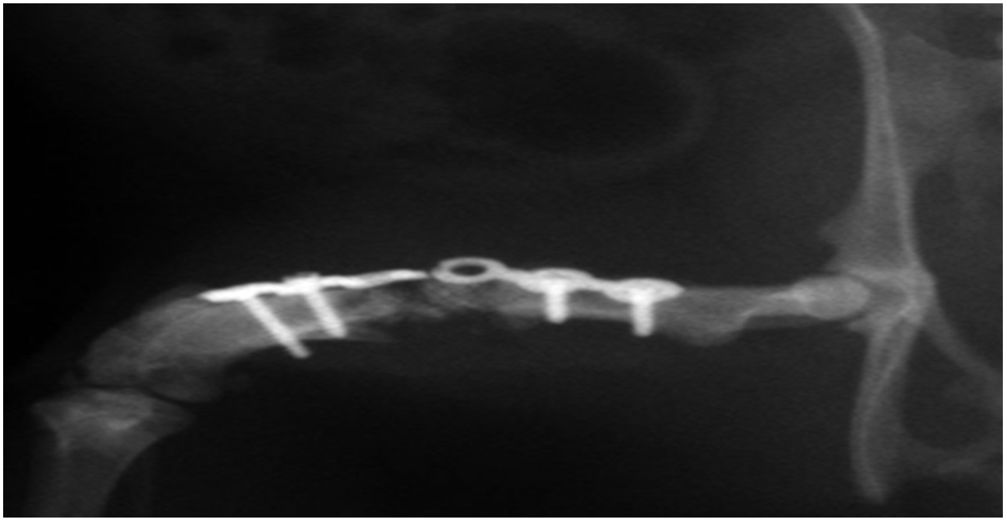
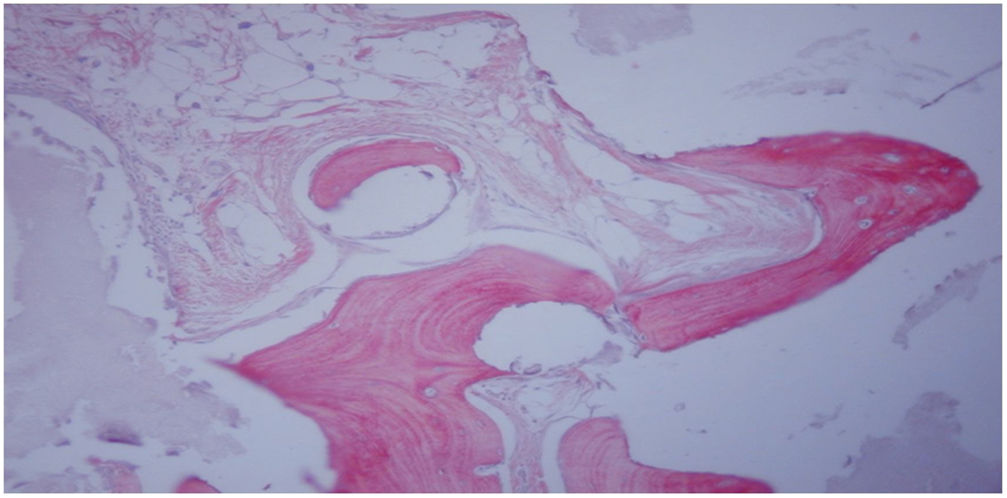
En el grupo iv se observó consolidación histológica de los defectos tanto con picrosirio como con tricrómico de Goldner. Radiográficamente, a las 12 semanas no se encontró ninguna rotura de las placas de osteosíntesis, por lo que biomecánicamente se consideró un modelo estable, e histológicamente hubo mayor cantidad de hueso que en los otros grupos. No se encontraron diferencias significativas entre el grupo i y iv (test de Fisher, p=0,002) (figs. 4 y 5). Radiológicamente presenta imagen de consolidación rica en hueso.
Estudio radiográfico de fémur derecho murino a las 12 semanas del implante femoral con HA+MSC capacitadas mediante el TRAP (grupo iv), y estabilización mediante placa de osteosíntesis y 4 tornillos. Se observa consolidación en el lado medial de la unión HA-hueso receptor del huésped, y no consolidación en el lado lateral (×12).
Estudio histológico a las 12 semanas del implante femoral con bloque de HA+MSC capacitadas mediante el TRAP (grupo iv). Se observa el tejido óseo neoformado con matriz madura (rojo claro) flanqueada por evidentes líneas cementantes, así como láminas de osteoide (rojo intenso) con osteocitos atrapados. Tinción con tricrómico-Goldner (×200).
Existen defectos óseos tras diversos procedimientos quirúrgicos y ninguno de los métodos de regeneración es óptimo hoy en día.
La HA se ha probado con eficacia en un modelo subcutáneo en ratas de experimentación. En este estudio experimental, todos los discos de HA mostraron formación de hueso en el interior de las áreas de los poros, como demuestran los cortes histológicos descalcificados y la microtomografía16. Según nuestros resultados, la combinación de MSC e HA se podría utilizar como un excelente sustituto de injerto óseo debido a sus propiedades mecánicas y la capacidad de formación de hueso17. Li et al.18 usaron como trasportador un composite de nanohidroxiapatita, colágeno y sulfato cálcico. Se implantó el constructo junto con rhBMP-2 en un defecto crítico en el cóndilo femoral de un conejo. Los resultados radiológicos y las tinciones histológicas indicaron que se produjo más hueso nuevo en el grupo del rhBMP-2.
En nuestro estudio se utilizó un modelo de resección segmentaria en fémur de rata, con un defecto de 5mm, que se ha demostrado un defecto crítico que no consolida espontáneamente19.
Warzecha et al.20, utilizando también un modelo de resección segmentaria en fémur estabilizado con placa de osteosíntesis de 1,0mm y tornillos de 1,3mm, utilizan el trifosfato cálcico y la BMP-2, y obtienen un buen modelo biomecánico para el estudio de la estimulación osteogénica.
También se han descrito varios métodos de fijación para estabilizar un defecto óseo en el fémur de la rata, utilizados habitualmente en la práctica clínica; entre ellos, las placas de osteosíntesis, los enclavamientos endomedulares y la fijación externa21. La decisión de estabilizar el defecto óseo con una placa de osteosíntesis se debe a que presenta mayor estabilidad y confortabilidad22,23. Con este modelo se puede ocupar el defecto óseo de 5mm con el bloque de HA con o sin células. Ferreira et al.24, en un modelo de resección segmentaria en fémur de ratones no tratados con células, observaron que todos los casos desarrollaron una no consolidación.
Las MSC se han aislado y caracterizado a partir de muestras de MO de muchas especies, incluyendo el ser humano, el conejo, la rata, la oveja, la cabra, el mono, el perro y el cerdo, a través de su unión preferencial a las superficies plásticas de cultivo celular25. Friedenstein et al.26 establecieron las normas de cultivo de MSC de la cobaya en virtud de la capacidad de las MSC para unirse a matrices de plástico, utilizando el método original para otros cultivos de MSC procedentes de MO de diferentes animales, incluidos los humanos. En nuestro trabajo, las células de MO se sometieron a un período de cultivo de 10 días a muy baja concentración de suero (período de selección) con el propósito de eliminar la mayor parte de las células de la línea hematopoyética. La presencia del rhTGF-ß1-F2 permitió mantener viva de manera selectiva la población de células madre osteoprogenitoras que se pretendió seleccionar. El medio de cultivo se renovó cada 3-4 días, añadiendo factor fresco. La caracterización fenotípica de las células del cultivo celular adherente o primario se consigue mediante citometría de flujo, constatando que las células están en fase activa G0/G1, y como marcadores fenotípicos son positivos CD29, CD73, CD105, CD166, HLA-I y STRO-1, y negativos, CD34, CD45 y CD44. Esto es constante en todos los cultivos primarios27.
La TGF-β y sus factores relacionados, incluyendo BMP y activinas, regulan diversos procesos celulares, tales como la proliferación, la diferenciación, la apoptosis y la formación de matriz extracelular durante la embriogénesis. La señalización de TGF-β está mediada por 2 tipos de receptores transmembrana serina/treonina cinasa, de tipo i (ALK5) y de tipo ii, que forman un complejo heteromérico. En este complejo de señalización, el TGF-β se une al receptor de tipo ii (TGFβR2), fosforilando el de tipo ii fosforilan y activando al receptor ALK5. El ALK5 activado induce las cascadas de señalización a través de vías Smad-dependientes y Smad-independientes. En la vía Smad-dependiente, el complejo de TGF-β-receptor activa Smad 2/3, mientras que el complejo de BMP-receptor activa Smad 1/5/828.
Chen et al.29 describen en una revisión la importancia de las TGF-β/BMP en la señalización de una gran cantidad de procesos celulares, siendo crucial durante toda la vida. Las TGF-β/BMP actúan en la formación del hueso en los mamíferos. La transducción de señales por las TGF-β/BMP se realiza específicamente a través de una vía Smad-dependiente (TGF-β/BMP ligandos, receptores y Smads) y otra Smad-independiente (vía activada por mitógenos proteína cinasa p38).
En este trabajo se usa una rhTGF-ß1-F2; la particularidad de la molécula F2 es por la afinidad a unirse al colágeno, por lo que se intensifica su acción en el medio. La secuencia de ADNc que codifica la región carboxi-terminal de la rhTGF-β1 se ha diseñado para incluir un decapéptido de alta afinidad de unión a colágeno derivado del factor de von Willebrand30.
Las BMP han demostrado, en estudios en animales y en humanos, su capacidad para la osteoinducción. En nuestro modelo usamos la rhBMP-2. Además, se ha publicado que el TGF-β1 en combinación con BMP-2 aumenta fuertemente la formación de hueso ectópico, y el volumen de hueso resultante es 5 veces mayor que la inducida por BMP-2 sola31.
En el presente estudio hemos tratado de caracterizar adicionalmente las células derivadas de MO, aislándolas en el sistema de cultivo de gel de colágeno tridimensional con la exposición a una nueva proteína de fusión TGF-β1 recombinante humana (rhTGF-β1-F2), diseñada para contener un dominio auxiliar de unión al colágeno. La combinación de rhTGF-β1-F2 y rhBMP-2 ha mejorado la diferenciación de las MSC hacia el linaje osteogénico, y el cultivo completo o TRAP, teniendo en cuenta que en el cultivo primario no se añade pulsos de rhBMP-2. También hay que tener en cuenta el uso en la fase la inducción del cultivo, durante los 3 últimos días, tanto en el cultivo primario como en el TRAP, de la adición dexametasona (10-8M) y beta-glicerolfosfato (2mM) como osteoinductores inespecíficos. Pasados los 17 días las células se despegaron, contaron e implantaron en los grupos iii y iv, respectivamente. En el grupo iii, con resección segmentaria de fémur estabilizada mediante placa de osteosíntesis de 1,5mm, ocupando el defecto óseo con un bloque de HA de 5mm, con 2,4 millones de células osteoinducidas en cultivo primario. Y en el grupo iv, con 2,4 millones de células osteoinducidas en el TRAP, es decir, con la conjunción de la rhTGF-β1-F2 y la rhBMP-2.
ConclusionesLas células madre mesenquimales, capacitadas in vitro en cultivos tridimensionales con geles de colágeno, expresan marcadores de diferenciación osteogénicos típicos. El grupo i consiguió consolidación en todos los fémures, y biomecánicamente fue estable, sin rotura de ninguna placa de osteosíntesis. El grupo ii se comportó como una no-unión con tejido fibroso, con fracaso biomecánico por rotura de todas las placas de osteosíntesis. El grupo iii presentó formación de hueso, pero no consolidación del defecto, con fracaso biomecánico por rotura de todas las placas de osteosíntesis. El grupo iv ha desarrollado consolidación, propiciada por la madurez del tejido osteocondral neoformado. Biomecánicamente los resultados fueron satisfactorios, con un modelo estable sin ninguna placa de osteosíntesis rota.
La ingeniería tisular con cultivos celulares osteoinducidos nos ofrece una posibilidad de obtener tejido óseo para la práctica clínica en Traumatología, dada la gran cantidad de enfermedad ortopédica y traumatológica que demanda tejido óseo.
Limitaciones del estudioEl tamaño muestral es pequeño, dada la dificultad de la investigación y los altos costes del estudio experimental. También hay que tener en cuenta la dificultad de la inferencia de estos resultados a poblaciones humanas, necesitando corroborarse con estudios clínicos prospectivos.
Nivel de evidenciaNivel de evidencia x.
Conflicto de interesesNo tengo ningún conflicto de intereses con ninguna casa comercial por la realización de este trabajo.
Mi más sincero agradecimiento por su apoyo y entrega a los profesores: Enrique Guerado Parra (Facultad de Medicina de Málaga), José Antonio Andrades Gómez y José Becerra Ratia (Facultad de Ciencias: Biología Celular, Málaga).