Comparar in vivo la capacidad de formación ósea de dos tipos de biomateriales diseñados como sustitutivos óseos respecto a autoinjerto de cresta iliaca, uno basado en carbonatohidroxiapatita y otro en vidrio mesoporoso bioactivo.
Material y métodoEstudio experimental compuesto por 14 conejos de Nueva Zelanda hembras adultas donde se realizó un defecto crítico en hueso radio. La muestra fue dividida en cuatro grupos: defecto sin material, con autoinjerto de cresta iliaca, con soporte de carbonatohidroxiapatita y con soporte de vidrio mesoporoso bioactivo. Se realizaron estudios seriados de radiología simple a las 2, 4, 6 y 12 semanas y estudio de micro-TC a eutanasia a las 6 y 12 semanas.
ResultadosEn el estudio de radiología simple, el grupo de autoinjerto mostró las mayores puntuaciones de formación ósea (7,5 puntos). Ambos grupos de biomateriales presentaron formación ósea similar (5,3 y 6 puntos, respectivamente) y mayor al defecto sin material (4 puntos), pero siempre menor que el grupo de autoinjerto. Los resultados del estudio de micro-TC mostraron el mayor volumen de hueso en el área de estudio en el grupo de autoinjerto. Los grupos con sustitutivos óseos presentaron mayor volumen de hueso que el grupo sin material, pero siempre menor que en el grupo de autoinjerto.
ConclusionesAmbos soportes parecen favorecer la formación ósea pero no son capaces de reproducir las características del autoinjerto. Por sus diferentes características macroscópicas cada uno podría ser adecuado para un tipo diferente de defecto.
Compare bone formation capacity in vivo of two types of biomaterials designed as bone substitutes with respect to iliac crest autograft, one based on carbonate hydroxyapatites and the other one on bioactive mesoporous glass.
Materials and methodsExperimental study consisting on 14 adult female New Zeland rabbits where a critical defect was made in the rabbit radius bone. The sample was divided into four groups: defect without material, with iliac crest autograft, with carbonatehydroxyapatite support, and with bioactive mesoporous glass support. Serial X-ray studies were carried out at 2, 4, 6 and 12 weeks and a microCT study at euthanasia at 6 and 12 weeks.
ResultsIn the X-ray study, autograft group showed the highest bone formation scores. Both groups of biomaterials presented bone formation similar and greater than the defect without material, but always less than in the autograft group. The results of the microCT study showed the largest bone volume in the study area in the autograft group. The groups with bone substitutes presented greater bone volume than the group without material but always less than in the autograft group.
ConclusionBoth supports seem to promote bone formation but are not capable of reproducing the characteristics of autograft. Due to their different macroscopic characteristics, each one could be suitable for a different type of defect.
El tratamiento de defectos óseos es uno de los retos más demandantes dentro del campo de la cirugía ortopédica. En este contexto, el autoinjerto óseo es la mejor solución para tratar los defectos óseos y estimular la formación de hueso nuevo y es considerado, por tanto, el patrón de oro1, dada su capacidad osteoconductora, osteoinductora y osteogénica. Sin embargo, su utilización se encuentra limitada por factores como el aumento del tiempo intraoperatorio, la morbilidad en la zona donante o la limitación de la cantidad de autoinjerto que se puede obtener. Dentro de este marco, surge la necesidad dentro del campo de la ingeniería de tejidos de crear «equivalentes tisulares» capaces de llevar a cabo la función del autoinjerto sin las limitaciones derivadas de su utilización.
En el campo de investigación de los sustitutivos óseos existen dos grandes familias de biomateriales, aquellos formados por apatitas y aquellos formados por vidrios mesoporosos bioactivos (VMB). Ambos tipos de materiales han demostrado ser biocompatibles, bioactivos y reabsorbibles en distinta medida2,3, además de integrarse con el tejido receptor sin interposición de tejido fibroso en estudios in vivo4,5.
El objetivo del presente estudio es comparar el comportamiento de los constructos basados en cerámicas de nano-carbonatohidroxiapatita (CHA) con aquellos basados en VMB igualando las condiciones in vivo y analizar su capacidad de formación ósea comparado con autoinjerto de cresta iliaca y defecto sin injerto.
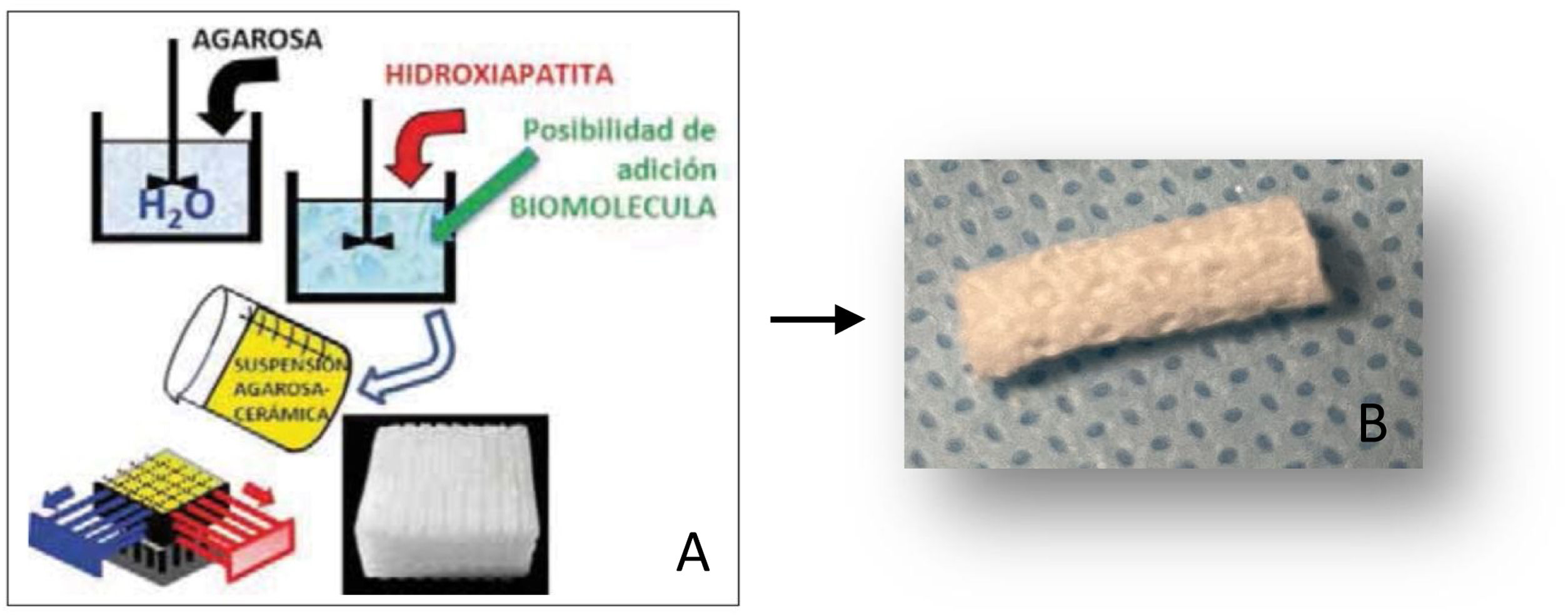
Material y métodoPreparación de los materialesLos soportes de carbonatohidroxiapatita (CHA) fueron realizados por el método GELPOR3D6,7 mediante la preparación de una disolución acuosa de agarosa (3,5% p/v) que fue calentada hasta los 80-90°C, disminuyendo posteriormente la temperatura a 40°C, temperatura a la que se añadió la gelatina y la CHA correspondiente (relación agarosa/gelatina/CHA: 45/10/45). Una vez obtenida una suspensión homogénea, la mezcla se vertió sobre un molde tridimensional previamente diseñado, constituido por filamentos rígidos de acero inoxidable del diámetro deseado (300-900 μm), que determina el tamaño de los poros en las tres dimensiones del espacio. Una vez obtenida la gelificación completa, se retiró el molde obteniendo así la pieza que fue posteriormente secada por liofilización para su esterilización mediante luz UV (fig. 1A y 1B).
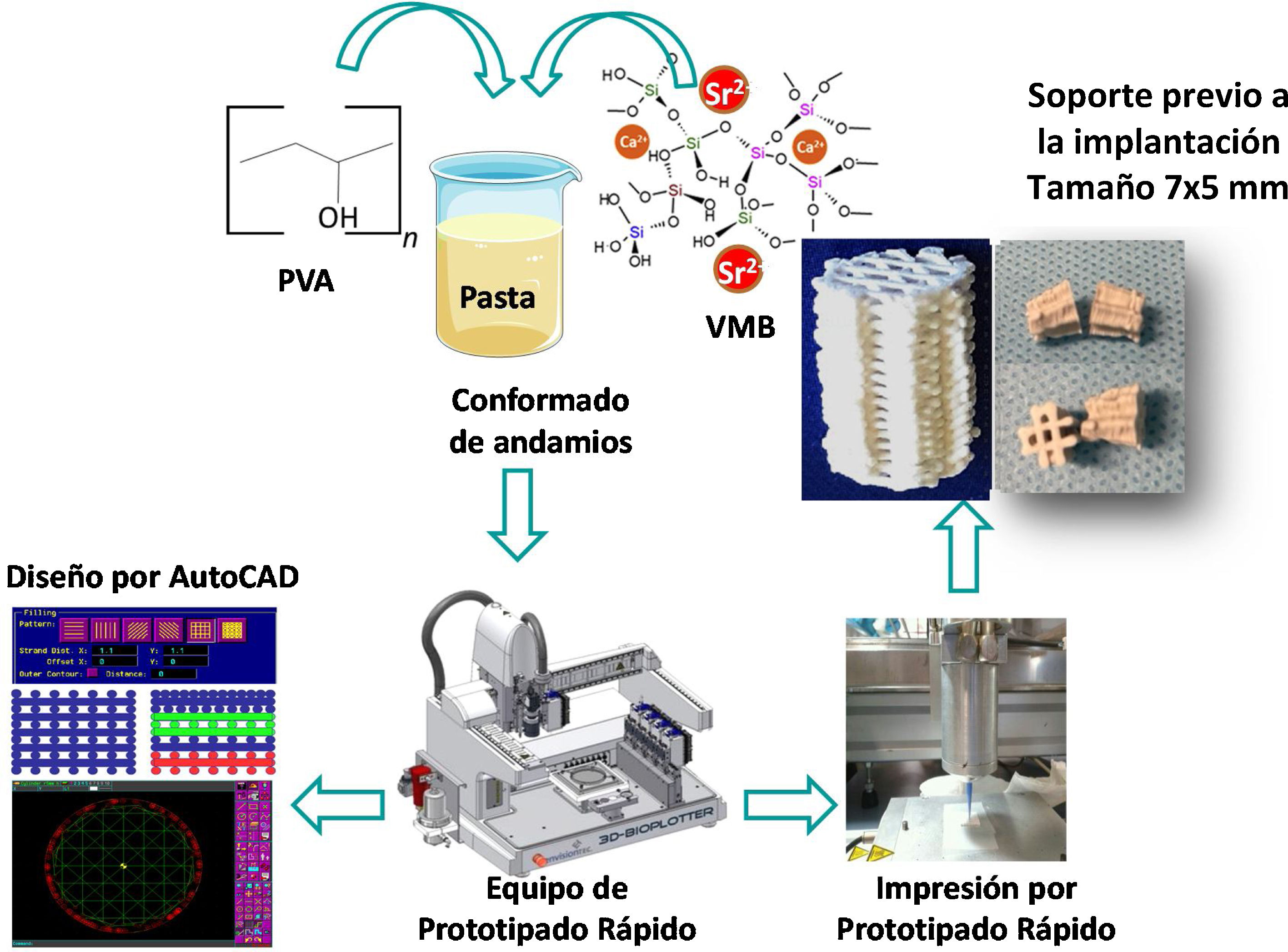
Los soportes de VMB fueron realizados siguiendo el procedimiento previamente descrito por Jiménez-Holguín et al.8 Para fabricar los andamios, se preparó una suspensión de 15% de PVA (Sigma Aldrich, St. Luois, MO, USA), mezclando 1,25 g de PVA en 10 mL de miliQ H2O a 90°C bajo agitación magnética y se mezcló con el VMB generando una pasta de PVA/VM para su posterior extrusión en el equipo de prototipado rápido de la impresora 3D (Regemat 3D S.L., España). Las dimensiones de los andamios cilíndricos obtenidos fueron de 6 mm de diámetro y 7,5 mm de longitud. Los andamios se secaron a 100°C durante dos horas y se esterilizaron con luz ultravioleta durante dos horas (fig. 2).
Esquema de la síntesis de soportes basados en VMB. Obsérvese que tras la mezcla y conformado de los andamios se realiza el diseño del soporte mediante AutoCAD (equipo de prototipado rápido impresora 3D BioplotterTM [EnvisionTEC, Gladbeck, Alemania]) para su posterior impresión por prototipado rápido hasta la obtención de los soportes que se implantaron.
Catorce hembras de conejo de Nueva Zelanda adultas con peso 4 kg±0,5 kg fueron usadas en este estudio. En cumplimiento con el RD 1090/2015, el estudio fue evaluado y aprobado por el Comité de Ética en Investigación con Animales de Experimentación del Instituto de Investigación I+12, el Comité de Ética/Subcomité de Experimentación Animal de la Universidad Autónoma de Madrid y por la Dirección General de Agricultura, Ganadería y Alimentación de la Comunidad de Madrid. Este estudio experimental con animales se adhiere a las directrices ARRIVE y se ha realizado de acuerdo con el Acta de 1986 del Reino Unido sobre animales (procedimientos científicos) y las recomendaciones relacionadas de la Directiva UE 2010/63/UE para experimientos con animales.
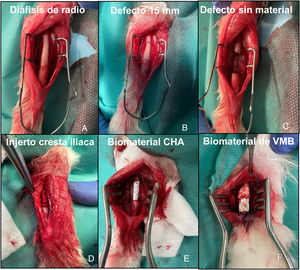
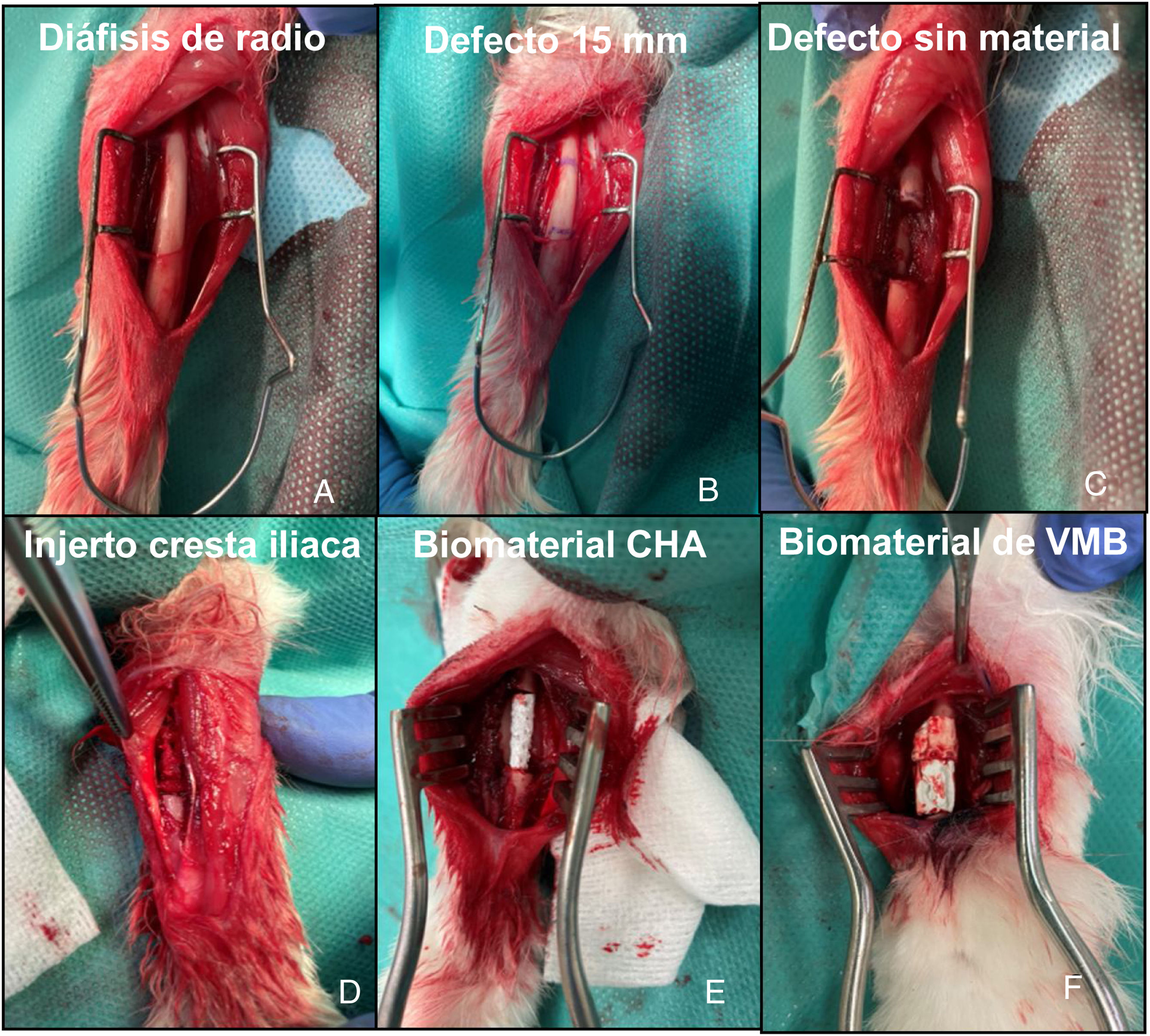
Intervención quirúrgicaLa sedación preanestésica se realizó con ketamina (40 mg/kg, IM) y xilazina (5 mg/kg IM). Una vez sedado el animal, se colocó un catéter venoso en la vena marginal de la oreja. Posteriormente se administró profilaxis antibiótica con cefazolina (50 mg/kg IV) y se procedió al rasurado del antebrazo y de la cresta iliaca en función del grupo de estudio, así como a la preparación aséptica de la piel con polividona yodada. El mantenimiento de la anestesia se realizó por vía inhalatoria con sevoflurano al 4%, realizándose además monitorización contínua de la frecuencia cardiaca y saturación de oxígeno. Se realizó una incisión longitudinal sobre la diáfisis dorsal del radio, siendo expuesta la misma tras disección cuidadosa de la musculatura adyacente. Posteriormente se extrajo un segmento óseo con el periostio circundante de 15 mm para conseguir un defecto crítico9, sin potencial de autorreparación, en dicho hueso. Las 14 conejas se dividieron en cuatro grupos de estudio. En el primer grupo (G1), de tres conejas, no se rellenó el defecto para estudiar el comportamiento del mismo; en el segundo (G2), de tres conejas, se rellenó con autoinjerto de cresta iliaca del propio animal; en el tercero (G3), de cuatro conejas, se implantó el constructo de CHA; y en el cuarto (G4), de cuatro conejas, el constructo de VMB (fig. 3). Posteriormente se realizó cierre por planos suturándose la fascia del antebrazo con hilo reabsorbible trenzado de 4/0 y la piel con monofilamento no reabsorbible de 5/0. Se permitió la carga de la extremidad intervenida en el postoperatorio inmediato. En cada grupo, una coneja fue sacrificada a las seis semanas y el resto a las 12 semanas. La eutanasia se llevó a cabo mediante el protocolo de sedación descrito previamente seguido de la administración vía intravenosa de tiopental sódico 0,5 g.
Imágenes intraoperatorias de la intervención sobre radio de conejo. A) Exposicón de la diáfisis de hueso radio. B) Planificación del defecto a crear de 15 mm. C) Exposición del defecto sin material (G1). D) Defecto relleno con autoinjerto de cresta iliaca del propio animal (G2). E) Defecto relleno con soporte de CHA (G3). F) Defecto relleno con soporte de VMB (G4).
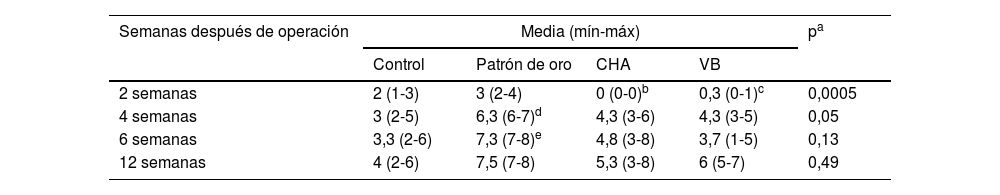
Se realizaron controles radiológicos del defecto utilizando un fluoroscopio modelo Xiscan 4400 en el postoperatorio inmediato y a las dos, cuatro, seis y 12 semanas tras la intervención quirúrgica en función del grupo de estudio para evaluar la formación ósea, unión y remodelado del defecto. Los resultados fueron puntuados mediante la escala modificada de Lane y Sandhu10, según se muestran en la tabla 1.
Escala de puntuación radiológica modificada de Lane y Sandhu
| Formación ósea | |
|---|---|
| No evidencia de formación ósea | 0 |
| Formación ósea ocupando 25% del defecto | 1 |
| Formación ósea ocupando 50% del defecto | 2 |
| Formación ósea ocupando 75% del defecto | 3 |
| Formación ósea ocupando 100% del defecto | 4 |
| Unión (proximal y distal evaluadas de forma separada) | |
| No unión | 0 |
| Unión posible | 1 |
| Unión radiográfica | 2 |
| Puntos totales posibles por categoría | |
| Formación ósea | 4 |
| Unión proximal | 2 |
| Unión distal | 2 |
| Remodelado | 2 |
| Puntuación máxima | 10 |
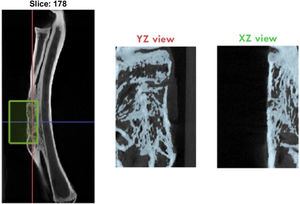
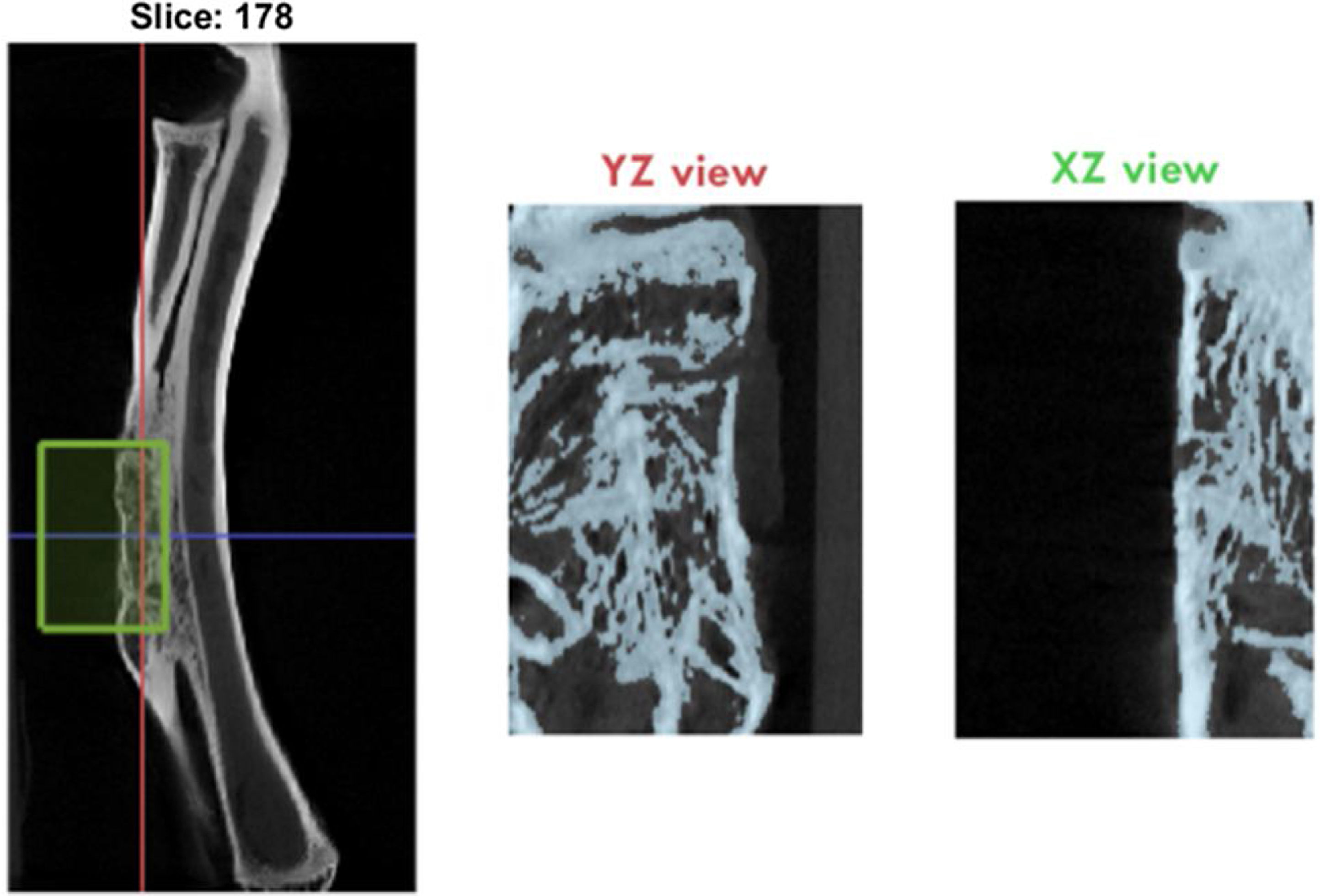
Se realizó un análisis de imagen y reconstrucción tridimensional por micro-TC al final del estudio donde se determinaron las siguientes variables de hueso neoformado: BV/TV (volumen de hueso/volumen total, %), Tt.Ar (hueso esponjoso total, mm2), Ct.Ar (hueso cortical total, mm2), y Ct.Th (espesor cortical, mm) en el área del defecto (fig. 4).
Análisis estadísticoLos resultados de radiología simple y micro-TC fueron comparados mediante la diferencia de medias utilizando el test no paramétrico de Kruskal-Wallis, cuando los valores de p resultaron<0,05 se realizaron las comparaciones por pares mediante el test U de Mann-Whitney. Se consideró como grado de significación estadística un valor p<0,05. Se utilizó el paquete estadístico SPSS Statistics for Windows, versión 24.0. Armonk, NY: IBM corp.
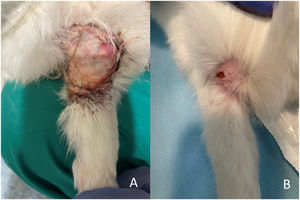
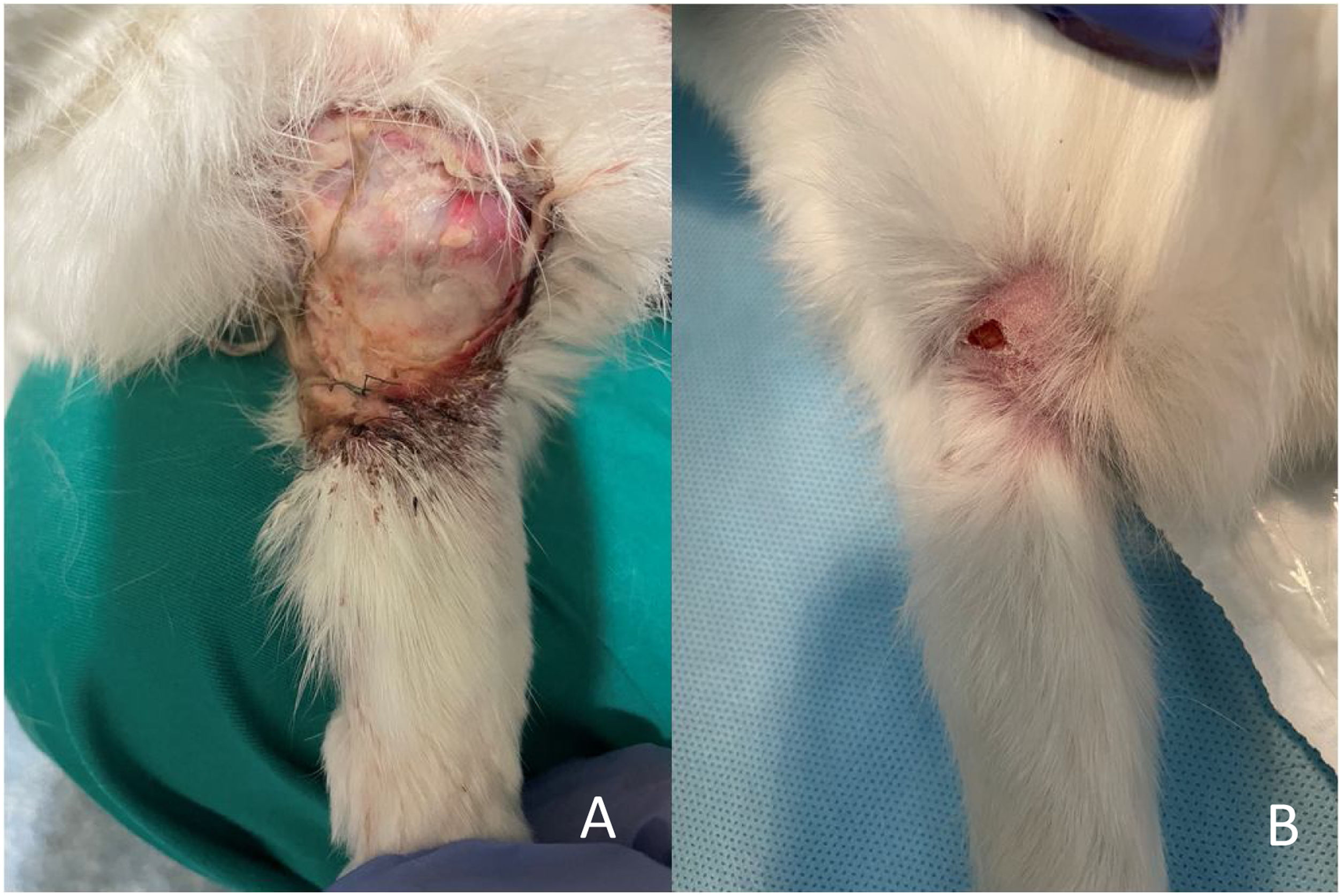
ResultadosSeguimiento clínicoNo se produjo ningún fallecimiento durante la intervención quirúrgica. Se realizó una eutanasia precoz a las siete semanas postoperatorias en una coneja que sufrió una lesión medular durante un cambio de ubicación para la limpieza de recinto de estabulación, pertenecía al grupo de autoinjerto de cresta iliaca (G2). Se decidió la eutanasia precoz de este animal por motivos humanitarios. Se produjo además una dehiscencia de sutura sin signos de infección en el grupo G2 que se resolvió mediante curas seriadas y una infección en el grupo G1 a la que se realizó lavado, desbridamiento y antibioterapia con resolución de la misma a las dos semanas. (fig. 5A y 5B)
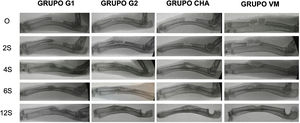
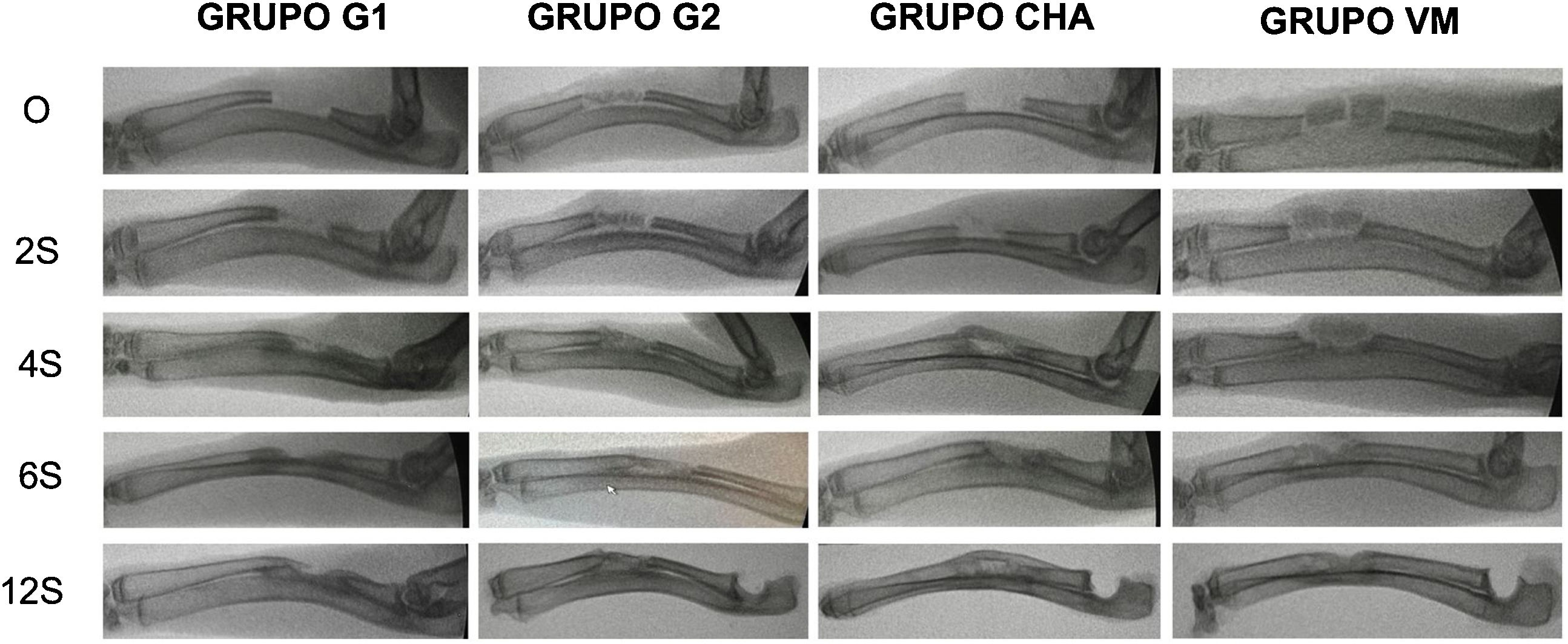
Resultados de radiología simpleEn todos los grupos aumentó la formación ósea según la escala modificada de Sandhu y Lane con el tiempo (fig. 6). En todos los tiempos de seguimiento el grupo de autoinjerto de cresta iliaca (G2) obtuvo las mayores puntuaciones, siendo estadísticamente significativa esta diferencia a las cuatro (p = 0,03) y seis semanas (p = 0,04) de seguimiento. Tanto el grupo de los vidrios mesoporosos como el grupo de las CHA presentaron mayor formación ósea a partir de las cuatro semanas que el grupo control sin material (G1), aunque siempre menor que en el grupo G2. Los resultados radiológicos se muestran en la tabla 2.
Controles radiológicos seriados de los diferentes grupos a las 0, 2, 4, 6, y 12 semanas postoperatorias. Obsérvese el patrón de formación ósea en los diferentes grupos de estudio destacando la falta de la misma en el grupo G1 donde se aprecia una amplia zona central sin relleno óseo.
Resultados de radiología simple
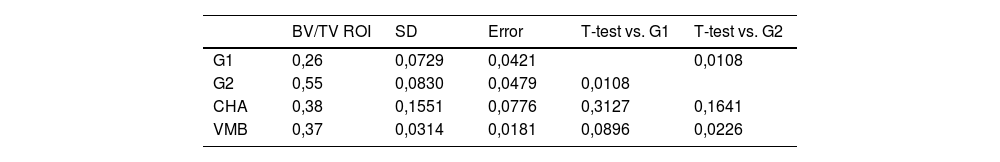
En cuanto al volumen de hueso en el área de estudio (BV/TV, ROI) fue significativamente superior (p = 0,012) en el grupo G2 respecto al resto de los grupos. Tanto el grupo de los VMB como el de la CHA presentaron mayor formación ósea que el grupo G1, aunque esta diferencia no resultó estadísticamente significativa (tabla 3).
Medidas del volumen de hueso dentro del defecto por grupos
| BV/TV ROI | SD | Error | T-test vs. G1 | T-test vs. G2 | |
|---|---|---|---|---|---|
| G1 | 0,26 | 0,0729 | 0,0421 | 0,0108 | |
| G2 | 0,55 | 0,0830 | 0,0479 | 0,0108 | |
| CHA | 0,38 | 0,1551 | 0,0776 | 0,3127 | 0,1641 |
| VMB | 0,37 | 0,0314 | 0,0181 | 0,0896 | 0,0226 |
BV/TV ROI: volumen de hueso en el área de estudio; CHA: grupo carbonatohidroxiapatita; G1: grupo control sin material; G2: grupo control autoinjerto cresta iliaca; SD: desviación estándar; VMB: grupo vidrio mesoporoso bioactivo.
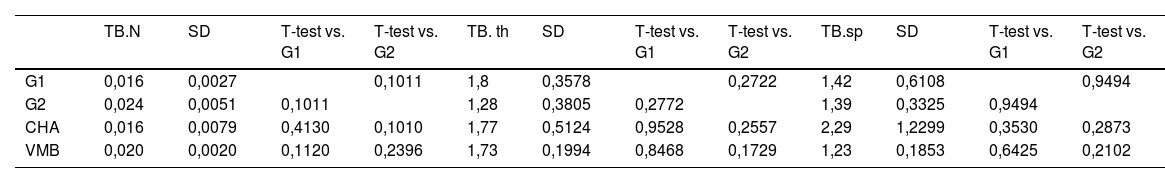
En cuanto al estudio trabecular, no se encontraron diferencias estadísticamente significativas en ninguno de los parámetros estudiados, que fueron el número de trabéculas óseas (TB.N), el grosor (TB.Th mm) y la separación trabecular (Tb.sp mm). Los resultados del estudio estadístico se muestran en la tabla 4.
Medidas trabeculares de estudio de micro-TC
| TB.N | SD | T-test vs. G1 | T-test vs. G2 | TB. th | SD | T-test vs. G1 | T-test vs. G2 | TB.sp | SD | T-test vs. G1 | T-test vs. G2 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| G1 | 0,016 | 0,0027 | 0,1011 | 1,8 | 0,3578 | 0,2722 | 1,42 | 0,6108 | 0,9494 | |||
| G2 | 0,024 | 0,0051 | 0,1011 | 1,28 | 0,3805 | 0,2772 | 1,39 | 0,3325 | 0,9494 | |||
| CHA | 0,016 | 0,0079 | 0,4130 | 0,1010 | 1,77 | 0,5124 | 0,9528 | 0,2557 | 2,29 | 1,2299 | 0,3530 | 0,2873 |
| VMB | 0,020 | 0,0020 | 0,1120 | 0,2396 | 1,73 | 0,1994 | 0,8468 | 0,1729 | 1,23 | 0,1853 | 0,6425 | 0,2102 |
BV/TV ROI: volumen de hueso en el área de estudio; CHA: grupo carbonatohidroxiapatita; G1: grupo control sin material; G2: grupo control autoinjerto cresta iliaca; SD: desviación estándar; TB.N: número de trabéculas óseas; VMB: grupo vidrio mesoporoso bioactivo.
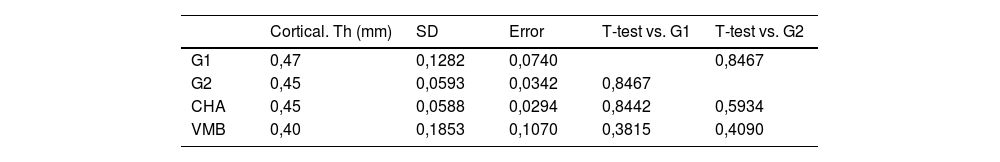
Respecto al estudio cortical, no se encontraron diferencias significativas en cuanto al grosor cortical en ninguno de los grupos de estudio. Los resultados se muestran en la tabla 5.
Medidas de grosor cortical mediante estudio de micro-Tc
| Cortical. Th (mm) | SD | Error | T-test vs. G1 | T-test vs. G2 | |
|---|---|---|---|---|---|
| G1 | 0,47 | 0,1282 | 0,0740 | 0,8467 | |
| G2 | 0,45 | 0,0593 | 0,0342 | 0,8467 | |
| CHA | 0,45 | 0,0588 | 0,0294 | 0,8442 | 0,5934 |
| VMB | 0,40 | 0,1853 | 0,1070 | 0,3815 | 0,4090 |
CHA: grupo carbonatohidroxiapatita; Cortical. Th (mm): grosor cortical en mm; G1: grupo control sin material; G2: grupo control autoinjerto cresta iliaca; SD: desviación estándar; VMB: grupo vidrio mesoporoso bioactivo.
Para evaluar el potencial de regeneración ósea de los biomateriales diseñados, basados unos en VMB y otros en CHA, se generó un defecto crítico sobre hueso radio de conejo. Además, se comparó con el patrón oro (autoinjerto de cresta iliaca) y con el defecto vacío.
Se eligió conejo de Nueva Zelanda como modelo de estudio, ya que según estudios previos, este animal es ideal para estudios sobre sustitutivos óseos11, dadas las similitudes entre las extremidades de conejo y humano, su mediano tamaño, su relativa facilidad de manejo y estabulación, así como su coste asequible. Presenta además una velocidad aumentada de regeneración ósea, lo que lo ha llevado a ser ampliamente utilizado como modelo en númerosos estudios de regeneración ósea12,13.
Se ha definido defecto crítico como «el menor defecto intraóseo en un hueso en particular y una especie animal que no puede regenerarse por sí mismo durante la vida completa del animal»14. A pesar de que aún no está bien establecido el tamaño mínimo que debe tener un defecto para poderse considerar crítico, se ha definido como una longitud de 2,5 a 3 veces el diámetro del hueso largo donde se localiza el defecto15. Se eligió el hueso radio como modelo de defecto óseo en hueso largo, ya que su forma es tubular lo que permite la creación de un defecto segmentario. Además, a pesar del defecto, el cúbito continúa soportando el peso del antebrazo, lo que permite la carga postoperatoria inmediata y evita la necesidad de estabilizar con material de osteosíntesis adicional. El diámetro del radio en conejos de Nueva Zelanda es de entre 4 y 5 mm, por lo que, de acuerdo con otros autores16,17, se creó un defecto en la diáfisis del radio de 15 mm. Numerosos investigadores han demostrado que este tamaño de defecto se rellena con una cicatriz fibrosa sin conexión ósea16,17.
En cuanto a la composición y diseño de los biomateriales utilizados en este estudio, se eligieron dos de las familias con mayor proyección en el campo de la ingeniería de biomateriales. Unos basados en biovidrios, y otros basados en apatitas18. Los equipos que desarrollan materiales basados en biovidrios consideran que son estos los soportes ideales para el desarrollo de sustitutivos óseos. Lo mismo promulgan los equipos especializados en la investigación en el campo de los soportes basados en apatitas. En este trabajo se han comparado dos tipos de soportes tridimensionales porosos desarrollados por el Grupo de Investigación Biomateriales Inteligentes (GIBI). Se han realizado los ensayos en las mismas condiciones in vivo para ambos tipos de biomateriales, ya que estos materiales se han implantado en el mismo modelo animal, mismo defecto, y mismo cirujano dentro siempre de las mismas instalaciones.
Por otro lado, Oonishi et al.19 mostraron que existen dos clases de bioactividad. Los materiales con bioactividad clase A presentan tanto efectos osteoconductores como osteoproductores, como resultado de una rápida reacción de superficie incluyendo la liberación local de concentraciones críticas de iones, principalmente Si, Ca, P y Na, provocando reacciones intra y extracelulares con el entorno biológico. A esta clase pertenecen los VMB. Por otro lado, los biomateriales con clase B solo producen efecto osteoconductor y permiten la aposición directa de hueso sobre el soporte dada su baja tasa de reacciones en la interfaz. A este grupo pertenecen las CHA. Además, el diseño de los soportes se basó en ambos casos en una arquitectura tridimensional de poros interconectados de diferentes tamaños de cara a simular la estructura ósea20, que presenta una porosidad de entre 1 y 3.500 μm, donde los diferentes tamaños de los poros implican diferentes funciones. Los poros mayores de 100 μm (macroporos) permiten albergar células progenitoras, crecimiento tisular, nutrición y vascularización. Los poros de tamaño<2 nm (microporos) o aquellos comprendidos entre los 2-50 nm (mesoporos) promueven la adhesión celular, absorción de metabolitos y rangos de reabsorción controlada del biomaterial necesarios para la reparación del tejido21. Además, esta porosidad fue creada en la fase de diseño de forma anisotrópica22, ya que ha demostrado mayor formación ósea que cuando se diseña de forma isotrópica para ambos materiales
En cuanto al comportamiento de los VMB, estos presentan una respuesta bioactiva rápida, debido a su solubilidad parcial en contacto con los fluidos biológicos, liberando cantidades significantes de iones al medio circundante, especialmente iones de Si, que potencian la angiogénesis, y los iones de Ca2+ que contribuyen a la proliferación celular y presentan además actividad osteogénica23. La constitución de los vidrios mesoporosos utilizados para la realización de este trabajo fue 78,5% SiO2-15% CaO-5% P2O5-2,5% SrO (mol-%). Los soportes mesomacroporosos de VMB fueron enriquecidos con SrO y presentaron mesoporosidad (6 nm), macroporosidad (1-100 μm) y canales gigantes (1 mm). In vitro han mostrado excelentes propiedades para la sustitución ósea, incluyendo estructura mesoporosa ordenada, elevadas propiedades texturales, rápida respuesta bioactiva y la capacidad para liberar concentraciones de iones de estroncio, que pueden estimular la expresión de marcadores tempranos de diferenciación osteoblástica24.
Por todo ello, y dada la amplia experiencia del grupo de estudio en el diseño y fabricación de este tipo de soportes, se consideraron candidatos ideales para la realización de este estudio in vivo.
Los resultados obtenidos en el grupo de los VMB, tanto en el caso del estudio de radiología simple como en el de micro-TC mostraron que existe mayor formación ósea que en el caso del control sin material, aunque no tanta como en el grupo de autoinjerto de médula ósea. Esto hace pensar que estos soportes ayudan a la formación de nuevo hueso, pero no son suficientes por sí solos, para sustituir al autoinjerto de médula ósea. Gil-Albarova et al.25 reportaron en un estudio sobre un defecto en fémur de conejo que este tipo de vidrios bioactivos son capaces de generar hueso, aunque dada su alta bioactividad podrían ser ideales también para la liberación de antibióticos.
El interés de los materiales basados en apatitas para el desarrollo de sustitutivos óseos viene marcado por su alta aceptación como material biocompatible dada su similitud con el componente mineral del hueso3, su capacidad osteoconductiva26 y su buena integración en el defecto óseo. El componente de CHA que compone este soporte, integrado dentro de una matriz de agarosa, puede ser fácilmente degradado favoreciendo su progresiva sustitución por tejido neoformado. La porosidad de estos soportes se encuentra entre las 50 y 800 μm. Este tipo de biomaterial, a su vez, ha demostrado que presenta una superficie adecuada para la adhesión de células preosteoblásticas que podrían crecer en el soporte sin toxicidad por ninguno de los componentes que forma este material3. Por estas razones se consideró a este material ideal para la realización de este estudio in vivo.
En cuanto a los resultados obtenidos de los estudios radiológicos y de micro-TC en el grupo de las CHA, fueron esencialmente similares a los obtenidos en el caso de los VMB. De nuevo se mostró mayor formación ósea que en el grupo de control sin material, pero no tanta como en el grupo de autoinjerto de médula ósea. Estos datos están en concordancia con los publicados por Oryan et al.27 en el que un estudio con el mismo modelo comparando soportes basados en hidroxiapatita con control e hidroxiapatita enriquecida con PRP's demostraron que los soportes de hidroxiapatita presentaron mayor formación ósea que los controles sin material, aunque menor que en el caso de los soportes de hidroxiapatita enriquecidos con PRP's. En otro estudio in vivo sobre fémur de conejo utilizando este tipo de soportes se concluyó permiten la osteoconducción con un apropiado rango de reabsorción y con amplia adaptabilidad intraoperatoria obteniendo formación ósea en todos los defectos28.
De nuevo, los soportes estudiados parecen mejorar la formación ósea respecto al grupo control, pero no lo suficiente como para poder considerarse sustitutivos óseos con características similares al autoinjerto. Esta respuesta puede deberse a la falta de osteoinductividad que presenta este tipo de soporte y que ya ha sido reportada previamente29, incluso con el mismo modelo experimental30.
Aunque en cuanto a composición y características macroscópicas son muy diferentes, no se han encontrado diferencias en este estudio preliminar, en lo referente a la formación ósea entre los biomateriales basados en VMB respecto a los basados en CHA, si bien es cierto que estas características macroscópicas podrían hacer a cada uno de ellos más adecuados para un tipo de defecto concreto. En el caso de los soportes basados en VMB, presentan una mayor resistencia inicial, aunque en contrapartida, presentan menor adaptabilidad intraoperatoria al defecto, debiendo planificar de antemano el tamaño del defecto para que el soporte encaje en el mismo. Por todo ello, este tipo de soportes probablemente serían más adecuados para defectos que impliquen hueso cortical además de medular, aunque son necesarios más estudios in vivo a este respecto para confirmar dicha afirmación. En el caso de los soportes basados en CHA, presentan una consistencia coralina, lo que hace que presenten menor resistencia inicial, aunque pueden adaptarse al defecto de forma intraoperatoria, existiendo la posibilidad de recortar el soporte en el mismo acto quirúrgico para adaptarlo a nuestro defecto. Estas características, a priori, posicionarían a este tipo de constructos como una opción más adecuada para defectos que impliquen principalmente hueso esponjoso.
En conclusión, se ha observado que tanto los soportes basados en CHA como aquellos basados en VMB favorecen la formación ósea, pero aún se está lejos de afirmar que por sí solos son capaces de reproducir las características del autoinjerto óseo. Nuestro grupo de investigación está trabajando en el enriquecimiento de estos soportes con sustancias osteoinductoras y células progenitoras para optimizar el comportamiento biológico de estos biomateriales y acercarnos a nuestro objetivo final de poder utilizarlos como sustitutivo al autoinjerto óseo en nuestra práctica médica habitual.
Nivel de evidenciaNivel de evidencia I.
FinanciaciónEl presente proyecto ha sido financiado por la Fundación de la Sociedad Española de Cirugía Ortopédica y Traumatología mediante la concesión de la ayuda para proyectos de iniciación a la investigación 2020 y por el Instituto de salud Carlos III con la subvención FIS numero PI20/01384, IP cofinanciada con fondos FEDER de la Unión Europea.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Aprobación del comité de éticaEn cumplimiento con el RD 1090/2015, el estudio fue evaluado y aprobado por el Comité de Ética en investigación con animales de experimentación del Instituto de Investigación I+12, el Comité de Ética/ subcomité de experimentación animal de la Universidad autónoma de Madrid, numero de registro: ES 28079-0001164 y por la Dirección General de Agricultura, Ganadería y Alimentación de la Comunidad de Madrid, número de registro: ES280790001164.







![Esquema de la síntesis de soportes basados en VMB. Obsérvese que tras la mezcla y conformado de los andamios se realiza el diseño del soporte mediante AutoCAD (equipo de prototipado rápido impresora 3D BioplotterTM [EnvisionTEC, Gladbeck, Alemania]) para su posterior impresión por prototipado rápido hasta la obtención de los soportes que se implantaron. Esquema de la síntesis de soportes basados en VMB. Obsérvese que tras la mezcla y conformado de los andamios se realiza el diseño del soporte mediante AutoCAD (equipo de prototipado rápido impresora 3D BioplotterTM [EnvisionTEC, Gladbeck, Alemania]) para su posterior impresión por prototipado rápido hasta la obtención de los soportes que se implantaron.](https://static.elsevier.es/multimedia/18884415/0000006700000004/v3_202404150749/S1888441522003502/v3_202404150749/es/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)