El objetivo del presente estudio fue determinar si la depresión antecede al deterioro cognitivo leve (DCL) como factor de riesgo o como predictor en la enfermedad de Alzheimer (EA). Se realizó una revisión sistemática de estudios observacionales (transversales y de cohorte o seguimiento) mediante el algoritmo de búsqueda PRISMA, de los marcadores clínicos en DCL y EA, en las bases de datos Science Direct, Springer, Scopus y Proquest. Los criterios de elegibilidad del estudio incluyeron como criterios inclusión: tipos de documentos, artículos de estudios primarios; tipo de fuente, revistas científicas, en idioma inglés, desde enero de 2010 hasta abril de 2020, en pacientes con DCL y EA y en el grupo de edad comprendido en personas con un rango de edad mínimo de 45años. Los criterios de exclusión fueron: las publicaciones de más de 10años (el objetivo del artículo era explorar estudios recientes), estudios de investigación secundaria, tipo de documento de informe, otros idiomas diferentes al inglés. Se identificaron 3.385 artículos, de los que finalmente se seleccionaron 30 artículos. Se encontró que existe una asociación entre la depresión y la EA, pero propiamente como un factor de riesgo, mas no como un predictor o marcador clínico del desarrollo de la EA. El grado de asociación es mayor cuando presentan sintomatología depresiva y simultáneamente reportan quejas de memoria subjetiva o la presencia de DCL.
The objective of the present study was to determine whether depression precedes Mild cognitive impairment (MCI) as a risk factor or as a predictor in Alzheimer's disease (AD). A systematic review of observational studies (cross-sectional and cohort or follow-up) was carried out using the PRISMA search algorithm, for clinical markers in MCI and AD, in the Science Direct, Springer, Scopus and Proquest databases. The study eligibility criteria included inclusion criteria: of types of documents, articles of primary studies, type of source scientific journals, published in the English language, from January 2010 to April 2020, in patients with MCI and AD and in the group of age included in people with a minimum age range of 45years. Exclusion criteria were: publications older than 10years because the aim of the article was to explore recent studies, secondary research studies, type of report document, languages other than English. 3385 articles were identified, of which 30 articles were finally selected. It was found that there is an association between depression and AD, but properly as a risk factor but not, as a predictor or clinical marker of the development of AD. The degree of association is greater when they present depressive symptoms and simultaneously report subjective memory complaints or the presence of MCI.
La depresión, según la Asociación Americana de Psiquiatría, es un trastorno que se caracteriza por la presencia de estado de ánimo triste, vacío o irritable, acompañado de cambios somáticos y cognitivos que indudablemente afectan de manera significativa la capacidad funcional de la persona1. La depresión ha sido asociada de dos maneras distintas con el deterioro de la cognición: la primera, como factor de riesgo para la demencia; la segunda, como un factor que conduce al deterioro cognitivo leve (DCL), debido a un posible efecto negativo de los síntomas del estado de ánimo en la cognición. Por ende, no es claro si los síntomas de depresión podrían constituir una manifestación temprana para la demencia, y específicamente para la enfermedad de Alzheimer (EA), o su relación esté dada como factor de riesgo para el desarrollo de la misma2.
Investigaciones han indicado que alrededor de la mitad de los adultos mayores con DCL concomitante y algunos síntomas depresivos podrían ser propensos a tener EA3. Así mismo, que la exposición acumulativa de síntomas depresivos a largo plazo en adultos mayores podría predecir el DCL posterior4. Estudios longitudinales han encontrado tasas de progresión de depresión y DCL del 39,7% a EA a los 27 meses de seguimiento5. Además, se ha evidenciado que los síntomas depresivos se han asociado con una ejecución inferior en tareas de memoria, así como una disminución más rápida de la memoria. Un estudio nacional de tendencias de salud y envejecimiento en Estados Unidos para la identificación de adultos elegibles encontró que una mayor cantidad de síntomas depresivos, menor bienestar psicológico y control percibido, se asocian independientemente con una memoria inicial más baja6. Un estudio de cohorte realizó un seguimiento que halló que el puntaje de la Geriatric Depression Scale (GDS) después del tercer año de seguimiento fue un predictor significativo en el aumento de los casos de EA7.
Por otro lado, la composición de la materia gris (MG) ha sido otro cambio neuropatológico estudiado, que muestra claramente la distinción entre pacientes con EA depresivos y no depresivos8. Los pacientes con EA con depresión muestran una pérdida de volumen de MG principalmente en la región paracentral, específicamente en las áreas motoras suplementarias, en el giro post y pre central y en el tálamo, a diferencia de los pacientes no depresivos; pero en regiones límbicas y de la corteza prefrontal no se reportaron diferencias significativas, posiblemente porque en estas regiones se haya sufrido el mismo nivel de daño como consecuencia de la EA8.
Sin embargo, no todas las investigaciones han encontrado los mismos resultados. En un estudio longitudinal realizado en Canadá no se encontró una asociación significativa entre la depresión y diferentes trastornos de ansiedad en la disminución de la función cognitiva. No obstante, la presencia de angustia psicológica dos años previos al estudio, así como la percepción de inseguridad en el vecindario, fueron factores reportados en el estudio como predictores en el deterioro de la función cognitiva; por otra parte, tener un nivel de educación alto y habilidades de afrontamiento son factores protectores2. También se ha encontrado que una reducida capacidad de memoria de base predice significativamente niveles más altos de síntomas depresivos en el seguimiento; sin embargo, el efecto inverso no fue significativo, es decir, los síntomas depresivos iniciales no se asociaron con la capacidad de memoria posterior al controlar la capacidad de memoria inicial, y es así que estos resultado muestran que la relación entre el deterioro de la memoria y los síntomas depresivos es unidireccional: el deterioro de la memoria predice los síntomas depresivos posteriores9.
En concordancia con lo expuesto, el presente estudio tiene como finalidad determinar si la depresión antecede al DCL como factor de riesgo o como predictor en la EA. Es así que se plantearon tres hipótesis: la primera, la depresión antecede al DCL como factor de riesgo en la EA; la segunda, la depresión antecede al DCL como predictor de la EA, y la tercera, la depresión no se asocia ni como factor de riesgo ni como predictor en la EA.
MetodologíaRevisión sistemática de estudios observacionales (transversales y de cohorte o seguimiento), realizada mediante el algoritmo de búsqueda PRISMA, acerca de los marcadores clínicos en DCL y EA. Los criterios de elegibilidad del estudio incluyeron criterios inclusión: tipo de documentos, artículos de estudios primarios; tipo de fuente, revistas científicas, publicados en el idioma inglés, desde enero de 2010 hasta abril de 2020, en pacientes con DCL y EA y en el grupo de edad comprendido en personas con un rango de edad mínimo de 45años. Los criterios de exclusión fueron: las publicaciones de más de 10años debido a que el objetivo del artículo era explorar estudios recientes, estudios de investigación secundaria, tipo de documento de informe, otros idiomas diferentes al inglés.
La búsqueda realizada para seleccionar los estudios se llevó a cabo mediante la exploración en las siguientes bases de datos electrónicas: Science Direct, Springer, Scopus y Proquest. La sintaxis de búsqueda fue la siguiente:
TITLE-ABS-KEY ((«cognitive predictor» OR «cognitive marker») AND («Depression») AND («mild cognitive impairment» OR «Mental Deterioration» OR «Alzheimer Disease» OR «Senile Dementia») AND («older adults» OR «old age»))
Selección de estudiosSe realizó una preselección de las publicaciones teniendo en cuenta su concordancia con la temática del presente artículo:
- 1.
Se estableció una selección de artículos completos, posteriormente se revisó el título y el resumen correspondientes para descartar los estudios que no se ajustaran a la temática.
- 2.
Los artículos que cumplieron con los criterios mencionados fueron sometidos a su lectura para el posterior análisis e inclusión.
- 3.
Se clasificaron de acuerdo al marcador clínico en las siguientes categorías: a)depresión, b)ansiedad, c)angustia psicológica, d)apatía, e)síntomas neuropsiquiátricos (SNP).
- 4.
Se extrajeron datos principales, como referencia, objetivo, diseño, muestra, instrumentos, criterios de inclusión y exclusión, resultados, conclusiones y limitaciones.
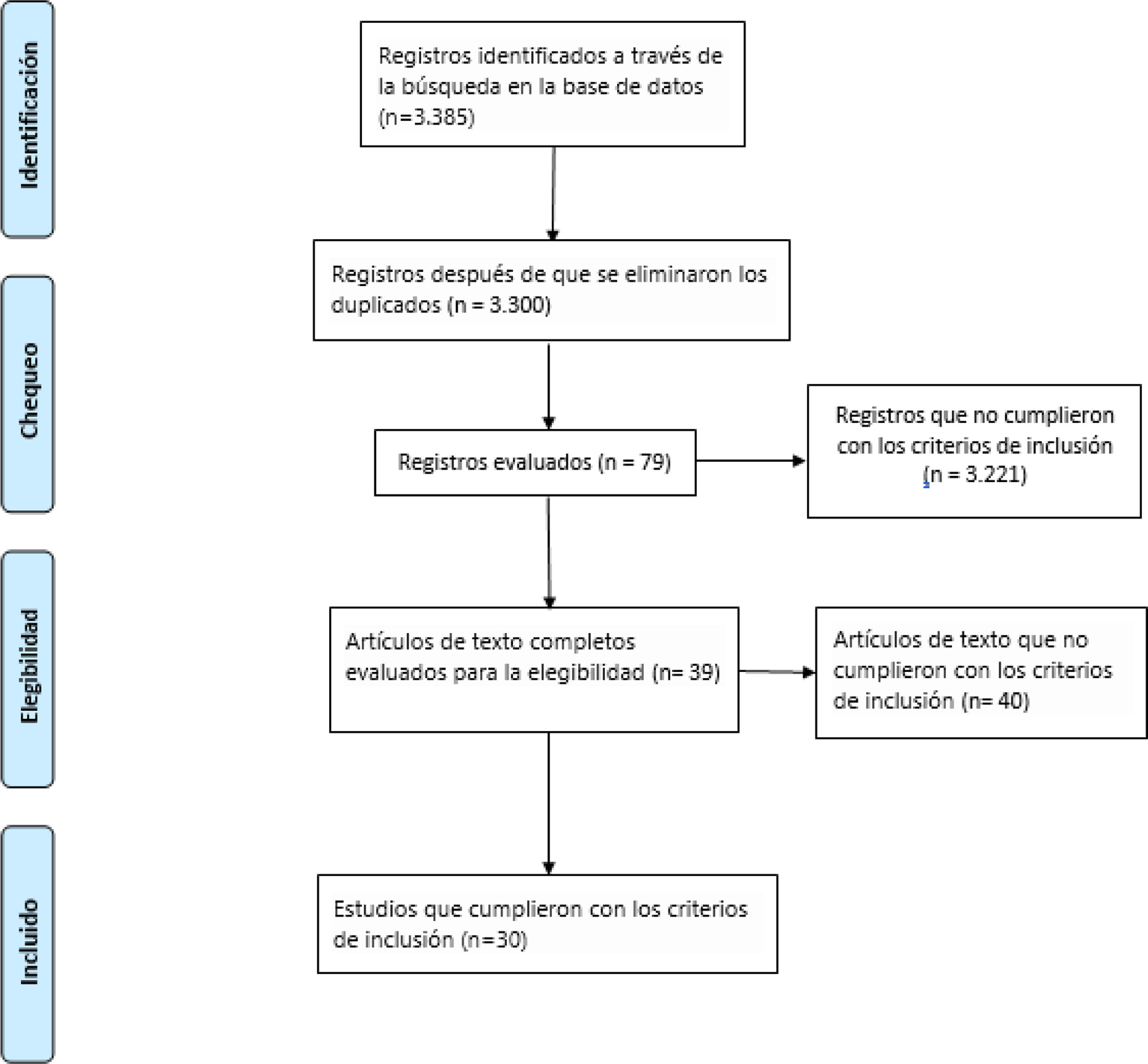
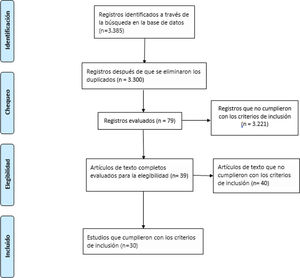
Se identificaron 3.385 artículos, de los que finalmente se seleccionaron 30 artículos con texto completo después de pasar por los diferentes filtros previamente descritos en la metodología. La figura 1 resume el proceso de selección realizado.
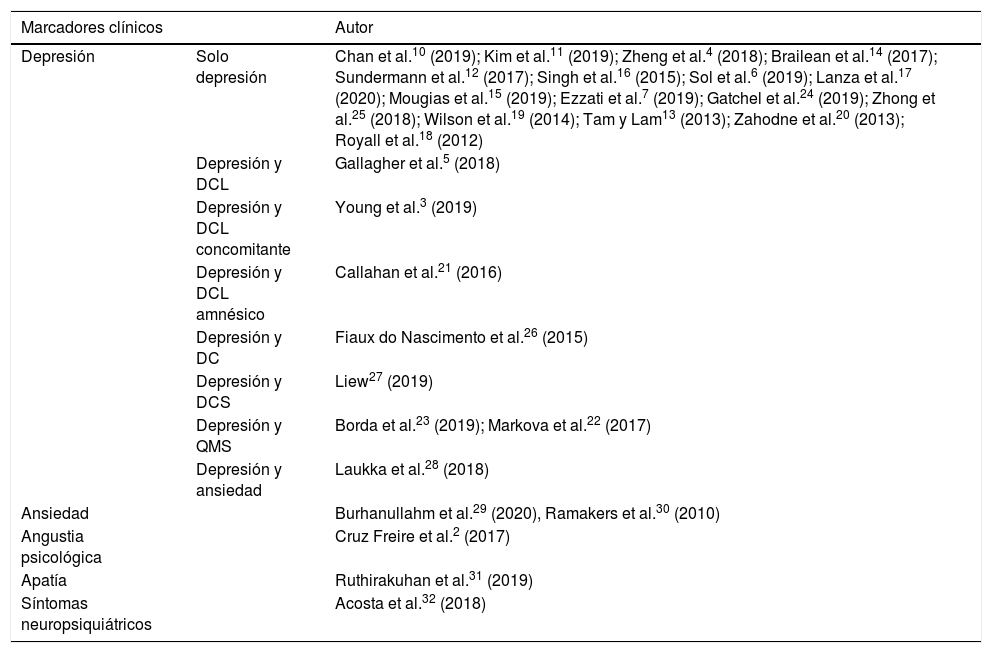
Los estudios que reportan marcadores clínicos en la EA son: estudios relacionados a depresión (23 estudios), ansiedad (2 estudios), angustia psicológica (1 estudio), apatía (1 estudio) y SNP (1 estudio). En la tabla 1 se muestra el resumen de los estudios incluidos en la presente revisión, así como los marcadores clínicos evaluados y asociados a cada uno de ellos, y en la tabla 2 se categorizan según el marcador que está implicado.
Características de los estudios incluidos
| Autores | Participantes-métodos | Marcadores clínicos | Resultados |
|---|---|---|---|
| Youn et al.3 (2019) | Estudio Cohorte. Participantes: (n=87) clasificados: (n=45) grupo cerebral CDAP (amiloide-acumulación-positivo) tenían depresión concomitante y DCL; y (n=42) grupo CDAN (amiloide-acumulación-negativo). Amiloidopatía cerebral evaluada por tomografía por emisión de 18F-florbetaben-positron. Se administró una batería de prueba neurocognitiva estandarizada y una resonancia magnética cerebral a todos los sujetos. Se examinó el genotipo de apolipoproteína E utilizando un método basado en la reacción en cadena de la polimerasa | Evaluado: DCL concomitante y depresiónAsociado: DCL concomitante y depresión | El grupo CDAN obtuvo mejores desempeños que el grupo CDAP en la recuperación de la lista de palabras y recuperación constructiva. Se observó un mejor rendimiento en la tarea de la función ejecutiva en el grupo CDAP que en el grupo CDAN |
| Chan et al.10 (2019) | Estudio longitudinal. 300 inscritos en BIOCARD (estudio Biomarcadores para controles más antiguos en riesgo de enfermedad de Alzheimer), cognitivamente normales al inicio, con un seguimiento de hasta 20 años. La gravedad de los síntomas depresivos se midió con HAM-D. Las evaluaciones clínicas y cognitivas se completaron anualmente | Evaluado: depresiónAsociado: depresión | Las puntuaciones HAM-D basales más altas se asociaron con un mayor riesgo de progresión desde la cognición normal hasta el inicio de síntomas clínicos ≤7 años, pero no con una progresión >7 años |
| Kim et al.11 (2019) | Estudio cohorte. Participantes: (n=144). Se comparó la organización denominada Richclub en la conectividad cerebral estructural entre los grupos: SMCD (n=53) individuos que tienen SMC (QMS) junto con síntomas depresivos y SMCO (n=91) individuos con SMC sin síntomas depresivos. Se obtuvieron imágenes de alta resolución ponderadas en 1 e imágenes de tensor de difusión y se realizó el análisis de red. El rendimiento de la memoria visual se midió utilizando SRM (tarea de memoria de reconocimiento espacial) y DMS (tarea de coincidencia retrasada con la muestra), mientras que la memoria de trabajo se evaluó utilizando SWM (tarea de memoria de trabajo espacial) | Evaluado: depresiónAsociado: depresión | La fuerza de conectividad entre el precúneo y otros nodos de club rico fue menor en el grupo SMCD que en el grupo SMCO. Al examinarse el precúneo izquierdo y derecho, solo la fuerza de conectividad del precúneo izquierdo se redujo más significativamente en el grupo SMCD que en el grupo SMCO, mientras que la del precúneo derecho no mostró diferencias significativas de grupo |
| Zheng et al.4 (2018) | Estudio longitudinal. Participantes (n=7.610), inscritos en ELSA (eEstudio longitudinal en inglés sobre el envejecimiento) en personas ≥50 años. Se realizaron dos evaluaciones de síntomas depresivos en la onda 1 (2002-2003) y la onda 2 (2004-2005), y de los datos cognitivos en la onda 2 y al menos una reevaluación de la función cognitiva (onda 3 a la onda 7, 2006-2007 hasta 2014-2015). Los síntomas depresivos se midieron con CES-D. La función de memoria, mediante el recuerdo inmediato y tardío. La función ejecutiva se evaluó con una tarea de fluidez verbal y la orientación por medio de preguntas | Evaluado: depresiónAsociado: depresión | Un incremento de una unidad en la suma de las puntuaciones CES-D se asoció con disminuciones más rápidas en las puntuaciones cognitivas globales, memoria, función ejecutiva y orientación. Las puntuaciones cognitivas de los participantes con síntomas depresivos persistentes se deterioraron significativamente con el tiempo en comparación con los participantes sin síntomas depresivos en la onda 1 y la onda 2 |
| Gallagher et al.5 (2018) | Estudio longitudinal. Datos usados del NACC. Participantes (n=1.965) con depresión clínicamente definida y DCL, seguidos hasta el desarrollo de la EA por un periodo de 27 meses. Se realizó una medición antidepresiva, así como examen médico y condiciones de comportamientos de salud para todos los participantes | Evaluado: DCL y depresiónAsociado: DCL y depresión | Se encontró que 656 (41,7%) de aquellos con depresión activa en los últimos dos años desarrollaron AD en comparación con 120 (31,6%) de aquellos con un historial más remoto de depresión |
| Cruz Freire et al.2 (2017) | Estudio longitudinal. Participantes (n=352), edad ≥55 años. Los adultos mayores fueron entrevistados al inicio y 2 años después. Se comparó entre 2 puntos de tiempo el puntaje de MoCA, el CIDI, que evalúa la depresión mayor y trastornos de ansiedad, y el K10, que midió el alto nivel de angustia psicológica | Evaluado: depresión, ansiedad y angustia psicológicaAsociado: angustia psicológica | La angustia psicológica de los meses anteriores tuvo un efecto negativo significativo en el puntaje global de MoCA futuro, pero el puntaje general de MoCA no tuvo ningún efecto sobre la angustia psicológica futura; para el episodio depresivo mayor y trastorno de ansiedad no se identificaron efectos predictivos estadísticamente significativos |
| Callahan et al.21 (2017) | Estudio casos y controles. Un total de 35 participantes tenían aMCI (DCL amnésico), 23 aMCI/D+ (aMCI y síntomas depresivos subclínicos), 13 LLD (depresión en la vejez) y 17 CONT (controles) de edad avanzada calificaron la valencia (positiva, negativa o neutra) de 30 imágenes del Sistema Internacional de Imagen Afectiva (IAPS). El porcentaje medio de imágenes positivas, negativas y neutrales retiradas se comparó dentro de los grupos inmediatamente y 30 minutos después | Evaluado: DCL amnésico y depresiónAsociado: DCL amnésico y depresión | El rendimiento de recuerdo inmediato y recuerdo retrasado en los participantes de CONT, aMCI y LLD se asoció con calificaciones positivas y negativas. En todos los casos las asociaciones fueron positivas, lo que indica que el recuerdo aumentó a medida que aumentaron las puntuaciones del gradiente. Ninguna de las variables fue un predictor significativo de recuerdo inmediato en el grupo aMCI/D+ |
| Brailean et al.14 (2017) | Estudio longitudinal. Participantes (n=1.506), los datos se utilizaron del Estudio longitudinal de envejecimiento Amsterdam (LASA). En el estudio actual la medición de la línea de base consistió en datos recolectados en 1995-1996. Se incluyeron cuatro medidas de seguimiento en este estudio: 1998-1999, n=1.249 (onda 2), 2001-2002, n=1.001 (onda 3), 2005-2006, n=708 (onda 4) y 2008-2009, n=520 (onda 5). Se aplicó CES-D y se sometieron a evaluación clínica y neuropsicológica | Evaluado: depresiónAsociado: depresión | Un aumento en los niveles generales de depresión se asoció con una disminución en la velocidad de procesamiento |
| Sundermann et al.12 (2017) | Estudio cohorte. Participantes (n=917), seguidos durante 4,2 años en promedio, eran cognitivamente sanos de ≥70 años, inscritos en el Estudio Einstein sobre el Envejecimiento (EAS), completaron la GDS-15 en su visita inicial. Los participantes fueron categorizados en grupos de «sin o con pocos síntomas» (puntuación GDS-15=0-2), «síntomas leves» (puntuación GDS-15=3-5) y «síntomas moderados/graves» (puntuación GDS-15>6) | Evaluado: depresiónAsociado: depresión | En comparación con los síntomas depresivos nulos o bajos, los síntomas leves se asociaron con un riesgo dos veces mayor de desarrollar aMCI en los hombres, pero no en las mujeres. Por el contrario, los síntomas depresivos moderados/graves se asociaron con un riesgo dos veces mayor de desarrollar un aMCI en las mujeres, pero no en los hombres |
| Singh et al.16 (2015) | Estudio cohorte. Participantes (n=70), mayores de 50 años, con síntomas depresivos (GDS >5) y cognitivos, seguidos por 6 meses. Se administró escitalopram en tableta y se realizó ACE al inicio del estudio y a los 3 meses después de comenzar los antidepresivos. Surgieron dos grupos en función de su perfil de evaluación cognitiva: con depresión (n=37) y con DCL (n=33) | Evaluado: depresiónAsociado: depresión | En el grupo con depresión, la puntuación media ACE de la evaluación previa a la intervención fue de 59 y en la fase posterior fue de 74; las puntuaciones medias mostraron que los dominios de atención, registro, recuerdo y fluidez verbal tienen una mejora relativamente mayor que los otros dominios cognitivos. En el grupo DCL la puntuación media ACE de la evaluación previa y posterior mostró un aumento significativo |
| Yu et al.9 (2018) | Estudio longitudinal. Participantes (n=160), evaluados en dos puntos de tiempo (promedio de 1,9 años de diferencia) en medidas de memoria-RAVLT y en síntomas depresivos-GDS. Se extrajeron un total de 14 tamaños de efecto para cada una de las dos direcciones de retardo cruzado de 6 estudios (incluido el presente; total n=8.324). Estos efectos fueron luego analizados usando un modelo de efectos mixtos de tres niveles | Evaluado: depresiónAsociado: deterioro memoria, predice síntomas depresivos | Las puntuaciones más bajas de la memoria de la línea de base se asociaron significativamente con puntuaciones más altas de GDS en el seguimiento después de controlar las puntuaciones de GDS de la línea de base |
| Laukka et al.28 (2018) | Estudio cohorte. Participantes en el estudio Lothian Birth Cohort 1921 (edad media en la ola 1=79 años, n=535), fueron examinados en cinco ocasiones a lo largo de 13 años, en la onda 2=83 años n=302, en la onda 3=87 años n=187, en la onda 4=90 años n=111 y en la onda 5=92 años n=50 participantes. La ansiedad y la depresión se midieron con HADS y el rendimiento cognitivo se evaluó con pruebas de razonamiento, memoria lógica y fluidez de letras. Los datos se analizaron utilizando modelos de efectos mixtos lineales de dos niveles PM (variable media de la persona o entre personas) y WP (dentro de la persona) | Evaluado: ansiedad y depresiónAsociado: ansiedad y depresión | En los efectos de PM, solo para la ansiedad los individuos que obtuvieron puntuaciones más altas en HADS en promedio tuvieron un rendimiento cognitivo más pobre; la asociación fue estadísticamente significativa para la fluidez de Raven's (p<0,001) y fluidez de letras. Para los efectos de la variable WP, solo para la depresión los individuos que obtuvieron una puntuación de depresión más alta se asociaron con un peor rendimiento cognitivo; la asociación fue significativa para la fluidez de letras |
| Sol et al.6 (2019) | Estudio transversal. (n=9.411) sin demencia al inicio del estudio, datos obtenidos del Estudio Nacional de Tendencias de Salud y Envejecimiento (NHATS). Se recolectaron anualmente desde 2011 onda 1, hasta la quinta onda en 2015 | Evaluado: depresiónAsociado: depresión | Menos síntomas depresivos, mayor bienestar psicológico y mayor control percibido se relacionaron cada uno independientemente con una mejor memoria inicial, pero solo los síntomas depresivos se relacionaron con la tasa de disminución más rápida de la memoria |
| Burhanullah et al.29 (2020) | Estudio longitudinal. Participantes (n=470), inscritos en el estudio del Condado de Cache, adultos clínicamente normales. La línea de base onda 1 n=960 y el seguimiento ondas 2-4 se realizaron aproximadamente con 3 a 4 años de diferencia; se recogieron medidas neuropsicológicas al inicio y en cada onda de seguimiento posterior. Los SNP se evaluaron utilizando el NPI | Evaluado: depresión y ansiedadAsociado: ansiedad | Un NPI-Total más alto se asoció con una tasa más rápida de disminución en la memoria de la lista de palabras, el recuerdo de la lista de palabras, el recuerdo de la praxis retardada y la fluidez de los animales. La NPI-Depresión de base no se asoció con el descenso en ninguna medida de resultado. Una mayor NPI-Ansiedad de base se asoció con un descenso más rápido en la prueba de modalidades de dígitos simbólicos |
| Lanza et al.17 (2020) | Estudio de cohorte, con registros de pacientes de los servicios gerontopsiquiátricos de la Universidad de Ulm en Bezirkskrankenhaus Günzburg de 2014 a 2018. 457 sujetos fueron diagnosticados con DD (DD-all). Se evaluó un subgrupo (n=176) de pacientes con biomarcadores, de los cuales fueron compatibles con EA n=86 (DD-BM+) y con depresión pura n=90 (DD-BM–); el grupo de controles sanos n=56 (HC). Se realizó una amplia batería de pruebas neuropsicológicas para evaluar el perfil cognitivo | Evaluado: depresiónAsociado: depresión | Aproximadamente un tercio de los sujetos con DD estaban por debajo de lo normal en TMT-B, fluidez semántica (categoría animales) y fluidez fonética (letra «P») y aproximadamente dos de cada tres sujetos estaban por debajo de lo normal para el recuerdo total y tardío en el CVLT. El rendimiento cognitivo medio de los pacientes con DD-BM+ no fue diferente del de los pacientes con DD-BM–. |
| Mougias et al.15 (2019) | Estudio transversal. Participantes (n=755), de 50 a 90 años, inscritos al programa «No olvide su memoria». Se analizó el papel predictivo de la edad, el sexo, la educación, la velocidad de procesamiento de la información (Trail Making Test — Parte A) y los síntomas depresivos GDS-15 ítems sobre medidas del estado cognitivo | Evaluado: depresiónAsociado: Depresión | El aumento de la edad, el nivel educativo más bajo y la velocidad de procesamiento de la información disminuida (puntuaciones TMT-A más altas) se correlacionaron significativamente con puntuaciones más bajas en todas las medidas cognitivas, mientras que los síntomas depresivos (puntuaciones GDS-15 más altas) se correlacionaron significativamente con puntuaciones más bajas en el RAVLT: medidas de retiro inmediato, P-VF y C-VF |
| Ruthirakuhan et al.31 (2019) | Estudio longitudinal. Participantes (n=4.932) inscritos al NACC diagnosticados con MCI al inicio y seguidos hasta el desarrollo de EA o pérdida, realizados entre septiembre de 2005 y febrero de 2018. Se realiza una evaluación anual. Los riesgos de desarrollar EA se evaluaron en 2 grupos: pacientes con DCL + SNP y pacientes únicamente con DCL | Evaluado: depresión y apatíaAsociado: apatía | La presencia de apatía y apatía más depresión se asoció significativamente con un aumento de las probabilidades de conversión a EA en los participantes con DCL, en comparación con aquellos sin SNP. La presencia solo de depresión en participantes con DCL no aumentó significativamente las probabilidades de conversión a EA |
| Borda et al.23 (2019) | Estudio de cohortes. Participantes (n=5.853). Este es un análisis secundario del Estudio de Salud y Envejecimiento de México (MHAS), que incluye información de tres períodos de seguimiento (2003, 2012 y 2015). Se crearon cuatro grupos de acuerdo con la sintomatología depresiva (DS) y el estado de las QMS los cuales fueron: sin SMC/sin DS, con SMC/sin DS, sin SMC/con DS y con SMC/con DS. Los análisis se estratificaron según el estado de la presión arterial | Evaluado: QMS y depresiónAsociado: QMS y depresión | Los participantes con presión arterial alta del grupo 3 (sin SMC/con DS) y el grupo 4 (con SMC/con DS) mostraron asociaciones significativas con la incidencia de deterioro cognitivo. El análisis realizado en sujetos sin presión arterial alta no mostró asociaciones estadísticamente significativas |
| Ezzati et al.7 (2019) | Estudio longitudinal. Participantes (n=1219), inscritos en el Estudio de envejecimiento de Einstein de adultos mayores, seguidos durante un máximo de 17,2 años. La GDS-15 ítems se utilizó como medida de los síntomas depresivos | Evaluado: depresiónAsociado: depresión | El efecto de los síntomas depresivos basales sobre la EA incidente fue significativo. Los resultaron indicaron que en un tiempo de <3 años de seguimiento los síntomas depresivos no se asociaron significativamente con la incidencia de demencia; sin embargo, después ≥3 años la puntuación GDS fue un predictor significativo de demencia incidente |
| Gatchel et al.24 (2019) | Estudio longitudinal. Participantes (n=276) inscritos en el Estudio de Harvard sobre el envejecimiento del cerebro (HABS); datos recopilados de septiembre de 2010 a agosto de 2017, todos sin deterioro cognitivo y con depresión leve como máximo al ingreso. Se realizaron las siguientes pruebas: GDS, PACC (Compuesto cognitivo de Alzheimer preclínico) y una medida continua de amiloide cortical usando imágenes de tomografía por emisión de positrones con PiB (compuesto B de Pittsburgh) | Evaluado: depresiónAsociado: depresión | La asociación negativa entre GDS y PACC se produjo a niveles de retención del PiB a partir de aproximadamente 1,04 DVR (relación de volumen de distribución). En contraste con la asociación entre GDS y PACC de 1 año después, la asociación de disminución de PACC con GDS creciente de 1 año no dependía de la patología de EA |
| Zhong et al.25 (2018) | Estudio de casos y controles de seguimiento 1 año. Participantes (n=148), 67 con depresión en la vejez y 81 controles normales. La función cognitiva global se evaluó mediante MMSE. Los niveles séricos de cortisol se midieron al inicio del estudio, con un sistema Architect i1000SR usando un ensayo de quimioluminiscencia | Evaluado: depresiónAsociado: depresión | Los pacientes con depresión tardía mostraron una disminución significativa en sus puntuaciones MMSE en comparación con las puntuaciones de los ancianos normales. La edad avanzada y niveles de cortisol sérico basales más altos en pacientes con depresión tardía son predictores independientes de una disminución confiable en las puntuaciones de MMSE |
| Acosta et al.32 (2018) | Estudio longitudinal. Participantes (n=1355), sin diagnóstico de demencia en la evaluación inicial, seguidos por 3 años (2003-2006). Se estableció un diagnóstico de demencia de acuerdo con 10/66 y los criterios del DSM-IV y para evaluar los SNP se usó la versión del NPI-Q | Evaluado: síntomas neuropsiquiátricosAsociado: síntomas neuropsiquiátricos | Se encontraron asociaciones individuales estadísticamente significativas para cinco SNP con la incidencia de demencia, que fueron las siguientes: alucinaciones, delirios, ansiedad, comportamiento motor aberrante y depresión. La presencia de dos SNP aumentó la incidencia de demencia con un riesgo relativo RR: 1,9, y en casos con tres o más síntomas, resultó en un RR: 3,0 |
| Markova et al.22 (2017) | Estudio transversal. Participantes (n=340), cognitivamente sanos; los datos se derivan de la tercera ola del Estudio normativo nacional de determinantes cognitivos del envejecimiento saludable (NANOK); se sometieron a una evaluación neuropsicológica completa y completaron el Cuestionario de quejas cognitivas (QPC), así como la GDS-15 ítems | Evaluado: QMS y depresiónAsociado: QMS y depresión | Varios síntomas depresivos en GDS-15 se asociaron significativamente con el número de QMS, y más QMS se asociaron con una peor puntuación MMSE. Se identificaron dos QMS relacionadas con la sintomatología depresiva: cambio de personalidad y limitación en las actividades diarias; y relacionadas con el rendimiento cognitivo: dificultades de orientación espacial y un menor rendimiento de la memoria en comparación con sus pares |
| Fiaux do Nascimento et al.26 (2015) | Estudio longitudinal. Participantes (n=701), se utilizó datos del Estudio de cohorte de envejecimiento de Bambuí (BCSA), seguimiento anual. Se calcularon los predictores de incidencia de síntomas depresivos clínicamente significativos (CSDS) durante 10 años de seguimiento, los síntomas depresivos fueron evaluados por el Cuestionario de Salud General (GHQ) 12 ítems y puntuaciones de cinco o más CSDS indicados | Evaluado: depresiónAsociado: depresión y DC | Los principales predictores de CSDS fueron deterioro cognitivo, diabetes, uso de 2 a 4 y de 5 o más medicamentos en los últimos 90 días y síntomas depresivos basales más altos |
| Wilson et al.19 (2014) | Estudio de cohorte. Participantes (n=1.764), sin deterioro cognitivo. Se utilizaron datos de dos estudios de cohorte clínico-patológicos: los participantes del Estudio de Órdenes Religiosas y el Proyecto Rush Memoria y Envejecimiento. Las evaluaciones incluyeron los síntomas depresivos CES-D-10 ítems y la función cognitiva evaluada mediante el MMSE y la batería de 17 pruebas de rendimiento. Los que murieron se sometieron a un examen neuropatológico | Evaluado: depresiónAsociado: depresión | La demencia incidente se asoció con un mayor nivel de síntomas depresivos antes del inicio de la demencia, pero una ligera disminución en los síntomas posteriores. Un mayor nivel de síntomas depresivos se asoció con una tasa más rápida de DC, lo que representa el 4,4% de la variabilidad residual en el deterioro cognitivo no atribuible a la carga neuropatológica |
| Tam y Lam13 (2013) | Estudio casos y controles. Participantes (n=549), 81 sujetos deprimidos y 468 controles, evaluados en 2 años. Evaluados mediante: MMSE, Subescala cognitiva de la escala de evaluación de la enfermedad de Alzheimer (ADAS-Cog), Prueba de fluidez verbal de categoría (CVFT), las pruebas de dígitos y de amplitud visual y el instrumento Evaluación de la discapacidad para la demencia (DAD). La gravedad de los síntomas se calificó utilizando la subescala de NPI | Evaluado: depresiónAsociado: depresión | Un diagnóstico de depresión, así como puntuaciones basales más bajos de CVFT y MMSE, predijeron un mayor riesgo de disminución de CDR en sujetos con puntuaciones CDR basales de 0. Entre los sujetos con puntuaciones CDR basales de 0,5, la severidad de la depresión predijo un mayor riesgo de progresión de la demencia |
| Zahodne et al.20 (2013) | Estudio cohorte. Participantes (n=334), clasificados con DCL amnésico, datos obtenidos de la Iniciativa de neuroimagen de la enfermedad de Alzheimer (ADNI). Los participantes se sometieron a resonancia magnética y fueron evaluados en un promedio de 5 ocasiones y durante 30,5 meses. La apatía y la depresión se midieron utilizando la versión breve del NPI-Q | Evaluado: apatía y depresiónAsociado: depresión | La depresión modera significativamente la trayectoria de la atrofia en la corteza cingulada anterior solo del hemisferio derecho, así que los individuos con depresión basal exhiben adelgazamiento cortical acelerado en esta región. La apatía no se asoció con el grosor cortical basal de ninguna región de interés. Se halló que la mayor depresión basal se asoció significativamente con la atrofia basal dentro de la corteza entorrinal derecha; esta asociación estaba en tendencia en el hemisferio izquierdo |
| Royall et al.18 (2012) | Estudio longitudinal. Participantes (n=547), inscritos al Estudio de Freedom House (FHS), evaluados en tres puntos separados durante 3 años. Se realizó una entrevista clínica estructurada usando la Escala de recursos para adultos mayores (OARS), GDS-15 ítems, CVLT, y la función de control ejecutivo se evaluó mediante entrevista ejecutiva (EXIT25) y el TMT parte A y B | Evaluado: depresiónAsociado: depresión | Las puntuaciones más altas de GDS se asociaron significativamente con el deterioro de la atención, según lo medido por los TMT A y EXIT25 en la función del control ejecutivo. Los síntomas depresivos se asocian con una disminución longitudinal de la cognición, que implica selectivamente control ejecutivo y un subconjunto de funciones ejecutivas (TMT A y EXIT25) |
| Ramakers et al.30 (2010) | Estudio cohorte. Participantes (n=263) con DCL, seguidos después de 2, 5 y 10 años. Los predictores investigados fueron evaluados por HAM-D, adicional a esto se aplicaron pruebas de MMSE, GDS, Escala de clasificación de la demencia de Blessed (BDS), pruebas de laboratorio apropiadas; una evaluación neuropsicológica y una tomografía computarizada o resonancia magnética | Evaluado: depresión, ansiedad, apatía y problemas para dormirAsociado: ansiedad | Los síntomas de depresión, ansiedad y problemas para dormir se asociaron con un menor riesgo de desarrollar EA. La depresión se asoció con un menor riesgo de EA en sujetos sin DCL amnésico. Con respecto al efecto de la duración del tiempo de seguimiento, solo en la ansiedad fue el riesgo de desarrollar EA |
| Liew27 (2019) | Estudio longitudinal. Participantes (n=13.462), tenían una cognición normal al inicio del estudio, que se basa en la base de datos del NACC. Se evaluó la depresión con GDS. Fueron seguidos casi anualmente por DCL o demencia incidente (mediana de seguimiento: 4,4 años) | Evaluado: depresión y DCSAsociado: depresión + SCD predicen trastornos neurocognitivos | La razón de riesgo (HR) de DCL y demencia aumentó gradualmente desde la depresión solamente (HR: 1,4) hasta la DCS solamente (HR 2,0), pero el HR fue más alto cuando la depresión y la DCS coexisten (HR: 2,8). Entre los individuos sin depresión o DCS, la mitad de ellos desarrollaron DCL o demencia dentro de los 12,2 años de seguimiento |
ACE: examen cognitivo de Addenbrooke; CDR: clasificación de demencia clínica; CES-D: escala de depresión del centro de estudios epidemiológicos; CIDI: entrevista internacional de diagnóstico compuesto; CVLT: prueba de aprendizaje verbal de California; DC: deterioro cognitivo; DCL: deterioro cognitivo leve; DCS: deterioro cognitivo subjetivo; DSM-IV: Manual Diagnóstico y Estadístico de Trastornos Mentales IV; EA: enfermedad de Alzheimer; GDS: escala de depresión geriátrica (Geriatric Depression Scale); HADS: escala de ansiedad y depresión hospitalaria; HAM-D: escala de depresión de Hamilton; K10: escala de angustia psicológica de Kessler; MMSE: mini examen del estado mental (MiniMental State Examination); MoCA: evaluación cognitiva de Montreal; NACC: Centro Nacional de Coordinación del Alzheimer; NPI: inventario neuropsiquiátrico; NPIQ: cuestionario de inventario neuropsiquiátrico; QMS: quejas de memoria subjetivas; RAVLT: prueba de aprendizaje verbal auditivo de Rey; SMCD: síntomas depresivos coexistentes (subjetive memory complaints with depressive symptoms); SMCO: grupo sin quejas de memoria ni síntomas depresivos (subjective memory complaints without depressive symptoms); SNP: síntomas neuropsiquiátricos; TMT-B: Trail Making Test forma B.
Fuente: Elaboración propia.
Clasificación de los marcadores clínicos
| Marcadores clínicos | Autor | |
|---|---|---|
| Depresión | Solo depresión | Chan et al.10 (2019); Kim et al.11 (2019); Zheng et al.4 (2018); Brailean et al.14 (2017); Sundermann et al.12 (2017); Singh et al.16 (2015); Sol et al.6 (2019); Lanza et al.17 (2020); Mougias et al.15 (2019); Ezzati et al.7 (2019); Gatchel et al.24 (2019); Zhong et al.25 (2018); Wilson et al.19 (2014); Tam y Lam13 (2013); Zahodne et al.20 (2013); Royall et al.18 (2012) |
| Depresión y DCL | Gallagher et al.5 (2018) | |
| Depresión y DCL concomitante | Young et al.3 (2019) | |
| Depresión y DCL amnésico | Callahan et al.21 (2016) | |
| Depresión y DC | Fiaux do Nascimento et al.26 (2015) | |
| Depresión y DCS | Liew27 (2019) | |
| Depresión y QMS | Borda et al.23 (2019); Markova et al.22 (2017) | |
| Depresión y ansiedad | Laukka et al.28 (2018) | |
| Ansiedad | Burhanullahm et al.29 (2020), Ramakers et al.30 (2010) | |
| Angustia psicológica | Cruz Freire et al.2 (2017) | |
| Apatía | Ruthirakuhan et al.31 (2019) | |
| Síntomas neuropsiquiátricos | Acosta et al.32 (2018) |
DC: deterioro cognitivo; DCL: deterioro cognitivo leve.
Fuente: Elaboración propia.
Existen estudios que evidencian que la depresión se asocia con el progreso a una EA3-26; en algunos solo la depresión antecede o se asocia a la EA4,24,25, mientras que otros muestran que la depresión más deterioro cognitivo, ya sea leve o subjetivo, están asociados4-25; en una investigación evidenciaron la asociación de la depresión acompañada de la ansiedad28, y finalmente en dos estudios se reportó una asociación entre las quejas de memoria subjetivas (QMS) y la sintomatología depresiva, como posible marcador clínico de la EA22,23.
Ezzati et al.7, al evaluar el efecto de los síntomas depresivos basales sobre la EA, indicaron que en un tiempo menor a 3 años de seguimiento los síntomas depresivos no se asociaron significativamente con la incidencia de demencia tipo Alzheimer; sin embargo, después del tercer año de seguimiento el aumento en la puntuación de la escala GDS está asociada a la EA, considerándose un predictor significativo para la EA. Un estudio longitudinal realizó un seguimiento por 20 años a una muestra de 300 participantes neurotípicos para evaluar la asociación entre la Escala de depresión de Hamilton (HAM-D) y el tiempo de inicio de DCL posterior a la evaluación de línea de base, y encontró que los puntuaciones basales más altas en la Escala de depresión de Hamilton se asociaron con un mayor riesgo de progresión hacia la EA durante los primeros 7 años de seguimiento, pero no posterior10.
Kim et al.11 hallaron que al comparar la conectividad cerebral entre el grupo que presenta QMS con síntomas depresivos coexistentes (subjetive memory complaints with depressive symptoms [SMCD]) (n=53) y el grupo sin quejas de memoria ni síntomas depresivos (subjective memory complaints without depressive symptoms [SMCO]) (n=91), la fuerza de conectividad del precúneo izquierdo se redujo significativamente en el grupo SMCD respecto al grupo SMCO, mientras que el precúneo derecho no mostró diferencias significativas, lo que sugiere que las alteraciones de la fuerza de conectividad del precúneo están asociadas con síntomas depresivos en personas de mediana edad con QMS.
Un estudio longitudinal realizado a 7.610 personas en el que se hicieron mediciones en dos momentos temporales diferentes, la primera en los años 2002-2003 y la segunda en 2004-2005, mostró dentro de sus resultados que un incremento de una unidad en la suma de las puntuaciones de la Escala de depresión del Centro de Estudios Epidemiológicos (CES-D) se asoció con disminuciones más rápidas en las puntuaciones cognitivas globales, memoria, función ejecutiva y orientación. Las puntuaciones cognitivas de los participantes con síntomas depresivos persistentes se deterioraron significativamente con el tiempo en comparación con los participantes sin síntomas depresivos en la medición 1 y 24.
Sundermann et al.12 evidenciaron que, en comparación con los síntomas depresivos nulos o bajos, los síntomas leves se asociaron con un riesgo dos veces mayor de desarrollar DCL amnésico en los hombres pero no en las mujeres. Por el contrario, los síntomas depresivos moderados/graves se asociaron con un riesgo dos veces mayor de desarrollar un DCL amnésico en las mujeres, pero no en los hombres. Por otro lado, Tam y Lam13 determinaron que un diagnóstico de depresión, así como puntuaciones basales más bajos en la prueba de fluidez verbal de categoría y en el Mini examen del Estado Mental (MiniMental State Examination [MMSE]) predicen un mayor riesgo de disminución en la Clasificación de demencia clínica (CDR) en sujetos con puntuaciones CDR basales de 0. Entre los sujetos con puntuaciones CDR basales de 0,5 la severidad de la depresión en lugar del diagnóstico de depresión predijo un mayor riesgo de progresión de la demencia. El riesgo de disminución de la CDR también se asoció con un mayor riesgo de deterioro funcional sin una disminución significativa en el rendimiento de MMSE. En sujetos con puntuaciones de CDR de 0,5, un diagnóstico de depresión se asoció con un mayor riesgo de deterioro funcional.
Brailean et al.14 identificaron en una muestra de 1.506 participantes mediante el instrumento CED-S que el aumento en los niveles generales de depresión se asoció con una disminución en la velocidad de procesamiento; sin embargo, Mougias et al.15 evidenciaron que la velocidad de procesamiento no se correlacionó significativamente con puntuaciones bajas en los síntomas depresivos evaluados mediante la escala GDS-15 ítems, mientras que sí se asoció con puntuaciones más bajas en el Prueba de aprendizaje verbal auditivo de Rey (RAVLT), medidas de retiro inmediato, y en la prueba de fluidez verbal.
Lo anterior también fue informado por Singh et al.16, quienes al comparar dos grupos, uno con depresión y el otro con DCL, y suministrar escitalopram en tableta al inicio del estudio y a los 3 meses después de comenzar los antidepresivos, evidenciaron que en el grupo con depresión las puntuaciones medias mostraron que los dominios de atención, registro, recuerdo y fluidez verbal tenían una mejora relativamente mayor que los otros dominios cognitivos, indicando que en aquellos que tienen un trastorno del estado de ánimo primario, el alivio de estos síntomas produce una mejora significativa en su condición cognitiva.
Asimismo, un estudio observacional basado en los registros de pacientes gerontopsiquiátricos encontró que aproximadamente un tercio de los sujetos con depresión presentaban un desempeño inferior a lo esperado en la prueba Trail Making Test forma B (TMT-B) fluidez semántica (categoría animales) y fluidez fonética (letra «P») y aproximadamente dos de cada tres sujetos presentaban un desempeño por debajo de lo esperado para el recuerdo total y tardío en el Prueba de aprendizaje verbal de California (CVLT)17. En otra investigación los síntomas depresivos se asociaron con una disminución longitudinal de la cognición; sin embargo, esta asociación implica selectivamente control ejecutivo, no función de la memoria, y un subconjunto de funciones ejecutivas18.
Wilson et al.19 utilizaron datos de dos estudios de cohorte clínico-patológicos, conformados por 1.764 participantes; evaluaron síntomas depresivos con la escala CES-D de 10 ítems, función cognitiva mediante el MMSE y 17 pruebas de rendimiento. Un total de 582 individuos murieron durante el seguimiento y se sometieron a un examen neuropatológico uniforme para cuantificar las placas beta-amiloides y la densidad de la proteína Tau en múltiples regiones del cerebro e identificar los cuerpos neocorticales de Lewy, la esclerosis del hipocampo y los infartos cerebrales macroscópicos y microscópicos; durante el seguimiento, el 52,2% de la cohorte desarrollaron DCL, que se asoció con un mayor nivel de síntomas depresivos antes del inicio del DCL, pero no con la tasa de cambios en los síntomas después del inicio del DCL. El 17,9% desarrollaron EA durante el seguimiento. La incidencia se asoció con una mayor cantidad de síntomas depresivos antes del inicio de la demencia, pero una ligera disminución en los síntomas posteriores. De acuerdo con el modelo de efectos mixtos ajustado para marcadores neuropatológicos, un mayor nivel de síntomas depresivos se asoció con una tasa más rápida de DCL, lo que representa el 4,4% de la variabilidad residual en el deterioro cognitivo no atribuible a la carga neuropatológica.
Un estudio de cohorte, que incluía participantes con DCL amnésico, valorados mediante resonancia magnética en serie realizada en escáneres de 1,5 Tesla con un promedio de 5 escaneos durante 30,5 meses, aplicó la versión breve del Cuestionario de inventario neuropsiquiátrico (NPI-Q) para evaluar la apatía y la depresión. Hallaron que la depresión modera significativamente la trayectoria de la atrofia en la corteza cingulada anterior de tal manera que los individuos con depresión basal exhiben adelgazamiento cortical acelerado en esta región, pero la apatía no se asoció con el grosor cortical basal de ninguna región de interés. También se identificó que la depresión basal se asoció significativamente con la atrofia basal dentro de la corteza entorrinal derecha y con la atrofia acelerada de la corteza cingulada anterior dentro del hemisferio izquierdo20.
Otras investigaciones han encontrado que no solo la depresión se relaciona con el progreso a la EA, sino la depresión coexistente con el DCL o deterioro cognitivo subjetivo (DCS) o QMS. De este modo, Gallagher et al.5 mostraron que el subtipo amnésico de DCL, la presencia de alelo APOE4 y la presencia de depresión activa en los últimos dos años se asocia significativamente con el desarrollo de la EA. En un análisis de subgrupos que comparó a participantes con depresión durante los últimos dos años, respecto a aquellos con un historial aislado de depresión, se evidenció que 656 (41,7%) de los participantes con depresión activa en los últimos dos años desarrollaron EA en comparación con 120 (31,6%) de aquellos con un historial aislado de depresión.
Callahan et al.21 compararon cuatro grupos que incluían participantes con DCL amnésico, DCL amnésico con síntomas depresivos subclínicos, depresión y grupo control; después de mostrarles 30 imágenes positivas, negativas y neutrales retiradas inmediatamente y presentadas 30minutos después, evidenciaron que el rendimiento general de la memoria fue comparable entre el grupo de DCL amnésico y aquellos con síntomas depresivos coexistentes, mostrando un menor desempeño en tareas de evocación en comparación con el grupo control y los pacientes diagnosticados con depresión.
Un estudio longitudinal de seguimiento anual realizado con 13.462 participantes neurotípicos mostró que 1.490 (11,1%) participantes desarrollaron DCL, mientras que 695 (5,2%) desarrollaron demencia, siendo predominante la demencia tipo Alzheimer27. La depresión y el DCS demostraron riesgos independientes de DCL y demencia. El riesgo fue mayor cuando la depresión y el DCS coexisten. A su vez, la mitad de los participantes de este grupo desarrollaron DCL y demencia dentro de los 7,2 años de seguimiento (en comparación con los 12,2 años en los participantes sin depresión o DCS)27. Markova et al.22 mencionan que varios síntomas depresivos en la escala GDS-15 ítems se asocian significativamente con el número de QMS, y estas se asocian a un peor puntaje en el MMSE.
Un estudio de cohorte evaluó la ansiedad y la depresión en adultos mayores mediante la Escala de ansiedad y depresión hospitalaria (HADS) y el rendimiento cognitivo se evaluó con pruebas de razonamiento, memoria lógica y fluidez de letras. Al analizar los datos en dos niveles interpersonal e intrapersonal se halló que los cambios interpersona para la depresión no fueron significativos, mientras que, para la ansiedad, los individuos que obtuvieron puntuaciones más altas en la HADS en promedio tuvieron un rendimiento cognitivo más pobre; la asociación fue estadísticamente significativa para la fluidez de Raven (p<0,001) y fluidez de letras, mientras los cambios intrapersona parecieron más influyentes para la depresión. Los individuos que obtuvieron un puntaje de depresión más alto de lo normal se asociaron con un peor rendimiento cognitivo28.
Por otra parte, Yu et al.9 encontraron que la memoria predice la depresión, pero esta no predice el deterioro de la memoria, y los resultados de su estudio mostraron que las puntuaciones más bajas de la memoria de la línea de base se asociaron significativamente con puntuaciones más altas de la escala de GDS en el seguimiento; no obstante, el efecto inverso no fue estadísticamente significativo. Las puntuaciones iniciales del GDS no predijeron significativamente la memoria en el seguimiento después de controlar la memoria inicial. La ruta autorregresiva fue significativa para la memoria, pero no para las puntuaciones de la escala GDS.
Ansiedad (marcador clínico)Algunos estudios, al evaluar la depresión y la ansiedad, encontraron que solo la ansiedad se asoció con un deterioro cognitivo y/o progreso a la EA29,30. Burhanullah et al.29 evalúaron la asociación de las puntuaciones totales del inventario neuropsiquiátrico y las dimensiones de depresión y ansiedad con el posterior inicio del deterioro cognitivo. Como resultado se evidenció que una mayor puntuación total en el inventario neuropsiquiatrico se asocia con una tasa más rápida de disminución en la memoria de la lista de palabras, el recuerdo de la lista de palabras, el recuerdo de la praxis retardada y la fluidez de los animales, mientras que una puntuación alta en la dimensión de depresión de base no se asoció con el descenso en ninguna medida de resultado. Sin embargo, una mayor puntuación en la dimensión de ansiedad se asoció con un descenso más rápido en la prueba de dígitos y símbolos. De igual manera, Ramakers et al.30 encontraron que los síntomas de depresión, ansiedad y problemas para dormir se asociaron con un menor riesgo de desarrollar EA; la depresión se asoció con un menor riesgo de EA en sujetos sin DCL amnésico, pero no en sujetos con DCL amnésico. Sin embargo, considerando la duración del seguimiento, solo la ansiedad fue un factor de riesgo para desarrollar EA, mostrando diferencias significativas entre los sujetos diagnosticados con EA a los 5 años de seguimiento y los sujetos recién diagnosticados con EA.
Angustia psicológica (marcador clínico)Cruz Freire et al.2 evaluaron en dos momentos diferentes a 2.433 participantes utilizando la Evaluación cognitiva de Montreal (MoCA), la entrevista internacional de diagnóstico compuesto, que evalúa la depresión mayor y los trastornos de ansiedad, y la escala de angustia psicológica de Kessler (K10), que mide el nivel de angustia psicológica. El estudio evidenció que a mayor angustia psicológica en el mes anterior a la valoración y una depresión mayor en los 12 meses anteriores fueron factores predictivos de deterioro cognitivo en la segunda medición.
Sin embargo, en el modelo de análisis de trayectoria la angustia psicológica previa tuvo un efecto negativo significativo en el puntaje global de MoCA futuro, pero el puntaje general de MoCA no tuvo ningún efecto sobre la angustia psicológica futura, mientras que para el episodio depresivo mayor y el trastorno de ansiedad no se identificaron efectos predictivos estadísticamente significativos, ya sea del estado de trastorno mental en la puntuación general de MoCA o en la puntuación general de MoCA en el estado de trastorno mental. De este modo, cuando la angustia psicológica y la depresión se introdujeron por separado en un modelo de regresión lineal múltiple, controlado por otras variables, se perdió la significación estadística, lo que sugiere que las otras variables están asociadas con la depresión y la angustia psicológica y tienen más poder para explicar el deterioro cognitivo.
Apatía (marcador clínico)Un estudio longitudinal realizado a 4.932 participantes inscritos al Centro Nacional de Coordinación de Alzheimer (NACC) diagnosticados con DCL y seguidos hasta el desarrollo de EA permitió identificar que el 37% de los pacientes con DCL que presentaban SNP desarrollaron EA durante el proceso de seguimiento (23 meses aproximadamente). La presencia de apatía y depresión se asoció significativamente con un aumento de las probabilidades de conversión a EA en los participantes con DCL, en comparación con aquellos sin SNP, pero la presencia solo de depresión en participantes con DCL no aumentó significativamente la probabilidad de conversión a EA31.
Síntomas neuropsiquiátricos (marcador clínico)Acosta et al.32 analizaron la asociación entre los SNP y la progresión a la demencia. Para evaluar los SNP usaron el Cuestionario del inventario neuropsiquiátrico (NPI-Q) y encontraron asociaciones individuales estadísticamente significativas para cinco síntomas con la incidencia de demencia, que fueron las siguientes: alucinaciones, delirios, ansiedad, comportamiento motor aberrante y depresión. Cuando se comparó con individuos con cero o un síntoma, la presencia de dos síntomas del inventario NPI-Q aumentó la incidencia de demencia con un riesgo relativo de 1,9, y en casos con tres o más síntomas resultó un riesgo relativo de 3,0.
DiscusiónSe realizó una búsqueda exhaustiva de artículos que permitió evidenciar que la depresión ha sido el marcador clínico más estudiado y asociado al desarrollo de la EA3-26. En algunas de estas investigaciones la progresión a la EA se asocia con la depresión o con la depresión y otros síntomas o patologías coexistentes (DCL, DCS, QMS o ansiedad). Sin embargo, la información referente a la angustia psicológica2, ansiedad28,30,31 o los SNP32 como marcadores clínicos asociados a la EA es reportada en menor medida. Algunas investigaciones3,5,21-23,26,27 reportaron que no solo la depresión se relacionó con el progreso a la EA, sino que esa asociación era más significativa cuando se presentaba la depresión en el DCL, el DCS o la QMS. Los instrumentos más utilizados en los estudios para evaluar la depresión fueron las escalas GDS, CES-D y HAM-D; y para evaluar los SNP, el NPI.
Los estudios de cohortes y de casos y controles dan mayor claridad al momento de analizar los marcadores clínicos (depresión, ansiedad, angustia psicológica, apatía y SNP) de la EA, y particularmente en esta revisión fueron varios los hallados de este tipo3,11-13,16,17,19-21,23,25,28,30. Aunque los estudios de cohortes y casos y controles son importantes a la hora de analizar o de hacer seguimiento a las variables clínicas analizadas, se presentan limitaciones en tanto que la variable a estudiar (depresión) tiene múltiples manifestaciones que pueden generar comorbilidades, por lo que la conformación de los grupos resulta no ser de manera pura, sino que puede estar siendo contaminada por las otras variables.
Así mismo, tal como lo mencionan los estudios de cohortes o longitudinales analizados, es crucial que durante el seguimiento los participantes continúen siendo evaluados hasta el final. A pesar de ello, en varios estudios5,13,14,26,27,32 se evidenció la limitación de pérdida de seguimiento, abandonos y elevada tasa de deserción, esto último mediado por la alta mortalidad en este grupo etario.
Por otra parte, los estudios transversales6,15,22, a diferencia de los mencionados, son una limitante al observar la interacción entre el predictor clínico y la EA, considerando que se evalúa en un tiempo específico y no permite examinar la incidencia de la depresión, ansiedad, angustia psicológica, apatía o SNP longitudinalmente en la tasa de deterioro cognitivo.
En general, se espera que las relaciones entre el predictor o marcador clínico sean estadísticamente significativas para la progresión a una EA o a deterioro cognitivo. Sin embargo, al analizar algunos de los estudios incluidos se pudo evidenciar que las diferencias estadísticas fueron mínimas2,7,11,22,28,30, por lo cual estos hallazgos deben ser interpretados con cautela.
Por otra parte, Ruthirakuhan et al.31 evidenciaron que la presencia de apatía coexistente con depresión se asoció significativamente con un aumento de las probabilidades de conversión a EA en los participantes con DCL; no obstante, la presencia solo de depresión en participantes con DCL no aumentó las probabilidades de conversión a EA, lo que denota que aunque la apatía más depresión se relaciona con EA, la depresión en sí no se encuentra significativamente asociada con un progreso a una EA. Estos hallazgos son similares a lo reportado por Yu et al.9, que encontraron que, a pesar de que la memoria predice la depresión, esta no predice el deterioro de la memoria, evidenciando así que el efecto inverso no fue estadísticamente significativo.
Finalmente, la falta de identificación precisa de síntomas depresivos, el uso de uno o pocos instrumentos o de escalas de autoinforme de síntomas depresivos en la evaluación que sean altamente confiables puede llevar a subestimar los síntomas, especialmente a medida que se deteriora la cognición, siendo así un sesgo en la exposición de los resultados de algunos estudios incluidos en la presente revisión4,12,19.
ConclusiónLos estudios identificados mostraron que existe una asociación entre la depresión y la progresión de la EA. Sin embargo, este antecedente clínico se consideraría como un factor de riesgo más, no como un predictor o marcador clínico del desarrollo de la EA, considerando que su impacto en el desarrollo de la EA se ve afectado por la coexistencia de otros síntomas o patologías.
FinanciaciónEl presente proyecto fue financiado por la Convocatoria N̊ 856 de 2019 Jóvenes investigadores e innovadores para el departamento del Huila del Ministerio de Ciencia, Tecnología e Innovación de la Republica de Colombia y se enmarca dentro del proyecto de investigación INV2384 “Medición longitudinal de la función de integración en la memoria a corto plazo en pacientes con deterioro cognitivo leve”.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Agradecemos a Minciencias por la beca pasantía otorgada en el ejercicio de Joven investigadora en la ejecución del proyecto relación entre rasgos de depresión y estado cognitivo en adultos mayores de la ciudad de Neiva, Huila.