A 31-year-old woman, with signs of HIV infection (oral thrush, weight loss, asthenia) presented to our hospital with dyspnea and fever. A rapid HIV test yielded a positive result, and cryptococcal capsular antigen was detected in serum. In the mycological study of the clinical respiratory samples, yeasts compatible with Cryptococcus were observed under light microscope in a wet mount; structures compatible with Pneumocystis jirovecii were also observed in Giemsa stain. Treatment for both pathologies was prescribed but, unfortunately, the patient died 7 days after. The finding of two etiologic agents in the same clinical picture is rare but not exceptional, and it always must be considered in immunocompromised hosts.
Paciente de 31 años y sexo femenino que nació y vivió en la Ciudad Autónoma de Buenos Aires, Argentina, en vivienda con sanitarios completos y necesidades básicas satisfechas. Refirió haber realizado viajes a la costa atlántica (provincia de Buenos Aires). Fue fumadora de 10 cigarrillos al día desde los 18 hasta los 30 años. No consumía alcohol. Como antecedentes acerca de su estado de salud solo dijo haber padecido varicela en la infancia. Acudió a la consulta por disnea clase funcional II/III de 3 semanas de evolución y fiebre durante los últimos 3 días.
Examen físicoLa paciente estaba adelgazada, manifestaba una marcada astenia, las conjuntivas estaban hipocoloreadas y las fauces presentaban membranas blanquecinas entre el paladar duro y el blando. Estaba lúcida, orientada en tiempo y espacio, y sin signos de foco motor ni meníngeo. La tensión arterial era 110-60mmHg, la frecuencia cardíaca 108latidos/min, la frecuencia respiratoria 27respiraciones/min, y la temperatura axilar 38,2°C. En el examen cardiovascular los ruidos eran normofónicos y no se auscultaban soplos. La mecánica ventilatoria era buena, con hipoventilación en ambos hemitórax sin ruidos agregados; ambos hemitórax eran sonoros a la percusión. A la palpación el abdomen se encontraba blando, indoloro, no se notaban visceromegalias y los ruidos hidroaéreos eran normales.
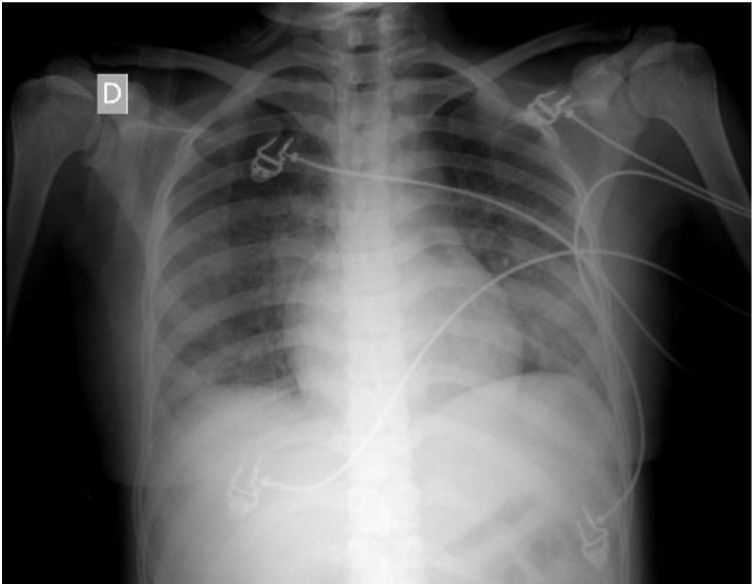
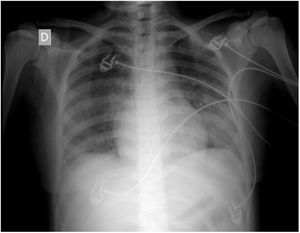
Estudios por imágenesEn la radiografía de tórax se observó el patrón retículo-intersticial bilateral que puede verse en la figura 1.
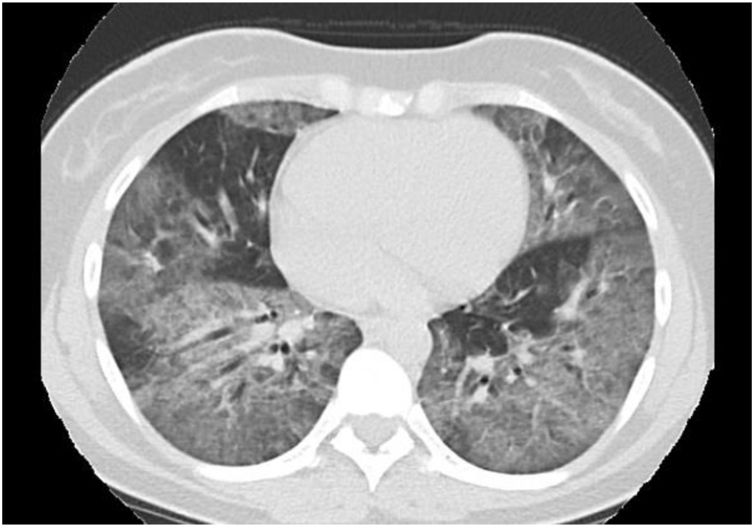
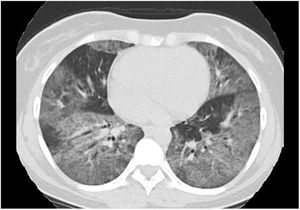
Se realizó, además, una tomografía axial computarizada sin contraste de tórax que evidenció un patrón intersticial en vidrio esmerilado generalizado con algunas zonas de hiperclaridad y engrosamiento de septos interlobulillares (fig. 2).
Estudios complementarios de laboratorioEritrosedimentación 88mm en la primera hora, hematocrito 33%, hemoglobina 10,6g/dl, plaquetas 294.000/μl, leucocitos 7.300/μl (neutrófilos 85,3%, linfocitos 9,6%, monocitos 3,9%, eosinófilos 0% y basófilos 0,1%), transaminasa glutámico-oxalacética 27U/l, transaminasa glutámico-pirúvica 21U/l, fosfatasa alcalina 202U/l, glucosa 112mg/dl, urea 16mg/dl, creatinina 0,5mg/dl, lactato deshidrogenasa 1.040U/l, creatina-fosfoquinasa 34U/l, procalcitonina 0,29ng/ml, sodio 138mEq/l, potasio 5,6mEq/l, cloruros 97mEq/l. Estudio de gases en sangre: FIO2 21%; pH 7,44; pCO2 32,4mmHg; pO2 55,3mmHg; BE −2,2mmol/l; HCO3 22,4mmol/l; saturación O2 92%.
Se realizó una prueba rápida para la detección del VIH que resultó positiva. Otras pruebas serológicas fueron la búsqueda de anticuerpos para la enfermedad de Chagas, de anticuerpos anti-Treponema pallidum, y marcadores de las hepatitis B y C; todas estas pruebas fueron no reactivas. Además, se realizó una inmunocromatografía (IC) para la detección de antígeno capsular de Cryptococcus (CrAg) en suero, que fue positiva, y se realizó la titulación por aglutinación de partículas de látex, que fue negativa. El recuento de linfocitos T fue el siguiente: CD4+ 13cél/μl, CD8+ 363cél/μl y CD3+ 394cél/μl. Se realizaron hemocultivos para bacterias, micobacterias y hongos, que resultaron negativos. Se realizó el examen microbiológico del líquido cefalorraquídeo (examen directo con tinta china, coloración de Gram y cultivo en medios para bacterias y hongos), que no arrojó ningún dato.
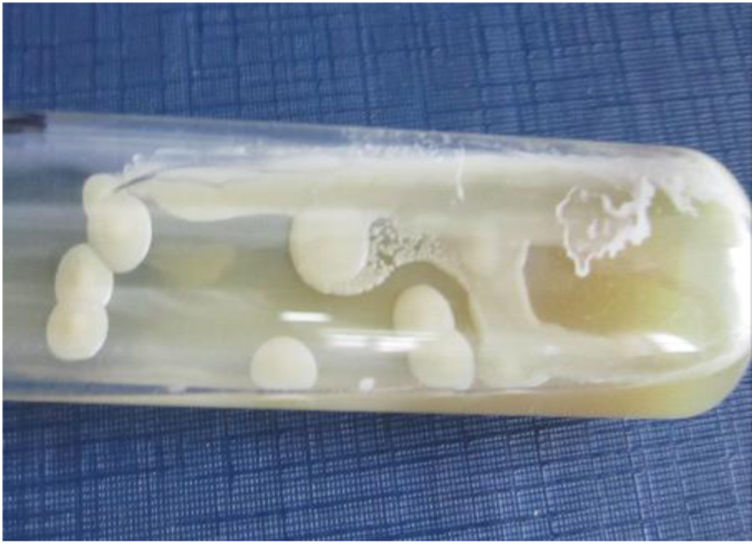
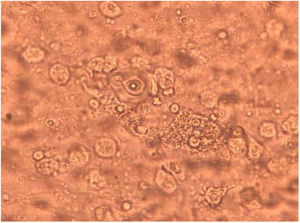
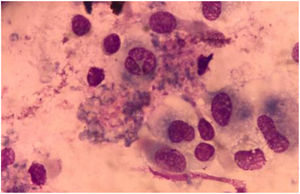
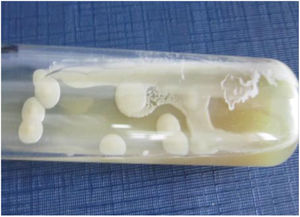
La paciente fue sometida a un lavado broncoalveolar (LBA); sobre la muestra obtenida se realizaron estudios microbiológicos para bacterias, micobacterias, virus y parásitos, que arrojaron resultados negativos. Con el examen micológico de esta muestra, sin embargo, se llegó al diagnóstico de coinfección de dos patógenos mediante el examen directo en fresco y la coloración de Giemsa (figs. 3 y 4). Posteriormente, en el cultivo se aisló uno de los agentes etiológicos observados previamente (fig. 5). Mediante la técnica de PCR se buscó la presencia en la muestra de LBA de Pneumocystis jirovecii e Histoplasma capsulatum; el resultado fue positivo para el primero y negativo para el segundo. Se prescribió tratamiento específico para las dos enfermedades oportunistas diagnosticadas, además de oseltamivir (75mg/día). Lamentablemente, la paciente evolucionó desfavorablemente y falleció al cabo de 7 días.
Preguntas- 1)
Teniendo en cuenta el cuadro clínico y los resultados de laboratorio junto con las imágenes, ¿cuáles son los diagnósticos más probables? ¿Qué estudios realizaría para certificar esos diagnósticos?
- 2)
La antigenemia para Cryptococcus por IC resultó positiva, ¿qué información da este resultado? ¿A qué podría deberse la discordancia entre los resultados obtenidos por la técnica de IC y los de aglutinación de partículas de látex? ¿Qué conducta tomaría? ¿En qué pacientes se recomienda realizar la búsqueda temprana de CrAg por IC?
- 3)
Tras realizar el LBA se procesó el material y en la microscopia se observó lo que se muestra en las figuras 3 y 4. ¿Qué estructuras reconoce? ¿Cuál es el diagnóstico? ¿Cuál de los patógenos se obtuvo en el cultivo y cómo se puede realizar la tipificación de dicho patógeno?
- 4)
¿Qué valor les adjudica a los métodos moleculares como herramientas diagnósticas?
- 5)
¿Cuál o cuáles serían los tratamientos de elección? ¿Cuál es el momento adecuado para dar inicio a la terapia antirretroviral (TARV) y por qué?
- 1.
La evaluación clínica evidenció una paciente cuyo estado general se encontraba muy deteriorado, con signos de muguet (afección marcadora y primera en frecuencia entre las micosis en enfermos con sida) y mal estatus inmunológico, que se confirmó mediante los estudios de laboratorio, sumado al compromiso pulmonar que se observó en las imágenes. Los diagnósticos posibles son múltiples, los más probables serían tuberculosis, neumocistosis, criptococosis e histoplasmosis por su frecuencia y por su tropismo por el sistema respiratorio. En el contexto actual, también debería pensarse en infección por SARS-CoV-2 y en época invernal por el virus de influenza. Para confirmar el diagnóstico se debe realizar el examen microbiológico de muestras respiratorias y hemocultivos por lisis-centrifugación. Además, en un paciente con estas características se debe realizar antigenemia de Cryptococcus (por IC) y la detección del antígeno de Histoplasma (ELISA) en orina. En lo que respecta a la tuberculosis, además de la baciloscopia y el cultivo se utiliza la detección molecular de micobacterias en muestras respiratorias (GEN Xpert® MTB/RIF), que es más sensible y permite iniciar un tratamiento precozmente.
- 2.
La detección de CrAg por IC indica la presencia de Cryptococcus y, por lo tanto, existe riesgo de progresión a una criptococosis meníngea. Es una herramienta de diagnóstico temprano que permite aplicar medidas preventivas en el paciente, ya que el CrAg puede detectarse incluso semanas antes de la aparición de los síntomas. Las concentraciones más altas del CrAg se detectan en la criptococosis diseminada y su titulación es útil para el seguimiento de esta micosis. La IC está validada para el diagnóstico de enfermedad en suero, plasma y sangre entera. Diversos autores destacan que para la detección temprana del CrAg circulante el uso de sangre entera no tiene tan buena sensibilidad como el uso del suero. Dicha prueba es más sensible que la aglutinación por partículas de látex, por lo cual pueden existir resultados discordantes. El límite de detección de la IC es de 1ng/ml y varios estudios postulan que su sensibilidad llegaría al 100%. Puede haber falsos negativos, ya sea por baja carga fúngica, cepas pobremente capsuladas o por el efecto prozona, y también falsos positivos, que deben sospecharse cuando al realizar la cuantificación se obtienen títulos menores de 1:10 y no existen otros elementos clínicos o microbiológicos sugestivos de criptococosis3. Ante una prueba de IC positiva para CrAg se debe titular el CrAg y realizar una punción lumbar para descartar un compromiso meníngeo. En base a estos resultados se instaura el tratamiento para la criptococosis en el caso de su diagnóstico, o una terapia preventiva en caso negativo. Además, deben realizarse hemocultivos (lisis-centrifugación o métodos automatizados) útiles para detectar criptococcemia. Si se descarta el compromiso del sistema nervioso central, se continúa con fluconazol 800mg/día (su uso mejora la supervivencia) hasta obtener hemocultivos o cultivos de otros materiales clínicos negativos para este microorganismo. Si todos los resultados son negativos se continúa con tratamiento preventivo (pre-emtive therapy), de lo contrario se rota al tratamiento recomendado para la criptococosis y se adapta según el o los órganos comprometidos. Actualmente, la propuesta más aceptada de tratamiento preventivo es el fluconazol, 800mg/día durante dos semanas, y después 400mg/día durante 4 semanas, y se comenzaría TARV a las dos semanas. En el caso de títulos superiores a 1/160 por la técnica de IC la indicación sería fluconazol 1200mg/día durante 4 semanas, después 400mg/día durante 8 semanas y por último seis meses más con 200mg diarios7. La detección temprana de CrAg por IC se recomienda en los pacientes con sida con recuentos de linfocitos T CD4+ inferiores a 200cél/μl, asintomáticos y sin antecedentes de criptococosis con el objeto de detectar precozmente o prevenir la criptococosis meníngea.
- 3.
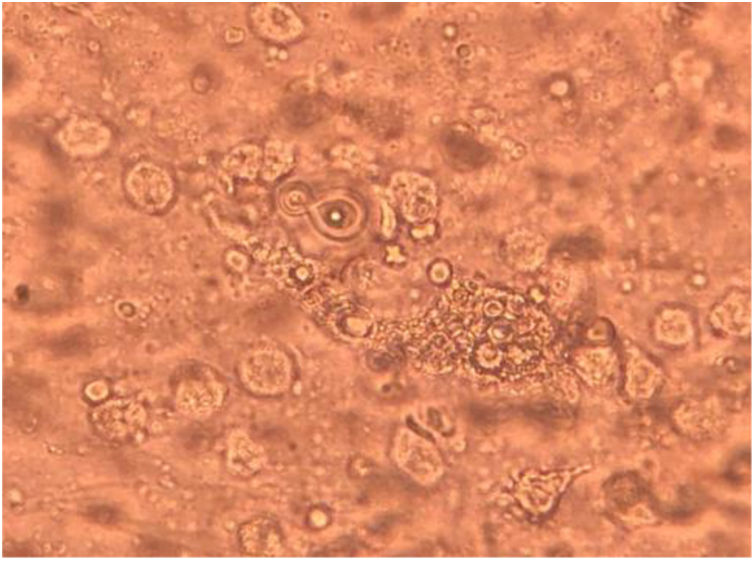
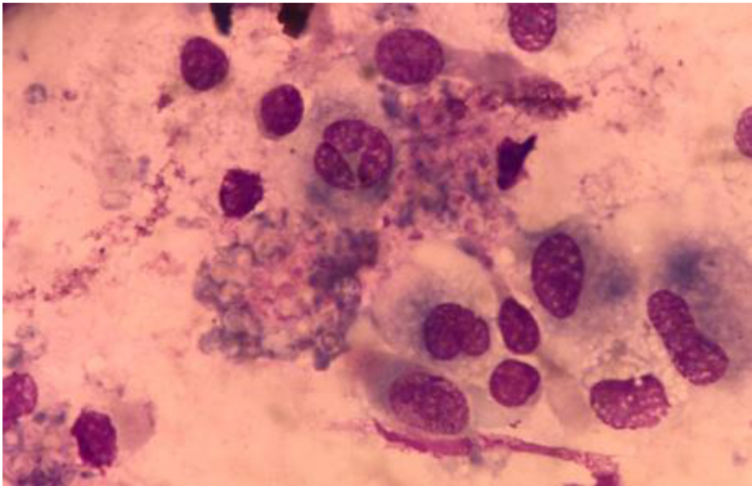
En la preparación microscópica en fresco de la figura 3 se observan levaduras capsuladas compatibles con Cryptococcus. Si bien su hallazgo en el cultivo de estas muestras no es diagnóstico de la criptococosis, ya que ocasionalmente podrían encontrarse como colonizadores transitorios, en este caso se observó en el examen directo en fresco. Dado que se trataba de una paciente VIH+ de reciente diagnóstico con una prueba positiva de CrAg en suero, su hallazgo completó el diagnóstico de criptococosis. La figura 4 muestra una preparación microscópica coloreada con Giemsa en la que se observan las ascosporas inmersas en la estructura de exudado espumoso típico de P. jirovecii. En el caso de este patógeno, el examen directo es el estándar de oro para el diagnóstico de certeza de la neumocistosis pulmonar, ya que es un microorganismo no cultivable. La paciente presentaba, entonces, criptococosis y neumocistosis. Es importante tener presente que en pacientes inmunocomprometidos no es excepcional la presencia concomitante de diversas patologías, sea en el mismo o en diversos órganos blanco. El patógeno obtenido en el cultivo del LBA fue Cryptococcus. Este hongo crece en los medios tradicionales de cultivo micológico como colonias glabras, cremosas, blancas o beige. Las pruebas básicas para la confirmación del género son la capacidad de crecimiento a 37°C, la producción de ureasa en medio de Christensen y la producción de fenoloxidasa, que se evidencia por el crecimiento de colonias de color marrón en el agar semillas de girasol. La capacidad de crecimiento en los medios de Salkin y glicina-canavanina-azul de bromotimol permiten la diferenciación entre especies de Cryptococcus neoformans y Cryptococcus gattii. La amplificación por PCR del gen Ura5 seguida de digestión enzimática y análisis de los polimorfismos en los fragmentos de restricción (RFLP) sirve para definir el genotipo5. En este caso el aislamiento se identificó como C. neoformans genotipo VNII.
- 4.
Pneumocystis jirovecii es un hongo con marcado estenoxenismo que parasita de forma pericelular los neumocitos y que requiere, por su localización, de profesionales altamente entrenados para su observación. Desde hace varios años el uso de técnicas moleculares para su detección es controvertido por la sospecha de que por la alta sensibilidad de la técnica no permitiría diferenciar colonización de infección. En nuestra experiencia en el uso de PCR anidada, si se considera el examen directo positivo como verdadero positivo, la sensibilidad de la PCR es del 95,7%, la especificidad del 88,7%, el valor predictivo positivo (VPP) del 52,9% y el valor predictivo negativo (VPN) del 99,4% (datos no publicados). En concordancia con la bibliografía, la PCR anidada muestra una buena sensibilidad y especificidad pero se destaca especialmente por su alto VPN. Por lo tanto, es una técnica útil como complemento de las técnicas de observación directa y cuyo resultado debe interpretarse en el contexto clínico del paciente. Su utilidad toma valor también al considerar que la neumocistosis pulmonar puede presentarse con un cuadro clínico que se solapa con otras entidades. Con respecto al uso de PCR para la detección de ADN de Histoplasma, en nuestra experiencia en el uso de PCR anidada en sangre entera hemos obtenido resultados con una sensibilidad del 82%, especificidad del 97%, VPP del 95,4% y VPN del 87,7% (datos no publicados). La técnica muestra una buena sensibilidad y especificidad, y destaca por su alto VPP. Es una técnica útil para su implementación como complemento de las técnicas convencionales, pero siempre debe tenerse en cuenta el estado clínico e inmunológico del paciente. No tiene un buen desempeño en pacientes inmunocompetentes ni tampoco en histoplasmosis de localización exclusivamente pulmonar. Junto con la determinación del antígeno galactomanano de H. capsulatum en orina, constituyen los métodos más eficientes y rápidos para el diagnóstico de esta patología.
- 5.
La criptococosis pulmonar grave en enfermos inmunocomprometidos debe ser tratada, en principio, igual que la criptococosis meníngea6. Se comienza con un tratamiento combinado: anfotericina B desoxicolato 0,7mg/kg/día o anfotericina B liposomal 3mg/kg/día o anfotericina B complejo lipídico 5mg/kg/día+5-fluorocitosina 100mg/kg/día dividida en 4 tomas. En caso de no contar con este último medicamento puede prescribirse fluconazol 1200mg/día o la combinación anfotericina B desoxicolato 0,7mg/kg/día+fluconazol 800mg/día durante la inducción. En los casos de criptococosis pulmonar leve o moderada sin otro compromiso puede prescribirse tratamiento con fluconazol 800mg/día u otro azol. Debe mantenerse el fluconazol a esa dosis durante 8 a 12 semanas según la evolución y después continuar con profilaxis secundaria con fluconazol (200mg/día) hasta obtener dos recuentos de linfocitos T CD4+ superiores a 150cél/μl con carga viral del VIH inferior a 20copias/ml; se recomienda sostener la profilaxis por lo menos hasta completar un año. Una vez descartado el compromiso meníngeo puede cambiarse el fluconazol por otro azol que alcance buena concentración en pulmón, como el itraconazol o el isavuconazol.
Para la neumocistosis asociada al sida la primera elección es la trimetoprima/sulfametoxazol (TMS) endovenosa (80/400mg cada ampolla). Si la presión de oxígeno en sangre arterial es inferior a 70mmHg debe calcularse una dosis de trimetoprima de 15mg/kg/día junto a 40mg de prednisona cada 12h. Tras 21 días de tratamiento se pasa a una profilaxis secundaria con TMS (160/800mg/día, tres veces por semana) también hasta obtener dos recuentos de linfocitos T CD4+ superiores a 150cél/μl con carga viral para el VIH inferior a 20copias/ml. Como alternativa terapéutica en casos de alergia se puede utilizar pentamidina endovenosa 4mg/kg/día, o primaquina 30mg vía oral+clindamicina endovenosa 600mg cada 6h1.Se ha sugerido que las equinocandinas podrían ser útiles, pero aún no hay estudios prospectivos a doble ciego en humanos que permitan cierta seguridad al respecto. Algunas publicaciones mencionan que su acción se limita a ciertos momentos del ciclo replicativo dado que las formas que no se replican o aberrantes podrían no expresar en su pared los ß-1,3-D-glucanos2. Los estudios realizados en ratones sugieren no utilizar las equinocandinas como monoterapia, aunque han demostrado que su combinación con TMS podría ser de utilidad4.Con respecto al inicio de la TARV, en la neumocistosis puede prescribirse tan pronto el enfermo esté en condiciones de recibir medicación por vía oral; en la criptococosis puede hacerse una vez se haya descartado el compromiso meníngeo, para lo cual debe esperarse al resultado de los cultivos de LCR (al menos dos semanas). En los casos de meningitis debe esperarse como mínimo 4 semanas para comenzar la TARV. A mayor carga fúngica inicial en el LCR, mayor probabilidad de aparición del síndrome de reconstitución inmune.