Introducción: La encefalopatía hepática mínima (EHM) es una condición en la cual los pacientes con cirrosis hepática presentan severas alteraciones, en ciertas pruebas neuropsicológicas con exploración neurológica normal. Ocurre entre el 30% a 80% de los pacientes con enfermedad hepática compensada. El diagnóstico se realiza mediante pruebas psicométricas (PES), electroencefalograma o la medición de la frecuencia crítica de centelleo (FCC).
Objetivo: Evaluar la FCC en pacientes con EHM y estudiar los efectos que la administración de L-ornitina L-aspartato (LOLA) o lactulosa, tiene sobre esta prueba.
Material y métodos: Se llevó a cabo un estudio prospectivo, controlado, abierto y aleatorizado en 80 pacientes que acudieron al Servicio de Gastroenterología del Hospital General de México "Dr. Eduardo Liceaga", del 01 julio del 2005 al 30 mayo del 2009, y que cumplieron con los criterios del protocolo de estudio.
Resultados: Se observó una proporción hombres a mujeres 2.1 para LOLA y 1.05 para lactulosa, así como distribución muy similar en la escolaridad y la calificación de Child-Pugh. En todos los pacientes se encontraron las PES alteradas, el 71% (57/80) tuvo alteración en la FCC. Se observó diferencia significativa en la FCC después del tratamiento. Adicionalmente, se apreció una tendencia a mejorar el desempeño en el resto de pruebas, al aplicar cualquiera de los tratamientos. La diferencia de la FCC es evidente en ambos tratamientos y es estadísticamente significativa sólo en el caso de LOLA.
Conclusiones: La prueba de centelleo (FCC) es útil para evaluar la respuesta terapéutica en pacientes con EHM.
Introduction: Minimal hepatic encephalopathy (MHE) is a condition in which patients with liver cirrhosis have severe alterations in some neuropsychological tests, however, that show a normal neurological examination. Occurs between 30% to 80% of patients with compensated liver disease. The diagnosis is made by Psychometric Tests (PES), electroencephalogram (EEG) or measuring the critical flicker frequency (FCC).
Objective: To evaluate the FCC in patients with MHE and study the changes that the administration of L-Ornitina L-aspartate (LOLA) or lactulose have about this test.
Material and methods: We performed a prospective, controlled, open, randomized trial in 80 patients who were treated at the Gastroenterology Service, Hospital General de México "Dr. Eduardo Liceaga" during the period from July 1, 2005 to May 30, 2009 and who met protocol criteria study.
Results: There was a male/female ratio 2.1 to LOLA and 1.05 for lactulose and distribution very similar in educational level and Child-Pugh score. When observed PES altered in all patients and 71% (57/80) had impaired the FCC.
There was a significant difference in the FCC test after treatment. Additionally there was a trend to improve performance in other tests to apply any of the treatments. The difference of the FCC is evident in both treatments and was statistically significant only in the case of LOLA.
Conclusions: We conclude that the critical flicker frequency (FCC) is useful to evaluate therapeutic response in patients with MHE. The FCC showed statistically significant difference in favor of patients treated with LOLA.
• Introducción
La encefalopatía hepática (EH) es un síndrome neuropsiquiátrico reversible, que presenta deterioro motor y cognitivo.1,2
Se observa en pacientes con falla hepática aguda o crónica y en pacientes con derivación portosistémica. Se estima que 30% a 45% de los pacientes con hipertensión hepática crónica o cirrosis, y 10% a 50% de aquellos con cortocircuitos portosistémicos intrahepáticos transyugulares podrán desarrollarla.3
La EH es un trastorno multifactorial que puede involucrar alteraciones en la morfología de los astrocitos,4 aumento en la permeabilidad de la barrera hematoencefálica con paso de 11% a 20% del amonio circulante a través de ella,5 formación de falsos neurotransmisores,6 alteración en la transmisión GABAérgica7,8 y alteraciones en el metabolismo del amoníaco y el manganeso.9-15
La EH se asocia frecuentemente con disminución importante en la calidad de vida de los pacientes, así como dificultad para realizar actividades que requieren un grado de atención selectiva, como conducir vehículos de motor, manejo de maquinaria industrial y equipos de alta precisión, entre otros.16,17
Su presentación clínica comprende síntomas neuropsicológicos, alteraciones motoras como asterixis, inversión del ciclo sueño-vigila y cambios en el estado de alerta, que se presentan en forma gradual como somnolencia, estupor y coma.2,15
La encefalopatía hepática mínima (EHM), también conocida como EH subclínica, es una condición en la que los pacientes con cirrosis hepática presentan severas alteraciones en ciertas pruebas neuropsicológicas, no obstante que muestren una exploración neurológica normal. Esta condición ocurre entre el 30% a 80% de los pacientes con enfermedad hepática compensada.2,18-21
El diagnóstico de la EHM se realiza mediante la aplicación de pruebas psicométricas (PES)22 o mediante la descripción de cambios electrofisiológicos del electroencefalograma (EEG), los cuales pueden ser poco específicos o muy complejos.23 Las PES evalúan el perfil neuropsicológico y la prevalencia de déficit cognitivo en pacientes con cirrosis, con énfasis en la detección de dominios frecuentemente anormales en este grupo de pacientes, como son la atención y el desempeño psicomotor, considerándose la base del diagnóstico. El panel completo consta de cinco pruebas, pero pueden utilizarse hasta tres de ellas para obtener resultados válidos22 (Figura 1).
• Figura 1. Pruebas psicométricas (PES) utilizadas en este estudio, para evaluar el perfil neuropsicológico.
La medición de la frecuencia crítica de centelleo (FCC) es una prueba que fue propuesta por Kircheis en 2002, como una manera instrumental de evaluar la EHM. En dicho estudio, la determinación de la FCC mostró una sensibilidad y especificidad cercana al 100%, definida con punto de corte de 39 Hz24-26 (Figura 2).
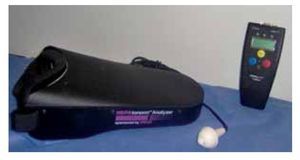
• Figura 2. Equipo utilizado para determinar la frecuencia crítica de centelleo (FCC).
El tratamiento actual más ampliamente utilizado en la EHM es la administración de lactulosa oral. Este disacárido no absorbible produce una diarrea osmótica que reduce la flora colónica y en consecuencia, ocasiona una disminución en la producción y absorción de amoníaco, con el subsecuente incremento en la eliminación de nitrógeno.27-30 A una dosis oral entre 45 a 90 g al día de lactulosa, el efecto terapéutico esperado es producir una frecuencia de dos a tres evacuaciones al día con un pH<6.31 Sin embargo, algunos de los efectos secundarios pueden ser náusea, flatulencia, diarrea y distensión abdominal.32
De manera alternativa se ha sugerido que un aminoácido denominado L-ornitina L-aspartato (LOLA), mejora el grado de encefalopatía porque reduce la hiperamonemia.33 Está bien establecido que la detoxificación del amoniaco se realiza de forma primordial en los hepatocitos periportales y perivenosos.34 Es sabido que el amoníaco es transformado en urea en un ciclo específico. De manera alterna, el amoniaco se acopla al glutamato con la consecuente formación de glutamina. El mecanismo de acción de LOLA se sustenta en proveer los sustratos para la detoxificación de amoniaco, al estimular la síntesis de urea y favorecer la síntesis de glutamina dentro del hígado, el encéfalo y el músculo.35,36
Los efectos secundarios de la administración oral de LOLA son poco frecuentes (<5%), e incluyen principalmente náusea. En la administración intravenosa de LOLA, el evento adverso más frecuente es el vómito, que se reduce o se controla al disminuir la velocidad de infusión.33
El objetivo principal de este estudio fue evaluar la FCC en pacientes con EHM, y estudiar los cambios que la administración de LOLA o lactulosa tienen sobre esta prueba.
• Material y métodos
Se diseñó un estudio prospectivo, controlado, abierto y aleatorizado que incluyó a pacientes que acudieron al Servicio de Gastroenterología del Hospital General de México "Dr. Eduardo Liceaga", durante el periodo comprendido del 1 julio de 2005 al 30 mayo de 2009.
Los sujetos de estudio cubrieron los siguientes criterios de inclusión: presencia de insuficiencia hepática crónica. Historia de consumo excesivo y crónico de alcohol (más de 30 g/día en mujeres y más de 70 g/día en hombres) de ambos sexos, entre 25 y 60 años, sin evidencia clínica de EH, abstinencia de alcohol dos meses previos al inicio del estudio, escolaridad mínima de seis años, residentes del Distrito Federal o área metropolitana, con marcadores virales para hepatitis (A, B, C) negativos.
Se excluyó a los pacientes con: insuficiencia hepática no alcohólica, consumo de LOLA, lactulosa o antibióticos en los dos meses previos, hemorragia de tubo digestivo al ingreso, manifestaciones clínicas de proceso infeccioso, manifestaciones de enfermedad pulmonar obstructiva crónica con falla respiratoria (PaO2<60 mmHg o PaCO2>50 mmHg), insuficiencia renal crónica (creatinina>1.5 mg/dL), manifestaciones de falla cardiaca de cualquier origen (clase funcional NYHA>I), enfermedad neurológica crónica como Alzheimer o Parkinson, enfermedad psiquiátrica o consumo de fármacos psicotrópicos y/o sedantes hipnóticos en los últimos dos meses, encefalopatía metabólica no hepática, antecedente de cáncer y trastornos visuales (retinopatía diabética, cataratas, daltonismo).
El diagnóstico de insuficiencia hepática se basó en la historia clínica, los exámenes de laboratorio, TGP, TGO, albúmina, bilirrubina directa e indirecta, biometría hemática, estudios de imagen (ultrasonido hepático o tomografía axial computarizada de abdomen) y biopsia hepática en caso de contar con ella. Se utilizó la clasificación de Child-Trucotte, modificada por Pugh para estadificar la enfermedad.37 La presencia de EH se descartó mediante los criterios de West Haven (modificados por Conn y Bircher en 1994).28
A todos los pacientes se les aplicaron tanto las PES como la FCC, siempre a las12:00 pm, en una habitación con adecuada iluminación, sin ruido. Las PES incluyeron el test de conexión numérica, la prueba de la línea quebrada y la prueba del punto seriado. Todas las pruebas estuvieron ajustadas a los lineamientos publicados por la Red de Encefalopatía Hepática Española (www.redeh.org), para determinar la presencia de EHM considerando la edad, los años de escolaridad, el tiempo de realización de la prueba y el número de errores cometidos. La medición de la FCC se estandarizó efectuando cinco ensayos previos hasta la comprensión del procedimiento por parte del paciente; después se realizaron ocho mediciones y se obtuvo la media de la FCC, dicha cifra fue la que se tomó como medición final.
Posteriormente, los pacientes fueron asignados en forma aleatoria a alguno de los dos grupos, el grupo uno incluyó 41 pacientes y recibió tratamiento con LOLA en granulado, a razón de 3 g cada 8 horas; el grupo dos incluyó 39 pacientes y recibió lactulosa a razón de 45 a 90 mL cada 24 horas divididos en tres tomas, para producir de dos a tres evacuaciones al día; ambos tratamientos tuvieron una duración de 15 días. Al finalizar el tratamiento, ambos grupos fueron reevaluados con las PES y la FCC.
El análisis estadístico incluyó estadística descriptiva, T pareada e intervalos de confianza.
• Resultados
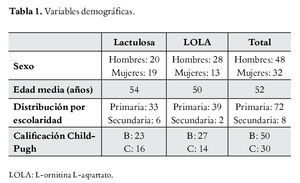
Durante el periodo de estudio fueron evaluados 480 pacientes con cirrosis hepática. Fueron incluidos 80 pacientes (16.6%) que cumplieron con los criterios del protocolo de estudio, con una proporción hombres a mujeres 2.1 para LOLA y 1.05 para lactulosa. Se observó una diferencia de cuatro años entre las medias de la edad de ambos grupos, y una distribución muy similar en la escolaridad y la calificación de Child-Pugh. Los pacientes incluidos tenían calificación Child-Pugh B (n=50) o C (n=30). En todos los pacientes se encontraron las PES alteradas, el 71% (57/80) tuvo alteración en la FCC. En la Tabla 1 se describen las variables demográficas de ambos grupos.
La Tabla 2 muestra las medias y desviación estándar para cada una de las PES, y de la FCC antes y después de los tratamientos específicos. Se puede apreciar que sólo existió una diferencia significativa en la prueba de línea quebrada entre cada grupo antes de aplicar el tratamiento, y en la FCC después del tratamiento. Adicionalmente, se apreció una tendencia a mejorar el desempeño en el resto de pruebas al aplicar cualquiera de los tratamientos.
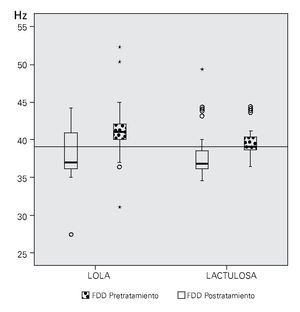
La Figura 3 muestra la distribución en gráfica de cajas de la FCC, antes y después del tratamiento con LOLA o lactulosa. Se ha mostrado con una línea horizontal el punto de corte a 39 Hz considerado como mínimo normal. Las medianas antes del tratamiento se encuentran por debajo de este valor, y las medianas posteriores al tratamiento se encuentran en el límite para el caso del uso de lactulosa y por encima para el caso de LOLA. La diferencia de la FCC es evidente en ambos casos y es estadísticamente significativa sólo en el caso de LOLA.
• Figura 3. Distribución en gráfica de cajas, para la frecuencia crítica de centelleo antes y después del tratamiento con LOLA o lactulosa. La línea horizontal señala el punto de corte a 39 Hz, en círculos se muestran los casos atípicos internos y en asteriscos, los casos atípicos externos.
Ninguno de los pacientes incluidos en el estudio presentó eventos adversos.
• Discusión
La EHM se presenta entre el 30% y 80% de los pacientes con enfermedad hepática compensada, siendo la causa de que los pacientes con cirrosis hepática presenten severas alteraciones cognitivas, aún cuando la exploración neurológica es normal.2 Esta condición neurológica tiene un impacto negativo sobre la calidad de vida de quienes la padecen, porque deteriora la destreza y atención de los pacientes.38,39
El diagnóstico actual se establece mediante la aplicación de las PES y de un examen electrofisiológico como el EEG. Sin embargo, la medición de la FCC pudiera ser una alternativa diagnóstica de mayor sensibilidad, dada su capacidad para valorar el grado de vigilia.26
En nuestro estudio encontramos prevalencia de 100% para EHM utilizando las PES y 71% con la FCC, esta divergencia de resultados está probablemente asociada a factores que intervienen en la aplicación de las PES que incluyen la edad, la escolaridad, el desempeño del examinador y los factores socioculturales de nuestra población. En un estudio realizado en España por Romero y colaboradores, llevando a cabo un análisis multivariado utilizando regresión lineal múltiple, se observó que la edad y la escolaridad se encuentran asociadas en forma independiente como causa de alteración en las PES.40 Todo ello redundaría en un incremento en el número de resultados positivos con las PES, comparados con los resultados de la FCC. Estos resultados contrastan con un estudio realizado en Alemania por Kircheis y colaboradores en 2002,24 donde se demostró que la prevalencia de la EHM fue del 72% cuando se aplicó la FCC, mostrando una alta correlación con las PES. Estos resultados podrían sugerir un incremento de falsos positivos en el diagnóstico de EHM a través de las PES, en poblaciones como la estudiada por nuestro grupo de trabajo. De acuerdo a los resultados del presente estudio, la FCC podría ser mucho más específica para diagnosticar la prevalencia real de esta entidad.
Más recientemente, Sharma y colaboradores25 estudiaron 156 pacientes con cirrosis hepática, utilizando para el diagnóstico de EHM mediciones de la FCC y de las PES. Este autor informó una prevalencia global de 53%. Así, 66 pacientes (80%) tuvieron medición de la FCC superior de 39 Hz. Este resultado es mayor a lo observado en nuestra población de estudio, previamente referido, pero se ubica dentro del rango de prevalencia de 30% a 80%.
Respecto a estudios realizados en pacientes con EHM y tratamiento con lactulosa y probióticos, el Dr. Sharma y colaboradores32 analizan 190 pacientes de la India; la evaluación de EHM fue realizada mediante las PES. La respuesta fue definida como normalización de algún parámetro. Este autor encontró prevalencia de EHM de 55.2%, en donde 86% de los pacientes tuvo por lo menos una prueba psicométrica anormal. La normalización de las PES se observó en 54.8% de los tratados con lactulosa.
Este resultado difiere de lo encontrado en nuestro estudio, donde la mejoría en las PES ocurrió en 84.3% de los pacientes tratados con lactulosa y 84% de los tratados con LOLA, con diferencia estadística a favor de LOLA al evaluar en forma separada la FCC.
En nuestras referencias no encontramos algún estudio en el cual a pacientes con EHM, se les realizara determinación de la FCC y fueran sometidos a algún tratamiento farmacológico ya sea disacáridos no absorbibles, LOLA o probióticos, y posteriormente se realizara nueva determinación de la FCC, y de esta forma evaluar la mejoría de dicha prueba posterior a determinado tiempo de tratamiento.24,41,42.
Consideramos el presente estudio como base para las investigaciones futuras, las cuales deberán incluir un número significativo de pacientes y la validación de la FCC en población mexicana.
• Conclusiones
La prueba de centelleo (FCC) es útil para evaluar la respuesta terapéutica en pacientes con EHM. La FCC demostró diferencia estadísticamente significativa a favor de los pacientes tratados con LOLA.
• Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
• Financiamiento
No se recibió ningún patrocinio para realizar este artículo.
Correspondencia:
Dr. Juan Miguel Abdo
Francis. Tlacotalpan N° 59-1702,
Colonia Roma, C.P. 06760, México D.F., México.
Correo electrónico: drjuanmiguelabdo@yahoo.com.mx