The aim of this revisión is to highlight recent evidence that links low quality and quantity of sleep with an increased propensity to develop overweight or obesity. In this text we present evidence obtained with controlled clinical studies as well as with experimental models, both indicating that decreased hours of sleep lead to metabolic and behavioral changes that then induce overconsumption of food, which then results in weight gain. With this review we want to present sleep as an additional factor contributing to metabolic disease and we aim to raise interest in professional involved in the study of overweight and obesity in order to include this factor as an additional variable in their research and strategies of intervention.
La presente revisión tiene como objetivos presentar a la comunidad académica evidencias recientes que proponen una relación entre la mala calidad y cantidad de sueño y la propensión al sobrepeso y obesidad. Se presentan en este escrito evidencias obtenidas en estudios clínicos controlados y de investigación básica experimental que demuestran que una cantidad o calidad deficiente de sueño lleva a corto plazo a alteraciones de tipo metabólico y conductual conducentes a la sobre ingestión de alimentos y al sobrepeso. También se discuten los posibles mecanismos que pudieran subyacer a este fenómeno, a nivel cerebral, metabólico y celular. El objetivo de esta revisión es presentar a las horas de sueño como un factor poco considerado en los estudios epidemiológicos y experimentales y posible desencadenante de alteraciones metabólicas. Con este escrito esperamos poder interesar a otros profesionistas involucrados en el estudio de este fenómeno para incluir la calidad y cantidad de sueño entre sus variables de estudio y/o incluir la higiene del sueño entre sus propuestas de tratamiento y prevención.
La prevalencia de obesidad se ha incrementando en todo el mundo a un ritmo alarmante, según la Organización Mundial de la Salud desde 1980 la prevalencia de obesidad se ha más que duplicado en todo el mundo (OMS, 2012). Particularmente en México la prevalencia de obesidad ha incrementado de tal forma que se sugiere que en 2012 ya ocupamos el 2o lugar de obesidad adulta a nivel mundial y el 1o en obesidad infantil (UNICEF, 2012). De acuerdo a la encuesta nacional de salud 2006 el 70% de la población mexicana presenta sobrepeso u obesidad (ENSANUT, 2012) en niños menores de 5 años es de 9.7%; en niños de niños de 5 a 11 34.4%, adolescentes 35%. Para los adultos en mujeres es de 73% y 69.4% para hombres. En obesidad abdominal la prevalencia nacional es de 73.9%. Resulta entonces prioritario determinar las causas que han disparado una epidemia de esta magnitud.
La etiología de la obesidad es multifactorial, tradicionalmente se han identificado como sus principales causas a la reducida actividad física y a la dieta de baja calidad fundamentada en mayor cantidad de comida rica en grasas y carbohidratos. Otro factor que contribuye al desarrollo de obesidad es la predisposición genética de nuestras etnias, ya que se sugiere que las razas asiáticas e hispánicas tienen mayor propensión a acumular grasa y desarrollar enfermedades metabólicas (Sweeting, 2007). También la programación metabólica temprana por una mala nutrición perinatal se considera causa de mayor propensión, para acumular energía en forma de grasa, ya que esta condición temprana promueve en el individuo el desarrollo de un metabolismo ahorrador (Escobar, Angeles-Castellanos, Miñana-Solis & Salgado-Delgado, 2010).
Los programas preventivos de salud pública dirigidos a promover mayor actividad física y las recomendaciones para seguir dietas con una proporción energética regulada han sido hasta el momento muy poco exitosos para revertir o prevenir el sobrepeso y la obesidad. Resulta entonces evidente que se ha ignorado la existencia de otros factores que también contribuyen a la pérdida del balance energético, pero que no se han incorporado en las intervenciones debido a un desconocimiento de su relevancia y los mecanismos que los asocian al desarrollo de obesidad.
En esta revisión se propone que características del estilo de vida moderno pudieran contribuir al desarrollo de la obesidad. Particularmente se presentarán evidencias de que la cantidad y calidad de sueño puede ser un factor determinante del estado metabólico y que debe ser considerado como factor desencadenante de sobrepeso y obesidad. Describimos en este texto la relevancia del dormir como regulador de procesos endocrinos y metabólicos y por ello, como determinante de la homeostasis energética. Proporcionamos las evidencias a nivel clínico y experimental que señalan fuertemente que la reducida calidad y cantidad de sueño propician pérdida de la homeostasis energética, sobrepeso y a largo plazo síndrome metabólico y obesidad.
Definiciones de sobrepeso / Obesidad y los mecanismos de balance energéticoEl sobrepeso y la obesidad resultan del exceso de tejido graso acumulado, lo cual se refleja en el peso corporal. Esta acumulación de grasa ocurre cuando la ingestión excesiva de energía sobrepasa el gasto energético (González-Barranco & Ríos-Torres, 2004). Idealmente la ingestión de alimentos y el gasto energético deben ser equivalentes en kilocalorías para mantener un equilibrio en el peso corporal.
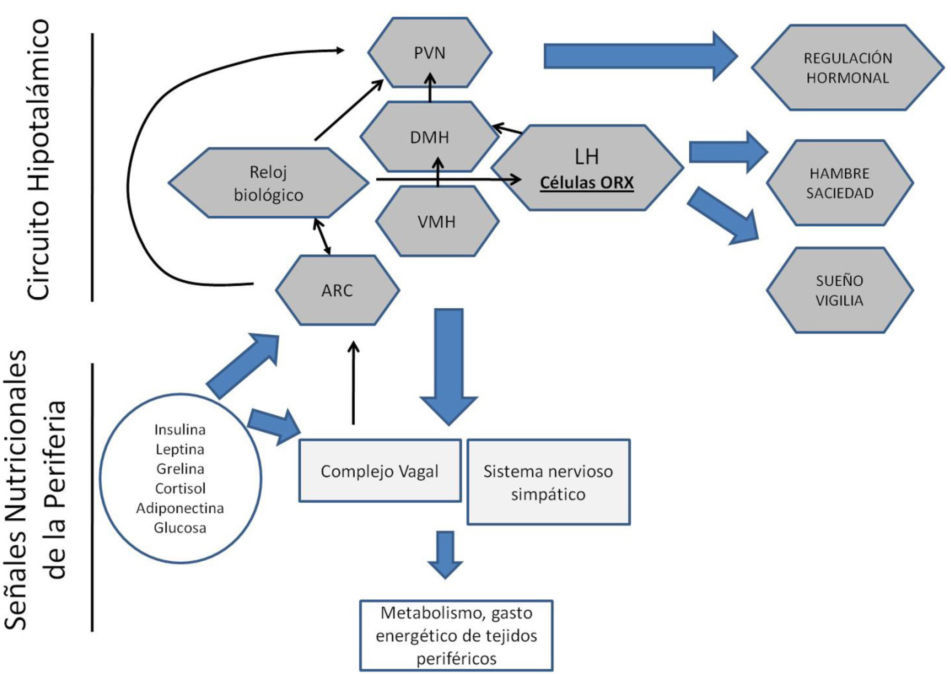
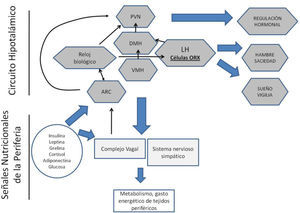
Por la relevancia que tiene la ingestión de alimentos para la supervivencia, el cuerpo cuenta con sistemas redundantes que monitorean el estado energético basándose en múltiples indicadores metabólicos generados por algunos tejidos y sistemas. La condición energética general es transmitida al hipo-tálamo localizado en el sistema nervioso, el cual integra todas las señales y organiza respuestas acordes a un estado de exceso o de falta de energía (Berthoud, 2002). Participa en este proceso el tejido adiposo secretando hormonas, entre ellas la leptina, que indica el nivel de adiposidad del cuerpo, y las adiponectinas que estimulan la utilización de las grasas en momentos de baja energía; participan el hígado y el páncreas que regulan los niveles de glucosa en sangre, la cual es una señal muy poderosa para señalizar estados de hambre y saciedad. El estómago y el intestino liberan las hormonas ghrelina y colecistoquinina que señalan vaciamiento y distención gástrica, respectivamente. También hormonas como la insulina, los glucocorticoides y la hormona de crecimiento contribuyen a la señalización del balance energético y son monitoreadas por núcleos específicos del hipotálamo y el tallo cerebral (ver Figura 1).
Circuito cerebral para la regulación homeostática de la conducta de alimentación y del metabolismo. Diversas estructuras hipotalámicas forman un circuito para recibir y analizar señales metabólicas y hormonales provenientes de la periferia. Con base en estas señales generan señales reguladoras para regular el hambre y la saciedad y regular. El sistema productor de orexinas, además, participa en la regulación del ciclo sueño/ vigilia, razón por la que alteración de los patrones de dormir pueden modificar la conducta alimentaria y el metabolismo. ARC= núcleo arqueado; DMH= núcleo dorsomedial del hipotálamo; LH = hipotálamo lateral; ORX = orexinas; PVN = núcleo paraventricular; VMH = núcleo ventromedial del hipotálamo
A partir de la integración de todas estas múltiples señales el cerebro genera los estados de hambre y saciedad(Berthoud & Morrison, 2008) y las respuestas reguladoras para mantener el balance energético. Se sugiere que la alteración en la señalización de alguno de estos indicadores o la falta de respuesta a nivel cerebral a alguna de estas señales pudiera ser causa de la pérdida de balance energético para desencadenar sobrepeso y obesidad. Estudios clínicos y experimentales han confirmado que el sobreconsumo de alimentos grasos y ricos en calorías altera estos sistemas de señalización y la manera de responder de áreas cerebrales, llevando a mediano plazo a un mal funcionamiento de los sistemas de regulación homeostática para el balance energético.
El ciclo vigilia / sueño, su relevancia para procesos de reparación y para la integridad fisiológicaUn sistema fundamental, y poco considerado para el balance energético, es el sistema circadiano que le dicta tiempos a sistemas cerebrales para la regulación de las funciones metabólicas, ya que las necesidades energéticas cambian entre el día y la noche (Buijs, van Eden, Goncharuk & Kalsbeek, 2003). El sistema circadiano dicta los tiempos para las funciones del cuerpo y define ciclos de sueño / vigilia. Durante la vigilia predomina la actividad física, el desgaste energético y también el consumo de alimento y agua, razón por la cual nuestros órganos deben prepararse para el consumo energético, la digestión y utilización de nutrientes. Durante el sueño, por el contrario, se ahorra y se almacena energía, se reducen los procesos digestivos y se llevan a cabo procesos de reparación celular, de descanso y de organización de memorias (Siegel, 2005). Estos estados que se alternan diariamente, tan distintos en requerimientos energéticos afectan a todos los tejidos y órganos del cuerpo y son coordinados por el reloj biológico, que transmite señales temporales a todo el cuerpo vía el sistema nervioso autónomo y vía el sistema endocrino (Buijs, et al. 2003). Durante el día señales de ambos sistemas activan tejidos y órganos para la producción de glucosa y de enzimas gástricas, para aumentar la secreción de insulina, favoreciendo la utilización de energía para la actividad física y mental y para generar todos los cambios necesarios en la respiración y flujo sanguíneo que permitan el buen desempeño de estas actividades. Durante la noche se secreta la melatonina, hormona conocida por sus efectos inductores del sueño y por su actividad de reparación celular, particularmente por sus efectos antioxidantes (Krueger, Rector, Roy, Van Dongen, Belenky & Panksepp, 2008; Siegel, 2005). También aumenta la producción de hormona de crecimiento que contribuye a la síntesis de proteínas para reparación celular (Qidwai, Ishaque S, Shah S & Rahim M, 2010). Se sugiere que el sueño también es necesario para que se lleven a cabo funciones de formación de memorias y de organización mental, de descanso muscular y de ahorro energético. Resulta evidente, entonces, que ambos estados, el sueño y la vigilia, son relevantes para el buen funcionamiento del individuo y que implican funciones muy distintas en el organismo; respetar los horarios para que se lleven a cabo estos estados resulta primordial para mantener la salud.
El estilo de vida moderno y los malos hábitos de sueño como causas de sobrepeso y obesidadEl estilo de vida moderno fomenta las actividades nocturnas. La luz eléctrica, la televisión y la computadora ofrecen a las nuevas generaciones la oportunidad de entretenimiento durante la noche Estas actividades que normalmente son de diversión, resultan muy atractivas y han desplazado al placer del sueño. De tal manera, el estilo de vida moderno ha sido promotor de mantenerse despierto durante la primera mitad de la noche, para llegar al descanso cerca de, o pasada la media noche (Martinez-Gomez, et al, 2010) A. Los horarios de escuela y trabajo, sin embargo, no han cambiado y requieren que los individuos se despierten temprano. La consecuencia inmediata de esta situación es la reducción en las horas de sueño, principalmente durante los días de la semana. Este fenómeno afecta principalmente a los jóvenes y niños, que permanecen despiertos por largas horas por las noches, convirtiendo la disminución en la duración del sueño en una característica de su estilo de vida (Leproult & Van Cauter, 2010). En Estados Unidos se reporta que la duración del sueño de la población disminuyó en los últimos años entre 1.5 a 2 horas por noche y la proporción de los adultos jóvenes que duermen menos de 7 horas por noche se ha incrementado de 15.6% en 1960 a 37.1% en 2000-2001 (Karlsson, Knutsson & Lindahl, 2001). En México es evidente un cambio en los hábitos de sueño en niños, jóvenes y adultos, aunque no existen estudios formales que hayan puesto este fenómeno en evidencia.
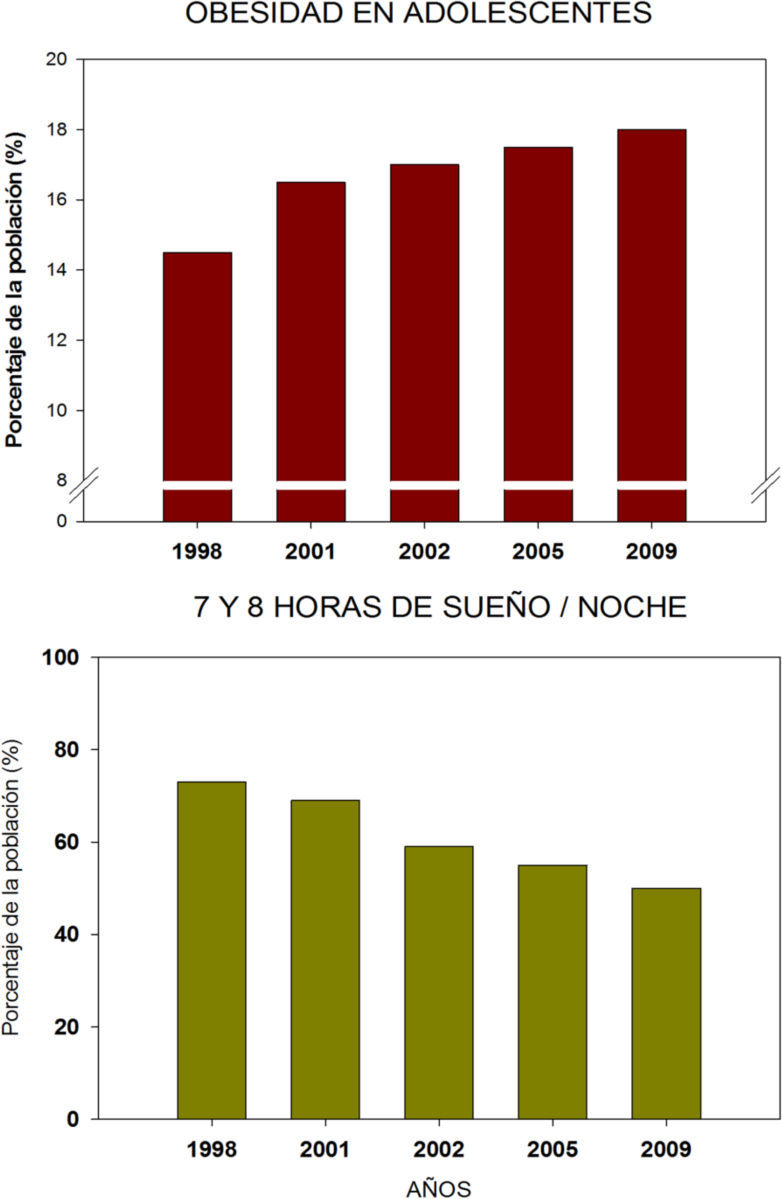
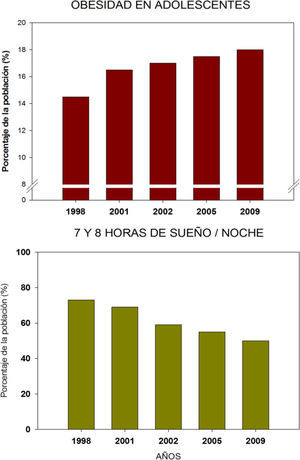
Es de llamar la atención que se ha observado un aumento sorprendente de la incidencia de obesidad y diabetes, que parece coincidir con el mismo periodo en el cuál se observó un descenso progresivo de las horas de sueño. Las dos tendencias tienen una imagen en espejo desde la segunda mitad del siglo XX, que indica una fuerte correlación que no necesariamente es causal (Figura 2). Es por ello que recientemente se ha propuesto a la restricción de sueño como un factor más que puede contribuir a la pérdida de homeostasis corporal y como desencadenante de sobrepeso y obesidad (Escobar et al, 2010).
Tendencias de obesidad en adolescentes norteamericanos contrastada con la proporción de individuos que durmieron las 7-8 horas por noche, considerada la cantidad óptima para adultos. Ambas gráficas muestran una tendencia inversa que sugiere que la mala cantidad de sueño pudiera ser factor predisponente al sobrepeso y obesidad. Datos tomados de Sleep in America poll (2009).
La posible relación entre poco sueño y obesidad puede explicarse desde varias aproximaciones. Por ejemplo el trabajo nocturno también promueve reducción de la cantidad y calidad del sueño junto con aumento de actividad por la noche. En trabajadores nocturnos se ha reportado mayor prevalencia de sobrepeso y obesidad que en la población general, con alta predisposición a enfermedades metabólica, entre otras (Rand, Macgregor & Stunkard, 1999). Se propone que el estar despierto por la noche es un estímulo suficiente para motivar la ingestión nocturna de alimentos. Tanto en los trabajadores nocturnos como en personas que prefieren desvelarse se ha reportado que la cantidad de comida ingerida durante la noche aumenta significativamente, representando aproximadamente el 65% del total del día, mientras que en personas principalmente diurnas el 75% de los alimentos se consumen de día (Westerlund, Ray & Roos, 2009). Un efecto similar reportó un estudio finlandés en niños, en donde se observó particularmente en varones jóvenes con patrones diarios de sueño reducido que consumían mayor cantidad de comidas ricas en energía durante el desvelo (Landhuis, Poulton, Welch & Hancox, 2008). Se sugiere que al igual que con el trabajador nocturno, en niños y adolescentes que duermen poco podría haber mayor propensión al sobre peso y obesidad (Spruyt, Molfese & Gozal, 2011). Existe controversia al respecto, porque en niños el efecto parece ser más bien a largo plazo. Un estudio prospectivo llevado a cabo por Landhuis et al en 2008 reportó que la cantidad de sueño de los 5 a los 11 años de edad correlacionaba positivamente con el índice de masa corporal (IMC) a la edad de los 32 años. Aquellos niños que habían dormido en promedio menos horas diarias de sueño, mostraban sobrepeso y un índice de masa corporal elevado. Otro estudio ha reportado que al sueño reducido se asocian alteraciones metabólicas, entre ellas insulina alta (Guidolin & Gradisar, 2012) aún a corto plazo.
En estudios realizados con adolescentes existe controversia sobre la asociación sueño reducido - sobrepeso, ya que algunos reportan efectivamente una correlación positiva, pero otros no (Chaput, Depres, Bouchard, Astrup & Tremblay, 2009); las diferencias en resultados se adjudican a la metodología para evaluar el sueño y a otros factores asociados al desvelo entre ellos el tipo de alimentos ingeridos y el tipo de actividades que se realizan a lo largo del día y la noche.
Estudios de seguimiento longitudinal con adultos también han mostrado una correlación entre las horas dedicadas al dormir y el desarrollo de enfermedades metabólicas. Adultos que duermen menos de 5 horas por noche muestran mayor tendencia al sobrepeso y obesidad que aquellos que duermen en promedio 7 horas, de tal manera que las horas dedicadas al dormir pudieran ser factor predictivo de enfermedades metabólicas y aumento de peso (Spiegel, Tasali, Penev & Van Cauter, 2004).
Por lo complicado de estos estudios poblacionales, dado la gran cantidad de variables que contribuyen al fenómeno, en los últimos años se ha abordado esta relación con estudios clínicos y experimentales controlados.
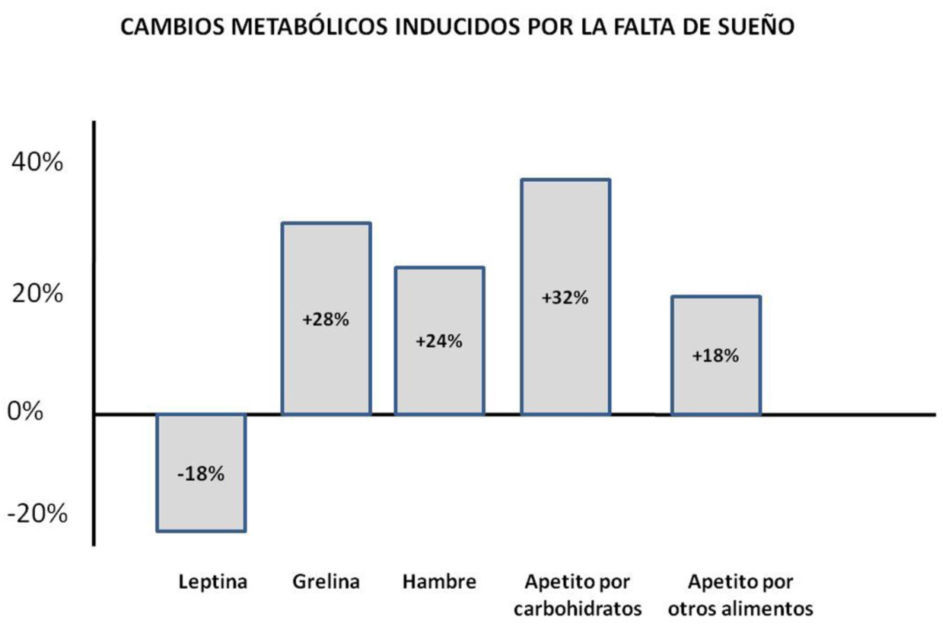
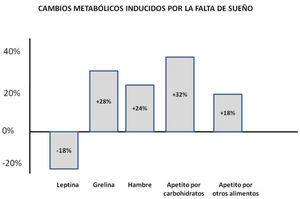
Evidencias clínicas que asocian la mala calidad de sueño con alteraciones en el balance energéticoLa posible relación causal entre la mala calidad y cantidad de sueño y la propensión al sobrepeso y obesidad se ha explorado principalmente en ambientes controlados. Con un grupo de voluntarios jóvenes se manipuló el número de horas de sueño en sujetos sanos (Spiegel et al, 2004). Posterior a una noche de privación total de sueño los individuos reportaron sensaciones de hambre intensa, de deseo aumentado por ingerir alimentos ricos en carbohidratos, entre ellos pasteles, pan y dulces. La cantidad de alimentos que ingirieron al día siguiente del desvelo rebasó el gasto de energía por el cansancio de la noche anterior. En otro estudio que se realizó con 12 hombres jóvenes saludables restringidos a 4 hrs de sueño por dos noches se detectaron niveles de glucosa elevados, los niveles de insulina bajos y la razón de ghrelina/leptina se elevó más del 70% (Shlisk, et al, 2012). Además, se incrementó en un 30% el apetito por comidas ricas en carbohidratos, comparado con el grupo de duración de sueño mayor (ver Figura 3). La leptina refleja los niveles de adiposidad, de manera que bajos niveles de leptina señalan reducción del tejido adiposo y se asocian que sentimientos de hambre, en contraste, la grelina se secreta por el estómago y duodeno cuando están vacíos y por ello cuando aumenta su secreción estimulan las sensaciones de hambre (Goel, et al, 2009). Estas observaciones sugieren que la falta de sueño modifica la regulación metabólica aún a muy corto plazo. Este mismo grupo mostró que estos efectos son reversibles si posterior a 6 noches de privación parcial de sueño se le permite a los individuos dormir por varias noches dormir al gusto para recuperarse. La relevancia de estos estudios reside en evidenciar estos cambios a nivel metabólico posteriores a unas cuantas noches de reducción de sueño, lo cual pone en perspectiva las consecuencias que podría tener un estilo de vida caracterizado por dormir mal.
Los cambios hormonales y conductuales consecuencia de la privación de sueño generan un estado de apetito por alimentos ricos en carbohidratos. Obsérvese que después de una noche de poco sueño, aumentan las señales promotoras del hambre y del deseo de alimentos ricos en energía. Datos tomados de Van Cauter E & Knutson KL (2008).
La privación de sueño, además, induce una alteración del sistema circadiano, que es el regulador del orden temporal del individuo. Asociado al desvelo y la ingestión de alimentos durante la noche, en individuos que han alterado sus patrones de sueño se presentan alteraciones de los ritmos circadianos en la secreción de leptina, insulina, melatonina y cortisol, consistentes en corrimientos y decremento de los picos de máxima expresión en el ciclo de 24 horas (Crispim, et al, 2007) con lo que se propone que el sistema se vuelve ineficiente para exhibir respuestas adecuadas en un ambiente cíclico. De las alteraciones circadianas resulta que los momentos óptimos para la digestión y absorción de los nutrientes no coinciden con la alimentación nocturna. La pérdida de coordinación entre funciones internas y la conducta ingestiva es un factor predisponente para la enfermedad metabólica y la obesidad (Arble, Bass, Laposky, Vitaterna & Turek, 2009). Un estudio que ejemplifica esta posible relación fue reportado por Qin et al (2003). En este estudio se comparó a un grupo de estudiantes que durante un mes llevaron un estilo de vida completamente diurno con otro grupo que llevó durante el mismo periodo un estilo de vida completamente nocturno. Ambos grupos se comprometían a realizar todas sus actividades de estudio, actividad física y alimentación completamente de día o de noche, de acuerdo con el grupo al que habían sido asignados. En los individuos del grupo nocturno se observó una disminución en la secreción de melatonina y leptina, ambas hormonas normalmente muestran un pico por la noche. También se observó aumento en los niveles de glucosa y de insulina, sugiriendo una resistencia a esta última. Los resultados de este estudio indican que el estilo de vida nocturno altera al sistema circadiano y con ello la regulación de funciones reguladoras del metabolismo. También resaltan que para el ser humano las horas de actividad y alimentación debieran ser durante el día.
Estudios experimentales que comprueban la relación entre la mala calidad de sueño con alteraciones en el balance energético.Con la finalidad de comprender mejor los mecanismos que asocian la mala calidad de sueño con el desarrollo de enfermedades metabólicas, sobrepeso y obesidad, se han desarrollado modelos experimentales que permiten mejor control de variables. Una serie de estudios con ratones y ratas han mostrado que restringir el alimento a la hora de reposo y sueño (que es el día para los roedores) o únicamente la fase de vigilia (la noche) tiene efectos muy diferentes sobre el metabolismo y el peso corporal. Los roedores que solamente consumen alimentos de día desarrollan sobrepeso en unas cuantas semanas, a pesar de consumir cantidades similares de alimento que los roedores alimentados en su fase de vigilia (Salgado-Delgado, Angeles-Castellanos, Buijs & Escobar, 2008; Salgado-Delgado, Angeles-Castellanos, Saderi, Buijs & Escobar, 2010).
Estudios recientes con roedores muestran también que la administración de alimentos ricos en grasas y carbohidratos tienen un efecto diferencial dependiendo si se administran de día o de noche. Cuando estos alimentos se proporcionan durante la fase de descanso el efecto metabólico y el aumento de peso son mucho más pronunciados que cuando estos alimentos se proporcionan en la fase de actividad de los animales. Al igual que los efectos reportados en personas, en estos roedores se han encontrado alteraciones de los ritmos circadianos de hormonas y de otras funciones asociadas con la digestión y el balance energético (Brandenberger & Weibel, 2004; Salgado-Delgado et al, 2008).
Para modelar el estilo moderno de vida, en donde los sujetos se mantienen despiertos y activos durante la noche, en vez de dormir. En nuestro laboratorio desarrollamos modelos de desvelo y de trabajo nocturno. Para mantener despiertos a los roedores implementamos ruedas de actividad forzada en las cuales se introducen ratas diariamente al inicio del día, que para ellas es el inicio de la etapa de dormir. Observamos que durante el intervalo en que se mantienen despiertas en las ruedas, las ratas aumentan la ingestión de alimento llegando a consumir hasta 75% de su ración diaria durante la etapa normalmente dedicada al sueño (Brandenberger & Weibel, 2004), lo cual se parece mucho a el patrón de alimentación que se observa en los trabajadores nocturnos. Estas ratas muestran sobrepeso después de 5 semanas en este protocolo, así como intolerancia a la glucosa y ritmos circadianos alterados, similar a lo que le ocurre a personas que se mantienen despiertas por la noche.
En un estudio reciente con ratas jóvenes combinamos una situación de desvelo de 4 horas diarias con la oportunidad de comer dieta de Cafetería, consistente en galletas, papas fritas y salchichas y agua azucarada. Comparadas con ratas que tuvieron acceso a la dieta de cafetería sin la actividad forzada, las ratas que se expusieron a la combinación de ambos factores comieron mucha más dieta de cafetería y subieron significativamente más de peso (26%) llegando a niveles de obesidad; también desarrollaron todos los signos de síndrome metabólico (Velasco-Ramos, tesis de licenciatura, 2013).
Posibles mecanismos que asocian la falta de sueño con obesidadLas evidencias obtenidas con estudios clínicos y epidemiológicos, así como con modelos experimentales apoyan cada vez más el hecho de que existe una relación entre metabolismo y patrones de sueño. ¿Cómo se asocian los hábitos de sueño/ vigilia con el metabolismo y el peso corporal?
Datos reportados por nuestro grupo sugieren que mantener despiertos a los roedores en vez de permitirles dormir los lleva a ingerir una gran proporción de sus alimentos durante la etapa de vigilia forzada. Un efecto similar se reporta en personas con hábitos de actividad nocturnos, en donde la vigilia prolongada promueve ingerir mayor proporción de alimentos durante la noche, particularmente en trabajadores nocturnos. El comer de noche lleva a problemas digestivos y a un aprovechamiento alterado de los nutrientes debido a que en la noche los procesos hormonales y metabólicos están ajustados para el ahorro y acumulación de energía (Williams & Elmquist, 2012). Estudios experimentales muestran que efectivamente en roedores que se les restringe el alimento a su fase de sueño aumentan significativamente más de peso que aquellos que comen en su fase de actividad, a pesar de que comen la misma cantidad de alimento (Salgado-Delgado et al, 2008) esto se observa también cuando se ofrecen dietas altas en grasa solo de día o solo de noche, en donde las dietas altas en grasa tienen mayor efecto obesigénico cuando se ingieren en la fase normal de sueño.
Un proceso que pudiera explicar la falta de sueño con el aumento de peso se relaciona con alteraciones de hormonas reguladoras del apetito. Como se mencionó, una serie de estudios ha demostrado a corto plazo que la grelina y la leptina se ven alteradas aún por una o dos noches de sueño reducido; la leptina disminuye y la grelina aumenta, resultando de ello mayor sensación de hambre (Sakurai, 2007). Estos cambios internos temporales podrían ser factores inductores de la sobreingestión de alimentos, que a largo plazo ante desvelos constantes llevarían a una pérdida del control del apetito, al sobre peso y obesidad.
A nivel de regulación cerebral se han identifciado zonas especializadas en reconocer y procesar señales metabólicas provenientes del cuerpo. Particularmente en el hipotálamo y tallo cerebral se localizan estructuras que detectan los niveles de glucosa, insulina, leptina y grelina, entre otras señales, para integrar el estado metabólico en que se encuentre el organismo y regular los estados de hambre y saciedad (Sakurai, 2012). Estas áreas de coordinación metabólica interactúan con estructuras cerebrales involucradas con generar la vigilia, el alertamiento y la motivación por la comida (ver Figura 1), inclusive en algunas de estas zonas reguladoras del metabolismo convergen procesos que determinan convergiéndola alternancia de procesos reguladores del sueño y la vigilia. Una de estas zonas integradoras se conoce como hipotálamo lateral y ahí se encuentran neuronas productoras de un péptido conocido como Orexina. Esto tiene una lógica ya que en la naturaleza encontrar comida requiere de estados de alerta y vigilia. En estas células del hipotálamo lateral convergen ambos sistemas. La liberación de Orexinas induce tanto un estado de hambre y búsqueda de alimento, como a un estado de vigilia y alertamiento (de Boer, et al, 2004). Estas células son activadas por la grelina y son inhibidas por la leptina y la glucosa. Además la actividad de estas células está directamente regulada por el reloj biológico en el hipotálamo para mantenerlas acopladas con el día y la noche (Salgado-Delgado, Angeles-Castellanos, Buijs & Escobar, 2010b). La actividad nocturna y el desvelo promueven la activación de este sistema orexinérgico, en momentos en que las señales del reloj biológico indican dormir. Esta activación podría ser la causa de un estado de hambre y deseos de comer por la noche. Con nuestro modelo de trabajador nocturno con ratas, encontramos que con la actividad y vigila forzadas, aumentaba la expresión y activación de células productoras de Orexinas y esta activación podría ser la causa de que los animales experimentales y las individuos que permanecen despiertos por la noche sientan deseos de comer. De ello surge la propuesta de que en personas que alteran sus patrones de dormir por mantenerse prolongadamente en vigilia, surjan deseos de consumir alimentos especialmente dulces y ricos en grasa.
En años recientes se ha descrito que genes metabólicos podrían verse alterados por genes reguladores de los ciclos circadianos que se expresan con ritmos de 24 horas. Estos genes (per1, per2, per3, cry1, cry2, clock, bmal1y reverbá) se les ha llamado también genes reloj porque se activan y transcriben sus proteínas en ciclos diarios de 24 horas. Estos ciclos le dictan ritmos circadianos a las funciones celulares. Los genes reloj mantienen una relación estrecha con genes reguladores del metabolismo celular entre ellos PGC1á, Sirt 1, Ppará y Pparã, con lo cual se confiere tiempos al metabolismo celular. Alteraciones en los ritmos circadianos afectan a los genes reloj y en consecuencia la transcripción de genes metabólicos (Feillet, Albrecht U & Challet, 2006) Así mismo se señales metabólicas generadas por la ingestión de alimentos le dan señales de tiempo a las células y pueden regular los ciclos circadianos de tal suerte que la hora de alimentación puede modificar a los genes reloj. Este proceso explicaría el porqué la alimentación durante la noche puede modificar el funcionamiento de algunos órganos y glándulas endocrinas, dando como resultado un funcionamiento fuera de coordinación con los ciclos sueño/ vigilia.
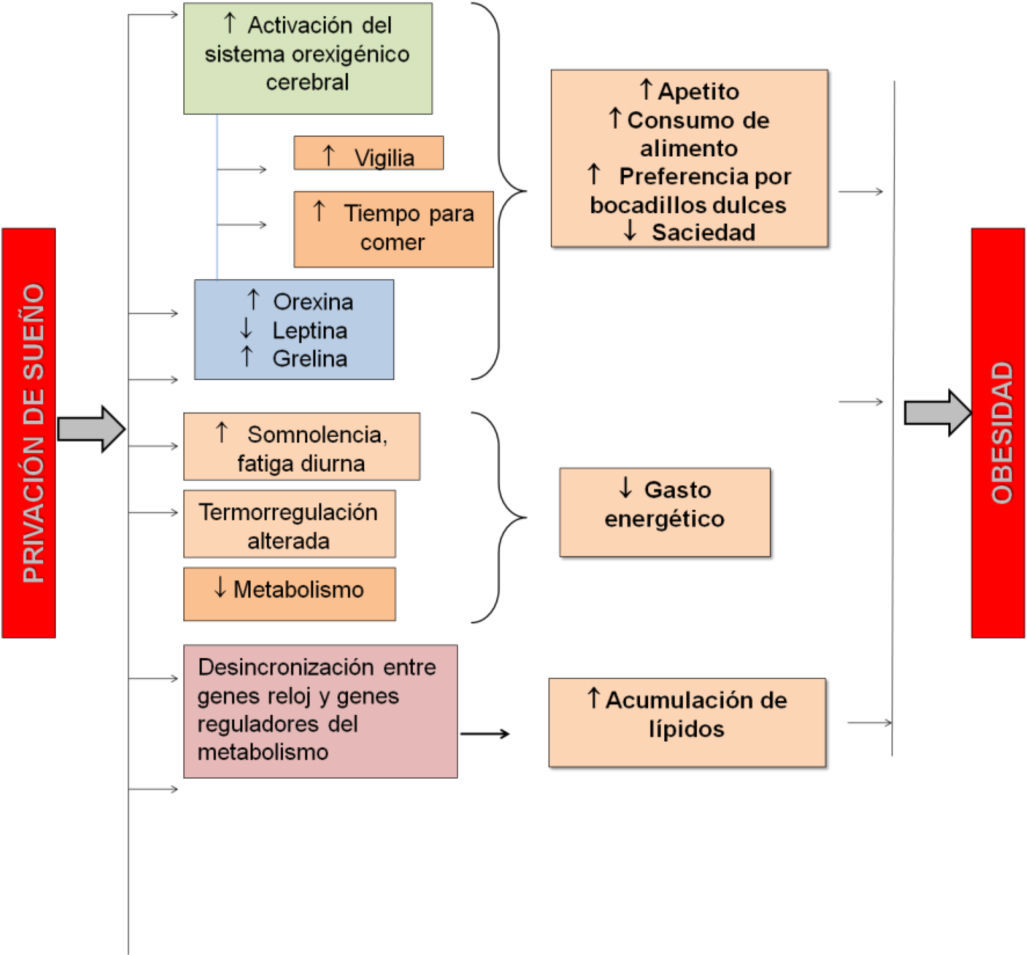
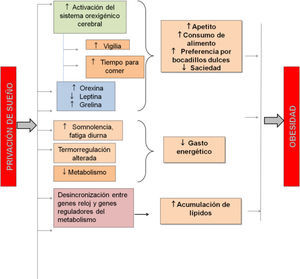
Recomendación y conclusionesEn esta revisión hemos presentado evidencias a nivel clínico y experimental que señalan una relación muy fuerte entre los hábitos de sueño y el desarrollo de sobrepeso y obesidad. Hemos descrito que los patrones de actividad /reposo y metabolismo convergen en sistemas de regulación a nivel de sistemas, cerebral y a nivel celular/genético, lo cual comprueba la estrecha relación de regulación que guardan ambos procesos (ver Figura 4). A pesar de que ya se cuenta con la evidencia aquí descrita, esta propuesta es relativamente nueva y requiere de mucho mayor estudio para comprender los mecanismos que asocian ambos fenómenos.
En México conocemos muy poco sobre los hábitos de sueño en niños y jóvenes. Resulta de extrema importancia que programas de salud exploren los patrones de sueño en estas poblaciones en riesgo para poder hacer un diagnóstico de su posible asociación con un apetito alterado y la propensión a sobrepeso y obesidad. Aún más, un sueño reparador es importante, para el buen rendimiento escolar, la estabilidad emocional, el crecimiento de los huesos y el estado general de salud. De tal manera un seguimiento de los hábitos de dormir y la implementación de programas para la higiene del sueño podrían eliminar un factor que aparentemente contribuye a la epidemia de obesidad y que ha pasado desapercibido.
Este trabajo se realizó como parte de las actividades del proyecto LA DESINCRONIZACIÓN CIRCADIANA Y LA PRIVACIÓN DE SUEÑO COMO FACTORES PROMOTORES DE OBESIDAD presentado como actividad de la Cátedra “Alberto Guevara Rojas” otorgado a la Dra Carolina Escobar durante el periodo abril 2012-abril 2013.
Trabajos del grupo dirigidos a explorar este tema han sido apoyados por PAPIIT/UNAM IN203907, IN-224911 y CONACyT 82462.
Información adicional sobre este artículo podrá escucharse en los podcast Mala calidad de sueño y obesidad 1 y 2 colocados en la página del departamento de Anatomía de la Fac de Medicina UNAM. Elaboración de Podcast por Daniel Maurer y Ma de Lourdes Vargas Anaya.