El virus de la hepatitis C (VHC) se ha relacionado repetidamente con un peor rendimiento de las funciones cognitivas. Sin embargo, no existe consenso acerca de la gravedad o del tipo de afectación cognitiva. Además, rara vez se controlan las variables que puedan influir en ello. El objetivo del presente estudio es definir el perfil cognitivo de los pacientes con VHC tras controlar el efecto de posibles covariables.
MétodosSe dividió a 42 pacientes con VHC en 2 grupos según la existencia de coinfección con virus de la inmunodeficiencia humana y se incluyó a un tercer grupo de 22 controles sanos. La evaluación neuropsicológica incluyó medidas de velocidad de procesamiento, funciones ejecutivas, memoria verbal, memoria visual y memoria de trabajo. Para explorar diferencias e identificar posibles covariables se tomaron medidas de depresión (BDI), ansiedad (HAM-A), fatiga (MAF), anhedonia (PAS), insomnio (ISI), calidad de vida (SF-36) y antecedentes de consumo de drogas (DAST-20).
ResultadosLos pacientes con VHC (incluyendo coinfectados por virus de la inmunodeficiencia humana) tuvieron un rendimiento peor que el grupo control en todos los dominios cognitivos. Sin embargo, tras controlar el efecto de BDI, HAM-A, MAF, ISI, SF-36 y DAST-20, solo la memoria verbal de los pacientes con VHC mostró diferencias entre los grupos.
ConclusionesEn consonancia con estudios previos, nuestros resultados muestran una relación entre la memoria verbal y el efecto del VHC en el cerebro, aunque el presente estudio no ha podido relacionar la afectación frontoestriatal de los pacientes con VHC con su rendimiento cognitivo.
Reduced performance in several cognitive domains has been repeatedly related to hepatitis C virus (HCV). Nevertheless, there is no consensus about the severity or cognitive profile. Moreover, other possible influential variables are scarcely controlled. The aim of this study is to define the specific cognitive profile in HCV after controlling for confounding variables.
MethodsForty-two HCV patients were distributed in 2groups according to the presence of co-infection with human immunodeficiency virus; a third group with 22 healthy controls was also included. The neuropsychological assessment included tests that assess processing speed, executive functioning, verbal memory, visual memory and working memory. Measures of depression (BDI), anxiety (HAM-A), fatigue (MAF), anhedonia (PAS), insomnia (ISI), quality of life (SF-36) and history of drug abuse (DAST-20) were taken in order to explore differences among groups and to control for their possible influence on cognitive performance.
ResultsHCV patients (including human immunodeficiency virus-coinfection) performed significantly worse in all cognitive measures. However, when the effect of BDI, HAM-A, MAF, ISI, SF-36 & DAST-20 was controlled, only verbal memory of HCV patients differed among groups. Coinfected patients performed worse in verbal memory.
ConclusionsAccording to previous studies verbal memory is the unique cognitive domain related to the effect of HCV. The present study does not support that the neurovirulence effect of HCV is decreasing cognitive performance in HCV patients. Nevertheless, the present study cannot relate the fronto-striatal disruption with the cognitive performance in HCV patients.
Los pacientes con virus de la hepatitis C (VHC) presentan daños hepáticos, pero el virus tiene también un efecto neurovirulento. La investigación en esta área está respaldada por el hecho de que en estos pacientes las estructuras frontoestriatales sufren alteraciones1, lo cual constituye una manifestación extrahepática del VHC que ha sido propuesta como causa posible de síntomas psiquiátricos y cognitivos2. Síntomas tales como fatiga, anhedonia, ansiedad, insomnio y depresión han sido repetidamente asociados al VHC por diferentes autores3,4.
Diversos estudios han concluido que, en comparación con otras enfermedades hepáticas crónicas, los pacientes de VHC presentan también una afectación adversa del funcionamiento cognitivo. Las funciones cognitivas afectadas varían de un estudio a otro: se ha encontrado una disminución del desempeño de la velocidad de procesamiento, atención y concentración, aprendizaje, memoria funcional y funciones ejecutivas2,5-8. Parece que las diferencias entre los estudios se deben parcialmente a la falta de congruencia de los métodos utilizados.
La vida de los pacientes infectados de VHC se ve afectada por la enfermedad; de hecho, los hallazgos han revelado que la infección por VHC está asociada a un descenso modesto aunque estadísticamente significativo de la autonomía en las actividades físicas e instrumentales de la vida diaria9. El VHC tiene un impacto sobre la calidad de vida, según se resalta en diversos estudios9-11. Sin embargo, su relación con el desempeño cognitivo ha sido significativa en algunos estudios9,12, aunque no en otros11.
Otro factor relevante para el desempeño cognitivo de los pacientes de VHC es la elevada tasa de comorbilidad con el virus de la inmunodeficiencia humana (VIH)13, ya que un 20% de los pacientes de VHC están coinfectados por él14. Al igual que el VHC, el VIH causa alteraciones en las conexiones entre las estructuras subcorticales y la sustancia blanca frontal15 aunque, a diferencia del VHC, en el trastorno neurocognitivo asociado al VIH se ha descrito repetidamente en la literatura la aparición de déficits cognitivos en una o más áreas cognitivas, tales como la función de la memoria o ejecutiva16. Clifford et al.17 no encontraron contribución alguna de la coinfección de VHC a los trastornos neurocognitivos de los pacientes de VIH. Sin embargo, los estudios que comparan el desempeño cognitivo en los pacientes de VHC y los pacientes de VHC coinfectados de VIH han encontrado un peor desempeño cognitivo en estos últimos18,19.
Se han estudiado diversos síntomas y comorbilidades del VHC en busca de su posible relación con el desempeño cognitivo. Patullo et al.20 han propuesto que el efecto de los síntomas psiquiátricos u otras variables de confusión tales como abuso de sustancias, gravedad de la enfermedad o comorbilidad con VIH pueden disminuir el desempeño cognitivo en estos pacientes, sobre todo en cuanto a las tareas dependientes de la velocidad. Incluso algunos estudios han filtrado cuidadosamente las variables de confusión y han incluido diagnósticos o abusos de sustancias, historial de trastornos psiquiátricos o coinfección, entre otros, como criterios de exclusión. Una investigación previa, realizada por el mismo grupo, detectó que las diferencias entre los pacientes de VHC y los controles sanos eran pequeñas, y que la significación clínica no era clara. Hilsabeck et al. agruparon a sus pacientes según sus síntomas depresivos o de ansiedad con relevancia clínica o normales, y no encontraron diferencias en cuanto a cognición8. Por el contrario, algunos estudios que han controlado depresión y ansiedad20, o nivel educativo o fatiga21, han encontrado que el aprendizaje verbal es el único dominio afectado. En un estudio piloto realizado por Lowry et al.5, se utilizó una muestra iatrogénica de mujeres con VHC para controlar posibles variables de confusión tales como abuso de sustancias o coinfección de VIH, y se observó que solo se veían afectadas la memoria y la atención. Hasta la fecha, la incongruencia acerca del desempeño cognitivo en el VHC se reduce cuando los estudios controlan una o 2variables. Pero aún no existe acuerdo.
Por tanto, los síntomas psiquiátricos pueden influir en el desempeño cognitivo de los pacientes de VHC, pero su influencia global sobre el desempeño cognitivo en el VHC ha sido escasamente estudiado. Por lo que el objetivo principal de este estudio es comparar el desempeño de las pruebas de los pacientes con VHC, coinfectados y no coinfectados de VIH, con los controles sanos, para evaluar si la infección está asociada a un mayor deterioro cognitivo, una vez controlados los efectos de los síntomas psiquiátricos y las características sociodemográficas. Suponemos que los pacientes infectados de VHC tendrán un desempeño significativamente peor que los controles sanos en las pruebas neurocognitivas. Además, la inclusión de posibles variables de confusión puede reflejar un perfil cognitivo diferente, por lo que suponemos que pocos dominios guardarán una relación específica con la infección por VHC.
MétodoParticipantesEl análisis de potencia realizado con el programa G*Power reveló que se requería un tamaño de muestra de 47 participantes para obtener un elevado tamaño del efecto (0,8). Identificamos y reunimos a 46 pacientes de VHC procedentes de un servicio de enfermedades infecciosas de un hospital universitario de España, tras ser diagnosticados de infección por VHC. Tres pacientes fueron rechazados, ya que no cumplían los criterios de inclusión establecidos: historial de diversos traumatismos cefálicos (N=1), dislexia (N=1) o daltonismo (N=1). Otro paciente desistió finalmente. La muestra final para el análisis se compuso de 42 pacientes de VHC no tratados previamente. Además, se incluyó a 22 familiares sanos de los participantes y a otros voluntarios (pareados según características de los pacientes) por el método del boca a boca, que formaron parte del grupo control. Dicho método boca a boca se utilizó entre los familiares, amigos y conocidos del equipo investigador, los pacientes y el personal del hospital o la universidad. En el análisis estadístico no incluimos a 3pacientes y un control, debido a que las evaluaciones fueron infructuosas o incompletas. Por tanto, utilizamos finalmente a 39 pacientes y 21 controles en el análisis.
La participación en el estudio de todos los participantes fue voluntaria, sin ningún tipo de recompensa. Todos ellos otorgaron su consentimiento escrito antes de ser incluidos en el estudio. El protocolo del estudio fue aprobado por el Comité de Ética del Departamento de Sanidad del Sistema Regional de Salud, perteneciente al gobierno regional de España. Las valoraciones fueron realizadas en un hospital psiquiátrico, en colaboración con el hospital universitario, en España.
La edad osciló entre 25 y 60 años; el 70,1% de los participantes eran varones. El nivel educativo medio de la muestra fue de 11,7 años, y los criterios de inclusión fueron: edad comprendida entre 18 y 65 años, diagnóstico positivo de infección crónica por VHC a través de la detección sérica de ARN de VHC y aceptación mediante consentimiento escrito de la participación en el estudio. Dichos criterios fueron añadidos como criterios de exclusión al grupo control, aunque el consentimiento informado fue oral en lugar de escrito. Los criterios de exclusión para pacientes y controles participantes fueron la presencia de cualquier otra enfermedad o disfunción hepáticas (puntuación Child-Turcotte-Pugh > 6, historia de varices hemorrágicas, ascitis o encefalopatía hepática), la presencia activa de trastorno por consumo de sustancias, el uso de fármacos psicotrópicos evidenciado mediante afectación de la cognición, historia de enfermedades neuropsiquiátricas que puedan afectar a la cognición, así como incapacidad para comunicarse en español, lo cual puede afectar la valoración psiquiátrica y la evaluación neuropsicológica.
Valoración clínicaLos participantes realizaron una entrevista en la que fueron valorados médica, clínica, psiquiátrica y neuropsicológicamente para evaluar su salud mental y, en particular, sus síntomas afectivos y cognitivos.
El psiquiatra P.M.G.S. entrevistó en primer lugar a cada participante utilizando la mini Entrevista Neuropsiquiátrica Internacional22. A continuación, los psiquiatras P.M.S.G. o E.E.Z. explicaron a todos los participantes cómo cumplimentar las escalas y cuestionarios autoadministrados. Posteriormente, 3neuropsicólogos, M.A.G.G., N.O.P. y V.G.B., hicieron la evaluación neuropsicológica, siguiendo las instrucciones de la prueba. La puntuación de la prueba que pudiera diferir de un evaluador a otro (tal como BVMT) fue siempre realizada por M.A.G.G.
Los síntomas afectivos examinados fueron administrados en el siguiente orden: los síntomas depresivos fueron evaluados mediante Beck Depression Inventory (BDI) versión II y la valoración de los síntomas de ansiedad con la Hamilton Rating Scale for Anxiety (HARS). La fatiga se evaluó utilizando la escala Multidimensional Fatigue (MAF), una versión revisada de la Piper Fatigue Scale, mientras que los síntomas de anhedonia se midieron utilizando la Physical Anhedonia Scale (PAS) y los síntomas de gravedad del insomnio se evaluaron mediante el Insomnia Severity Index (ISI). El historial de abuso de sustancias se evaluó utilizando la prueba Drug Abuse Screening Test (DAST-20). Por último, se utilizó el Short Form-36 Health Survey (SF-36) como estimación global de la salud; esta escala está formada por 8 subescalas: función física(FF), limitaciones del rol debido a la salud física (LP), dolor (D), salud general (SG), vitalidad (V), función social (FS), limitaciones del rol debido a problemas emocionales (LE), y bienestar emocional (BE). Algunas de las puntuaciones de los ítems de las escalas clínicas anteriormente mencionadas se invirtieron y, por tanto, las puntuaciones mayores indicaron siempre una mayor sintomatología22,23.
Los neuropsicólogos, que desconocían la información médica y clínica del paciente, administraron la batería de pruebas neuropsicológicas (tiempo=1h), que consistió en 9pruebas que cubrían: memoria verbal, memoria visual, velocidad psicomotora y funciones ejecutivas. Las pruebas se presentaron en el orden siguiente:
Dígitos, orden directo e inverso (Digit Span: direct order and backwards, WAIS-III). Esta prueba evalúa el nivel de atención y concentración del participante e incluye también un componente mayor de la memoria funcional. En primer lugar, se solicita al participante que repita una serie de números que ha escuchado. En la segunda parte, se le solicita que repita los números escuchados hacia atrás24.
Letras y números (Letter-Number sequencing, WAIS-III). Esta prueba se utiliza principalmente para evaluar la memoria funcional y la atención del participante. Los participantes deben repetir una serie de números y letras mezclados. Primero tienen que repetir los números en orden ascendente y las letras en orden alfabético24.
Hopkins Verbal Learning Test (HVLT). Esta prueba mide el aprendizaje y la memoria verbales del participante. Combina pruebas de aprendizaje y una prueba de memoria diferida24.
Test breve de memoria visual (Brief Visual Memory Test, BVMT). Esta mide el aprendizaje y la memoria visual; combina también 3pruebas de aprendizaje y una prueba de memoria diferida25.
Test de palabras y colores Stroop (Stroop Test). En esta prueba, a los participantes se les entregan 3 pruebas de 45 segundos para leer en voz alta un listado de colores mecanografiados en tinta negra; decir el color en el que se escribe un conjunto de «x»; y decir el color de la tinta en la que se mecanografía el listado de colores24.
Test del trazo (Trail Making Test). Tiene 2 partes (A y B) y evalúa la atención, las funciones ejecutivas y la velocidad de procesamiento. Se solicita al participante que conecte una serie de puntos, con números o números/letras, en el orden correcto, lo más rápidamente posible24.
Símbolos y dígitos (Digit Symbol, WAIS-III). Esta prueba mide la memoria funcional del participante, a quien se presenta un listado de pares números-dígitos seguido de un listado de dígitos en los que falta el símbolo. El participante debe cumplimentar el número máximo posible de símbolos24.
Test de clasificación de tarjetas de Wisconsin (Wisconsin Card Sorting Test, WCST-CV64). Esta versión de 64 ítems evalúa la función ejecutiva, la memoria funcional y la flexibilidad mental24.
Puntuaciones compuestas (composite scores). Se calcularon las puntuaciones compuestas para crear puntuaciones de dominio cognitivo. Las medidas incluidas en cada dominio fueron elegidas por marco teórico, para garantizar una mejor consistencia interna. Las pruebas implicadas en cada dominio fueron: Stroop Test y Digit Symbol for Processing Speed; Digit Span, Letter-Number, TMT y WCST para memoria funcional; WCST para funciones ejecutivas; HVLT para memoria verbal y BVMT para memoria visual. Se invirtieron algunas medidas, para que las puntuaciones mayores indicaran un mejor desempeño neurocognitivo; la consistencia interna de estos dominios neurocognitivos compuestos fue alta (αde Cronbach=0,825-0,936).
Análisis de los datosSe utilizó IBM SPSS Statistics para Windows, versión 23.0 (IBM Corp., Armonk, NY, EE. UU.), para analizar los datos. Se analizó la distribución normal de los datos, con arreglo a los grupos, utilizando la prueba de Shapiro-Wilk, y todas las variables dependientes (dominios cognitivos) seguían una distribución normal.
Para analizar las diferencias por sexo entre los 3 grupos se empleó el análisis de varianza (ANOVA). Se usaron análisis de medición múltiple de covarianza (MANCOVA) a fin de analizar las diferencias cognitivas en cuanto al desempeño entre los grupos, incluyendo como covariables las medidas que difirieron significativamente entre los grupos. El nivel de significación se estableció en 0,05 y todas las pruebas fueron bilaterales.
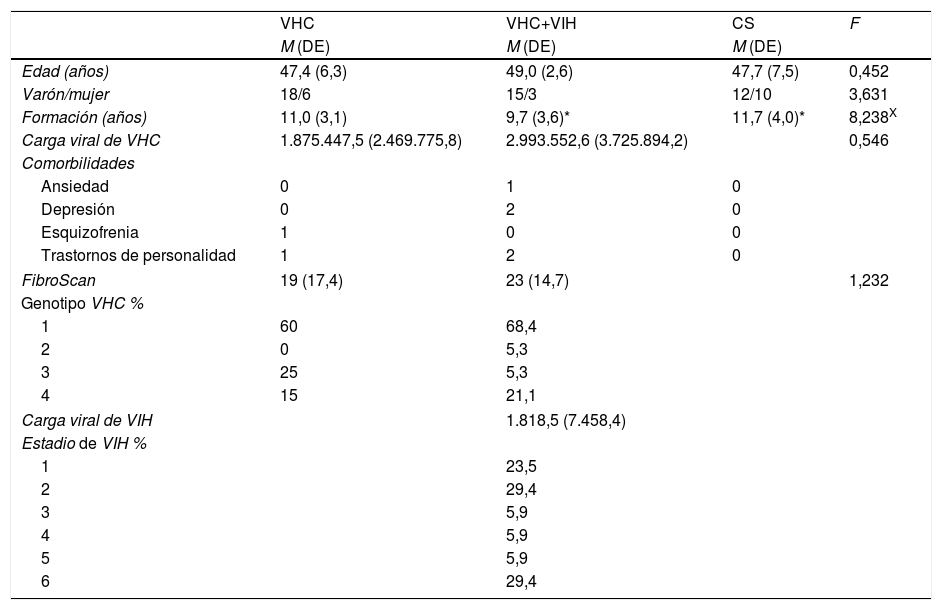
ResultadosCaracterísticas sociodemográficas de los gruposLas características sociodemográficas, médicas y de comorbilidades de los 3grupos se describen en la tabla 1. Los grupos fueron equivalentes en términos de medidas de VHC, distribución por sexo, aunque difirieron en cuanto a nivel educativo y edad (tabla 1). Por tanto, el nivel educativo y la edad fueron incluidas como covariables. La muestra total fue caucásica. Del total, 56pacientes tenían trabajo, el 18% recibía apoyo socioeconómico y el 26% estaba en paro. El 90% de los participantes sanos trabajaba, el 5% recibía apoyo socioeconómico y el 5% estaba en paro.
Diferencias sociodemográficas y médicas entre los participantes, con arreglo a su grupo de condición
| VHC | VHC+VIH | CS | F | |
| M (DE) | M (DE) | M (DE) | ||
| Edad (años) | 47,4 (6,3) | 49,0 (2,6) | 47,7 (7,5) | 0,452 |
| Varón/mujer | 18/6 | 15/3 | 12/10 | 3,631 |
| Formación (años) | 11,0 (3,1) | 9,7 (3,6)* | 11,7 (4,0)* | 8,238X |
| Carga viral de VHC | 1.875.447,5 (2.469.775,8) | 2.993.552,6 (3.725.894,2) | 0,546 | |
| Comorbilidades | ||||
| Ansiedad | 0 | 1 | 0 | |
| Depresión | 0 | 2 | 0 | |
| Esquizofrenia | 1 | 0 | 0 | |
| Trastornos de personalidad | 1 | 2 | 0 | |
| FibroScan | 19 (17,4) | 23 (14,7) | 1,232 | |
| Genotipo VHC % | ||||
| 1 | 60 | 68,4 | ||
| 2 | 0 | 5,3 | ||
| 3 | 25 | 5,3 | ||
| 4 | 15 | 21,1 | ||
| Carga viral de VIH | 1.818,5 (7.458,4) | |||
| Estadio de VIH % | ||||
| 1 | 23,5 | |||
| 2 | 29,4 | |||
| 3 | 5,9 | |||
| 4 | 5,9 | |||
| 5 | 5,9 | |||
| 6 | 29,4 | |||
CS: grupo control sano; DE: desviación estándar; M: media; VHC: grupo VHC; VHC: virus de la hepatitis C; VHC+VIH: grupo VHC y VIH; VIH: virus de la inmunodeficiencia humana.
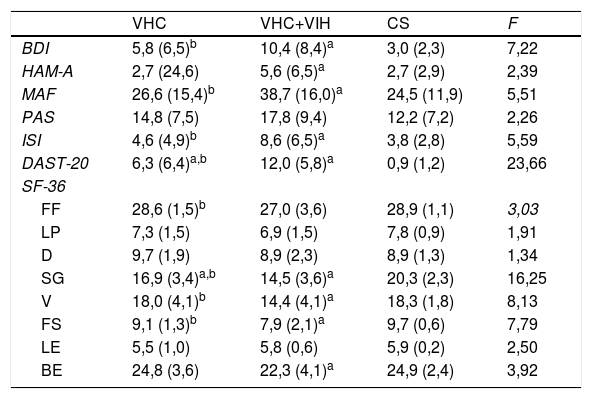
Todas las puntuaciones psiquiátricas y las diferencias entre los grupos se incluyen en la tabla 2. Los resultados reflejaron que todas las variables difirieron entre los grupos, exceptuando la medida de anhedonia. Entre todas las dimensiones SF-36, 5reflejaron diferencias significativas entre los grupos: PF, SG, V, FS y BE.
Diferencias clínicas entre los participantes según su grupo
| VHC | VHC+VIH | CS | F | |
| BDI | 5,8 (6,5)b | 10,4 (8,4)a | 3,0 (2,3) | 7,22 |
| HAM-A | 2,7 (24,6) | 5,6 (6,5)a | 2,7 (2,9) | 2,39 |
| MAF | 26,6 (15,4)b | 38,7 (16,0)a | 24,5 (11,9) | 5,51 |
| PAS | 14,8 (7,5) | 17,8 (9,4) | 12,2 (7,2) | 2,26 |
| ISI | 4,6 (4,9)b | 8,6 (6,5)a | 3,8 (2,8) | 5,59 |
| DAST-20 | 6,3 (6,4)a,b | 12,0 (5,8)a | 0,9 (1,2) | 23,66 |
| SF-36 | ||||
| FF | 28,6 (1,5)b | 27,0 (3,6) | 28,9 (1,1) | 3,03 |
| LP | 7,3 (1,5) | 6,9 (1,5) | 7,8 (0,9) | 1,91 |
| D | 9,7 (1,9) | 8,9 (2,3) | 8,9 (1,3) | 1,34 |
| SG | 16,9 (3,4)a,b | 14,5 (3,6)a | 20,3 (2,3) | 16,25 |
| V | 18,0 (4,1)b | 14,4 (4,1)a | 18,3 (1,8) | 8,13 |
| FS | 9,1 (1,3)b | 7,9 (2,1)a | 9,7 (0,6) | 7,79 |
| LE | 5,5 (1,0) | 5,8 (0,6) | 5,9 (0,2) | 2,50 |
| BE | 24,8 (3,6) | 22,3 (4,1)a | 24,9 (2,4) | 3,92 |
BDI: Beck Depression Inventory; BE: bienestar emocional; CS: grupo control sanos;D: dolor; DAST-20: Drug Abuse Screening Test; FF: función física; FS: función social; HAM-A: Hamilton Rating Scale for Anxiety; ISI: Insomnia Severity Index; LE: limitaciones de rol debido a problemas emocionales; LP: limitaciones de rol debido a salud física; MAF: Multidimensional Fatigue Scale; PAS: Physical Anhedonia Scale; SF-36: Short-Form; SG: salud general; V: vitalidad; VHC: grupo VHC; VHC: virus de la hepatitis C; VHC+VIH: grupo VHC+VIH; VIH: virus de la inmunodeficiencia humana.
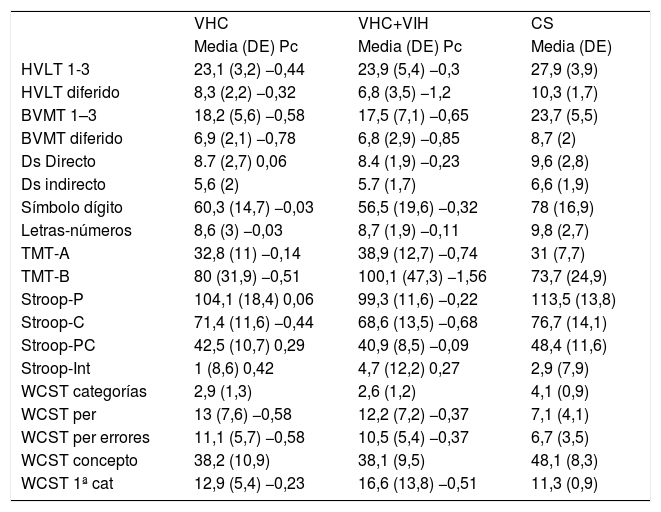
La tabla 3 resume el desempeño neurocognitivo y refleja las medias de las puntuaciones directas y los percentiles, comparados con los datos normativos, cuando se disponía de ellos.
Descripción de las medidas neuropsicológicas según grupo
| VHC | VHC+VIH | CS | |
| Media (DE) Pc | Media (DE) Pc | Media (DE) | |
| HVLT 1-3 | 23,1 (3,2) −0,44 | 23,9 (5,4) −0,3 | 27,9 (3,9) |
| HVLT diferido | 8,3 (2,2) −0,32 | 6,8 (3,5) −1,2 | 10,3 (1,7) |
| BVMT 1–3 | 18,2 (5,6) −0,58 | 17,5 (7,1) −0,65 | 23,7 (5,5) |
| BVMT diferido | 6,9 (2,1) −0,78 | 6,8 (2,9) −0,85 | 8,7 (2) |
| Ds Directo | 8.7 (2,7) 0,06 | 8.4 (1,9) −0,23 | 9,6 (2,8) |
| Ds indirecto | 5,6 (2) | 5.7 (1,7) | 6,6 (1,9) |
| Símbolo dígito | 60,3 (14,7) −0,03 | 56,5 (19,6) −0,32 | 78 (16,9) |
| Letras-números | 8,6 (3) −0,03 | 8,7 (1,9) −0,11 | 9,8 (2,7) |
| TMT-A | 32,8 (11) −0,14 | 38,9 (12,7) −0,74 | 31 (7,7) |
| TMT-B | 80 (31,9) −0,51 | 100,1 (47,3) −1,56 | 73,7 (24,9) |
| Stroop-P | 104,1 (18,4) 0,06 | 99,3 (11,6) −0,22 | 113,5 (13,8) |
| Stroop-C | 71,4 (11,6) −0,44 | 68,6 (13,5) −0,68 | 76,7 (14,1) |
| Stroop-PC | 42,5 (10,7) 0,29 | 40,9 (8,5) −0,09 | 48,4 (11,6) |
| Stroop-Int | 1 (8,6) 0,42 | 4,7 (12,2) 0,27 | 2,9 (7,9) |
| WCST categorías | 2,9 (1,3) | 2,6 (1,2) | 4,1 (0,9) |
| WCST per | 13 (7,6) −0,58 | 12,2 (7,2) −0,37 | 7,1 (4,1) |
| WCST per errores | 11,1 (5,7) −0,58 | 10,5 (5,4) −0,37 | 6,7 (3,5) |
| WCST concepto | 38,2 (10,9) | 38,1 (9,5) | 48,1 (8,3) |
| WCST 1ª cat | 12,9 (5,4) −0,23 | 16,6 (13,8) −0,51 | 11,3 (0,9) |
BVMT 1-3: Brief Visual Memory Test, pruebas 1 a 3; BVMT diferido: Prueba diferida Brief Visual Memory Test; CS: grupo controles sanos; DS Directo: Digit Span orden directa (WAIS III); DS indirecto: Digit Span orden indirecto (WAIS III); Grooved-D: Grooved Pegboard Test, mano dominante; Grooved-ND: Grooved Pegboard Test, mano no dominante; HVLT 1-3: Hopkins Verbal Learning Test, pruebas 1 a 3; HVLT diferido: Hopkins Verbal Learning Test prueba diferida; Letras-Números: Secuenciación Letras-Números (WAIS III); Símbolo-dígitos: Símbolo Dígito (WAIS III); Stroop-C: hoja de color Stroop Test; Stroop-Int: Interferencia Stroop Test; Stroop-P: hoja de palabras Stroop Test; Stroop-PC: Stroop Test hoja de color-palabras; TMT-A: Trail Making Test parte A; TMT-B: Trail Making Test parte B; VHC: grupo VHC; VHC: virus de la hepatitis C; VHC+VIH: grupo VHC y VIH; VIH: virus de la inmunodeficiencia humana; WCST 1.ª cat: Wisconsin Card Sorting Test, intentos para completar la primera categoría; WCST categorías: Wisconsin Card Sorting Test, puntuación de número de categorías; WCST concepto: Wisconsin Card Sorting Test, puntuación de respuestas de nivel conceptual; WCST per: Wisconsin Card Sorting Test, puntuación de perseveraciones; WVST per errores: Wisconsin Card Sorting Test, puntuación de errores perseverativos.
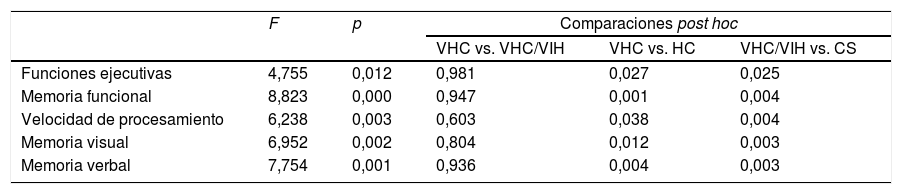
Se llevó a cabo un análisis exploratorio de las diferencias de desempeño cognitivo entre los grupos, utilizando un análisis de varianza (ANOVA), que no reflejó diferencias entre los grupos de VHC. Sin embargo, existieron diferencias significativas entre los grupos VHC y VHC-VIH y el grupo de controles sanos. Las diferencias entre grupos se reflejan detalladamente en la tabla 4.
ANOVA exploratorio que compara el desempeño cognitivo en cada dominio en las diferentes situaciones
| F | p | Comparaciones post hoc | |||
| VHC vs. VHC/VIH | VHC vs. HC | VHC/VIH vs. CS | |||
| Funciones ejecutivas | 4,755 | 0,012 | 0,981 | 0,027 | 0,025 |
| Memoria funcional | 8,823 | 0,000 | 0,947 | 0,001 | 0,004 |
| Velocidad de procesamiento | 6,238 | 0,003 | 0,603 | 0,038 | 0,004 |
| Memoria visual | 6,952 | 0,002 | 0,804 | 0,012 | 0,003 |
| Memoria verbal | 7,754 | 0,001 | 0,936 | 0,004 | 0,003 |
CS: grupo controles sanos; VHC: grupo VHC; VHC+VIH: grupo VHC y VIH.
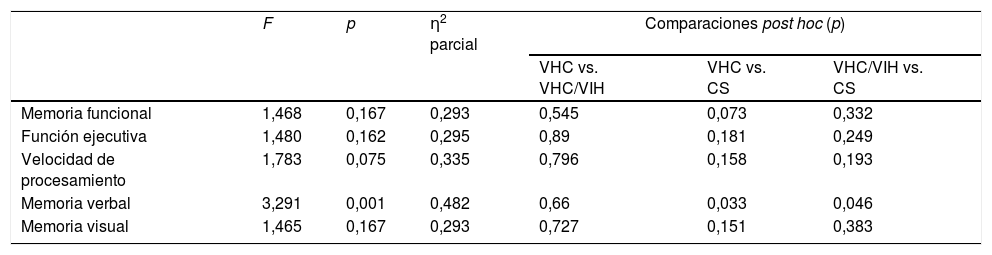
En el análisis multivariante de covarianza (MANCOVA), el nivel educativo, la edad, y las medidas de depresión, fatiga, insomnio, historial de abuso de sustancias y la calidad de vida (FF, SG, V, FS, y BE), que difirieron significativamente entre los grupos, fueron incluidas en el análisis como covariantes. El análisis MANCOVA (ver tabla 5) reflejó que, utilizando la λ de Wilk, no existió un efecto significativo de los grupos sobre los dominios cognitivos (L=0,84; F[10,84]=0,76; p=0,67]. Sin embargo, los efectos entre sujetos reflejaron que, tras controlar las variables anteriores, solo el aprendizaje verbal resultó significativo, y el efecto del tamaño del grupo fue bajo para moderar la memoria verbal (η2 parcial=0,48).
MANCOVA para dominios cognitivos que comparan los grupos VHC, VHC/VIH y controles sanos, tras controlar las covariables
| F | p | η2 parcial | Comparaciones post hoc (p) | |||
| VHC vs. VHC/VIH | VHC vs. CS | VHC/VIH vs. CS | ||||
| Memoria funcional | 1,468 | 0,167 | 0,293 | 0,545 | 0,073 | 0,332 |
| Función ejecutiva | 1,480 | 0,162 | 0,295 | 0,89 | 0,181 | 0,249 |
| Velocidad de procesamiento | 1,783 | 0,075 | 0,335 | 0,796 | 0,158 | 0,193 |
| Memoria verbal | 3,291 | 0,001 | 0,482 | 0,66 | 0,033 | 0,046 |
| Memoria visual | 1,465 | 0,167 | 0,293 | 0,727 | 0,151 | 0,383 |
CS: grupo controles sanos; VHC: grupo VHC; VHC+VIH: grupo VHC y VIH.
Este es el primer estudio que tiene en consideración un número tan elevado de medidas demográficas, psiquiátricas y de calidad de vida, al estudiar la cognición en el VHC. Estos resultados muestran la falta de deterioro cognitivo en los pacientes de VHC (>1 DE), aunque un peor desempeño en comparación con la muestra normativa. El peor desempeño cognitivo podría deberse al efecto de la comorbilidad con el VIH, los síntomas psiquiátricos o la calidad de vida, lo cual podría explicar la falta de acuerdo existente en este campo.
Este estudio respalda la relevancia de controlar las variables, ya que muestra un cambio en el patrón de los dominios afectados, tras considerar las covariables. Esto puede deberse a, en primer lugar, el hecho de que existe una relación entre psicopatología y un peor rendimiento cognitivo en enfermedades diferentes. El desempeño cognitivo puede deteriorarse en presencia de síntomas afectivos o clínicos26. Y, en segundo lugar, a que el VIH o el abuso de sustancias han guardado tradicionalmente una relación con el deterioro cognitivo de los pacientes, aun en ausencia de infección por VHC27.
El trastorno por consumo de sustancias fue un criterio de exclusión en este estudio, aunque el abuso/dependencia de sustancias en el pasado podría haber influido en la cognición actual. Por ello, en un intento de cuantificar dicha influencia, también se midió la larga duración del consumo de sustancias de los participantes. A pesar de ser poco frecuente, algunos estudios han incluido algunas de las covariantes anteriores al estudiar la cognición en la infección por VHC y, aunque ninguno de ellos ha incluido tantas covariantes como nuestro estudio, algunos de sus resultados se acercan a los hallados en el presente estudio. De manera similar a nuestros resultados, McAndrews et al.28 encontraron que, tras controlar el efecto del nivel educativo, solo la memoria verbal fue significativamente menor en los pacientes de VHC, en comparación con los controles sanos. Karaivazoglou et al.21 encontraron un peor desempeño en cuanto a aprendizaje y memoria verbal en los pacientes de VHC tras controlar la edad, la formación, la depresión y la fatiga. El estudio de Karaivazoglou et al. es el más similar al presente, aunque nosotros hemos incluido fatiga, insomnio y coinfección de VIH o historial de abuso de sustancias como covariantes, lo cual enriquece el estudio y respalda los resultados previos.
La evidencia sostiene que la presencia de coinfección en el sistema nervioso central incrementa la expresión del virus en el tejido cerebral y causa complicaciones tales como deterioro cognitivo19. Sin embargo, nuestro estudio no apoya nuestra hipótesis acerca de un perfil cognitivo propio de los pacientes con VHC como consecuencia de la alteración frontoestriatal. Más estudios en la combinación de los campos de neuroimagen y cognición son necesarios.
A menudo, los pacientes infectados por VHC refieren síntomas tales como estado depresivo, fatiga y confusión mental20, que influyen en su calidad de vida. La comorbilidad con la sintomatología de la salud mental es una cuestión creciente para el sistema de salud. Diversos estudios previos han comenzado a centrarse en esta cuestión en nuestro país, pero se necesitan más estudios en el futuro29,30. Las intervenciones adecuadas podrían reducir estos síntomas e incrementar la calidad de vida de los pacientes. Una vez que se defina debidamente el desempeño cognitivo, ello podría guiar a los clínicos en la búsqueda de la definición del tratamiento adecuado para cada paciente. Quizá el abordar las variables psiquiátricas podría incrementar la calidad de vida, la función social y el desempeño cognitivo, ya que están correlacionados31. Los diferentes tipos de tratamiento podrían incrementar su efectividad, si se combinan, ya que la intervención cognitiva ha sido un tratamiento efectivo a la hora de mejorar, no solo el desempeño cognitivo de los pacientes, sino también su estado de ánimo y su calidad de vida32. La combinación de psicoterapia, intervención cognitiva y grupos de apoyo podría incrementar la calidad de vida y reducir las quejas de los pacientes sobre su salud, estado de ánimo y cognición, según lo referido por algunos autores20,33.
Aunque este estudio supone una contribución válida y relevante en este campo, encontramos ciertas limitaciones. El tamaño reducido de la muestra limita su generalización a la población general con infección por VHC, que debería hacerse con precaución. Además, la muestra control utilizada en el presente estudio difiere en cuanto a nivel educativo respecto al grupo de pacientes. Como los estudios previos han encontrado que esta variable tiene un papel relevante en la relación entre la cognición y el VHC, es recomendable que los estudios futuros empleen tiempo y recursos para equiparar detenidamente los grupos por nivel educativo. Los pacientes de este estudio reflejaron un deterioro cognitivo muy leve; es posible que el estrecho rango de datos haya limitado los resultados. También es posible que el elevado número de comparaciones realizadas en el análisis estadístico haya disminuido la fiabilidad de nuestros resultados. Es difícil estudiar este tipo de población, debido al alto nivel de síntomas de comorbilidad que presentan. El hecho de la amplia mayoría de pacientes de VHC implica la necesidad de diseños de investigación que incluyan todas estas variables, aunque limita el estudio del efecto del VHC por sí mismo. El equilibrio entre incluir o no los síntomas de comorbilidad es un reto y probablemente la investigación nueva acerca de su relación pueda añadir alguna luz. En el momento de efectuar este estudio, SF-36 era una medida fiable de la calidad de vida, aunque no específica para el VHC. Sin embargo, desde entonces, Armstrong et al. han aportado una medida multidimensional de calidad vida específica de VHC (PROQOL-VHC) que incluye una dimensión del tratamiento que podría resultar muy útil a la hora de estudiar los cambios subsiguientes al tratamiento del VHC34.
Por último, los resultados concluyen que el desempeño neurocognitivo se reduce ligeramente en los pacientes de VHC, con un desempeño menor en aquellos coinfectados de VIH. El efecto neurovirulento del VHC parece limitarse a la memoria verbal.
FinanciaciónEste estudio ha sido financiado por Sociedad de Enfermedades Infecciosas del Norte (SEINORTE).
Conflicto de interesesTodos los autores reportan la ausencia de conflicto de intereses.
Los autores quisieran agradecer su contribución todos los participantes en este estudio, así como la ayuda prestada por las enfermeras Nuria Grivé Isern, María Ángeles Ruiz de Azúa Velasco y Amaia Ortiz de Zárate San Agustín, del Hospital Psiquiátrico de Álava, y a María Isabel Santamaría Mas del Servicio de Enfermedades Infecciosas del Hospital Universitario Txagorrtitxu de Álava, a la hora de realizar el reclutamiento y seguimiento de los participantes. Sin su tiempo, la cooperación en este estudio habría sido imposible. Y por último nos gustaría agradecer a los revisores sus comentarios constructivos.