el diagnóstico y estadificación locorregional del cáncer de mama se realiza mediante mamografía, ecografía (incluyendo territorio ganglionar) y resonancia magnética, previa confirmación histológica. Para el estudio de metástasis a distancia se emplean pruebas como la tomografía computarizada (TC).
Métodosestudio prospectivo, aleatorizado y controlado con 44 pacientes (septiembre 2022 a marzo 2023), estudiadas mediante ecografía dirigida inicial con: nódulos mamarios sospechosos de malignidad (NMSM) mayor de 5 cm o que asocien inflamación mamaria, NMSM con adenopatías (región axilar/mamaria interna) o adenopatías en la región axilar/mamaria interna sin nódulo. La mitad siguieron el protocolo habitual y la otra mitad el protocolo TEMA (TC toraco-abdomino-pélvico y mamografía con contraste con el mismo bolo de contraste intravenoso 2 fases, tomosíntesis y ecografía con toma de biopsias; todo ello en un acto único).
Resultadosno hubo diferencias significativas en las edades, estadio, tipo tumoral o inmunofenotipo de ambos grupos. Con el protocolo habitual, el tiempo medio desde la realización de la biopsia de lesiones con sospecha de malignidad a la realización del TC de estadificación o Tiempo de Demora Total (TDT) fue de 40 días, y todas habían iniciado quimioterapia neoadyuvante. El tiempo medio necesario para el diagnóstico y la estadificación con el protocolo TEMA fue de 27 minutos.
Conclusionesla ecografía dirigida inicial permite identificar a las pacientes que se benefician de la estadificación locorregional y a distancia inicial, candidatas a seguir el protocolo TEMA. Este permite la estadificación completa inmediata, eliminando el TDT y de forma más precisa (sin modificaciones por la quimioterapia).
After histological confirmation, mammography, ultrasound (including nodal territory), and MRI are used for locoregional staging. Tests such as computed tomography (CT) are used for the study of distant metastases.
MethodsProspective randomized controlled study with 44 patients (September 2022 to March 2023), studied by initial directed ultrasound with: breast nodules suspicious for malignancy (BNSM) >5 cm or associated breast inflammation, BNSM with lymphadenopathy (axillary/internal mammary region), or lymphadenopathy in axillary/internal mammary region without nodule. Half followed the usual protocol and the other half the TEMA protocol (thoraco-abdominal-pelvic CT and mammography with contrast with the same bolus of intravenous contrast, 2 phases, tomosynthesis and ultrasound with biopsies; all in a single act).
ResultsThere were no significant differences in age, stage, tumor type, or immunophenotype between the two groups. With the usual protocol, the mean time from biopsy of lesions with suspected malignancy to staging CT scan, or Total Delay Time (TDT) was 40 days, and all had started neoadjuvant chemotherapy. The median time required for diagnóstico and staging with the TEMA protocol was 27 min.
ConclusionsInitial targeted ultrasound identifies patients who will benefit from initial locoregional and distant staging, candidates for the TEMA protocol. This allows immediate complete staging, which is more accurate (without modifications due to chemotherapy), and eliminating TDT.
El cáncer de mama es el tumor más frecuente en las mujeres. Una de cada 8 mujeres españolas lo padecerá en algún momento de su vida, especialmente a partir de la quinta década de la vida, constituyendo uno de los principales problemas de salud en este sector poblacional1–3.
El diagnóstico se basa en la exploración física y técnicas de imagen, y su confirmación se realiza mediante el estudio anatomopatológico, que permite determinar malignidad o benignidad de los hallazgos mediante citología o histología. El examen clínico incluye palpación bimanual de ambas mamas y ganglios linfáticos regionales4–6.
La mamografía es el único método diagnóstico aceptado como técnica de detección, permitiendo su detección precoz y reduciendo las tasas de mortalidad5. Su sensibilidad diagnóstica se sitúa en torno al 85% y se ve reducida con la densidad mamaria, característica frecuente en pacientes más jóvenes, y para el cáncer de mama lobulillar. Esto justifica el uso de otras técnicas diagnósticas como la ecografía o la resonancia magnética (RM)7–9.
En la última década, la mamografía con contraste (CEM) es una técnica en auge. Se trata de un estudio funcional donde se usa un agente de contraste (yodo) que permite obtener imágenes de la neoangiogénesis en tumores de mama, mejorando la visibilidad del área tumoral. El contraste yodado intravenoso se administra a la misma dosis que en la tomografía computarizada. Durante un intervalo de 2 a 8 minutos tras la inyección, se adquieren imágenes de alta y baja energía, lo que permite obtener una imagen recombinada en la que se muestran las zonas con captación de contraste. Esto permite combinar los beneficios del uso del contraste, con el bajo coste de la mamografía, pues la otra técnica funcional de la que disponemos (RM) requiere recursos y no está disponible en todos los centros9,10.
La CEM muestra una sensibilidad de alrededor del 95% con especificidad del 75–80%. Además, proporciona una mejor delimitación de la extensión de las lesiones malignas que la mamografía9.
Estadificación del cáncer de mamaEl diagnóstico anatomopatológico final debe realizarse de acuerdo con la clasificación de la Organización Mundial de la Salud (OMS) y la octava edición del sistema de estadificación de tumores, ganglios y metástasis (TNM) del American Joint Committee on Cancer. Este sistema clasifica en estadios, en función del tamaño del tumor principal, el número de ganglios afectos y la existencia de metástasis. Cuando el diagnóstico se hace de manera temprana, la estadificación locorregional se realiza mediante mamografía, ecografía mamaria y de territorios ganglionares y RM, dado que las metástasis en pacientes asintomáticas son raras y la mayoría no se beneficia de pruebas de laboratorio integrales (incluidos marcadores tumorales y estadificación radiológica). La tomografía computarizada (TC) del tórax y métodos de imagen en abdomen (ecografía, TC o RM) se considerarían para detección de metástasis en pacientes con los siguientes criterios4:
- •
Ganglios axilares clínicamente positivos.
- •
Tumores grandes (de más de 5 cm).
- •
Biología agresiva.
- •
Signos clínicos, síntomas o valores de laboratorio que sugieran la presencia de metástasis.
Los métodos de imagen dual que combinan pruebas funcionales y anatómicas, como la tomografía por emisión de positrones (PET-TC) con fluorodesoxiglucosa, pueden ser útiles cuando los métodos de imagen anteriormente descritos no son concluyentes. La PET-TC puede reemplazar las técnicas de imagen tradicional en pacientes de alto riesgo, aunque en casos de cáncer lobulillar y tumores de bajo grado puede ser menos sensible4.
Retraso en la estadificación y Tiempo de Demora Total (TDT)Se considera esencial realizar un diagnóstico y tratamiento precoces para un mejor pronóstico de la enfermedad. Para ello se tiene en cuenta el estadio al diagnóstico y la duración de distintos intervalos: el transcurrido desde la aparición del primer síntoma hasta la primera consulta, desde ese momento hasta el diagnóstico y hasta el inicio del tratamiento. Estos intervalos describen la duración total del tiempo invertido en el tratamiento de la enfermedad (combinación de tiempo necesario o inevitable y tiempo evitable y que debe reducirse); estos tiempos invertidos en el tratamiento deberían invertirse en el diagnóstico. En general, una mayor duración de estos intervalos asocia peor pronóstico, al igual que un estadio más tardío al diagnóstico. Asimismo, hay evidencia que sugiere que tiempos menores en el diagnóstico asocian mayor supervivencia para cáncer de mama, colorrectal, de cabeza y cuello, testicular y melanoma de piel. Además, presenta beneficios relacionados con aspectos como la ansiedad y calidad de vida, más allá de los resultados oncológicos11. La mayoría de los autores hablan de retraso diagnóstico o para realización de cirugía o inicio de quimioterapia/radioterapia12, pero no del retraso en la estadificación. El retraso diagnóstico o tiempo hasta la estadificación, se definió como el tiempo en días desde la fecha de la sospecha inicial de cáncer, hasta la fecha de los procedimientos de estadificación. En el campo de la mama no hay publicaciones al respecto, pero en un estudio realizado en el Hospital General Universitario de Ciudad Real13 se propuso una Vía de Alta Resolución para realizar pruebas radiológicas para estadificación inicial ante el diagnóstico endoscópico de neoplasias del tracto digestivo. En él se afirma que el estadificación determina la actitud terapéutica, por lo que la realización de pruebas de imagen debe hacerse con el menor retraso posible. En cuanto al TDT en un metaanálisis de 87 estudios14, las pacientes que iniciaban el tratamiento a los 3–6 meses tras la aparición de los síntomas de cáncer de mama tenían menor supervivencia que las que iniciaban el tratamiento antes de 3 meses.
En este trabajo se analiza la utilidad de introducir, en el protocolo asistencial de las pacientes con sospecha de cáncer de mama, la realización de TC de estadificación a distancia en aquellos casos con criterio de este, desde el servicio de radiodiagnóstico, en acto único y aprovechando el contraste intravenoso que se usa para la realización de la CEM.
Materiales y métodosSe realizó un estudio prospectivo aleatorizado y controlado. Para ello se seleccionaron pacientes mayores de 18 años desde septiembre de 2022 a marzo de 2023, que acudieron al Servicio de Radiología de Mama del Hospital Clínico Universitario Virgen de la Arrixaca (Murcia), por nódulo mamario o axilar a estudio.
El protocolo del estudio se llevó a cabo de conformidad con el Código de Ética de la Asociación Médica Mundial (Declaración de Helsinki) y previa valoración y dictamen favorable por la Comisión de Ética de la Investigación Clínica de la Universidad de Murcia.
Todas las pacientes comenzaron el estudio con una ecografía inicial dirigida realizada por un adjunto de radiodiagnóstico con 12 años de experiencia en radiología de mama. A partir de ahí se clasificaron en 2 grupos: grupo Control (C) y protocolo TEMA (Tomografía Computarizada de Estadificación y MAmografía con contraste intravenoso 2 fases). La asignación al grupo se realizó aleatoria y secuencialmente al inicio del estudio (fueron numeradas, incluyendo a las impares en el grupo protocolo TEMA y a las pares en el grupo C). Se seleccionaron 22 pacientes en cada grupo. Cabe destacar que la ecografía inicial dirigida se realizó a todas las pacientes que acudieron con bultoma a estudio en el periodo estudiado (825 pacientes), mayores de 30 años, que no estaban embarazadas ni eran lactantes o cuya sospecha no fuera la de absceso mamario, seleccionando únicamente las que cumplían criterios de inclusión.
Los criterios de inclusión tras la ecografía inicial incluyeron:
Nódulo de cualquier tamaño con características ecográficas sospechosas de malignidad que asocie adenopatía/adenopatías axilares ipsilaterales, sospechosas de afectación metastásica axilar y/o adenopatía/adenopatías en cadena mamaria interna ipsilateral sospechosas de afectación metastásica.
Nódulo de cualquier tamaño con características ecográficas sospechosas de malignidad que asocie cambios inflamatorios.
Nódulo mayor de 5 cm de diámetro mayor con características ecográficas sospechosas de malignidad, independientemente de los hallazgos axilares o en cadena mamaria interna.
Adenopatía/adenopatías axilares sospechosas de afectación metastásica axilar y/o adenopatía/adenopatías en cadena mamaria interna sospechosas de afectación metastásica en pacientes sin nódulos palpables en mama.
Los criterios de exclusión fueron:
Pacientes varones, alergia al contraste yodado y negativa a la realización de pruebas radiológicas.
Grupo protocolo TEMA: tras la explicación de los procedimientos a las pacientes y firma del consentimiento informado, se procedió a realizar una TC toraco-abdomino-pélvico con contraste intravenoso en 2 fases. A continuación, se realizó una CEM y tomosíntesis con el mismo bolo de contraste (la CEM precisa de un decalaje de 2 minutos para la toma de las primeras imágenes). Se completó el estudio mediante ecografía completa (ecografía mamaria bilateral, regiones axilares, espacios infra y supraclavicular y región mamaria interna) y por último, se tomaron biopsias con aguja gruesa (BAG) de las lesiones sospechosas.
Grupo C: se les realizó una CEM y tomosíntesis, ecografía completa y BAG de lesiones sospechosas.
Se recogieron las siguientes variables:
- •
Grupo protocolo TEMA: tiempo en minutos que requirió el estudio de TC y tiempo completo de estadificación (TC toraco-abdomino-pélvico, CEM, ecografía y toma de biopsias).
- •
Grupo C: número de días entre la biopsia y la realización del TC de estadificación (TDT) y si habían o no recibido algún ciclo de quimioterapia neoadyuvante antes del mismo.
En ambos grupos se recogió la edad, estadificación TNM (clínico), metástasis al diagnóstico, tipo tumoral (ductal, lobulillar) e inmunofenotipo.
Análisis estadísticoSe llevó a cabo utilizando el paquete SPSS Statistics for Windows versión 22.0.
Se realizó un análisis descriptivo de la población a estudio calculando mínimo, máximo, media, desviación típica y rango de las variables cuantitativas. Se incluyó el estudio de la frecuencia absoluta y porcentajes de las variables cualitativas.
Se aplicó la prueba de normalidad a variables cuantitativas (Kolmogorov-Smirnov).
Se usó el estadístico t de Student para comparar las edades entre ambos grupos y la chi cuadrado con la prueba exacta de Fisher (en los casos necesarios) para comparar estadios, tipos de cáncer de mama, inmunofenotipos y existencia o no de metástasis en el TC de estadificación entre grupos.
ResultadosSe analizaron un total de 44 casos que cumplían los criterios de selección, con una edad media de edad de 55,86 ± 13,62 años (29–81).
En el grupo de pacientes del protocolo TEMA, la media de edad fue de 60± 13,6 años (40–81), mientras que en el grupo C, fue de 51,7± 12,6 años (29–75).
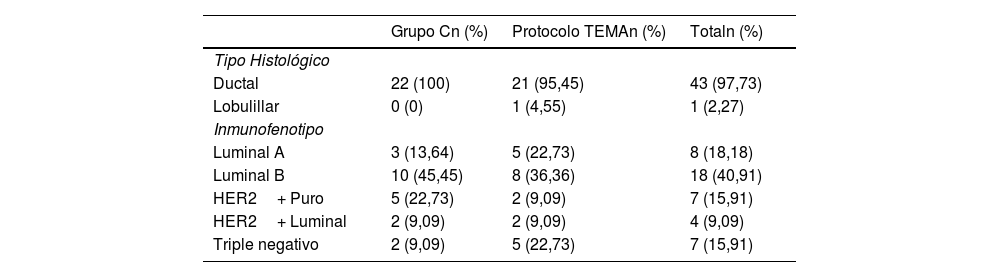
En cuanto a las características anatomopatológicas del tumor, se recogen en la tabla 1.
Características histológicas e inmunofenotipo del cáncer de cada grupo de pacientes y del total de la muestra
| Grupo Cn (%) | Protocolo TEMAn (%) | Totaln (%) | |
|---|---|---|---|
| Tipo Histológico | |||
| Ductal | 22 (100) | 21 (95,45) | 43 (97,73) |
| Lobulillar | 0 (0) | 1 (4,55) | 1 (2,27) |
| Inmunofenotipo | |||
| Luminal A | 3 (13,64) | 5 (22,73) | 8 (18,18) |
| Luminal B | 10 (45,45) | 8 (36,36) | 18 (40,91) |
| HER2+ Puro | 5 (22,73) | 2 (9,09) | 7 (15,91) |
| HER2+ Luminal | 2 (9,09) | 2 (9,09) | 4 (9,09) |
| Triple negativo | 2 (9,09) | 5 (22,73) | 7 (15,91) |
C: Grupo control; TEMA: Tomografía Computarizada de Estadificación y MAmografía.
El TDT en el grupo C, fue de 40,45 ± 17,27 (14–77) días.
El TC de estadificación en el grupo protocolo TEMA se realizó en un intervalo medio de 2,35 ± 0,38 (1,41-4,17) minutos y el estudio completo se realizó en una media de 27,50 ± 13,48 (5,53-56,18) minutos.
De las pacientes del protocolo TEMA, ninguna tuvo que completar estudio con PET-TC (fue suficiente con el TC del estudio). De las pacientes del grupo control, hubo 3 pacientes que fueron consideradas para la realización de PET-TC) y el resto se estadificó con TC.
En cuanto a la presencia de metástasis, en el grupo protocolo TEMA se describieron 7 casos (31,82%), mientras que en el grupo C solo 2 casos (9,09%). De este segundo grupo, un 95,45% (21/22) había iniciado el tratamiento con quimioterapia neoadyuvante cuando se realizó el TC de estadificación.
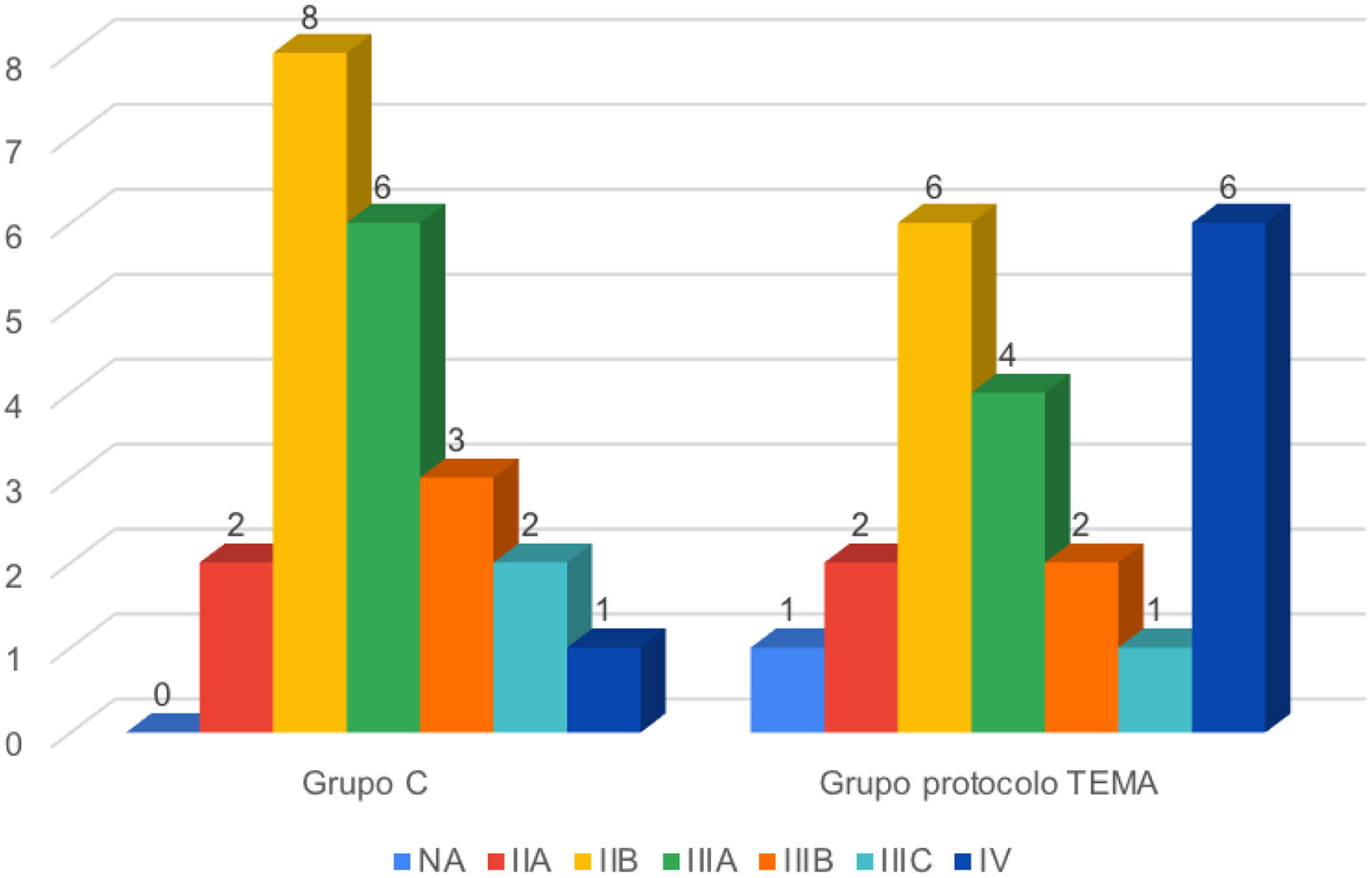
En relación a la estadificación, en la figura 1 se muestran los diferentes estadios de ambos grupos. En el grupo Protocolo TEMA se incluyó a una paciente (5%) que presentó una recaída axilar tras un cáncer de mama previo y que por tanto no aplica esa estadificación (NA).
Las variables cuantitativas siguieron una distribución normal, p = 0,5.
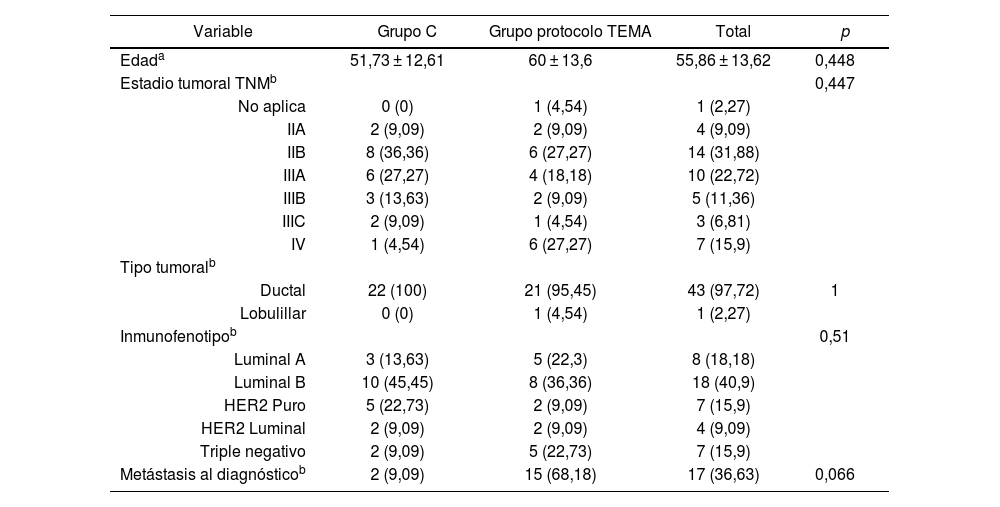
Se aplicó el estadístico t de Student para comparar las edades y el estadístico chi cuadrado con la corrección de la prueba exacta de Fisher, para la comparativa del estadio, tipo tumoral, inmunofenotipo y metástasis al diagnóstico, sin encontrar diferencias significativas entre grupos (tabla 2).
Valores de significación (p) obtenidos
| Variable | Grupo C | Grupo protocolo TEMA | Total | p |
|---|---|---|---|---|
| Edada | 51,73 ± 12,61 | 60 ± 13,6 | 55,86 ± 13,62 | 0,448 |
| Estadio tumoral TNMb | 0,447 | |||
| No aplica | 0 (0) | 1 (4,54) | 1 (2,27) | |
| IIA | 2 (9,09) | 2 (9,09) | 4 (9,09) | |
| IIB | 8 (36,36) | 6 (27,27) | 14 (31,88) | |
| IIIA | 6 (27,27) | 4 (18,18) | 10 (22,72) | |
| IIIB | 3 (13,63) | 2 (9,09) | 5 (11,36) | |
| IIIC | 2 (9,09) | 1 (4,54) | 3 (6,81) | |
| IV | 1 (4,54) | 6 (27,27) | 7 (15,9) | |
| Tipo tumoralb | ||||
| Ductal | 22 (100) | 21 (95,45) | 43 (97,72) | 1 |
| Lobulillar | 0 (0) | 1 (4,54) | 1 (2,27) | |
| Inmunofenotipob | 0,51 | |||
| Luminal A | 3 (13,63) | 5 (22,3) | 8 (18,18) | |
| Luminal B | 10 (45,45) | 8 (36,36) | 18 (40,9) | |
| HER2 Puro | 5 (22,73) | 2 (9,09) | 7 (15,9) | |
| HER2 Luminal | 2 (9,09) | 2 (9,09) | 4 (9,09) | |
| Triple negativo | 2 (9,09) | 5 (22,73) | 7 (15,9) | |
| Metástasis al diagnósticob | 2 (9,09) | 15 (68,18) | 17 (36,63) | 0,066 |
TEMA: Tomografía Computarizada de Estadificación y MAmografía; TNM: tumores, ganglios y metástasis.
El cáncer de mama es el tumor más frecuente en la mujer1 y el más prevalente del mundo según la OMS. Supone la primera causa de muerte por cáncer en España en mujeres, por lo que representa un importante desafío para la salud1,2. Un retraso en el diagnóstico y estadificación y, por ende, en su tratamiento, supone una disminución de la supervivencia2,5 y es por ello por lo que los esfuerzos deben ir orientados, al diagnóstico precoz, mediante los programas de cribado1,2 y a la correcta y pronta estadificación en el circuito del diagnóstico.
Los métodos actuales de diagnóstico en el cribado se basan en la mamografía (única prueba de imagen que ha demostrado ser eficaz para ello)1,2. En el contexto del diagnóstico, es decir, cuando existe sintomatología mamaria, las técnicas de imagen se amplían disponiendo de herramientas más precisas como la CEM y la tomosíntesis, que aumentan la sensibilidad y la especificidad de la mamografía9,10. Esto permite detectar lesiones pequeñas y lesiones adicionales que hubieran pasado desapercibidas. La sensibilidad y especificidad de la CEM está muy cerca de alcanzar a la RM, siendo más barata, rápida, mejor tolerada y teniendo mayor disponibilidad (constituyendo una alternativa en pacientes no candidatas a RM). Esto hace que pacientes con alta sospecha de cáncer de mama se beneficien de la CEM.
Por otro lado, en cuanto a la estadificación del cáncer de mama, no todas las pacientes se benefician de la realización de pruebas para la detección de metástasis, ya que, en diagnósticos precoces, es poco probable que existan4 y prima un correcto y rápido tratamiento, fundamentalmente quirúrgico.
En el trabajo realizado, se expone un estudio que incorpora un TC de estadificación para el estudio de extensión, previa clasificación de las pacientes mediante ecografía dirigida inicial. Esta ecografía inicial, en manos de expertos en mama permite: clasificar a pacientes que se beneficien de estadificación a distancia (protocolo TEMA), aprovechar recursos (un solo contraste para 2 pruebas diferentes que lo precisan) y dar al clínico la información necesaria para un correcto tratamiento, sin precisar la realización de PET-TC en estas pacientes.
Teniendo en cuenta los resultados de este trabajo, el TDT fue de 40,45 ± 17,27 (14–77) días en el grupo C, que representaría la manera habitual de realización de la estadificación del cáncer de mama en nuestro hospital. Además, 21 de las 22 pacientes, recibió al menos un ciclo de quimioterapia neoadyuvante en el momento de la adquisición de imágenes, lo que podría modificar sus resultados (infradiagnóstico). Esto indica que el tratamiento sistémico primario, si es necesario, no se retrasa por la espera de la estadificación a distancia, remarcando la importancia de minimizar dicha demora. No obstante, cabe destacar que el número de pacientes con metástasis en la estadificación con TC fue menor en grupo C (n = 2) frente al grupo protocolo TEMA (n = 7), aunque sin diferencias significativas (p = 0,066). Lo relevante es el cambio en el pronóstico y en la actitud terapéutica que se llevó a cabo en las 2 pacientes en las que se detectó metástasis en el grupo C (SBRT sobre una metástasis hepática en una de ellas y RT en pelvis sobre una metástasis ósea en la otra, además de quimioterapia adyuvante en ambas), mientras que todas las pacientes del grupo protocolo TEMA mantuvieron el tratamiento y pronóstico inicial.
En esta línea, las pacientes incluidas en el protocolo TEMA tendrían un estudio a distancia inmediato y preciso, en menos de una hora (media de 27,50 minutos). Este protocolo es similar al propuesto en el Hospital General Universitario de Ciudad Real13, en el que se propuso una Vía de Alta Resolución para la realización de pruebas radiológicas en la estadificación inicial, ante el diagnóstico endoscópico de neoplasias de tracto digestivo.
Con este nuevo manejo se eliminaría el TDT, creando un protocolo en acto único. En la literatura existen pocos trabajos que consideren el TDT, no obstante, las pacientes con demora en el inicio del tratamiento del cáncer de mama presentan menor supervivencia según algunos autores14. Además, un acortamiento en los tiempos de diagnóstico se asocia a beneficios relacionados con la ansiedad y calidad de vida11.
En cuanto a las limitaciones del estudio, además de la poca casuística recogida, es importante destacar que pueden existir falsos positivos en la ecografía inicial. En nuestro estudio no hubo falsos positivos en los nódulos mamarios, pero hubo 3 falsos positivos en los ganglios axilares, ya que existe enfermedad axilar benigna que puede coexistir con un cáncer de mama ipsilateral. Los 3 falsos positivos correspondieron con adenopatías con cambios reactivos (n = 2) y sarcoidosis ganglionar (n = 1). Ninguna de estas pacientes tuvo metástasis a distancia en el estudio de extensión. Las 2 pacientes con adenopatías reactivas tuvieron una estadificación cT2N0M0 e inmunofenotipo agresivo (triple negativo) y la paciente con sarcoidosis ganglionar tuvo una estadificación cT4bN0M0. Esto significa que, aunque fueron casos de falsos positivos en ecografía axilar, las 3 hubieran sido candidatas a estadificación a distancia, por lo que no hubo sobrediagnóstico. Otras limitaciones recaen sobre temas logísticos, ya que es necesario que el aparato de TC esté muy cerca del mamógrafo para que se pueda realizar la CEM a tiempo (se dispone de 8 minutos para su realización). Por último, en este estudio no se ha valorado la ansiedad de las pacientes ni otros ítems fuera del diagnóstico.
Como conclusiones y en consonancia con nuestros resultados, la ecografía dirigida inicial permite identificar pacientes que se benefician de una estadificación locorregional y a distancia, mediante la introducción del protocolo TEMA. Este permite la estadificación completa inmediata (eliminando el TDT), de forma precisa (sin modificaciones por la quimioterapia) y en acto único.
Responsabilidades éticasEl presente proyecto de investigación fue aprobado por el Comité de Ética de la Comisión de Ética de Investigación Clínica de la Universidad de Murcia.
Consentimiento informadoLos autores declaran que han obtenido el consentimiento de los pacientes tanto para los procedimientos asistenciales como para su participación en el estudio.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesNinguno de los autores presenta conflicto de intereses ni de orden económico, profesional, laboral ni personal; Antonio Piñero Madrona es Editor de la Revista de Senología.