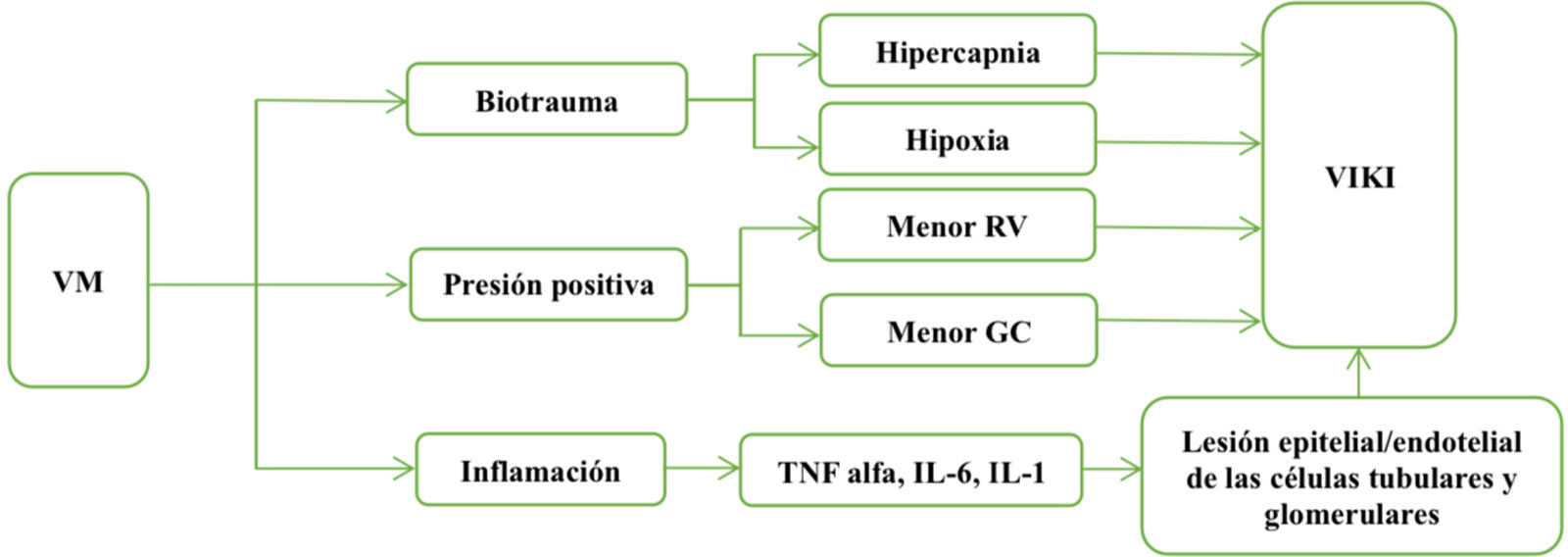
En pacientes críticamente enfermos que cursan con lesión renal inducida por el pulmón o lesión renal inducida por el ventilador se describen varios factores que pueden contribuir a su desarrollo. La respuesta inflamatoria generada desde un pulmón lesionado con hipoxemia e hipercapnia produciendo cambios hemodinámicos a nivel renal con la posterior caída del filtrado glomerular. Durante la ventilación mecánica los fenómenos anteriores se suelen magnificar, la presión positiva intratorácica y la presión intraabdominal generadas por la ventilación mecánica pueden afectar la hemodinamia renal, y así reducir el flujo sanguíneo y la filtración glomerular. Además, de una mayor respuesta inflamatoria desencadenada por la ventilación mecánica, con niveles elevados de citoquinas proinflamatorias, influye en la lesión renal aguda (LRA). Entre los parámetros ventilatorios, los estudios sugieren que el aumento de la presión positiva al final de la espiración (PEEP) y del volumen corriente (Vc) y una reducción de la distensibilidad del sistema respiratorio se relacionan con el desarrollo de lesión renal inducida por el ventilador, aunque hay discrepancias en algunos hallazgos. Como resultado de lo anterior, se han generado pautas de manejo para la interacción pulmón-riñón en pacientes críticos con lesión renal inducida por el ventilador, como son el cumplimiento de las pautas KDIGO; manejo conservador de líquidos, monitoreo de variables clínicas como la creatinina sérica, el gasto urinario, monitoreo ventilatorio con el objetivo de una ventilación protectora, y tratar las complicaciones como hipotensión, congestión venosa, insuficiencia cardiaca derecha e hipertensión intraabdominal, ya que pueden contribuir a una mayor disfunción renal. La importancia de comprender y abordar la interacción entre los pulmones y los riñones en pacientes críticamente enfermos puede mejorar los resultados clínicos.
In critically ill patients with lung-induced kidney injury or ventilator-induced kidney injury, several factors are described that may contribute to their development. The inflammatory response generated from an injured lung with hypoxemia and hypercapnia producing hemodynamic changes at the renal level with the subsequent drop in glomerular filtration. During mechanical ventilation the above phenomena are usually magnified, the positive intrathoracic pressure and intra-abdominal pressure generated by mechanical ventilation can affect renal hemodynamics, and thus reduce blood flow and glomerular filtration. In addition, a greater inflammatory response triggered by mechanical ventilation, with elevated levels of proinflammatory cytokines, influences acute kidney injury (AKI). Among ventilatory parameters, studies suggest that increases in positive end-expiratory pressure (PEEP) and tidal volume (Vc) and a reduction in compliance of the respiratory system are related to the development of ventilator-induced kidney injury, although there are discrepancies in some findings. As a result of the above, management guidelines have been generated for lung-kidney interaction in critically ill patients with ventilator-induced kidney injury, such as compliance with the KDIGO guidelines; conservative fluid management, monitoring of clinical variables such as serum creatinine, urinary output, ventilatory monitoring with the aim of protective ventilation, and treating complications such as hypotension, venous congestion, right heart failure and intra-abdominal hypertension, as they may contribute to greater kidney dysfunction. The importance of understanding and addressing the interaction between the lungs and kidneys in critically ill patients may improve clinical outcomes.
Artículo
Socios de la Asociación de Medicina Crítica y Cuidado Intensivo
Para acceder a la revista
Es necesario que lo haga desde la zona privada de la web de la AMCI, clique aquí