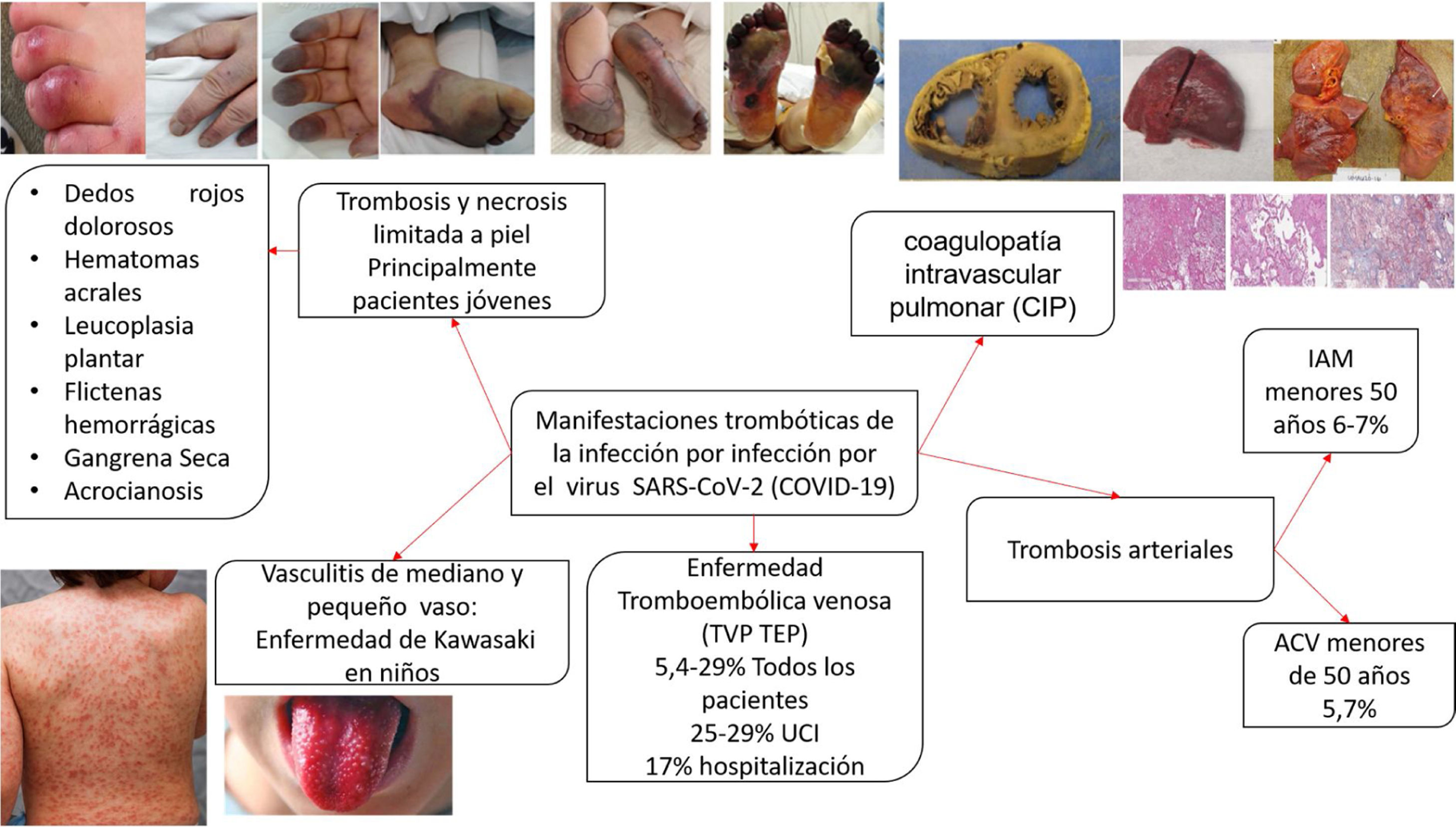
La presencia de coagulopatía en pacientes con infección por COVID-19 se asocia con un mayor riesgo de muerte. Además, la relevancia de dichas anomalías de la coagulación se ha convertido en un factor determinante en el desenlace de los pacientes más enfermos, a medida que una proporción sustancial de pacientes con manifestaciones clínicas graves desarrollan complicaciones tromboembólicas venosas y arteriales, muchas veces no diagnosticadas sino hasta hallazgos post mortem. La evidencia disponible derivada de observaciones clínicas y series de autopsias distingue la coagulopatía asociada a COVID-19 de la microangiopatía trombótica y la coagulación intravascular diseminada (CID) (coagulopatía inducida por sepsis). Se pueden observar posibles superposiciones en pacientes críticos en los que el colapso circulatorio, la falla orgánica multisistémica, la hipoxemia refractaria y el síndrome de dificultad respiratoria aguda causan una combinación de CID de bajo grado y microangiopatía trombótica pulmonar localizada, que podría tener un impacto sustancial en la disfunción orgánica en los pacientes más gravemente afectados.
The presence of coagulopathy in patients with COVID-19 infection is associated with an increased risk of death. Furthermore, the relevance of these coagulation abnormalities has become a determining factor in the outcome of the sickest patients, as a substantial proportion of patients with severe clinical manifestations develop venous and arterial thromboembolic complications. These are often undiagnosed until post-mortem findings. Available evidence arising from clinical observations and autopsy reports distinguishes COVID-19-associated coagulopathy from thrombotic microangiopathy (TMA) and disseminated intravascular coagulation (DIC). Possible overlaps can be observed in critically ill patients, in whom circulatory collapse, multisystem organ failure, refractory hypoxaemia, and ARDS cause a combination of low-grade DIC and localised thrombotic pulmonary microangiopathy. These could have a substantial impact on organ dysfunction, in the most severely affected patients.
Un síndrome adquirido conocido como coagulopatía asociada a la infección por el virus SARS-CoV-2 (enfermedad por coronavirus 2019 [COVID-19]) ha surgido y demostrado ser frecuente, multifactorial, con afectación de los sistemas venoso, arterial y microcirculatorio, siendo distinto del que se presenta en otras infecciones. La información disponible hasta el momento distingue la coagulopatía asociada a COVID-19 de la coagulación intravascular diseminada (CID) y la microangiopatía trombótica (MAT) en sus etapas iniciales y, aunque la terapia anticoagulante para la tromboprofilaxis ha sido recomendada por todas las sociedades importantes en los campos de la cardiología, la hematología y la trombosis, el tratamiento óptimo aún no se ha establecido con claridad, ya que no se cuenta con información derivada de ensayos clínicos rigurosos dada la novedad de la infección y existe aún un gran campo de incertidumbre.
Los pacientes con infección por COVID-19 presentan un amplio espectro de expresiones fenotípicas, que involucran la mayoría de los órganos y sistemas. Las anomalías que se presentan en la coagulación durante esta nueva infección viral, pueden imitar otras coagulopatías sistémicas asociadas con infecciones graves, como son: 1) la CID asociada a sepsis (coagulopatía inducida por sepsis [CIS]), y 2) la MAT; sin embargo, tienen características únicas que la diferencian y le dan un carácter único1.
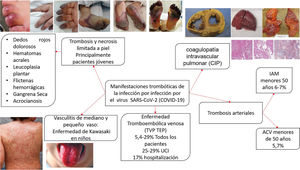
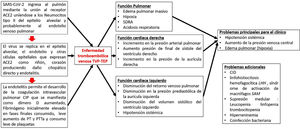
La presencia de coagulopatía en pacientes con infección por COVID-19 se asocia con un mayor riesgo de muerte. Además, la relevancia de dichas anomalías de la coagulación se está volviendo cada vez más clara, a medida que una proporción sustancial de pacientes con manifestaciones clínicas graves desarrollan complicaciones tromboembólicas venosas y arteriales, muchas veces no diagnosticadas sino hasta hallazgos post mortem1,2 (fig. 1).
Los hallazgos más típicos en pacientes con infección por COVID-19 severa y coagulopatía son: 1) aumento constante de la concentración de dímero-D; 2) disminución relativamente modesta en el recuento de plaquetas, y 3) prolongación leve de los tiempos de coagulación: tiempo de protrombina (PT) (se debe aclarar que estos cambios sutiles pueden pasar desapercibidos cuando se expresa como relación internacional normalizada [INR]) y tiempo parcial de tromboplastina activado (PTTa)1,2.
En resumen, la evidencia disponible derivada de observaciones clínicas y series de autopsias distingue la coagulopatía asociada a COVID-19 de la MAT y de la CIS. Se pueden observar posibles superposiciones en pacientes críticos en los que el colapso circulatorio, la falla orgánica multisistémica, la hipoxemia refractaria y el síndrome de dificultad respiratoria aguda (SDRA) causan una combinación de CID de bajo grado y microangiopatía trombótica pulmonar localizada, que podría tener un impacto sustancial en la disfunción orgánica en los pacientes más gravemente afectados1–3.
MétodologíaDiseño: revisión narrativa.
Fuentes de datos: Medline, Scopus, Pubmed.
Terminos de búsqueda: «COVID-19», «SARS», «SARS-CoV-2», «pulmonary thrombosis», «embolism», «acute respiratory distress syndrome», «coronavirus», «coagulopathy», «thrombus» y «anticoagulants».
Selección de estudios y extracción de datos: los artículos se eligieron en función de su relevancia respecto a los mecanismos de coagulopatía y trombosis en COVID-19, diagnóstico y terapia anticoagulante, publicados entre diciembre del 2019 y junio del 2020. Se revisaron las listas de referencias para identificar artículos relevantes adicionales.
FisiopatologíaRespuesta inmunológicaEl 3 de enero del 2020, científicos del Instituto Nacional de Control y Prevención de Enfermedades Virales identificaron el primer genoma completo del nuevo coronavirus del género β (2019-nCoVs) en muestras de líquido de lavado broncoalveolar de un paciente de Wuhan7. El estudio filogenético demostró que el genoma del SARS-CoV-2 es aproximadamente un 96% idéntico al del coronavirus de murciélago Bat CoV RaTG13, sin embargo, es lo suficientemente divergente de SARS-CoV-1 (aproximadamente un 79%) y MERS-CoV (aproximadamente un 50%) como para considerarse un nuevo betacoronavirus humano8.
El SARS-CoV-2 es un virus ARN monocatenario de sentido positivo que usa la glucoproteína espiga (proteína S) en la superficie del virión para mediar el reconocimiento del receptor de la enzima conversora de angiotensina 2 (ECA2) y la fusión de la membrana. La proteína S se divide en 2subunidades, S1 y S2, por una proteasa extracelular. Mientras S1 se une a ECA2, S2 se escinde aún más y es activada por la TMPRSS2 (proteasa transmembrana de serina 2 asociada a la superficie del huésped), dando como resultado la fusión de la membrana viral con la membrana de la célula del huésped y la liberación de su genoma en el citoplasma de la célula huésped, utilizando la maquinaria del huésped para la traducción de las poliproteínas y las proteasas virales esenciales. Finalmente, los viriones maduros de SARS-CoV-2 se exocitan y se liberan de la célula huésped al ambiente para repetir el ciclo de infección9.
La proteína S del virus, al igual que en el caso del virus SARS-CoV-1, comparte una alta afinidad por el mismo receptor de la célula huésped, la ECA2, la cual se encuentra principalmente localizada en los neumocitos tipo ii, así como en el corazón, el riñón y, en general, el endotelio vascular; esta afinidad ha demostrado ser 10 a 20 veces mayor en la infección por SARS-CoV-2 en comparación con la afinidad vista con el virus SARS-CoV-11,9.
LA ECA2 tiene un papel en la regulación de la inmunidad innata que cuando tiene regulación a la baja, como en el caso de la infección por COVID-19, podría incrementar el riesgo de inmunotrombosis en los humanos. La ECA2 tiene un papel contrarregulador importante en el sistema renina angiotensina aldosterona. A pesar de su parecido estructural con la ECA1, sus sitios activos son distintos y no hay datos concluyentes de que sus niveles aumenten en pacientes que son tratados con IECA o ARA-II1,8.
Recientemente, se ha demostrado con estudios clínicos que la patogénesis de la COVID-19 está asociada con la coagulopatía; sin embargo, difiere de la CISD asociada con sepsis, con niveles relativamente normales de PT, fibrinógeno y plaquetas, a pesar de niveles de dímero-D marcadamente elevado1,10.
Los modelos inmunológicos de infección por SARS-CoV-2 proponen 3etapas fundamentales que explican la historia natural de la enfermedad por COVID-19. En la primera etapa, la activación temprana del sistema inmunitario a través de la inducción de una potente respuesta de interferón es importante para controlar el virus. En la segunda etapa, una respuesta retardada de interferón puede conducir a un daño progresivo del tejido. Y en la tercera etapa se genera un estado hiperinflamatorio caracterizado por la excesiva activación del sistema inmunitario y de la coagulación, posiblemente seguida de una disregulación de los mecanismos de reparación de tejidos y fibrosis11. En la infección por SARS-CoV-2, la replicación activa en las células epiteliales de las vías respiratorias (alvéolos y endotelio), así como la liberación de virus, hace que la célula huésped sufrapiroptosis12, una forma altamente inflamatoria de muerte celular programada, que promueve la liberación de patrones moleculares asociados a patógenos (PAMP), como el ARN viral y los patrones moleculares asociados a daños (DAMP), incluidos ATP, ADN y oligómeros de ASC, los cuales son detectados por células epiteliales alveolares y macrófagos a través de receptores de reconocimiento de patrones (PRR), generando citocinas y quimiocinas proinflamatorias, IL-6, IFN-γ, MCP1 e IP-10, como reflejo de una respuesta de células T helper 1 (Th1), las cuales estimulan el reclutamiento pulmonar de macrófagos y monocitos, e infiltración de linfocitos T en las vías respiratorias, excepto de neutrófilos, lo cual puede explicar la linfopenia y el aumento de la relación neutrófilos-linfocitos observados en alrededor del 80% de los pacientes con infección por SARS-CoV-213. En la mayoría de los casos, este proceso es capaz de resolver la infección. Sin embargo, en algunos casos, se produce una respuesta inmunitaria disfuncional, que genera hiperreactividad inmunológica asociada a síndrome de activación de macrófagos, también llamada «tormenta de citocinas» o linfohistiocitosis hemofagocítica secundaria (sHLH), lo que causa una grave enfermedad pulmonar e incluso sistémica14.
El STC es una complicación grave y potencialmente mortal que puede llegar a aparecer en la infección por SARS-CoV-2 severa. Tras la fase inicial de infección precoz y la fase pulmonar, algunos pacientes presentan una respuesta hiperinflamatoria, con activación del macrófago, mediada fundamentalmente a través de las IL-1 y 6. La elevación de la proteína C reactiva (PCR) y de la ferritina son 2 datos característicos y claves para su diagnóstico. A diferencia del síndrome hemofagocítico, que tiene unos criterios diagnósticos y un sistema de puntuación para estimar la probabilidad de presentarlo llamado HScore, no existen unos criterios bien establecidos para la definición del STC15.
El tratamiento fundamentalmente empleado en el SCT es el tocilizumab, un anti-IL-6. El empleo de glucocorticoides, aunque controvertido, cada vez es más utilizado por su similitud con otras enfermedades en las que existe también una tormenta de citocinas, como son el síndrome de activación macrofágica y el síndrome hemofagocítico14.
Patogénisis de la coagulopatíaDe manera reciente, estudios clínicos han mostrado que la patogénesis de COVID-19 se encuentra relacionada con el desarrollo de un tipo específico de coagulopatía que difiere de la CIS asociada con sepsis, con niveles relativamente normales de PT, fibrinógeno y plaquetas, a pesar de niveles de dímero-D marcadamente elevados2.
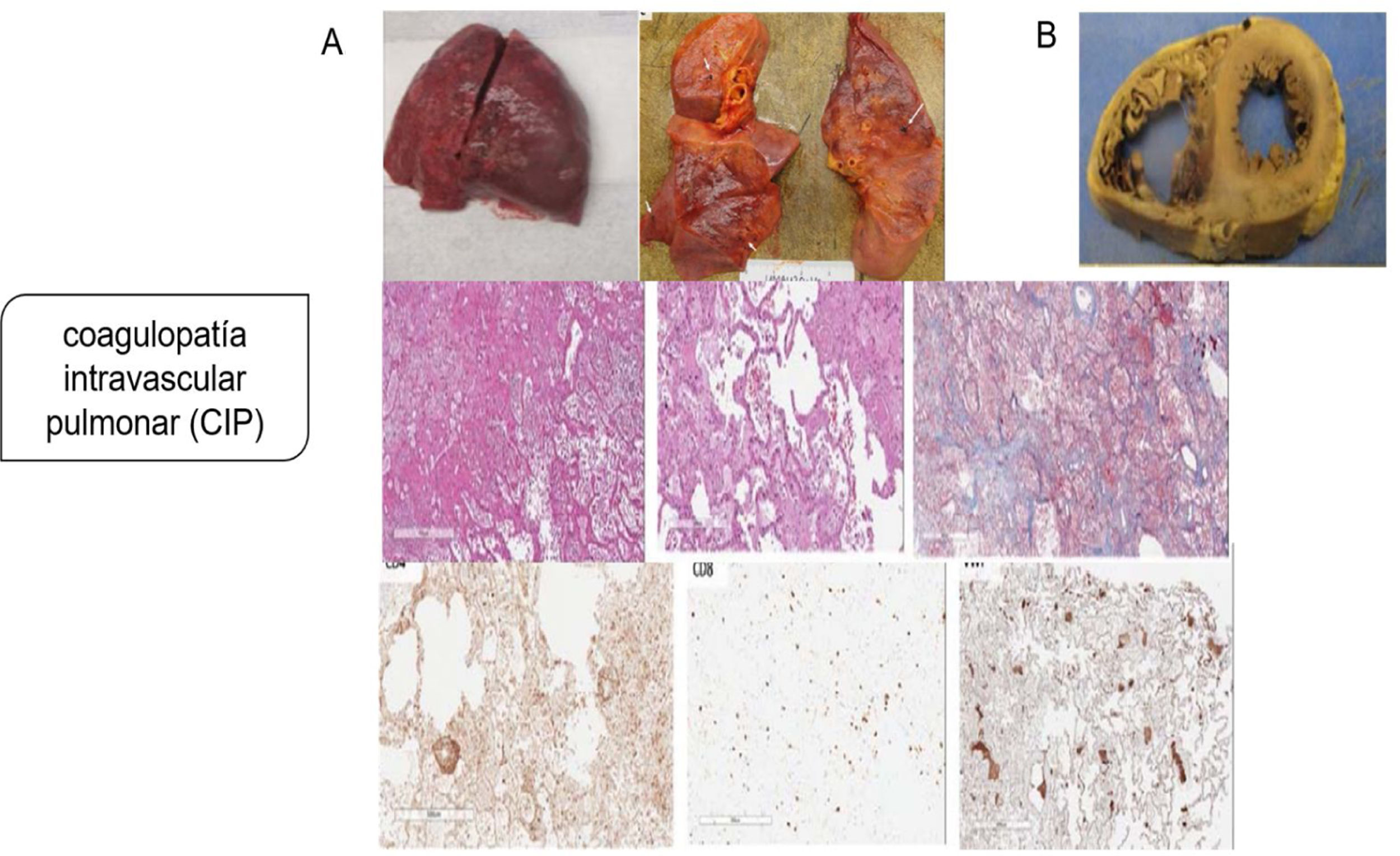
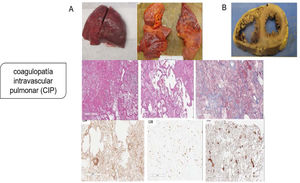
Aunque la patogenia primaria se pensó como una lesión pulmonar por neumocitos tipo ii, con una consecuente neumonía viral que progresaba a SDRA o síndrome de activación de macrófagos que complica el SDRA que conduce a la CID, la evidencia patológica de la serie de autopsias muestra que el mecanismo patogénico principal es la coagulopatía intravascular pulmonar (CIP), como fue nombrado por primera vez por McGonagle et al.11, que es un tipo de trombosis inmune que es distinta de la CID clásica. Los hallazgos patológicos indican que los pulmones son edematosos con hemorragia irregular y macroscópicamente con daño alveolar difuso y trombos de fibrina extensos en los pequeños vasos y capilares distendidos (fig. 2). La presentación de numerosos megacariocitos teñidos con CD61 y el factor von Willebrand (FVW) respalda aún más la hipótesis de la coagulación local es el factor principal de todo el proceso.
Coagulopatía intravascular pulmonar (CIP) en la infección por SARS-CoV-2. A) Pulmones macroscópicamente: edematosos con hemorragia irregular, con daño alveolar difuso y trombos de fibrina extensos en pequeños vasos y capilares distendidos; microscópicamente: membranas hialinas y hemorragia con trombos de fibrina presentes dentro de vasos y capilares dilatados con depósitos de fibrina extracelular extensa; agregaciones perivasculares de linfocitos, que fueron positivas para CD4 mayoritariamente y escasamente para CD8; presentación de numerosos megacariocitos teñidos con CD61 y el factor von Willebrand respalda aún más la hipótesis de la coagulación local es el factor principal de todo el proceso. B) Los hallazgos patológicos graves del corazón mostraron dilatación ventricular derecha extrema y esfuerzo del tabique interventricular como evidencia de insuficiencia cardíaca derecha causada por hipertensión pulmonar.
Tomado de Fox et al.6.
Los hallazgos patológicos graves del corazón en el mismo estudio mostraron dilatación ventricular derecha extrema y esfuerzo del tabique interventricular como evidencia de insuficiencia cardíaca derecha causada por hipertensión pulmonar4,16.
Como la CIP es el primer paso de la enfermedad, los pacientes no responden a las modalidades clásicas de tratamiento dirigidas al edema pulmonar, SDRA y MAT con tormenta de citocinas. La tormenta de citocinas se interpreta como síndrome de fuga capilar y modalidades de tratamiento como inmunoglobulina humana IGG intravenosa, esteroides, anti-IL-6 y el intercambio de plasma generalmente no logran manejar el cuadro clínico4.
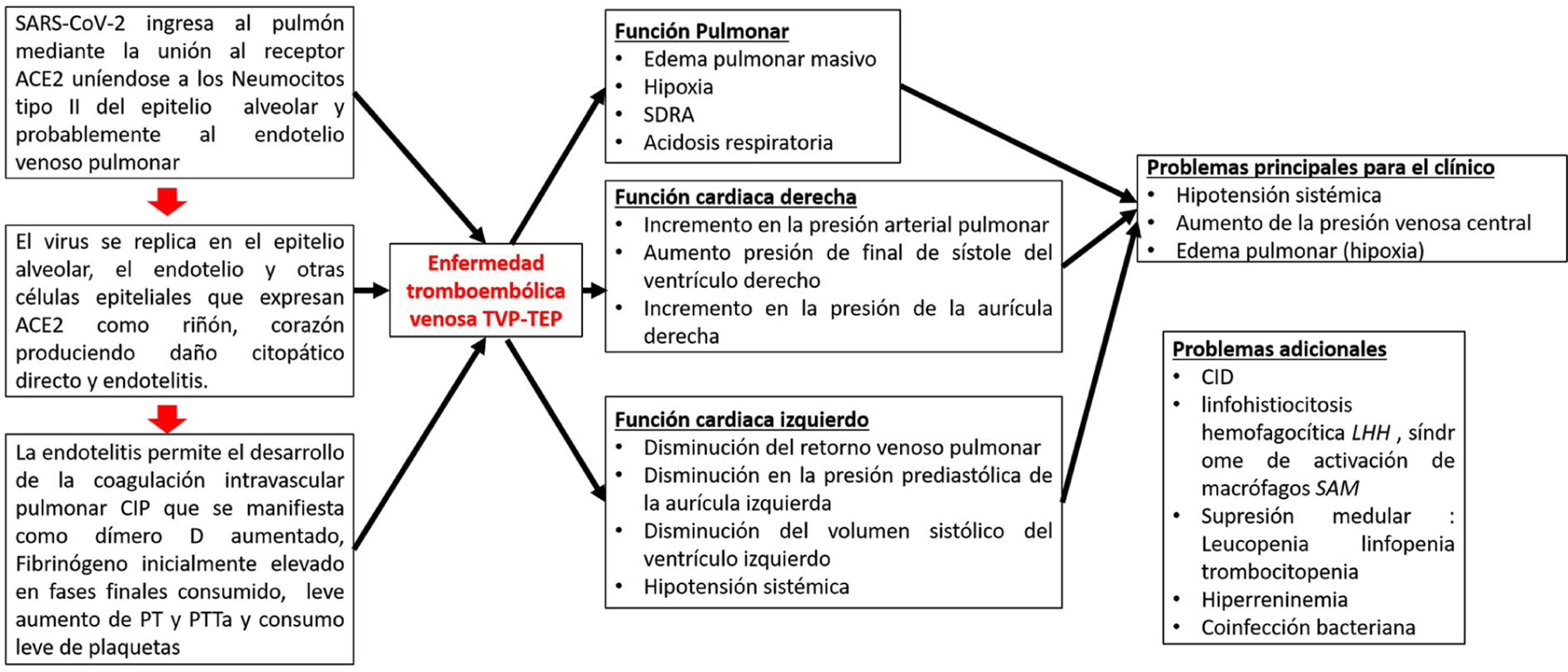
El SARS-CoV-2 se une a los receptores ACE2 en los neumocitos tipo ii y posiblemente en las células endoteliales vasculares, y provoca la lisis de las células que conduce inmediatamente a la activación directa del endotelio, lo que provoca la actividad procoagulante y activa la acumulación de depósitos de fibrina en los vasos venosos microcapilares pulmonares. El mecanismo posible es que los estímulos circulatorios proinflamatorios, como los PAMP virales, los DAMP y las citocinas desencadenan la activación de los monocitos sanguíneos que, aunado al daño endotelial inducido por el virus, activan la expresión en la membrana del factor tisular y la vía extrínseca de la coagulación, lo que conduce al depósito de fibrina y la coagulación sanguínea17. Los neutrófilos son reclutados por las células endoteliales activadas y liberan trampas extracelulares de neutrófilos, que activan la vía de intrínseca de la coagulación y las plaquetas para amplificar la señal procoagulante. Las principales vías anticoagulantes endógenas, que incluyen el inhibidor de la vía del factor tisular, la antitrombina y la PCR, se reducen aún más, promoviendo la actividad procoagulante18. Los depósitos de fibrina causan un mecanismo compensatorio de aumento de plasminógeno al principio, pero a medida que avanza la enfermedad no se descomponen los depósitos de fibrina reflejados en niveles aumentados de dímero-D. La estrategia de tratamiento biológicamente plausible podría estar dirigida a la disminución y control del estado hipercoagulable con anticoagulantes tipo heparina de bajo peso molecular (HBPM), bloquear la generación de trombina y misminuir la respuesta inflamatoria19 (fig. 3).
Patogénesis de la infección por COVID-19.
Adaptado de Belen-Apak y Sarıalioğlu4.
El SARS-CoV-2 severo también se asocia con mayores concentraciones de citocinas proinflamatorias, como el factor de necrosis tumoral α (TNF-α) y las IL, incluidas IL-1 e IL-6. La IL-6 puede inducir la expresión del factor tisular en las células mononucleares, lo que posteriormente inicia la activación de la coagulación y la generación de trombina. El TNF-α y la IL-1 son los principales mediadores que impulsan la supresión de las vías anticoagulantes endógenas; Sin embargo, los niveles de citocinas proinflamatorias en los pacientes con infección por COVID-19 no alcanzan los valores tan altos observados en la tormenta de citocinas clásica asociada a sepsis. En resumen, la COVID-19 está asociada con una elevación leve de citocinas inflamatorias y demuestra una fisiología e inmunología que son difíciles de conciliar con el SDRA o síndromes de liberación de citocinas. Por lo tanto, parece probable un mecanismo alternativo de enfermedad4.
Las infecciones por coronavirus también están asociadas con una activación notable del sistema fibrinolítico. Las observaciones en ratones knock-out activadores de plasminógeno de tipo urocinasa apuntaron a una vía impulsada por urocinasa que estimula la fibrinólisis y que es un factor importante en la letalidad. Además, las concentraciones plasmáticas de activador de plasminógeno de tipo tisular fueron 6 veces mayores en pacientes infectados con coronavirus 1 del síndrome respiratorio agudo severo humano (SARS-CoV-1) que en pacientes sin infección. La lesión de las células endoteliales inducida por la inflamación podría provocar la liberación masiva de activadores de plasminógeno, lo que podría explicar las altas concentraciones de dímero-D y productos de degradación de la fibrina en pacientes con COVID-19 grave1.
La MAT suele estar causada por una interacción patológica de la pared de los vasos plaquetarios debido a los multímeros del FVW ultragrandes. Estos multímeros se liberan de las células endoteliales perturbadas y en circunstancias normales se escinden por ADAMTS13 (una desintegrina y metaloproteasa con repeticiones de trombospondina tipo 1). En muchos estados inflamatorios graves, tras una infección sistémica se ha establecido una deficiencia secundaria de ADAMTS13. Actualmente, no hay datos sobre las concentraciones de ADAMTS13 en pacientes con infección grave por COVID-191.
La inmovilización y la estasis venosa son otros factores que pueden aumentar el riesgo de trombosis.
Inflamación y endotelioLas complicaciones cardiovasculares están emergiendo rápidamente como una amenaza clave en la COVID-19, además de la enfermedad respiratoria. Una constelación de afectación de órganos multisistémicos, inflamación de bajo grado, linfopenia, hipercoagulabilidad y disfunción microvascular heterogénea es una descripción clásica de muchas vasculopatías sistémicas, como las vasculitis. Se ha encontrado evidencia de infección viral directa de la célula endotelial e inflamación endotelial difusa. Aunque el virus utiliza el receptor ACE2 expresado por los neumocitos en el revestimiento alveolar epitelial para infectar al huésped, causando lesiones pulmonares, el receptor ACE2 también se expresa ampliamente en las células endoteliales20. El reclutamiento de células inmunes, ya sea por infección viral directa del endotelio o mediada por el sistema inmunitario, puede provocar una disfunción endotelial generalizada asociada con la apoptosis. El endotelio vascular es un órgano paracrino, endocrino y autocrino activo que es indispensable para la regulación del tono vascular y el mantenimiento de la homeostasis vascular. La disfunción endotelial es un determinante principal de la disfunción microvascular al cambiar el equilibrio vascular hacia una mayor vasoconstricción con isquemia orgánica posterior, inflamación con edema tisular asociado y un estado procoagulante.
La infección por SARS-CoV-2 facilita la inducción de endoteliitis en varios órganos como consecuencia directa del compromiso viral (como se observa con la presencia de cuerpos virales) y de la respuesta inflamatoria del huésped. Además, la inducción de apoptosis y piroptosis podría tener un papel importante en la lesión de células endoteliales en pacientes con COVID-1921. La endoteliitis por COVID-19 podría explicar la función microcirculatoria sistémica en diferentes lechos vasculares y sus secuelas clínicas en pacientes con COVID-19. Esta hipótesis proporciona una justificación para que las terapias estabilicen el endotelio mientras abordan la replicación viral. Esta estrategia podría ser particularmente relevante para pacientes vulnerables con disfunción endotelial preexistente, que se asocia con sexo masculino, tabaquismo, hipertensión, diabetes, obesidad y enfermedad cardiovascular establecida, todo lo cual se asocia con resultados adversos en COVID-19 por razones desconocidas20,21.
La plasmina (plasminógeno) elevada es una característica común en personas con afecciones médicas subyacentes y los hacen susceptibles a la infección por SARS-CoV-2. La plasmina y otras proteasas pueden escindir la proteína S del SARS-CoV-2 extracelularmente, aumentando su capacidad de unirse a los receptores de la ACE2 de las células huésped y probablemente facilitando la entrada y la fusión del virus. La plasmina descompone proteolíticamente el exceso de fibrina para elevar el dímero-D y otros productos de degradación de fibrina, tanto en el líquido de lavado broncoalveolar como en el plasma, lo que disminuye las plaquetas y provoca hemorragia. La plasmina también escinde las subunidades del canal de sodio epitelial (ENaC), ubicadas en las membranas apicales de las células epiteliales en las vías respiratorias, los pulmones y los riñones. Esto aumenta la capacidad de los iones Na+ para ingresar a las células epiteliales, lo que resulta en hipertensión y deshidratación del líquido que recubre las vías respiratorias pulmonares y las células alveolares. La hiperfibrinólisis asociada con la plasmina conduce a un dímero-D elevado en pacientes graves20.
El dímero-D y la endoteliitis a viral son factores de riesgo independientes de la gravedad y mortalidad de la enfermedad. La carga viral en los picos de las vías respiratorias en días 5-6 después de la aparición de los síntomas y el ARN viral se puede encontrar en muestras de heces y de esputo, lavado broncoalveolar de fluido y células epiteliales pulmonares. Los pacientes mayores de 65 años generalmente tienen una mayor carga viral que dura hasta 14 días y pueden desarrollar una lesión pulmonar aguda grave, que requiere hospitalización en la Unidad de Cuidados Intensivos con un mal resultado19.
En resumen, la plasmina elevada en pacientes con afecciones preexistentes puede ser un mecanismo que contribuye a una mayor susceptibilidad a la infección por SARS-CoV-2, ya que aumenta su virulencia, infectividad y mortalidad.
DiagnósticoLa hipercoagulabilidad es de hecho un problema importante en pacientes con infección por COVID-19 y el sistema hemostático se desplaza notablemente hacia el lado procoagulante en estos pacientes. El patrón más común de coagulopatía observado en pacientes hospitalizados con COVID-19 se caracteriza por elevaciones en los niveles de fibrinógeno y dímero-D, lo cual está correlacionado con un aumento de biomarcadores de inflamación, como la PCR y la ferritina.
A diferencia del patrón observado en la CID clásica asociada a sepsis o trauma, la prolongación del PTTa o PT es mínima, la trombocitopenia es leve (recuento de plaquetas ∼ 100×109/l) y con poca probabilidad de marcadores de microangiopatía. En muy raras ocasiones, los pacientes con infección grave por COVID-19 y fallo multiorgánico progresan a una coagulopatía que cumple con los criterios de CID según los criterios de la Sociedad Internacional de Trombosis y Hemostasia (ISTH). Esto se refleja en la trombocitopenia moderada a severa (recuento de plaquetas <50×109/l), prolongación del PT y el PTTa, elevación extrema del dímero-D y disminución del fibrinógeno (< 1,0g/l). La utilidad de las pruebas viscoelásticas, como la tromboelastografía, se está investigando, pero todavía no está considerada para el uso rutinario.
En cuanto a las anomalías de la coagulación en este tipo de pacientes, la elevación del dímero-D junto con la carga viral son los factores más fuertemente relacionados con aumento de la mortalidad1,22.
BiomarcadoresDímero-DEl dímero-D es un producto de degradación de la fibrina y su formación está mediada principalmente por 3enzimas: la trombina, el factor xiiia y la plasmina; normalmente los productos de degradación de la fibrina (complejo E-dímero-D) no son detectados en la circulación; sin embargo, fragmentos moleculares solubles de alto peso molecular que contienen dímero-D están presentes en la CID y otras alteraciones trombóticas. Así mismo, es importante resaltar que los valores de dímero-D se incrementan con la edad y en adultos mayores de 60 años basalmente sus valores superan los 500 ng/ml y después de los 80 años menos del 5% tiene un valor de dímero-D negativo. El dímero-D generalmente se encontró elevado en pacientes con infección por el virus SARS-CoV-2, con valores mayores de 1,5 μg/ml y se asoció a mayor riesgo de presentar fenómenos trombóticos con una sensibilidad del 85%, una especificidad del 88,5%, un valor predictivo positivo del 70,5% y un valor predictivo negativo del 94,7%. El dímero-D resalta como un marcador independiente de mal pronóstico, con mayor peso entre los anteriores, encontrándose valores> 1 μg/ml en el 81% de los no sobrevivientes en una cohorte de pacientes con una odds ratio de 18,42 con una p=0,0033 para riesgo de mortalidad intrahospitalaria1,2,22,23.
PTTaUn PTTa prolongado puede indicar una deficiencia del factor de coagulación o la presencia de un inhibidor de la coagulación que sea específico (p. ej., anticuerpo contra el factor viii) o inespecífico (p. ej., anticoagulante lúpico). El anticoagulante lúpico puede afectar a las pruebas in vitro de coagulación sanguínea, pero generalmente no está asociado con el sangrado. Como parte del síndrome antifosfolípido, el anticoagulante lúpico se asocia con un riesgo trombótico; en estudios se ha demostrado que los pacientes con infección por COVID 19 pueden presentar presencia de anticoagulante lúpico que se manifiesta como prolongación del PTTa y a menudo tenían una deficiencia de factor xii asociada. Es importante tener en cuenta que ninguna observación está asociada con una tendencia a sangrado, sino, por el contrario, una tendencia al estado hipercoagulable17,22,23.
PlaquetasAlrededor del 5% de los pacientes presentan un recuento de plaquetas menor de 100.000 plaquetas/l. Sin embargo, se puede encontrar en el 70 al 95% de los pacientes con infección por COVID-19 grave trombocitopenia leve (un recuento de plaquetas de <150.000 plaquetas/l). Sin embargo, no se ha encontrado que la trombocitopenia en COVID-19 sea un predictor importante de progresión de la enfermedad o resultado adverso22.
FibrinógenoLas concentraciones medias de fibrinógeno en estos pacientes están en los límites superiores de lo normal, presumiblemente como una respuesta de fase aguda. Sin embargo, se observó una disminución repentina en el fibrinógeno plasmático a concentraciones inferiores a 1g/l poco antes de la muerte en varios pacientes en China. Las concentraciones plasmáticas de antitrombina son más bajas en los no sobrevivientes de infección por COVID-19 que en los sobrevivientes; sin embargo, las concentraciones plasmáticas rara vez caen por debajo del 80% de lo normal1,2.
TromboelastografíaSe ha investigado sobre otras herramientas que le puedan ser útil al clínico en detectar precozmente esta coagulopatía, entre ellas el uso de la tromboelastografía, que nos permite una visión más completa de la coagulación permitiéndonos evaluar la contribución de las plaquetas en la formación y resistencia del coágulo que no son considerados en la evaluación de rutina de la coagulación (PT y PTTa) y es de suma importancia en el paciente críticamente enfermo, volviéndose popular en los últimos años para la monitorización y manejo transfusional en cirugía mayor, trauma y hemofilia (fig. 4)24.
Tromboelastograma de paciente con infección por SARS-CoV-2 con evidencia de coagulopatía dada una disminución de los valores de tiempo R y K, y el aumento de los valores de ángulo alfa y amplitud máxima (MA) sin lisis del coágulo a los 30 min, asociado a dímero-D de más de 2.600 ng/ml.
Adaptada de Panigada et al.25.
Panigada et al. realizan un estudio de tromboelastografía25 en 24 pacientes con infección por COVID grave admitidos en la Unidad de Cuidado Crítico, encontrando que los parámetros del tromboelastograma son consistentes con un estado de hipercoagulabilidad dado que muestran una disminución de los valores de R y K, y el aumento de los valores de ángulo K y MA. El recuento de plaquetas es normal o aumentado, el PT y el PTTa estaban cerca de lo normal. El fibrinógeno se encuentra normal o elevado y el dímero-D dramáticamente aumentado (6-12 veces del valor normal). La PCR, el factor viii y el FVW, aumentados, y la antitrombina, disminuida marginalmente.
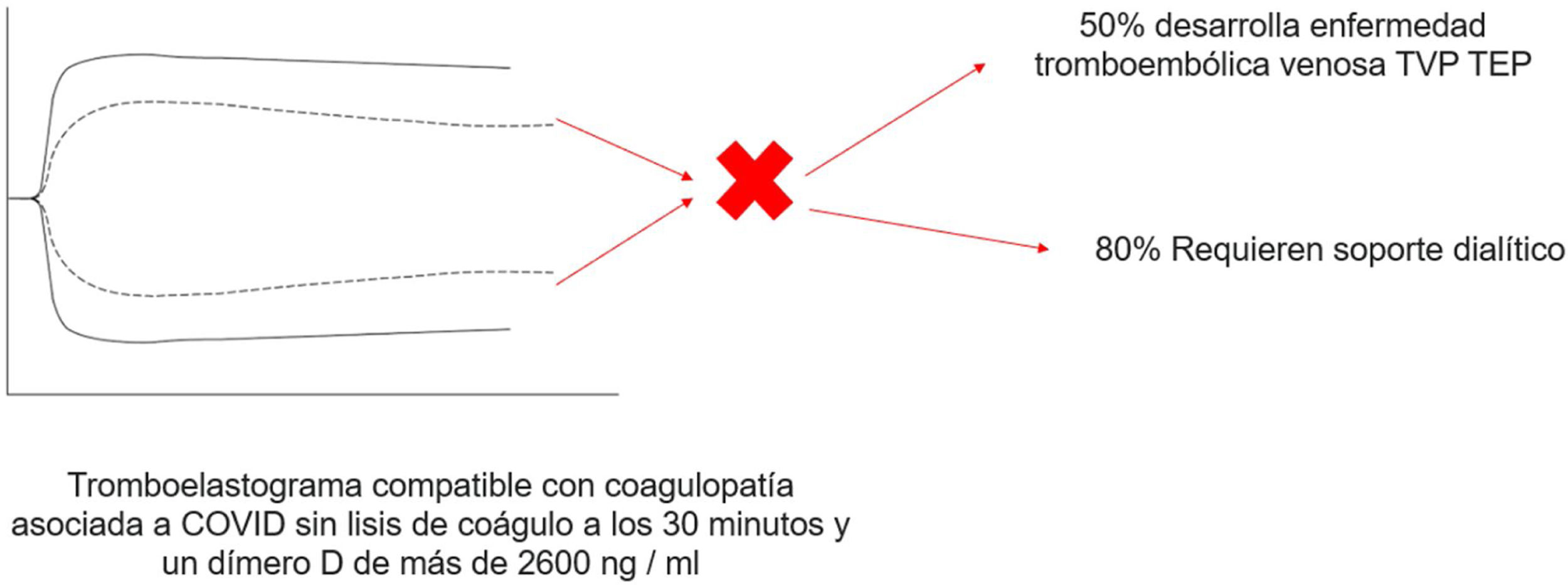
Cuarenta y cuatro pacientes con COVID-19 fueron incluidos, los cuales mostraron coagulopatía manifiesta dada la alteración en los valores de laboratorio de la coagulación, incluyendo dímero-D elevado, fibrinógeno, PT y PTTa; Los parámetros viscoelásticos en el tromboelastograma mostraron una amplitud máxima elevada y una lisis baja a los 30 min. Se observó una falta total de lisis del coágulo a los 30 min en el 57% de los pacientes y predijo TEV junto con un dímero-D mayor de 2.600 ng/ml y la necesidad de diálisis. En general, los pacientes sin lisis del coágulo a los 30 min y un dímero-D de más de 2.600 ng/ml tuvieron una tasa de TEV del 50% en comparación con el 0% para los pacientes sin factor de riesgo (p=0,008) y necesidad de hemodiálisis en un 80% en comparación con el 14% para los pacientes sin factor de riesgo (p=0,004)26.
Diagnóstico diferencialLa evidencia disponible distingue la coagulopatía asociada a COVID-19 de la MAT y la CID; no obstante, se pueden observar posibles superposiciones en pacientes críticos con choque, falla orgánica multisistémica e hipoxemia refractaria. Sin embargo, es de vital importancia diferenciar su patrón de presentación clínica y de laboratorio27.
Microangiopatía trombótica (MAT)Las características más relevantes son: anemia hemolítica, Coombs negativo, trombocitopenia y evidencia de trombos microvasculares de plaquetas. Se asocia con 2condiciones fundamentales, la púrpura trombocitopénica trombótica (PTT) y el síndrome de uremia hemolítica. Las características de laboratorio incluyen anemia (con esquistocitos, reticulocitosis, hiperbilirrubinemia indirecta, lactatodeshidrogenasa (LDH) elevada y haptoglobina disminuida) y trombocitopenia. En la PTT los niveles de proteasa de escisión de FVW (ADAMTS 13) son bajos. Las características patológicas incluyen trombos arteriolares y capilares diseminados que consisten en agregados de plaquetas, FVW y fibrina con inflamación adyacente de las células endoteliales vasculares. El sangrado no es común en la MAT6.
Otras anormalidades de laboratorio en pacientes con infección por COVID-19 que podrían ser relevantes para la coagulopatía son el aumento de la LDH y, en algunos pacientes, concentraciones de ferritina sorprendentemente altas, que recuerdan los hallazgos en MAT. Los hallazgos post mortem en pacientes con infección por COVID-19 muestran depósitos trombóticos microvasculares ricos en plaquetas típicas en los pequeños vasos de los pulmones y otros órganos. Sin embargo, no hay signos de hemólisis o esquistocitos en el extendido de sangre periférica y el recuento de plaquetas es más alto de lo que cabría esperar en caso de MAT1,2,6.
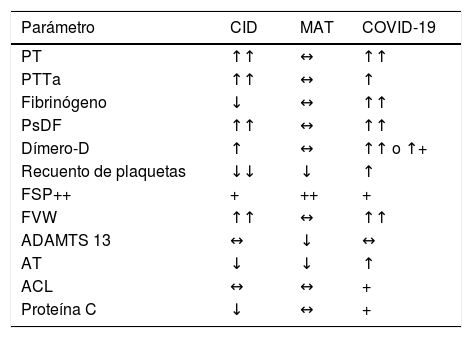
Coagulopatía intravascular diseminada (CID)Es un síndrome que complica una variedad de enfermedades y condiciones agudas como: sepsis, traumatismo mayor, malignidad, complicaciones del embarazo, exposición a toxinas, reacciones alérgicas graves, generando la activación sistémica de la coagulación que conduce a la obstrucción trombótica principalmente de los vasos sanguíneos pequeños. A diferencia de la MAT y la coagulopatía asociada a COVID-19, el sangrado es la característica fenotípica más frecuente. Se caracteriza por la activación de proteínas de coagulación, factor tisular, células endoteliales y sistema fibrinolítico, reducción de las proteasas de la superficie de células endoteliales (antitrombina, PCR) y trombocitopenia. Las características de laboratorio varían ampliamente dependiendo de la etapa; en fases tempranas, se evidencia una activación compensada del sistema hemostático, sin embargo, con la progresión se observan de manera característica trombocitopenia, aumento de PT y PTTa, elevación de productos de degradación de fibrina, disminución de la inhibición de la proteasa y disminución de niveles de fibrinógeno en fases avanzadas (tabla 1)1,2,28.
Diagnóstico diferencial de la coagulopatía asociada a la infección por COVID 19
| Parámetro | CID | MAT | COVID-19 |
|---|---|---|---|
| PT | ↑↑ | ↔ | ↑↑ |
| PTTa | ↑↑ | ↔ | ↑ |
| Fibrinógeno | ↓ | ↔ | ↑↑ |
| PsDF | ↑↑ | ↔ | ↑↑ |
| Dímero-D | ↑ | ↔ | ↑↑ o ↑+ |
| Recuento de plaquetas | ↓↓ | ↓ | ↑ |
| FSP++ | + | ++ | + |
| FVW | ↑↑ | ↔ | ↑↑ |
| ADAMTS 13 | ↔ | ↓ | ↔ |
| AT | ↓ | ↓ | ↑ |
| ACL | ↔ | ↔ | + |
| Proteína C | ↓ | ↔ | + |
ADAMTS 13: A disintegrin-like and metalloprotease with thrombospondin type 1 motif n. 13; AT: antitrombina; ACL: anticuerpos anticardiolipinas; CID: coagulación intravascular diseminada; COVID-19: coronavirus 19 disease; FSP: frotis de sangre periférica; PT: tiempo de protrombina; MAT: microangiopatía trombótica; PTTa: tiempo de tromboplastina activado; PsDF: productos de degradación del fibrinógeno.
Adaptado de BecKer29.
Para el diagnóstico de CID asociada a sepsis tenemos varios criterios diagnósticos, la recomendación de la ISTH es la escala de CIS. Con un puntaje en CIS score 4 puntos se alcanzó una mortalidad cercana al 30%, la cual se incrementó hasta cerca del 45% en pacientes con 6 puntos a 28 días. Estudios anteriores han demostrado que el 71% de los pacientes que murieron han cumplido los criterios establecidos por la ISTH para el diagnóstico de CIS1–3,28.
Usando la evidencia disponible, sugerimos monitorizar la coagulopatía en pacientes con COVID-19 grave midiendo el PT, el TTPa, el recuento de plaquetas, el fibrinógeno y las concentraciones de dímero-D cada 2-3 días29. Consideramos que el seguimiento de estos parámetros de forma sistemática y de rutina debe ser tomado como una herramienta fundamental para orientar la terapéutica de estos pacientes en pro de medidas más agresivas en los pacientes que presentan empeoramiento de estos paraclínicos asociado a evoluciones tórpidas o no satisfactorias en el entorno hospitalario y de cuidado crítico1–3,28.
TratamientoSe ha demostrado que la coagulopatía en la infección por virus SARS-CoV-2 (COVID-19) severa está asociada con una alta mortalidad que se evidencia principalmente por el incremento de los niveles de dímero-D en estos pacientes, que es un marcador particularmente importante para este tipo especial de coagulopatía.
Thachil et al.19 sugirieron que el uso de la terapia de tromboprofilaxis y anticoagulante ante evidencia de dímero-D aumentado o trombosis arterial o venosa documentada con heparina también disminuye la mortalidad. Se debe resaltar que el principal medicamento utilizado en este estudio fue la HBPM y a dosis que consideramos profilácticas (40-60mg subcutánea día).
Esto es especialmente cierto en pacientes: a) que han cumplido los criterios de CIS ≥ 4 (40,0% vs. 64,2%, p=0.029) en comparación con aquellos con puntaje CIS <4 (29,0% vs. 22,6%, p=0.419), o b) con dímero-D notablemente elevado (más de 6veces en el límite superior de lo normal). En aquellos con una elevación tan marcada del dímero-D, se encontró una reducción de aproximadamente el 20% en la mortalidad con heparina (32,8% vs. 52,4%, p=0.017)2.
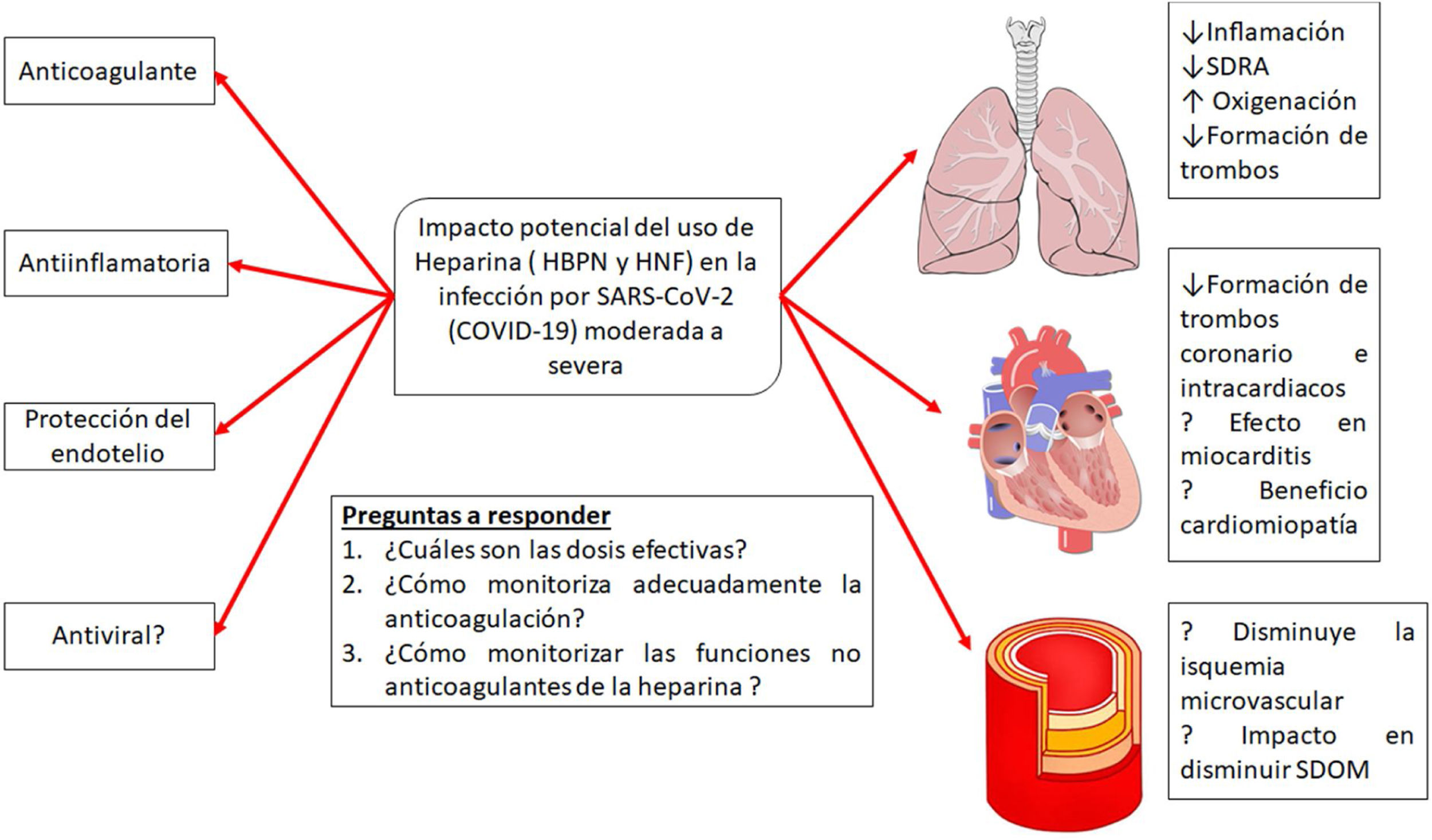
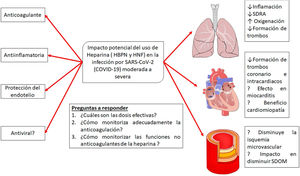
La heparina es un producto natural cuyos efectos no están totalmente descritos ya que, a medida que se investiga, se le siguen adjudicando nuevas propiedades. En los últimos 10años creció el interés en las propiedades «no anticoagulantes» de las heparinas (fig. 5). Varios estudios muestran que la heparina posee características pleiotrópicas dado que se le agregan efectos antiinflamatorios, anticomplementémicos, antifibróticos y antiangiogénicos, lo cual puede estar relacionado también con efectos antimetastásicos, todo esto al parecer debido a que es capaz de interactuar con un amplio rango de proteínas que inducen actividades biológicas asociadas. Los mecanismos de la actividad antiinflamatoria e inmunomoduladora de la heparina son aún bastante discutidos, aunque se considera que podrían estar relacionados con la unión a mediadores de la respuesta inmunitaria, como citocinas y proteínas de fase aguda, y neutralizándolas directamente en el sitio de la inflamación, disminuyendo los niveles de IL-6 y 8, TNF y PCR. También las heparinas se unen a la selectina P e inhiben la adhesión de leucocitos y neutrófilos a las células endoteliales, y de esa manera previenen la liberación de radicales de oxígeno y enzimas proteolíticas. Otro mecanismo propuesto es la inhibición del factor nuclear B (NF-B) y la inducción de apoptosis por modulación de la actividad de TNF- y NF-B30.
Posibles efectos del tratamiento con heparinas en la infección por la infección por SARS-CoV-2.
Adaptado de Thachil19.
Con respecto a esto, la dosis correcta de HBPM es un asunto de interés inmediato ya que un medicamento solo puede ser efectivo si se administra en una dosis efectiva. Aunque una dosis profiláctica puede ser adecuada en la mayoría de los pacientes, sería importante considerar una dosis más alta en individuos con alto índice de masa corporal2.
En vista del estado hipercoagulable de los pacientes con COVID-19 grave y el posible aumento del riesgo de trombosis, sugerimos que todos los pacientes con COVID-19 que ingresen en el hospital reciban profilaxis antitrombótica en ausencia de contraindicaciones médicas, a pesar de las anormalidades de las pruebas de coagulación y en ausencia de sangrado activo. La tromboprofilaxis se debe mantener excepto si el recuento de plaquetas es inferior a 25×109/l o el fibrinógeno menor de 0,5g/l3. Se debe tener en cuenta que la anormalidad del PT o el PTTa no es una contraindicación para la tromboprofilaxis farmacológica. La tromboprofilaxis mecánica debe usarse cuando la tromboprofilaxis farmacológica está contraindicada.
Si la HBPM no está disponible, se podría usar heparina no fraccionada, aunque esta requiere inyecciones más frecuentes; una alternativa es fondaparinux, pero no está claro si este medicamento tiene los beneficios antiinflamatorios postulados de la heparina2.
El efecto de dosis crecientes de HBPM y la anticoagulación plena en los resultados del paciente está bajo investigación en muchos ensayos prospectivos. Se está estudiando la eficacia de la anticoagulación terapéutica intermedia o completa para pacientes con COVID-19 en estado crítico sin enfermedad tromboembólica (ETV) documentada. En pacientes que ya reciben anticoagulación para ETV o fibrilación auricular, deben continuarse las dosis terapéuticas de terapia anticoagulante, pero es posible que sea necesario mantenerlas si el recuento de plaquetas es inferior a 30-50×109/l o si el fibrinógeno es inferior a 1,0g/l. Sin embargo, se requiere una evaluación individual del paciente para equilibrar los riesgos de trombosis y sangrado). Muchos centros han aumentado la dosis de anticoagulación con HBPM a dosis de «intensidad intermedia», como 0,5mg/kg 2veces al día de enoxaparina. Se informó una estrategia adaptada al riesgo de hemorragia y trombosis de laboratorio y clínica para la toma de decisiones de la dosis de HBPM. Un documento de consenso encontró que el 31,6% de los participantes apoyó la dosis de intensidad intermedia, la dosis terapéutica del 5,2%, mientras que el resto apoyó el uso de la dosis estándar de profilaxis de TEV para pacientes hospitalizados con COVID-19 moderada a severa sin evidencia de CID31.
En caso de que la HBPM no sea suficiente para evitar la CIP, la extensión de la trombosis a las venas pulmonares repercutirá en hipertensión pulmonar secundaria e insuficiencia cardíaca. El aumento de la presión intravascular en los pulmones dará como resultado exudación alveolar extensa que causará hipoxia marcada y progresiva. Como consecuencia de la disminución del flujo venoso pulmonar, el volumen sistólico izquierdo disminuirá y provocará hipotensión sistémica. Reciente evidencia sugiere la opción de tratamiento con activador de plasminógeno tisular o defibrotide como modalidades fibrinolíticas que podrían prevenir la intubación y la progresión a CID. Sin embargo, faltan más estudios clínicos controlados para demostrar su beneficio y la inclusión en guías de práctica clínica4,26.
El tratamiento actual de la COVID-19 es de apoyo y la insuficiencia respiratoria por SDRA es la principal causa de mortalidad y, aunque actualmente no se disponen de tratamientos específicos contra el SARS-CoV-2, una serie de moléculas se encuentran en investigación y, de hecho, tienen uso compasivo en la práctica clínica. Por lo que es de fundamental importancia comprender las interacciones medicamentosas que podrían conllevar la terapia anticoagulante y los tratamientos experimentales contra el SARS-CoV-2; debido a que los anticoagulantes orales directos y los antagonistas de vitamina K (AVK) tienen un importante metabolismo hepático se debe tener en cuenta que tratamientos que incluyan moléculas como lopinavir/ritonavir son potentes inhibidores del citocromo CYP3A4, por lo que pueden aumentar la concentración de los anticoagulantes orales como rivaroxabán y apixabán, y antiagregantes como el ticagrelor y clopidogrel, cuyas concentraciones pueden llegar a verse disminuidas. La cloroquina y la hidroxicloroquina son inhibidores moderados del CYP2D6 y de la glucoproteína y deben usarse con precaución con el dabigatrán y el edoxabán; además moléculas como los glucocorticoides, que se han convertido por el momento en nuestro país en piedra angular del tratamiento, pueden interactuar con los AVK, por lo que se desaconseja su uso. En conclusión, en el manejo del paciente crítico o en el ámbito hospitalario los anticoagulantes orales no están recomendados como primera opción en tromboprofilaxis o la anticoagulación, ya que la HBPM y la HNF poseen semividas más cortas, menos interacciones y tratamientos de reversión estandarizados en caso de urgencias hemorrágicas o quirúrgicas, además de ser anticoagulantes de elección durante el embarazo. Y los pacientes con indicación previa de anticoagulación que venían recibiendo anticoagulantes orales de forma ambulatoria deben ser cambiados a régimen de anticoagulación plena con HBPM al ser ingresados al hospital. Dicho cambio deberá hacerse también cuando concluya el tratamiento antiviral y sea posible administrar de nuevo la anticoagulación oral. La Universidad de Liverpool ha recopilado una lista de interacciones farmacológicas, accesible en covid19-druginteractions.org32,33.
En caso de un síndrome coronario agudo con una gran carga trombótica (situación que puede darse en el contexto de una infección con gran potencial inflamatorio y protrombótico como el SARS-CoV-2), se puede plantear perfectamente el uso de antiagregantes parenterales potentes, como los inhibidores de la glucoproteína iib/iiia o cangrelor. Para el paciente diagnosticado de angina estable que no requiere tratamiento invasivo, el ácido acetilsalicílico (AAS) es el fármaco antitrombótico electivo. Y para quienes la revascularización percutánea sea la opción, la doble antiagregación con AAS y clopidogrel debe ser lo indicado32.
Ya que nos movemos en un escenario cambiante, no hay evidencia científica sólida que respalde un tratamiento antitrombótico en este tipo específico de pacientes infectados por SARS-CoV-2. La mayor parte de la información disponible se basa en series de pacientes de China y, por lo que se está viendo, la pandemia se comporta en el mundo occidental de una forma bastante diferente. Se ha informado una incidencia de TEV sintomática entre el 0-0,6% a los 30-42 días después del alta en pacientes con COVID-19. Se está investigando en ensayos clínicos si se justifica la tromboprofilaxis posterior al alta y se recomienda la inscripción de cualquier decisión de utilizar tromboprofilaxis posterior al alta. Por lo que es indispensable, individualizar la situación clínica del paciente y la presencia de comorbilidades para valorar tanto el riesgo trombótico como el hemorrágico. Además, se debe educar a los pacientes sobre los signos y síntomas de TEV en el momento del alta hospitalaria y se les debe recomendar que busquen atención médica urgente si se presentan32.
DeclaracionesConsentimiento para publicación: no aplica.
Conflicto de interesesEn nombre de todos los autores, los autores de correspondencia declaran que no hay conflicto de intereses.