El shock séptico es un síndrome caracterizado por hipoperfusión tisular e hipotensión persistente que no cede al aporte hídrico, y es secundario a una infección no controlada. Es una causa frecuente de ingreso en la unidad de cuidados intensivos y su riesgo de mortalidad es variable.
El origen del shock séptico puede tener diversas etiologías y diferentes microorganismos responsables, como bacterias, virus u hongos, con complicaciones variables dependiendo del parénquima comprometido.
La hipoperfusión tisular está presente en pacientes con shock séptico debido a varios mecanismos, que incluyen vasodilatación sistémica, hipovolemia relativa, disfunción endotelial macro y microcirculatoria y presión arterial baja con presión de perfusión global alterada. Clásicamente se ha descrito el shock séptico como un estado hiperdinámico, con aumento del gasto cardíaco y resistencias vasculares sistémicas caídas, lo que hace que la hipotensión arterial sea en muchos casos refractaria a manejo solo con líquidos. Cuando se presenta depresión miocárdica, a la cual muchos autores han llamado cardiopatía séptica, el estado de hipoperfusión empeora y aumenta la mortalidad. Desde el punto de vista renal, genera lesión renal aguda, que es una de las principales complicaciones asociadas al shock séptico, incrementando el riesgo de mortalidad, y entre el 30 y el 40% requerirán terapia de reemplazo renal.
El tratamiento hemodinámico del shock séptico está dirigido a mantener el suministro de oxígeno por encima de un umbral crítico, mientras se mantiene una presión arterial media en un nivel que permita una adecuada perfusión de los órganos.
Septic shock is a syndrome characterized by tissue hypoperfusion and persistent hypotension that does not respond to fluid supply, and this is secondary to an uncontrolled infection. It is a frequent cause of admission to the intensive care unit and its mortality risk is variable.
The origin of septic shock can have various etiologies and different responsible microorganisms such as bacteria, viruses or fungi, with variable complications depending on the affected parenchyma.
Tissue hypoperfusion is present in patients with septic shock due to several mechanisms that include systemic vasodilation, relative hypovolemia, macro and microcirculatory endothelial dysfunction and low blood pressure with altered global perfusion pressure. Classically, septic shock has been described as a hyperdynamic state, with increased cardiac output and decreased systemic vascular resistance, which makes arterial hypotension in many cases refractory to management with fluids alone. When myocardial depression occurs, which many authors have called septic heart disease, the state of hypoperfusion worsens and increases mortality. From the renal point of view, it generates acute kidney injury, which is one of the main complications associated with septic shock, increasing the risk of mortality, and between 30 and 40% will require renal replacement therapy.
Hemodynamic treatment of septic shock is aimed at maintaining oxygen supply above a critical threshold, while maintaining a mean arterial pressure at a level that allows adequate organ perfusion.
El shock séptico es un síndrome caracterizado por hipoperfusión tisular e hipotensión persistente que no cede a aporte hídrico, y es secundario a una infección no controlada1. Es una causa frecuente de ingreso en la unidad de cuidados intensivos (UCI) y su riesgo de mortalidad es variable. Dicho riesgo de mortalidad puede ser calculado por varios scores, dentro de los que están el APACHE II, el SOFA y el NEWS2. El shock séptico puede llegar a alcanzar riesgos de mortalidad por encima del 70% con un APACHE II por encima de 302. El origen del shock séptico puede tener diversas etiologías y microorganismos responsables variables (bacterias, virus u hongos, etc.), manifestándose en un amplio espectro de síndromes, según el órgano o sistema implicado (por ejemplo, neumonía, infecciones abdominales o infecciones del tracto urinario, encefalitis, infecciones tropicales, etc.). En la pandemia del 2020, la covid-19 causó en muchos pacientes un cuadro de shock séptico con SDRA severo de difícil manejo en una proporción significativa de pacientes ingresados en la UCI, y su mortalidad fue considerable3.
La lesión renal aguda (LRA) es una de las principales complicaciones asociadas al shock séptico; alrededor del 50% de los pacientes con shock séptico presentan LRA temprana, incrementando el riesgo de mortalidad, evidenciado en los scores anteriormente descritos, como APACHE II y SOFA2, y entre el 30 y el 40% requerirán terapia de reemplazo renal (TRR)4,5, ambos factores asociados con peores resultados. Hasta el momento no existen tratamientos específicos para prevenir el fracaso renal agudo o la insuficiencia renal, y biomarcadores para su detección temprana, como NGAL, cistatina C o Neprocheck®, aún no son de disponibilidad general. El enfoque actual, descrito en la presente Surviving Sepsis Campaign, se basa en tratar la etiología de la infección, evitar nefrotóxicos, optimizar la hemodinámica sistémica y corregir rápidamente la hipoperfusión mediante la administración de líquidos y vasopresores2.
La hipoperfusión tisular está presente en pacientes con shock séptico debido a varios mecanismos que incluyen vasodilatación sistémica, hipovolemia relativa, disfunción endotelial macro y microcirculatoria y presión arterial baja con presión de perfusión global alterada. Clásicamente se ha descrito el shock séptico como un estado hiperdinámico, con aumento del gasto cardíaco y resistencias vasculares sistémicas caídas, lo que hace que la hipotensión arterial sea en muchos casos refractaria a manejo solo con líquidos6, y cuando se presenta depresión miocárdica, a lo cual muchos autores han llamado cardiopatía séptica, el estado de hipoperfusión empeora y aumenta la mortalidad7,8. El tratamiento hemodinámico del choque séptico está dirigido a ambos, a mantener el suministro de oxígeno por encima de un umbral crítico mientras se mantiene una presión arterial media (PAM) en un nivel que permita una adecuada perfusión de los órganos9. La autorregulación de los órganos juega un papel importante para mantener el flujo sanguíneo de estos en un rango de presiones de perfusión10. Existe evidencia de que la autorregulación local puede verse afectada en el shock séptico11. La presión de perfusión óptima puede variar, especialmente en pacientes previamente hipertensos, ya que pueden tener un desplazamiento hacia la derecha en su curva de autorregulación renal12.
Este concepto fue destacado por un estudio histórico realizado por Asfar et al.5, que comparó el uso de un objetivo más alto de PAM (80-85mmHg) vs. el objetivo habitual (65-70mmHg) en pacientes con shock séptico tratados con norepinefrina (NE) como único vasopresor. Aunque el estudio no encontró diferencias en todo el grupo de estudio, entre los pacientes con hipertensión crónica, aquellos asignados al objetivo de PAM más alto tenían una función renal mejorada. Una revisión sistemática y metaanálisis de 11 estudios aleatorizados reportó que el uso de NE resultó en una baja mortalidad (RR 0,89; IC 95% 0,81-0,98) y una disminución del riesgo de arritmias comparado con dopamina (RR 0,48; IC 95% 0,40-0,58)13. Un consenso sobre shock circulatorio y monitorización hemodinámica de la Sociedad Europea de Medicina de Cuidados Intensivos (ESICM 2014) recomendó titular la NE a metas de PAM más altas en pacientes previamente hipertensos12. Sin embargo, la evidencia aún sigue siendo conflictiva. En el estudio de Asfar et al. la incidencia de fibrilación auricular aumentó en el grupo asignado al objetivo de PAM alto, asociado a las mayores dosis de NE requeridas, lo que ha generado algunas preocupaciones sobre la seguridad de esta estrategia5. En este contexto, la adición de arginina vasopresina exógena (AVP), un fármaco utilizado como vasoconstrictor pero con mecanismos independientes de las catecolaminas, puede prevenir este efecto secundario al disminuir los requerimientos de dosis de NE. Por otro lado, en el 2020 Lamontagne et al. publican un estudio multicéntrico realizado en Inglaterra, Gales e Irlanda del Norte donde evaluaron una estrategia de hipotensión permisiva con PAM entre 60-65mmHg vs. PAM mayores o iguales a 65mmHg en pacientes mayores de 65 años. El estudio no encontró diferencias estadísticamente significativas entre los 2 grupos, evidenciando que una estrategia de hipotensión permisiva podría ser una opción en shock séptico en pacientes ancianos, sin embargo, al analizar la PAM esta fue de 66,7mmHg en el grupo de hipotensión permisiva y de 72,6mmHg en el grupo control, por lo que la duda continúa14.
Las dosis bajas de AVP en el shock séptico parecen ser seguras y, cuando se combinan con NE para mantener un objetivo convencional de PAM, dieron como resultado un aumento del aclaramiento de creatinina y una disminución del uso de la TRR, en comparación con la NE sola15.
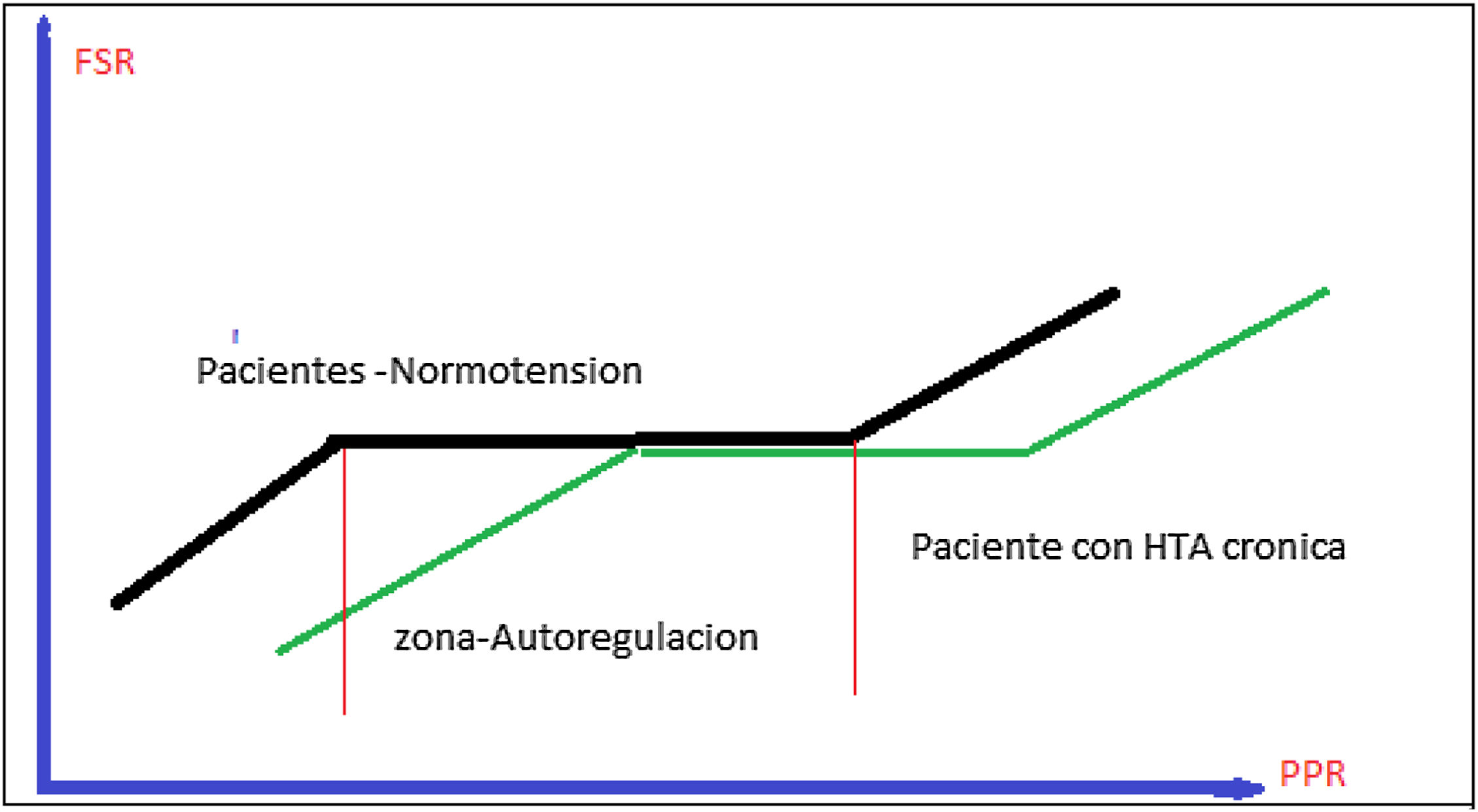
En teoría, la AVP puede mejorar la tasa de filtración glomerular (TFG)7. Por lo tanto, la adición de AVP a NE para lograr un objetivo de PAM más alto en pacientes con shock séptico previamente hipertensos puede ser una estrategia razonable para preservar la función renal y evitar los efectos secundarios de las altas dosis de catecolaminas. Sin embargo, a diferencia de la NE, la AVP aumenta la resistencia vascular sistémica (poscarga) sin un efecto inotrópico paralelo. Cuando se presenta cardiopatía séptica, existe una preocupación razonable con respecto al impacto de la AVP en el rendimiento cardíaco y el volumen sistólico cuando se trata de presiones arteriales más altas8,16. Actualmente, la recomendación de la Surviving Sepsis Campaign es mantener una PAM de 65mmHg, sin embargo, ellos mismos aceptan que la recomendación sale de estudio, donde la media real estaba cercana a los 70mmHg, lo cual ha sido discutido por Carlos Sanchez et al. en sus observaciones, y que ciertos pacientes con características especiales podrían beneficiarse de metas de PAM más altas17 (fig. 1).
Autorregulación renal en pacientes con o sin hipertensión crónica. En la zona de autorregulación, el flujo renal es constante, independiente de la perfusión renal. En cambio, los umbrales de autorregulación en los pacientes con hipertensión arterial son más altos que en los pacientes normotensos. FSR: flujo sanguíneo renal; HTA: hipertensión arterial; PPR: presión de perfusión renal.
Alrededor del 80% de los pacientes con shock séptico desarrollan LRA a lo largo de su evolución y entre el 30 y el 40% requieren TRR5,18. De acuerdo con la severidad, la LRA generalmente se gradúa en 3 etapas19. Un gran estudio epidemiológico mostró que los pacientes en estado crítico que cumplen con los criterios de LRA en etapa 3 tienen una mortalidad del 51,1%, y en aquellos pacientes que requirieron TRR fue del 55,3%17. Un gran ensayo clínico de shock séptico reveló que el 50,4% de los pacientes ya tenían una LRA en estadio 2-3 al ingresar en la UCI. Entre los pacientes sin fracaso renal agudo al ingreso, el 37,8% desarrolló LRA durante su evolución y el requerimiento de TRR estuvo en torno al 6%. Además, la mortalidad a los 60 días fue de 3 a 5 veces mayor en aquellos que desarrollaron LRA, independientemente de si la esta estaba presente al ingreso o se desarrolló más tarde3. Además, la LRA afecta negativamente los resultados clínicos a corto y largo plazo, y los costos de atención médica20,21.
Ninguna estrategia de reanimación específica parece influir en el progreso de la LRA en pacientes con shock séptico4. Independientemente de la mejora en la hemodinámica sistémica, la disfunción renal no responde a la reanimación intensiva con líquidos y NE en entornos experimentales11. El estado del flujo sanguíneo renal (FSR) no está claro, ya que se informó que aumentó, disminuyó o no cambió en la sepsis humana. Los datos sobre el FSR de los animales son heterogéneos y no proporcionan conclusiones claras. Sin embargo, el gasto cardíaco es el predictor independiente más importante del FSR en la sepsis15. En algunos pacientes, un aumento del FSR se asocia con una disminución de la TFG. Esto podría explicarse potencialmente por la vasodilatación arteriolar eferente22, el shunt intrarrenal persistente (anomalías en la microcirculación) y/o la falta de autorregulación12. En un modelo de oveja de lesión renal inducida por sepsis, se encontraron reducciones manifiestas de la resistencia vascular renal, lo que evidencia una falla de la autorregulación. El aumento de la PAM a 70mmHg y la normalización de la hemodinámica sistémica por medio de fluidos y NE no lograron mejorar el FSR y la microcirculación cortical12. Sin embargo, no hubo ningún intento de aumentar aún más la presión arterial.
Evidencia clínica y fisiológica de objetivos de presión arterial más altos en el shock sépticoEl impacto fisiológico de apuntar a niveles más altos de PAM en la perfusión de órganos en el shock séptico ha mostrado resultados contradictorios. Thooft et al.23 encontraron que el aumento de PAM con NE durante el shock séptico puede aumentar el gasto cardíaco y mejorar el flujo microvascular sublingual (como marcador de perfusión tisular) en pacientes reanimados estables. Dubin et al.24 aumentaron la PAM con NE en una cohorte de pacientes con shock séptico y no observaron mejoría en los índices medios de microcirculación sublingual. Sin embargo, hubo variaciones considerables en las respuestas interindividuales, dependiendo de la condición basal de la microcirculación. Asimismo, Bourgoin et al.25 demostraron que el aumento de la PAM de 65 a 85mmHg con NE, durante un período de estudio de 4h en pacientes con shock séptico, resultó en un aumento del gasto cardíaco, de la resistencia vascular sistémica y de los índices de trabajo sistólico del ventrículo derecho e izquierdo, pero sin cambios significativos en el consumo de oxígeno, el lactato o la diuresis.
El primer gran ensayo aleatorizado que evaluó el impacto de enfocarse en presiones arteriales más altas en el shock séptico es el estudio de Asfar et al.5, mencionado anteriormente. De acuerdo con su hipótesis, que establecía que las presiones de perfusión más altas podrían asociarse con mejores resultados, especialmente en pacientes previamente hipertensos, la aleatorización se estratificó según si los pacientes tenían hipertensión crónica previa o no. Ni en el grupo total de pacientes (n=776) ni en el subgrupo de aquellos sin hipertensión crónica (n=336) se observaron diferencias en la función renal. Sin embargo, entre los 340 pacientes con hipertensión crónica, aquellos asignados al objetivo de PAM alta (80-85mmHg) exhibieron una disminución tanto en la incidencia de LRA, definida como una duplicación del nivel de creatinina en sangre, como en la tasa de TRR5. No obstante, la incidencia de fibrilación auricular fue significativamente mayor en los pacientes asignados al grupo con objetivo más alto, probablemente porque requirieron dosis significativamente más altas de NE para alcanzar una PAM de 80-85mmHg5.
Algunos estudios recientes han propuesto aplicar el objetivo de PAM alto como una prueba corta para pacientes con shock séptico con evidencia de hipoperfusión persistente, con o sin hipertensión crónica. El ensayo ANDROMEDA-SHOCK recomendó una «prueba vasopresora» de 2h dirigida a mejorar la perfusión tisular26, y mantuvo la presión arterial alta solo si había evidencia de un resultado positivo. Debido al diseño del estudio, no es posible concluir si esta intervención específica mejoró los resultados. Un estudio en curso, TARTARE-2S27, propone una prueba vasopresora similar durante 2h en pacientes con shock séptico y oliguria, manteniendo el objetivo de PAM más alto en caso de respuesta positiva. Hasta ahora, todos los estudios dirigidos a presiones arteriales más altas en el shock séptico han utilizado la NE como único vasopresor. Las dosis necesarias para aumentar la PAM de 65 a 85mmHg son muy variables, pero pueden llegar a duplicarse o triplicarse.
Efectos fisiológicos de la norepinefrina en pacientes con shock sépticoLa NE es el vasopresor de elección en el shock séptico28. Tiene amplios efectos sobre diferentes determinantes de la función cardíaca y renal. Es un agonista alfa-adrenérgico que aumenta el tono vascular, lo que puede afectar tanto a la precarga como a la poscarga, aunque el primer efecto parece predominar en pacientes con shock séptico. Monnet et al.29 estudiaron el impacto de la NE en un grupo de pacientes con shock séptico con evidencia de dependencia de la precarga y observaron que la NE aumentaba los volúmenes diastólicos del ventrículo izquierdo y el gasto cardíaco, mientras disminuía la dependencia de la precarga. Persichini et al.30 demostraron que este aumento del retorno venoso se debe a un incremento de las presiones medias de llenado sistémico y de la presión impulsora del retorno venoso (que es la presión media de llenado sistémico menos la presión de la aurícula derecha). Al inducir la venoconstricción en los vasos de capacitancia, la NE capta volumen del compartimento no estresado al estresado aumentando la presión media de llenado sistémico.
Un segundo efecto potencialmente favorable de la NE es el aumento de la fuerza contráctil del miocardio, principalmente debido a la activación de los adrenoreceptores beta-1, aunque la NE también puede provocar una respuesta inotrópica mediada por los adrenoreceptores alfa-131. Hamzaoui et al.32 demostraron que la NE aumentó la fracción de eyección del ventrículo izquierdo y el volumen sistólico en 38 pacientes con shock séptico. Este efecto inotrópico positivo también se observó en pacientes con fracción de eyección del ventrículo izquierdo<45%. La combinación del aumento de la presión arterial y la contractilidad puede mejorar el acoplamiento ventrículo-arterial33. No obstante, la frecuencia cardíaca no se modifica significativamente por la NE. Por lo tanto, el aumento del gasto cardíaco en respuesta a la NE en el shock séptico parece ser el resultado de los efectos combinados de la NE sobre la precarga y la contractilidad.
En estudios clásicos se evidenció que el aumento de la poscarga provocada por la NE es potencialmente perjudicial para el rendimiento cardíaco en algunos pacientes cardíacos postoperatorios34. Sin embargo, en el shock séptico, el aumento de la poscarga no parece empeorar la función cardíaca.
Con respecto a la función renal, aunque los estudios fisiológicos experimentales antiguos indicaron que la NE podría disminuir el FSR secundario al aumento de la resistencia vascular renal35, estudios más recientes mostraron que la NE aumenta consistentemente el FSR, la TFG y la producción de orina cuando se usa en pacientes con shock séptico36,37. La resistencia vascular renal generalmente disminuye en el shock séptico11,38. La NE puede restaurar esta resistencia mientras aumenta la presión de perfusión renal como resultado del aumento de la presión arterial.
Efectos fisiológicos de la arginina vasopresina en pacientes con shock sépticoAunque la NE aún se recomienda como vasopresor de primera línea en el shock séptico28, durante la última década ha habido un interés creciente en el uso de AVP como agente adyuvante39, especialmente después de la publicación de varios estudios que informaron una deficiencia endógena relativa de AVP en pacientes con shock séptico, y que dicha deficiencia puede contribuir a la disminución del tono vascular observado en el shock séptico40,41. La AVP es el mediador de un notable sistema regulador para la conservación del agua. La hormona es liberada por la glándula pituitaria posterior cada vez que la privación de agua provoca un aumento de la osmolalidad del plasma o cuando el sistema cardiovascular se ve afectado por hipovolemia y/o hipotensión. Los efectos de la AVP se deben principalmente a sus interacciones con los 3 tipos de receptores: V1a (vasoconstricción), V1b (liberación de ACTH) y V2 (efectos antidiuréticos). La AVP es un potente vasoconstrictor primario mediado por el receptor V1a que se encuentra en el músculo liso vascular42. Dado que la vasodilatación esplácnica es una característica fisiopatológica principal del shock séptico, la vasoconstricción de la vasculatura esplácnica inducida por la AVP puede aumentar el volumen de estrés y mejorar el retorno venoso. Además, la estimulación del músculo liso arterial puede aumentar la resistencia vascular sistémica con un aumento adicional de la PAM.
Los efectos hemodinámicos de dosis bajas de AVP (0,05±0,02U/min) en el shock séptico han sido analizados en un metaanálisis que agregó a más de 900 pacientes con shock séptico de 9 ensayos controlados aleatorizados. En comparación con los pacientes de control tratados solo con NE, los tratados con AVP (+NE) exhibieron una disminución media del 12% en la frecuencia cardíaca, un aumento del 14% en el volumen sistólico y ningún cambio en el gasto cardíaco. En cuanto al efecto de la AVP sobre los requerimientos de NE, el uso de AVP se asoció con una disminución de la dosis de NE de 1,6 veces. Ninguno de los estudios incluidos en este metaanálisis aplicó un objetivo alto de PAM40. Un estudio controlado aleatorizado en 50 pacientes con shock séptico comparó 2 dosis de AVP: 0,03 vs. 0,06U/min, y descubrió que la dosis de 0,06 se asoció con una mayor disminución de los requerimientos de NE sin aumentar los efectos adversos42. Un gran ensayo controlado aleatorizado más reciente (VANISH) confirmó los efectos hemodinámicos descritos en el metaanálisis15. La sutil disminución de la frecuencia cardíaca observada en la mayoría de los estudios no es fisiológicamente sorprendente. Se sabe que AVP actúa sobre el área postrema para mejorar la actividad barorrefleja42. La vasoconstricción inducida por AVP está mediada por la activación del receptor V1a en el músculo liso vascular. Esta vía difiere del mecanismo de acción de las catecolaminas y puede explicar por qué la AVP complementa a la NE en el shock séptico43. Algunos estudios han medido los efectos de AVP en comparación con NE solo en variables de perfusión (niveles de lactato y CO2 gástrico) y no se han observado cambios7,44. Con respecto a las complicaciones cardíacas, no se han observado diferencias significativas en el infarto agudo de miocardio o el paro cardíaco en los ensayos más grandes15,43.
En este contexto, las dosis bajas de AVP parecen seguras en el shock séptico y no se asocian con deterioro hemodinámico. Sin embargo, en pacientes con shock séptico, no se han evaluado los efectos de AVP sobre la función cardíaca por medio de ecocardiografía.
Con respecto a los efectos de la AVP sobre la función renal en el shock séptico, varios estudios clínicos han evidenciado que la AVP podría ser superior a la NE para mantener la TFG y mejorar la depuración de creatinina7,15,41,44. Patel et al.7 realizaron un estudio aleatorizado, controlado y doble ciego en 24 pacientes con shock séptico en el que demostraron que una infusión de AVP (0,06U/min) durante 4h sobre NE basal aumentó el aclaramiento de creatinina en un 75% y duplicó la diuresis, mientras que no se observaron cambios en el grupo tratado solo con NE. En un estudio similar en 23 pacientes con shock séptico, Lauzier et al.44 observaron que la infusión de AVP (0,04-0,2U/min) duplicó el aclaramiento de creatinina después de 24h, en comparación con ningún cambio en el grupo tratado solo con NE. El ensayo VASST, un ensayo controlado aleatorizado que comparó la NE sola con la NE más AVP a 0,03U/min en 778 pacientes con shock séptico, no mostró diferencias en el resultado primario de mortalidad41. Sin embargo, en un análisis post hoc se encontró que en los 106 pacientes clasificados en riesgo de LRA al inicio, el tratamiento con AVP se asoció a una menor tasa de progresión a insuficiencia renal y TRR45. En el ensayo VANISH, 409 pacientes con shock séptico fueron aleatorizados para recibir AVP (0,06U/min) o NE solos. Aunque no hubo diferencia en el desenlace primario (días sin insuficiencia renal), el grupo tratado con AVP requirió menos TRR (25,4 vs. 35,3%)15. Se ha propuesto que el efecto positivo de la AVP sobre la función renal se debe a la vasoconstricción selectiva de la arteriola eferente glomerular mediada por la activación del receptor V146, y por la vasodilatación de las arteriolas aferentes mediada por la activación del receptor V247.
Efectos fisiológicos de la epinefrina en pacientes con shock sépticoLos efectos cardiovasculares y renales de la epinefrina son multifacéticos y dependen de la dosis administrada; con respecto a los efectos cardíacos, la epinefrina actúa sobre los receptores adrenérgicos B-1, B-2 y a-1. A dosis bajas predomina la actividad B-1, lo que resulta en un aumento del gasto cardíaco debido a un incremento de la frecuencia cardíaca y la contractilidad miocárdica; sin embargo, a dosis más altas, la actividad a-1 se vuelve más prominente, lo que lleva a un aumento de la resistencia vascular sistémica y, por ende, de la PAM. Los efectos adversos potenciales incluyen arritmias y una circulación esplácnica deteriorada48. Además, la epinefrina puede inducir hipopotasemia y prolongación del intervalo QTc, lo que puede ser mitigado con el uso de bloqueadores beta como el propranolol49.
El uso de epinefrina en el contexto de la reanimación cardiopulmonar y el shock puede estar asociado con efectos adversos renales. Un estudio observacional encontró que dosis acumuladas más altas de epinefrina se asociaron con lesión renal aguda. En pacientes con paro cardíaco intrahospitalario, dosis de 3-4 y >5mg de epinefrina se asociaron con odds ratios ajustadas de 4,2 y 11,3, respectivamente, para desarrollar lesión renal aguda50.
Actualmente, la campaña Surviving Sepsis Campaign la recomienda como medicamento de segunda-tercera elección tras el inicio de NE en pacientes con shock séptico que no logren una PAM objetivo51. En cuanto a su impacto en el riñón, este estudio demostró que la infusión de epinefrina reduce significativamente el flujo sanguíneo renal y disminuye la conductabilidad renal (vasoconstricción renal), aumenta la producción total de orina y no afecta el aclaramiento de creatinina52.
En resumen, la epinefrina aumenta el gasto cardíaco y la presión arterial a través de sus efectos adrenérgicos, pero puede inducir arritmias y deterioro de la función renal, especialmente en dosis altas.
Efectos fisiológicos de la dopamina en pacientes con shock sépticoAl considerar el uso de la dopamina como agente vasopresor en el shock séptico es necesario tener en cuenta los posibles beneficios vs. los efectos adversos y así tomar la mejor decisión para el paciente. Se considera que la dopamina a dosis bajas (2-5μg/kg/min) presenta el llamado efecto dopa por la estimulación de los receptores dopaminérgicos D-1, que produce vasodilatación de lechos vasculares renales, cerebrales, esplácnicos y coronarios; las dosis intermedias (5-10μg/kg/min) presentan efecto sobre los receptores B-1 adrenérgicos, lo que provoca un aumento de la inotropia y, por consiguiente, del gasto cardíaco, y a dosis altas de (>10μg/kg/min) su efecto es más a-1 adrenérgico, lo que produce vasoconstricción y elevación de las resistencias vasculares sistémicas. Durante muchos años se consideró que la dosis baja producía un efecto protector renal, pero que no ha sido demostrado en estudios experimentales. El estudio SOAP II de De Backer et al. comparó el uso de dopamina vs. NE en varios tipos de shock. El estudio, con 1.679 pacientes, no evidenció diferencias en mortalidad a 28 días (52,5 vs. 48,5%, p=0,10), pero sí se evidenció un aumento de mortalidad en el subgrupo de shock cardiogénico y un aumento del riesgo de arritmias como fibrilación auricular en el grupo de dopamina (24,1 vs. 12,4%, p<0,001, NNH 9)53. Un metaanálisis realizado en 2023 por Jia et al. evidenció que la dopamina en pacientes en shock séptico presentó mayor riesgo de mortalidad a 28 días, mayor estancia en UCI y mayor riesgo de arritmias, comparada con otros vasopresores, así como con la combinación de otros vasopresores54.
ConclusiónLa AVP se une a receptores en las arteriolas eferentes glomerulares y produce vasoconstricción y aumento de la filtración glomerular, mientras que la NE se une preferentemente a los receptores a-1 de las arteriolas aferentes renales, disminuyendo así la presión de perfusión glomerular y la filtración. Estos diferentes mecanismos farmacológicos podrían explicar el beneficio potencial de la AVP en comparación con la NE sobre la función renal, por eso hay muchos ensayos clínicos que demuestran que el uso de AVP tiene un efecto favorable sobre la perfusión renal no solo en el shock séptico, sino también en el shock vasopléjico después de una cirugía cardíaca, como lo demostró el estudio VANCS (AVP vs. NE en pacientes con shock vasopléjico después de una cirugía cardíaca).
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.