La aféresis terapéutica (AT) permite eliminar del plasma moléculas asociadas a la enfermedad e interrumpir su progresión. El efluente de reemplazo para AT depende del tipo de enfermedad. Las más usadas son la albúmina (4% o 5%) y el plasma fresco congelado. Sin embargo, los expansores plasmáticos sintéticos como hidroxietil-almidón (HEA) (6%) se han utilizado en AT.
ObjetivoDescribir la experiencia con el uso de HEA (al 6%) en la unidad de cuidados intensivos (UCI) como principal efluente de reemplazo.
Materiales y métodosEstudio descriptivo retrospectivo, desde el 1 de octubre de 2014 hasta el 31 de diciembre de 2020, en una UCI de Cartagena, Colombia, en pacientes con indicación, por un nefrólogo, de inicio de AT según las guías de la Sociedad Americana de Aféresis (ASFA). La AT se realizó por filtración a través de la tecnología multifiltrate clásica (Fresenius Medical Care). El volumen de plasma se calculó mediante el método de Kaplan y la dosis de recambio plasmático fue de 1 a 1,5 veces el volumen plasmático estimado, con reemplazo isovolumétrico e isooncótico utilizando HEA al 6%, plasma fresco congelado (PFC) y cristaloides.
ResultadosDe 22 pacientes incluidos, 18 recibieron HEA al 6% como fluido de recambio principal. La mediana de edad fue de 44años (32,3-64,5). Los pacientes presentaron hipertensión (n=7 [31,8%]) y diabetes mellitus (n=3 [13,6%]). Las principales indicaciones de AT fueron el síndrome de Guillain-Barré (n=18 [81,8%]) y la miastenia gravis (n=18 [81,8%]). Las condiciones hematológicas y/o nefrológicas se registraron como indicación de AT en menor proporción (n=4 [18%]). Al 6% fue administrado en pacientes con condiciones neurológicas. Se realizaron 101 sesiones de AT: 87 con HEA al 6% y 14 con plasma fresco congelado (PFC). La seguridad de la AT con HEA al 6% se analizó con los valores de hemoglobina, recuento de plaquetas, coágulo grama y creatinina (antes y después de las sesiones de AT).
ConclusiónEl uso de HEA como líquido de reemplazo para la AT resultó ser seguro y puede ser una alternativa al uso de la albúmina al 4% o al 5% como líquido de sustitución.
Therapeutic apheresis (TA) enables the removal of disease-associated molecules from plasma, thereby halting disease progression. The replacement effluent for TA depends on the type of disease. The most used are albumin (4% or 5%) and fresh plasma. However, synthetic plasma expanders such as hydroxyethyl starch (6%) have been utilized in TA.
ObjectiveTo describe the experience with the use of hydroxyethyl starch (6%) in the intensive care unit (ICU) as the primary replacement effluent.
Materials and methodsA retrospective descriptive study was conducted from October 1, 2014, to December 31, 2020, in an ICU in Cartagena, Colombia, involving patients indicated by a nephrologist to initiate TA according to the guidelines of the American Society for Apheresis (ASFA). Therapeutic apheresis was performed by filtration using the classic multifiltrate technology (Fresenius Medical Care). Plasma volume was calculated using the Kaplan method, and the plasma exchange dose was 1 to 1.5 times the estimated plasma volume, with isovolumetric and iso-oncotic replacement using 6% hydroxyethyl starch, fresh frozen plasma (FFP), and crystalloids.
ResultsOf the 22 patients included, 18 received 6% hydroxyethyl starch as the main replacement fluid. The median age was 44years (32.3-64.5). Patients presented with hypertension (n=7 [31.8%]) and diabetes mellitus (n=3 [13.6%]). The main indications for TA were Guillain-Barré syndrome (n=18 [81.8%]) and myasthenia gravis (n=18 [81.8%]). Hematological and/or nephrological conditions were recorded as indications for TA in a smaller proportion (n=4 [18%]). Six percent hydroxyethyl starch was administered to patients with neurological conditions. A total of 101 TA sessions were performed: 87 with 6% hydroxyethyl starch and 14 with fresh frozen plasma (FFP). The safety of TA with 6% hydroxyethyl starch was analyzed using hemoglobin values, platelet count, coagulation profile, and creatinine levels (before and after TA sessions).
ConclusionThe use of HES as a replacement fluid for therapeutic apheresis proved to be safe and may be an alternative to the use of 4% or 5% albumin as a substitution fluid.
La aféresis terapéutica (AT) es un procedimiento indicado en diversos escenarios del paciente crítico que permite eliminar del plasma ciertas moléculas asociadas a enfermedades (autoanticuerpos, complejos inmunes, crioglobulinas, endotoxinas, etc.), interrumpiendo así su progresión. Es un procedimiento complejo que requiere infraestructura, equipo y personal capacitado. En muchos casos, la UCI es el único entorno clínico en el que dicha atención se puede brindar de manera efectiva en cualquier momento1.
Las características del efluente de reemplazo para AT dependerán del tipo de enfermedad para la que se realice el tratamiento. Tradicionalmente, el efluente más utilizado es la albúmina y el plasma fresco congelado2-4. Previamente, los expansores de plasma sintético, como HEA al 6%, han sido utilizados en estudios en vida real en AT, demostrando ser seguros y bien tolerados al ser comparados con albúmina2.
Como estrategia de reanimación en pacientes críticos, el uso de coloides ha sido cuestionado en la literatura por no generar mayores beneficios en comparación con los cristaloides. Los dextranos, las gelatinas y especialmente los almidones han sido seriamente cuestionados por su asociación con resultados adversos, como enfermedad renal aguda, e incluso con un posible aumento de la mortalidad. La AT sería un escenario donde los coloides sintéticos en el paciente crítico tendrían indicación sin aumento en la tasa de complicaciones, ni impacto en la mortalidad2-7. El objetivo de este trabajo fue describir la experiencia con el uso de HEA al 6% en la unidad de cuidados intensivos como principal efluente de reemplazo en una serie retrospectiva.
Materiales y métodosEstudio descriptivo retrospectivo realizado entre el 1 de octubre de 2014 y el 31 de diciembre de 2020 en una UCI de referencia en la ciudad de Cartagena, Bolívar, entre pacientes hospitalizados en la unidad de cuidados intensivos, mayores de 18años, con indicación de inicio de AT según las guías de la Sociedad Americana de Aféresis (ASFA) vigentes en el momento de la indicación. Se excluyeron los pacientes sin registro de aféresis disponible.
Variables de estudioLa información se recopiló de las historias clínicas electrónicas y los registros de las sesiones de AT. Se incluyeron variables demográficas (edad, sexo), clínicas (diagnóstico, categoría, historia personal), aspectos técnicos (número de sesiones, acceso vascular, volumen de recambio), parámetros de laboratorio (hemoglobina, plaquetas, tiempos de coagulación y creatinina), soporte en UCI (vasodilatadores, ventilación mecánica y hemodiálisis) y complicaciones durante la hospitalización (trombosis e infecciones del acceso vascular, así como lesión renal aguda; no se registraron reportes de sangrado).
Indicaciones de aféresisSe indicó AT según los criterios de las guías ASFA. Las indicaciones se clasifican en función de la evidencia disponible en el momento de publicación de las guías.
La categoría I incluye indicaciones en las que la aféresis se acepta como terapia de primera línea; en la categoríaII, la aféresis se acepta como un tratamiento solitario o en conjunto con otros tratamientos; la categoríaIII incluye los trastornos en los que no se ha establecido un papel óptimo de la terapia de aféresis, y la categoríaIV se aplica cuando se ha demostrado la ineficacia o el daño de la aféresis8.
Técnica y protocolo para la realización de aféresis terapéuticaSe utilizó AT por filtración en todos los casos, previa implantación de catéter mahurkar bilumen de 13,5Fr en vena femoral. Para el proceso de separación de la sangre en sus componentes se usó un dispositivo de alta permeabilidad, biocompatible, filtro de polisulfona Fresenius (diámetro interno de 330μm, espesor de pared 65μm, área de superficie 0,6m2). El flujo de sangre pautado varió entre 80-250ml/minuto con una fracción de filtración del 15%. Se empleó anticoagulación sistémica con heparina sódica, bolo 50-70UI/kg, continuando con una infusión de 15-18UI/kg/hora.
Volumen y fluidoPara todos los casos, el volumen de plasma se calculó por método de Kaplan y la dosis de recambio plasmático fue de 1 y 1,5 veces el volumen plasmático estimado, con reemplazo isovolumétrico e isooncótico utilizando hidroxietil-almidón (HEA) al 6%, plasma fresco congelado (PFC) y cristaloides. En nuestro protocolo se ofrece de forma rutinaria en los casos en los que no está indicado el 100% de sustitución por plasma fresco congelado o el HEA al 6%. Por otro lado, desde la segunda o tercera sesión utilizamos plasma fresco además del coloide sintético para reducir el impacto en el sistema de coagulación y así obviar la medición rutinaria del fibrinógeno y dar un mayor margen de seguridad a la técnica.
Frecuencia y seguimiento de las sesionesLa frecuencia de los intercambios se realizó de acuerdo con la indicación del médico nefrólogo, y se monitorizaron los parámetros clínicos y de laboratorio durante toda la terapia (frecuencia cardiaca, presión arterial, temperatura, frecuencia respiratoria, diuresis, función renal, hemoglobina, plaquetas y tiempos de coagulación). Se utilizó gluconato de calcio por protocolo 1gramo al inicio y 1gramo al final de cada sesión para prevenir hipocalcemia; el número total de reemplazos y la duración total de la terapia dependían de la indicación para realizar el procedimiento. Para el seguimiento de la terapia se indicaron controles de hemograma, tiempos de coagulación y ocasionalmente, según disponibilidad, fibrinógeno. No se emplearon las diferentes pruebas recomendadas de manera tradicional, dada su baja disponibilidad en las instituciones participantes.
Análisis estadísticoLas variables cualitativas se expresaron en términos de frecuencia absoluta y relativa. Las variables cuantitativas se presentaron con medidas de tendencia central (mediana o media en función de su distribución) con sus respectivas medidas de dispersión (RIC, DE). Los pacientes se dividieron en dos grupos según el tipo de líquido principalmente utilizado durante las diferentes sesiones de AT. El análisis de hipótesis se utilizó para la prueba de suma de rango de variables continuas y para la prueba categórica de χ2 y la prueba exacta de Fisher, según fuera necesario. El paquete estadístico utilizado fue Stata versión 15.0.
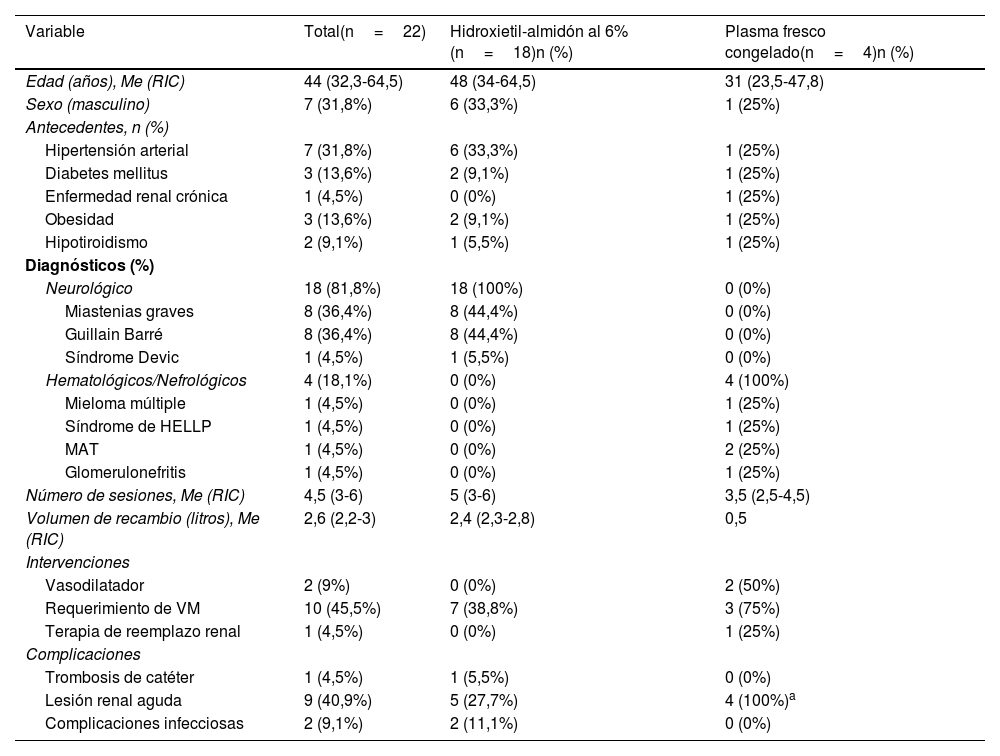
ResultadosSe incluyó un total de 22 pacientes durante el periodo de estudio, de los cuales 18 recibieron HEA al 6% como fluido de recambio principal durante las sesiones de AT. Se realizaron un total de 101 sesiones de plasmaféresis: 87 con HEA al 6% y 14 con plasma fresco congelado (PFC). La mediana de edad fue de 44 (32,3-64,5) años. La hipertensión (n=7 [31,8%]) y la diabetes mellitus (n=3 [13,6%]) fueron las comorbilidades más frecuentes (tabla 1).
Variables demográficas y clínicas
| Variable | Total(n=22) | Hidroxietil-almidón al 6%(n=18)n (%) | Plasma fresco congelado(n=4)n (%) |
|---|---|---|---|
| Edad (años), Me (RIC) | 44 (32,3-64,5) | 48 (34-64,5) | 31 (23,5-47,8) |
| Sexo (masculino) | 7 (31,8%) | 6 (33,3%) | 1 (25%) |
| Antecedentes, n (%) | |||
| Hipertensión arterial | 7 (31,8%) | 6 (33,3%) | 1 (25%) |
| Diabetes mellitus | 3 (13,6%) | 2 (9,1%) | 1 (25%) |
| Enfermedad renal crónica | 1 (4,5%) | 0 (0%) | 1 (25%) |
| Obesidad | 3 (13,6%) | 2 (9,1%) | 1 (25%) |
| Hipotiroidismo | 2 (9,1%) | 1 (5,5%) | 1 (25%) |
| Diagnósticos (%) | |||
| Neurológico | 18 (81,8%) | 18 (100%) | 0 (0%) |
| Miastenias graves | 8 (36,4%) | 8 (44,4%) | 0 (0%) |
| Guillain Barré | 8 (36,4%) | 8 (44,4%) | 0 (0%) |
| Síndrome Devic | 1 (4,5%) | 1 (5,5%) | 0 (0%) |
| Hematológicos/Nefrológicos | 4 (18,1%) | 0 (0%) | 4 (100%) |
| Mieloma múltiple | 1 (4,5%) | 0 (0%) | 1 (25%) |
| Síndrome de HELLP | 1 (4,5%) | 0 (0%) | 1 (25%) |
| MAT | 1 (4,5%) | 0 (0%) | 2 (25%) |
| Glomerulonefritis | 1 (4,5%) | 0 (0%) | 1 (25%) |
| Número de sesiones, Me (RIC) | 4,5 (3-6) | 5 (3-6) | 3,5 (2,5-4,5) |
| Volumen de recambio (litros), Me (RIC) | 2,6 (2,2-3) | 2,4 (2,3-2,8) | 0,5 |
| Intervenciones | |||
| Vasodilatador | 2 (9%) | 0 (0%) | 2 (50%) |
| Requerimiento de VM | 10 (45,5%) | 7 (38,8%) | 3 (75%) |
| Terapia de reemplazo renal | 1 (4,5%) | 0 (0%) | 1 (25%) |
| Complicaciones | |||
| Trombosis de catéter | 1 (4,5%) | 1 (5,5%) | 0 (0%) |
| Lesión renal aguda | 9 (40,9%) | 5 (27,7%) | 4 (100%)a |
| Complicaciones infecciosas | 2 (9,1%) | 2 (11,1%) | 0 (0%) |
Para analizar el perfil de los pacientes que recibieron HEA al 6% se conformaron dos grupos. El primer grupo recibió HEA al 6%, y el segundo grupo, PFC, como efluente principal (tabla 1). Las condiciones neurológicas fueron la principal indicación de AT, el síndrome de Guillain-Barré (n=18 [81,8%]) y la miastenia gravis (n=8 [36,4%]). Las condiciones hematológicas y/o nefrológicas (n=4 [18%]), incluyendo mieloma múltiple, síndrome de HELLP, microangiopatía trombótica (MAT) y glomerulonefritis, se registraron en menor proporción, con un caso de cada condición (n=1 [4,5%]). Todas las indicaciones de aféresis correspondieron a la categoríaI de las guías ASFA. El 100% de los pacientes con condiciones neurológicas recibieron HEA al 6%.
En todos los casos, el catéter implantado para la sesión de AT fue a través de abordaje femoral; la mediana del volumen por cada sesión fue de 2,6litros (RIC: 2,2-3). La mediana de sesiones realizadas en ambos grupos fue de 4,5 (RIC: 3-6), siendo el número de sesiones en el grupo de HEA al 6% de 5 (RIC: 3-6).
El soporte vital en UCI se describe en la tabla 1, incluyendo el requerimiento de vasodilatadores, ventilación mecánica y terapia de reemplazo renal. Al final de la hospitalización, dos pacientes fallecieron, uno en cada grupo.
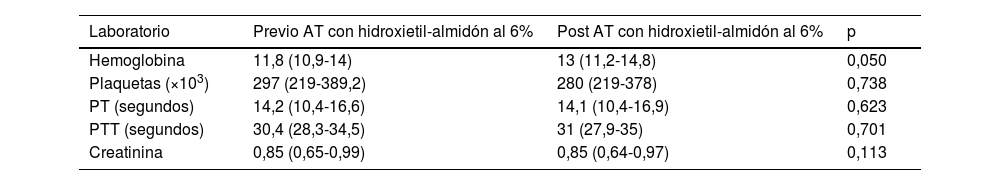
La seguridad de la AT con HEA al 6% se analizó mediante parámetros de laboratorio, describiendo la mediana en los niveles de hemoglobina, recuento de plaquetas y coagulograma antes y después de la sesión de AT (tabla 2).
Características de laboratorio durante las sesiones AT previo y post administración hidroxietil-almidón al 6%
| Laboratorio | Previo AT con hidroxietil-almidón al 6% | Post AT con hidroxietil-almidón al 6% | p |
|---|---|---|---|
| Hemoglobina | 11,8 (10,9-14) | 13 (11,2-14,8) | 0,050 |
| Plaquetas (×103) | 297 (219-389,2) | 280 (219-378) | 0,738 |
| PT (segundos) | 14,2 (10,4-16,6) | 14,1 (10,4-16,9) | 0,623 |
| PTT (segundos) | 30,4 (28,3-34,5) | 31 (27,9-35) | 0,701 |
| Creatinina | 0,85 (0,65-0,99) | 0,85 (0,64-0,97) | 0,113 |
Este es, a nuestro conocimiento, el primer estudio realizado en Colombia sobre la experiencia en AT utilizando HEA al 6% como fluido principal de recambio en pacientes hospitalizados en la UCI. El uso de coloides como estrategia de reanimación en pacientes críticos ha sido cuestionado en la literatura debido a su asociación con resultados adversos, como insuficiencia renal e incluso un posible aumento de la mortalidad3. La mayor preocupación se ha centrado en el uso de soluciones concentradas de HEA (10%) (peso molecular de más de 200kD) y una relación de sustitución molar (el número de hidroxigrupos etílicos por molécula de glucosa de más de 0,5). Las soluciones HEA de uso común tienen una concentración más baja (6%) (peso molecular de 130kD y relaciones de sustitución molar de 0,38 a 0,45)7,9, y podrían ser usadas en la AT; sin embargo, la experiencia a la fecha sigue siendo muy reducida2,10.
La preocupación en cuidado intensivo por el HEA aumentó debido a una relación de mortalidad en pacientes con sepsis y shock séptico y la necesidad de reemplazo renal entre tratados con HEA al 6%4,5,7,9. Zarychanski et al. demostraron una relación significativa entre la administración de HEA al 6% y el riesgo de requerir terapia de reemplazo renal (RR, 1,32; IC95%: 1,15 a 1,50; I 2, 0%; AR, 3,12%; IC95%: 0,47% a 5,78%) en comparación con otros fluidos5. Por el contrario, Pagano et al.11 examinaron los efectos secundarios de HEA en pacientes que se sometieron a AT, comparando la función renal de pacientes que recibieron AT con y sin HEA, sin observar diferencias significativas en la función renal en ambos grupos9. En este estudio se analizaron los niveles de creatinina antes y después de las sesiones de AT en el grupo de HEA, sin diferencias en su comportamiento.
El líquido de reemplazo más utilizado según la literatura médica es albúmina al 5%. El uso de plasma como líquido de reemplazo generalmente se reserva para el tratamiento de la púrpura trombocitopénica trombótica o a pacientes con coagulopatía subyacente. En el caso de niveles bajo de fibrinógeno (<100-120mg/dl) se administra crioprecipitado y se puede incorporar plasma como parte del líquido de reemplazo12.
Estrategias como el uso HEA combinado con PFC se han utilizado para prevenir la coagulopatía, al igual que el uso de albúmina con HEA; en este último caso con reducción de costos, sin aumento en alteraciones hematológicas6. Los objetivos del fluido son evitar el riesgo de hipovolemia y cambios bruscos en la presión oncótica, además de reponer factores o sustancias en el plasma del paciente, y, no menos importante, mantener en rangos fisiológicos los niveles séricos de factores de coagulación; el HEA al 6% puede ser usado en aquellos pacientes en los que no está indicado el 100% de sustitución por plasma fresco congelado, por ejemplo, en las condiciones neurológicas.
En este estudio las patologías neurológicas fueron el escenario principal para el uso de HEA. La AT es un procedimiento que se usa comúnmente en muchos trastornos neurológicos de etiología autoinmune, a pesar de la alternativa de las inmunoglobulinas intravenosas (IGIV) (mayor disponibilidad y facilidad de uso), gracias a la capacidad de la AT para eliminar mediadores inflamatorios patógenos (autoanticuerpos, complemento y citoquinas)13.
Por otro lado, en lo relacionado con los costos de los líquidos de sustitución para estas terapias, en Colombia no contamos con estudios de costos haciendo comparaciones directas entre los distintos líquidos; sin embargo, si tomamos a un individuo promedio de 70kg y considerando los costos directos de los líquidos de sustitución, con el uso de HEA la plasmaféresis es mucho más económica en comparación a realizar el procedimiento usando albúmina al 4% o al 5%. En valores, en Colombia, el costo por sesión de plasmaféresis bajo estas condiciones usando HEA como líquido de sustitución puede costar alrededor de 400UDS comparado con el costo por sesión de plasmaféresis usando albúmina al 4% o al 5%, el cual puede incrementarse mínimo hasta en un 50%. Necesitamos estudios comparativos que puedan confirmar estos posibles escenarios.
La principal limitación del estudio es que se trata de un estudio retrospectivo de un único centro con una muestra reducida. Esta limitación puede afectar a la generalización de los resultados a otras poblaciones y entornos clínicos. Además, no se pudo evaluar la respuesta clínica debido a la ausencia de seguimiento a largo plazo de los pacientes. Es importante considerar estas limitaciones al interpretar los resultados del estudio y al planificar futuros estudios.
ConclusiónLa presente serie puede facilitar la indicación rápida y la decisión para iniciar el recambio plasmático con hidroxietil-almidón (HEA) en pacientes críticos, sin cambios agudos en parámetros hematológicos y renales. El uso de HEA como líquido de reemplazo para la aféresis terapéutica resultó ser seguro y puede ser una alternativa de menor coste económico en comparación con el uso de albúmina al 4% o al 5% como líquido de sustitución. En consecuencia, el uso de HEA podría ser una alternativa segura y probablemente más económica respecto al uso de albúmina al 5% en pacientes con bajo riesgo de daño renal (patología neurológica), permitiendo una rápida implementación en un entorno de pacientes críticos.
Conflicto de interesesMaría José Soler ha recibido honorarios por conferencias y consultoría de Novo Nordisk, Jansen, Mundipharma, AstraZeneca, Esteve, Fresenius, Eli Lilly, Boehringer-Ingelheim, Vifor, ICU, Pfizer, Bayer, Travere Therapeutics, GE Healthcare, GSK, MEDICE, ProKidney y Otsuka. También es una de las ex editoras jefes de CKJ. Actualmente es miembro del consejo editorial de las revistas de la Sociedad Americana de Nefrología (ASN). Todo ello, fuera del trabajo presentado.
Jorge Rico-Fontalvo ha sido conferencista en los últimos 5 años para Fresenius Medical Care, Astra Zeneca, Boehringer Ingelheim, Novo Nordisk, Lilly, Sanofi, Novartis, Abbvie, Merck y Bayer. Ha participado en Advisory Board con AZ, Boehringer Ingelheim, Lilly, Bayer y Novo Nordisk. Todo ello, fuera del trabajo presentado.
Natalia Ramos Terrades ha recibido honorarios por conferencias y consultoría de Alexion, todos ellos fuera del trabajo enviado.
Diana Borré-Naranjo ha sido conferencista para Alexion-Astrazeneca y Sanofi para microangiopatias trombóticas.
José Rojas-Suárez ha sido conferencista para Alexion-Astrazeneca y Sanofi para microangiopatias trombóticas.
El resto de autores declaran no tener ningún conflicto de intereses.