El síndrome de obesidad-hipoventilación asociado a la COVID-19 conduce rápidamente a la insuficiencia respiratoria aguda severa con la necesidad de ventilación mecánica invasiva, convirtiéndose en un reto terapéutico hacia el personal del cuidado intensivo debido a la ausencia de estrategias ventilatorias. A continuación se expone el caso de un paciente masculino de 51 años con antecedentes de síndrome de Pickwick que presentó neumonía grave por SARS-CoV-2, el cual progresa tempranamente a un síndrome de dificultad respiratoria aguda grave requiriendo soporte mecánico ventilatorio invasivo con presión positiva y la necesidad de soporte vasoactivo, cursando además con un síndrome de obesidad-hipoventilación de fenotipo maligno. En base a lo anterior se realiza una propuesta de manejo clínico institucional basado en la literatura científica actual del síndrome de obesidad-hipoventilación y neumonía grave secundario a SARS-CoV-2. A pesar de la alta mortalidad relacionada con la COVID-19 y la dificultad presentada durante la ventilación mecánica invasiva, el desenlace final del paciente fue favorable.
Obesity-hypoventilation syndrome associated with COVID-19 rapidly leads to severe acute respiratory failure with the need for invasive mechanical ventilation, becoming a therapeutic challenge for intensive care personnel due to the absence of ventilatory strategies. The following is the case of a 51-year-old male patient with a history of Pickwickian syndrome who presented with severe SARS-CoV-2 pneumonia, which progressed early to severe acute respiratory distress syndrome requiring invasive mechanical ventilatory support with positive pressure, and the need for vasoactive support, also presenting with a malignant phenotype obesity-hypoventilation syndrome. Based on the above, we make a clinical management proposal based on the current scientific literature on obesity-hypoventilation syndrome and severe pneumonia secondary to SARS-CoV-2. Despite the high mortality related to COVID-19 and the difficulty presented during invasive mechanical ventilation, the patient's outcome was favourable.
Durante la pandemia por la enfermedad del coronavirus 2019 (COVID-19), la obesidad ha sido considerada un problema de salud pública global y agravante de patologías respiratorias1. Esto favorece a un aumento de 3 veces la presencia de enfermedad grave en pacientes con COVID-19 y un incremento en las tasas de morbimortalidad en pacientes críticamente enfermos dentro de las Unidades de Cuidados Intensivos (UCI)2. Dentro de la obesidad, el síndrome de obesidad-hipoventilación (SOH) o síndrome de Pickwick, es una de las patologías que afectan la dinámica respiratoria3. Además, conlleva mayores dificultades en el manejo (hipoventilación, requerimiento de intubación orotraqueal y retiro de soporte ventilatorio mecánico invasivo) lo que prolonga la estancia hospitalaria4.
A continuación, se presenta un caso de SOH que progresa a un fenotipo maligno secundario a neumonía grave por el coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2). Además, se realiza una propuesta de manejo clínico institucional basado en la literatura científica actual de estas entidades.
Presentación de casoPaciente masculino de 51 años, con antecedentes de SOH y alergia a corticoides; ingresa al servicio de urgencias con cuadro clínico de 6 días de evolución caracterizado por tos seca no productiva, disgeusia y disnea en reposo grado 3 según la modified Medical Research Council (mMRC). Al examen físico presentó obesidad tipo iii según la Organización Mundial de la Salud con índice de masa corporal de 46kg/m2, Glasgow (15/15), cifras tensionales en 144/75mmHg, frecuencia cardiaca de 87 latidos/min, frecuencia respiratoria de 25 respiraciones/min y saturación de oxígeno de pulso (SpO2) en 74% al aire ambiente, por lo que requirió soporte de oxígeno suplementario por máscara de no reinhalación con fracción inspirada de oxígeno (FiO2) a 15L/min, mejorando SpO2 a 94%. Ante riesgo de claudicación respiratoria, deterioro hemodinámico y presencia de SOH de fenotipo maligno por Sequential Organ Failure Assessment (SOFA)>2 puntos, se decidió el traslado a la UCI.
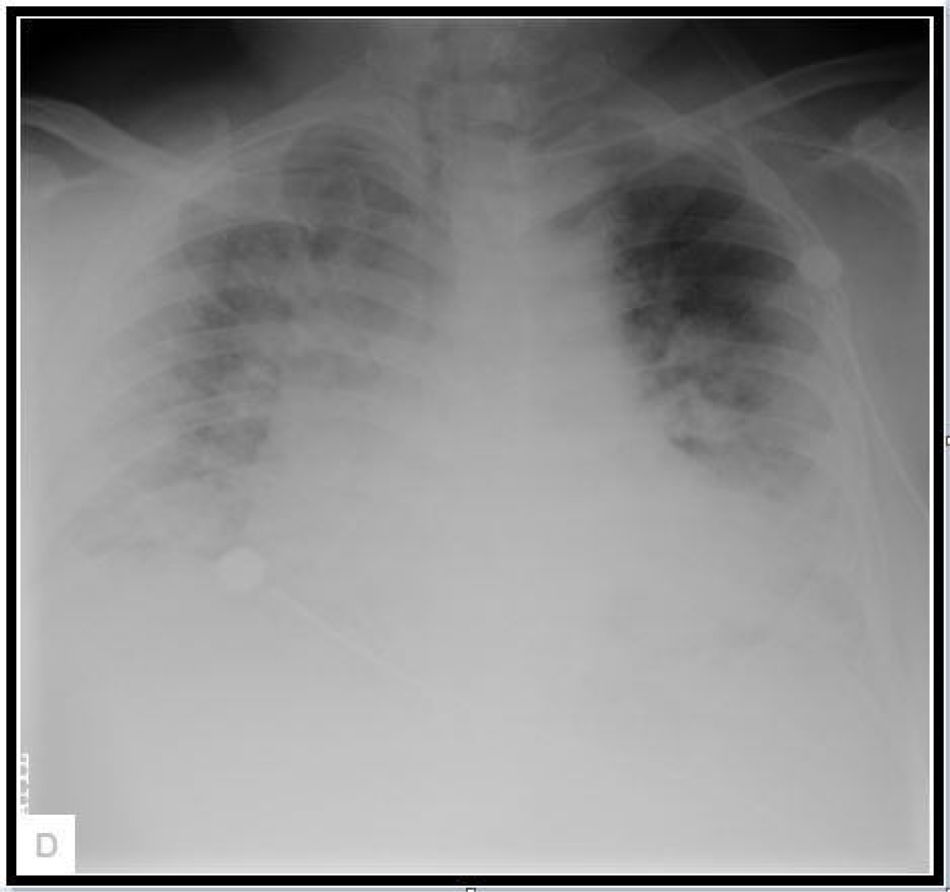
En la radiografía de tórax inicial se evidenció infiltrados alveolares intersticiales difusos bilaterales (fig. 1), sugerente de infección por SARS-CoV-2, confirmada 48h después con prueba de RT-PCR. Los paraclínicos reportaron aumento de marcadores pronósticos, leucocitosis y linfopenia (tabla 1). Debido a estos hallazgos y al riesgo de coinfección bacteriana (CURB-65 2 puntos) se inició terapia antibiótica empírica intravenosa con un macrólido y una cefalosporina de cuarta generación.
Evolución hemática, gasométrica y ventilatoria durante la estancia en UCI
| Parámetros hemáticos, gasométricos y monitorización ventilatoria | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Días de hospitalización | Día 1 | Día 2 | Día 3 | Día 4 | Día 5 | Día 6 | Día 7 | Día 8 | Día 9 | Día 10 | Día 11 | Día 12 | Día 13 | Día 14 | Día 15 |
| Dímero D (ng/mL) | 2000 | - | - | 1875 | 387 | - | - | 425,1 | - | 525 | 498,1 | - | - | 312,5 | |
| Ferritina (ng/mL) | 998,2 | - | - | 1098,1 | >2000 | - | - | 1503 | - | 528,31 | 786,9 | - | - | 573,1 | |
| LDH | 416,2 | - | - | 406,1 | 386,6 | - | - | 225,2 | - | 274,1 | 250,4 | - | - | 198,2 | |
| Leucocitos (103/mm3) | 7,19 | 7,46 | 8,19 | 7,83 | 7,53 | 7,06 | 10,60 | 11,3 | 14,50 | 13 | 13,30 | 15,30 | 13,40 | 12,1 | 10,90 |
| Linfocitos (%) | 23,40 | 23,6 | 19,20 | 7,15 | 11,10 | 19,20 | 7,72 | 6,20 | 3,93 | 9,99 | 6,05 | 5,06 | 5,81 | 7,22 | 12,10 |
| Hemoglobina (g/dl) | 13,60 | 13,70 | 13 | 13 | 13,1 | 17,10 | 12,40 | 12,70 | 12,80 | 13 | 12,70 | 12,30 | 11,90 | 11,90 | 12 |
| Plaquetas (103/mm3) | 194 | 232 | 283 | 307 | 290 | 284 | 376 | 377 | 379 | 296 | 248 | 220 | 222 | 229 | 223 |
| Bilirrubina total (mg/dl) | 0,50 | - | - | 0,62 | 0,71 | - | - | 0,63 | - | 0,4 | 0,34 | - | - | 0,21 | |
| ALT (U/L) | 23,2 | - | - | 71,6 | 67,1 | - | - | 54,8 | - | 58,1 | 46,5 | - | - | 28,6 | |
| AST (U/L) | 18,7 | - | - | 53,1 | 41,3 | - | - | 32,9 | - | 37,6 | 30,4 | - | - | 19,2 | |
| Creatinina (mg/dl) | 0,68 | 0,67 | 0,75 | 0,93 | 0,91 | 0,83 | 0,82 | 0,81 | 0,62 | 0,65 | 0,65 | 0,68 | 0,63 | 0,67 | 0,60 |
| BUN (mg/dl) | 8,06 | 8,62 | 12,74 | 20,22 | 19,54 | 29,56 | 29 | 29,30 | 31 | 31 | 24,74 | 19 | 17,2 | 16,1 | 18,18 |
| PaO2 (mmHg) | 66,9 | 91,5 | 68,6 | 62,6 | 189,7 | 102,9 | 132,9 | 202 | 137,4 | 150,1 | 165,8 | 223,5 | 109 | 98 | 91,2 |
| PaCO2(mmHg) | 41 | 42 | 48,6 | 39,9 | 47,7 | 50 | 45 | 53 | 52,9 | 54,3 | 47,4 | 51,8 | 50,2 | 48,2 | 45,1 |
| PaO2/ FiO2(mmHg) | 88,6 | 91,5 | 68,6 | 62,6 | 189,7 | 113 | 132,9 | 202 | 195,7 | 250 | 275 | 447 | 363,3 | 326,6 | 304 |
| PEEP (cmH20) | - | 12 | 12 | 14 | 14 | 14 | 16 | 16 | 13 | 13 | 11 | 8 | - | - | - |
| FiO2 (L/min) | 15 | 15 | 15 | 15 | 15 | 12 | 15 | 15 | 10 | 9 | 8 | 7 | 6 | 4 | 3 |
ALT: alanina aminotransferasa; AST: aspartato aminotrasferasa; BUN: nitrógeno ureico; FiO2: fracción inspirada de oxígeno; LDH: lactato deshidrogenasa; PaCO2: presión parcial de dióxido de carbono; PaO2: presión parcial de oxígeno; PaO2/FiO2: presión parcial de oxígeno/Fracción inspirada de oxígeno; PEEP: presión positiva al final de la espiración.
Después de 20h, comienza con síndrome de dificultad respiratoria aguda (SDRA) grave según consenso de Berlín con cociente PaO2/FiO2<100mmHg, por lo cual se procede a proteger la vía aérea a través de ventilación mecánica invasiva (VMI) con presión positiva. Se consideró una vía aérea difícil debido a la presencia de factores asociados como: cuello corto, circunferencia de cuello>40cm, pobre protrusión mandibular y distancia tiromentoniana<7cm. De igual manera se tomó muestra de cultivo por aspirado de secreción bronquial.
A pesar de tener VMI, con niveles elevados de presión positiva al final de la espiración (PEEP)>15 cmH2O, presión de conducción<14cmH2O y FiO2 a 15L/min, persistió con un trastorno significativo de la oxigenación con PaO2/FiO2<150mmHg e hipercapnia PaCO2>50mmHg (tabla 1). Por otro lado, el paciente presentó hipotensión arterial sistémica, oliguria (<0,5cc/kg/h) por lo que requirió soporte inotrópico positivo y la necesidad de diuréticos de asa a dosis baja. Se solicitó ecocardiografía Doppler transtorácica que reportó signos indirectos de Hipertensión Arterial Pulmonar (HAP) grupo 3 según la Sociedad Europea de Cardiología y la Sociedad Europea Respiratoria.
En el cultivo de secreción bronquial, se reportó el aislamiento microbiológico de Staphylococcus aureus resistente a meticilina, escalonando la terapia antibiótica a vancomicina y meropenem por riesgo a Pseudomonas aeruginosa. Al quinto día, persistió con niveles elevados de PEEP>15 cmH2O, FiO2 a 15L/min y deterioro respiratorio por hipercapnia no permisiva (PaCO2>55mmHg), por lo que se ajustó relación inspiración/espiración con mejoría 48h después de su dinámica respiratoria por PaCO2 (45-50mmHg) y aumento de PaO2/FiO2>150mmHg. De igual manera se disminuyó progresivamente la PEEP<13cmH2O, FiO2<10L/min, así como el retiro de soporte inotrópico y mejoría de función renal. Tres días después, se inicia el proceso de destete ventilatorio efectuado exitosamente.
Finalmente, evolucionó a un síndrome confusional agudo de tipo hiperactivo de etiología múltiple según el manual diagnóstico y estadístico de los trastornos mentales 5 (DSM-V) por lo que se inició haloperidol por horario con adecuada adherencia clínica. Ante buen progreso clínico y una dinámica ventilatoria espontánea con venturi a 6L/min, se obtuvo una PaO2/FiO2>300mmHg y PaCO2 entre 40 y 45mmHg, por lo que se decidió traslado a sala de hospitalización general y egreso hospitalario 12 días después.
DiscusiónSegún la Sociedad Americana de Tórax el SOH se describe como la presencia de obesidad (índice de masa corporal≥30kg/m2), trastornos respiratorios del sueño e hipercapnia diurna despierto (PaCO2 en reposo≥45mmHg a nivel del mar) en ausencia de patología que explique la hipoventilación3. Por otro lado, su fenotipo maligno se caracteriza por la presencia de SOFA≥2 puntos5. Aunque se desconoce la prevalencia global, se ha relacionado con aumento de la tasa de morbimortalidad y la necesidad de hospitalización en UCI4.
En nuestro caso, la coexistencia del SOH maligno y la COVID-19 delimitó un curso clínico de gravedad, lo que culminó en la insuficiencia respiratoria aguda tipo ii, necesidad de VMI con niveles de PEEP>15 cmH2O y FiO2 a 15 L/min, e hipercapnia no permisiva con PaCO2>55mmHg. Problemática similar a lo reportado por Huang et al. donde los niveles de PaCO2 permanecieron elevados a pesar de ajustes en la terapia de oxigenación1. Esto se explica por la poca capacidad de volumen pulmonar, responsable de la hipoventilación alveolar y la disminución de la sensibilidad de los quimiorreceptores de PaCO2, ocasionando retención y problemas en su eliminación2.
En pacientes con SDRA sometidos a VMI, la hipercapnia genera un aumento del cortocircuito pulmonar, creando zonas de West 3, así como vasoconstricción capilar pulmonar e incremento de la poscarga del ventrículo derecho, lo que favorece a la presencia de HAP y cor pulmonale agudo, presente en el 50% de los pacientes con SOH2. De igual manera, la hipercapnia aumenta el riesgo de disfunción diafragmática y el tiempo de destete ventilatorio como se evidenció en este caso6.
En nuestro paciente se evidenció la existencia de cor pulmonale agudo, el cual pudo estar asociado a SOH o desencadenado por los altos niveles de PEEP>15 cmH2O 2, coinfección bacteriana en el tracto respiratorio inferior e hipercapnia refractaria. Estas condiciones clínicas favorecieron el requerimiento de uso de soporte inotrópico positivo progresando a un SOH de fenotipo maligno, por lo que se estableció una situación poco caracterizada y potencialmente fatal. La relación entre la presencia de HAP y COVID-19 aún no está clara, sin embargo, en los pacientes con HAP severa se evidencia una disminución en la expresión de la enzima convertidora de angiotensina tipo 2, lo que podría explicar la baja mortalidad de los pacientes con infección por SARS-CoV-2, como se presentó en nuestro caso7. Además, el fenómeno conocido como «paradoja de la obesidad», en pacientes con SDRA y VMI aumenta la morbilidad, pero parece proteger contra la mortalidad6.
En pacientes con hipercapnia (PaCO2≥50mmHg), Nin et al. observaron observó un aumento en la disfunción renal, cardiovascular, así como una menor PaO2/FiO2<150 y un incremento significativo de la mortalidad en UCI (62,5%; n=1899)8. Estos hallazgos son compatibles con lo reportado por Tiruvoipati et al. donde se observó un aumento significativo en la mortalidad en los pacientes que desarrollaron acidosis hipercápnica (pH<7,35 y PaCO2>45mmHg) en las primeras 24h de la ventilación mecánica, comparados con aquellos con normocapnia y pH normal (pH 7,35-7,45 y PaCO2 35-45mmHg)9.
Según lo reportado por Yang et al. la hipercapnia se asocia a mayor gravedad en pacientes con neumonía grave por COVID-19, así como el aumento en la necesidad de VMI10. Esto es debido a que durante el SDRA y el estado protrombótico secundario a la COVID-19 se afectan las células endoteliales alveolares, lo cual provoca mayor derivación de CO2 y aumento en las especies reactivas de oxígeno8. Esto favorece la lesión pulmonar, reducción en los procesos de reparación celular y suprime las respuestas inmunitarias innatas como adaptativas, lo que intensifica la susceptibilidad a procesos infecciosos coexistentes9.
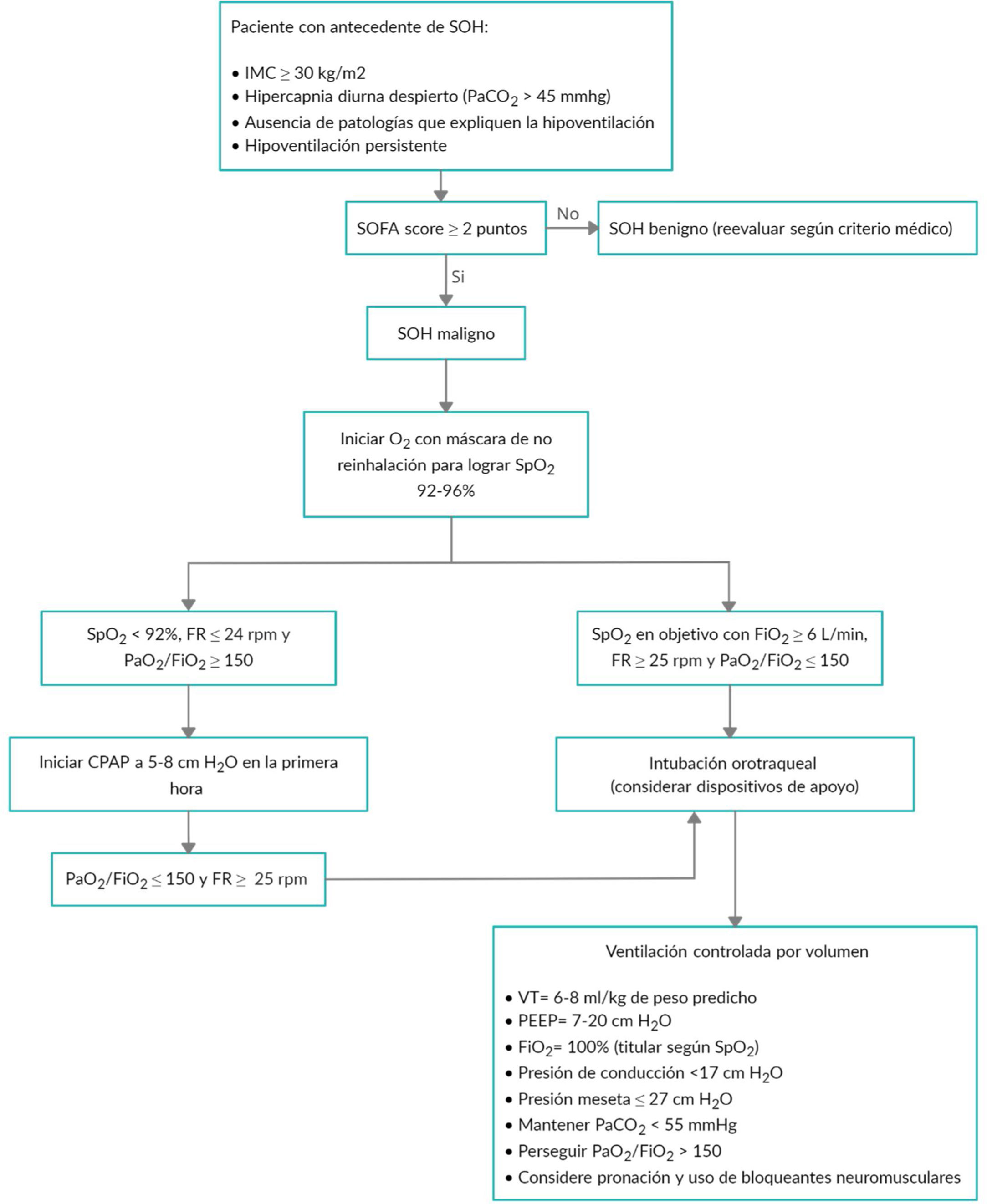
Propuesta de manejoEl abordaje ventilatorio del SOH maligno durante la COVID-19 es poco evidenciado en la literatura actual, lo que lleva a la necesidad de diseñar este algoritmo de manejo (fig. 2). En primer lugar, en pacientes con SOH que ingresan a la UCI se debe valorar la estrategia de evaluación en falla multiorgánica a través del puntaje SOFA5. Si el paciente cumple con 2 o más puntos se considera que cursa con disfunción orgánica y SOH maligno. Marik et al. observaron que un 75-86% de los pacientes con SOH maligno admitidos en la UCI son diagnosticados erróneamente, lo que dificulta recibir una ventilación adecuada5.
Algoritmo de manejo para la insuficiencia respiratoria aguda en la enfermedad por coronavirus 2019 (COVID-19) y el síndrome de obesidad-hipoventilación maligno.
CPAP: presión positiva continua en la vía respiratoria; FiO2: fracción inspirada de oxígeno; FR: frecuencia respiratoria; IMC: índice de masa corporal; O2: oxígeno; PaCO2: presión parcial de dióxido de carbono; rpm: respiraciones por minuto; PaO2/FiO2: presión parcial de oxígeno/Fracción inspirada de oxígeno; PEEP: Presión positiva al final de la espiración; SARS-CoV-2; infección por el coronavirus 2 del síndrome respiratorio agudo grave; SOFA: Sequential Organ Failure Assessment Score; SOH: síndrome de obesidad-hipoventilación; SpO2: saturación de oxígeno de pulso; VT: Volumen corriente.
El manejo inicial consiste en mejorar la ventilación alveolar y la permeabilidad de las vías respiratorias8. Se recomienda el uso de oxígeno por máscara de no reinhalación para mantener SpO2 (92-96%). En pacientes clínicamente estables, PaCO2<55mmHg y SpO2<92%, el tratamiento de elección consiste en la aplicación de presión positiva continua en las vías respiratorias3,5. Si la respuesta clínica no es favorable se debe proceder a proteger la vía aérea con intubación orotraqueal. Se propone utilizar ventilación mecánica protectora en modo controlado por volumen, con el objetivo de obtener una mejor oxigenación y responder ante los retos ventilatorios que se presenten durante su utilización (fig. 2).
ConclusionesLa coexistencia del SOH maligno, hipercapnia no permisiva y la COVID-19 puede delimitar un curso clínico de gravedad en pacientes críticamente enfermos. Por lo tanto, uno de los pilares de manejo incluye el uso de distintas terapias de oxigenación, con la finalidad de proporcionar un adecuado soporte respiratorio y mejorar el intercambio de gases. Es imperativo establecer y hacer uso de protocolos de atención institucionales, como se planteó en este manuscrito con el objetivo de responder ante los retos clínicos y así impactar en una evolución positiva.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.