El SDRA es una alteración entre el capilar y el alvéolo por un proceso inflamatorio acompañado de una lesión pulmonar. El soporte ventilatorio durante el SDRA busca estabilizar la situación clínica; sin embargo, puede condicionar alteraciones y complicaciones. Lo ideal es aplicar VM buscando evitar estos efectos adversos, además de mejorar la oxigenación y dar tiempo para el manejo de la causa primaria. Así pues, las estrategias de protección pulmonar buscan minimizar el daño pulmonar, con volúmenes y presiones de ventilación más bajos. El daño puede ser a nivel pulmonar y diafragmático con ventilación invasiva y no invasiva, y esto aumenta la morbimortalidad de pacientes en la UCI. El objetivo de este trabajo es revisar los conceptos de ventilación mecánica protectora a nivel pulmonar y diafragmática incluyendo las estrategias de manejo, además de evaluar los predictores que modifiquen la generación de estas complicaciones, así como su repercusión en la mortalidad.
ARDS is an alteration between the capillary and the alveolus due to an inflammatory process accompanied by lung injury. Ventilatory support during ARDS seeks to stabilize the clinical situation, however, it can cause alterations and complications. The ideal is to apply VM seeking to avoid these adverse effects, in addition to improving oxygenation and giving time to manage the primary cause. Therefore, lung protection strategies seek to minimize lung damage, with lower ventilation volumes and pressures. The damage can be at the pulmonary and diaphragmatic level with invasive and non-invasive ventilation, this increases the morbidity and mortality of patients in the ICU. The objective of this work is to review the concepts of protective mechanical ventilation at the pulmonary and diaphragmatic level, including management strategies, in addition to evaluating the predictors that modify the generation of these complications and their impact on mortality.
El síndrome de distrés respiratorio agudo (SDRA) es una alteración entre el capilar y el alvéolo por un proceso inflamatorio acompañado de una lesión pulmonar, y puede ser desencadenado por un proceso infeccioso respiratorio y no respiratorio, transfusiones, trauma, quemaduras o choque1.
El soporte ventilatorio durante el SDRA busca estabilizar la situación hemodinámica, mantener la sincronía y evitar la hiperinflación dinámica manteniendo una adecuada oxigenación2. Durante la ventilación mecánica (VM) puede condicionar alteraciones y complicaciones, las cuales pueden ser secundarias a la presión transpulmonar excesiva y a la variación de la presión pleural3.
Lo ideal es aplicar VM buscando evitar estos efectos adversos, además de mejorar la oxigenación y dar tiempo para el manejo de la causa primaria del SDRA, como por ejemplo manejo antibiótico del foco infeccioso respiratorio, o control de la fuente de un foco no respiratorio.
Cabe recordar que el SDRA puede ser precipitado por una variedad de causas, incluyendo infecciosas y no infecciosas. Las no infecciosas pueden lesionar el pulmón directamente debido a inflamación local, o indirectamente como resultado de inflamación sistémica y lesión por mediadores4. En 2018, el cigarro electrónico y la lesión pulmonar asociada al vapeo han emergido como causas de SDRA. La neumonía de etiología viral se ha reconocido como una causa de SDRA, incluyendo SARS-CoV (2003), influenza H1N1 (2009), MERS-CoV (2012) y SARS-CoV-2 (2019)5.
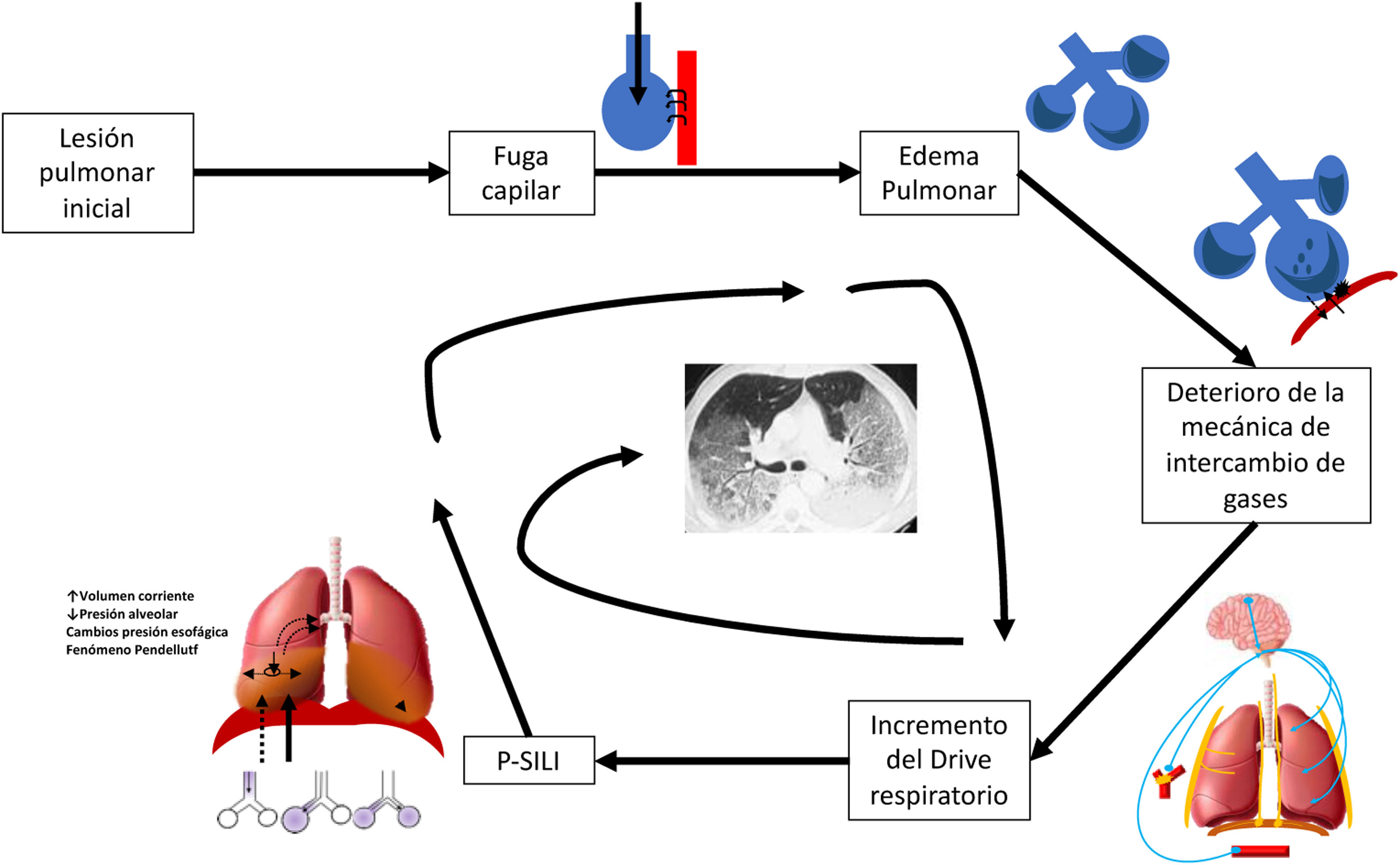
Posterior a la lesión pulmonar inicial también se ha demostrado que existe daño asociado al esfuerzo ventilatorio espontáneo del paciente previo y durante el inicio de la VM; este esfuerzo aumenta la presión transpulmonar y el volumen tidal, provocando sobredistensión alveolar: este fenómeno se conoce como lesión pulmonar autoinfligida por el paciente (P-SILI)6 (fig. 1). Otro fenómeno que explica la generación de P-SILI es el movimiento del gas entre regiones por la heterogeneidad pulmonar de las diferentes constantes tiempo, llamado fenómeno de Pendelluft.
En este trabajo buscaremos revisar los conceptos para realizar una VM protectora evitando las complicaciones asociadas, con énfasis a la protección a nivel pulmonar y diafragmática.
Ventilación protectora pulmonarLa ventilación pulmonar protectora es un conjunto de estrategias que se han implementado y estudiado en el manejo de pacientes con VM que cursan con patología pulmonar aguda, crónica o SDRA, siendo este último una de las patologías en las que más se han realizado ensayos por la complejidad y la heterogeneidad que presenta.
Las estrategias de protección pulmonar durante la VM buscan minimizar el daño pulmonar, con volúmenes y presiones de ventilación bajos, evitando el colapso alveolar y la sobredistensión pulmonar con el objetivo de mantener presiones alveolares por debajo de umbrales considerados críticos, previniendo lesiones adicionales al pulmón.
La lesión pulmonar inducida por la ventilación mecánica (LPIVM) ocurre con más frecuencia en pacientes con incremento de las zonas conocidas como dependientes, donde la interacción de la ventilación genera incremento sustancial del estrés y la tensión, como resultado de presiones transpulmonares regionales altas. Para lograr disminuir la lesión en estas áreas se actúa sobre parámetros globales como el volumen corriente y la presión meseta (Pplat), incluyendo la presión positiva al final de la espiración (PEEP), que se utiliza para prevención de atelectasias y pretendiendo incrementar las zonas aireadas o no dependientes7.
Durante los últimos años se ha buscado el impacto sobre la mortalidad de las estrategias de protección pulmonar en conjunto a otras terapéuticas (posición prona, bloqueadores neuromusculares, óxido nítrico, surfactante, agonista beta2, simvastatina, omega 3 y corticosteroides), siendo pocos los que demuestren impacto relevante sobre la mortalidad7,8.
La posición prona ayuda a aumentar el volumen pulmonar al final de la espiración, homogenizar la transmisión de la presión9 con un impacto en la mortalidad en pacientes con SDRA severo10. El uso de corticoesteroides y el bloqueo neuromuscular reducen el tiempo de VM y la mortalidad, en conjunto con otras medidas de protección pulmonar7,11,12.
Lesión inducida por la ventilación mecánica (LPIVM)La VM constituye una parte importante del tratamiento del SDRA, observando que su aplicación en los pacientes puede no estar libre de riesgos ni de efectos adversos que sean letales13. La LPIVM fue reportada desde 1944, por el médico John Fothergill: en su opinión, la respiración boca a boca podría ser mejor durante la reanimación que los fuelles, dispositivos mecánicos con aire no controlado, ya que podrían causar más lesiones pulmonares14.
En 1952, los investigadores de la epidemia de polio describieron lesiones en la conformación de los pulmones asociadas a la VM14. En 1967 se acuñó el concepto «pulmón respiratorio» para referirse a la lesión pulmonar post mortem en pacientes que habían requerido soporte con VM y en quienes los pulmones presentaban extensos infiltrados alveolares y producción de membranas hialinas.
La LPIVM se define como la presencia de daño pulmonar desarrollado o agravado por la VM; puede ocurrir con la VM invasiva y no invasiva, asociada con aumento de la morbimortalidad de pacientes en unidad de cuidados intensivos (UCI). La VM puede estar relacionada con lesión en pulmones normales y enfermos; en estos últimos, el daño es más significativo, probablemente en relación con mayores tensiones pulmonares15.
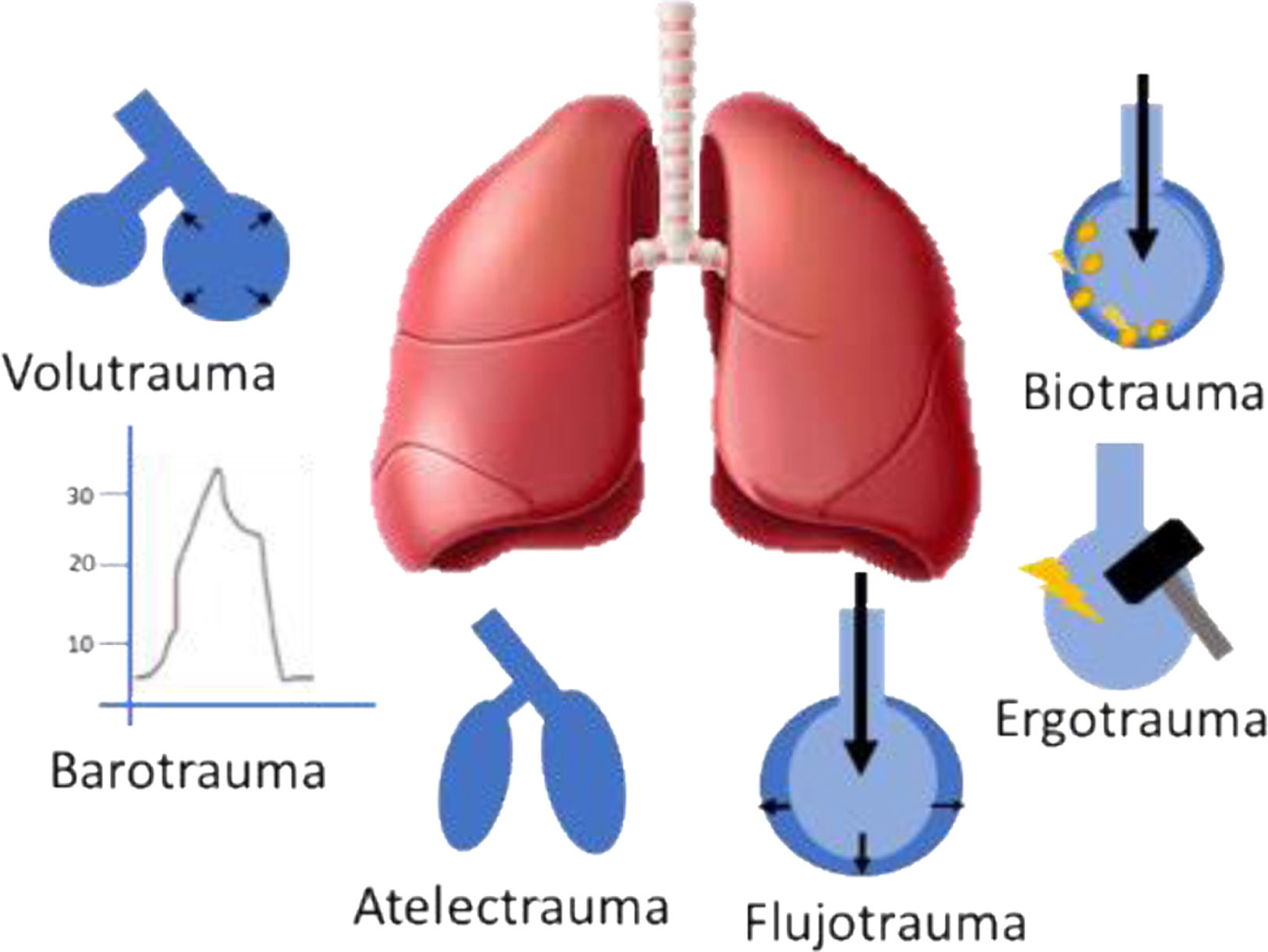
Los mecanismos de la LPIVM se presentan como consecuencia de un daño físico pulmonar, en su mayoría relacionados a la sobredistensión; entidades que se clasifican de manera clínica en forma de volutrauma, barotrauma, atelectrauma, flujotrauma, ergotrauma y biotrauma, los cuales se describen a continuación (fig. 2)15.
- •
Volutrauma. Es el daño pulmonar causado por sobredistensión a nivel alveolar, secundario a volúmenes corrientes altos16.
- •
Barotrauma. Lesión pulmonar causada por presiones transpulmonares altas. La distensión alveolar excesiva generada por la presión positiva ocasiona ruptura de las paredes, principalmente cuando se usan volúmenes tidales altos16.
- •
Atelectrauma. Se describe como la lesión pulmonar secundaria a la apertura y cierre cíclico de los alvéolos17.
- •
Flujotrauma. Lesión pulmonar inducida por flujo alto o en relación al patrón inadecuado.
- •
Biotrauma. Lesión pulmonar y de órganos extrapulmonares causada por una respuesta inflamatoria a una lesión pulmonar física18.
- •
Ergotrauma. Es la lesión que se genera cuando la energía entregada del VM al sistema respiratorio con cada ventilación es excesiva, valorado por el poder mecánico (PM)18.
El diafragma es el principal músculo respiratorio; durante la contracción diafragmática se genera activamente la inspiración; por el contrario, la espiración es un proceso pasivo secundario a la relajación diafragmática. Estos movimientos generan cambios de presión intratorácicos e intraabdominales19.
Los pacientes en estado crítico con frecuencia presentan debilidad muscular generalizada; la afección del diafragma de forma aislada ha sido una entidad en reciente estudio. Se conoce como disfunción diafragmática a los múltiples cambios deletéreos en la estructura y la función del diafragma; este término incluye eventración, debilidad y parálisis diafragmática, otra forma rara de disfunción diafragmática es el flutter diafragmático19,20.
La debilidad diafragmática asociada a enfermedad crítica es una manifestación de múltiples factores de riesgo que a menudo se presentan simultáneamente o de forma aislada; la enfermedad crítica, la estancia en UCI, las terapias farmacológicas utilizadas y la VM per se son los principales factores involucrados21,22.
La LDIVM se refiere, como su nombre lo dice, a la disfunción del diafragma inducida por el ventilador; el mecanismo de daño asociado a la ventilación mecánica se conoce como miotrauma ventilatorio o diafragmático, y pueden ocurrir hasta 4 formas de miotrauma durante la ventilación: sobreasistencia del ventilador o carga insuficiente, subasistencia o baja asistencia ventilatoria (exceso de carga), contracciones excéntricas del diafragma y acortamiento excesivo al final de la espiración22.
La sobreasistencia ventilatoria o carga insuficiente se presenta en alrededor de 50% de los pacientes ventilados y se debe a un esfuerzo respiratorio insuficiente secundario a un soporte ventilatorio excesivo, sedación profunda y/o parálisis; esto propicia atrofia por desuso, secundaria a la activación de distintas vías celulares. Puede mitigarse preservando cierto grado de activación muscular durante la ventilación mecánica23.
La baja asistencia ventilatoria (exceso de carga) surge cuando el esfuerzo respiratorio es excesivo debido a una descarga insuficiente: el nivel de asistencia ventilatoria no es capaz de disminuir el trabajo muscular respiratorio para mantener la ventilación, y esto provoca una lesión diafragmática que se manifiesta como pérdida de la producción de fuerza después de una carga resistiva; se ha demostrado alteración del sarcómero, inflamación del tejido y fatiga muscular24.
El miotrauma excéntrico se debe a las contracciones excéntricas del diafragma que se desarrollan durante el alargamiento de las fibras musculares, es decir, durante la fase espiratoria del ventilador. Este tipo de contracciones suceden en casos específicos de asincronía paciente-ventilador: trigger inefectivo, ciclado prematuro, trigger reverso y durante la ventilación binivel no sincronizada25.
Miotrauma espiratorio. La activación contráctil en la fase espiratoria se denomina frenado espiratorio o esfuerzo postinspiratorio. La aparición de miotrauma espiratorio se relaciona directamente con los efectos de la aplicación de PEEP, con asincronías o incluso con la actividad excesiva de los músculos respiratorios accesorios que mueven el diafragma26.
La disfunción diafragmática puede ser asintomática. Los síntomas más frecuentes son la disnea de esfuerzo y la ortopnea, y también puede haber síntomas de hipoventilación y reflujo gastroesofágico; en el paciente crítico con ventilación mecánica el principal síntoma es una extubación difícil. Los síntomas suelen ser más graves en pacientes obesos, enfermedad cardiaca o pulmonar19. La debilidad diafragmática es un marcador de gravedad y mal pronóstico de la enfermedad, y puede presentarse en fases tempranas o tardías de la enfermedad crítica, asociada o no al uso de la ventilación mecánica. Cuanto se presenta de manera tardía después de varios días bajo VM, se asocia con fracaso en destete de la VM21.
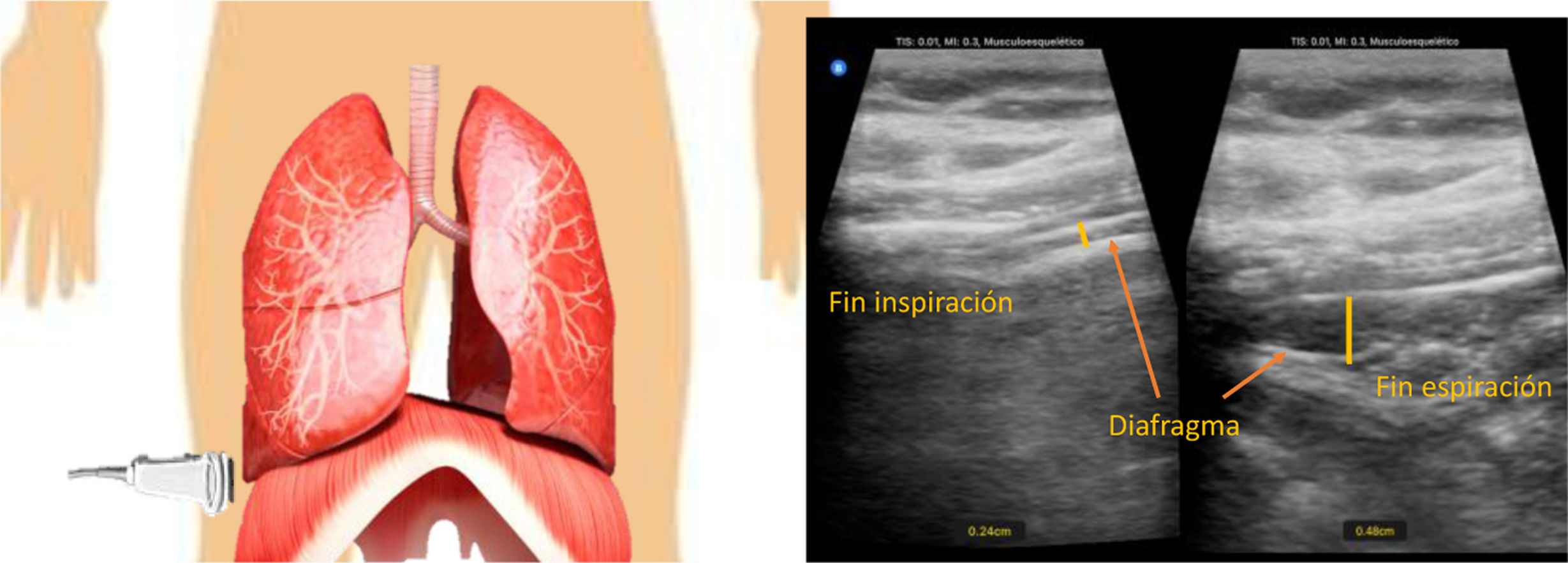
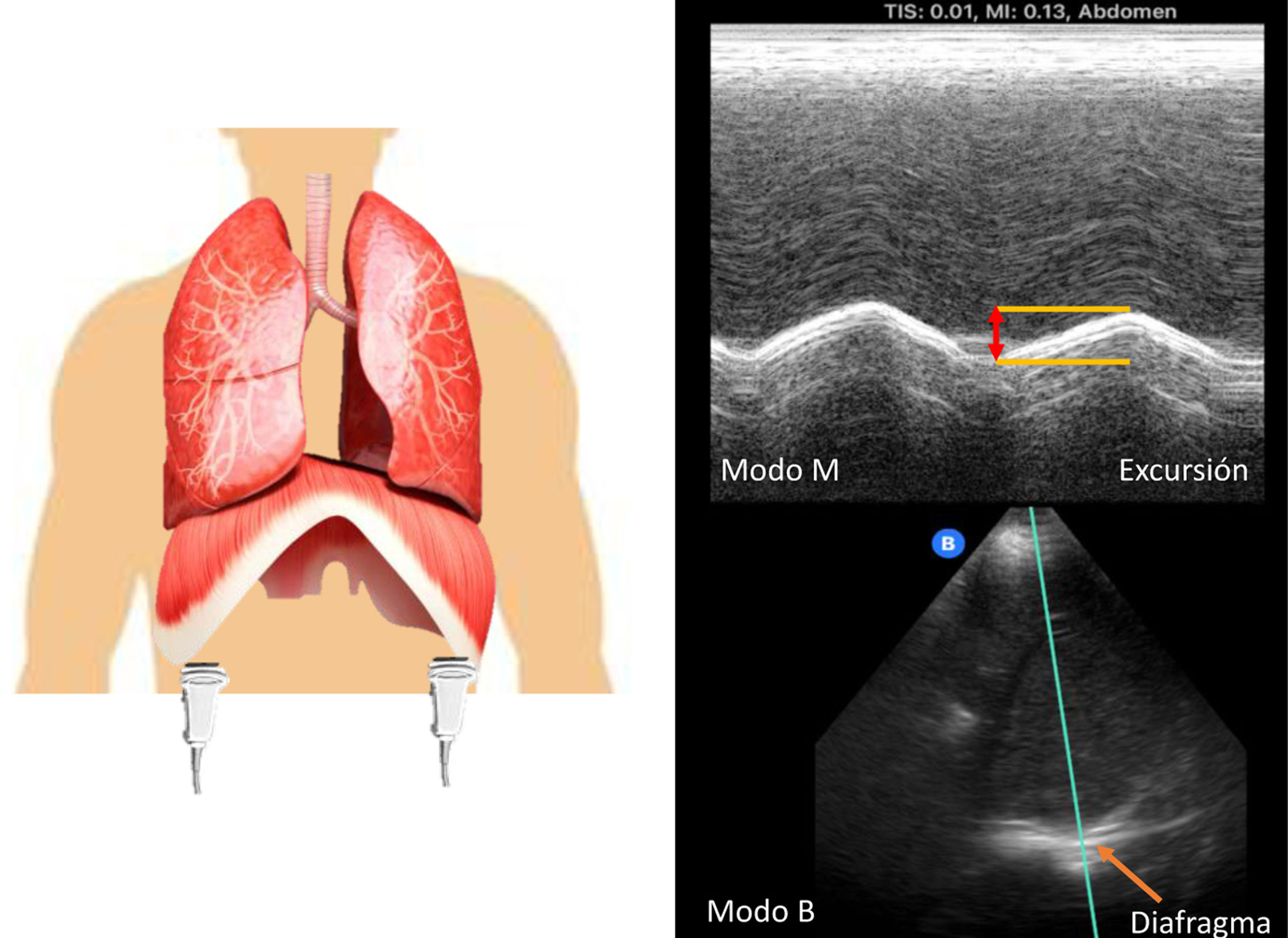
Existen técnicas para monitorear la actividad del diafragma en pacientes críticos (tabla 1). La fuerza del diafragma puede evaluarse mediante la cantidad de presión generada por la contracción del diafragma, sobre la base de la presión generada durante los esfuerzos inspiratorios volátiles máximos o mediante la estimulación calibrada no volátil del nervio frénico27. El estándar de oro para evaluar la fuerza del diafragma es la medición de la presión transdiafragmática por estimulación magnética de los nervios frénicos28. La ecografía diafragmática mide la fracción de engrosamiento del diafragma (fig. 3), que oscila entre el 0 y el 5% en pacientes con bloqueo neuromuscular y entre el 20 y el 50% en pacientes con respiración espontánea; también podemos medir con ecografía la excursión máxima del diafragma (fig. 4); este marcador predice el éxito y/o el fracaso de la extubación con una sensibilidad y una especificad razonables. Existe una amplia gama de estudio para valorar la fuerza del diafragma, y con ello podemos detectar la lesión diafragmática de manera oportuna. La ecografía diafragmática se considera accesible y con evidencia suficiente para poder utilizarla en unidades con difícil acceso a estudios más invasivos. Otras pruebas indirectas que evalúan la función diafragmática son los parámetros derivados de la presión en pacientes ventilados, la presión máxima inspiratoria, P0.1, SNIFF, trabajo respiratorio, producto presión-tiempo y la presión de los músculos respiratorios29.
Cada vez es más frecuente la debilidad diafragmática en la UCI asociada a VM. Con la reciente pandemia de COVID-19 y la necesidad de mayor requerimiento de VM se vio un incremento en las lesiones asociadas al diafragma; por lo tanto, es necesario implementar estrategias que equilibren la ventilación mecánica protectora y mantengan la actividad diafragmática. La ecografía es una herramienta útil para evaluar la actividad diafragmática y la lesión; sin embargo, se requieren más estudios. La monitorización invasiva de la actividad diafragmática es el estándar de oro, aunque no siempre se tiene disponible. Existen estrategias para evitar la debilidad diafragmática tanto farmacológicas como no farmacológicas, pero ante su etiología multifactorial y la asociación a mayor tiempo de recuperación y aumento en la mortalidad, sigue siendo un campo de estudio a futuro.
Relación de la driving pressure (DP) y el poder mecánico (PM) en la LPIVMEl concepto de DP fue introducido por Amato et al. en el 2015 como un índice entre el Vt y la complianza pulmonar (Crs), entendiendo Crs como el resultado de la medición de Pplat menos PEEP; DP (ΔP=Vt/Crs) con un valor >15cmH2O se asocia a mayor mortalidad. Se puede valorar de manera rutinaria en pacientes sin esfuerzo respiratorio30,31. En 2017, Villar et al., en un estudio observacional definieron el punto de corte de DP en 18cmH2O en donde un incremento ordinal se acompañaba de mayor mortalidad32.
Actualmente es considerado como el mejor predictor de LPIVM en pacientes con SDRA; sin embargo, la evidencia en torno a esta variable se basa en estudios observacionales retrospectivos donde no se identifica de manera directa la causa de LPIVM33,34.
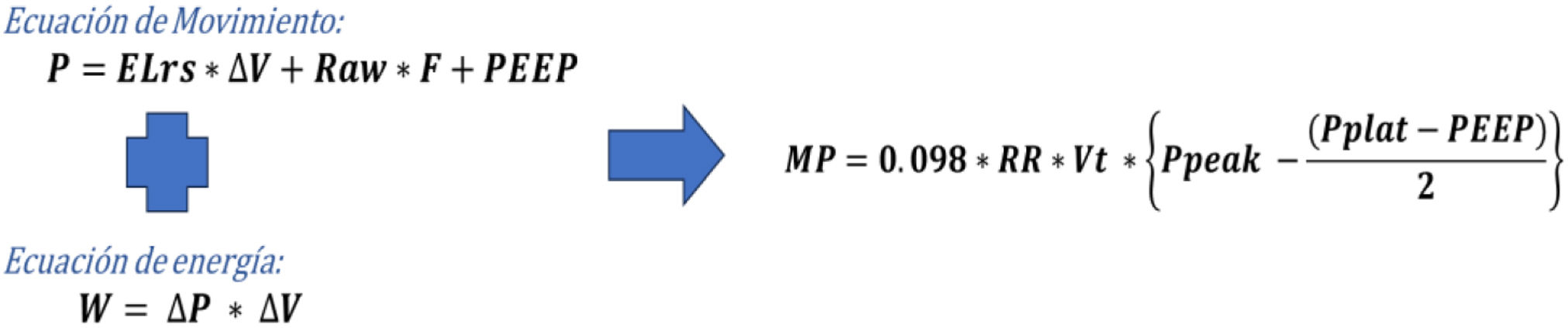
En 2016, Guerin et al., en dos estudios controlados aleatorizados, demostraron que al ventilar a los pacientes con Vt bajo la DP es un factor de riesgo igual al Pplat o Crs35. En ese mismo año, Gattinoni et al. unificaron el mecanismo de LPIVM en una sola variable que denominaron PM, basándose en el principio de la ecuación del movimiento (fig. 5). Se define como la energía entregada del ventilador al sistema respiratorio en un periodo de tiempo36.
Fórmula de la ecuación de movimiento y de poder mecánico.
ΔV, delta de volumen tidal; ELrs: elastancia del sistema respiratorio; F: flujo inspiratorio; MP: poder mecánico; P: presión de vía aérea; PEEP: presión positiva al final de la espiración; Ppeak: presión pico de vía aérea; Raw: resistencia de la vía aérea; RR: frecuencia respiratoria; Vt: volumen tidal.
Cressoni et al. realizaron en 2017 un estudio experimental en animales y definieron el punto de corte de PM para el desarrollo de LPIVM en 12,1joules/min, con relación significativa entre edema, elastancia, potencia y disminución de PaO2/FiO2. El PM resulta de multiplicar la energía por respiración por la frecuencia respiratoria. Su fórmula se considera como la gold standard para el cálculo del PM37.
Si se expresan las presiones en cmH2O y el volumen en litros, su producto multiplicado por 0,098 se expresa en joules7. Serpa et al. examinaron en 2018 la asociación entre PM y mortalidad en pacientes críticamente enfermos, observando un aumento consistente en la mortalidad con un PM >17,0joules/min (OR: 1,70 [1,32-2,18]; p<0,001), así como con días libres de VM38.
Otros estudios retrospectivos consideran el PM como un predictor de mortalidad a los 28 días en la UCI independiente del valor de DP y Pplat, así como el aumento de PEEP sin la reducción de MP se asocia a mayor mortalidad. El efecto de PM en LPIVM puede depender del tamaño del pulmón funcional35,39-41.
A pesar de ser un novedoso parámetro de monitorización, es difícil para la práctica diaria la realización de la medición directa de los parámetros. En SDRA un abordaje ventilatorio personalizado es lo ideal; en el estudio de Pelosi et al. recomienda mantener una DP <13cmH2O para titular el valor de PEEP y de Vt en conjunto dentro de lo posible con una Pplat <27cmH2O. La información actual sugiere que la ventilación guiada con DP y PM podría disminuir la presencia de LPIVM en pacientes con SDRA42.
Estrategias para minimizar la LPIVM y la LDIVMDurante la VM se puede garantizar un adecuado intercambio de oxígeno y aun así ocurrir la muerte43. Hay que recordar que los cambios estructurales que desencadenan el LPIVM son prevenibles, teniendo mucha atención a las variables dinámicas (frecuencia respiratoria, flujo inspiratorio y el tiempo inspiratorio) y estáticas (presión pico inspiratorio, presión meseta, presión positiva al final de la espiración y volumen tidal)44.
De acuerdo a la evidencia, existen varias estrategias que protegen al pulmón de estas alteraciones estructurales, dentro de las cuales tenemos el mantener los pulmones parcialmente colapsados, evitar la apertura y el cierre cíclico de los alvéolos, manteniendo el pulmón colapsado y consolidado en reposo45.
Otra estrategia diferente es la llamada apertura pulmonar, que, según un metaanálisis, demostraba disminución significativa de la mortalidad en pacientes con SDRA46. Esta estrategia se centra en niveles altos de PEEP más Vt bajos; esto disminuye los niveles excesivos de presión inspiratoria, evitando la sobredistensión pulmonar y la respuesta inflamatoria, además de disminuir el colapso y la apertura repetitiva de las unidades alveolares. Sin embargo, se tiene como hipótesis que el beneficio de esta estrategia es principalmente por los Vt bajos y no por lo niveles altos de PEEP.
Además de mantener una estrategia ventilatoria, se deben considerar otros factores que condicionan daño durante la ventilación, los cuales explican por qué no todos los pacientes presentan LPIVM. La energía aplicada del ventilador al parénquima pulmonar condicionara diferente respuesta de acuerdo a la interacción de lo que conocemos como amplificadores del stress (la heterogeneidad pulmonar, la disminución del parénquima pulmonar aireado [baby lung]) y las características basales pulmonares (el estado de la presión y del flujo vascular, el estado inflamatorio basal, la temperatura corporal y el estado ácido-base)47. También será importante la frecuencia con que el parénquima pulmonar se exponga a los ciclos de stress alto.
Otros factores son los que predispongan y alteren la ventilación, la oxigenación y el flujo sanguíneo, como un esfuerzo respiratorio vigoroso, donde el uso de sedación y analgesia puede disminuir el trabajo respiratorio, disminuyendo las presiones pulmonares y la demanda ventilatoria. Evaluar el grado de afectación del parénquima pulmonar, el baby lung, la severidad y la heterogeneidad pulmonar es primordial para identificar tempranamente la hipoxemia refractaria, donde una de las medidas para minimizar el riesgo de LPIVM y mejorar la oxigenación es la posición prona48,49.
Un punto clave en el manejo del paciente ventilado es la Pplat, ya que presiones altas generan sobredistensión y alteración de la permeabilidad capilar. La interacción de Vt altos y baja complianza del sistema respiratorio (Crs) pueden incrementar los valores de Pplat. Se considera efectivo un valor menor de 28cmH2O para limitar el riesgo de sobredistensión y alteración de la permeabilidad capilar, por lo que una meta de Vt de 6 a 8ml/kg predicted body weight (PBW) para limitar la Pplat es parte del tratamiento estándar; sin embargo, esto debe personalizarse, ya que dependerá, como se mencionó previamente, de la Crs. Otro punto importante sobre limitar las presiones es usar el valor de DP, en el cual, sin importar los valores de Vt y PEEP, si se supera un valor de 19cmH2O en ARDS moderado/severo se aumenta significativamente la mortalidad hospitalaria50. En pacientes con Crs bajas valores altos de PEEP pudieran ser necesarios, siempre y cuando se logre alcanzar Pplat y DP adecuados. La relación de PEEP altos conservando DP menores de 13cmH2O se asocian a menor mortalidad y a mayor nivel de reclutabilidad.
El flujo puede aumentar el riesgo de daño al mantener perfiles de flujo alto. Ajustar el flujo inspiratorio con una relación I:E de 1:1,5 a 1:1 es ideal, así como un flujo desacelerado en el paciente controlado por presión50.
Otra variable por evaluar es el PM, ya mencionado previamente: recordar que dentro de su fórmula incluye muchos de los determinantes del LPIVM. Buscar un valor menor de 13joules/min pudiera ser protector y evitar el LPIVM; sin embargo, en pacientes con disminución de la capacidad funcional residual, o baby lung, un valor menor 17joules/min pudiera evitar el daño pulmonar. Se han realizado estudios en busca de mejorar el valor predictivo del PM. En un estudio buscaron ajustar el PM al tamaño pulmonar o más bien al parénquima pulmonar potencialmente aireado en pacientes ventilados con COVID-19, obteniendo un índice entre PM y la Crs estática, observando relación entre al índice y días libres de ventilación mecánica como una probable asociación a mortalidad51. Actualmente el PM se utiliza como una variable más al momento de evaluar el riesgo de LPIVM.
En cuanto a la protección diafragmática, el grado de soporte ventilatorio será factor importante para el desarrollo de la lesión de las fibras musculares, ya que un soporte insuficiente condicionará una esfuerzo ventilatorio excesivo y la lesión o un soporte excesivo condicionarán una atrofia difusa. Las disincronías paciente-ventilador como disparo inefectivo, disparo reverso y ciclado prematuro generan una carga excéntrica que generara lesión, o, en el caso de una PEEP alta, condicionará una atrofia longitudinal de las fibras musculares diafragmáticas.
Dentro de los objetivos para protección diafragmática tenemos que enfocarnos en mantener un esfuerzo inspiratorio moderado. El esfuerzo respiratorio se define como la actividad de los músculos respiratorios que consume energía, cuyo objetivo es impulsar la respiración; tanto un esfuerzo inspiratorio excesivo como uno insuficiente tienden a causar daño diafragmático, por lo que es necesario mantener un esfuerzo inspiratorio moderado23,52.
Reducir el esfuerzo respiratorio requiere que el ventilador cicle al unísono con el ritmo respiratorio central del paciente. Para una apropiada sincronización, los periodos de inflación y de inactividad mecánica deben coincidir con el tiempo inspiratorio y espiratorio neural. Las contracciones excéntricas que se presentan en el diafragma pueden resultar en diferentes formas de asincronía paciente-ventilador: trigger reverso, trigger inefectivo y ciclado prematuro. Cuando se detectan, pueden evitarse asegurándose que el ventilador inicie un ciclo de espiración al mismo tiempo que finaliza el esfuerzo inspiratorio del paciente26,53.
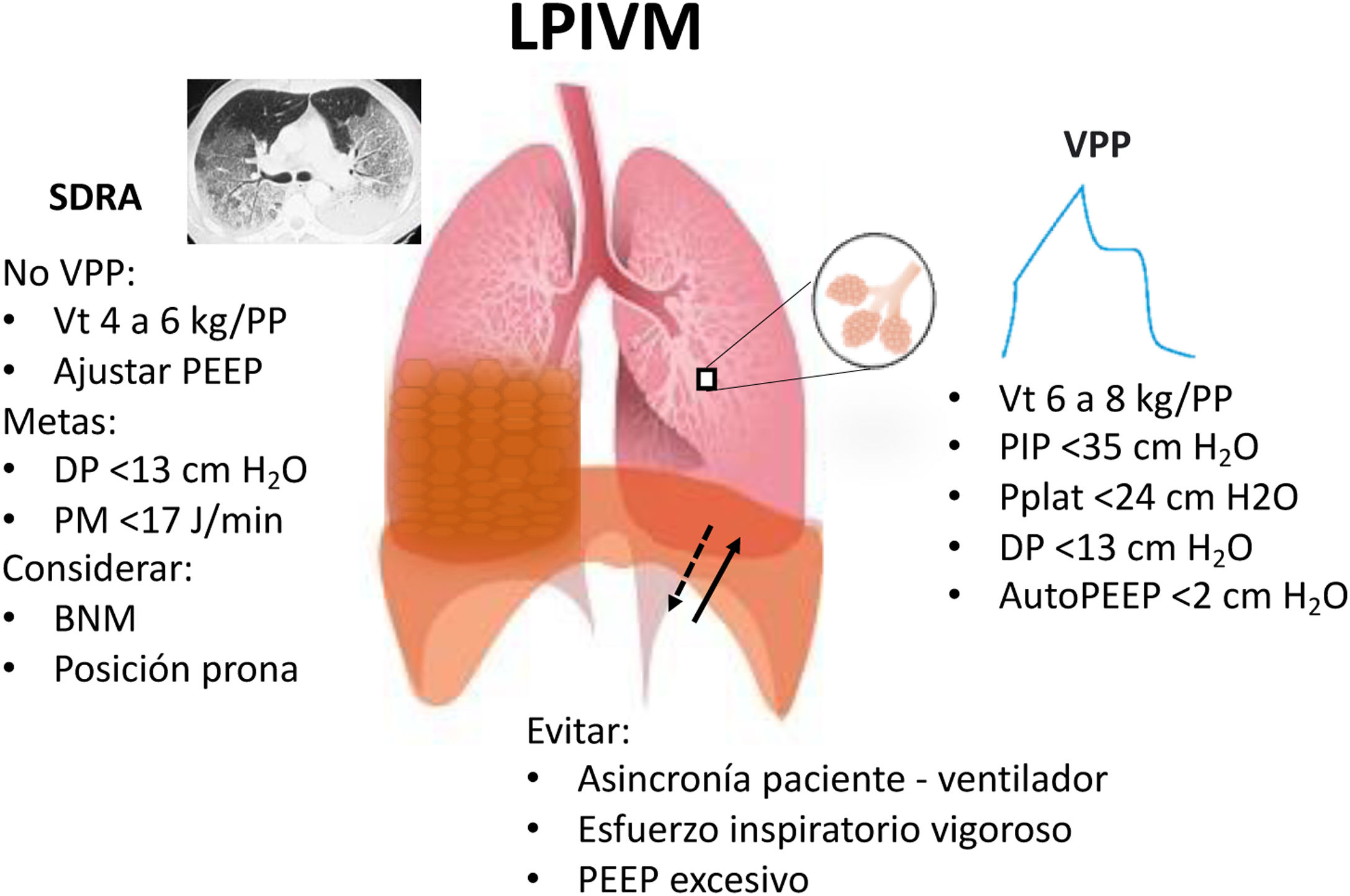
ConclusionesSiempre recordar que debemos proteger el pulmón mientras se protege el diafragma (fig. 6). En el SDRA el impulso y el esfuerzo respiratorios suelen ser muy elevados, debido al aumento del espacio muerto, la acidosis metabólica, la estimulación de los receptores del parénquima pulmonar, encefálico y corticales. La monitorización del esfuerzo respiratorio es importante para mantener la protección pulmonar; por lo regular, se requiere supresión del esfuerzo con sedación, ventilación controlada o, en casos de poca respuesta, el bloqueo neuromuscular puede ser considerado. La protección pulmonar debe tener prioridad sobre la protección del diafragma debido al beneficio en disminuir la mortalidad. La PEEP, la presión transpulmonar y la oxigenación idealmente deben estar en metas para, de manera secundaria, proteger el diafragma.
Esquema de las variables que conforman una ventilación protectora pulmonar y diafragmática, así como las medidas a seguir para mantener la ventilación protectora y evitar el LPIVM en pacientes con SDRA.
BNM: bloqueo neuromuscular; DP: driving pressure; LPIVM: lesión pulmonar inducida por ventilación mecánica; PEEP: presión positiva al final de la espiración; PIP: presión inspiratoria pico; PM: poder mecánico; Pplat: presión meseta; SDRA: síndrome de distrés respiratorio agudo; VPP: ventilación pulmonar protectora; Vt: volumen tidal.
Los autores declaran que no existe ningún conflicto de intereses.
Agradecemos a los maestros que a lo largo de nuestra formación nos han alentado a no dejar de buscar la excelencia en la atención de nuestros pacientes y en la actualización médica continua.