La mortalidad atribuible a la neumonía asociada al ventilador (VAP) es alrededor del 10%, y dentro de la nueva clasificación de las infecciones del tracto respiratorio inferior (LRTI), los pacientes diagnosticados con VHAP tuvieron la mayor mortalidad hospitalaria. La patogenia es multifactorial, las bacterias gramnegativas son responsables de la mayoría de los casos bacterianos de HAP/VAP (más del 60%). Los hallazgos del examen físico (fiebre, secreciones purulentas), la radiografía de tórax, los cultivos del aspirado endotraqueal, los cultivos broncoscópicos y el ínidice de infección pulmonar clínica (CPIS) tienen poca precisión para diagnosticar VAP. Las directrices recientes no recomiendan el uso de biomarcadores para el diagnóstico de VAP, aunque sugieren que pueden ofrecer orientación sobre la duración del tratamiento. Esperamos más estudios en programas de Stewardship con las nuevas herramientas moleculares para el uso de los antibióticos en VAP. Presentamos las recomendaciones para el tratamiento antimicrobiano empírico de la ERS/ESICM/ESCMID/ALAT, con los nuevos antibióticos y las recomendaciones de prevención de VAP. Se hacen necesarias las actualizaciones de las guías, tanto de la guía americana como de la la europea.
Mortality attributable to ventilator-associated pneumonia (VAP) is about 10%, and within the new classification of lower respiratory tract infections (LRTI), patients diagnosed with VHAP had the highest in-hospital mortality. Pathogenesis is multifactorial, with gram-negative bacteria responsible for the majority of bacterial cases of HAP/VAP (more than 60%). Physical examination findings (fever, purulent secretions), chest radiograph, endotracheal aspirate cultures, bronchoscopic cultures, and clinical lung infection index (CPIS) have poor accuracy for diagnosing VAP. Recent guidelines do not recommend the use of biomarkers for the diagnosis of VAP, although they suggest that they may offer guidance on the duration of treatment. We look forward to further studies in Stewardship programs with the new molecular tools for the use of antibiotics in VAP. We present the recommendations for empirical antimicrobial treatment of ERS/ESICM/ESCMID/ALAT, with the new antibiotics and recommendations for the prevention of VAP. Updates to the guidelines of both the American and European guidelines are necessary.
Las infecciones del tracto respiratorio inferior (LRTI) nosocomiales que ocurren después de 48 horas de hospitalización se clasifican como1:
- •
HAP: LRTI adquirida fuera de la unidad de cuidados intensivos (UCI) al menos ≥48horas después del ingreso, que no requiere ventilación mecánica invasiva (VMI).
- •
VHAP: LRTI adquirida fuera de la UCI al menos ≥48horas después del ingreso, requiriendo VMI debido a la LRTI.
- •
UCI-HAP: LRTI adquirida al menos ≥48horas después del ingreso a la UCI, sin requerir VMI debido a la LRTI.
- •
VAP: pacientes ingresados en la UCI que desarrollan LRTI al menos después de ≥48horas de intubación endotraqueal/traqueostomía.
- •
VAT: pacientes ingresados en la UCI que desarrollan LRTI al menos ≥48horas después de la intubación endotraqueal/traqueotomía sin infiltrado pulmonar radiológico nuevo o progresivo.
Se estima que la mortalidad atribuible a la VAP es alrededor del 10%, pero varía considerablemente según el tipo y la gravedad de la enfermedad subyacente2,3. Martin-Loeches et al., en el estudio ENIRRIS, realizado en 28UCI de Europa y Latinoamérica, reportaron que la LRTI nosocomial más frecuente fue la VAP (52,5%), seguida de la VAT (15,1%), la HAP (14,3%), la UCI-HAP (9,2%) y la VHAP (8,9%). Los pacientes diagnosticados con VHAP tuvieron la mayor mortalidad hospitalaria (50%), mortalidad en UCI (40,3%) y mortalidad a 28días (41,5%) en comparación con los otros grupos1.
EpidemiologíaLa VAP afecta entre el 20% y el 36% de los pacientes en estado crítico y provoca una presión sustancial de prescripción de antibióticos, lo que representa la mitad de todos los antibióticos utilizados en la UCI4,5. La VAP aumenta la duración de la estancia hospitalaria con una media de cuatro a nueve días, aumentando los costos hospitalarios en €9.000 por paciente6. La HAP representa el 15% de todas las infecciones nosocomiales7, y los sobrevivientes enfrentan una morbilidad significativa, incluida una disminución de la función física y cognitiva8. La incidencia de HAP/VAP es mayor en pacientes inmunocomprometidos, quirúrgicos y ancianos7.
Con respecto a la incidencia, la HAP ocurre en una tasa de 5 a 20 casos por cada 1.000 ingresos hospitalarios, mientras que la VAP muestra una incidencia de 2-16 episodios por 1.000 días de ventilación. Juntas constituyen la segunda causa más común de infección nosocomial y la primera en términos de mortalidad por todas las causas (30-70% de los casos)9. Esta varía según la región. Así, las tasas de VAP en hospitales de América del Norte han informado ser tan bajas como 1 a 2,5 casos por 1.000 días de ventilador10. En los centros europeos, sin embargo, informan tasas mucho más altas; el estudio EU-VAP/CAP, por ejemplo, informó unas tasas de 18,3 episodios de VAP por 1.000 días de ventilador11. Los países de ingresos medianos a bajos también reportan tasas más cercanas a 18,5 por 1.000 días-ventilador12.
Patogenia y etiologíaLa VAP es multifactorial, y se debe a las alteraciones en las defensas protectoras normales de las vías respiratorias, a los cambios en la flora microbiológica y a las respuestas inmunes del paciente. Los mecanismos de la VAP son:
- 1.
Factores externos asociados con las terapias de la UCI, incluida la VMI, los agentes de sedación y parálisis, y la posición semisentada.
- 2.
El tubo endotraqueal (ETT), que previene el cierre de la glotis y genera una comunicación directa a los pulmones permitiendo la microaspiración de secreciones de los senos paranasales y la orofaringe. El manguito del ETT corre el riesgo de desinflarse y moverse, y los pequeños pliegues permiten la fuga de secreciones acumuladas. Se puede formar una biopelícula bacteriana alrededor del tubo endotraqueal que luego puede desprenderse con el movimiento o la succión. El ETT no previene la microaspiración silenciosa13.
- 3.
La microbiota pulmonar se torna disbiótica, con baja diversidad microbiana y alta carga microbiana14,15. Los macrófagos alveolares y las células epiteliales reclutan citoquinas que facilitan la migración de más neutrófilos hacia los espacios aéreos pulmonares para cumplir sus funciones de fagocitosis, degranulación, liberación de especies reactivas de oxígeno (ROS) y formación de trampas extracelulares de neutrófilos (NET)16. Además, la ventilación mecánica induce una respuesta inflamatoria localizada, denominada biotrauma, que genera inflamación local persistente y posteriormente aumenta el riesgo de VAP17. Los estudios han demostrado un aumento significativo en los biomarcadores pulmonares, tales como la interleucina-1 beta (IL-1β), la IL-8, la metaloproteinasa de matriz-8 (MMP-8), la MMP-9, la elastasa de neutrófilos humanos (HNE) y la IL-6 en la VAP18.
Las bacterias gramnegativas son responsables de la mayoría de los casos bacterianos de HAP/VAP (más del 60%), y los patógenos reportados con mayor frecuencia son Pseudomonas aeruginosa, Acinetobacter baumannii y enterobacterias. Las cepas grampositivas, y especialmente Staphylococcus aureus (ambas sensibles o resistentes a la meticilina), son agentes comunes (aproximadamente el 30% de los casos). Finalmente, Aspergillus spp. es responsable de una proporción variable de casos, constituyendo una causa relevante de VAP (5-12%)19,20.
En la VAP de aparición temprana (dentro de los primeros 4días de hospitalización) en pacientes previamente sanos y que no han recibido antibióticos previos, los microorganismos son los que involucran la flora orofaríngea normal, mientras que la VAP de aparición tardía (que ocurre después de al menos 5días de hospitalización) y en la VAP en pacientes con factores de riesgo de patógenos resistentes a múltiples fármacos (MDR) se asocian a patógenos MDR21. Sin embargo, los patógenos MDR pueden aislarse en etapas tempranas de la VAP, principalmente en presencia de ciertos factores de riesgo, tales como la exposición a antimicrobianos dentro de los últimos 90días22.
La prevalencia de la resistencia a los antimicrobianos ha aumentado constantemente y la presencia de patógenos MDR se ha asociado con un aumento en la morbilidad y la mortalidad debido a un tratamiento antimicrobiano inicial inadecuado21,22. Los factores para predecir el riesgo de MDR en el momento del diagnóstico de HAP/VAP son7:
- •
Entornos hospitalarios con altas tasas de resistencia a múltiples medicamentos.
- •
Colonización previa con patógenos MDR.
- •
Terapia antibiótica intravenosa previa en los últimos 90días.
- •
Hospitalización mayor o igual a 5días.
- •
Síndrome de dificultad respiratoria aguda (SDRA) anterior a la VAP.
- •
Terapia de reemplazo renal antes de la VAP.
La resistencia a las cefalosporinas de tercera y cuarta generación en cepas de Enterobacteriaceae debido a la expresión de β-lactamasas adquiridas de espectro extendido (BLEE) y β-lactamasas tipo AmpC es una preocupación cada vez mayor23. La propagación de cepas productoras de carbapenemasas también es un problema de mayor magnitud, y los aislados de Pseudomonas aeruginosa MDR son cada vez más frecuentes24; actualmente de la mitad a dos tercios de las cepas de Acinetobacter baumannii que causan VAP son resistentes a los carbapenems25.
La colonización del tracto respiratorio inferior por Candida spp. afecta hasta el 27% de los pacientes ventilados y está asociada con un mayor riesgo de VAP bacteriana, particularmente por Pseudomonas aeruginosa26. Es muy importante tener en cuenta que los datos disponibles no respaldan un papel directo de Candida spp. como patógeno causante de VAP27.
DiagnósticoEl diagnóstico de VAP sigue siendo controvertido, con grandes variaciones en los estándares de referencia7,21. Esta confusión significa que las tasas de incidencia de VAP en la misma cohorte de pacientes pueden ser del 4% al 42% con la aplicación de diferentes criterios diagnósticos28. Esto genera un reto al médico al balancear los riesgos de los antibióticos innecesarios frente a la morbimortalidad de la enfermedad ante un retraso en la terapia. Para reducir la mortalidad es esencial el tratamiento antimicrobiano temprano y acertado29. También es imperativo descartar otros factores de confusión, como la sobrecarga de líquidos y el SDRA. El examen histopatológico del tejido pulmonar inflamado e infectado se considera la herramienta diagnóstica más precisa para el diagnóstico de VAP7,21. Sin embargo, una biopsia de pulmón no es práctica ni apropiada en los pacientes críticos.
La sospecha de HAP/VAP se basa en la presencia de nuevos infiltrados pulmonares asociados con, al menos, uno de los siguientes criterios:
- •
Fiebre >38°C o hipotermia.
- •
Leucocitosis/leucopenia.
- •
Presencia de secreciones purulentas.
- •
Empeoramiento del intercambio de gases.
El examen clínico es esencial, pero tiene una sensibilidad del 66,4% (IC95%: 40,7-85,0) y una especificidad del 53,9% (IC95%: 34,5-72,2) en el diagnóstico de VAP30. Las características clínicas clásicas, tales como fiebre, secreciones purulentas y leucocitosis, tienen una sensibilidad del 69% y una especificidad del 75% en estudios post mortem y en estudios clínicos prospectivos30. Aunque no son concluyentes y son atribuibles a cualquier afección que libere citoquinas, la fiebre y la leucocitosis deberían impulsar una investigación clínica más exhaustiva.
El aumento de las secreciones traqueales purulentas puede indicar una infección del tracto respiratorio inferior, pero en pacientes intubados esto puede deberse a una supresión del reflejo de la tos, colonización bacteriana en el tubo orotraqueal y un aclaramiento mucociliar alterado31. Las secreciones traqueales pueden tener otras fuentes potenciales, como la traqueobronquitis, y pueden verse exacerbadas por antecedentes de tabaquismo o enfermedad pulmonar obstructiva crónica (EPOC)32. Un cambio en las características subjetivas de las secreciones contribuye al diagnóstico de VAP7,21,30.
Los cambios en la oxigenación pueden indicar un proceso inflamatorio del parénquima pulmonar que genera una sospecha de VAP, pero pueden ser una característica de una etiología no infecciosa, como el SDRA. Tanto la VAP como el SDRA se asocian con hipoxemia, siendo la neumonía la principal causa de SDRA, mientras que el SDRA también aumenta el riesgo de VAP33,34.
Diagnóstico radiológico de VAPLa neumonía produce infiltrados nuevos o progresivos, lo que resulta en un broncograma aéreo debido a la opacificación alveolar y los bronquios llenos de aire con consolidación lobar y sublobar. La interpretación de la radiografía de tórax es difícil en el paciente críticamente enfermo debido a la superposición de otras patologías comunes que se presentan con infiltrados pulmonares, tales como contusiones pulmonares, atelectasias, edema pulmonar o SDRA35. Los hallazgos de la radiografía de tórax deben compararse con imágenes anteriores para establecer cambios nuevos o progresivos. La radiografía de tórax tiene una sensibilidad del 88,9% (IC95%: 73,9-95,8) y una especificidad del 26,1% (IC95%: 15,1-41,4), con una discrepancia significativa en la interpretación30. Una comparación entre la tomografía de tórax (TAC) y la radiografía de tórax encontró menos del 45% de las opacidades en TAC observadas en las radiografías de tórax, y 26,9% viceversa36. La radiografía de tórax todavía puede considerarse un complemento valioso para el diagnóstico de VAP7,21.
La TAC es el examen estándar de oro para el diagnóstico de neumonía, ya que proporciona una orientación anatómica y patológica tridimensional sin superposición anatómica y una alta resolución de diferentes densidades de tejido pulmonar para el diagnóstico de neumonía36,37. Aunque es útil, la TAC no se utiliza de forma rutinaria para diagnosticar VAP en pacientes de la UCI debido a los riesgos del transporte, la necesidad de sedación y relajación adicional, y por lo tanto se debe usar cuando el diagnóstico por radiografía es confuso y los riesgos son mínimos en el transporte para el paciente.
Cada vez hay más evidencia en que la ecografía pulmonar (LUS) puede ayudar a evaluar la progresión y el diagnóstico de VAP en la UCI38. La LUS proporciona una evaluación no invasiva, rápida, sin riesgo y con mínimos costos. Sin embargo, puede ser difícil en pacientes con obesidad, enfisema subcutáneo y edema de la pared torácica. Actualmente, la LUS no está reconocida como una herramienta de evaluación validada en las guías publicadas para el diagnóstico de VAP7,21 y requiere estudios de validación adicionales a gran escala en pacientes críticamente enfermos. Sin embargo, en presencia de infiltrados pulmonares, en manos de expertos la LUS puede ser más precisa que la radiografía de tórax para este propósito.
Diagnóstico microbiológico de VAPSe requieren técnicas de diagnóstico precisas que identifiquen los organismos infecciosos responsables para guiar el régimen de tratamiento terapéutico más apropiado. Las técnicas de toma de las muestras pueden ser por:
- 1.
Aspirado endotraqueal (ETA). Es el método más usado para el diagnóstico etiológico de la VAP por ser una técnica no invasiva y eficiente que puede realizar la mayoría del personal de la UCI39. Aunque evita la contaminación orofaríngea, no puede diferenciarse de los organismos colonizadores en los dispositivos de las vías respiratorias, lo que lleva a resultados no concluyentes21. Si bien la evidencia sugiere que los ETA tiene altas tasas de falsos positivos y está asociada con un mayor uso de antibióticos, el análisis cuantitativo proporciona una alternativa confiable a las técnicas invasivas. Algunos metaanálisis concluyen que los ETA tienen una sensibilidad del 75,7% (IC95%: 51,5-90,1) y una especificidad del 67,9% (IC95%: 40,5-86,8) para el diagnóstico de VAP30.
- 2.
MiniBAL. Es un método ciego que utiliza un catéter telescópico tapado (o un cepillo para muestras protegidas). Es una técnica de muestreo no dirigida que no es siempre distal (porque no hay confirmación de la colocación correcta de la punta del catéter) y que se considera «no invasiva», a pesar de que el sangrado y el neumotórax son posibles complicaciones.
- 3.
Técnicas invasivas que se utilizan para obtener muestras de las vías respiratorias distales mediante un broncoscopio de fibra óptica incluyen el lavado broncoalveolar (BAL) y el cepillado protegido de muestras (PSB). El BAL y el PSB evitan la contaminación de las vías respiratorias superiores y requieren capacitación especializada40. El BAL y el PSB tienen riesgos, tales como una pérdida de presión positiva al final de la espiración, riesgos de extubación accidental, broncoespasmo e hipoxia, con necesidad adicional de sedación o agentes bloqueadores neuromusculares. Se afirma que el PSB tiene una sensibilidad del 61,4% (IC95%: 43,7-76,5) y una especificidad del 76,5% (IC95%: 64,2-85,6), mientras que el BAL tiene una sensibilidad del 71,1% (IC95%: 49,9-85,9) y una especificidad del 79,6% (IC95%: 66,2-85,9)30.
La evidencia sugiere que no se reduce la mortalidad, la duración de la ventilación mecánica ni la duración de la estancia en la UCI cuando se compararon el BAL y el PSB con el ETA en pacientes con VAP. Lo que sí es cierto que, por su alto valor predictivo negativo en pacientes en quienes están con antibióticos o los han recibido durante su estancia en la UCI, un resultado negativo de una técnica invasiva lleva a suspender o no iniciar antibióticos de forma más confiable que con el ETA21,30,40.
Ahora bien, el BAL, el PSB y el ETA se pueden analizar para obtener cultivos con resultados cuantitativos o cualitativos. El análisis cuantitativo proporciona un recuento umbral de crecimiento bacteriano, lo que permite diferenciar entre infección y colonización, mientras que el análisis cualitativo identifica puramente la presencia o ausencia de cultivos patógenos41. La razón fundamental para utilizar cultivos cuantitativos en pacientes con sospecha de VAP es diferenciar los organismos infecciosos de la colonización simple y optimizar la terapia con antibióticos. Sin embargo, no hay evidencia de que el uso de cultivos cuantitativos resulte en una reducción de la mortalidad, la duración de la estancia en la UCI, el período de ventilación mecánica o las tasas de cambio de antibióticos en comparación con cultivos cualitativos en pacientes con VAP20,41.
Los umbrales considerados para las diferentes técnicas son para el ETA >105UFC/ml, para el cepillo protegido >103UFC/ml y para el BAL >104UFC/ml)7,21. El recuento de unidades formadoras de colonias está afectado por el previo uso de antibióticos. Las directrices recomiendan cultivos semicuantitativos para diagnosticar VAP, ya que esto requiere menos recursos y experiencia de laboratorio, y proporciona resultados más rápidos que los cultivos cuantitativos7.
Puntuación de infección pulmonar clínica (CPIS)La CPIS combina criterios clínicos, radiológicos y microbiológicos con una puntuación de 0 a 12, siendo una puntuación igual o superior a 6 lo que proporciona una alta probabilidad de VAP21,42,43 (tabla 1).
Puntuación CPIS
| Temperatura corporal• ≥ 36,5 o ≤ 38,4 = 0 puntos• ≥ 38,5 o ≤ 38,9 = 1 puntos• ≥ 39 o <36,5 = 2 puntos | Oxigenación• PaO2/FiO2, mmHg >240 o SDRA=0 puntos• PaO2/FiO2, mmHg ≤240 y no SDRA=2 puntos |
| Leucocitos/mm3• ≥ 4000 o ≤ 11.000=0 puntos• <4000 o >11.000=1 punto• Formas inmaduras ≥% 50=adicione 1 punto | Radiografía de tórax• Sin infiltrados=0 puntos• Infiltrados difusos=1 punto• Infiltrados localizados=2 puntos |
| Secreción traqueal• Secreción traqueal (-)=0 puntos• Secreción traqueal con menos purulencia=1 punto• Secreción purulenta abundante=2 puntos | Cultivo semicuantitativo en ETA• Número de colonias no significativo: 0 puntos• Número de colonias significativa: 1 punto• Gram con bacterias: adicione 1 punto |
ETA: aspirado endotraqueal; SDRA: síndrome de dificultad respiratoria aguda.
En el trabajo original de Pugin et al. se informó que la CPIS tiene una sensibilidad del 93% y una especificidad del 96% para diagnosticar VAP42. Sin embargo, en comparación con los cultivos cuantitativos obtenidos por BAL e histología, la especificidad y la sensibilidad del CPIS pareciera ser baja43. Una puntuación CPIS superior a 6 tiene una sensibilidad del 73,8% (IC95%: 50,6-88,5) y una especificidad del 66,4% (IC95%: 43,9-83,3)30.
Se han sugerido beneficios de la CPIS para el seguimiento del paciente, demostrando que aquellos pacientes que persisten con CPIS >6 a las 72-96horas a pesar del tratamiento antibiótico tienen una más alta mortalidad21,43. En general, el uso generalizado de la CPIS como herramienta de diagnóstico de VAP debe adoptarse con precaución.
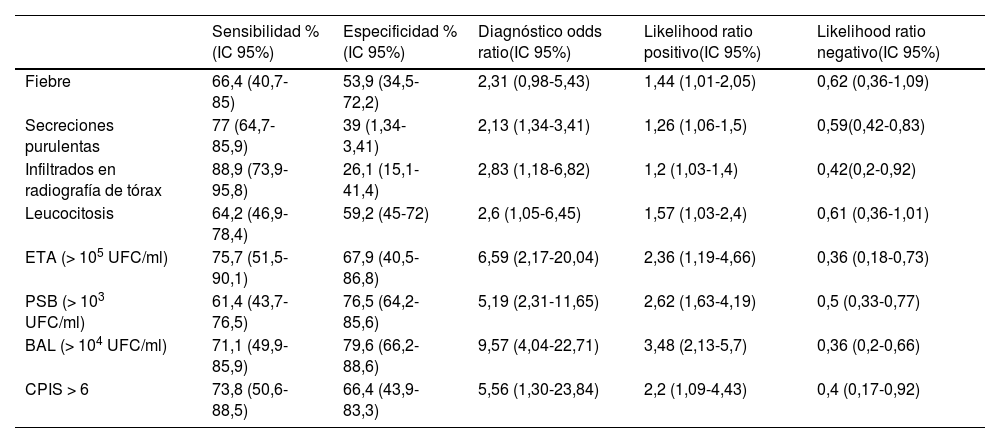
Una revisión sistemática y metaanálisis de 25 estudios sobre el diagnóstico de VAP encontró que los hallazgos del examen físico (fiebre, secreciones purulentas), radiografía de tórax, los cultivos del aspirado endotraqueal, los cultivos broncoscópicos y la CPIS tienen poca precisión para diagnosticar VAP30 (tabla 2).
Estimaciones de la realización del examen físico, radiografía de tórax, valores de laboratorio y CPIS para el diagnóstico de neumonía asociada a ventilador, en relación con el estándar de referencia de histopatología a partir de biopsia de pulmón
| Sensibilidad %(IC 95%) | Especificidad %(IC 95%) | Diagnóstico odds ratio(IC 95%) | Likelihood ratio positivo(IC 95%) | Likelihood ratio negativo(IC 95%) | |
|---|---|---|---|---|---|
| Fiebre | 66,4 (40,7-85) | 53,9 (34,5-72,2) | 2,31 (0,98-5,43) | 1,44 (1,01-2,05) | 0,62 (0,36-1,09) |
| Secreciones purulentas | 77 (64,7-85,9) | 39 (1,34-3,41) | 2,13 (1,34-3,41) | 1,26 (1,06-1,5) | 0,59(0,42-0,83) |
| Infiltrados en radiografía de tórax | 88,9 (73,9-95,8) | 26,1 (15,1-41,4) | 2,83 (1,18-6,82) | 1,2 (1,03-1,4) | 0,42(0,2-0,92) |
| Leucocitosis | 64,2 (46,9-78,4) | 59,2 (45-72) | 2,6 (1,05-6,45) | 1,57 (1,03-2,4) | 0,61 (0,36-1,01) |
| ETA (> 105 UFC/ml) | 75,7 (51,5-90,1) | 67,9 (40,5-86,8) | 6,59 (2,17-20,04) | 2,36 (1,19-4,66) | 0,36 (0,18-0,73) |
| PSB (> 103 UFC/ml) | 61,4 (43,7-76,5) | 76,5 (64,2-85,6) | 5,19 (2,31-11,65) | 2,62 (1,63-4,19) | 0,5 (0,33-0,77) |
| BAL (> 104 UFC/ml) | 71,1 (49,9-85,9) | 79,6 (66,2-88,6) | 9,57 (4,04-22,71) | 3,48 (2,13-5,7) | 0,36 (0,2-0,66) |
| CPIS > 6 | 73,8 (50,6-88,5) | 66,4 (43,9-83,3) | 5,56 (1,30-23,84) | 2,2 (1,09-4,43) | 0,4 (0,17-0,92) |
BAL: lavado broncoalveolar; CPIS: puntuación de infección pulmonar clínica; ETA: aspirado endotraqueal; IC: intervalo de confianza; PSB: cepillo protegido; UFC: unidades formadoras de colonias.
Método de referencia: Histopatología.
Varios estudios examinaron las combinaciones de signos o pruebas30 (tabla 3).
Estimaciones resumidas del desempeño de combinaciones de hallazgos clínicos de estudios individuales
| Sensibilidad %(IC 95%) | Especificidad %(IC 95%) | Likelihood ratio positivo(IC 95%) | Likelihood ratio negativo(IC 95%) | |
|---|---|---|---|---|
| Tejerina et al. (142 con VAP, 111 sin VAP) | ||||
| Infiltrado en radiografía de tórax + 1 de: leucocitosis, fiebre, secreciones purulentas | 64,8 (56,6-72,2) | 36 (27,7-45,3) | 1,01 (0,84-1,22) | 0,98 (0,7-1,36) |
| Infiltrado en radiografía de tórax + 3 de: leucocitosis, fiebre, secreciones purulentas | 15,5 (10,5-22,3) | 91 (84,2-95) | 1,72 (0,85-3,48) | 0,93 (0,85-1,02) |
| Fabregas et al. (13 con VAP, 12 sin VAP) | ||||
| Infiltrado en radiografía de tórax + 1 de: leucocitosis, fiebre, secreciones purulentas | 84,6 (57,8-95,7) | 33,3 (13,8-60,9) | 1,27 (0,8-2,0) | 0,46 (0,1-2,08) |
| Infiltrado en radiografía de tórax + 2 de: leucocitosis, fiebre, secreciones purulentas | 69,2 (42,4-87,3) | 75 (46,8-91,1) | 2,77 (0,97-7,87) | 0,41 (0,17-0,99) |
| Infiltrado en radiografía de tórax + 3 de: leucocitosis, fiebre, secreciones purulentas | 23,1 (8,2-50,3) | 91,7 (64,6-98,5) | 2,77 (0,33-23,14) | 0,84 (0,6-1,18) |
| Torres et al. (18 con VAP, 12 sin VAP) | ||||
| Secreciones purulentas y: A) leucocitosis; o B) infiltrado en radiografía de tórax | 70 | 45 |
IC: intervalo de confianza.
Los más estudiados son la procalcitonina (PCT), el receptor desencadenante soluble expresado en células mieloides (sTREM-1) y la proteínaC reactiva (PCR). Sin embargo, son inconsistentes en el diagnóstico de VAP, alterados por el uso de antibióticos y con sensibilidades y especificidades variables44-47. Por lo tanto, las directrices recientes no recomiendan el uso de biomarcadores para el diagnóstico de VAP, aunque sugieren que pueden ofrecer orientación sobre la duración del tratamiento7,44,47.
Las características de los dos biomarcadores más utilizados en la práctica clínica se observan en la tabla 4.
Características de la proteína C reactiva y de la procalcitonina
| Biomarcador | Proteína C reactiva | Procalcitonina |
|---|---|---|
| Propiedades | Pentraxina | Hormoquina |
| Valores normales | 0,08 mg/dl (media) | <1 ng/ml |
| Pico máximo | > 50 mg/dl | > 100 ng/ml |
| Origen | Hígado | Todas células y macrófagos |
| Tiempo a elevarse | 4-6 horas | 3-4 horas |
| Tiempo a concentración pico | 36-50 horas | Alrededor de 24 horas |
| Vida media | 19 horas | 22-35 horas |
| Esteroides | No efecto | Frecuente falsos negativos |
| Inmunosupresión | No efecto | Frecuente falsos negativos |
| Neutropenia | No efecto | Frecuente falsos negativos |
| Falla renal | No efecto | Aumenta valores |
| Terapia de reemplazo renal | No efecto | Disminuye valores |
| Falla hepática crónica | Disminuye (70% de lo normal) | No efecto |
| Falla hepática aguda | No incrementa | No efecto |
| Segundo hit infeccioso | Disminuye (70% del primer episodio) | Disminuye (10% del primer episodio) |
| Infección bacteriana vs viral | Pobre | Pobre |
Tomado de Torres et al.44.
En pacientes con VAP documentada microbiológicamente, una PCR >0,6 del valor inicial en el día4 (D4) fue un marcador de mal resultado48. Utilizando el concepto de índice de PCR, se han definido cuatro patrones individuales de respuesta a la terapia con antibióticos: 1)patrón de respuesta rápida, que consiste en una disminución rápida del índice de PCR a <0,4 en el D4; 2)patrón de respuesta lento, que es una disminución continua del índice de PCR, con un valor en D4 >0,4 pero <0,8; 3)patrón de falta de respuesta, definido por una proporción de PCR persistentemente >0,8 (y a veces incluso en aumento), y 4)patrón de respuesta bifásico, que se caracteriza por una caída inicial en el índice de PCR <0,8, seguida de un aumento secundario hasta un valor por encima de ese umbral48.
En pacientes con VAP, la PCT medida al inicio y en el D4 del tratamiento podría predecir la supervivencia, diferenciando a los pacientes con buenos y malos resultados. Los niveles elevados persistentes de PCT en el D4 de la terapia con antibióticos fueron indicativos de un fracaso en el control de la infección49,50. Una disminución >80% de los niveles iniciales o valores <0,5ng/ml es lo que se espera como respuesta al tratamiento. Hasta el momento hay al menos 18 ensayos clínicos aleatorizados (ECA) que evalúan la terapia antibiótica guiada por PCT en pacientes críticamente enfermos, con pruebas sólidas de que esta estrategia es segura, se asocia con una duración más corta del tratamiento y, en algunos ECA, disminuye la mortalidad. Sin embargo, las principales críticas han sido que, en los controles de los primeros ECA, la duración de la terapia con antibióticos fue más larga de lo recomendado47.
En la práctica clínica, los pacientes que presentan niveles persistentemente elevados de biomarcadores durante el D3/D4 de la terapia con antibióticos deben generar sospecha de fracaso del tratamiento y deben impulsar un enfoque diagnóstico y terapéutico agresivo51.
Nuevas herramientas molecularesLas herramientas que utilizan el uso de la reacción en cadena de polimerasa (PCR) múltiple para detectar ácido desoxirribonucleico (ADN) bacteriano acortan el tiempo de identificación de los microorganismos y sus mecanismos de resistencia en unas pocas horas, lo que permite hacer ajustes tempranos a los antibióticos. Las dos técnicas más utilizadas son el panel FilmArray neumonía plus de Biofire®, que analiza 18 bacterias (11 gramnegativas, 4 grampositivas y 3 atípicas), 7 marcadores de resistencia a los antibióticos y 9 virus, y el panel Unyvero de Curetis®, que analiza 20 bacterias y 10 mecanismos de resistencia. Las diferencias entre ambos paneles se pueden ver en la tabla 5.
Comparación de dos paneles de PCR múltiplex para neumonía
| Panel FilmArray neumonía | Panel Unyvero | |
|---|---|---|
| Muestra | BALEsputoETA | BALEsputoETA |
| Objetivos bacterianos | 18 | 20 (incluye Pneumocystis jirovecii y Stenotrophomonas maltophilia) |
| Objetivos virales | 8 | 0 |
| Marcadores de resistencia | 7 | 10 |
| Cuantificación | Semicuantitativo en copias de ADN/ml desde 104 a >107 | No cuantifica |
| Sensibilidad ponderada | 96,2% | 94,7% |
| Especificidad ponderada | 98,3% | 98,4% |
| Tiempo de respuesta | 1,5 horas | 4,5 horas |
| Tecnología | Multiplex PCR | Multiplex PCR seguida de probe array |
BAL: lavado broncoalveolar; ETA: aspirado endotraqueal.
Las técnicas están siendo cada vez más estudiadas en VAP52-56. Entre sus ventajas están la de obtener resultados tempranos para una apropiada terapia de escalación o desescalación antibiótica promoviendo el uso adecuado de antimicrobianos (stewardship), su alto valor predictivo negativo (para los microorganismos que analiza), la identificación temprana de mecanismos de resistencia (carbapenemasas, betalactamasas de espectro extendido para gramnegativos y la resistencia a la oxacilina para S.aureus), la mayor probabilidad de resultados positivos en pacientes que están con antibióticos con respecto a los cultivos en los que se pueden negativizar sus resultados, y su uso en pacientes inmunosuprimidos. Sin embargo, este tipo de técnica está limitada por el riesgo de sobredetección, es decir, detección de ADN de microorganismos no viables (especialmente, cuando las copias de ADN son bajas: 104 o 105).
En un futuro, los estudios del microbioma pulmonar a través de la extracción de ADN y ARN para secuenciación de las muestras para metagenómica y metatranscriptómica nos permitirán determinar los perfiles funcionales (activos viables) de los genes de virulencia y resistencia de los microorganismos y diferenciar los genes humanos expresados.
Inteligencia artificial (IA)En un estudio pequeño, el aprendizaje automático para la predicción de VAP se consideró superior al CPIS para pacientes con alto riesgo de VAP solo 24horas después de las intubaciones57. Se requieren más recursos, inversión e investigación antes de una implementación generalizada para el diagnóstico, el pronóstico y el manejo clínico guiado de la VAP con la IA.
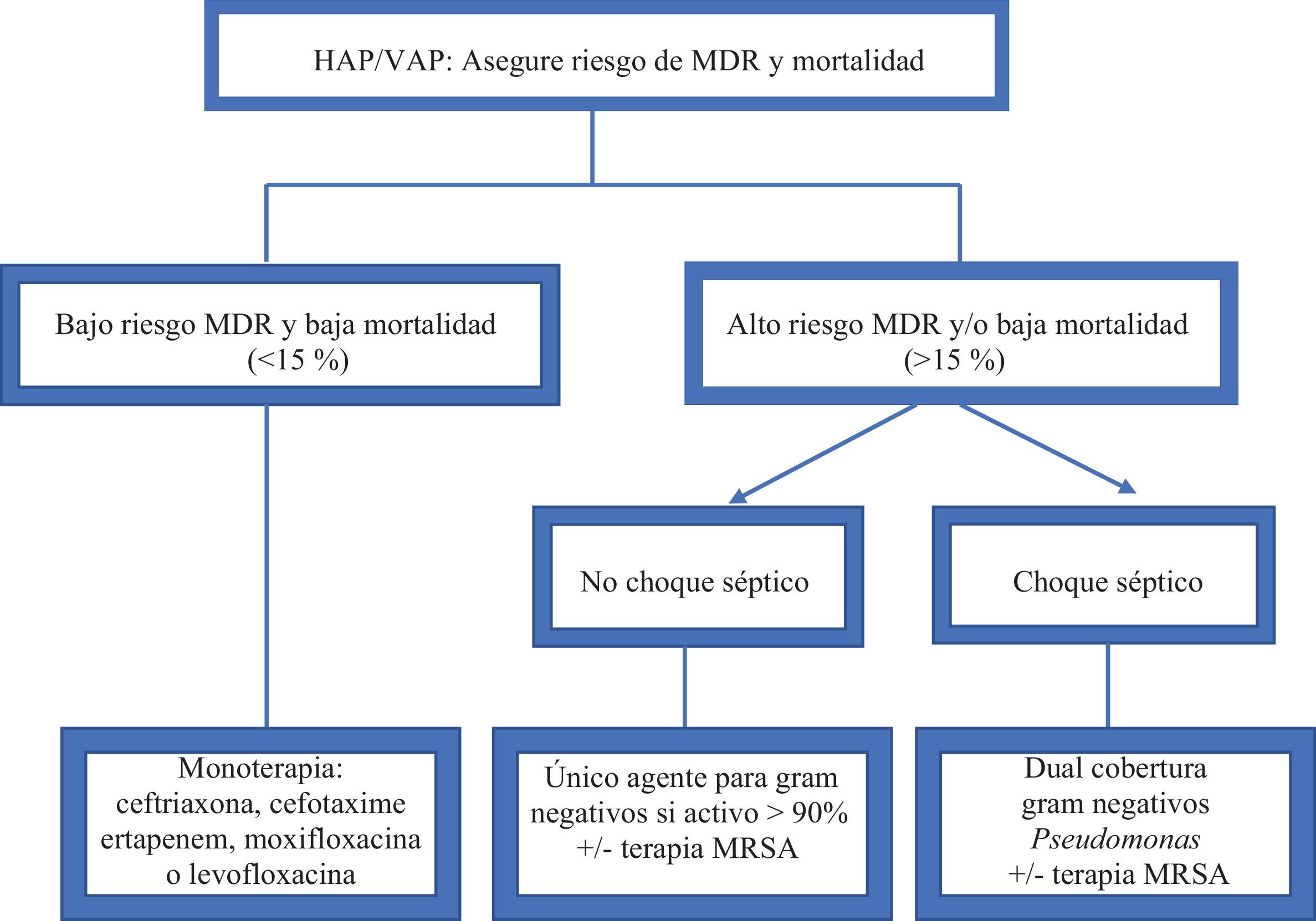
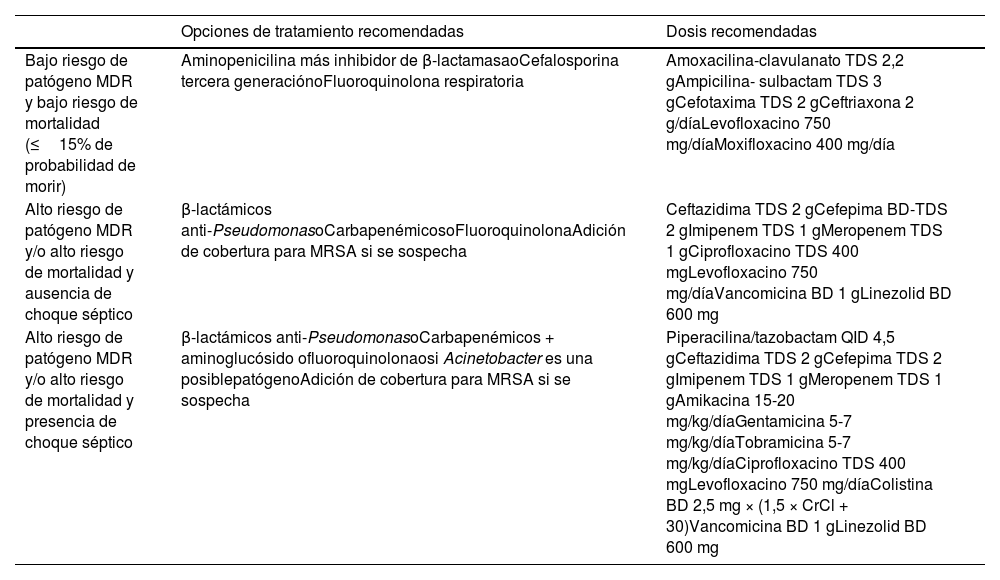
TratamientoEl apropiado tratamiento temprano con antibióticos es esencial para reducir la incidencia de resultados negativos en HAP/VAP; sin embargo, se debe evitar tanto la terapia ineficaz como el tratamiento excesivo. En este contexto, es crucial considerar conjuntamente el riesgo de patógeno MDR, el riesgo de mortalidad y la prevalencia local de resistencia a los antibióticos, para identificar el tratamiento adecuado7. En la figura 1 se presentan las recomendaciones para el tratamiento antimicrobiano empírico de la ERS/ESICM/ESCMID/ALAT, y en la tabla 6 se resumen estas recomendaciones. Tan pronto como estén disponibles los resultados microbiológicos, la terapia debe centrarse o limitarse en función del patógeno aislado y los resultados del antibiograma.
Recomendaciones para el tratamiento antimicrobiano de las guías ERS/ESICM/ESCMID/ALAT
| Opciones de tratamiento recomendadas | Dosis recomendadas | |
|---|---|---|
| Bajo riesgo de patógeno MDR y bajo riesgo de mortalidad (≤15% de probabilidad de morir) | Aminopenicilina más inhibidor de β-lactamasaoCefalosporina tercera generaciónoFluoroquinolona respiratoria | Amoxacilina-clavulanato TDS 2,2 gAmpicilina- sulbactam TDS 3 gCefotaxima TDS 2 gCeftriaxona 2 g/díaLevofloxacino 750 mg/díaMoxifloxacino 400 mg/día |
| Alto riesgo de patógeno MDR y/o alto riesgo de mortalidad y ausencia de choque séptico | β-lactámicos anti-PseudomonasoCarbapenémicosoFluoroquinolonaAdición de cobertura para MRSA si se sospecha | Ceftazidima TDS 2 gCefepima BD-TDS 2 gImipenem TDS 1 gMeropenem TDS 1 gCiprofloxacino TDS 400 mgLevofloxacino 750 mg/díaVancomicina BD 1 gLinezolid BD 600 mg |
| Alto riesgo de patógeno MDR y/o alto riesgo de mortalidad y presencia de choque séptico | β-lactámicos anti-PseudomonasoCarbapenémicos + aminoglucósido ofluoroquinolonaosi Acinetobacter es una posiblepatógenoAdición de cobertura para MRSA si se sospecha | Piperacilina/tazobactam QID 4,5 gCeftazidima TDS 2 gCefepima TDS 2 gImipenem TDS 1 gMeropenem TDS 1 gAmikacina 15-20 mg/kg/díaGentamicina 5-7 mg/kg/díaTobramicina 5-7 mg/kg/díaCiprofloxacino TDS 400 mgLevofloxacino 750 mg/díaColistina BD 2,5 mg × (1,5 × CrCl + 30)Vancomicina BD 1 gLinezolid BD 600 mg |
BD: dos veces al día; CrCl: depuración de creatinina; QID: cuatro veces al día; TDS: tres veces al día.
Tanto las directrices europeas como las americanas recomiendan que la duración del tratamiento antimicrobiano para la VAP no debe exceder los 7días en la mayoría de los pacientes, incluidos los infectados con bacilos gramnegativos no fermentadores (Pseudomonas aeruginosa, Acinetobacter spp…)58. Un curso más prolongado puede ser apropiado para pacientes con fibrosis quística, inmunosuprimidos, para los pacientes con empiema, absceso pulmonar o neumonía necrosante, y para los pacientes con patógenos difíciles de tratar7,21,58. También es posible que se necesiten ciclos más prolongados de antibióticos en pacientes con terapia empírica inicial inapropiada, y deben individualizarse según la respuesta clínica del paciente, los hallazgos bacteriológicos específicos (como patógenos MDR, MRSA o bacteriemia) y la medición seriada de biomarcadores cuando esté indicado7.
Se debe agregar terapia para estafilococo resistente a la meticilina (MRSA) cuando el paciente tenga colonización conocida previa por MRSA, o la prevalencia de MRSA en la UCI es alta (>20%)9,21.
Algunos pacientes pueden haber recibido antibióticos antes de las muestras microbiológicas, hecho que altera los resultados de los cultivos, siendo negativos muchas veces. En tales casos, dar un curso completo (7días) de antibióticos pueden exponer al paciente a antibióticos prolongados e indebidos y puede promover la resistencia de los antibióticos59. Allí es donde tienen utilidad las herramientas moleculares por su alto valor predictivo negativo, en donde un resultado negativo genera mayor seguridad en suspender o no iniciar antibióticos56. Otra posibilidad es reevaluar el paciente a las 48-72horas: si el curso clínico es favorable y la probabilidad de infección es baja, los antibióticos podrían detenerse21. Otra solución es utilizar la PCT y suspender los antibióticos a las 48-72horas si el nivel es <0,5ng/ml o tiene una disminución de más del 80% en comparación con el valor máximo inicial60.
Recordar que siempre debemos considerar las posibles causas de falla en la respuesta a la terapia antibiótica inicial contra la VAP/NN9:
- 1.
Espectro inadecuado de antimicrobianos.
- 2.
Prescripción de dosificación inadecuada de antibiótico(s).
- 3.
Falta o control insuficiente de la fuente de la VAP/NN (empiema, absceso, neumonía necrosante, origen extrapulmonar).
- 4.
Factores individuales específicos, como son:
- •
Alta gravedad clínica.
- •
Inmunosuprimidos.
- •
Duración inadecuada de la terapia.
- •
Diagnóstico incorrecto (insuficiencia cardíaca, embolia pulmonar).
- •
Un metaanálisis de 52 estudios en pacientes con VAP cuyo objetivo era determinar los niveles terapéuticos de los antibióticos en el líquido de revestimiento epitelial (ELF) encontró que las relaciones de penetración de ELF (concentración de antibióticos en el ELF en relación al plasma) están disminuidas en comparación con voluntarios sanos y que, por lo tanto, se requiere un ajuste de dosis61. Las relaciones de penetración de ELF para aminoglucósidos y la mayoría de los β-lactámicos administrados por vía intravenosa fueron entre 0,12 y 0,57. La colistina intravenosa puede ser indetectable en el ELF; en contraste, las relaciones de penetración con fluoroquinolonas son buenas hasta de 1,31.
El uso de datos de PK/PD para optimizar la dosificación de antibióticos ha sido respaldado en el consenso de la IDSA21, para alcanzar las concentraciones terapéuticas adecuadas de antimicrobianos, en escenarios tales como shock séptico, la terapia de reemplazo renal continua y el ECMO. Por lo tanto, están a favor del uso de infusiones extendidas o continuas, o la monitorización terapéutica de medicamentos.
GuíasLas dos recomendaciones de expertos más importantes son las de la Sociedad de Enfermedades Infecciosas de América (IDSA) - Sociedad Americana de Tóráx (ATS) de 201621, y las guías de la de la Sociedad Europea Respiratoria (ERS) - Sociedad Europea de Medicina Crítica (ESICM) - Sociedad Europea de Microbiología Clínica y Enfermedades Infecciosas (ESCMID) - Asociación Latinoamericana del Tórax (ALAT) de 20177. Las diferencias en sus recomendaciones se pueden ver en la tabla 7.
Diferencias más significativas entre las guías americana y europea
| Americana | Europea |
|---|---|
| Diagnóstico | |
| Muestras no invasivas | Muestras distales cuantitativas |
| Recomienda PCT tan bien como el seguimiento clínico para la desescalación antibiótica | En contra del uso de PCT para guiar la reducción de antibióticos en la la atención estándar |
| No recomienda utilizar el CPIS | Recomienda utilizar el CPIS para determinar pacientes de «bajo riesgo» que pueden suspenderse los antibióticos después de 72 h |
| Tratamiento | |
| Terapia empírica guiada por disfunción orgánica y factores de MDR | Terapia empírica guiada por el riesgo de mortalidad, la ecología local y los factores de MDR |
| Recomienda PK/PD para optimizar dosis de antibióticos | |
| Recomienda adicionar antibióticos inhalados si no respuesta a terapia inicial | |
| En contra del uso rutinario de aminoglucósidos y colistina | |
| Prevención | |
| No hace recomendaciones | No se pueden hacer recomendaciones sobre el uso de clorhexidina debido a perfil de seguridad controvertido |
| Recomienda SOD pero no SDD en entornos con bajas tasas de resistencia a bacterias | |
CPIS: puntuación de infección pulmonar clínica; MDR: multi-drogorresistencia; PK/PD: farmacocinética/farmacodinamia; SOD: descontaminación oral y digestiva; SDD: descontaminación digestiva selectiva.
Como se puede observar, la IDSA favorece muestras no invasivas con cultivos semicuantitativos (ETA), mientras que las europeas recomiendan el muestreo cuantitativo distal (BAL) antes del uso de antibióticos. Sin embargo, ambas son recomendaciones débiles con evidencia de baja calidad.
El uso de la CPIS y biomarcadores como la PCT sola o en combinación con criterios clínicos, la IDSA no lo recomienda. Las pautas europeas no hicieron referencia al uso de biomarcadores para determinar si comenzar o no los antibióticos. Pero la guía europea está en contra del uso de PCT para guiar la reducción de antibióticos en la atención estándar, mientras que la IDSA recomienda la PCT como el seguimiento clínico para la desescalación antibiótica. Sin embargo, las guías europeas consideran que puede ser útil la PCT en aquellos pacientes con terapia inicial inapropiada, pacientes severamente inmunocomprometidos, con patógenos MDR, y cuando se necesita una terapia antibiótica de segunda línea.
La IDSA no recomienda el uso de la CPIS para decidir si comenzar con antibióticos. Las pautas europeas se refieren a la utilidad de la CPIS para determinar aquellos con «bajo riesgo» (es decir, CPIS ≤6 al inicio de los síntomas y a las 72h), porque si en estos pacientes los antibióticos se suspenden a las 72horas se tiene una tasa menor de resistencia a los antimicrobianos y probablemente se trate más de una traqueobronquitis.
Ambas guías recomiendan los antibióticos por solo 7días, pero la europea adjunta una advertencia, y es que esta recomendación no debe extenderse a pacientes con inmunodeficiencia, fibrosis quística, empiema, absceso pulmonar, cavitación o neumonía necrosante. La guía europea advierte también que es posible que sea necesario modificar este tiempo en función de ciertas condiciones clínicas, como son un tratamiento inicial inapropiado, patógenos MDR y terapias antibióticas de segunda línea.
Nuevos antibióticosEn los últimos años se han aprobado varias moléculas nuevas para el tratamiento de infecciones MDR, centrándose especialmente en las bacterias gramnegativas resistentes62. En la tabla 8 se observan las principales características de estos nuevos fármacos con respecto a su espectro de actividad y mecanismos de resistencia asociados.
Nuevos fármacos para el tratamiento de enterobacterias resistentes y gramnegativos no fermentadores
| Antibiótico | Mecanismo de acción | Espectro de actividad | Mecanismos de resistancia |
|---|---|---|---|
| Ceftolozano/tazobactam | Cefalosporina de quinta generación + clásico inhibidor β-lactamasas | Amplio espectro, incluyendo Pseudomonas aeruginosa | AmpC, PBP3, GalU; OXA-2/10, ESBLs, carbapenemasas clase A y B |
| Ceftazidima/avibactam | Cefalosporina + diazabicycloctanesInhibidor β-lactamasas | Amplio espectro, incluyendo Pseudomonas aeruginosa | AmpC, MexAB↑, PBP3, GalU; OXA-2/10, GES, KPC, carbapenemasas clase B |
| Imipenem/relebactam | Carbapenems + inhibidor β-lactamasas | Amplio espectro | OprD-, MexAB↑, MexST, ParRS, PBP2, PBP1a; carbapenemasas clase A y B |
| Meropenem/vaborbactam | Carbapenems + boronic acid inhibidor β-lactamasas | Amplio espectro | OprD-, MexAB↑, PBP3, GalU; carbapenemasas clase A y B |
| Cefiderocol | Cefalosporina siderófora | Amplio espectro | AmpC, PBP3, GalU; OXA-2/10, ESBLs, carbapenemasas clase A y B |
| Aztreonam/avibactam | Monobactam + diazabicycloctanesInhibidor β-lactamasas | Limitado espectro | MexAB↑, PBP3, GalU; ESBLs carbapenemasas clase A |
| Cefepima/zidebactam | Cefalosporina + diazabicycloctanesInhibidor β-lactamasas e inhibidores PBP2 | Amplio espectro | MexXY↑, MexAB↑, PBP3, GalU, PBP2; ESBLs, carbapenemasas clase A y B |
| Cefepima/taniborbactam | Cefalosporina + boronic acid inhibidor β-lactamasas incluyendo MBLs | Amplio espectro | MexXY↑, MexAB↑ |
AmpC: resistencia beta-lactamasa clase C; BLEE: betalactamasa de espectro extendido; GalU: alfa galactosidasa; GES: betalactamasa de espectro extendido de Guayana; KPC: carbapenemasa de Klebsiella pneumoniae; MBL: metalo-beta-lactamasa; Mex: mecanismo resistente al eflujo de múltiples fármacos; OXA: beta-lactamasa oxacillina; ParRS: sistema regulador de resistencia de Pseudomonas aeruginosa; PBP: proteína fijadora de penicilina.
Los inhaladores de dosis medidas presurizados (pMDI), los nebulizadores presurizados a chorro (JN), el nebulizador ultrasónico y las nebulizaciones con malla ultrasónica y vibratoria (VMN) son los dispositivos de aerosol más comunes utilizados en la UCI. De estos, la VMN proporciona características óptimas de aerosol, y en lo posible es el nebulizador preferido63.
Hasta la fecha, los antibióticos nebulizados no pueden recomendarse como alternativa a la vía intravenosa, dado que faltan datos sobre esta indicación, porque entre el 10 y el 20% de los pacientes con VAP tienen bacteriemia, y porque el uso diario repetido de la nebulización puede prolongar la duración de la ventilación mecánica64,65.
El uso de antibióticos nebulizados como tratamiento complementario a la vía intravenosa tampoco está recomendado. Tres ECA recientes no lograron demostrar superioridad de los antibióticos nebulizados (amikacina sola o combinada con fosfomicina) sobre placebo en pacientes con VAP debido a «patógenos tradicionales»66-70. Es posible que los ensayos IASIS, INHALE y VAPORISE no hayan logrado mostrar un beneficio clínico de combinar aminoglucósidos nebulizados con betalactámicos intravenosos para el tratamiento de la VAP debido a la inclusión de muchos pacientes con patógenos susceptibles, la administración de dosis bajas probablemente subóptimas de aminoglucósidos nebulizados y las configuraciones del ventilador no óptimas.
Por tanto, se debe recomendar solo el uso de antibióticos nebulizados a pacientes con VAP por bacilos gramnegativos con MDR que sean susceptibles solo a colistina o aminoglucósidos21,65,69,70. Si los antibióticos nebulizados en pacientes con traqueobronquitis (TAV) por bacilos gramnegativos MDR pueden disminuir la aparición posterior de VAP, como lo sugieren dos estudios realizados, queda por determinar71,72. Actualmente, las guías europeas recomiendan evitar el uso adicional de antibióticos en aerosol para el tratamiento de TAV por la evidencia baja.
PrevenciónLos mecanismos fisiopatológicos que conducen al desarrollo de HAP implican:
- •
Factores relacionados con el paciente: desnutrición, inmunosupresión, dispositivos médicos.
- •
Factores iatrogénicos: ingreso a UCI, intubación, sedación, control del dolor.
Klompas et al.73 realizaron en 2022 una actualización de las estrategias para prevenir la VAP, los eventos asociados al ventilador y la HAP (tabla 9).
Estrategias para la prevención de la neumonía adquirida en el hospital
| Estrategias para la prevención de HAP/VAP |
| Proporcionar un cuidado bucal regular con el cepillado dental, evitando el uso de clorhexidina74,75 |
| • Diagnosticar y manejar la disfagia |
| • Proporcionar movilización temprana76 |
| • Implementar intervenciones multimodales para prevenir la propagación de infecciones virales (por ejemplo, COVID-19) |
| Estrategias para la prevención de VAP únicamente |
| • Evite la intubación y reintubación utilizando oxígeno nasal de alto flujo o ventilación con presión positiva no invasiva77,78 |
| • Minimizar la sedación: |
| - Evite las benzodiazepinas en favor de otros agentes79 |
| - Utilice un protocolo para minimizar la sedación80 |
| - Implemente un protocolo de liberación del ventilador81 |
| • Evite cambiar frecuentemente el circuito del ventilador82 |
| • Eleve la cabecera de la cama entre 30 y 45°83 |
| • Proporcionar nutrición enteral temprana versus nutrición parenteral84 |
| Estrategias adicionales |
| • Buena evidencia de que la intervención mejora los resultados en algunas poblaciones, pero puede conferir cierto riesgo en otras: |
| - Utilizar descontaminación oral o digestiva selectiva en países y UCI con baja prevalencia de organismos resistentes a los antibióticos85 |
| • Puede reducir las tasas de VAP, pero no hay datos suficientes para determinar el impacto en la duración de la ventilación mecánica, la duración de la estancia hospitalaria o la mortalidad |
| - Utilice tubos endotraqueales con puertos de drenaje de secreciones subglóticas para pacientes que se espera que requieran >48 a 72horas de ventilación mecánica86 |
| - Considere la traqueotomía temprana87 |
| - Considere la alimentación pospilórica en lugar de la gástrica para pacientes con intolerancia gástrica o con alto riesgo de aspiración88 |
A finales de 2023, Ehrmann et al. realizaron en 19UCI en Francia el estudio AMIKINHAL89, en donde a los pacientes adultos que llevaban VMI durante al menos 72horas se les nebulizaba con el uso de un nebulizador de malla vibratoria (Aerogen Solo, Aerogen) que se llenaba con amikacina a una dosis de 20mg/kg. Se incluyeron 847 en los análisis (417 asignados al grupo de amikacina y 430 al grupo de placebo), y como resultados tuvieron que a los 28 días se había desarrollado VAP en 62 pacientes (15%) del grupo con amikacina nebulizada y en 95 pacientes (22%) del grupo de placebo (diferencia en el tiempo medio de supervivencia restringido con respecto a la neumonía asociada al ventilador, de 1,5días; IC95%: 0,6-2,5; p=0,004). Se desarrolló complicación asociada al ventilador relacionada con la infección en 74 pacientes (18%) en el grupo de amikacina nebulizada y en 111 pacientes (26%) en el grupo de placebo (índice de riesgo: 0,66; IC95%: 0,50-0,89). Se necesitan más estudios para determinar la validez externa de este estudio.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no encontrarse en situación real de conflicto de intereses asociado con el trabajo de investigación realizado y sometido a publicación.
Los autores agradecen a la Universidad Pontificia Bolivariana y a la Universidad de Barcelona.