La neumonía por Pneumocystis jirovecii es una infección oportunista que se presenta habitualmente en pacientes con inmunodeficiencias graves adquiridas. Durante la actual contingencia en salud por la COVID-19 se ha incrementado la presencia de infección por este microorganismo fúngico en pacientes críticamente enfermos, lo que aumenta el riesgo de desenlaces fatales. A continuación, se presenta el caso de un hombre con neumonía grave por SARS-CoV-2, inmunosupresión por VIH y coinfección por P. jirovecii quien desarrolló síndrome de distrés respiratorio agudo requiriendo soporte ventilatorio mecánico invasivo con presión positiva. A pesar del manejo intrahospitalario recibido, terapia antibiótica y soporte ventilatorio, el paciente presentó deterioro hemodinámico con inestabilidad falleciendo al día 20 de la hospitalización. Posteriormente se realiza una revisión bibliográfica de la literatura actual discutiendo aspectos como epidemiología, fisiopatología, diagnóstico oportuno y tratamiento acerca de la relación entre P. jirovecii y SARS-CoV-2 en pacientes críticamente enfermos.
Pneumocystis jirovecii pneumonia is an opportunistic infection that commonly occurs in patients with severe acquired immunodeficiencies. During the current health contingency, the presence of infection and co-infection by P. jirovecii in critically ill patients is apparently increasing altogether with the risk of fatal outcomes. The following is the case of a man with severe SARS-CoV-2 pneumonia, HIV immunosuppression and P. jirovecii coinfection who developed acute respiratory distress syndrome requiring invasive mechanical positive pressure ventilatory support. Despite the in-hospital management received, antibiotic therapy, and ventilatory support, the patient presented hemodynamic deterioration with instability, dying on day 20 of hospitalization. Subsequently, a bibliographic review of the current literature is carried out, discussing aspects such as epidemiology, pathophysiology, timely diagnosis, and treatment between the relationship of P. jirovecii and SARS-CoV-2 in critically ill patients.
La infección por el virus del Coronavirus tipo 2 (SARS-CoV-2) produce una alteración de la función pulmonar y alveolar provocando insuficiencia respiratoria aguda o incluso la muerte1. Se ha asociado a un amplio espectro de presentaciones atípicas, que complica a los pacientes inmunodeprimidos críticamente enfermos2. Una de estas condiciones es la infección con neumonía por Pneumocystis, subestimada en pacientes con enfermedad por coronavirus 2019 (COVID-19)3. La similitud entre los síntomas y los hallazgos radiológicos de ambas infecciones retrasa el diagnóstico e inicio de un tratamiento oportuno para esta infección fúngica4.
La infección por neumonía asociada a Pneumocystis es causada por el hongo Pneumocystis jirovecii, lo cual produce una disnea progresiva súbita que afecta principalmente a pacientes con defectos de las células T2. En fase aguda puede progresar a hipoxemia grave y síndrome de distrés respiratorio agudo (SDRA), lo que aumenta el riesgo de desenlaces fatales1. A continuación, se presenta el caso de un hombre con neumonía grave por SARS-CoV-2, inmunosupresión por VIH (virus de la inmunodeficiencia humana) y coinfección por P. jirovecii dentro de una unidad de cuidados intensivos (UCI). Además, se realizó una revisión de literatura acerca de la correlación entre ambas infecciones.
MetodologíaSe recolectó retrospectivamente datos clínicos de un paciente con antecedentes de VIH, que ingresó a la UCI con neumonía grave por SARS-CoV-2 y coinfección por P. jirovecii dentro de la institución Camino Universitario Distrital Adelita de Char (Barranquilla, Colombia). Lamentablemente el paciente falleció, por lo cual se tuvo que solicitar consentimiento informado a través del comité de ética institucional de investigación para la publicación del informe médico e imágenes adjuntas.
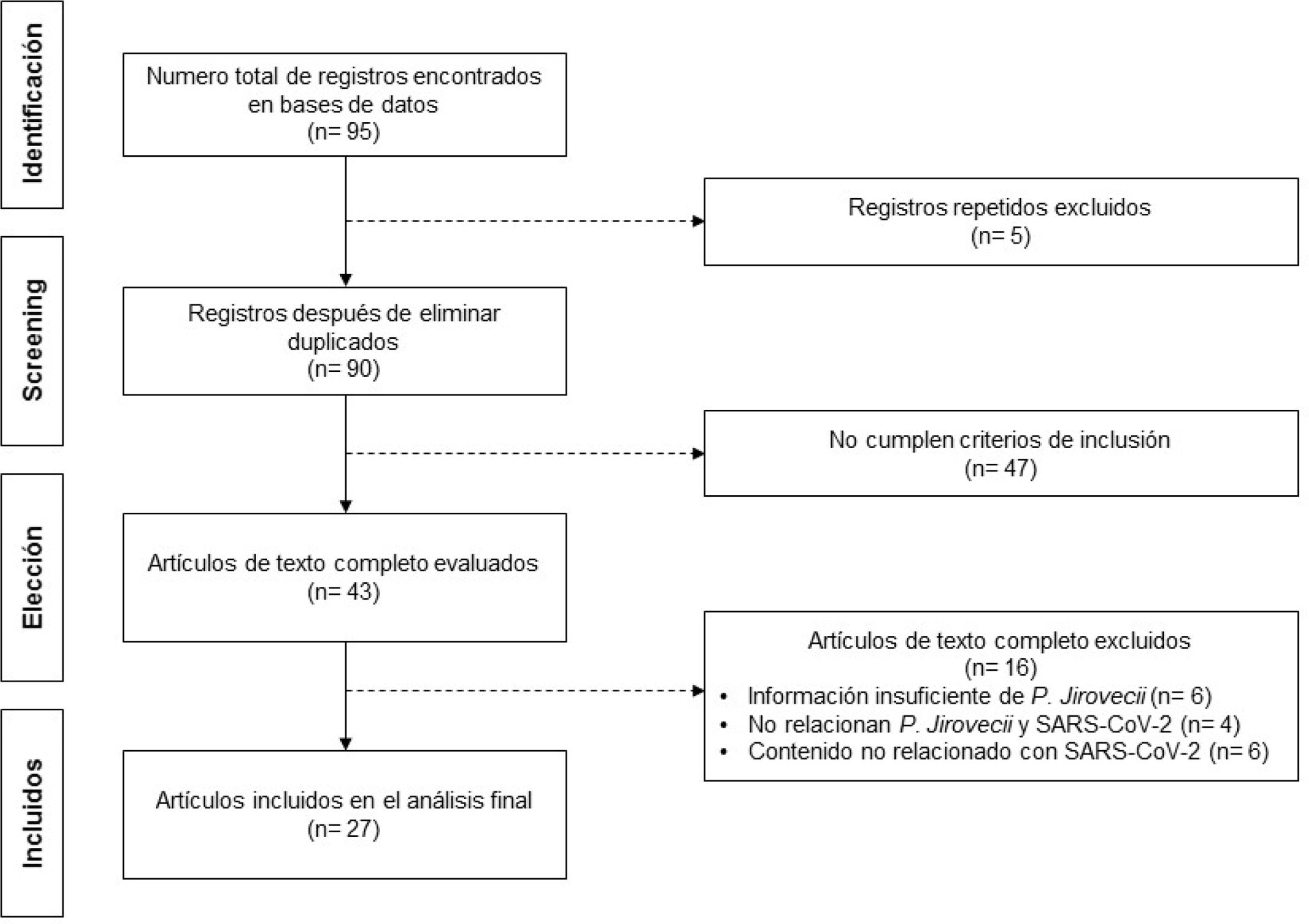
Se realizó un análisis sistemático bibliográfico a través de las bases de datos electrónicas PubMed, Medline, ScienceDirect, Revisiones Cochrane y Scielo con los términos «pneumocystis jirovecii», «pneumonia» y «SARS-CoV-2», encontrando 95 artículos. Se incluyeron reportes de caso, revisiones bibliográficas, cartas al editor, puntos de vista y serie de casos en inglés o español, acerca de P. jirovecii en pacientes con neumonía por SARS-CoV-2, entre el 30 de diciembre del 2019 y el 1 de abril del 2021 (fig. 1). Se excluyeron artículos con neumonía de SARS-CoV-2 asociada a otra infección diferente a la de P. jirovecii, reportes de casos en pacientes menores de 18 años y productos bibliográficos con resumen no disponible. Una vez seleccionados los artículos, se evaluaron aspectos que incluyeran epidemiología (casos reportados), fisiopatología, diagnóstico, tratamiento y pronóstico.
Caso clínicoHombre de 63 años, que acudió a centro médico por cuadro clínico de 10 días de evolución caracterizado por cefalea, fiebre no cuantificada, tos no productiva y disnea en reposo grado 3 según la modified Medical Research Council (mMRC). Presentaba antecedentes de obesidad grado II según la Organización Mundial de la Salud, con índice de masa corporal de 36kg/m2 y diagnóstico conocido de VIH/sida, en manejo farmacológico con terapia antirretroviral de gran actividad (emtricitabina 200mg+tenofovir 300mg y atazanavir 300mg+ritonavir 100mg). Al momento de la exploración física se evidenció regular estado de salud, con presión arterial de 120/80mmHg, temperatura de 38°C, saturación arterial de pulso (SpO2) del 92% al ambiente requiriendo cánula nasal a 3l/min, frecuencia cardiaca de 85latidos/min, frecuencia respiratoria de 32respiraciones/min y escala de Glasgow de 15/15. A la auscultación pulmonar presentaba estertores bilaterales, roncus y crépitos húmedos en ambos campos pulmonares.
Ante situación clínica en salud se decidió hospitalizar bajo diagnóstico de infección aguda de las vías respiratorias inferiores; se ordenó RT-PCR para SARS-CoV-2 resultando positivo 72h después, por lo que se estableció manejo antiinflamatorio y anticoagulante solicitando paraclínicos, gases arteriales (tabla 1) y estudios de imagen. Por probabilidad de neumonía adquirida en la comunidad (CURB-65 de 2 puntos) se inició cubrimiento antibiótico inicial con cefalosporina de cuarta generación. Debido al alto riesgo de falla ventilatoria y necesidad de soporte ventilatorio mecánico invasivo fue trasladado a UCI.
Laboratorios y gases arteriales de ingreso a UCI
| Paraclínico | Resultado |
|---|---|
| Alanina aminotransferasa (U/l) | 59,0 |
| Aspartato aminotransferasa (U/l) | 40,8 |
| Dímero D (ng/ml) | 365 |
| Ferritina (ng/ml) | 797,95 |
| BUN (mg/dl) | 15,06 |
| Creatinina (mg/dl) | 1,13 |
| Sodio (mmol/l) | 138,9 |
| Potasio (mmol/l) | 3,78 |
| Cloro (mmol/l) | 107,4 |
| Hematocrito (%) | 36,8 |
| Hemoglobina (g/dl) | 12,5 |
| Leucocitos (103/mm3) | 14,2 |
| Neutrófilos (%) | 86,1 |
| Eosinófilos (%) | 0,03 |
| Recuento linfocitos CD4+ (células/mm3) | 84 |
| Gases arteriales | |
| pH | 7,35 |
| PCO2 (mmHg) | 28,3 |
| PO2 (mmHg) | 52 |
| HCO3 (mmol/l) | 15,5 |
| BE ecf (mmol/l) | +10 |
BE ecf: exceso de base estándar; HCO3: bicarbonato; PCO2; presión parcial de dióxido de carbono; PO2: presión parcial de oxígeno.
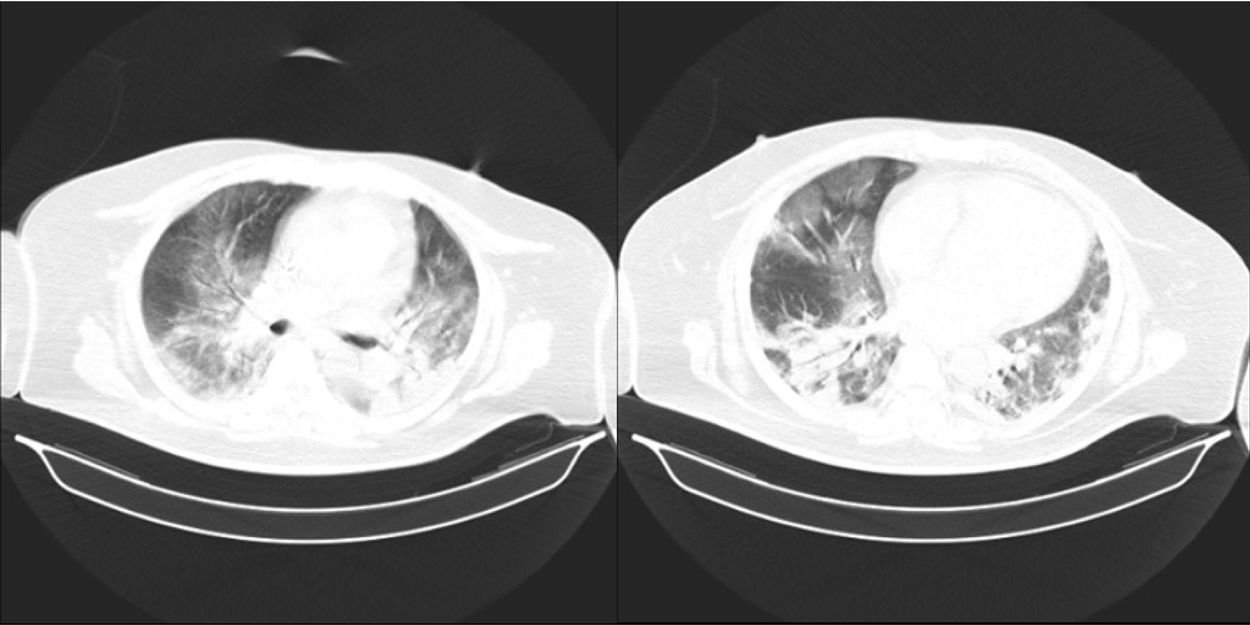
En la tomografía computarizada (TC) torácica se evidenció extensas opacidades intersticio-alveolares en vidrio deslustrado comprometiendo ambos lóbulos pulmonares, correspondiente a proceso bronconeumónico atípico (fig. 2). A pesar de la presencia de oxígeno de alto flujo con mascarilla de no reinhalación a 14l/min, persistía con SpO2<85% y mal patrón respiratorio, iniciando soporte ventilatorio mecánico invasivo con presión positiva secundario a SDRA según el consenso de Berlín, tomando muestra de secreción de aspirado bronquial para descartar sobreinfección con gérmenes atípicos. Ante la sospecha de infección oportunista y la presencia de factores de riesgo asociado (VIH; recuento absoluto de linfocitos T CD4+ de 84células/mm3) para P. jirovecii, se inició empíricamente trimetroprima-sulfametoxazol.
Posteriormente la prueba de reacción de la cadena a la polimerasa (PCR) cualitativa resultó positiva para la presencia de P. jirovecii, por lo que se continuó la terapia antibiótica con trimetroprima-sulfametoxazol. Secuencialmente, el paciente evolucionó de forma tórpida con shock séptico de 8 puntos en la escala de evaluación de fallo orgánico secuencial (SOFA), por lo que se indicó soporte vasopresor y se inició reposición hídrica avanzada; sin embargo, el paciente falleció a los 20 días de hospitalización.
Análisis de la literatura y de las bases de datosAspectos generalesLa neumonía asociada al hongo P. jirovecii es una infección transmisible oportunista que afecta a individuos inmunodeprimidos5. Se presenta en pacientes con factores de riesgo como el trasplante de órganos6, infección por VIH7, trastornos vasculares del colágeno8 y la administración de fármacos inmunomoduladores9. Esto se debe a una deficiente respuesta inmunitaria de células T CD4+, haciendo susceptible a la infección por este hongo oportunista6. En infecciones graves, hasta un 50% de los pacientes pueden requerir la necesidad de hospitalización en UCI, lo cual tiene una mortalidad de hasta el 40-60% de los casos10.
La infección por SARS-CoV-2 puede causar un estado de inmunodeficiencia que puede permitir la aparición de P. jirovecii en pacientes con COVID-1911. Se ha encontrado que las infecciones por P. jirovecii y SARS-CoV-2 pueden presentarse como procesos en conjunto, primordialmente en pacientes inmunodeprimidos7. Se presenta de forma aguda con hipoxemia grave y deterioro rápido de la función respiratoria, requiriendo ventilación mecánica invasiva8. Además, comparten características radiológicas en «vidrio deslustrado extenso», dificultando su distinción12.
EpidemiologíaSe estima que existen 37,9 millones de personas que viven con VIH en el mundo13. Esto aumenta el riesgo de infecciones oportunistas por microorganismos atípicos como P. jirovecii, principalmente en pacientes críticamente enfermos14. La incidencia ha disminuido después de la introducción de la terapia antirretroviral de gran actividad y el uso rutinario de profilaxis anti-Pneumocystis6. Sin embargo, en pacientes sin VIH representan la mayoría de casos de P. jirovecii en países industrializados8.
Hasta la fecha la asociación entre la infección por SARS-CoV-2 y la neumonía por P. jirovecii es poco conocida15. Los casos notificados de coinfección fúngica por P. jirovecii son escasos, debido al pequeño número de broncoscopias y necropsias realizadas hasta el momento16. En un estudio aislado realizado en Francia se encontró que el 1,45% (n=2) de las 145 muestras respiratorias con SARS-CoV-2 positivas tenían la presencia de P. jirovecii17. Otra investigación liderada por Alanio et al. en 2021 reportó que el 9,3% (n=10/108) de las muestras en lavado broncoalveolar presentaban aislamiento para P. jirovecii18. En nuestra revisión bibliográfica encontramos 10 reportes de casos aislados entre ambas entidades clínicas, cumpliendo con todas nuestras variables clínicas, como se describe en la tabla 2.
Casos reportados de neumonía por SARS-CoV-2 asociado a coinfección por Pneumocystis jirovecii entre el 30 de diciembre del 2019 y el 1 de abril del 2021
| Características clínicas de neumonía por SARS-CoV-2 asociado a coinfección por Pneumocystis jirovecii | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Autor | Edad (años) | Sexo | SARS-CoV-2 | PJI | VIH | Hospitalización (días) | VMI | Hallazgos radiológicos en TC o de Rx torácica inicial | Tratamiento antibiótico antifúngico | Condición final | Observaciones |
| Mang et al.2020Alemania3 | 52 | Hombre | Sí | Sí | Sí | 40 | Sí | Opacidades bilaterales en vidrio deslustrado, consolidaciones; patrón de pavimento loco | TMZ | Vivo | Presentaba coinfección con gérmenes atípicos bacterianos |
| Larzábal et al.2020Argentina5 | 46 | Mujer | Sí | Sí | Sí | 21 | No | Opacidades bilaterales intersticio-alveolares con proyección cefálica bilateral | TMZ; FCZ; CTX | Vivo | Antecedente de tabaquismoEl tratamiento fue escalonado a primaquina, clindamicina por lesión renal aguda AKIN III |
| De Francesco et al.2020Italia6 | 65 | Hombre | Sí | Sí | No | 84 | Sí | Infiltrados pulmonares bilaterales con opacidades en vidrio deslustrado | TMZ | Muerto | Antecedente de trasplante de riñón, hipertensión y diabetes mellitus tipo II insulinodependiente. Presentaba coinfección con gérmenes atípicos fúngicos |
| Rubiano et al.2020EE.UU.7 | 36 | Hombre | Sí | Sí | Sí | 26 | Sí | Enfermedad difusa del espacio aéreo alveolar en vidrio deslustrado de los lóbulos inferior y superior | TMZ | Muerto | El tratamiento antibiótico estuvo acompañado de prednisolona y remdesivir |
| Mouren et al.2021Francia11 | 65 | Hombre | Sí | Sí | No | 14 | No | Opacidades bilaterales en vidrio deslustrado subpleural predominantemente en lóbulos inferiores | TMZ | Vivo | En tratamiento con quimioterapia para leucemia linfocítica crónica recurrente por 4 ciclos |
| Coleman et al.2020Reino Unido12 | 55 | Hombre | Sí | Sí | Sí | 14 | No | Cambios quísticos subpleurales y paramediastino extenso; vidrio deslustrado subpleural bilateralmente; fibrosis pulmonar intersticial | CMZ | Vivo | Antecedente de asma |
| Jeican et al.2021Rumania16 | 52 | Hombre | Sí | Sí | No | 1 | Sí | Condensación pulmonar en el tercio posterior inferior del pulmón derecho | NR | Muerto | La identificación del P. jirovecii fue a través de muestras de tejido pulmonar durante la autopsia |
| Características clínicas de neumonía por SARS-CoV-2 asociado a coinfección por Pneumocystis jirovecii | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Autor | Edad (años) | Sexo | SARS-CoV-2 | PJI | VIH | Hospitalización (días) | VMI | Hallazgos radiológicos en TC o de Rx torácica inicial | Tratamiento antibiótico antifúngico | Condición final | Observaciones |
| Menon et al.2020EE.UU.20 | 83 | Mujer | Sí | Sí | No | 10 | Sí | Opacidades bilaterales difusas en vidrio deslustrado; pequeños focos nodulares de consolidación | TMZ | Vivo | Antecedente de asma |
| Broadhurst et al.2020Sudáfrica24 | 54 | Hombre | Sí | Sí | Sí | 8 | Sí | Opacidades bilaterales difusas en vidrio deslustrado de predominio inferior | CMZ; FCZ | Muerto | El tratamiento fue escalonado posteriormente a colistina, por coinfección por gérmenes bacterianos |
| Bhat et al.2020EE.UU.25 | 25 | Hombre | Sí | Sí | Sí | 21 | No | Cambios quísticos apicales; opacidades difusas en vidrio deslustrado; consolidación densa; neumotórax derecho espontáneo | TMZ | Vivo | El tratamiento antibiótico estuvo acompañado de prednisolona y remdesivir |
CMZ: cotrimoxazol; CTX: ceftriaxona; FCZ: fluconazol; NR: no se reporta; PJI: Pneumocystis jirovecii; Rx: radiografía; TC: tomografía computarizada; TMZ: trimetropima sulfametoxazol; VIH: virus de la inmunodeficiencia humana; VMI: ventilación mecánica invasiva.
El hongo P. jirovecii es un microorganismo que se localiza en los neumocitos tipo I6. El ciclo de vida se presenta con dos formas morfológicas: quística y atrófica (trofozoito). La forma quística es infecciosa y se almacena en los alvéolos16. La forma atrófica libera espora en el alvéolo, lo que genera un infiltrado inflamatorio que aumenta el grosor de la pared bronquial, reduce el diámetro y aumenta la resistencia al flujo de aire19. La forma infecciosa presenta una pared celular protectora gruesa, rica en β-glucanos, que permite que sobreviva en el ambiente exterior16.
En la mayoría de los pacientes con factores de riesgo para P. jirovecii, el hongo está inactivo y disperso en el pulmón sin crear una respuesta inmune con el huésped16. En pacientes críticamente enfermos con SARS-CoV-2 existen altos niveles de citocinas proinflamatorias (IL-1, IL-2, IL-6, necrosis tumoral alfa), antiinflamatorias (IL-4, IL-10) y disminución drástica de células T (CD4+, CD8)15. Este desequilibrio inmunológico conduce a un riesgo de coinfección fúngica grave por P. jirovecii o Aspergillus6. En un estudio de Kanduc et al., en 2020, se encontró que 17 de los 24 pentapéptidos compartidos entre el SARS-CoV-2 y las moléculas de surfactante eran semejantes a la de P. jirovecii, aumentando la presencia de infección y gravedad en estos pacientes1.
En los pacientes con inmunosupresión por VIH, la deficiencia de linfocitos T CD4+ juega un papel crítico en la respuesta inmune por P. jirovecii y SARS-CoV-220. Esto se debe a una activación compensatoria de la función de los macrófagos espumosos exacerbando la liberación de citocinas proinflamatorias que predispone a la infección por P. jirovecii16. Se ha encontrado últimamente que la disminución de linfocitos T CD4+ grave (<200 células/μl) y COVID-19 en pacientes favorece el riesgo de presentar neumonía por P. jirovecii21. Sin embargo, aún faltan estudios clínicos para conocer la ruta de patogenia de ambas infecciones en pacientes con VIH.
DiagnósticoEl diagnóstico inicial para determinar la presencia de P. jirovecii es un reto médico, particularmente en pacientes con inmunodeficiencias adquiridas leves, donde la carga fúngica es menor22. Las características clínicas incluyen fiebre, tos, disnea, hipoxemia y elevación de LDH, muy similar a la infección por SARS-CoV-223. La detección e identificación del P. jirovecii se realiza mediante PCR en muestras respiratorias, tinción con colorante de plata o inmunofluorescencia5. Sin embargo, estas pruebas diagnósticas producen tasas significativas de falsos negativos, brindando una falsa seguridad a los médicos y colocando en riesgo a los pacientes24.
El estudio de imagen no es el método diagnóstico fiable para diferenciar ambas afecciones24. Los hallazgos radiológicos en TC de tórax en ambas infecciones se presentan como un patrón en vidrio deslustrado con engrosamiento del tabique interlobulillar12. Esto dificulta un diagnóstico radiográfico certero y temprano, especialmente en el paciente inmunodeprimido25. Sin embargo, en algunos pacientes con neumonía por P. jirovecii los infiltrados radiológicos pueden progresar a las zonas apicales y periféricas en comparación con la COVID-1923. Estas situaciones se convierten en un desafío médico para el paciente, personal en imagenología y el cuidado intensivo26.
El uso de la PCR cualitativa para la detección de P. jirovecii es controvertido22. Esto se debe a la dificultad entre la distinción entre colonización e infección por P. jirovecii en un paciente con infección por SARS-CoV-217,20. Sin embargo, la determinación de la PCR cuantitativa de una muestra de lavado broncoalveolar (>1,6?×103 DNA copias/μl) se ha utilizado para diferenciar una colonización de una infección por P. jirovecii22.
En pacientes con infección aguda por SARS-CoV-2 se ha encontrado últimamente que la técnica (1,3)-β-D-glucano es de potencial uso para la detección de P. jirovecii20. Se ha sugerido que niveles >100pg/ml de muestra de lavado broncoalveolar son sugestivos de infección por este hongo22. Por otro lado, en pacientes con neoplasias hematológicas los niveles bajos de β-D-glucano sérico no descartan el diagnóstico de P. jirovecii debido a su baja sensibilidad (69,8%)11, así que este resultado debe interpretarse con precaución al excluir el diagnóstico de P. jirovecii.
TratamientoEn pacientes con neumonía por SARS-CoV-2 e inmunosupresión debe iniciarse tratamiento antibiótico para abordar infecciones pulmonares oportunistas (P. jirovecii)5,13,27. Aunque actualmente se usa profilaxis antibiótica de forma rutinaria para la prevención de infecciones bacterianas, la P. jirovecii no está cubierta por estos antibióticos de primera línea26. La primera elección es el uso de trimetroprima-sulfametoxazol, un antibiótico de amplio espectro para gérmenes bacterianos y fúngicos con acción para P. jirovecii27. Se recomienda iniciar trimetoprima de 15 a 20mg/kg/día y sulfametoxazol de 75 a 100mg/kg/día por vía oral divididas en 3 dosis5. Primordialmente, se espera mejoría clínica después de 4-8 días de uso de antibiótico17.
En pacientes con VIH y P. jirovecii el tratamiento antibiótico se ha acompañado de terapia corticoide en los últimos años8. Pero no se ha establecido que durante la coinfección asociada al virus del SARS-CoV-2 presente una mejoría en los pacientes16. En los casos moderados a graves se indica trimetoprima de 15 a 20mg/kg/día y sulfametoxazol de 75 a 100mg/kg/día por vía intravenosa cada 6 a 8horas5. El tratamiento no debe suspenderse mientras estén pendientes los estudios diagnósticos y la sospecha de P. jirovecii5.
PronósticoLas tasas de mortalidad de P. jirovecii siguen siendo altas a pesar del tratamiento8. En pacientes sin VIH se han encontrado tasas de mortalidad de hasta el 40-60% en pacientes críticamente enfermos10. Sin embargo, en los últimos años, debido a la introducción de terapia antirretroviral las tasas de supervivencia se encuentran del 86% al 92% en pacientes infectados por el VIH8. Hasta ahora, el pronóstico en pacientes con COVID-19 e infección por P. jirovecii no se ha determinado, pero puede condicionar la gravedad especialmente en los pacientes críticamente enfermos.
ConclusiónLa neumonía por P. jirovecii y el virus del SARS-CoV-2 comparten singularidades clínicas e imagenológicas parecidas. En pacientes con inmunosupresión grave adquirida y neumonía por SARS-CoV-2 se debe sospechar de coinfección por P. jirovecii, como se presentó en nuestro caso. Así mismo, iniciar una terapia antibiótica correcta empírica para mejorar la morbimortalidad en pacientes críticamente enfermos. Por lo tanto, en pacientes con inmunosupresión se sugiere profilaxis antibiótica para P. jirovecii hasta que las pruebas diagnósticas confirmen o no la presencia del mismo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.