Las alteraciones hemostáticas en el sangrado masivo incluyen diversas manifestaciones que aumentan el riesgo de complicaciones y mortalidad. El abordaje del sangrado crítico requiere equipos multidisciplinarios y métodos estandarizados para una evaluación rápida, identificación de la causa, intervenciones precisas y toma de decisiones continua. Escenarios como la cirugía mayor, el trauma y el parto presentan múltiples factores que suelen culminar en choque hemorrágico, caracterizado por isquemia tisular y disfunción endotelial, con alteraciones como hipofibrinogenemia y desfibrinólisis. La disminución aguda de la masa eritrocitaria y la hipotensión empeoran la hemostasia y el aporte de oxígeno. Este consenso incluye recomendaciones basadas en la evidencia para la evaluación y manejo del sangrado crítico en tres áreas clave: posparto, trauma y cirugía cardiovascular. Su objetivo general es crear un documento guía de fácil acceso que defina las prioridades en el manejo de pacientes con sangrado en escenarios críticos, con o sin coagulopatía, y que sirva como herramienta de consulta para la implementación y mejora del cumplimiento con el principio de «Gestión de la Sangre del Paciente», término recientemente acuñado en español por la Organización Mundial de la Salud para referirse al conjunto de prácticas clínicas óptimas centradas en el paciente y basadas en la mejor evidencia para lograr los mejores desenlaces posibles.
Las recomendaciones para el abordaje y manejo del sangrado en escenarios críticos de acuerdo con el sistema GRADE, se estructuran en áreas clave: 1.Evaluación de la coagulación en sangrado crítico. Se recomienda una temprana y secuencial de la hemostasia, considerando pruebas viscoelásticas o convencionales, especialmente para la cuantificación del fibrinógeno y la función plaquetaria. También se sugiere integrar estas pruebas en protocolos institucionales. 2.Manejo del sangrado posparto. Las recomendaciones priorizan la identificación temprana del sangrado, el uso de uterotónicos, ácido tranexámico, reposición de fibrinógeno, la monitorización integral y el control mecánico del sangrado. 3.Sangrado traumático. Se recomienda el uso de ácido tranexámico y terapia transfusional ajustada al requerimiento individual y protocolos de transfusión masiva, además de la evaluación temprana con pruebas convencionales o viscoelásticas de la coagulación. 4.Cirugía cardiovascular. Las recomendaciones incluyen la identificación preoperatoria de anemia y factores de riesgo, el uso de ácido tranexámico, y la evaluación perioperatoria con algoritmos basados en pruebas viscoelásticas para reducir transfusiones; estrategias transfusionales restrictivas, y el manejo del sangrado basado en metas en procedimientos prolongados de bypass.
Hemostatic alterations in massive bleeding manifest in various ways, significantly increasing the risk of complications and mortality. The management of critical bleeding requires multidisciplinary teams and standardized approaches to enable rapid assessment, identification of root causes, precise interventions, and ongoing decision-making. Situations such as major surgery, trauma, and childbirth often involve multiple factors that contribute to hemorrhagic shock, characterized by tissue ischemia and endothelial dysfunction, hypofibrinogenemia and dysfibrinolysis. Acute reductions in erythrocyte mass couple with persistent hypotension further compromise hemostasis and oxygen delivery. This consensus document provides evidence-based recommendations the assessment and management of critical bleeding in three key areas: postpartum hemorrhage, trauma, and cardiovascular surgery. The primary objective is to deliver accessible guidance that prioritizes effective bleeding management in critical scenarios, wheter or not coagulopathy is present. This document also serves as a practical tool to support the implementation and optimization of «Patient Blood Management,» a framework endorsed by the World Health Organization to enhance patient outcomes through evidence-based clinical care.
The GRADE-based recommendations for managing critical bleeding are organized into four key areas: 1.Evaluation of coagulation in critical bleeding. Early and sequential assessment of hemostasis is recommended, incorporating viscoelastic or conventional tests. Special enphasis is placed on fibrinogen quantification and platelet function, with the integration of these tests into institutional protocols. 2.Management of postpartum bleeding. Recommendations highlight the importance of early bleeding identification, the use of uterotonics, tranexamic acid, fibrinogen replacement, comprehensive monitoring, and mechanical bleeding control. 3.Traumatic bleeding key mesures include administering tranexamic acid and implementing transfusion therapy tailored to individual needs. Massive transfusion protocols, is emphasized, alongside early coagulation assessment using conventional or viscoelastic tests to guide treatment. 4.Cardiovascular surgery. Recommendations focus on preoperative identification and correction of anemia and risk factors. The use of tranexamic acid, along with perioperative coagulation assessment guided by viscoelastic test-based algorithms, is adviced to minimize transfusions. Strategies also enphasize restrictive transfusion thresholds and targeted bleeding management during prolonged bypass procedures.
Las alteraciones de la hemostasia asociadas al sangrado masivo agrupan una amplia variedad de presentaciones y fenotipos, que funcionan como determinantes de complicaciones y mortalidad. La aproximación al sangrado crítico implica la participación de equipos multidisciplinarios y enfoques transversales que involucren dinámicas estandarizadas para la evaluación e identificación temprana de la causa del sangrado, ejecución de intervenciones específicas y oportunas, evaluación de su impacto y posterior toma de decisiones.
La cirugía mayor, el trauma y el parto agrupan un amplio espectro de condiciones relacionadas con sangrado crítico y coagulopatía. Las causas de hemorragia en estos escenarios obedecen a múltiples causas con un desenlace común: el choque hemorrágico, una condición asociada a isquemia tisular y disfunción endotelial frecuentemente asociada a múltiples alteraciones de la hemostasia, entre las que resaltan la hipofibrinogenemia, la disfibrinólisis y un incremento paradójico inicial con posterior deterioro de la actividad intrínseca de trombina1.
La disminución aguda de la masa eritrocitaria durante la hemorragia grave cataliza el deterioro hemostático al desencadenar un empeoramiento del fenómeno isquémico y una pérdida de los mecanismos de interacción con plaquetas y vías relacionadas con la explosión de trombina (factoresIX yXI). Por su parte, la hipotensión persistente durante el choque hemorrágico agrava el desacople de la relación aporte/consumo de oxígeno tisular, que se asocia con descenso significativo en las concentraciones de fibrinógeno y falla en los mecanismos de coagulación, lo que perpetúa el sangrado y contribuye al deterioro hemodinámico progresivo2.
Esta publicación incluye recomendaciones de un grupo de trabajo que participó en la recopilación y revisión de información reciente referente a la evaluación diagnóstica global del sangrado crítico y aspectos relevantes de su manejo en tres escenarios críticos de gran interés, como son el sangrado posparto, el trauma y la cirugía cardiovascular. Su objetivo general es crear un documento guía de fácil acceso que defina las prioridades en el manejo de pacientes con sangrado en escenarios críticos, con o sin coagulopatía y que funcione como herramienta de consulta para la implementación y mejora del cumplimiento en relación con el principio «Gestión de la Sangre de los Pacientes», término recientemente acuñado al español por la Organización Mundial de la Salud para referirse al conjunto de prácticas clínicas óptimas centradas en el paciente y basadas en la mejor evidencia que permitan los mejores desenlaces posibles.
MetodologíaPara la creación de grupos de trabajo se realizó una asignación de temas con sus respectivas preguntas mediante la estrategia PICO (población objeto, intervención, comparación y desenlaces). Una vez definidas las preguntas se procedió a realizar una búsqueda sistemática de la literatura en Medline, Embase y Cochrane utilizando términos MeSH. El resultado de cada búsqueda según la pregunta se entregó al grupo de trabajo asignado (Anexo 1).
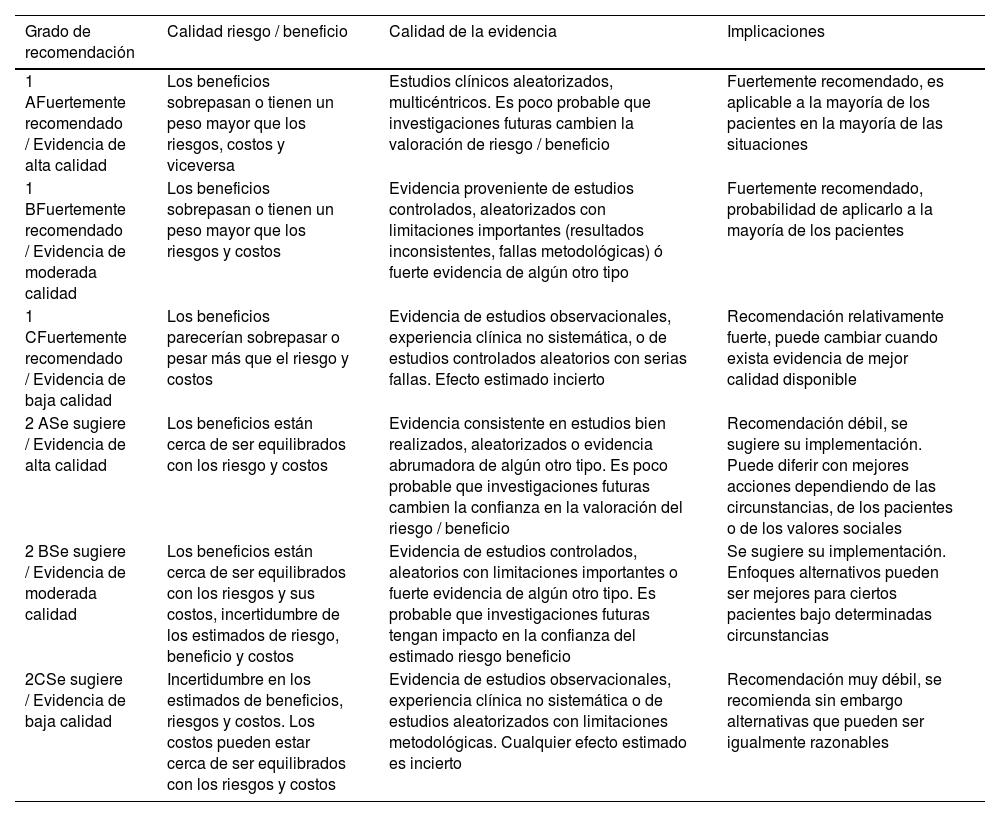
Para la evaluación de evidencia se acordó utilizar la estrategia Grading of Recommendations, Assessment, Development and Evaluations (GRADE)3 dadas sus múltiples ventajas, que incluyen: 1)separación entre la calidad de la evidencia y el grado de recomendación; 2)criterios explícitos y comprensivos para bajar o subir la puntuación de la calidad de la evidencia; 3)proceso transparente de traslado de la evidencia a las recomendaciones; 4)reconocimiento explícito de valores y preferencias, y 5)clasificación clara y pragmática de las recomendaciones en fuertes (Recomendación) o débiles (Sugerencia) soportadas por una evidencia de calidad alta (A), moderada (B) o baja/muy baja (C) (tabla 1).
Graduación de la evidencia incluida según escala3
| Grado de recomendación | Calidad riesgo / beneficio | Calidad de la evidencia | Implicaciones |
|---|---|---|---|
| 1 AFuertemente recomendado / Evidencia de alta calidad | Los beneficios sobrepasan o tienen un peso mayor que los riesgos, costos y viceversa | Estudios clínicos aleatorizados, multicéntricos. Es poco probable que investigaciones futuras cambien la valoración de riesgo / beneficio | Fuertemente recomendado, es aplicable a la mayoría de los pacientes en la mayoría de las situaciones |
| 1 BFuertemente recomendado / Evidencia de moderada calidad | Los beneficios sobrepasan o tienen un peso mayor que los riesgos y costos | Evidencia proveniente de estudios controlados, aleatorizados con limitaciones importantes (resultados inconsistentes, fallas metodológicas) ó fuerte evidencia de algún otro tipo | Fuertemente recomendado, probabilidad de aplicarlo a la mayoría de los pacientes |
| 1 CFuertemente recomendado / Evidencia de baja calidad | Los beneficios parecerían sobrepasar o pesar más que el riesgo y costos | Evidencia de estudios observacionales, experiencia clínica no sistemática, o de estudios controlados aleatorios con serias fallas. Efecto estimado incierto | Recomendación relativamente fuerte, puede cambiar cuando exista evidencia de mejor calidad disponible |
| 2 ASe sugiere / Evidencia de alta calidad | Los beneficios están cerca de ser equilibrados con los riesgo y costos | Evidencia consistente en estudios bien realizados, aleatorizados o evidencia abrumadora de algún otro tipo. Es poco probable que investigaciones futuras cambien la confianza en la valoración del riesgo / beneficio | Recomendación débil, se sugiere su implementación. Puede diferir con mejores acciones dependiendo de las circunstancias, de los pacientes o de los valores sociales |
| 2 BSe sugiere / Evidencia de moderada calidad | Los beneficios están cerca de ser equilibrados con los riesgos y sus costos, incertidumbre de los estimados de riesgo, beneficio y costos | Evidencia de estudios controlados, aleatorios con limitaciones importantes o fuerte evidencia de algún otro tipo. Es probable que investigaciones futuras tengan impacto en la confianza del estimado riesgo beneficio | Se sugiere su implementación. Enfoques alternativos pueden ser mejores para ciertos pacientes bajo determinadas circunstancias |
| 2CSe sugiere / Evidencia de baja calidad | Incertidumbre en los estimados de beneficios, riesgos y costos. Los costos pueden estar cerca de ser equilibrados con los riesgos y costos | Evidencia de estudios observacionales, experiencia clínica no sistemática o de estudios aleatorizados con limitaciones metodológicas. Cualquier efecto estimado es incierto | Recomendación muy débil, se recomienda sin embargo alternativas que pueden ser igualmente razonables |
En el diseño, búsqueda de literatura y desarrollo de las actividades y reuniones de consenso participaron profesionales de diversas especialidades involucradas en el abordaje y tratamiento de pacientes con sangrado en condición crítica, tales como medicina intensiva, obstetricia y banco de sangre, entre otras. Este documento cuenta con la participación y el aval del Comité de Hemostasia de la Asociación Colombiana de Medicina Crítica y Cuidado Intensivo (AMCI)
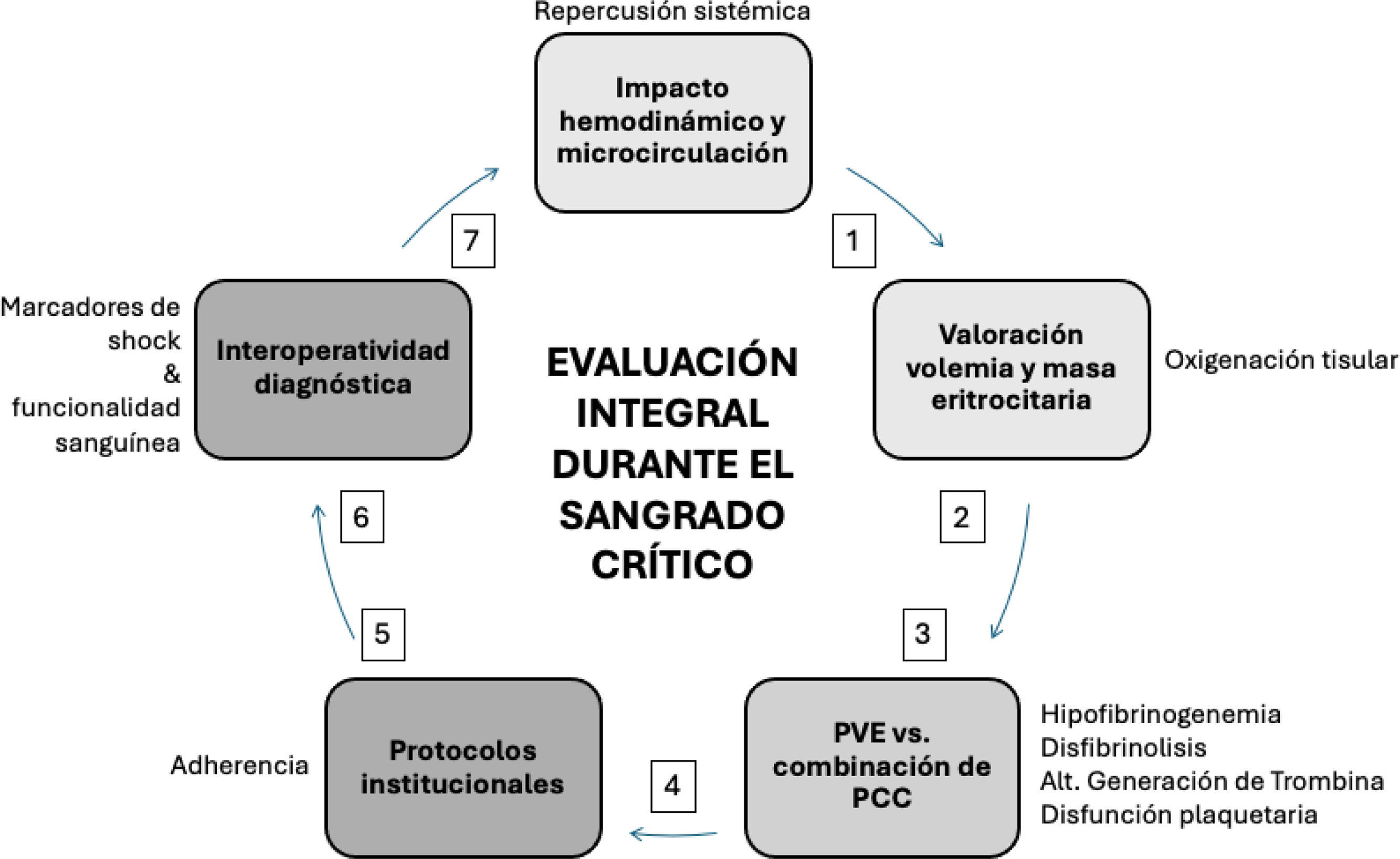
Recomendaciones para la evaluación integral de la coagulación durante el sangrado crítico¿Qué pruebas debe incluir la evaluación de la coagulación en pacientes con sangrado grave?
Recomendación 1
Se recomienda durante el sangrado mayor realizar valoración secuencial del impacto hemodinámico, la masa eritrocitaria y los marcadores sanguíneos de perfusión tisular, dada su estrecha relación con coagulopatía severa (Grado de recomendación 1A).
Recomendación 2
Se recomienda durante el sangrado mayor una valoración integral, temprana y secuencial de la hemostasia enfocada principalmente en la cinética y la cuantificación del fibrinógeno (síntesis y destrucción), el potencial de generación de trombina (evaluación de las vías intrínseca y extrínseca) y el componente plaquetario (función y cuantificación), de acuerdo con los recursos locales disponibles (Grado de recomendación 1B).
El sangrado severo es un evento frecuente en trauma, obstetricia y cirugía mayor, que impone una serie de retos para cuidadores y sistemas de salud. Existe suficiente información que asocia la hemorragia grave con importantes desenlaces adversos y mortalidad, por lo que se encuentra dentro de las categorías de eventos mayores4–6. Durante la hemorragia grave ocurre un deterioro variable del agua intravascular (40-50% del volumen perdido) y de los componentes sanguíneos, lo cual compromete la microcirculación (perfusión y oxigenación tisular) y el sistema hemostático (coagulopatía). Desde esta relación entre el grado de hipoperfusión y el deterioro en los componentes sanguíneos, es necesaria la medición simultánea de los dos procesos vitales durante la hemorragia grave.
Además de las intervenciones para detener la pérdida de sangre, es fundamental realizar una evaluación multimodal inmediata que valore el impacto hemodinámico sistémico, incluyendo presión arterial sistólica, frecuencia cardíaca, índice de choque, ultrasonografía, variabilidad del pulso y CO2 espirado, entre otros, y sus efectos en la perfusión tisular. El análisis de gases sanguíneos permite evaluar aspectos clave del consumo y aporte de oxígeno a los tejidos, así como otros factores relacionados con el equilibrio ácido-básico, como la PCO2 y el déficit de base. Otras mediciones útiles para evaluar el impacto de una hemorragia mayor incluyen el lactato y el hematocrito (o hemoglobina): el primero refleja el estado de anaerobiosis tisular, mientras que el segundo indica la capacidad de transporte de oxígeno y la amortiguación de hidrogeniones. Las alteraciones graves en los niveles de calcio y glucosa séricos, la masa eritrocitaria y el equilibrio ácido-básico se asocian frecuentemente con la aparición de coagulopatía en escenarios de hipoxia tisular y hemorragia7,8 (tabla 2).
Estándar actual básico y pruebas en proceso de validación clínica para la evaluación adjunta al manejo hemodinámico durante el sangrado mayor
| Evaluación adjunta al manejo hemodinámico durante el sangrado mayor | ||
|---|---|---|
| Componente | Estándar actual | Pruebas emergentes |
| Oxigenación tisular | • SvO2• Déficit de base• Lactato sérico• Hematocrito• Temperatura central | • Delta Pv-aCO2 |
| Metabólico | • Calcio ionizado• Glucosa sérica | – |
| Hemostasia | • Fibrinógeno de Clauss• TP (INR)• TTPa• Conteo plaquetario• PVE (ROTEM®/TEG®/Qantra®) | • PFP• Pruebas específicas para ACOD y HBPM |
ACOD: anticoagulantes orales directos; HBPM: heparinas de bajo peso molecular; INR: índice internacional normalizado; PFP: pruebas de función plaquetaria; Pv-a: presión veno-arterial; PVE: pruebas viscoelásticas; ROTEM®: tromboelastometría rotacional; SvO2: saturación venosa de oxígeno; TEG®: tromboelastografía; TP: tiempo de protrombina; TTPa: tiempo de tromboplastina parcial activado.
El sangrado mayor puede comprometer la producción hepática y endotelial de los factores de coagulación, así como los sistemas moduladores de la fibrinólisis. Igualmente, la respuesta plaquetaria inicial con promoción de coágulos a partir de su activación y su participación en los mecanismos de generación de trombina (factorII activado [FIIa]) y de conversión del fibrinógeno a fibrina (factorI activado [FIa]), puede verse fuertemente afectada por los efectos de la pérdida sanguínea masiva, la anemia aguda y la isquemia tisular9.
La complejidad de estas interacciones hace necesario que, durante la hemorragia grave, se realice una valoración integral de la hemostasia de manera rutinaria y temprana, que incluya la evaluación del potencial de trombina y la suficiencia, tanto antigénica como funcional, del fibrinógeno y del componente plaquetario. Esta valoración requiere una combinación de diferentes pruebas convencionales de la coagulación (PCC) (la cuantificación del fibrinógeno, el tiempo de protrombina [TP], el índice internacional normalizado [INR, por sus siglas en inglés], el tiempo de tromboplastina parcial activado [TTPa], el tiempo de coagulación activado [TCA], el recuento plaquetario, entre otras) y/o la realización de pruebas viscoelásticas (PVE)10.
El escenario de sangrado severo puede ser lo suficientemente complejo como para requerir mediciones sucesivas de estos y otros parámetros, de acuerdo con las condiciones clínicas y sospechas diagnósticas (p.ej., déficit selectivo de factores, consumo reciente de anticoagulantes y/o inhibidores plaquetarios), las intervenciones realizadas y su consecuente respuesta clínica11 (fig. 1).
En pacientes con sangrado grave, ¿cuál es el papel de las pruebas convencionales y de las pruebas viscoelásticas en la evaluación de la coagulación?
Recomendación 3
Se recomienda la utilización de pruebas viscoelásticas para la evaluación global de la hemostasia durante la atención de pacientes críticos con sangrado grave o en riesgo de estarlo (Grado de recomendación 1B).
Recomendación 4
Se sugiere la combinación de pruebas de coagulación convencionales en escenarios donde las pruebas viscoelásticas no estén disponibles (Grado de recomendación 2B).
Recomendación 5
Se recomienda que las pruebas viscoelásticas y las pruebas convencionales para la evaluación de la hemostasia estén articuladas dentro de protocolos institucionales para el manejo del sangrado mayor, adecuados al contexto local, población objeto y nivel de atención correspondientes (Grado de recomendación 1A).
Las PCC se usan como guías de decisión en cirugía, obstetricia y trauma para evaluar distintos trastornos de la coagulación relacionados con estados procoagulantes y de anticoagulación. Estas incluyen una serie de pruebas de laboratorio que evalúan diferentes procesos y componentes de la hemostasia por separado. Por otro lado, las PVE incluyen una serie de tecnologías diagnósticas que utilizan combinaciones de activadores e inhibidores rápidos de la coagulación para inducir la formación selectiva del coágulo a partir de vías específicas dentro de una muestra de sangre total.
En los últimos años se ha observado un incremento gradual en el uso de las PVE para la identificación rápida de alteraciones de la hemostasia en estos escenarios, debido, principalmente, a una reducción en el tiempo de la obtención del resultado (30-60min para las PCC frente a 10-15min para las PVE) y a un mejor rol predictivo de los eventos relacionados con el sangrado mayor y/o el aumento en los requerimientos transfusionales12. Las PVE permiten guiar intervenciones individualizadas de forma temprana, posibilitando una racionalización de los recursos hospitalarios para la atención en este escenario13,14.
La mayoría de las publicaciones que comparan las PVE con las PCC incluyen estudios observacionales no aleatorizados. Sin embargo, algunas guías (como la publicada por la Sociedad Europea de Anestesiología [ESA]) resaltan una asociación entre la utilización de las PVE y la reducción en el volumen del sangrado, así como en el riesgo de exposición a productos sanguíneos alogénicos (especialmente de plasma). Se ha sugerido un potencial beneficio en costos y eficacia con el uso de estrategias para adherencia y seguimiento con PVE en hemorragia crítica asociada a coagulopatía, tanto en pacientes sometidos a cirugía cardiaca como en sujetos de trauma15.
Una revisión sistemática y metaanálisis reciente mostró una relación entre la utilización de PVE y una reducción significativa en los índices de mortalidad (OR: 0,64; IC95%: 0,43-0,96) y de falla renal aguda (OR: 0,53; IC95%: 0,34-0,83), sin diferencias en términos del uso de concentrados de factores, el tiempo de estancia hospitalaria o la incidencia de eventos tromboembólicos16. La gran mayoría de estudios publicados hasta la fecha son principalmente de poblaciones de cirugía cardiovascular y de trauma17-19.
Un metaanálisis realizado por Deppe et al., que incluyó 8.332 pacientes de cirugía cardiaca, encontró que el manejo de la coagulación basado específicamente en tromboelastografía y tromboelastometría rotacional (TEG®/ROTEM®, por sus siglas en inglés, respectivamente) se asoció con una reducción en la probabilidad de exposición a productos sanguíneos alogénicos, re-exploraciones por sangrado postoperatorio, lesión renal postoperatoria y eventos tromboembólicos17. Otro estudio aleatorizado reciente mostró que, al menos en pacientes con tiempos largos de circulación extracorpórea, en el escenario de cirugía cardiovascular, el uso de ROTEM® resultó en un menor sangrado, una marcada reducción en los costos y mayor beneficio en términos de mortalidad a largo plazo20.
Aunque la gran mayoría de estudios publicados hasta el momento coinciden con las observaciones anteriormente descritas, un estudio aleatorizado reciente en pacientes con sangrado, en quienes se utilizó al menos una unidad de concentrados eritrocitarios, no encontró diferencias significativas en los índices de sangrado ni en la sobrevida a 90días al comparar las PVE con un manejo protocolizado en el que se utilizaban PCC en sujetos que requirieron al menos una unidad de glóbulos rojos21. Una limitación importante de este estudio es la baja utilización de plasma fresco congelado (PFC), de concentrados de fibrinógeno (CF) y de concentrados plaquetarios (CP) en los dos grupos evaluados. Hasta el momento, la evidencia a favor de las PVE ha utilizado distintos puntos de corte para la cuantificación del sangrado y la medición de algunos desenlaces relevantes. Aún se requieren estudios de mejor calidad metodológica que confirmen las observaciones encontradas.
Los protocolos de manejo son un avance importante que promueve el trabajo en equipo y una estructura de pensamiento colectivo en torno a escenarios clínicos complejos22. Se hace necesario que todas las instituciones trabajen de manera conjunta e interdisciplinaria en la elaboración y puesta en marcha de protocolos locales para el manejo del sangrado y la identificación de individuos en riesgo, que permitan asegurar un flujo eficiente de la información, capacidad diagnóstica veraz y un tratamiento oportuno23.
Es necesario que las pruebas diagnósticas se encuentren vinculadas correctamente dentro de los árboles de decisiones, con el objeto de lograr una homogeneización en las intervenciones y toma de decisiones, ajustándose a los principios de la «Gestión de la Sangre del paciente / Patient Blood management» (GSP/PBM)23-25. La interpretación de PVE y PCC sin el conocimiento de contexto (p.ej., sangrado activo frente a no sangrado activo; choque severo frente a no choque) o sin su correspondiente vinculación a otras pruebas diagnósticas hematológicas relevantes puede inducir a errores en el manejo con riesgos sobre el paciente.
¿Cómo deben guiarse las intervenciones con las pruebas viscoelásticas durante el sangrado mayor?
Recomendación 6
Cuando se utilicen pruebas viscoelásticas en el contexto de un sangrado mayor, se recomienda valorar inicialmente las alteraciones de la cinética del fibrinógeno (hipofibrinogenemia y disfibrinólisis), a menos que haya información relevante o un contexto especial que sugiera alteraciones de otros componentes de la hemostasia (Grado de recomendación 1B).
Recomendación 7
Se sugiere que las pruebas viscoelásticas sean interpretadas en conjunto con herramientas diagnósticas para la medición del choque hemorrágico, la masa eritrocitaria, la concentración sérica de fibrinógeno y el conteo plaquetario (Grado de recomendación 2B).
La dinámica del fibrinógeno y la función plaquetaria son cruciales para la firmeza del coágulo en pacientes con sangrado grave, siendo el fibrinógeno un objetivo de intervención clave26. La hipofibrinogenemia y las disfunciones del fibrinógeno están estrechamente ligadas a la endoteliopatía resultante del choque hemorrágico, especialmente en adultos27. Las alteraciones en la generación de trombina y la disfunción plaquetaria también se relacionan con daño endotelial28,29, disfunción multiorgánica y peores desenlaces en pacientes con trauma severo y coagulopatía.
Las pruebas viscoelásticas (PVE) permiten identificar estas alteraciones con precisión, lo que facilita una terapia hemostática dirigida30-32. Recientemente, se han propuesto recomendaciones para el uso de las PVE en el manejo del sangrado severo, enfocándose en aspectos como la fisiología del paciente, la formación y destrucción del coágulo33,34, la contribución plaquetaria y la presencia de inhibidores específicos. Además, la complementación de las PVE con evaluaciones cuantitativas de elementos sanguíneos como el fibrinógeno sérico y el hematocrito mejora la interpretación de los resultados y guía una intervención más precisa en el contexto clínico35.
Recomendaciones para la aproximación y manejo del sangrado posparto¿Cuáles son las prioridades y cómo se debe evaluar la causa de la coagulopatía y el sangrado en pacientes con sangrado posparto?
Recomendación 8
Se recomienda realizar identificación y diagnóstico precoz de la hemorragia posparto (Grado de recomendación 1A).
El boletín del Colegio Americano de Obstetras y Ginecólogos sobre hemorragia posparto (HPP) la define como el sangrado de más de 500ml en un parto vaginal y de más de 1.000ml en una cesárea. Por otra parte, la guía de Obstetricia y Ginecología del Colegio Real de Obstetricia y Ginecología de Australia y Nueva Zelanda define HPP como un sangrado mayor a 500ml durante el puerperio y la clasifica como hemorragia severa si es mayor a 1.000ml. La Sociedad de Obstetricia y Ginecología de Canadá la define como «cualquier hemorragia obstétrica que ponga en riesgo la estabilidad hemodinámica». Por su parte, el Colegio Real de Obstetricia y Ginecología, clasifica la HPP como «menor» en presencia de sangrado <500ml, «moderada» entre 1.000 y 2.000ml y «severa» al sangrado de más de 2.000ml.
Actualmente se propone un enfoque fisiológico para definir la HPP como una pérdida de sangre que provoca una alteración sistémica y pone en riesgo la vida36. Además, se ha introducido el concepto de «pérdida sanguínea anormal posparto no diagnosticada», definida por una disminución de hemoglobina periparto de más de 2g/dl en ausencia de HPP evidente, con una incidencia del 11,2% en partos vaginales según un reporte reciente37. Un estudio de 2019, realizado por Anger et al., correlacionó la pérdida de sangre con el descenso de hemoglobina, indicando que pérdidas entre 500 y 999ml no alteran significativamente los niveles de hemoglobina, mientras que pérdidas superiores a 1.000ml se asocian con mayores complicaciones y descensos marcados de hemoglobina38. Las estimaciones de pérdida de sangre han demostrado subestimar la HPP; por ello, la definición más precisa sería cualquier hemorragia que provoque inestabilidad hemodinámica en la paciente. Se recomienda, además, incluir el índice de Shock, una herramienta ampliamente validada en obstetricia, para evaluar esta condición.
Recomendación 9
Se recomienda considerar como prioridades la búsqueda y la corrección de la causa de la hemorragia posparto (Grado de recomendación 1A)
La causa de la HPP debe ser identificada tempranamente para una adecuada y oportuna corrección. Se conoce que la mayoría de los casos se relacionan con atonía uterina, seguida por trauma del canal del parto, retención de tejido placentario y, finalmente, un 2-5% de los casos que se relacionan con coagulopatía39.
La coagulopatía en HPP es inducida principalmente por la cantidad de sangrado, la presencia de hipotermia y una expansión volumétrica inapropiada de cristaloides, la cual debe vigilarse y manejarse tempranamente. El sangrado posparto no diagnosticado conlleva a una mayor pérdida sanguínea y a un retraso en el tratamiento37. La identificación temprana de la causa, la identificación del grado de pérdida sanguínea y la movilización de recursos pueden prevenir los desenlaces adversos. La planeación multidisciplinaria en varios niveles y la garantía de protocolos de identificación y tratamiento temprano de la causa, así como el manejo de las pacientes de alto riesgo, mejoran los resultados de las pacientes40.
Recomendación 10
Se recomienda una monitorización integral y secuencial de las pacientes con hemorragia posparto. Como estándar mínimo, esta monitorización debe incluir la identificación temprana del grado de pérdida sanguínea y la evaluación de variables clínicas habituales, tales como presión arterial sistólica, frecuencia cardíaca, índice de choque, nivel de conciencia, llenado capilar y marcadores de perfusión tisular (p.ej., lactato sérico, déficit de base) (Grado de recomendación 1C).
Los cambios en signos vitales pueden ser tardíos en la HPP. Se identifica taquicardia cuando hay una pérdida del 25% (aproximadamente 1.500ml) de la volemia. La identificación temprana de las pacientes con HPP mejora sus desenlaces41,42. La taquicardia y la hipotensión sistólica son los primeros signos clínicos de hipovolemia en la paciente durante el embarazo, el parto y el puerperio. El índice de choque tiene valor predictivo de mortalidad y puede apoyar las decisiones de reanimación. Sin embargo, faltan estudios para validación de su uso en obstetricia. Las alteraciones del equilibro acido-básico mediante gasometría (pH, déficit de base) y la elevación de marcadores de hipoxia tisular (lactato, SvO2) se correlacionan con su severidad43-45. Es importante ajustar los valores de lactato sérico para pacientes que han pasado por trabajo de parto, ya que estos pueden ser más altos que los valores utilizados habitualmente en la población general.
¿Qué tratamiento médico debe utilizarse en el manejo de pacientes con sangrado posparto?
Recomendación 11
Se recomienda el uso temprano de uterotónicos en la hemorragia posparto (Grado de recomendación 1A).
La utilización de uterotónicos como oxitocina, carbetocina, misoprostol y los derivados del cornezuelo del centeno (metilergometrina) son fármacos avalados para la prevención y el manejo de la hemorragia posparto46-49. Su principal utilidad corresponde a la prevención y tratamiento de la atonía uterina. La oxitocina es la primera línea de tratamiento de la HPP. Su aplicación puede ser IV o IM. El uso intravenoso en bolos está contraindicado debido al riesgo de colapso materno y a otras preocupaciones de seguridad. Todos los agentes son efectivos para prevenir la HPP >1.000ml al compararse con placebo o no tratamiento46. Es importante señalar que los trastornos hipertensivos son una contraindicación para el uso de metilergometrina.
En estudios previos se ha demostrado que la carbetocina tiene la misma efectividad que la oxitocina, con la ventaja de mantenerse en condiciones de estabilidad farmacéutica a pesar de las altas temperaturas ambientales47. Misoprostol y carbetocina están recomendados en escenarios donde no se pueda garantizar la refrigeración o no exista disponibilidad de oxitocina47. Misoprostol y carbetocina están recomendados en escenarios donde no se pueda garantizar la refrigeración o no exista disponibilidad de oxitocina47.
Recomendación 12
Se recomienda el uso de ácido tranexámico en todos los escenarios de hemorragia posparto. Su aplicación debe realizarse tan pronto como sea posible luego de la identificación del sangrado (Grado de recomendación 1A).
El uso de ácido tranexámico (ATx) ha sido validado en diferentes estudios y actualmente se considera un estándar en el manejo de hemorragias obstétricas. El ensayo WOMAN, un estudio multicéntrico y multinacional que incluyó a más de 20.000 pacientes en 193 hospitales de 21 países, demostró que el ATx reduce en un tercio las muertes por hemorragia obstétrica. En este ensayo se aleatorizó a 10.000 pacientes en cada grupo, mostrando una reducción del 30% en la mortalidad y en la necesidad de procedimientos quirúrgicos mayores para controlar el sangrado. La dosis de ATx utilizada en el estudio fue una dosis de carga de 1g administrada en 10min, seguida de una infusión de 1g si el sangrado continuaba o reaparecía dentro de las siguientes 24horas. No se observó un aumento significativo en eventos tromboembólicos u otros eventos adversos en el grupo tratado con ATx en comparación con el grupo placebo50-53. El número de eventos tromboembólicos y otros eventos adversos no aumentó significativamente en el grupo tratado con ATx frente al grupo tratado con placebo53. Un estudio evaluó el efecto del ATx frente a un análogo de la prostaglandina en la reducción de la HPP en mujeres con atonía uterina. En este estudio, el ATx por vía IV tuvo efectos comparables al análogo de la prostaglandina en la reducción de la atonía uterina. Un estudio evaluó el efecto del ATx frente a un análogo de la prostaglandina en la reducción de la HPP en mujeres con atonía uterina. En este estudio, el ATx por vía IV tuvo efectos comparables al análogo de la prostaglandina en la reducción de la atonía uterina.
Recomendación 13
Se sugiere evaluar los niveles de calcio ionizado en la etapa inicial de la hemorragia posparto y su reposición si los niveles están bajos. En escenarios donde no sea posible su cuantificación, debe considerarse un abordaje por protocolo que contemple el número de paquetes transfusionales utilizados (Grado de recomendación 2B).
Los niveles bajos de calcio ionizado sérico al momento del diagnóstico de la HPP se asocian con mayor riesgo de sangrado severo. Una cohorte retrospectiva entre 2009 y 2020 de 436 pacientes con HPP confirmó que la hipocalcemia es más frecuente en pacientes con hemorragia severa (51,5% vs 10,6%, p<0,001)54. Dado lo anterior, se recomienda el control y el seguimiento de los niveles séricos de calcio ionizado en todas las pacientes con HPP. Los casos que requieren la ejecución de un protocolo de transfusión masiva precisan la administración de gluconato de calcio (20-30mg/kg) por cada paquete transfusional completado55.
Recomendación 14
Se sugiere la administración de fibrinógeno en pacientes con hemorragia posparto que presenten niveles séricos de fibrinógeno <2g/l y/o alteración compatible con pobre contribución del fibrinógeno a la firmeza del coágulo por pruebas viscoelásticas (Grado de recomendación 2B).
La valoración del fibrinógeno a partir de la medición de sus niveles y/o de su contribución a la firmeza del coágulo por PVE es útil para predecir la severidad de la HPP. Valores menores a 2g/l (200mg/dl) y/o 10mm del A5FIBTEM (o su equivalente para otras PVE) predicen la severidad de la hemorragia10. Cuando se encuentren disponibles pruebas de laboratorio en el lugar de asistencia (point of care) para evaluación de la repercusión sistémica y hematológica secundarias a la hemorragia y/o PVE, estas pueden ser útiles para hacer más expedita la velocidad del resultado y, con ello, del tratamiento56,57. En sitios donde no existe disponibilidad de medición de niveles de fibrinógeno o pruebas viscoelásticas puede utilizarse el INR/PT (1,8 veces el control) como una alternativa con suficiente poder pronóstico para la determinación de hipofibrinogenemia asociada a HPP.
Dado que la capacidad de reposición de fibrinógeno con altos volúmenes de PFC es limitada, existe una tendencia a incluir tempranamente la suplementación complementaria de fibrinógeno en los protocolos de manejo de HPP si el sangrado persiste luego de la respuesta inicial (usualmente >4U GRE: 3-4 PFC). En un estudio observacional en el que se compararon pacientes de HPP tratadas con «paquetes transfusionales» y otras con suplementación con concentrados de fibrinógeno (CF) según un algoritmo de manejo basado en ROTEM se encontraron diferencias significativas en la cantidad de unidades promedio de GRE (8 vs. 3,2; p=0,0004) y en la proporción de pacientes con injuria pulmonar (9,3 vs 0; p=0,038). La suplementación con concentrados de fibrinógeno en comparación con la utilización convencional de PFC también se ha asociado a una reducción en los índices de sobrecarga hídrica, admisiones a UCI y menores tasas de histerectomía a 4años57,58.
La dosis de fibrinógeno sugerida para el tratamiento inicial de la HPP que cursa con hipofibrinogenemia y/o sangrado no controlado es de 3-4g (50mg/kg) en forma de crioprecipitados o CF, y el nivel esperado con esta dosis es un aumento en 100-120mg del valor inicial57. Hasta un 30% de pacientes con HPP grave pueden requerir más de una intervención para la reposición de fibrinógeno hasta niveles mínimos permisibles, implicando una obligatoria valoración de este factor inmediatamente después de cada corrección.
En ausencia de repercusión sistémica o sangrado activo no se recomienda el uso empírico de concentrados de fibrinógeno o crioprecipitados para la prevención de la HPP sin confirmar antes la evidencia de hipofibrinogenemia10.
Recomendación 15
Se sugiere la utilización de concentrados de complejos protrombínicos de 4 factores cuando exista evidencia diagnóstica de necesidad de otros factores de la coagulación diferentes al fibrinógeno y no se disponga de plasma o se haya transfundido una cantidad considerable de este hemocomponente en el contexto de hemorragia posparto masiva (Grado de evidencia 2C).
Los concentrados de complejos protrombínicos de 4 factores (CCP-4F) han sido aprobados para el manejo de sangrado grave asociado a consumo reciente de antagonistas de vitaminaK y recientemente para la reversión de anticoagulantes orales directos (ACOD) en dosis que fluctúan entre 25-25U/kg. El perfil de seguridad de los CCP-4F a las dosis recomendadas parece tolerable, especialmente en el riesgo de eventos tromboembólicos inducidos59. En HPP las alteraciones de la generación de trombina no son usuales, pero la posibilidad de que ocurra se incrementa según la cantidad de sangrado aumenta al tiempo que sus repercusiones sistémicas57. Se estima que hasta un 8-10% de las pacientes con HPP tendrán otras alteraciones distintas a hipofibrinogenemia y, de estas, las alteraciones en la generación de la trombina prevalecen entre las más frecuentes. Son escasos los reportes de utilización de CCP-4F en HPP. Sin embargo, la creciente publicación de algoritmos para este escenario basados en PVE recomiendan la utilización de CCP-4F en dosis bajas (10-15U/kg) cuando exista evidencia de alteraciones en la generación de trombina (p.ej., CTEXTEM >80s o RTEG >10min) en presencia de función normal del fibrinógeno.
Se han descrito ampliamente los efectos dilucionales de altos volúmenes de PFC sobre los factores de la coagulación. Además, se encontró una relación dosis-dependiente entre la cantidad de PFC y la aparición de disfunción pulmonar, sepsis y morbimortalidad compuesta. La sobrecarga cardiaca asociada a transfusiones (TACO) se asocia notablemente con la utilización de PFC a dosis consideradas «cotidianas» (>4-7U). En un estudio comentado que utilizaron CCP-4F guiados por PVE en comparación con la terapia convencional se observó una disminución importante en la incidencia de eventos compuestos y en el volumen de sangrado.
Recientemente se alertó sobre la necesidad de aprobación para los CCP-4F como un adjunto a la terapia con PFC en pacientes con coagulopatía inducida por trauma (CIT) debido a la superioridad en términos de rapidez para revertir los valores anormales de INR y reducción de los requerimientos60. Se espera que para los próximos años surja información sobre el uso de CCP-4F como un adjunto al manejo convencional en la paciente obstétrica con hemorragia grave.
¿Qué estrategia transfusional debe utilizarse en el manejo de pacientes con sangrado posparto?
Recomendación 16
Se recomienda la recuperación temprana de la masa eritrocitaria para asegurar un nivel de hematocrito entre 26-28% en toda paciente con hemorragia obstétrica mayor (Grado de recomendación 1A).
Recomendación 17
Se recomienda el uso de plasma fresco congelado solamente durante el manejo inicial de la hemorragia posparto grave que haya requerido >4-6 unidades de glóbulos rojos, manteniendo una relación GRE:PFC:CP de 1,5-1:1:1. Tan pronto como sea posible, se recomienda virar hacia un manejo hemostático guiado por metas y centrado en el logro de niveles de fibrinógeno >2g/l a partir de crioprecipitados o concentrados de fibrinógeno, así como un conteo plaquetario ≥50.000/ml (Grado de recomendación 1B).
Actualmente, los protocolos de trasfusión masiva obstétrica incluyen dentro de sus fases iniciales el uso de PFC y concentrados plaquetarios. El paquete de transfusión masiva (PTM) en obstetricia debe ajustarse y estandarizarse a las necesidades locales, siendo un recurso fundamental durante el manejo inicial de la HPP61. Esto implica que su proporción de hemocomponentes garantice una relación GRE:PFC:CP de 1,5-1:1:1 como estrategia de choque inicial frente a la HPP grave62. Sin embargo, mantener de manera persistente esta misma relación luego del manejo inicial incrementa el riesgo de eventos adversos derivados de la administración masiva de PFC, como el daño inflamatorio pulmonar relacionado con la incitación proinflamatoria asociada a la presencia de leucocitos en las unidades donadas y la hipofibrinogenemia, así como otros efectos hemodilutorios debido a su alta proporción de agua libre62.
Una vez realizada la primera aproximación con el PTM obstétrico, se hace necesaria una evaluación rápida hemostática para descartar la presencia de hipofibrinogenemia residual con niveles de fibrinógeno <2g/l dada su asociación significativa con sangrado residual y coagulopatía en la gestantes. La transfusión de CP puede hacerse a expensas de pools/unidades individuales de «donante aleatorio» o unidades de aféresis (una unidad de CP por aféresis es equivalente a 5 o 6 unidades individuales)61-63. Los CP de donante aleatorio también pueden venir de forma unitaria, obtenidas de la sangre total de varios donantes. Una intervención usual con CP puede requerir una unidad de aféresis o 4-5 de donante aleatorio cuando la HPP está asociada a conteos plaquetarios inferiores a 50.000/ml61,63,59.
Recomendación 18
Se sugiere el uso de concentrados de fibrinógeno en la hipofibrinogenemia documentada durante la hemorragia posparto en caso de no disponibilidad de crioprecipitados (Grado de recomendación 1C).
Los agentes hemostáticos deben formar parte de un enfoque multimodal que incluya el manejo médico y quirúrgico, el uso de uterotónicos, la administración de cristaloides tibios y la transfusión de hemocomponentes para tratar la hemorragia posparto (HPP). En casos de hipofibrinogenemia, se puede considerar la administración de fibrinógeno mediante concentrado de fibrinógeno (CF) o crioprecipitados, según su disponibilidad. La medición de los niveles de fibrinógeno es esencial para predecir la gravedad de la HPP, dado que el fibrinógeno desciende a niveles críticamente bajos más rápidamente que otros factores de coagulación64.
No se recomienda el uso de fibrinógeno como estrategia para prevenir la HPP. Su uso solamente está recomendado cuando hay hemorragia documentada y niveles disminuidos de fibrinógeno por método de Clauss o PVE65. Tampoco se recomienda el uso empírico de CF en el tratamiento temprano de la HPP sin confirmar la evidencia de hipofibrinogenemia. Ante la confirmación de esta, puede indicarse trasfusión de crioprecipitados o de concentrado de fibrinógeno. Gran parte de esta evidencia es extraída de estudios en trauma y cirugía cardiovascular66,67.
Recomendación 19
Se recomienda el uso de cristaloides balanceados tibios (40-42°C) bajo una estrategia de uso restrictivo, guiada por parámetros fisiológicos dinámicos en toda paciente con hemorragia posparto (Grado de recomendación 1A).
El manejo restrictivo de líquidos es un aspecto crítico del manejo inicial de la hemorragia grave. Una cantidad importante de evidencia apoya este enfoque. En primer lugar, la reanimación excesiva con líquidos puede provocar sobrecarga hídrica, con exacerbación del sangrado y peores resultados. Aunque en pacientes con hemorragia vaginal superior a 500ml un abordaje restrictivo de resucitación no fue significativamente diferente en términos de tasa de transfusiones o eventos adversos, sí se encontró una menor proporción de sujetos que progresaron a hemorragia de más de 1.000ml (39,2% vs. 51,3%)68. Diversos estudios han demostrado que las estrategias restrictivas de líquidos ayudan a mantener un entorno de coagulación más favorable, ya que la administración agresiva con cristaloides diluye progresivamente los elementos enzimáticos y celulares de la hemostasis con serias repercusiones sobre la formación del coágulo y el consecuente aumento del sangrado, particularmente en casos de hemorragia no controlada.
Estudios recientes han puesto de manifiesto la importancia de la hipotensión permisiva en el tratamiento de las hemorragias graves. Esta estrategia consiste en permitir que la presión arterial permanezca por debajo de los niveles habituales de normalidad hasta que el sangrado se controle mecánicamente. La razón detrás de la hipotensión permisiva es reducir la presión dentro de los vasos sanguíneos lesionados, minimizando la pérdida de sangre y optimizando la formación de coágulos. Esta estrategia, en conjunto con un uso responsable y dinámico de los cristaloides y componentes sanguíneos, permite una estrategia equilibrada y adaptada a la consecución de metas hemodinámicas y fisiológicas durante la atención inicial de la HPP69.
El calentamiento de los líquidos intravenosos durante la reanimación de pacientes que experimentan una HPP es fundamental para contrarrestar la hipotermia asociada al choque hipovolémico con endoteliopatía, disfunción orgánica aguda y sus consecuentes efectos sobre la hemostasia, el equilibrio acido-básico y los desenlaces globales posteriores al evento de sangrado agudo. Diferentes guías clínicas, así como la Organización Mundial de la Salud, enfatizan en la importancia de mantener la normotermia (temperatura corporal central >36°C) a través de una estrategia de calentamiento corporal activo (mantas calientes y/o equipos de calentamiento), de protección frente a los mecanismos de pérdida térmica hacia el ambiente y el uso rutinario de fluidos tibios (40-42°C). Los proveedores de atención médica deben considerar la incorporación de métodos para el calentamiento de líquidos en sus protocolos de reanimación para optimizar la atención de los pacientes que experimentan hemorragias graves.
¿Qué tratamiento quirúrgico o mecánico debe utilizarse en el manejo de pacientes con sangrado posparto?
Recomendación 20
Se recomienda la búsqueda del control mecánico de la hemorragia posparto con estrategias multimodales que incluyan: masaje bimanual, taponamiento uterino, suturas del canal del parto, suturas hemostáticas, embolización, histerectomía, cirugía de control de daños o ligadura vascular según la causa subyacente (Grado de recomendación 1B).
Recomendación 21
Se sugiere el traje antichoque como estrategia para la estabilización y/o remisión de las pacientes con hemorragia posparto a un escenario de mayor complejidad (Grado de recomendación 2B).
El traje antichoque es una tecnología de bajo costo, reusable y de amplia disponibilidad recomendada por OMS y FIGO70,71 para el manejo de la hemorragia obstétrica mayor, siendo un sistema de compresión graduada con seis regiones de compresión de neopreno que genera presión circunferencial en la mitad inferior del cuerpo para mejorar el gasto cardiaco y la presión arterial con presión de 20-40mm Hg, además con compresión directa abdominal y pélvica que reduce el espacio total vascular y disminuye la perfusión pélvica al comprimir directamente la aorta descendente, permitiendo realizar procedimientos por vía vaginal y perineal y un traslado seguro de la paciente con sangrado mayor72,73
¿Cómo se debe llevar a cabo el seguimiento y la evaluación de la respuesta al manejo inicial en pacientes con sangrado posparto?
Recomendación 22
Se recomienda la combinación de pruebas convencionales para una evaluación integral de la hemostasia (tiempo de tromboplastina activada, tiempo de protrombina, fibrinógeno sérico y conteo plaquetario) en pacientes con hemorragia posparto al momento de la identificación de la hemorragia54,74,75 (Grado de recomendación 1B).
Recomendación 23
Se recomienda el uso de pruebas viscoelásticas para la evaluación de pacientes con hemorragia posparto en los casos en donde estas se encuentren disponibles (Grado de recomendación 1B).
La introducción de TEG® y ROTEM® dentro de los algoritmos de hemorragia mayor obstétrica permite realizar una aproximación rápida de la hemostasia a la cabecera del paciente64,76-78. Los valores de referencia de los parámetros ROTEM® en obstetricia se han contrastado con los de pacientes adultos no obstétricos, resultando concordantes. Se ha podido confirmar una correlación entre los parámetros de FIBTEM® y los niveles de fibrinógeno plasmático por el método de Clauss. No obstante, se necesitan más investigaciones para definir los valores umbral para la terapia hemostática en el curso de la HPP77. La NATA recientemente recomendó las PVE para la valoración de pacientes con HPP en los sitios donde estas se encuentren disponibles79.
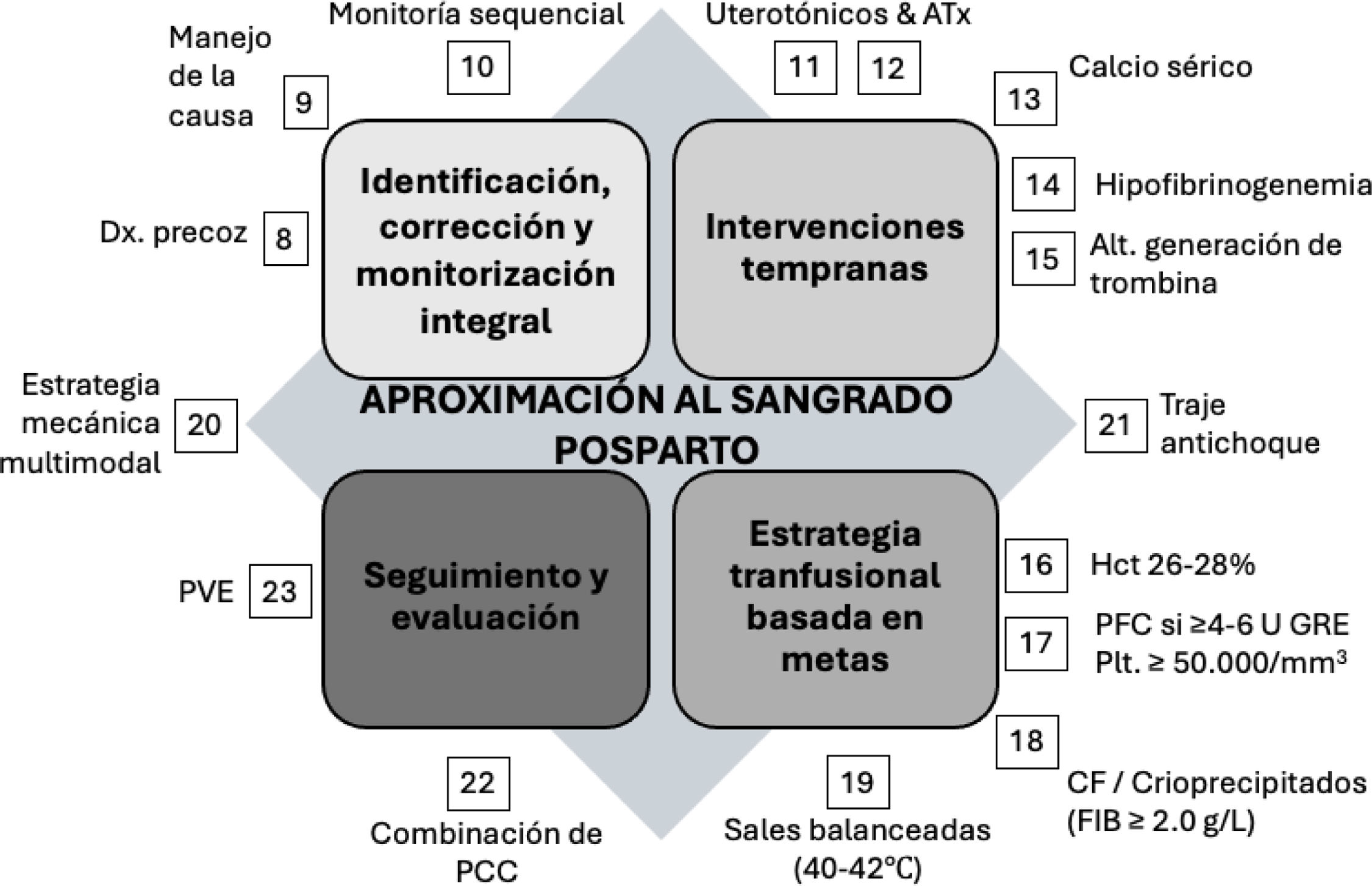
En un estudio doble ciego controlado aleatorizado se analizaron 55/663 mujeres con volúmenes de HPP entre 1.000-1.500ml, con respecto al efecto de utilizar concentrados de fibrinógeno en comparación con placebo cuando el sangrado continuaba, el FIBTEM® era ≤15mm y su repercusión sobre el volumen de sangrado adicional. Aunque hubo una tendencia a mayor transfusión de hemocomponentes y mayores tasas de sangrado, no se encontró una diferencia significativa en los desenlaces esperados. El análisis de subgrupos sugirió que no se requería la utilización de fibrinógeno ante valores de FIBTEM ≥12mm o niveles de fibrinógeno ≥2g/l80. El mismo grupo de investigadores publicó un estudio observacional que incluyó 605 pacientes con volúmenes de HPP ≥1.000ml en donde se corroboró la factibilidad y seguridad del uso restrictivo de PFC basado en PVE y observación clínica81,82. Las PVE permiten una rápida evaluación de la coagulación y una rápida corrección del fibrinógeno, pudiendo mejorar los desenlaces como parte de un paquete integrado de cuidado para la HPP83 (fig. 2).
Aproximación al sangrado posparto. La numeración corresponde a cada una de las recomendaciones incluidas en el texto.
ATx: ácido tranexámico; CF: concentrado de fibrinógeno; FIB: concentración de fibrinógeno; GRE: glóbulos rojos empacados; PCC: pruebas de coagulación convencionales; PFC: plasma fresco congelado; PVE: pruebas viscoelásticas.
¿Cuáles son las prioridades y cómo se realizan la aproximación diagnóstica y el monitoreo de la coagulopatía en pacientes con sangrado traumático?
Recomendación 24
Se recomienda evaluar clínicamente la extensión de la hemorragia traumática utilizando una combinación de la fisiología del paciente, el patrón anatómico de la lesión, el mecanismo de la lesión y la respuesta a la reanimación inicial (Grado de recomendación 1C).
Recomendación 25
Se recomienda considerar un valor de hemoglobina menor a 10 g/dl al ingreso como predictor de hemorragia grave y usar mediciones secuenciales de hemoglobina en las primeras 24 horas posteriores al trauma (Grado de recomendación 1B).
Para abordar el riesgo de transfusión masiva (TM) en pacientes con trauma grave se requiere una respuesta institucional coordinada que involucre equipos médicos multidisciplinarios en servicios de urgencias, incluyendo cirugía general, enfermería, laboratorio y banco de sangre84. Herramientas como el TASH Score, que considera siete variables clínicas, proporcionan una forma de predecir la probabilidad de requerir TM, mostrando que una puntuación de 18 se asoció a una probabilidad del 50% de TM, con una sensibilidad del 31% y una especificidad del 93%85,86. Además, el Shock Index y su forma modificada son indicadores útiles para evaluar la necesidad de TM, con altas sensibilidades y especificidades, complementando otras herramientas de evaluación como el ABC Score87.
La aplicación del Injury Severity Score (ISC)88 permite una evaluación detallada de las lesiones por región corporal, categorizando a los pacientes según la gravedad de sus lesiones, con un puntaje mayor de 15 correlacionado con una alta sensibilidad y especificidad para predecir la necesidad de TM89. Parámetros como la coagulopatía aguda traumática (CAT) y mediciones de hemoglobina y hematocrito también se han identificado como predictores útiles de la gravedad del trauma y la necesidad de transfusiones masivas90,91. La medición seriada de hemoglobina y hematocrito ha demostrado ser sensible para detectar pacientes con lesiones graves y pérdida sanguínea significativa, con estudios observacionales respaldando su utilidad en la identificación de pacientes en riesgo de complicaciones graves, como en el caso de fractura de cadera derivada de trauma severo92.
Recomendación 26
Se recomienda que la evaluación de rutina en trauma severo incluya el monitoreo temprano y secuencial de la hemostasia mediante pruebas viscoelásticas o distintas combinaciones de pruebas convencionales de coagulación y tecnologías diagnósticas a la cabera del paciente que permitan discriminar el impacto sistémico del shock hemorrágico (Grado de recomendación 1B).
Recomendación 27
Se recomienda el uso de métodos viscoelásticos para evaluar la función de hemostática en el paciente con sangrado traumático (Grado de recomendación 1B).
La coagulopatía traumática, definida por la prolongación del tiempo de protrombina (PT)93, ha sido identificada como un factor clave en la mortalidad y la disfunción orgánica en pacientes con hemorragia traumática. Estudios como el realizado por Peltan et al.94 revelaron que el 50% de los pacientes con sangrado traumático presentaban coagulopatía traumática aguda, con un INR>1,2, y el 21% con un INR>1,5, asociándose significativamente con la mortalidad global, el shock hemorrágico y falla multiorgánica. La medición inicial del INR se ha mostrado como una herramienta útil para la detección temprana de la coagulopatía y para guiar la transfusión de productos sanguíneos en pacientes traumatizados.
La hipofibrinogenemia, asociada con diversas alteraciones subyacentes en la coagulopatía traumática, como hipotermia, acidosis metabólica y administración de grandes volúmenes de cristaloides, es un factor crítico que se correlaciona con una mayor mortalidad95. Se ha observado una tendencia hemorrágica con niveles de fibrinógeno menores de 150mg/dl96, además de su relación con la gravedad en las puntuaciones de riesgo de transfusión masiva, hipotensión, niveles bajos de hemoglobina y un exceso de base de3. Se recomienda la corrección de niveles bajos de fibrinógeno con crioprecipitados o CF97. Por otro lado, el conteo plaquetario al ingreso se relaciona con el aumento del Injury Severity Score (ISC), la mortalidad secundaria a sangrado y las lesiones en el sistema nervioso central para conteos plaquetarios menores de 100.000/l97,98, destacando su importancia en la evaluación inicial y el manejo de pacientes traumatizados.
La tromboelastografía (TEG®) y la tromboelastometría (ROTEM®) son herramientas que permiten analizar las propiedades viscoelásticas del coágulo, proporcionando datos sobre su formación, firmeza y lisis99. Estas pruebas han demostrado utilidad en la detección precoz de la coagulopatía inducida por trauma (TIC), evidenciando disfunción plaquetaria en los primeros 30min tras una lesión grave. Aunque su utilidad inicial es motivo de debate, algunos estudios sugieren que el uso guiado por TEG® podría reducir la mortalidad100, mientras que las pruebas convencionales podrían ser útiles para identificar pacientes con disfunción hemostática y mayor riesgo de mortalidad101.
¿Qué tratamiento médico debe usarse para manejar pacientes con sangrado traumático?
Recomendación 28
Se recomienda la administración de vasopresores, además de fluidos para mantener la presión arterial meta, en pacientes de trauma con sangrado e hipotensión (Grado de recomendación 1C).
Recomendación 29
Se recomienda la infusión de un agente inotrópico en presencia de disfunción miocárdica (Grado de recomendación 1C).
Recomendación 30
Se recomienda restringir el uso de coloides, debido a los efectos adversos sobre la hemostasia y riesgo de disfunción renal (Grado de recomendación 1C).
Recomendación 31
Se recomienda el uso de soluciones electrolíticas balanceadas y evitar las soluciones con alto contenido de sodio y cloro (Grado de recomendación 1B).
La definición de transfusión masiva (TM) ha evolucionado102 y actualmente se basa en criterios específicos103. Durante la atención inicial en trauma, factores como el sangrado grave o masivo y el umbral crítico de administración —definido como la transfusión de 4 o más unidades en las primeras 2horas— son utilizados para evaluar la gravedad de la hemorragia y el riesgo de mortalidad. Además, la intensidad de la reanimación, medida por la cantidad de unidades transfundidas en los primeros 30min, se reconoce como un predictor de mortalidad y gravedad de la hemorragia104.
En la población civil se estudian estrategias de transfusión empírica, desarrolladas en el contexto militar, para determinar su eficacia. El estudio PROMMTT incluyó 1.245 pacientes que recibieron al menos una unidad de glóbulos rojos empaquetados (UGRE) en las primeras 6horas, demostrando que una mayor proporción de transfusión de plasma: UGRE y plaquetas: UGRE se asoció independientemente con una reducción de la mortalidad. Además, la administración temprana de plasma se correlacionó con una disminución de la mortalidad a corto y a largo plazo. Por otro lado, el estudio PROPPR asignó 680 pacientes con trauma severo a dos grupos que recibieron plasma, plaquetas y UGRE en diferentes relaciones, encontrando resultados relevantes para la práctica clínica en el manejo de la transfusión masiva.
Recomendación 32
Se recomienda administrar ácido tranexámico al paciente traumatizado que está sangrando o que presenta riesgo de hemorragia grave en las primeras 3horas, con una dosis de carga de 1g infundido por más de 10min, seguido de una infusión IV de 1g durante 8horas (Grado de recomendación 1A).
Recomendación 33
Se recomienda que los protocolos para la gestión de pacientes con sangrado consideren la administración de la primera dosis de ácido tranexámico en ruta al hospital (Grado de recomendación 1C).
Recomendación 34
Se recomienda que la administración de ácido tranexámico no espere los resultados de una prueba viscoelástica (Grado de recomendación 1B).
Recomendación 35
Se recomienda el uso de ácido tranexámico durante las primeras 3horas en pacientes con coagulopatía traumática y aumento de la fibrinólisis documentada en pruebas viscoelásticas y sangrado masivo persistente (Grado de recomendación 1C).
El ácido tranexámico (TXA), un análogo sintético de la lisina, ha demostrado reducir la mortalidad en pacientes con sangrado significativo o riesgo de este al bloquear la degradación del coágulo105. El estudio CRASH-2, un ensayo multicéntrico y controlado, incluyó a más de 20.000 pacientes con trauma asignados al azar para recibir TXA o placebo dentro de las primeras 8horas posteriores a la lesión106. Se encontró una disminución significativa en la mortalidad por todas las causas en el grupo tratado con TXA en comparación con el grupo placebo, especialmente cuando se administró durante la primera hora después de la lesión. Sin embargo, el beneficio disminuyó cuando se administró TXA después de las 3horas posteriores a la lesión, lo que sugiere que la efectividad del tratamiento puede depender del momento de su administración y las dinámicas de la hemostasia en el trauma107.
Recomendación 36
En el manejo inicial de los pacientes de trauma con hemorragia masiva se recomienda el uso de un protocolo de transfusión masiva que se encuentre basado en una estrategia hemodinámica y hemostática dirigida por objetivos (Grado de recomendación 1B).
Recomendación 37
Se recomienda el tratamiento con concentrado de fibrinógeno o crioprecipitados si el sangrado mayor en trauma se acompaña de hipofibrinogenemia (signos viscoelásticos de un déficit de fibrinógeno funcional o un nivel de fibrinógeno de Clauss en plasma ≤1,5g/l) (Grado de recomendación 1C).
Recomendación 38
Se sugiere, después del uso de 3-4g de concentrado de fibrinógeno (dosis 50-70mg/kg) y sangrado persistente, utilizar crioprecipitados si se sospecha una deficiencia de factorXIII (Grado de recomendación 1C).
Recomendación 39
Se sugiere la reposición inicial de fibrinógeno con el uso de concentrado de fibrinógeno 3-4g o 15-20 unidades de crioprecipitados. Las dosis repetidas deben guiarse por los métodos viscoelásticos y/o la evaluación de laboratorio de los niveles de fibrinógeno (Grado de recomendación 2C).
El concentrado de complejo de protrombina (CCP) es un producto que contiene factores de coagulación dependientes de la vitaminaK, utilizado para revertir la sobreanticoagulación por warfarina108. Los CCP han mostrado ser de utilidad como intervención adjunta al manejo inicial con PFC, especialmente el CCP-4F, que contiene factorVII adicional y proteínas anticoagulantes109. Estudios como el de Jehan et al. han encontrado que la combinación de CCP-4F con PFC permite una corrección más rápida del INR y una tasa de corrección más rápida en comparación con el uso de PFC solo, sin aumentar el riesgo de complicaciones tromboembólicas. Sin embargo, a pesar de sus beneficios potenciales, la evidencia actual aún no proporciona una recomendación clara sobre su uso, aunque su capacidad para almacenarse a temperatura ambiente puede ser una ventaja importante en comparación con otros productos sanguíneos, y se necesitan más estudios para evaluar su asociación con eventos adversos, como la lesión pulmonar aguda relacionada con la transfusión (TRALI).
Por otro lado, en los pacientes con trauma grave la restauración de la hemostasia temprana es esencial para mejorar los resultados clínicos. El fibrinógeno juega un papel crucial en este proceso al ser un sustrato fundamental en la integralidad final del coágulo. La rápida disminución del fibrinógeno en estos pacientes puede conducir a una recuperación más lenta y se ha asociado con un pronóstico desfavorable110. Por lo tanto, la corrección temprana del déficit de fibrinógeno se ha identificado como una estrategia clave para mejorar la supervivencia en casos de coagulopatía traumática.
A pesar de que el fibrinógeno es una proteína decisiva en el logro de una hemostasia óptima, su uso precoz ha generado debate. El estudio retrospectivo Early Coagulation Support (ECS) evaluó la instauración de un protocolo que incluía ATx, CF y GRE en comparación con el tradicional PTM en pacientes con hemorragia incontrolable o signos de hipoperfusión111. Este estudio concluyó que una intervención temprana con fibrinógeno se asociaba a una reducción significativa en el número de unidades transfundidas de GRE, PFC y CP, así como una disminución significativa en la estancia hospitalaria, sugiriendo que un abordaje basado en la reposición temprana del fibrinógeno debería ser una estrategia adaptable al manejo usual del trauma grave con sangrado mayor. Guías internacionales97 recomiendan el tratamiento con concentrado de fibrinógeno (3-4g) o con crioprecipitados (15-10 unidades) si se encuentra una hemorragia significativa acompañada de resultados en las pruebas viscoelásticas que sugieran déficit de fibrinógeno o un nivel de fibrinógeno en plasma menor de 1,5-2,0g/l, dado que promueve la estabilización de la cascada de coagulación y, por consiguiente, la disminución del riesgo de coagulopatía traumática24,97.
¿Qué estrategia transfusional debe ser utilizada en el manejo de pacientes con sangrado traumático?
Recomendación 40
Se recomienda la administración de concentrados plaquetarios de donante aleatorio o por aféresis para mantener un recuento plaquetario superior a 50×109/l (Grado de recomendación 1C).
Recomendación 41
Se sugiere mantener un recuento plaquetario mayor a 100×109/l en pacientes con hemorragias continuas y/o trauma craneoencefálico (Grado de recomendación 2C).
Recomendación 42
Se recomienda que los niveles de calcio ionizado sean medidos y mantenidos dentro del rango normal durante la transfusión masiva (Grado de recomendación 1C).
El recuento de plaquetas al ingreso hospitalario se considera un predictor importante, ya que su disminución se relaciona con un aumento de la morbilidad y mortalidad en pacientes con trauma112. Aunque se ha observado que los recuentos bajos de plaquetas están vinculados a peores resultados, la administración de plaquetas para aumentar su número muestra resultados contradictorios en términos de supervivencia113,114. Un estudio observacional encontró que una alta relación entre plaquetas y glóbulos rojos en las primeras 4horas después del trauma, pero no más tarde, se asoció con una menor disfunción orgánica y mortalidad en los primeros 30días, aunque también con tasas más altas de infección y neumonía115.
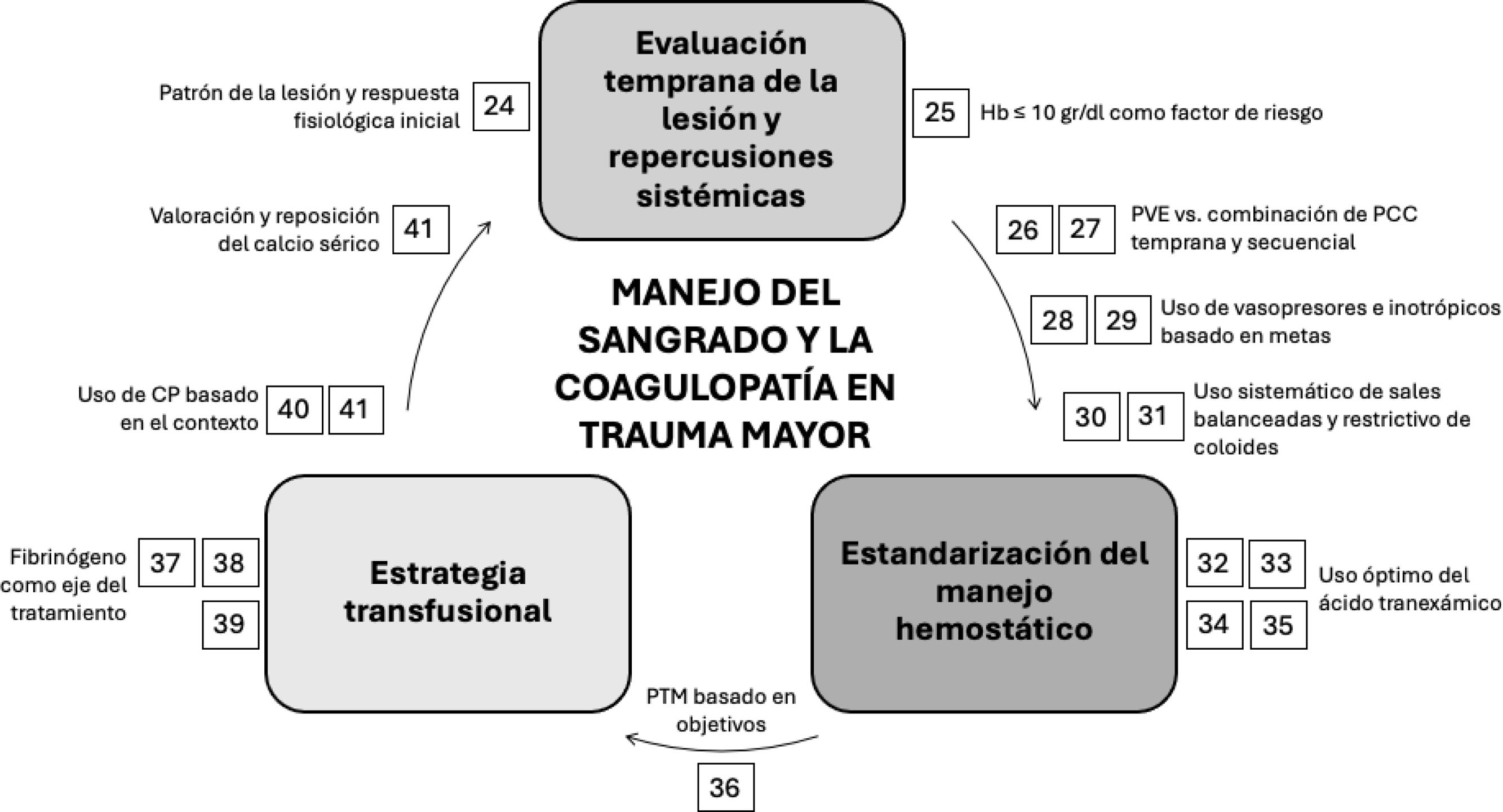
El estudio PROPPR no encontró beneficio en la supervivencia a las 24horas o a los 30días cuando se transfundieron plaquetas de manera temprana, después de la llegada a un centro de trauma116. Por otro lado, la hipocalcemia inducida por la transfusión, con niveles de calcio ionizado por debajo de 0,9mmol/l o de calcio corregido por debajo de 7,5mg/dl, requiere reemplazo de calcio inmediato, ya que niveles inferiores a 0,8mmol/l se asocian con alteraciones del ritmo cardiaco, vasoplejía y coagulopatía. Aunque es crucial mantener la concentración de calcio ionizado dentro del rango normal, no hay evidencia disponible que demuestre que reduzca la mortalidad en pacientes con sangrado crítico que necesitan transfusiones masivas117 (fig. 3).
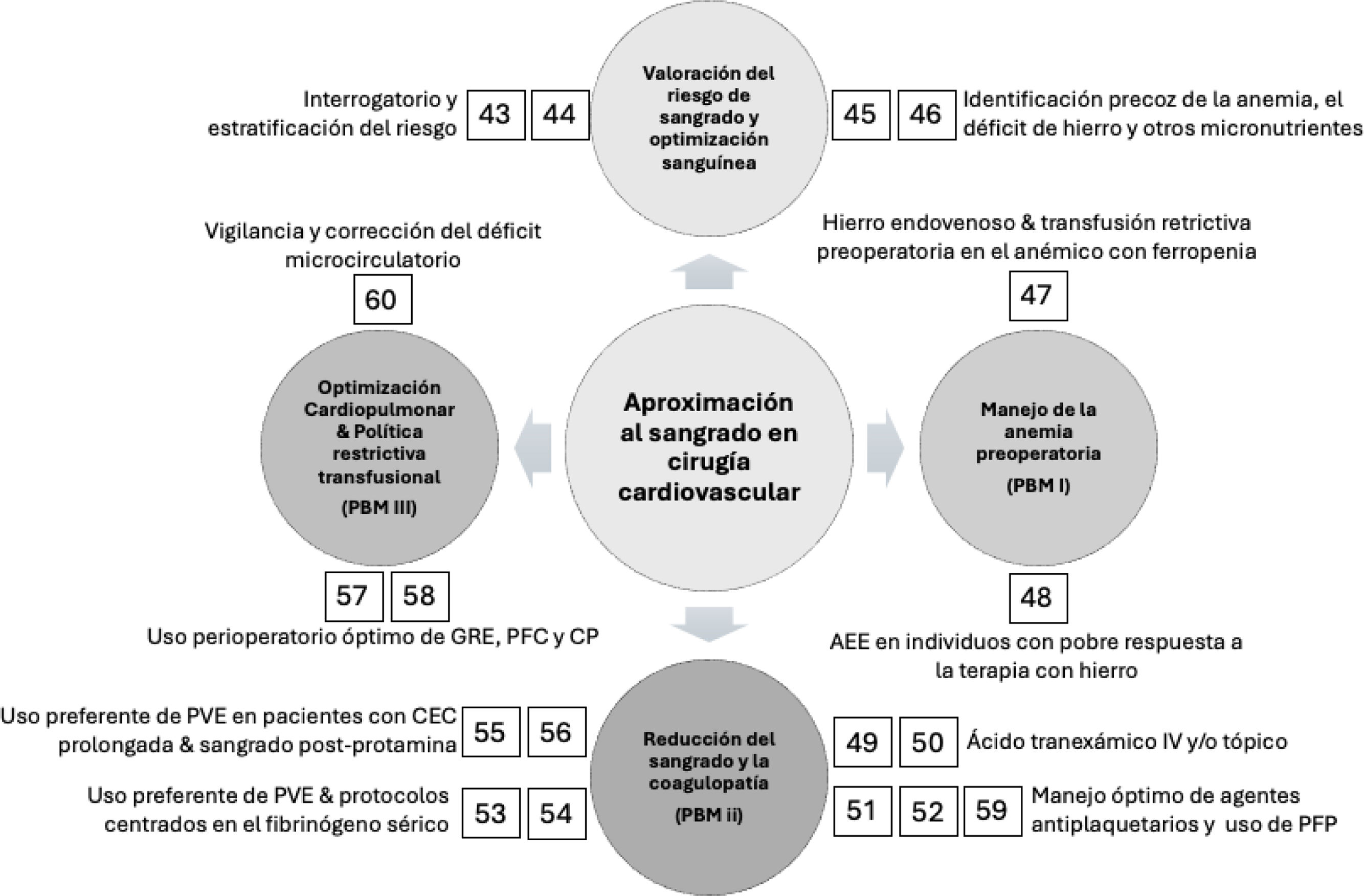
Recomendaciones para la aproximación y manejo del sangrado en cirugía cardiovascularValoración del riesgo hemorrágico en cirugía cardiacaRecomendación 43
Se recomienda identificar antes de cirugía a los pacientes con alto riesgo de sangrado y exposición a transfusiones, con el fin de utilizar todos los recursos disponibles que propendan por una política de gestión perioperatoria de la sangre del paciente (Grado de recomendación 1A).
El alto consumo de hemocomponentes en la población de pacientes sometidos a cirugía cardiaca refleja la complejidad y la gravedad de sus condiciones médicas. Esta necesidad elevada de transfusiones sanguíneas puede estar vinculada a una serie de factores, como la extensión de la cirugía, la presencia de comorbilidades, la gravedad de la enfermedad cardiovascular subyacente y la respuesta individual del paciente a la cirugía y la terapia.
Sin embargo, más allá de la simple correlación entre el consumo de hemocomponentes y la gravedad de la enfermedad, existe una preocupación significativa en relación con el pronóstico de estos pacientes. Se ha observado consistentemente que el pronóstico empeora a medida que aumenta el número de unidades de hemocomponentes transfundidas durante la cirugía cardiaca. Este fenómeno se puede atribuir a varios factores. En primer lugar, la necesidad de transfusiones sanguíneas excesivas puede indicar una mayor pérdida de sangre intraoperatoria, lo que a su vez está asociado con una cirugía más prolongada, mayor trauma quirúrgico y una respuesta inflamatoria sistémica más intensa, todos ellos factores que pueden contribuir al aumento del riesgo de complicaciones postoperatorias y mortalidad.
El uso excesivo de hemocomponentes puede llevar a complicaciones relacionadas con la transfusión, como la sobrecarga de volumen, la sobrecarga de hierro, la disfunción pulmonar aguda, la lesión renal aguda y la inmunomodulación. Estas complicaciones pueden prolongar la estancia hospitalaria, aumentar los costos de atención médica y afectar la calidad de vida y el resultado a largo plazo luego de cirugía cardiaca118,119. Es crucial abordar de manera integral el manejo preoperatorio de la sangre en pacientes sometidos a cirugía cardiaca, para minimizar la necesidad de transfusiones sanguíneas y optimizar el pronóstico postoperatorio116,117.
¿Cuáles son las prioridades en la optimización de la hemoglobina y la prevención de la pérdida sanguínea en el preoperatorio de cirugía cardiaca?
Recomendación 44
Antes de cirugía cardiaca, se recomienda entrevistar al paciente para indagar sobre sus antecedentes personales o familiares relacionados con alteraciones de la coagulación, sangrado durante procedimientos o cirugías previas y/o si el paciente recibe algún medicamento o extractos herbales que puedan alterar su capacidad hemostática (Grado de recomendación 1C).
La entrevista al paciente y el examen físico son las herramientas primarias para determinar las alteraciones de la hemostasia y los antecedentes de sangrado en procedimientos quirúrgicos previos. Dentro de los antecedentes se debe incluir la valoración de enfermedad renal crónica previa, la cual, en cirugía cardiaca, se asocia con un aumento del sangrado y de los requerimientos transfusionales.
Se debe evaluar la ingesta de fármacos que afecten la capacidad hemostática, tales como la heparina no fraccionada (HNF), HBPM, ACOD y agentes antiplaquetarios. Hasta que haya evidencia conclusiva, se recomienda evaluar la ingesta de sustancias herbales (p.ej., Ginkgo biloba, Ginseng) que podrían potencialmente alterar la función15,25.
Recomendación 45
Se recomienda la evaluación y tratamiento de la anemia, la deficiencia de hierro y otros déficits carenciales asociados en todos los individuos programados para cirugía cardiaca electiva, idealmente dentro de las 3-8 semanas previas al procedimiento (Grado de recomendación 1C).
Recomendación 46
En pacientes con anemia programados para cirugía cardiaca electiva, se recomienda posponer la cirugía hasta que la anemia preoperatoria y el déficit de micronutrientes hayan sido corregidos (Grado de recomendación 1C).
La prevalencia de anemia en los pacientes adultos programados para cirugía cardiaca ocupa un rango amplio entre el 20-60%. Sus causas más frecuentes incluyen déficit de hierro, desnutrición, malabsorción de nutrientes, inflamación, alteraciones de la médula ósea y pérdida sanguínea crónica. Esta condición ha sido identificada como un factor prevenible asociado a incremento en la exposición a transfusiones, malos desenlaces postoperatorios y altos costos en la atención.
La corrección de la anemia y el déficit de hierro antes de cirugía cardíaca se ha recomendado como el «nuevo normal» debido a su impacto positivo sobre los resultados perioperatorios y la seguridad del paciente. La anemia compromete el suministro de oxígeno a los tejidos y órganos, lo que puede exacerbar las condiciones isquémicas y aumentar el riesgo de eventos cardiovasculares adversos durante y después de la cirugía. En el contexto de la cirugía cardíaca, donde la oxigenación óptima de los tejidos es crucial para la función miocárdica y la recuperación postoperatoria, la anemia no tratada puede conducir a malos resultados, incluido el aumento de la mortalidad, estancias hospitalarias prolongadas y tasas más altas de complicaciones, como infarto de miocardio, accidente cerebrovascular e insuficiencia renal.
El momento óptimo para la corrección de la anemia y el déficit de hierro antes de la cirugía cardíaca depende de varios factores, que incluyen la gravedad del déficit, su etiología subyacente y el tipo de intervención quirúrgica. Las intervenciones para tratar la anemia preoperatoria y la deficiencia de hierro idealmente deben comenzar con suficiente anticipación al procedimiento para permitir un tratamiento eficaz de optimización de los niveles de hemoglobina.
Para optimizar las reservas de hierro y estimular la producción de glóbulos rojos es ideal comenzar con intervenciones dietarias, suplementación de hierro (oral o parenteral) y agentes estimulantes de la eritropoyesis (AEE) entre 8 y 3semanas antes de la cirugía. En casos de anemia grave o deficiencia de hierro resistente al tratamiento puede ser necesaria una terapia acelerada que incluya hierro parenteral, AEE y vitaminasB9 yB12, con el objetivo de reducir la necesidad de transfusiones en el perioperatorio. La colaboración estrecha entre cardiólogos, hematólogos y otros miembros del equipo multidisciplinario es esencial para desarrollar planes de tratamiento individualizados, adaptados a las necesidades del paciente y la programación quirúrgica15,120,121.
Recomendación 47
Se recomienda que las estrategias para optimización de la anemia y el déficit de hierro se encuentren asociadas a una política de transfusión restrictiva en los pacientes anémicos que estén programados para cirugía cardiaca electiva (Grado de recomendación 1B).
La terapia con hierro ha demostrado ser efectiva para mejorar las cifras de hemoglobina en los pacientes llevados a cirugía cardiaca electiva y demostró disminuir la cantidad de unidades de glóbulos rojos transfundidas en el periodo postoperatorio.
La suplementación de hierro por vía intravenosa ha demostrado ser más efectiva y rápida que la suplementación de hierro por vía oral. Existe un fuerte acuerdo en que la terapia con hierro suplementario es eficaz en aquellos pacientes que presentan anemia ferropénica. Las directrices existentes recomiendan el tratamiento preoperatorio con hierro en los pacientes con anemia ferropénica que van a ser llevados a cirugía cardiaca electiva120–122.
La transfusión de hemocomponentes durante cirugía cardiaca y cirugía mayor se asocia con un aumento de las complicaciones y de la mortalidad123,124. En cirugía cardiaca existe un debate sobre los beneficios de una estrategia transfusional restrictiva en comparación con una estrategia liberal. Las guías de Patient Blood Management (PBM) en cirugía cardiaca abordan este tema125, revisando los estudios disponibles. Por otro lado, el estudio TRICS, que incluyó pacientes sometidos a cirugía cardiaca con un riesgo moderado a alto de mortalidad, demostró que la estrategia restrictiva de transfusión de glóbulos rojos (con un umbral transfusional de Hb <7,5g/dl) no fue inferior a la estrategia liberal (con Hb>9,5g/l)126.
Recomendación 48
Se recomienda el uso de eritropoyetina en aquellos pacientes que vayan a ser llevados a cirugía cardiaca electiva y presenten anemia secundaria a enfermedad renal crónica, así como otras causas de anemia crónica (Grado de recomendación 1C).
La eritropoyetina, asociada o no al uso de hierro, se recomienda en aquellos pacientes con anemia no ferropénica, cuyas principales causas son insuficiencia renal y anemia por enfermedad crónica, o en aquellos pacientes que rechazan las transfusiones de sangre. No se recomienda la transfusión profiláctica de glóbulos rojos en pacientes anémicos asintomáticos antes de cirugía cardiaca122,127,128.
Recomendación 49
Se recomienda la administración profiláctica de ácido tranexámico antes de la entrada a circulación extracorpórea en pacientes sometidos a cirugía cardiaca (Grado de recomendación 1A).
Recomendación 50
Se sugiere la aplicación profiláctica tópica de ATx en la cavidad torácica para disminuir la pérdida sanguínea después de la cirugía cardiaca (Grado de recomendación 2B).
Los antifibrinolíticos se han usado desde hace varias décadas para la prevención del sangrado en cirugía cardiovascular. El uso del ATx ha demostrado una disminución del sangrado postoperatorio en cirugía cardiaca. El estudio ATACAS comparó ATx con placebo en pacientes llevados a cirugía de revascularización coronaria. En el grupo tratado con ATx se encontró una reducción en la cantidad del sangrado postoperatorio, el número de reintervenciones y la cantidad de componentes sanguíneos transfundidos.
Un metaanálisis reciente que incluyó 13 estudios y 1.168 pacientes y que comparó ATx frente a placebo en cirugía cardiaca encontró que el uso del ATx se asoció con una reducción del sangrado y de los requerimientos transfusionales postoperatorios. Un segundo metaanálisis que incluyó 7 estudios y 692 pacientes, respecto al uso tópico intrapericárdico del ATx, encontró una disminución en el sangrado postoperatorio sin un aumento del riesgo de las complicaciones postoperatorias129–131.
Manejo preoperatorio de antiagregantes plaquetarios en cirugía cardiovascular¿Cuánto tiempo antes de la cirugía se deben suspender los antiagregantes plaquetarios en pacientes que van a ser llevados a cirugía cardiaca electiva?
Recomendación 51
Se recomienda suspender el ticagrelor 3 días antes de la cirugía cardiaca, el clopidogrel 5días antes de la cirugía cardiaca y el prasugrel 7días antes de la cirugía cardiaca (Grado de recomendación 1B).
La suspensión preoperatoria de medicamentos antiplaquetarios como ticagrelor, prasugrel y clopidogrel es una medida crucial para mitigar el riesgo de sangrado perioperatorio y sus complicaciones asociadas en pacientes sometidos a cirugía cardiaca. Estas directrices subrayan la importancia de una planificación cuidadosa y una coordinación estrecha entre los cardiólogos y cirujanos para garantizar una gestión óptima de los agentes antiplaquetarios en el período perioperatorio, maximizando así la seguridad del paciente durante la cirugía cardiaca.
La guía de práctica clínica de la Sociedad Europea de Cardiología (ESC) sobre el manejo perioperatorio de la enfermedad arterial coronaria establece que la interrupción de ticagrelor 3días antes y prasugrel al menos 7días antes de la cirugía es fundamental para minimizar el riesgo de sangrado. Estas recomendaciones son extraídas de estudios publicados por Gherli et al. y por Hansson et al., en donde se estudió la seguridad y la incidencia de eventos hemorrágicos que recibían estos antiplaquetarios con o sin aspirina. Asimismo, se sugiere que la suspensión de clopidogrel se realice con un margen de tiempo de 5días para permitir una recuperación adecuada de la función plaquetaria y reducir el riesgo hemorrágico132,133.
Además de la suspensión preoperatoria de los medicamentos antiplaquetarios, es crucial establecer estrategias para gestionar el riesgo trombótico durante el período en que estos fármacos se encuentran discontinuados. En este sentido, se pueden considerar alternativas temporales, como el uso de agentes antiplaquetarios intravenosos o la administración de heparina no fraccionada, bajo la supervisión de un equipo multidisciplinario especializado. Estas medidas pueden mantener un equilibrio adecuado entre la prevención de la trombosis y la reducción del riesgo de sangrado en el período perioperatorio, garantizando una atención integral y segura para pacientes con cirugía cardiaca.
Recomendación 52
Cirugía cardiaca: se recomienda mantener la terapia con aspirina como prevención secundaria en pacientes que serán sometidos a cirugía cardiaca. (Grado de recomendación 1B).
Cirugía no cardiaca con alto riesgo de sangrado: se sugiere suspender la terapia con aspirina en prevención secundaria en pacientes con alto riesgo de sangrado que se someterán a cirugía no cardiaca, excepto en aquellos con stents coronarios. (Grado de recomendación 1B)
Cirugía no cardiaca con bajo o moderado riesgo de sangrado: se recomienda continuar la terapia con aspirina como prevención secundaria en pacientes con bajo o moderado riesgo de sangrado que serán sometidos a cirugía no cardiaca. (Grado de recomendación 1B)134-139.
La evidencia en conjunto indica que la continuación de ácido acetilsalicílico (ASA) hasta la cirugía cardíaca se asocia con un riesgo moderado de complicaciones hemorrágicas y una reducción significativa en el riesgo de infarto de miocardio perioperatorio. Por tanto, el riesgo de complicaciones hemorrágicas si no se suspende el ASA debe contemplarse con el riesgo de complicaciones trombóticas, especialmente en pacientes con alto riesgo de eventos coronarios durante el perioperatorio. Si se produce sangrado durante la cirugía, la transfusión de plaquetas ha demostrado que contrarresta eficazmente los efectos del ASA. Estos hallazgos respaldan aún más la posibilidad de continuar con el ASA durante todo el perioperatorio en individuos de alto riesgo, ya que este fármaco permite la reversión efeciente de su efecto antiagregante directo128-133.
¿Cómo deben evaluarse la coagulopatía y el sangrado en pacientes durante el perioperatorio de cirugía cardiaca?
Recomendación 53
Se recomienda la determinación de los niveles de fibrinógeno sérico y el recuento plaquetario como partes integrales de la valoración de la coagulopatía en cirugía cardiaca (Grado de recomendación 1B).
El déficit de fibrinógeno es una de las principales causas de sangrado en cirugía cardiaca. Los valores séricos de fibrinógeno en algunos estudios han mostrado una correlación moderada con el sangrado en el intraoperatorio y el postoperatorio de la cirugía cardiaca.
Existe una correlación adecuada entre los niveles séricos de fibrinógeno determinados por el método de Clauss y la contribución del fibrinógeno a la firmeza del coágulo determinado por el tiempoK y el ángulo alfa de TEG® o por la subprueba de FIBTEM®. El recuento plaquetario es una PCC que complementa la determinación de la función plaquetaria mediante las PVC y las PFP específicas118.
Recomendación 54
Se recomienda la aplicación de algoritmos transfusionales basados en pruebas viscoelásticas como estrategia para reducir la exposición a hemocomponentes y el riesgo de eventos adversos asociados a las transfusiones (Grado de recomendación 1B).
Las PVE han sido objeto de investigación en la valoración del sangrado perioperatorio en cirugía cardiovascular. Múltiples estudios observacionales, estudios aleatorizados y metaanálisis han demostrado la disminución de los requerimientos transfusionales y la mejoría de los resultados cuando se usan PVE en la evaluación del estado de coagulación y para el manejo del sangrado140-143.
Las PVE han mostrado ser superiores a las pruebas convencionales en la valoración del estado de coagulación y son útiles para guiar el manejo del sangrado en la cirugía cardiaca144-147. El uso de las PVE está recomendado en las diferentes guías de medicina transfusional y manejo del sangrado a nivel mundial para la valoración del estado de coagulación en cirugía cardiovascular148.
¿Cómo se debe evaluar la coagulopatía y el sangrado al terminar el soporte con circulación extracorpórea (CEC) y revertir la heparina en pacientes durante el perioperatorio de cirugía cardiaca?
Recomendación 55
Se sugiere evaluar y tratar las alteraciones hemostáticas a partir de algoritmos basados en pruebas viscoelásticas durante el recalentamiento de individuos con tiempos prolongados de circulación extracorpórea (≥115min) (Grado de recomendación 2A).
Se ha demostrado una adecuada correlación entre los parámetros medidos con las PVE VPOC durante las diferentes fases o periodos en cirugía cardiovascular al compararlos con las pruebas convencionales, pero, en especial, en el periodo de CEC al compararlo con los niveles de fibrinógeno por medio del método estándar de Clauss144.
Shore-Lesserson et al. demostraron la utilidad del uso de las VPOC comparadas con las pruebas convencionales en 105 pacientes de riesgo moderado y alto en cirugía cardiaca, con tiempos de CEC>115. En este ensayo se incluyó la medición de estos parámetros durante la fase de recalentamiento y sus resultados a favor de menores requerimientos transfusionales141.
En un ensayo prospectivo aleatorizado en el que se evaluó la eficacia de un algoritmo de terapia transfusional con ROTEM® en comparación con las PCC en pacientes de cirugía cardíaca, se incluyeron un total de 104 pacientes. Se analizó un subgrupo de 55 pacientes considerados con mayor riesgo de desarrollar coagulopatía por tener un tiempo de CEC >115min y se encontró que usar la terapia guiada por ROTEM® resultó en una disminución significativamente menor del sangrado en las primeras 24horas (1.538,2±806,4ml) frente al grupo control (2.056,8±974,5ml; p=0,032)20.
Recomendación 56
Se sugieren protocolos basados en pruebas viscoelásticas para el manejo de individuos con sangrado clínicamente relevante tras la reversión del efecto de la heparina no fraccionada con protamina (Grado de recomendación 2B).
Recomendación 57
Se sugiere la aplicación de políticas restrictivas para el uso de plasma fresco congelado y concentrados plaquetarios en individuos llevados a circulación extracorpórea (Grado de recomendación 2B).
Los algoritmos de diagnóstico para el estado del perfil de coagulación que guíen la terapia transfusional en cirugía cardiaca pueden estar basados tanto en PCC como en PVE. No hay duda de las ventajas de las PVE, con opción de resultados rápidos, que permiten evaluar de forma integrada los diferentes componentes del sistema de coagulación. Las PVE han demostrado reducir las transfusiones al compararlas con las pruebas estándar145.
En un ensayo controlado aleatorizado con 7.402 pacientes evaluados en 12 hospitales se encontró una reducción en la transfusión de glóbulos rojos al implementar un protocolo VPOC (RR: 0,91; IC95%: 0,85-0,98; p=0,02) y de plaquetas (RR: 0,77; IC95%: 0,68-0,87; p<0,001)146.
Una revisión Cochrane encontró que el uso PVE se asocia con una reducción en las transfusiones de hemocomponentes, con un riesgo relativo (RR) para transfusión de glóbulos rojos (GRE) de 0,86 (IC95%: 0,79-0,94), para plasma fresco congelado (PFC) de 0,57 (IC95%: 0,33-0,96) y para concentrados plaquetarios (CP) de 0,73 (IC95%: 0,60-0,88)18. Asimismo, en una revisión sistemática y metaanálisis que evaluó 15 ensayos clínicos con 8.737 pacientes sometidos a cirugía cardiovascular, en los cuales se compararon pruebas convencionales con pruebas viscoelásticas en el punto de atención (PVE VPOC), se observó una disminución en la necesidad de terapia transfusional, aunque sin un impacto estadísticamente significativo en la mortalidad. Sin embargo, la calidad de la evidencia fue evaluada como baja según la escala GRADE142. Igualmente, en otra revisión sistemática y metaanálisis que evaluó 15 ensayos clínicos con 8.737 pacientes sometidos a cirugía cardiovascular y en el que se compararon las pruebas convencionales y las PVE, se encontró una disminución en la terapia transfusional sin impacto estadísticamente significativo en la mortalidad142.
El principal beneficio del uso de pruebas viscoelásticas (PVE) radica en su impacto en la reducción de la terapia transfusional, aunque no se ha demostrado un beneficio consistente en términos de mortalidad. Se requieren ensayos clínicos con un diseño metodológico más riguroso para llegar a una conclusión definitiva en este aspecto. No obstante, muchas guías para el manejo del sangrado en cirugía cardiaca recomiendan las PVE como parte fundamental de los algoritmos de tratamiento, así como el uso de combinaciones de concentrados de complejos de protrombina (PCC) en contextos donde no se disponga de PVE25.
La correlación entre los niveles bajos de fibrinógeno, el sangrado en cirugía cardiovascular y los incrementos de los requerimientos transfusionales ha sido descrita en diferentes estudios observacionales, en especial relacionados con la fase final de la CEC y la estancia inicial en UCI.
La determinación de la hipofibrinogenemia no ha sido inferior en las PVE al compararlas con el método de Clauss, considerado como la prueba estándar, tanto a las 6 como a las 24horas del postoperatorio. Sin embargo, la superioridad de las PVE, a diferencia del método de Clauss, está directamente relacionada con la posibilidad de optimizar los tiempos en el inicio de la terapia transfusional y con la dificultad de la medición con el método de Clauss hacia el final de la CEC, debido a la interacción con la heparina143,144,147,149.
La reducción de las transfusiones de PFC y CP en cirugía cardíaca es imperativa debido a los riesgos potenciales asociados estos hemocomponentes y la disponibilidad actual de estrategias alternativas para controlar la coagulopatía y el sangrado. Las transfusiones de PFC se administran comúnmente para corregir la coagulopatía y mantener la hemostasia durante la cirugía cardíaca, particularmente en casos de sangrado excesivo o deficiencias de factores de coagulación. Sin embargo, las transfusiones de PFC se asocian significativamente con lesión pulmonar aguda relacionada con la transfusión (TRALI), sobrecarga circulatoria asociada a la transfusión (TACO), disfunción multiorgánica y sepsis postoperatoria.
Se ha cuestionado la eficacia de las transfusiones de PFC para el tratamiento de la coagulopatía en cirugía cardiaca150. Esto se suma a los riesgos inherentes mencionados anteriormente, lo cual refuerza la necesidad de estrategias para reducir la dependencia de las transfusiones de PFC en cirugía cardíaca151,152.
Entre las estrategias usadas para reducir la exposición perioperatoria al PFC se incluyen una hemostasia quirúrgica meticulosa, agentes farmacológicos para mejorar la hemostasia (p.ej., antifibrinolíticos), el uso de PVE y la administración componentes sanguíneos específicos o factores de coagulación en función de las necesidades individuales del paciente. Al minimizar el uso de transfusiones de PFC y adoptar un enfoque más personalizado y multidisciplinario para el manejo hemostático, es posible mitigar los riesgos relacionados con las transfusiones y optimizar los resultados de los pacientes en cirugía cardíaca.
¿Qué estrategia transfusional debe utilizarse en el manejo al terminar el CPB y revertir la heparina?
Recomendación 58
Se recomienda una estrategia transfusional restrictiva de glóbulos rojos empacados (GRE) en pacientes sometidos a cirugía cardiaca bajo circulación extracorpórea (CEC) (Grado de recomendación 1B).
Se considera que los pacientes sometidos a cirugía cardiovascular presentan mayor riesgo de tener complicaciones inherentes al sangrado o a la anemia perioperatoria. La decisión de transfundir GRE se ha mantenido en debate respecto al beneficio de la optimización del transporte de oxígeno y la mejora de sus desenlaces en relación con un punto de corte basado en niveles de hemoglobina o hematocrito. Por lo tanto, también se deben tomar en consideración algunos marcadores de perfusión tisular y tomar la decisión según las condiciones y comorbilidades de cada paciente148.
Sin embargo, con la implementación del ensayo clínico multicéntrico TRICS, en el que se comparó la estrategia transfusional conservadora de hemoglobina <7,5g/dl frente a la estrategia liberal de 9,5g/dl en pacientes sometidos a cirugía cardíaca que tenían un riesgo de muerte de moderado a alto, se encontró que la estrategia restrictiva no fue inferior en relación con los desenlaces combinados, que incluyeron muerte por cualquier causa, infarto de miocardio, accidente cerebrovascular o insuficiencia renal de nueva aparición con diálisis25,121,141,145.
Recomendación 59
Se recomienda la realización de pruebas de función plaquetaria para los pacientes que llegan a cirugía cardiaca bajo los efectos de antiagregantes y que presentan sangrado tras la reversión de la heparina no fraccionada (HNF) (Grado de recomendación 2C).
Los pacientes sometidos a cirugía cardiovascular, por su patología de base, pueden estar en tratamiento con medicación antiagregante, la cual no es posible evaluar mediante pruebas convencionales. Esto incrementa el riesgo de sangrado y transfusiones en el posoperatorio.
Las PVE optimizan el diagnóstico del estado de la función plaquetaria y ayudan a ajustar los tiempos óptimos para cirugía en aquel grupo de pacientes en el cual se puede diferir su cirugía. Sin embargo, aquella población que requiere ser intervenida bajo los efectos de estos medicamentos es un reto y, en ocasiones, se maneja empíricamente con opciones farmacológicas o mediante transfusión de plaquetas153,154.
Agarwal et al. realizaron un ensayo clínico aleatorizado multicéntrico en el cual, en pacientes sometidos a revascularización miocárdica bajo terapia de antiagregación plaquetaria, se realizó una asignación aleatoria a la monitorización preoperatoria de la función plaquetaria mediante Multiplate® (grupoA) o mediante mapeo plaquetario por TEG® (grupoB) con evaluación previa y posterior a la bomba por medio de FF o atención de rutina (grupoC)155,156. En las poblaciones de los gruposA yB, en quienes se documentó compromiso de la función plaquetaria y sangrado microvascular, se requirió mayor transfusión de plaquetas, pero con una reducción de las transfusiones globales y con menor reexploración por hemorragia en comparación con el grupo control. En las poblaciones de los gruposA yB, en quienes se documentó compromiso de la función plaquetaria y sangrado microvascular, se requirió mayor transfusión de plaquetas, pero con una reducción de las transfusiones globales y con menor reexploración por hemorragia en comparación con el grupo control. Además de esto, se encontró un impacto económico favorable, pues se acompañó de un ahorro de costos de casi el 50%157. Sin embargo, se requieren más ensayos clínicos con un adecuado diseño y una muestra más significativa para contar con mayor evidencia a favor de su uso en el control del sangrado en este tipo de pacientes157-160. Sin embargo, se requieren más ensayos clínicos con un adecuado diseño y una muestra más significativa para contar con mayor evidencia a favor de su uso en el control del sangrado en este tipo de pacientes158-160.
Recomendación 60
Se recomienda la vigilancia y corrección temprana del déficit microcirculatorio como una estrategia para la prevención y el tratamiento de alteraciones hemostáticas asociadas al sangrado mayor en cirugía cardiaca (Grado de recomendación 1B).
Las recomendaciones para vigilar y restablecer tempranamente la dinámica microcircutoria han sido ampliamente descritas en las recomendaciones1 y2 de este documento. Las alteraciones en la microcirculación en enfermedades cardiovasculares y cirugía cardiaca se correlacionan de manera independiente con estancias prolongadas en la unidad de cuidados intensivos postoperatorios y tasas de mortalidad elevadas a los 30días. Además, se ha demostrado que la circulación extracorpórea (CEC) induce disfunción microcirculatoria, predisponiendo a los pacientes a disfunción orgánica múltiple postoperatoria y coagulopatía sistémica secundaria a disrupción del endotelio y el glicocálix161,162.
Es común en cirugía cardiovascular que persista vasoplegia con alteración microcirculatoria. Distintas estrategias terapéuticas pueden ser usadas en este contexto. Un estudio realizado por Hajjar et al. comparó la utilización aleatoria de vasopresina y norepinefrina en 300 sujetos con síndrome vasoplégico post-cirugía cardiaca concluyendo que los dos medicamentos podrían ser utilizados como estrategia de primera línea para la recuperación del tono vasomotor163. Sin embargo, la pérdida del tono vasomotor en shock hemorrágico durante cirugía cardiaca puede ser de origen multifactorial, lo cual merece un análisis amplio de la dinámica cardiaca, la suficiencia del componente intravascular, el impacto sistémico de la circulación extracorpórea y una identificación precoz de la causa del sangrado.
Por lo anterior se hace necesario rastrear variables microcirculatorias para desarrollar tratamientos dirigidos dentro de los protocolos de manejo hemodinámico. Es imperativo mejorar la integración del monitoreo microcirculatorio en la práctica clínica para ayudar a los equipos quirúrgicos en el manejo terapéutico de los pacientes sometidos a cirugía cardiaca, lo que potencialmente resultará en una mayor estabilidad hemodinámica, mejor respuesta a las estrategias para reducir el sangrado y mejores resultados generales (fig. 4).
Aproximación a sangrado en cirugía cardiovascular. La numeración corresponde a cada una de las recomendaciones incluidas en el texto.
CP: concentrado plaquetario; GRE: glóbulos rojos empacados; PCC: pruebas de coagulación convencionales; PFC: plasma fresco congelado; PVE: pruebas viscoelásticas.
Los autores no recibieron apoyo financiero para la investigación, autoría y/o publicación de este artículo.
Esta publicación hace parte de la actividad académica desarrollada desde el comité de sangrado de la Asociación Colombina de Medicina Crítica y Cuidado Intensivo de la cual son integrantes la Dra. Sandra Olaya, la Dra. Liliana Correa, el Dr. Hans García y el Dr. Manuel Garay, razón por la cual tiene su aval.