La tormenta tiroidea (TT) es una patología infrecuente, pero potencialmente mortal si no se detecta y trata oportunamente. Se caracteriza por manifestaciones clínicas graves a nivel del sistema nervioso central, cardiovascular y gastrointestinal, asociado a niveles elevados de triyodotironina (T3) libre y tiroxina (T4) libre. Las infecciones y/o el abandono del tratamiento son los desencadenantes más frecuentes. Identificar el factor desencadenante, reducir los niveles circulantes de hormonas tiroideas, y admitir a unidad de cuidado intensivo se convierten en la piedra angular del tratamiento. En la presente revisión, basados en un escenario clínico, proporcionaremos información con respecto al abordaje diagnóstico y terapéutico de una TT.
Thyroid storm (TT) is a rare but potentially fatal condition if not detected and treated promptly. It is characterized by severe clinical manifestations at the level of the central nervous system, cardiovascular system, and gastrointestinal system, associated with elevated levels of free triiodothyronine (T3) and free thyroxine (T4). Infections and/or treatment discontinuation are the most frequent triggers. Identifying the triggering factor, reducing circulating levels of thyroid hormones, and admission to an intensive care unit become the cornerstone of treatment. In this review, based on a clinical scenario, we will provide information regarding the diagnostic and therapeutic approach to TT.
Una mujer de 56 años con diagnóstico de enfermedad de Graves decidió abandonar el tratamiento médico hace varios meses. Consulta a urgencia por fiebre de 38,5°C, palpitaciones precordiales, diarrea persistente e insomnio de hace una semana. Al examen físico, presenta frecuencia cardiaca de 145 latidos/minutos y presión arterial de 140/90mmHg. Se encuentra inquieta e irritable, con la mucosa oral seca, proptosis ocular bilateral, ritmo cardiaco regular y bocio tiroideo grado II a la palpación. Su hormona estimulante de tiroides (TSH) es <0,01mU/L (0,35-4,96mU/L) y la tiroxina libre (T4L), 6,0ng/dL (0,70-1,48ng/dL). Su puntuación Burch-Wartofsky (BWS) es de 80 puntos, y según los criterios de la Asociación Japonesa de Tiroides: TT1 «primera combinación». Ambos criterios definen una tormenta tiroidea (TT). ¿Cómo manejarías esta paciente?
Definición y descripción epidemiológicaLa TT fue descrita por primera vez en el año 1926 por el Dr. Lahey, y en ese momento fue vista como una exacerbación de la enfermedad de Graves con hallazgos exagerados de hipertiroidismo1. Actualmente se define como una manifestación grave de la tirotoxicosis debido al compromiso multiorgánico y su elevada morbimortalidad2. En los Estados Unidos, uno de cada 6 egresos por tirotoxicosis fue diagnosticado con TT, asociándose a una tasa de mortalidad mayor en comparación con una tirotoxicosis sin TT3. En una encuesta realizada en Japón entre 2004 y 2008 por la Asociación Japonesa de Tiroides se informó una incidencia estimada de 0,2 casos/100.000 por año, con una tasa de mortalidad hospitalaria que oscila entre el 9,5 y el 11%.4. Un último informe japonés entre el 2011 y 2014 reportó un aumento en la incidencia de 6,3 casos/100.000 por año, y una tasa de mortalidad alrededor del 10,1%5,6.
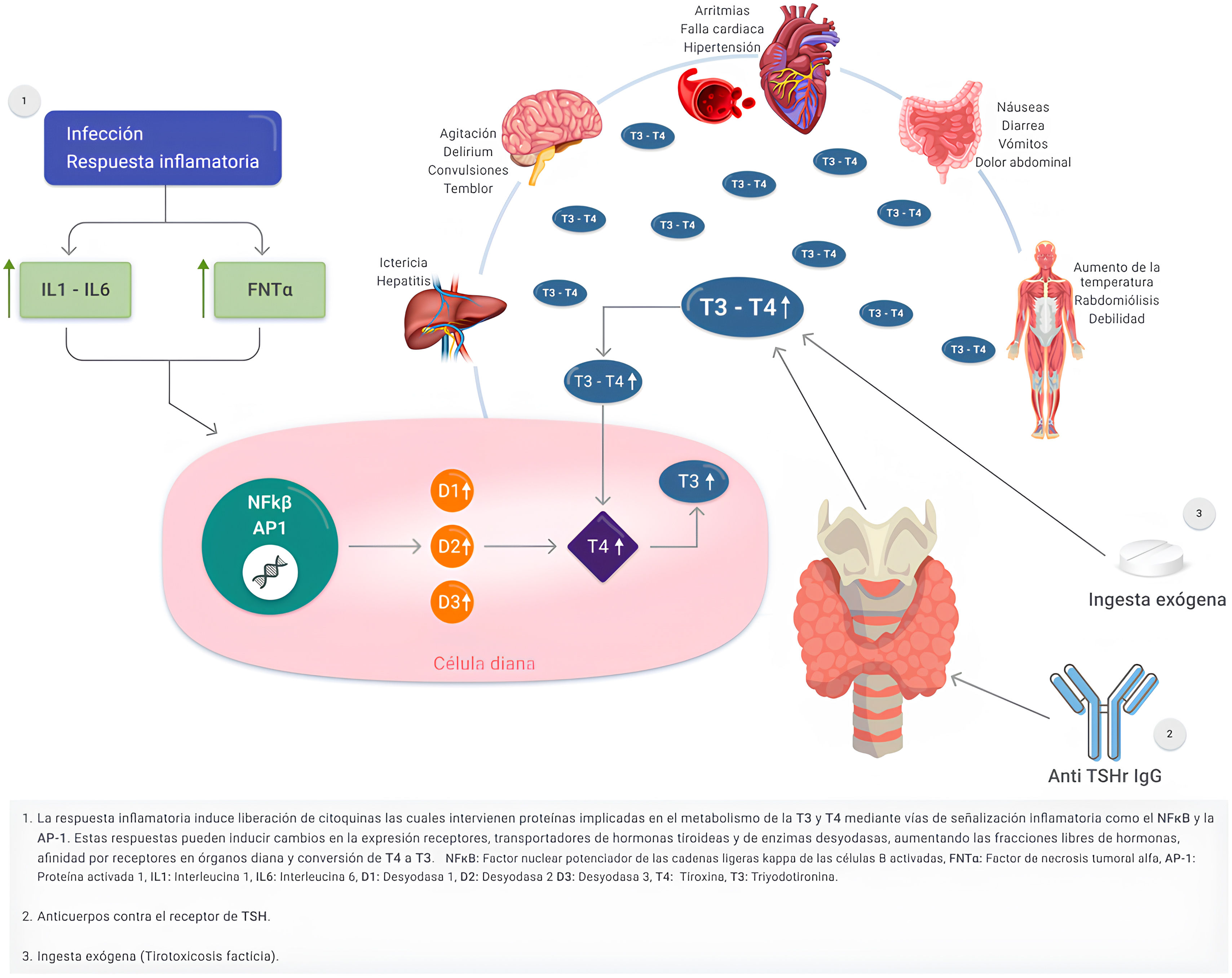
PatogeniaEl mecanismo por el cual una enfermedad o lesión aguda precipita una TT es poco conocido y es probable que intervengan varios mecanismos, como los mencionados a continuación. En primer lugar, la respuesta inflamatoria generada por un agente infeccioso, trauma o estrés quirúrgico induce la liberación de citocinas (factor de necrosis tumoral alfa e interleucinas 1 y 6) afectando la expresión de proteínas implicadas en el metabolismo de la T4 y T3. En segundo lugar, se activan vías de señalización inflamatoria como el factor nuclear potenciador de la cadena ligera kappa de las células B activadas (NFκB) y la proteína activadora-1 generando así una mayor inflamación. Hechos anteriores que inducen cambios en las proteínas transportadoras de hormonas tiroideas como la globulina ligadora de tiroxina (TBG), transtirretina, albúmina, receptores tipo TRα - TRβ y las enzimas desyodasas tipo D2 generando una mayor circulación de hormonas tiroideas6,7. Fisiológicamente, menos del 1% de las hormonas tiroideas se encuentran libres en el plasma y disponibles para su captación en los tejidos, y la TBG es la responsable de la entrega inmediata de las hormonas tiroideas a los tejidos periféricos por su mayor afinidad por la T4 y la T37,8. En sujetos con TT, existe una mayor biodisponibilidad de las hormonas tiroideas en su fracción libre, explicada por una disminución en la afinidad de las proteínas transportadoras y así una mayor unión a sus receptores1,8 (fig. 1). Otro mecanismo planteado es el aumento de la actividad adrenérgica que imita un exceso de catecolaminas. Sin embargo, las concentraciones séricas y urinarias de catecolaminas son normales, lo que contradice el concepto de aumento de la actividad simpática per se, y lo que ocurre es un incremento en la sensibilidad de los receptores beta-adrenérgicos. Finalmente, otro mecanismo que desempeña un papel en la patogenia es un incremento en las respuestas de las celulas efectoras a las hormonas tiroideas, siendo relevante en pacientes con hipoxemia, acidosis metabólica o infección. En estos pacientes, el desacople en el proceso de fosforilación oxidativa, que conduce normalmente a la producción de trifosfato de adenosina, da lugar a una utilización excesiva de este sustrato, y en consecuencia aumenta el consumo de oxígeno y altera la termogénesis conduciendo a la hipertermia9.
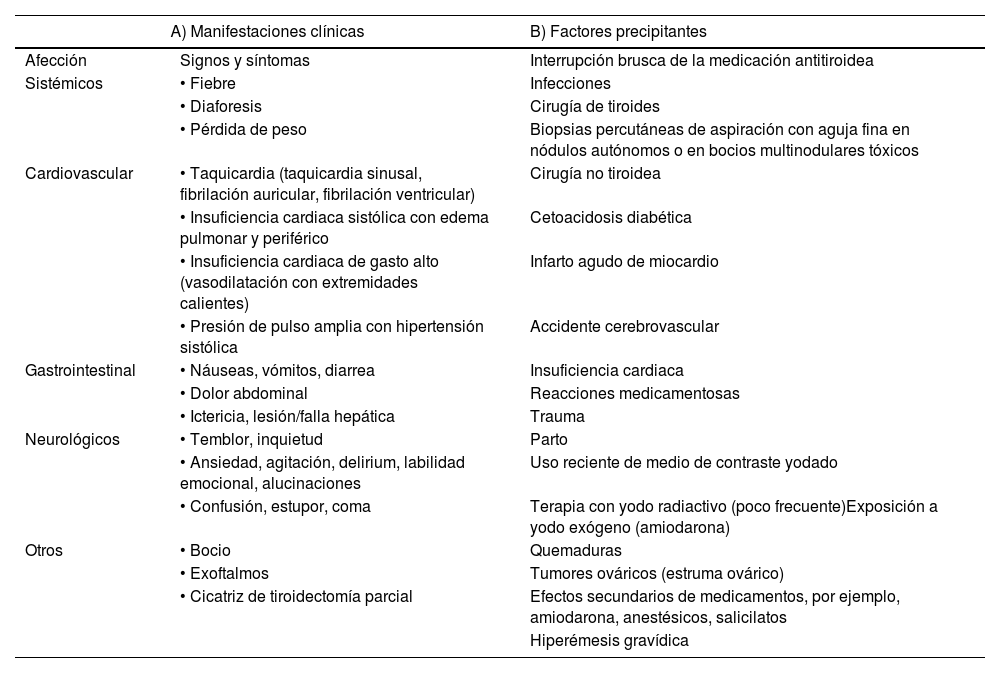
Manifestaciones clínicas y factores precipitantesA nivel del sistema cardiovascular, se presenta taquicardia sinusal u otra taquiarritmia, hipertensión arterial e insuficiencia cardiaca (IC) de alto gasto. Pero también puede manifestarse con colapso cardiovascular o choque con perfil hiperdinámico10–13. Otra manifestación cardiovascular frecuente es la fibrilación auricular de respuesta ventricular rápida, y una vez presente nos lleva a sospechar un cuadro de TT11–13. De la misma manera podemos evidenciar un bocio tiroideo, proptosis ocular bilateral, y temblor como manifestaciones de una enfermedad de Graves7,10. La hipertermia, ictericia y síntomas neuropsiquiátricos (temblor, ansiedad, delirium y cuadros psicóticos) son consecuencia del metabolismo acelerado12. Otros hallazgos de importancia se describen en la tabla 1. Las infecciones y/o el abandono del tratamiento son los desencadenantes más frecuentes en una TT, por lo que es crucial identificar el factor desencadenante y tratarlo, sin embargo, algunas veces el factor desencadenante no se encuentra en el 25-43% de los casos12–16. Otros factores precipitantes determinados en la literatura se describen en la tabla 1.
Manifestaciones clínicas y factores precipitantes en tormenta tiroidea
| A) Manifestaciones clínicas | B) Factores precipitantes | |
|---|---|---|
| Afección | Signos y síntomas | Interrupción brusca de la medicación antitiroidea |
| Sistémicos | • Fiebre | Infecciones |
| • Diaforesis | Cirugía de tiroides | |
| • Pérdida de peso | Biopsias percutáneas de aspiración con aguja fina en nódulos autónomos o en bocios multinodulares tóxicos | |
| Cardiovascular | • Taquicardia (taquicardia sinusal, fibrilación auricular, fibrilación ventricular) | Cirugía no tiroidea |
| • Insuficiencia cardiaca sistólica con edema pulmonar y periférico | Cetoacidosis diabética | |
| • Insuficiencia cardiaca de gasto alto (vasodilatación con extremidades calientes) | Infarto agudo de miocardio | |
| • Presión de pulso amplia con hipertensión sistólica | Accidente cerebrovascular | |
| Gastrointestinal | • Náuseas, vómitos, diarrea | Insuficiencia cardiaca |
| • Dolor abdominal | Reacciones medicamentosas | |
| • Ictericia, lesión/falla hepática | Trauma | |
| Neurológicos | • Temblor, inquietud | Parto |
| • Ansiedad, agitación, delirium, labilidad emocional, alucinaciones | Uso reciente de medio de contraste yodado | |
| • Confusión, estupor, coma | Terapia con yodo radiactivo (poco frecuente)Exposición a yodo exógeno (amiodarona) | |
| Otros | • Bocio | Quemaduras |
| • Exoftalmos | Tumores ováricos (estruma ovárico) | |
| • Cicatriz de tiroidectomía parcial | Efectos secundarios de medicamentos, por ejemplo, amiodarona, anestésicos, salicilatos | |
| Hiperémesis gravídica | ||
El diagnóstico de una TT puede ser complejo en el paciente críticamente enfermo, puesto que se ha descrito que uno de cada dos pacientes no tenía diagnóstico previo de tirotoxicosis17. A la hora de identificar qué pacientes tienen una mayor probabilidad de cursar con una TT, se proponen los puntajes BWS, desarrollados en el año 1993, y los generados por la Asociación Japonesa de Tiroides en el año 20124,7,11,12. Al evaluar la utilidad diagnóstica de estas herramientas clínicas, el puntaje BWS mostró una sensibilidad del 100% y una especificidad del 50%, logrando así identificar casos verdaderos de TT, pero su baja especificidad puede resultar en una alta tasa de falsos positivos18. Los criterios de la Asociación Japonesa de Tiroides arrojaron una sensibilidad y especificidad del 75% y 90%, respectivamente, con la limitación de no identificar presentaciones leves o atípicas de la enfermedad18. En conclusión, estos sistemas de puntuación proporcionan una herramienta para evaluar la gravedad y diagnóstico probable de TT. No obstante, se deben tener en cuenta sus ventajas y limitaciones. Por lo tanto, el juicio clínico junto con estas herramientas garantizan un diagnóstico preciso y un tratamiento adecuado12,19.
Con referencia a las pruebas tiroideas, no es necesario esperar los resultados para iniciar el tratamiento en un paciente con criterios clínicos de TT. Generalmente, los pacientes con esta condición clínica tendrán niveles elevados de T4 libre y/o T3 libre, con bajos niveles de TSH11,12,18. En la tabla 2 se describen los criterios diagnósticos.
Criterios diagnósticos en tormenta tiroidea
| A) Burch-Wartofsky | B) Asociación Japonesa de Tiroides/Sociedad Endocrina de Japón | |||
|---|---|---|---|---|
| Criterio | Puntos | Prerrequisito para el diagnóstico | ||
| Temperatura °C | Presencia de tirotoxicosis con niveles elevados de triyodotironina libre (FT3) o tiroxina libre (FT4) | |||
| 37,2-37,7 | 5 | Síntomasa | ||
| 37,8-38,3 | 10 | 1. Manifestaciones del SNC: inquietud, delirio, aberración mental/psicosis, somnolencia/letargo, coma (≤14 en la Escala de Coma de Glasgow) | ||
| 38,4-38,8 | 15 | |||
| 38,9-39,3 | 20 | 2. Fiebre: ≥38˚C | ||
| 39,4-39,9 | 25 | 3. Taquicardia: ≥130 latidos por minuto o frecuencia cardiaca ≥130 latidos por minuto en fibrilación auricular | ||
| >40 | 30 | |||
| Cardiovascular | 4. ICC: Edema pulmonar o ≥ clase III según la clasificación de Killip, shock cardiogénico o clase IV según la clasificación de Killip | |||
| FC: 90-109 latidos/minuto | 5 | |||
| FC: 110-119 latidos/minuto | 10 | 5. Manifestaciones gastrointestinales/hepáticas: náuseas, vómitos, diarrea o un nivel de bilirrubina total ≥3,0mg/dL | ||
| FC: 120-129 latidos/minuto | 15 | |||
| FC: 130-139 latidos/minuto | 20 | Diagnóstico | ||
| FC: >140 latidos/minuto | 25 | Grados TT | Combinación de características | Requisitos para el diagnóstico |
| Fibrilación auricular | TT1 | Primera combinación | Tirotoxicosis y al menos una manifestación del sistema nervioso central y fiebre, taquicardia, insuficiencia cardiaca congestiva o manifestaciones gastrointestinales o hepáticas | |
| Ausente | 0 | |||
| Presente | 10 | |||
| Insuficiencia cardiaca congestiva | ||||
| Ausente | 0 | |||
| Leve | 5 | |||
| Moderada | 10 | |||
| Severa | 15 | TT1 | Combinación alterna | Tirotoxicosis y al menos 3 combinaciones de fiebre, taquicardia, insuficiencia cardiaca congestiva o manifestaciones gastrointestinales o hepáticas |
| Disfunción gastro-hepática | ||||
| Ausente | 0 | |||
| Moderada (diarrea, dolor abdominal, náuseas/vómitos) | 10 | |||
| Severa (ictericia) | 20 | TT2 | Primera combinación | Tirotoxicosis y una combinaciónde 2 de los siguientes: fiebre, taquicardia, insuficiencia cardiaca congestiva o manifestaciones gastrointestinales o hepáticas |
| Alteraciones del sistema nervioso central | ||||
| Ausente | 0 | |||
| Leve (agitación) | 10 | |||
| Moderado (letargia, delirium, psicosis) | 20 | |||
| Severa (convulsiones, coma) | 30 | TT2 | Combinación alterna | Pacientes que cumplieron con el diagnóstico de TS1 excepto que el nivel sérico de FT3 o FT4 no está disponible |
| Evento precipitante | ||||
| Ausente | 0 | |||
| Presente | 10 | |||
| Interpretación | ||||
| Tormenta tiroidea | Mayor o igual a 45 puntos | TT1 | Define tormenta tiroidea | |
| Tormenta inminente | Entre 25 y 44 puntos | TT2 | Sospecha de tormenta tiroidea | |
| Tormenta poco probable | Menor de 25 puntos | |||
FT3: triyodotironina libre; FT4: tiroxina libre; ICC: insuficiencia cardiaca congestiva; SNC: sistema nervioso central; TT: tormenta tiroidea.
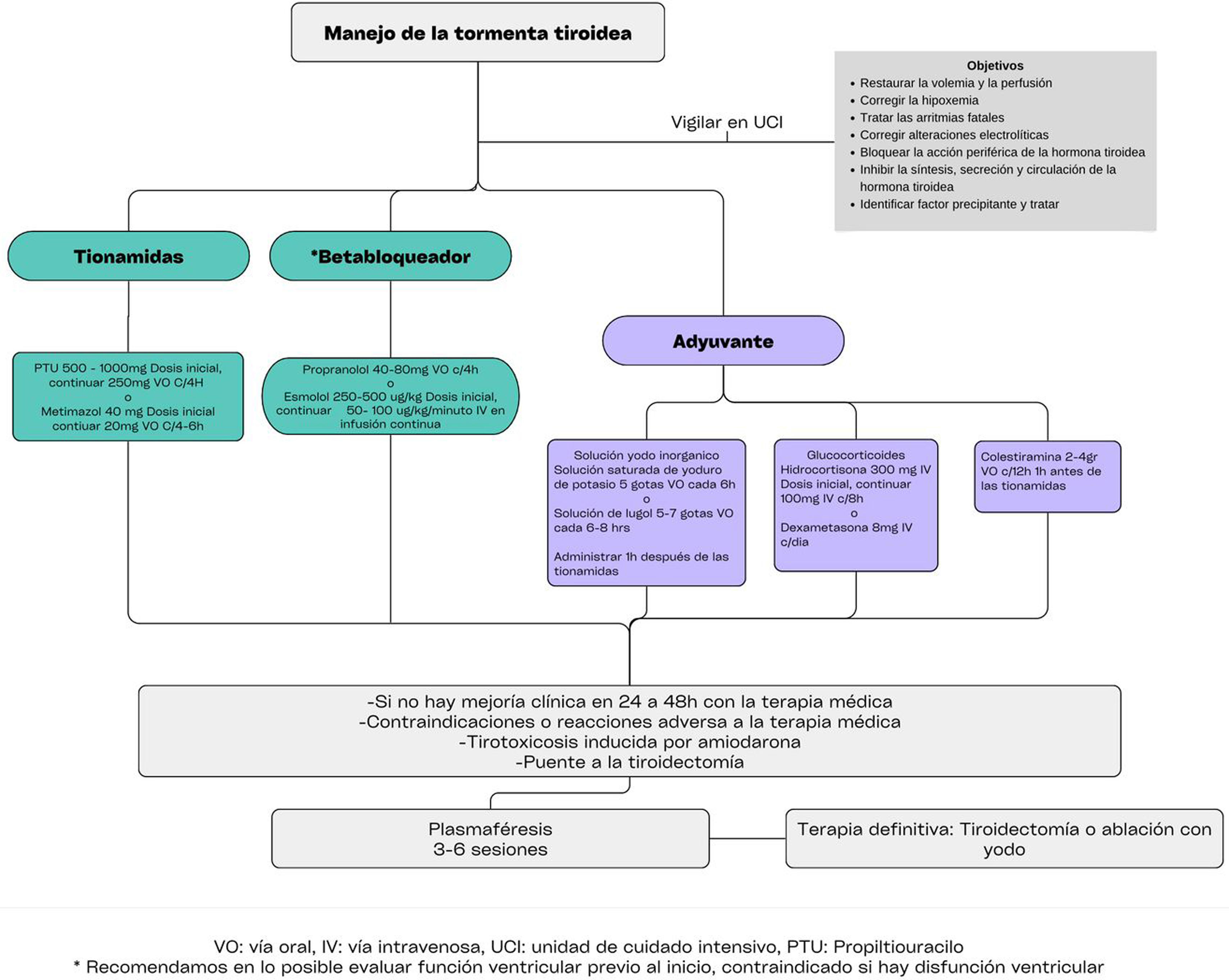
Ante la sospecha diagnóstica apoyada en el juicio clínico y las herramientas clínicas previamente descritas, el tratamiento debe iniciarse inmediatamente. La importancia de un tratamiento temprano mejora significativamente el pronóstico del paciente reduciendo la mortalidad y acelerando la recuperación al controlar los niveles hormonales y estabilizar el metabolismo evitando complicaciones graves, como insuficiencia cardiaca grave, shock cardiogénico, arritmias cardiacas fatales, convulsiones y disfunción multiorgánica, que pueden ser fatales si no se abordan rápidamente18,20–23. El tratamiento de los pacientes con TT se fundamenta en los siguientes pilares: el tratamiento se inicia con medidas de soporte general y monitoreo en cuidado intensivo con el fin de corregir la hipovolemia, hipoxemia, inestabilidad hemodinámica, disfunción cardiaca y alteraciones electrolíticas. Administrar un fármaco antitiroideo para disminuir la producción y secreción tiroidea de T4 y T3. Contrarrestar los efectos tisulares de las altas concentraciones séricas de T4 y T3. Remoción mediante plasmaféresis o la intervención quirúrgica como terapia definitiva. Finalmente, cualquier enfermedad o factor precipitante debe tratarse adecuadamente18,20–23. A continuación especificamos cada una de las intervenciones mencionadas.
Soporte y cuidados generalesEstas medidas se dirigen principalmente a estabilizar las manifestaciones clínicas generadas por la circulación excesiva de hormona tiroidea, realizando un monitoreo regular de los signos vitales, niveles hormonales y sintomas clínicos.
El oxígeno suplementario e incluso el soporte ventilatorio puede ser necesario cuando hay compromiso respiratorio generado por la hipoxemia. Hemodinamicamente los pacientes pueden presentarse con depleción del volumen intravascular, donde los cristaloides intravenosos ayudan a corregir la volemia pero con una estricta vigilancia del balance hídrico para evitar sobrecarga de volumen o descompensación de una insuficiencia cardiaca preexistente7,24. En este punto los vasopresores y los inotrópicos están restringidos por la sensibilidad del paciente a estos fármacos y su frágil estado vascular, pero si no hay respuesta a la reposición con líquidos o coexiste un estado de choque séptico o cardiogénico, se volverían indispensables para manejar la hipoperfusión6. Para el manejo de la fiebre se incluyen los antipiréticos, tipo acetaminofén, junto con técnicas de enfriamiento (mantas térmicas), dado que los antiinflamatorios no esteroideos y salicilatos aumentan los niveles séricos de hormona tiroidea libre, motivo por el cual se contraindican para el manejo de la fiebre20,21,25-27.
Para el manejo de los síntomas neuropsiquiátricos, como el delirio o la psicosis, el tratamiento de primera línea es el uso de los antipsicóticos de segunda generación, como la olanzapina y la risperidona. Informes clínicos han mostrado un aumento en el desarrollo de TT con el uso de haloperidol21,24,27.
Cuando se presenta un episodio convulsivo, las benzodiazepinas son los agentes de primera línea. Se recomienda el fenobarbital o fenitoína si las convulsiones persisten después de dosis repetidas de benzodiazepinas21,24.
La protección gástrica con inhibidores de la bomba de protones y la profilaxis farmacológica con heparinas también son necesarias6,21,22,28–30. Por último, algunas sociedades apoyan el uso de multivitaminas, especialmente tiamina, debido a las posibles deficiencias, sumado a un adecuado soporte nutricional6,21,22,28–30.
Estrategia farmacológica específicaLos antitiroideos del grupo de las tionamidas inhiben la acción de la peroxidasa tiroidea, enzima que participa en la síntesis de hormonas tiroideas1. Entre los fármacos encontramos el propiltiouracilo (PTU) y el metimazol (MM). El carbimazol, un precursor del MM, está disponible solo en Europa y Asia10. En las recomendaciones generadas por la Asociación Americana de Tiroides en el año 2016 prefieren el uso de PTU sobre el MM, por el beneficio adicional de disminuir la conversión periférica de T4 a T3, y así mayormente reducir los niveles de T3 en un menor tiempo28,31. Sin embargo, los estudios clínicos no han demostrado entre las tionamidas diferencias en su eficacia clínica al tratar esta condición5,32–34. Referente a los eventos adversos entre el PTU y MM, un estudio multicéntrico reveló que ambas intervenciones son seguras sin diferencias significativas33, al contrario de un estudio japonés que demostró una mayor incidencia de eventos adversos con PTU al compararlo con MM35. Por ello, la Sociedad Japonesa recomienda como primera línea el MM, dado su menor riesgo de efectos adversos34. Los principales efectos adversos descritos incluyen la agranulocitosis, hepatotoxicidad, vasculitis ANCA positivo, reacciones cutáneas, artralgias, malestar gastrointestinal, alteración del gusto, sialoadenitis y linfadenopatías2,37.
Concerniente a los pacientes que tienen contraindicación para recibir vía oral las tionamidas, y la falta de disponibilidad de presentaciones endovenosas en algunos países, una solución a lo anterior es la administración mediante una sonda orogástrica o nasogástrica, al igual que el uso de preparaciones por vía rectal25,36. Para el PTU la dosis establecida vía rectal es de 400 a 600mg cada 6h, en forma de enema de retención o supositorio, de igual modo MM a una dosis de 20 a 40mg cada 6h24.
Estrategia farmacológica adyuvanteLas soluciones de yoduro inorgánico (solución Lugol o saturada de yoduro de potasio) inhiben la liberación de hormonas tiroideas preformadas, y de esta forma interfieren con la síntesis de nuevas hormonas. El uso concomitante de soluciones de yoduro junto con las tionamidas potencian la inhibición en la liberación de hormonas preformadas a través del efecto Wolff-Chaikoff al inhibir la liberación proteolítica de la yodotironina y de la tiroglobulina1,6,27. Por esta razón, se realizaron dos estudios prospectivos en Japón, donde el grupo de intervención (soluciones de yoduro junto a las tionamidas) experimentó una disminución significativamente más rápida de las hormonas tiroideas7,38,39.
Al administrar la solución de yoduro inorgánico se recomienda realizarlo una hora después de la administración de las tionamidas, ya que la administración de yodo proporcionará un sustrato adicional para una mayor producción de hormonas y un aumento de las reservas dentro de la glándula (efecto Jod-Basedow), agravando así la TT1,24,25,27. Aunque el yodo suele ser bien tolerado, hay reportes de lesiones y hemorragias locales en la mucosa esofágica o duodenal tras la administración oral de la solución de Lugol (dosis máxima: 960mg de yodo al día)40–42.
Una alternativa terapéutica para pacientes que presentan contraindicaciones a las tionamidas y/o efectos secundarios al yodo es el carbonato de litio, ayudando a inhibir la liberación de hormonas tiroideas, pero debido a su estrecho margen terapéutico y perfil de efectos secundarios se debe monitorear los niveles séricos de litio, manteniéndolos entre 0,9 y 1,2mEq/L para evitar la toxicidad renal y neurológica1,2,6,24,25,27,38,42.
Otro aspecto en la patogenia de la TT que se atribuye al exceso de hormonas tiroideas es el incremento en la sensibilidad y la respuesta de los receptores beta-adrenérgicos; por ende, bloquear estos receptores formaría parte del tratamiento. A causa de lo antes mencionado se evaluó el uso de beta-bloqueadores (BB) en diferentes ensayos clínicos, demostrando un beneficio en el control de los síntomas como la taquicardia, hipertensión arterial, arritmias cardiacas, agitación, psicosis, temblor, diarrea y mejora de la calidad de vida6,28,32,43.
El BB de elección por mucho tiempo ha sido el propranolol debido a su capacidad para disminuir la conversión periférica de T4 a T3 y controlar los sintomas mencionados6,20,28,32,43.
Sin embargo, dado el alto riesgo de progresión a insuficiencia cardiaca y compromiso severo de la función ventricular en la fase aguda de una TT, se prefiere el uso de un BB de acción corta como el esmolol (vida media de 9 minutos) administrado por vía intravenosa en lugar de un BB de vida media larga, ya que permite suspenderse en caso de presentarse compromiso de la función ventricular. Por eso la importancia de realizar un ecocardiograma con el objetivo de evaluar la función ventricular antes de administrar el BB, con la finalidad de prevenir una progresión a shock cardiogénico e insuficiencia cardiaca6,21,27,34. Otros BB disponibles son el atenolol, bisoprolol y metoprolol22,27.
Otra de las estrategias farmacológicas adyuvantes son los glucocorticoides que se usan con el objetivo de disminuir la conversión periférica de las hormonas tiroideas de T4 a T3, así como de prevenir la insuficiencia suprarrenal relativa debido a la incapacidad de las glándulas suprarrenales de satisfacer la demanda metabólica aumentada durante la TT21,24,44,45. La hidrocortisona es el esteroide de primera línea, aunque la dexametasona puede ser utilizada como una alternativa. Al iniciar los esteroides, es preciso anotar que no se deben suspender abruptamente una vez se haya confirmado la recuperación de la función suprarrenal, por lo que se recomienda reducirse gradualmente y luego suspenderse6,13,21,24,46.
Por último, tenemos los fármacos como la colestiramina que aceleran la eliminación de las hormonas tiroideas de la circulación a un ritmo mayor que el que ocurre a través del metabolismo, además de interferir también con la reabsorción enterohepática y el reciclaje de las hormonas tiroideas6,20,24,47. Un ensayo clínico evaluó su eficacia en pacientes con TT, demostrando una disminución más rápida de los niveles de hormonas tiroideas en el grupo tratado con colestiramina, y un mayor beneficio al inicio del cuadro clínico47,48.
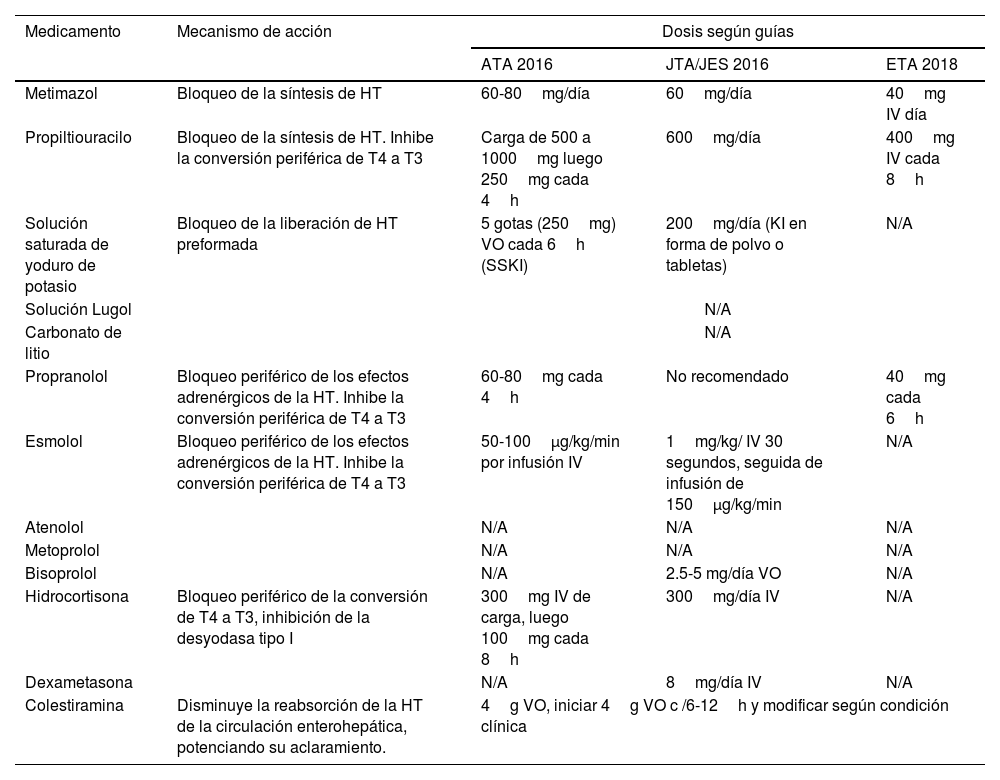
En la tabla 3 se especifica los mecanismos de acción y las dosis sugeridas por las sociedades científicas.
Fármacos en tormenta tiroidea
| Medicamento | Mecanismo de acción | Dosis según guías | ||
|---|---|---|---|---|
| ATA 2016 | JTA/JES 2016 | ETA 2018 | ||
| Metimazol | Bloqueo de la síntesis de HT | 60-80mg/día | 60mg/día | 40mg IV día |
| Propiltiouracilo | Bloqueo de la síntesis de HT. Inhibe la conversión periférica de T4 a T3 | Carga de 500 a 1000mg luego 250mg cada 4h | 600mg/día | 400mg IV cada 8h |
| Solución saturada de yoduro de potasio | Bloqueo de la liberación de HT preformada | 5 gotas (250mg) VO cada 6h (SSKI) | 200mg/día (KI en forma de polvo o tabletas) | N/A |
| Solución Lugol | N/A | |||
| Carbonato de litio | N/A | |||
| Propranolol | Bloqueo periférico de los efectos adrenérgicos de la HT. Inhibe la conversión periférica de T4 a T3 | 60-80mg cada 4h | No recomendado | 40mg cada 6h |
| Esmolol | Bloqueo periférico de los efectos adrenérgicos de la HT. Inhibe la conversión periférica de T4 a T3 | 50-100μg/kg/min por infusión IV | 1mg/kg/ IV 30 segundos, seguida de infusión de 150μg/kg/min | N/A |
| Atenolol | N/A | N/A | N/A | |
| Metoprolol | N/A | N/A | N/A | |
| Bisoprolol | N/A | 2.5-5 mg/día VO | N/A | |
| Hidrocortisona | Bloqueo periférico de la conversión de T4 a T3, inhibición de la desyodasa tipo I | 300mg IV de carga, luego 100mg cada 8h | 300mg/día IV | N/A |
| Dexametasona | N/A | 8mg/día IV | N/A | |
| Colestiramina | Disminuye la reabsorción de la HT de la circulación enterohepática, potenciando su aclaramiento. | 4g VO, iniciar 4g VO c /6-12h y modificar según condición clínica | ||
ATA: Asociación Americana de Tiroides; EPOC: enfermedad pulmonar obstructiva crónica; ETA: Asociación Europea de Tiroides; HT: hormona tiroidea; ICC: insuficiencia cardiaca congestiva; IV: intravenoso; JTA/JES: Asociación Japonesa de Tiroides/Sociedad Japonesa de Endocrinología; SSKI: solución saturada de yoduro de potasio; T4: tiroxina; T3: triyodotironina; N/A: no aplica; VO: vía oral.
Cuando las estrategias farmacológicas antes mencionadas no logran mejorar el estado clínico del paciente, o cuando estas modalidades de tratamiento están contraindicadas, se ha implementado el uso de plasmaféresis como una alternativa terapéutica41,49. La plasmaféresis se ha utilizado en diferentes estudios observacionales. El primero de ellos es un estudio retrospectivo de 46 pacientes durante un episodio de TT, quienes recibieron 4 sesiones de plasmaféresis, y cuyos resultados mostraron una reducción significativa de los niveles de hormonas tiroideas, 45% en los niveles de T4 y 60% en los niveles de T350,51. Asimismo, otro estudio retrospectivo multicéntrico realizado en Colombia evaluó a 19 pacientes, demostrando que 4 sesiones resultaron en una reducción significativa de las hormonas tiroideas, y sin eventos adversos asociados52. Por ende, las recomendaciones de la Sociedad Japonesa en el 2016 consideran el inicio de la plasmaféresis en pacientes que no muestran mejoría clínica dentro de las 24 a 48h posteriores al tratamiento inicial1,2. Otra indicación de la plasmaféresis es como terapia puente para pacientes con tratamiento definitivo de emergencia (tiroidectomía) o en la tirotoxicosis inducida por amiodarona2,53,54.
En la tabla 4 presentamos los estudios clínicos que evalúan las intervenciones terapéuticas en TT.
Estudios clínicos en tormenta tiroidea
| Titulo | Tipo | Autores | Población/intervención | Conclusión |
|---|---|---|---|---|
| Estudio prospectivo multicéntrico basado en registros sobre la tormenta tiroidea: directrices para el tratamiento de Japón32 | Estudio multicéntrico prospectivo. Mayo/2018 - abril de 2022 | Furukawa et al. | 110 pacientes con TT de 52 hospitales; 93 casos definitivos y 17 casos sospechosos-ATD: 105 pacientes (MM solo: 101; PTU solo: 3; MM y PTU: 1)-Yoduro inorgánico 108 pacientes82 lo recibieron dentro de 1 hora después de la administración de ATD21 pacientes a más de 1 hora después de la administración de ATD-GC: 99 pacientes (21 recibieron dosis insuficiente)-BB: 102 pacientes, IV: 55 pacientes; BB selectivos a 91 pacientes | - MM se administró como un ATD único a la mayoría de los pacientes (101 de 105), la tasa de mortalidad no aumentó- La administración temprana de KI se asoció con menor mortalidad en comparación con la administración tardía- Pacientes que recibieron dosis insuficientes de GC tuvieron peor pronóstico que los que recibieron dosis suficientes- Uso preferencial de BB IV y BB selectivos podría haber contribuido a un mejor pronóstico- Los pacientes para quienes se siguieron las pautas de tratamiento de JTA y JES tendieron a tener tasas de mortalidad más bajas que los pacientes para quienes no se siguieron las pautas |
| Comparación de propiltiouracilo frente a metimazol para la tormenta tiroidea en pacientes críticamente enfermos33 | Estudio de cohorte retrospectivo, multicéntrico. 1 de enero de 2016 y el 31 de diciembre de 2020 | Lee et al. | 1383 pacientes ingresados en UCI o UCE con diagnóstico de TT:656 tratados con PTU727 tratados con MMDosis diaria total media: 600mg para PTU y 40mg para MM. Se utilizó KI en el 41,3% del grupo de PTU y en el 26,0% del grupo de MM | No se encontraron diferencias en el resultado compuesto de la mortalidad o el alta hospitalaria, la mortalidad hospitalaria sola, la duración del soporte de órganos o los costos totales de hospitalización, y solo una pequeña disminución en los costos específicos de ATD en los tratados con MM |
| Factores asociados con la mortalidad de la tormenta tiroidea: análisis utilizando una base de datos nacional para pacientes hospitalizados en Japón5 | Estudio observacional analítico retrospectivo. 01/abril/ 2011 - 31/marzo/2014 | Ono et al. | Base de datos nacional de pacientes hospitalizados en Japón: 1324 pacientes diagnosticados con TTMM solo: 879 pacientesMM y PTU: 88 pacientesPTU solo: 77 pacientes | Los pacientes con TT tuvieron más probabilidades de ser tratados con MM£ que con PTULos tratados con MM mostraron mortalidad más baja en comparación con los tratados con PTU solaLa mortalidad intrahospitalaria no se asoció de manera significativa con la variación en el tratamiento con ATDAsociación significativa con la mortalidad intrahospitalaria: No uso ATD, BB, necesidad de VM, hemodiafiltración, contra choque, bombeo intraaórtico con balón y ECMO |
| Tratamiento y manejo de la tormenta tiroidea: análisis de las encuestas a nivel nacional34 | Estudio observacional analítico retrospectivo2004 y 2008 | Isozaki et al. | 356 pacientes con TT, datos reportados por las encuestas nacionales realizadas en JapónMM solo: 276 pacientes (85,4%)PTU solo: 45 pacientes (13,9%)MM y PTU: 2 pacientes (0,6%)Sin ATD: 33 pacientes | No diferencias significativas en la mortalidad y/o gravedad entre grupos tratados con MM vs PTUTratamiento con yoduro inorgánico no mostró diferenciasLos tratados con GC mostraron una mayor gravedad de la enfermedad y mortalidadNo hubo diferencias significativas en la mortalidad entre el uso de BB endovenosos vs. oralesLa mortalidad fue significativamente mayor en los pacientes tratados con BB no selectivos en comparación con otros tipos de BB |
| Tormenta tiroidea en la UCI: un estudio multicéntrico retrospectivo23 | Estudio retrospectivo, multicéntrico2000 y 2017 | Bourcier et al. | 92 pacientes hospitalizados en 31 UCI fueron incluidos en el estudioCombinación de fármacos ATD, BB, GC, KI o plasmaféresis8 pacientes (9%) fueron tiroidectomizados | Los no supervivientes en UCI requirieron con mayor frecuencia vasopresores, ECMO, TRR, VM y/o plasmaféresis terapéuticaLos supervivientes de la UCI recibieron BB con mayor frecuencia |
| Triyodotironina y tiroxina en el hipertiroidismo. Comparación de los cambios agudos durante la terapia con agentes antitiroideos31 | Estudio clínico experimental aleatorio con análisis observacional descriptivo | Abuid y Larsen | Fase Observacional: 66 pacientes con hipertiroidismo no tratadoFase experimental:A. 9 pacientes durante el tratamiento con PTU (3), MM (3) o yoduro solo (3)B. PTU + yoduro (11) y MM + yoduro (8) | Fase observacional: Sobreproducción relativa de T3 de forma consistente en pacientes con hipertiroidismoFase experimental:A. La disminución aguda en suero los primeros 5 días fue mayor en el grupo tratado con yoduro y PTU solos que la observada en el grupo tratado con MMB. Las concentraciones iniciales de T3 en suero no fueron diferentes en los grupos de PTU y MM, las concentraciones de T3 en los pacientes con PTU fueron significativamente más bajas en los días 1 y 2 y durante el período de meseta aparente en los días 3-5. Los valores de T4 no fueron significativamente diferentes en ningún momento |
| Comparación de metimazol y propiltiouracilo en pacientes con hipertiroidismo causado por la enfermedad de Graves35 | Ensayo prospectivo abierto aleatorizado. octubre de 2003 y julio de 2004 | Nakamura et al. | 303 pacientes con enfermedad de Graves no tratada atendidos en 4 hospitales de Japón. Aleatorizados en 3 gruposMM 30mg/d en dos dosis divididas (n=98)PTU 300mg/d en tres dosis divididas (n=81)MM 15mg/d en una dosis única (n=124) | El tratamiento con MM 30mg/d es superior en la efectividad sobre el PTU 300mg/d y la MM 15mg/d, especialmente para los pacientes con hipertiroidismo graveEfectos adversos: leves en el 52% de los pacientes tratados con PTU, 30% con MMI 30mg/d y el 13,9% en MM 15mg/d |
| Efectos a corto plazo de los antagonistas β-adrenérgicos y el metimazol en la tirotoxicosis de nueva aparición causada por la enfermedad de Graves43 | Ensayo controlado aleatorizado | Tagami et al. | 28 pacientes con EG leve se aleatorizaron 1:1 para recibir:MM con BBMM sin BB | No hubo diferencias significativas en la mejoría de la función tiroidea entre los dos grupos. En el grupo tratado con BB mejoró significativamente la taquicardia, síntomas como la fatiga fácil y la dificultad para respirar, asi como el funcionamiento físico |
| Efectos opuestos de la dexametasona sobre las concentraciones séricas de 3,3’,5’-triyodotironina (T3 reversa (rT3)) y 3,3’5-triyodotironina (T3)44. Se observó un aumento de rT3 y una disminución considerable de T3, permaneció disminuida durante todo el tiempo estudiado, al menos 4 días después de suspender el esteroide.La T4 sérica disminuyó en los casos de enfermedad de Graves. | Ensayo clínico experimental controlado | Chopra et al. | Dexametasona, 2mg cada 6h durante 4 dosis:4 pacientes con hipotiroidismo en tratamiento con tiroxina sintética (T4)8 pacientes con hipertiroidismo por EG no tratados | Se observó un aumento de rT3 y una disminución considerable de T3, permaneció disminuida durante todo el tiempo estudiado, al menos 4 días después de suspender el esteroideLa T4 sérica disminuyó en los casos de enfermedad de Graves |
| Efectos agudos de los corticosteroides sobre la actividad tiroidea en la enfermedad de Graves45 | Ensayo clínico experimental controlado | Williams et al. | 7 pacientes con EG no tratada; 6 sujetos sanos: dexametasona (2mg por vía oral cada 6h durante 4 dosis) | La T3, la T4 y la Tg séricas cayeron por debajo de los valores basales dentro de las 24 a 48h después de la primera dosis de dexametasona en pacientes con hipertiroidismo. En sujetos sanos la T3 sérica disminuyó transitoriamente en un grado mucho menor que en los pacientes con hipertiroidismo; la T4 y Tg no mostraron cambios significativos |
| Dosis bajas de colestiramina en el tratamiento del hipertiroidismo48 | Ensayo prospectivo, aleatorizado, doble ciego y controlado con placebo | Kaykhaei et al. | 45 pacientes con EG recién diagnosticada aleatorizados a los siguientes grupos:Grupo I: colestiramina 2g dos veces al día, MM y propranololGrupo II: colestiramina 1g dos veces al día, MM y propranololGrupo III: placebo en polvo, MM y propranolol. Se utilizó la dosis fija de MMI (30mg/d) y propranolol (40mg/d). El período de estudio fue de 4 semanas | Los niveles séricos de hormonas tiroideas disminuyeron más rápidamente y en mayor medida en los grupos tratados con colestiramina. Todos los pacientes del grupo I habían alcanzado el estado eutiroideo al final del estudio |
| Terapia complementaria con colestiramina para la tirotoxicosis47 | Ensayo clínico cruzado doble ciego controlado con placebo | Solomon et al. | 15 pacientes con tirotoxicosis. Tratamiento inicial durante 2 semanas (Fase 1), 1 semana sin tratamiento, luego pasaron al tratamiento opuesto durante 2 semanas (Fase 2)El tratamiento estándar incluyó atenolol 50mg/día, MM en dosis individualizada y 4g de colestiramina o 4g de placebo en polvo 4 veces al día | Fase 1: 7 pacientes recibieron colestiramina y 8 pacientes recibieron placebo. Se observó una disminución más rápida en todos los niveles de hormonas tiroideas en el grupo tratado con colestiraminaFase 2: los 8 pacientes que recibieron colestiramina mostraron una disminución adicional de la T4L entre las semanas 1 y 2, la tasa general de disminución de los niveles de HT no fue diferente entre los grupos |
| Plasmaféresis terapéutica para el tratamiento de la tirotoxicosis: un estudio multicéntrico retrospectivo52 | Estudio retrospectivo multicéntrico. 2012-2020 | Builes-Montaño et al. | 19 pacientes con tirotoxicosis en dos centros especializados de Colombia | Una mediana de 4 sesiones condujo a una reducción significativa en T4L (p=0,0001) y TT3 (p <0,0003) con una disminución no significativa en la dosis de BB (p=0,7353), sin cambios en las enzimas hepáticas y sin eventos adversos |
| Medicamentos antitiroideos y malformaciones congénitas: un estudio de cohorte coreano a nivel nacional55 | Estudio de cohorte retrospectivo. 2008 y 2014 | Seo et al. | 12.891 embarazos (0,45%) estuvieron expuestos a ATD durante el primer trimestre | La exposición a los ATD durante el primer trimestre se asoció con un mayor riesgo de malformaciones congénitas, en particular para los embarazos en los que las mujeres recibieron recetas de MM o de ambos ATD |
| Comparación de eficacia y efectos adversos entre metimazol 15mg + yodo inorgánico 38mg/día y metimazol 30mg/día como terapia inicial para pacientes con enfermedad de Graves con hipertiroidismo moderado a severo38 | Ensayo clínico controlado, prospectivo | Sato et al. | 310 pacientes con EG no tratada, se asignaron a uno de los dos regímenes:MM 15mg + yodo inorgánico a 38,2mg/día(M15+I)MM 30mg/día (M30) | El grupo M15+I logró una normalización más rápida de los niveles de T4 en comparación con el grupo M30. Los efectos adversos fueron significativamente más frecuentes en el grupo M30 en comparación con el grupo M15+I. Aunque la tasa de remisión fue ligeramente mayor en el grupo M15+I, la diferencia no alcanzó significación estadística |
ATD: antitiroideo; BB: β-bloqueadores; ECMO: membrana extracorpórea de oxigenación; EG: enfermedad de Graves; GC: glucocorticoide; HT: hormona tiroidea; IV: intravenoso; JES: Sociedad Japonesa de Endocrinología; JTA: Asociación Japonesa de Tiroides; KI: yoduro de potasio; MM: metimazol; M15+I: metimazol 15mg más yodo inorganico; PTU: propiltiouracilo; Tg: tiroglobulina; TRR: terapia de reemplazo renal; TT: tormenta tiroidea; TT3: triyodotironina total; T4L: tiroxina libre; UCE: unidad de cuidados intermedios; UCI: unidad de cuidados intensivos; VM: ventilación mecánica.
Dentro de las indicaciones de tiroidectomía durante un episodio de TT, se considera al paciente que es refractario al manejo médico. Otras indicaciones quirúrgicas, como la presencia de síntomas o signos de compresión en el cuello, un posible cáncer de tiroides coexistente, coexistencia de hiperparatiroidismo que requiera cirugía, bocio de gran tamaño (>80g), extensión subesternal o retroesternal, terapia con yodo radioactivo insuficiente o la necesidad de una corrección rápida del estado tirotóxico, serán consideradas en conjunto con el equipo quirurgico1,20,21,51–53,56. Ver el algoritmo de manejo en la figura 2.
EmbarazoEl plan de tratamiento durante el embarazo es similar al de los casos en mujeres no embarazadas; el tratamiento incluye opciones farmacológicas como tionamidas, BB, soluciones de yodo, esteroides y colestiramina19,57,58. La elección de las tionamidas depende del trimestre del embarazo19,24,57–60. Su potencial teratogénico durante el primer trimestre se demostró en una cohorte retrospectiva de 12.891 embarazos, donde el índice de malformaciones congénitas fue del 7,27%, y este riesgo fue mayor con el uso de MM. Por tal razón el MM es preferible en el segundo y tercer trimestre, mientras que el PTU se favorece en el primer trimestre55. Los BB durante el embarazo deben usarse con precaución debido al mayor riesgo de insuficiencia cardiaca congestiva propio de las gestantes, por lo cual evaluar la función ventricular es fundamental antes de iniciarlos58. En cuanto a los esteroides, se prefiere la hidrocortisona sobre la dexametasona, ya que esta última atraviesa la barrera uteroplacentaria20,61. La colestiramina puede interferir en la absorción de vitaminas, por lo que la suplementación prenatal puede no ser suficiente y debe valorarse si los beneficios superan los riesgos en el contexto de una TT57,59,61. La plasmaféresis es segura durante el embarazo, aunque su efecto sobre la coagulación pone en consideración inducir el parto 24h después de la última sesión57,59,61.
La cirugía durante el embarazo es una contraindicación relativa, sólo debe considerarse cuando es necesario un control rápido de las hormonas tiroideas y no es posible el uso de tionamidas20,59.
Conclusiones del caso clínicoEl caso clínico sugiere una TT, tiene un sistema de puntuación de BWS de 80 puntos (mayor o igual a 45 puntos define TT), del mismo modo cumple criterios para TT definitiva «TT1» según los criterios de la Asociación Japonesa de Tiroides. El factor precipitante fue el abandono del tratamiento, de igual forma se descartaron infecciones por los episodios febriles.
Como medidas de soporte inicial se abordó la deshidratación causada por la diarrea, utilizando cristaloides a una tasa de infusión que evitara la sobrecarga de fluidos. Con el objetivo de bloquear la síntesis tiroidea, iniciamos tionamidas (metimazol 20mg vía oral cada/6h) y solución de Lugol 7 gotas vía oral cada 8h, controlamos la frecuencia cardiaca y apoyo de suprarrenal con propranolol (40mg vía oral cada/6h) e hidrocortisona (100mg intravenoso cada/8h), respectivamente, descartando disfunción ventricular izquierda de acuerdo a parámetros ecocardiográficos ante el inicio del propranolol. Administramos colestiramina con el fin de inhibir la circulación hormonal (4g vía oral cada/12h) 1h antes del uso de tionamidas, como es recomendado. Tras el seguimiento hubo una buena respuesta al tratamiento, los síntomas neurológicos resolvieron, mejoró el sueño, se estabilizó la frecuencia cardiaca, cesaron los episodios de fiebre y la diarrea desapareció. Con la estabilidad clínica iniciamos un descenso gradual de los esteroides, ajustamos la dosis de propranolol de acuerdo a su frecuencia cardiaca (entre 70 y 100 latidos/minuto), y su T4L registró un valor de 1,4ng/dL (valor inicial 1,6ng/dL). Es importante mencionar que durante la fase aguda de una TT la terapia debe guiarse de acuerdo a la mejoría de los síntomas y los niveles de T4 y/o T3 dado que los niveles de TSH pueden permanecer suprimidos durante varias semanas antes de normalizar. Al egreso hospitalario se generó un plan ambulatorio para su seguimiento y tratamiento definitivo.
ConclusionesLa TT es una condición médica grave, potencialmente mortal, que se caracteriza por el daño a órganos y que emerge de un abandono de la medicación o un estrés médico/quirúrgico significativo. El sistema de puntuación Burch-Wartofsky y los criterios de la Asociación Japonesa de Tiroides son los más usados a la hora de establecer el diagnóstico de una TT. El tratamiento inicial incluye la supresión de la producción de hormonas tiroideas con tionamidas, y se complementa con soluciones de yoduro al inhibir temporalmente la función tiroidea. Los BB controlan los sintomas cardiovasculares, gastrointestinales, neuropsiquiátricos y bloquean la conversión de T4 a T3, asimismo como lo hacen los esteroides, además de que tratan la insuficiencia suprarrenal. La respuesta al tratamiento por lo general es inmediata, y si los síntomas persisten se debe considerar la plasmaféresis y/o la tiroidectomía.
FinanciaciónLos autores declaran no haber recibido ningún tipo de financiación para la elaboración de la presente revisión.
Conflicto de interesesLos autores declaran no tener ningún tipo de conflicto de intereses.