La sepsis es un trastorno que puede progresar al shock, con falla multiorgánica e incrementándose la mortalidad, por lo que el estudio de biomarcadores de inflamación pueden contribuir a prevenir dichas complicaciones.
ObjetivoEstablecer una asociación entre las concentraciones séricas de los biomarcadores lipopolisacárido (LPS) y factor diferenciador mieloide-88 (MyD88) con la sepsis bacteriana y el progreso a shock.
MétodosSe realizó un estudio analítico de corte trasversal, empleando una cohorte de pacientes adultos sépticos con etiología bacteriana gramnegativa y con progreso a shock, de cualquier género y condición socioeconómica, a los cuales se les establecieron las concentraciones séricas de los biomarcadores LPS y MyD88, mediante enzimoinmunoanálisis.
ResultadosLas concentraciones séricas del LPS en pacientes con shock séptico (n=50), resultaron media±desviación estándar (DE): 31,86±11,4 ng/mL; y los pacientes sépticos sin progreso a shock (n=75), resultaron 24,7±13,6 ng/mL (p=0,010); mientras que las halladas para el MyD88 en pacientes con shock séptico (n=50), fueron media±DE: 3.267,2±2.001,5 pg/mL y los pacientes sépticos sin progreso a shock (n=75) fueron 2.178,3±2.948,9 pg/mL (p=0,004).
ConclusiónSe obtuvo una asociación entre los niveles séricos de los biomarcadores LPS y MyD88, tanto en pacientes con sepsis bacteriana sin progreso a shock, como en los que progresaron a dicha condición.
Sepsis is a disorder that can progress to shock, with multiple organ failure and increased mortality, so the study of inflammation biomarkers can help prevent these complications.
ObjectiveEstablish an association between serum concentrations of the biomarkers LPS and MyD88 with bacterial sepsis and progression to shock.
MethodsA cross-sectional analytical study was carried out, using a cohort of septic adult patients with Gram-negative bacterial etiology and with progression to shock, of any gender and socioeconomic condition, in whom serum concentrations of the biomarkers LPS and MyD88 were established by enzyme immunoassay.
ResultsLPS serum concentrations in patients with septic shock (n=50) were mean±SD: 31.86±11.4 ng/mL; and septic patients without progress to shock (n=75), the results were 24.7±13.6 ng/mL (p=0.010).; while those found for MyD88 in patients with septic shock (n=50) were mean±SD: 3267.2±2001.5 pg/mL and septic patients without progression to shock (n=75) were 2178.3±2948.9 pg/mL (p=0.004).
ConclusionAn association was obtained between the serum levels of the biomarkers LPS and MyD88, both in patients with bacterial sepsis without progression to shock, and in those who progressed to this condition.
La incidencia global de sepsis intrahospitalaria y en la unidad de cuidado intensivo (UCI) es de 189 y 58 casos por 100.000 personas/año, respectivamente; mientras la letalidad alcanza 26,7% y 41,9%, respectivamente1. En el progreso a shock séptico, las células que presentan un incremento son los neutrófilos, linfocitos TCD4+, TCD8+, linfocitos B y asesinas naturales, igualmente las interleucinas inflamatorias, pero con disminución en las concentraciones séricas de inmunoglobulinas (IgA, IgG e IgM) y del complemento C3 y C42.
Al paciente se le categoriza como sepsis-2 cuando se define un sitio de infección sospechoso como foco de sepsis, sumado a dos o más criterios del síndrome de respuesta inflamatoria sistémica (SRIS); mientras que, cuando se evidencian al menos dos criterios, como presión arterial sistólica baja (≤100mmHg), frecuencia respiratoria alta (≥ 22 respiraciones por minuto), o alteración del estado de conciencia (Glasgow <15), se tipifica como sepsis-33.
Las alteraciones metabólicas son comunes durante la sepsis aguda, en la que los trastornos persistentes de componentes lipídicos perduran hasta dos años después de la remisión, pudiéndose asociar con alto riesgo arterioesclerótico4; en tanto que la falla multiorgánica evoluciona debido a la tormenta de citocinas, emanada de neutrófilos, macrófagos, mastocitos y células asesinas naturales5, provocando síntomas clínicos en pacientes críticos, pudiendo evolucionar a fatalidad6, siendo la IL-6 más fidedigna como biomarcador para poner de manifiesto dicha condición, incluso, en la sepsis temprana7. Existen en la actualidad, una gran variedad de biomarcadores de inflamación para sepsis, destacándose las vesículas extracelulares de macrófagos, plaquetas y granulocitos, debido a que aseguran un diagnóstico más fidedigno, a diferencia de los biomarcadores clásicos8; sin embargo, las concentraciones séricas de biomarcadores de inflamación exhiben mayor valor pronóstico en sepsis, como los valores de las puntuaciones entre el ingreso y segundo día en la UCI, comparados con cambios en la evaluación de fisiología y enfermedades agudas y crónicas II (APACHE-II) y las puntuaciones pronósticas mediante el empleo de la evaluación de la puntuación de insuficiencia orgánica secuencial (SOFA) o SOFA rápida (qSOFA)9, por ejemplo, se emplean biomarcadores novedosos que tienen una capacidad pronóstica de mortalidad a 30 días, en comparación con otros de uso tradicional10.
El lipopolisacárido (LPS) es una endotoxina ubicada en la membrana externa de bacterias gramnegativas, constituido de lípido A, oligosacárido central (OS), polisacárido específico O y antígeno O (OPS), es importante en la patogenia séptica y es transportado por la proteína de unión a LPS (LBP) e interactúa con CD14 soluble o de membrana11, también es un buen transductor de señales mediadas por el transductor de la señal y activador de la transcripción (JAK2-STAT) al interior de monocitos y macrófagos, aumentando abruptamente la síntesis de citocinas proinflamatorias12, generando hiperinflamación13, coadyuvando con el daño celular y multisistémico14, incluso, en concentraciones bajas de LPS, puede incrementar otras citocinas15. Durante la señalización, el LPS utiliza el factor diferenciador mieloide-88 (MyD88) como proteína adaptadora, y, unidas al receptor de tipo Toll 4 (TLR4), activan al factor de transcripción nuclear kappa beta (NF-κβ)16, por lo que la ausencia o reducción del LPS induce la caída de señales en células inflamatorias, resultando esto benéfico en pacientes sépticos17. Se ha demostrado que el hemocultivo y los métodos genómicos son el estándar de oro para el diagnóstico de sepsis18. Sin embargo, suele evidenciarse múltiples cambios del metabolismo, involucrando piruvato, lactato, carnitina, fenilalanina, urea, creatina, creatinina y mioinositol, relacionados con un alto riesgo de mortalidad en UCI, pudiendo contribuir su medición en el pronóstico de la sepsis19,20.
El MyD88 es una glicoproteína descubierta y clonada por Dan Lieberman y Bárbara Hoffman, que cumple roles como factor de transcripción, exhibiendo como función principal la regulación de la inmunosupresión en células de tipo mieloides21. Como proteína adaptadora universal, el MyD88 propaga señales resultantes de la unión del receptor TLR y de interleucina-1 (IL-1R) en el control de las respuestas inmunitarias innatas, constituyendo un centro organizador supramolecular, el cual es amplificador de señales y denominado myddosoma22; también recluta cinasas asociadas al receptor de IL-1 (IRAK), esencial para la activación de NF-κβ y proteína cinasa activada por mitógeno (MAP), requiriéndose la activación de todas estas moléculas, para una actividad robusta23. Durante la señalización MyD88-NFκβ en la inmunomodulación inducida por LPS, las concentraciones séricas de citocinas de inflamación aguda disminuyen significativamente después de seis horas, pudiendo desencadenar la producción y secreción de otras citocinas24.
Dentro de ese contexto, la valoración de los biomarcadores de inflamación LPS y MyD88, tiene alta relevancia, tanto en el diagnóstico de sepsis bacteriana por gramnegativos, como en progreso a shock séptico, suelen demostrar vías de señalización inflamatorias, necesarias para el progreso del shock y la mortalidad en el paciente séptico, por lo que el presente estudio se propuso evidenciar este contexto, en población séptica.
Material y métodosSe llevó a cabo un estudio analítico transversal, en el que se emplearon historias clínicas electrónicas y muestras sanguíneas de 125 pacientes con sepsis y shock séptico de un centro clínico de Barranquilla, Colombia, durante febrero de 2017 a enero de 2022. Los criterios de inclusión definidos fueron: ser mayor de edad, haber sido diagnosticado con sepsis o shock séptico de etiología gramnegativa mediante hemocultivo y las puntuaciones de las escalas SOFA o qSOFA también fueron consideradas en cada paciente, aplicadas por el médico especializado. Se excluyeron a los pacientes con sepsis bacteriana grampositiva, viral, parasitaria o micótica. Asimismo, los pacientes sépticos menores de edad y adultos sanos o con otras patologías también fueron excluidos. Se diligenció un acta de consentimiento informado, la cual fue firmada por cada uno de los pacientes seleccionados para el estudio. Los niveles séricos tanto de LPS como del MyD88 se efectuaron por el método de inmunoanálisis ligado por enzima (ELISA). Tanto el procesamiento de las muestras, como el análisis de los resultados, se realizaron en laboratorio de Inmunología de la Universidad Simón Bolívar, sede Barranquilla.
ProcedimientosDe cada paciente recluido en urgencias, hospitalización o UCI, se obtuvo una muestra sanguínea venosa por el personal especializado del centro clínico, una vez realizado el diagnóstico de sepsis o shock séptico y confirmada su etiología bacteriana gramnegativa. La muestra se sometió a centrifugación, empleando para ello una centrifugadora marca BOECO® (Ref 1800-12), con serie número 0000130-03 y fabricada por BOECO® (Andreas Hettich GmbH y Co. KG, 78532 Tuttingen, Alemania), con lo cual se obtuvo el suero sanguíneo. Las concentraciones séricas de LPS y MyD88 fueron medidas empleando el reactivo ELISA Kit marca Human, cumpliendo a cabalidad las normas de fábrica. Para la transferencia de volúmenes necesarios, se emplearon pipetas automáticas (seriales núm. QE413607 y QG458515) marca BOECO®. El Microplate Reader, modelo EL10A y fabricado por BIOBASE® BIODUSTRY (núm. 51 South Gongye Road, Jinan, Shandong, China), número de serie SNEL10A38182088E, se empleó para medir la densidad óptica (DO) en cada muestra, a partir de la curva de calibración estandarizada antes de cada medición y los resultados fueron tabulados en Excel (Microsoft Corporation, Redmond, Washington, Estados Unidos), estableciéndose su nivel de acuerdo con los valores de referencia del fabricante, teniendo en cuenta la edad y el género de la población estudiada. La unidad de medida establecida para la concentración sérica del LPS fue nanogramos sobre mililitro (ng/mL), mientras que para el MyD88 fue picogramos sobre mililitro (pg/mL).
Análisis estadísticoLa media, desviación estándar, la sensibilidad y especificidad de los niveles séricos del LPS y MyD88 fueron calculadas en la población con sepsis y shock séptico. El estadístico Mann-Whitney-Wilcoxon corregido con el método de Bonferroni se implementó en el estudio para obtener la diferencia entre las variables. Se utilizó X2 tanto para el análisis de resultados, como para la comprobación de la relación significativa entre las variables contrastadas con el progreso de shock y el valor p <0,05 fue considerado como significativo.
Consideraciones éticasTodos los pacientes seleccionados diligenciaron y firmaron el acta de consentimiento informado. Se tuvieron en cuenta los principios éticos para la investigación médica que involucre seres humanos, estipulados en la Declaración de Helsinki, así como las normas científicas, técnicas y administrativas para la investigación en salud, establecidas por la resolución 8430. Los datos personales de los pacientes fueron protegidos, tal como lo establece la ley Habeas Data 1581. El estudio fue aprobado por los comités éticos de las universidades Simón Bolívar e Internacional Iberoamericana, mediante las actas 00075 (resolución 046 PRO-CEI-USB0106-00) y CR-128, respectivamente.
ResultadosLas concentraciones séricas halladas para ambos biomarcadores se expresan como media más una desviación estándar (media±DE). En pacientes con shock séptico (n=50), los valores hallados para LPS fueron 31,86±11,4 ng/mL, en tanto que los hallados para MyD88 estuvieron en 3.267,2±2.001,5 pg/mL. Mientras que en pacientes sépticos sin progreso a shock (n=75), LPS resultó con 24,7±13,6 ng/mL y para MyD88 su concentración fue de 2.178,3±2.948,9 pg/mL.
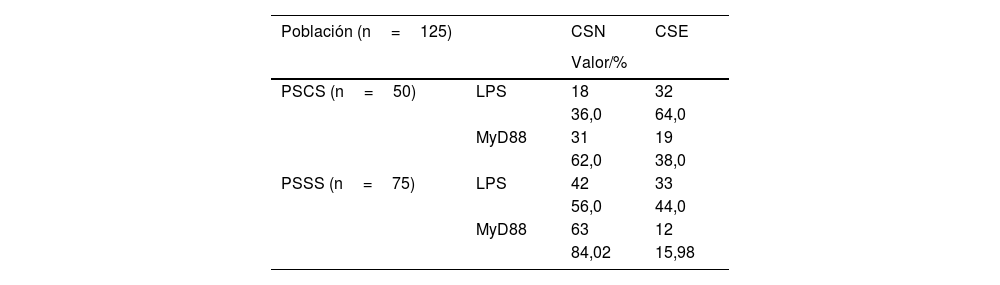
En el grupo de pacientes sin shock séptico, se destaca que 44% de estos presentaron niveles elevados de LPS y 15,98% lo mostraron para el biomarcador MyD88 (tabla 1).
Concentraciones séricas de biomarcadores LPS y MyD88 en la sepsis y shock séptico
| Población (n=125) | CSN | CSE | |
|---|---|---|---|
| Valor/% | |||
| PSCS (n=50) | LPS | 18 | 32 |
| 36,0 | 64,0 | ||
| MyD88 | 31 | 19 | |
| 62,0 | 38,0 | ||
| PSSS (n=75) | LPS | 42 | 33 |
| 56,0 | 44,0 | ||
| MyD88 | 63 | 12 | |
| 84,02 | 15,98 |
CSE: concentración sérica elevada; CSN: concentración sérica normal; LPS: lipopolisacárido; MyD88: cúmulo de diferenciación mieloide 88; PSCS: paciente séptico con progreso a shock: PSSS: paciente séptico sin progreso a shock.
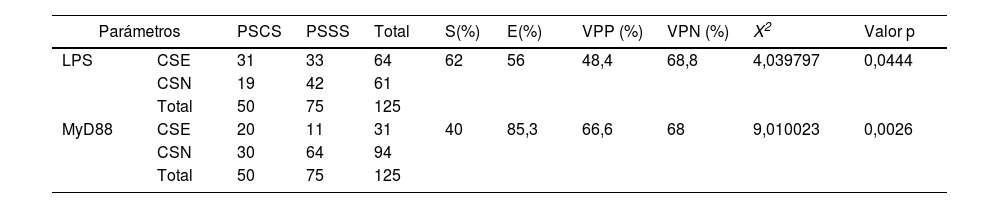
Los valores de sensibilidad hallados indican que el 62% de los pacientes con shock séptico, presentaron niveles elevados del biomarcador LPS; mientras que los valores de especificidad establecen que el 85,3% de los pacientes sin shock mostraron niveles normales del MyD88. De acuerdo con el valor predictivo positivo, se halló que 66,6% de los pacientes con niveles séricos elevados del MyD88 y 48,4% con LPS elevados, progresaron a shock séptico. Mediante X2, los valores resultantes fueron p=0,0444 para LPS y p=0,0026 para el MyD88, lo cual estableció una relación significativa entre estos biomarcadores y la condición estudiada (tabla 2).
Valoración de biomarcadores LPS y MyD88 en sepsis y progreso a shock séptico
| Parámetros | PSCS | PSSS | Total | S(%) | E(%) | VPP (%) | VPN (%) | X2 | Valor p | |
|---|---|---|---|---|---|---|---|---|---|---|
| LPS | CSE | 31 | 33 | 64 | 62 | 56 | 48,4 | 68,8 | 4,039797 | 0,0444 |
| CSN | 19 | 42 | 61 | |||||||
| Total | 50 | 75 | 125 | |||||||
| MyD88 | CSE | 20 | 11 | 31 | 40 | 85,3 | 66,6 | 68 | 9,010023 | 0,0026 |
| CSN | 30 | 64 | 94 | |||||||
| Total | 50 | 75 | 125 | |||||||
CSE: concentración sérica elevada; CSN: concentración sérica normal; E: especificidad; LPS: lipopolisacárido; MyD88: cúmulo de diferenciación mieloide 88; PSCS: paciente séptico con progreso a shock: PSSS: paciente séptico sin progreso a shock; S: sensibilidad; VPP: valor predictivo positivo; VPN: valor predictivo negativo.
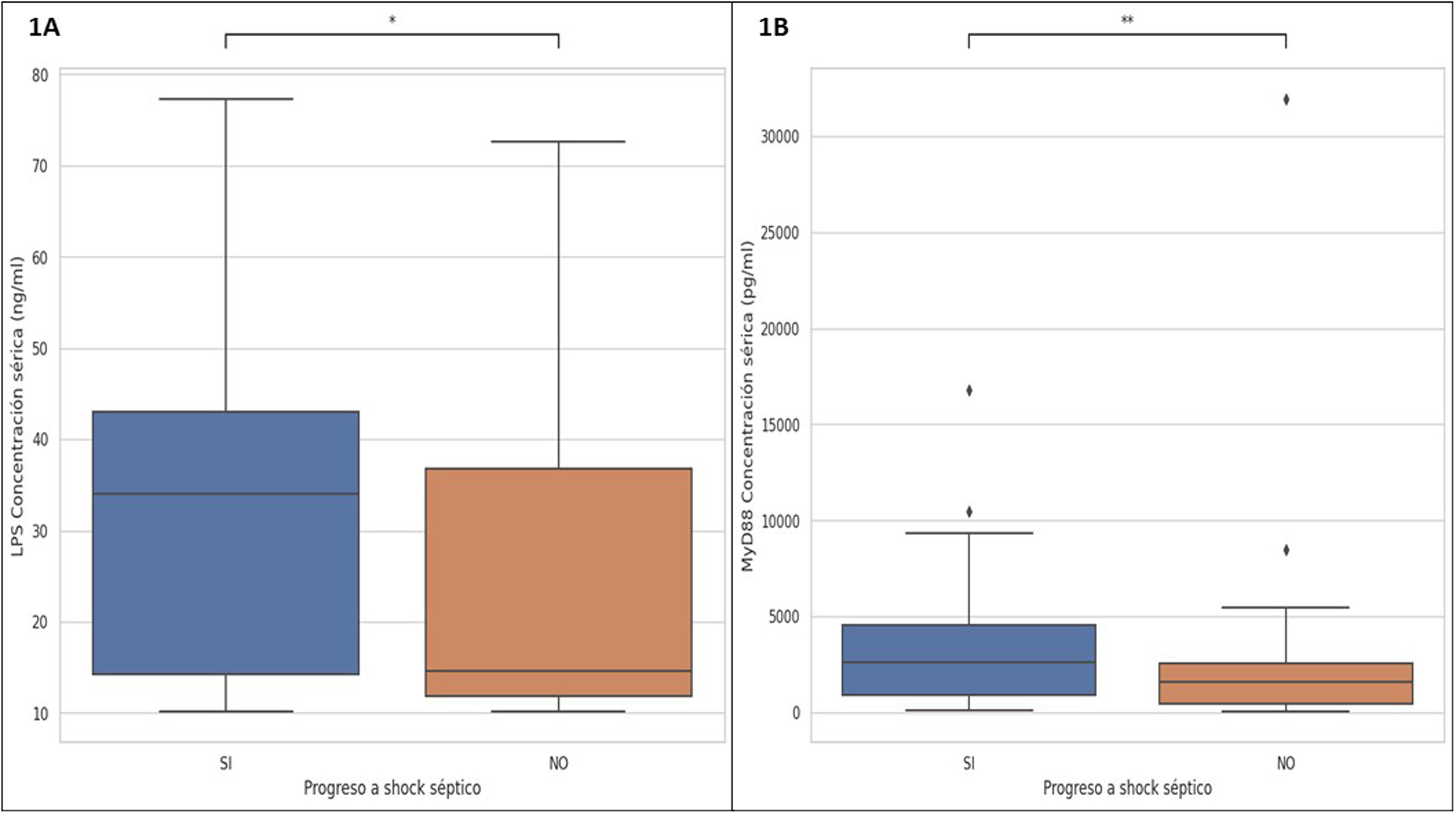
A través de la prueba Mann-Whitney-Wilcoxon, con corrección de Bonferroni, se halló un valor de p=0,01038 para LPS, mientras que para el MyD88 fue p=0,0046. Estos resultados indican una diferencia estadística significativa entre las concentraciones séricas de los biomarcadores LPS y MyD88, con el progreso a shock séptico en la población estudiada. Es decir, los pacientes sépticos que presenten altos niveles de MyD88 tendrán mayor probabilidad de shock, que aquellos con niveles séricos elevados del LPS (fig. 1).
Significancia estadística de biomarcadores LPS y MyD88 en sepsis y shock séptico
1A) Significancia estadística de las concentraciones séricas del LPS: p=0,01038 (*) en sepsis y shock séptico; 1B) Significancia estadística de las concentraciones séricas del MyD88: p=0,0046 (**) en sepsis y shock séptico. Se empleó Mann-Whitney-Wilcoxon, con corrección de Bonferroni.
LPS: lipopolisacárido; MyD88: cúmulo de diferenciación mieloide 88.
La sepsis como condición inflamatoria sistémica involucra a una variedad de elementos de la inmunidad tanto innata como adaptativa, en la cual se ejecutan respuestas celulares y humorales, determinadas por señales captadas a través de receptores y proteínas adaptadoras al interior de las células inmunitarias. El MyD88 es una de ellas y transduce señales emitidas por la unión del LPS con su respectivo receptor, por lo que ambos biomarcadores se pudieron relacionar en el presente estudio en la condición de sepsis y shock séptico. La evidencia que explica el rol del LPS como endotoxina de bacterias gramnegativas suele ser determinante con la mayor probabilidad de su elevación en la sepsis. Mientras que la actividad del MyD88 está limitada, tanto por su alta degradación, como por las señales que logren ingresar a las células que lo expresan, pudiendo esto tener incidencia en los niveles hallados en los pacientes sépticos. Por lo que, cuando las concentraciones de este biomarcador se encuentren elevadas, ello suele poseer mayor relevancia en la condición séptica y en el shock, lo cual quedó demostrado en el presente estudio. El estado hiperinflamatorio desencadenado en la sepsis, en el que predomina una mayor interacción entre receptores y sus ligandos, producción y actividad excesiva de células, elevada producción de citocinas e inmunoglobulinas, con consumo energético excesivo, puede reducir significativamente la respuesta inmune, necesaria para hacerle frente al agente causal. Este contexto puede ser relevante para estandarizar el momento preciso de la toma de la muestra durante la sepsis y lograr mayor exactitud y precisión en la medición del LPS y MyD88. Sin embargo, esto no logró incidir en los resultados hallados, pero en ambientes experimentales puede notarse, tal como fue demostrado mediante la inoculación del LPS en animales, y los incrementos de este dependieron, en gran parte, del progreso de la sepsis25. La metodología implementada en el presente estudio también fue realizada y demostrada por Azlık et al., coincidiendo con los hallazgos aquí referidos26; sin embrago, en población séptica China, la sensibilidad del LPS demostrada fue de 57%27, no lejana a la hallada en el presente estudio.
Los focos de infección caracterizados en los pacientes seleccionados, de mayor a menor prevalencia fueron las infecciones de vías urinarias, neumonía, peritonitis, diálisis peritoneal e infecciones en piel, semejante a lo establecido por Caraballo et al., en población colombiana28. Sin embargo, esto al parecer no tuvo incidencia en los resultados, debido a que todos los pacientes exhibieron sepsis de etiología gramnegativa al momento de la medición del LPS y MyD88, independientemente del foco de infección. En su mayor proporción, los pacientes sépticos estudiados, al momento del estudio, se encontraron recluidos en salas de hospitalización, mientras que en la UCI se encontraron aquellos con shock y un grupo minoritario de pacientes sépticos en urgencias. Muchos de estos pacientes, tanto al ingreso hospitalario, como en hospitalización y en UCI, habían iniciado antibioticoterapia y, teniendo en cuenta que las bacterias gramnegativas suelen ser productoras de β-lactamasa de espectro extendido, podría ello representar un factor de riesgo de sepsis y shock séptico, mayormente en UCI que en hospitalización y urgencias29. En este mismo sentido, estudios indican que, al tratar a pacientes infectados por gramnegativos con antibióticos, se liberan los LPS, los cuales son considerados como antígenos muy potentes, generándose hiperinflamación, que suele ser muy grave e incrementando la progresión al shock séptico30.
La diferencia demostrada en el presente estudio, relacionada con las concentraciones séricas del MyD88 en sepsis y shock séptico, se podría relacionar con la capacidad de MyD88 para inducir señales proinflamatorias durante la sepsis, máxime si se tiene en cuenta que MyD88 activa respuestas inmunitarias, mediante la amplificación de señales basadas en la unión del LPS bacteriano a su receptor, coincidiendo con lo establecido por Lee et al. en población taiwanesa, que demostró una relación significativa del MyD88 en pacientes sépticos31. Sin embargo, la evidencia muestra que la proteólisis del MyD88 ocurre mediante la vía ubiquitina-proteasoma, ruta muy activa durante la sepsis y el shock32, pudiendo esto influir en la baja probabilidad demostrada en el presente estudio. Sobre todo si se tiene en cuenta que esta ruta degradativa es necesaria para la inmunidad celular y humoral, la cual, al encontrarse saturada, quizás no permita el equilibrio necesario, pudiendo ello relacionarse con la diferencia del MyD88 exhibida en este estudio.
Las limitaciones más importantes del presente estudio fueron no sincronización entre la toma de muestras sanguíneas, tanto para hemocultivos que indicara el agente etiológico bacteriano, como para la determinación de concentraciones séricas del LPS y MyD88; también la baja demanda de estos biomarcadores en la sepsis, limitando la eficiencia demostrada en el presente trabajo. Asimismo, considerando que no todos los pacientes sépticos progresan a shock, se requiere estandarizar el momento más oportuno para determinar el LPS y MyD88 durante la sepsis. Mientras que las fortalezas principales fueron demostrar la factibilidad de incorporar estos dos biomarcadores en la evaluación de sepsis bacteriana y progreso a shock; también, con la valoración de los niveles séricos del LPS y MyD88 se puede complementar o apoyar en el control clínico, coadyuvando a evitar o reducir la mortalidad durante la sepsis o el shock séptico.
ConclusiónSe halló una relación significativa entre los niveles séricos del LPS y MyD88 con la sepsis y el shock séptico, demostrándose el valor de estos como biomarcadores en los pacientes con dicha condición.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interésLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a las directivas de las Universidades Simón Bolívar e Internacional Iberoamericana por facilitar logística para la realización de este proyecto.