La esquizofrenia es un trastorno que implica múltiples anomalías bioquímicas. Los pacientes con esquizofrenia tienen una prevalencia muy alta de tabaquismo, que se ha relacionado con el hecho de que la nicotina tiene importantes interacciones con la dopamina, siendo teóricamente capaz de reducir algunos de los síntomas positivos, negativos y cognitivos de la esquizofrenia. Sin embargo, existe controversia respecto al papel de la nicotina en la sintomatologia de los pacientes con esquizofrenia fumadores. El objetivo de la presente investigación fue evaluar el efecto de la administración de nicotina en un modelo de hiperactivación del sistema dopaminérgico, mediante una tarea de estimación temporal en animales del laboratorio. Los resultados sugieren una recuperación de las habilidades cognitivas, sin embargo el efecto procognitivo de la nicotina depende de una gran variedad de factores, incluyendo los sistemas neurales subyacentes a las tareas usadas y su interacción con otros fármacos y sistemas. Se propone que la evaluación del procesamiento de la información temporal puede servir como una herramienta en la comprensión y evaluación de los déficits cognitivos de la esquizofrenia.
Schizophrenia is a disorder that involves multiple biochemical abnormalities. Patients with schizophrenia have a high prevalence of smoking, which has been linked with the fact that nicotine has significant interactions with dopamine, theoretically being able to reduce some of the positive, negative and cognitive symptoms of schizophrenia. However, there is controversy about the role of nicotine on symptoms of patients with schizophrenia who smoke. The objective of this research was to evaluate the effect of nicotine administration in a model of hyperactivation of the dopaminergic system using a temporal bisection task. The results suggest a recovery of cognitive skills, but the procognitive effect of nicotine depends on a variety of factors, including the underlying neural systems of the tasks and its interaction with other drugs and systems. It is proposed that the evaluation of the temporal processing of information could be a tool in the understanding and assessment of cognitive deficits of schizophrenia.
La esquizofrenia es un trastorno del desarrollo neurológico y progresivo con múltiples anomalías bioquímicas que involucran alteraciones en el sistema dopaminérgico, serotonérgico, glutamatérgico y gabaérgico (Miyamoto, LaMantia, Duncan, Sullivan, Gilmore & Lieberman, 2003).
Las principales alteraciones en el sistema dopaminérgico que se presentan en la esquizofrenia, son la actividad hiperdopaminérgica en la vía mesolímbica y actividad hipodopaminérgica en las vías mesocorticales (Miyamoto et al., 2003). Dichas alteraciones en el sistema dopaminérgico están relacionadas con los síntomas que presentan los pacientes con esquizofrenia, los cuales se han clasificado en síntomas positivos, negativos y cognitivos, por ejemplo, alucinaciones, anhedonia y déficits en las funciones ejecutiva, respectivamente.
Esquizofrenia y tabaquismoCasi el 90% de las personas con esquizofrenia fuman, en comparación con sólo el 33% en la población general y 45.57% en los pacientes con otros diagnósticos psiquiátricos (Lohr & Flynn, 1992).
Las razones de la elevada prevalencia de tabaquismo entre los esquizofrénicos se han relacionado con numerosas interrelaciones entre los aspectos psicopatológicos, bioquímicos y neurofarmacológicos del hábito de fumar y de la esquizofrenia.
Algunos estudios han sugerido que los pacientes esquizofrénicos fuman como un intento de automedicarse para reducir algunos de los déficits cognitivos de este trastorno (Kumaria & Postmab, 2005), debido a quela nicotina tiene importantes interacciones con la dopamina. Se ha demostrado que la nicotina aumenta la liberación sináptica de dopamina cuando se administra agudamente. Además, se ha propuesto que las neuronas del sistema dopaminérgico mesolímbico poseen receptores nicotínicos y que la nicotina aumenta la liberación de dopamina en sus terminales presinápticas (Lohr et al., 1992; Smith, Singh, Infante, Khandat & Kloos, 2002).
Así, una explicación de la alta prevalencia de tabaquismo en los pacientes esquizofrénicos, puede ser que la nicotina reduce los síntomas negativos mediante el aumento de la liberación de dopamina, ya que la nicotina invertiría parcialmente la disfunción de la dopamina (Barr, Procyshyn, Hui, Johnson & Honer, 2008).
Por el contrario, la actividad de la dopamina puede ser disminuida por la administración crónica de nicotina debido a la tolerancia y la desensibilización de los receptores nicotínicos. En este caso, el fumar de forma crónica podría ayudar a aliviar los síntomas positivos, causados por la actividad hiperdopaminérgica (Smith et al., 2002).
Asimismo, diversos estudios sugieren que la nicotina mejora el rendimiento cognitivo en la esquizofrenia, particularmente mejora el rendimiento en la atención y la memoria de trabajo (Dépatie, O’Driscoll, Holahan, Atkinson, Thavundayil, Kin & Lal, 2002; Jacobsen, D'Souza, Mencl, Pugh, Skudlarski & Krystal, 2004; Larrison-Fauchera, Matorinb & Serenoa, 2004; Levin, Wilson, Rose & McEvoy, 1996).
Sin embargo, aún existe controversia respecto al efecto procognitivo de la nicotina. Por ejemplo, no existe una relación inversa contundente entre el tabaquismo y los síntomas clásicos de la esquizofrenia. Por el contrario, diversos estudios han encontrado una relación positiva entre el tabaquismo y la intensidad de los síntomas positivos y negativos de la esquizofrenia. Además, la reducción o el cese de fumar en la mayoría de los estudios no tuvo ningún efecto importante en los síntomas de la esquizofrenia, y aunado a eso, el fumar precede a la aparición de la esquizofrenia en la mayoría de los casos (Dome, Lazary, Kalapos & Rihmer, 2010).
Asimismo, algunos estudios son contradictorios, ya que hay un gran número de investigaciones en las que no son encontradas mejoras en el rendimiento cognitivo por administración de la nicotina (Attaway, Compton & Turner, 1999; Levin & Torry, 1996; Moragrega, Carrasco, Vicens & Redolat, 2003).
Del mismo modo, la nicotina tiene efectos complejos sobre el comportamiento de los animales experimentales que están influenciados por factores tales como la dosis, la vía de administración, la especie y la cepa utilizada para los estudios, la naturaleza de la prueba utilizada para los experimentos y la exposición previa a la droga (Popke, Mayorga, Fogle & Paule, 2000).
Alteraciones en la estimación temporal en la esquizofreniaAlgunos estudios sugieren que los síntomas clásicos de la esquizofrenia, como los trastornos del pensamiento y el comportamiento desorganizado y contextualmente inapropiado, están relacionados con un déficit fundamental en la precisión temporal (Carroll, Boggs, O’Donnell, Shekhar, & Hetrick, 2008; Carroll, O’Donnell, Shekhar & Hetrick, 2009).
Asimismo, varias regiones cerebrales que están implicadas en la fisiopatología de la esquizofrenia también se han relacionado con las bases neurales propuestas para la estimación del tiempo. Tanto la esquizofrenia como la habilidad para estimar el tiempo con precisión, se han relacionado con el sistema dopaminérgico estriatal y la interconectividad entre el cuerpo estriado y la corteza prefrontal (Ward, Kellendonk, Kandel & Balsam, 2012). Este sobrelapamiento de sistemas puede ser una ventaja al evaluar el desempeño cognitivo en la esquizofrenia, pues al evaluar el desempeño en la estimación del tiempo, se estarían evaluando precisamente los sistemas que se encuentran involucrados en la esquizofrenia.
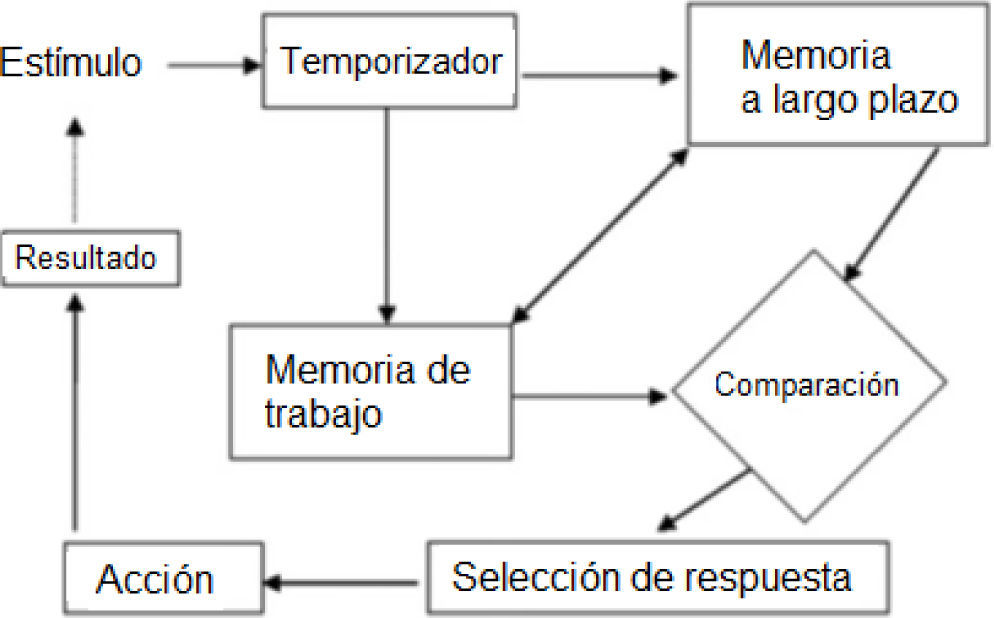
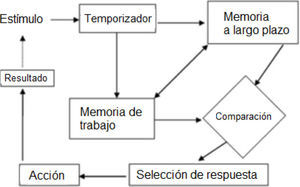
Del mismo modo, la realización de las tareas que implican la estimación de intervalos de tiempo involucra procesos cognitivos como la memoria de trabajo, atención y funciones ejecutivas, las cuales se encuentran precisamente alteradas en la esquizofrenia (Ward et al., 2012). La figura 1 muestra los procesos cognitivos que se piensan como la base de rendimiento en las tareas de estimación de intervalos de tiempo.
JustificaciónAunque los efectos conductuales y cognitivos de la nicotina en la esquizofrenia han recibido mucho interés en los últimos años, no se ha realizado una evaluación de la modulación de la dopamina por la nicotina usando una tarea que implique diversos dominios cognitivos. En este caso, se sugiriere que la evaluación del procesamiento de la información temporal puede servir como una herramienta en la comprensión y evaluación de los déficits cognitivos de la esquizofrenia por tres principales razones: 1) permite evaluar diversas habilidades cognitivas en una misma tarea de estimación del tiempo, 2) al evaluar el desempeño en la estimación del tiempo, se estarían evaluando precisamente los sistemas funcionales que se encuentran involucrados en la esquizofrenia y 3) la alteración en el desempeño cognitivo de la esquizofrenia, se manifestará también como un déficit en la estimación del tiempo.
MétodoSujetosVeinticuatro ratas Wistar macho provenientes del bioterio de la Facultad de Psicología de la Universidad Nacional Autónoma de México. Con una edad aproximada de 3 meses y un peso de 250-350 gramos al inicio del experimento. Fueron alojadas en cajas comunales en condiciones estándar de laboratorio, con un ciclo constante de luz-oscuridad y de temperatura y tuvieron acceso libre al agua con acceso restringido al alimento a una hora por día y mantenidas entre el 85 ± 90% de su peso corporal basal inicial.
MaterialesOcho cajas de condicionamiento operante (Med Associates, Inc.) convencionales de 28x27x22 centímetros, con paredes de policarbonato. Las cajas operantes tenían dos palancas fijas equidistantes para emitir las respuestas, un dispensador de pellets reforzadores, luz general y sonido y luz como estímulos.
FármacosEl metilfenidato (Novartis®) fue usado para modelar la alteración dopaminérgica en los sujetos experimentales. Las dosis que se usaron de acuerdo a una curva dosis-respuesta fueron 0.1, 0.3, 1.0, y 3.0mg/kg (Arroyo, Ostos-Valverde, Perez-Gutierrez, Paz-Trejo, Zamora, Miranda & Sanchez-Castillo, 2011), administradas por vía intraperitonial.
Se usó nicotina (Sigma®) en polvo disuelta en agua salina como vehículo. Las dosis usadas fueron 0.1, 0.2, 0.4 y 0.8mg/Kg (Sánchez-Castillo Franco, Ramírez, Paz & Miranda, 2013) administradas por vía intraperitoneal y 1.5mg/Kg de nicotina administrada por vía subutánea, balanceada con hidróxido de sodio (J.T.Baker®) a un pH de 7.5.
Se administró agua salina en proporción de 1mg/kg en las sesiones control por vía intraperitonial y subcutánea.
ProcedimientoLas ratas fueron entrenadas para responder en las palancas izquierda y derecha. Una vez que la conducta de presión de palanca fue aprendida, comenzó el entrenamiento en la una tarea de bisección temporal. En la fase de entrenamiento, se presentó un estímulo auditivo con una duración de 2 segundos (s.) y otro con duración de 8 s., siendo el primero el estímulo corto y el último el estímulo largo. Los sujetos aprendieron a responder diferencialmente a cada estímulo. La mitad de las ratas fueron entrenadas a responder en la palanca derecha contingentemente con el estímulo corto y en la palanca izquierda con el estímulo largo; mientras que la otra mitad fue entrenada a responder en la palanca derecha contingentemente con el estímulo largo y en la palanca izquierda con el estímulo corto.
Cada sesión constó de 40 ensayos en los que se presentaron dichos estímulos aleatoriamente y se reforzaron las respuestas correctas con pellets. Las sesiones de entrenamiento continuaron hasta que la precisión fue al menos 85% correcta.Una vez que se alcanzó dicho parámetro, se iniciaron las sesiones de generalización en las que se presentaron estímulos intermedios espaciados en términos logarítmicos que fueron de 2.52, 3.17, 4, 5.04 y 6.35 s. (Orduña, Hong & Bouzas, 2007). Después de que las ratas mostraron una categorización de estímulos temporales estable en las sesiones de prueba, se corrieron dos sesiones con administración de solución salina como control y posteriormente se comenzó la administración de los fármacos.
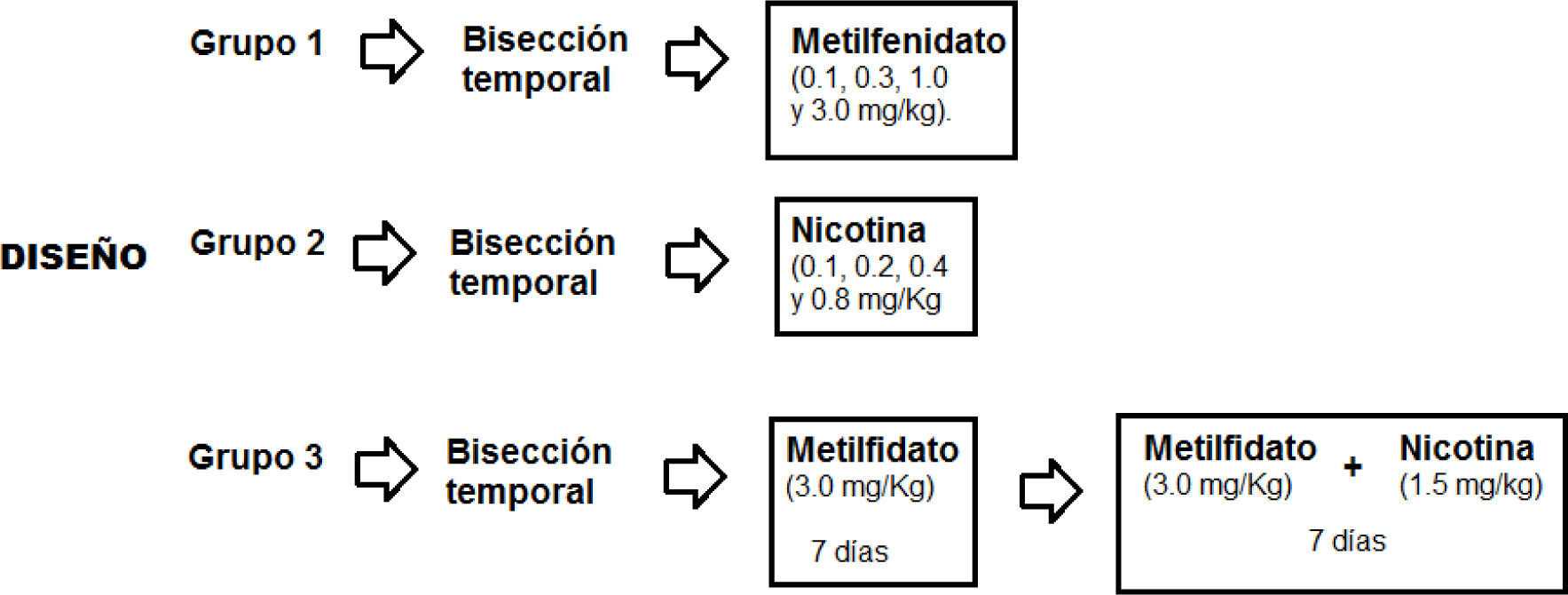
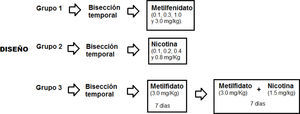
Las 24 ratas se dividieron en tres grupos de 8 ratas cada uno. El primer grupo recibió la administración de las cuatro dosis de metilfenidato (0.1, 0.3, 1.0, y 3.0mg/kg). El segundo grupo recibió la administración de las cuatro dosis de nicotina (0.1, 0.2, 0.4 y 0.8mg/Kg). El tercer grupo recibió la administración repetida de metilfenidato (3.0mg/Kg) por 7 días y a continuación la administración conjunta de metilfenidato (3.0mg/kg) y nicotina (1.5mg/kg) por otros 7 días. La figura 2 muestra una representación gráfica del diseño de la presente investigación.
La administración del metilfenidato y la nicotina de los primeros dos grupos fue por vía intraperitonial y se realizó de forma espaciada semi-aleatoriamente entre sesiones. Todas las administraciones se realizaron 20 minutos antes de introducir a los sujetos a las cajas operantes para correr la sesión de generalización. Mientras que la administración repetida de metilfenidato (3.0mg/kg) para el tercer grupo de ratas fue de una inyección al día durante 7 días por vía intraperitoneal. Y la administración de la nicotina (1.5mg/kg) se realizó por vía subcutánea, dos veces al día, durante 7 días.
Análisis de datosSe analizaron los datos de las sesiones experimentales de generalización. Se obtuvo el porcentaje de respuestas en la palanca asociada al estímulo largo. Se obtuvo el punto de bisección el limen y la fracción de weber para cada condición control y experimental, utilizando una función sigmoidal de tres parámetros, donde ‘a’ fue la tasa máxima, ‘b’ la desviación estándar y ‘Xo’ el punto de bisección.
Se realizaron análisis de varianza (ANOVA) de una vía para todas las condiciones así como para cada medida psicométrica.
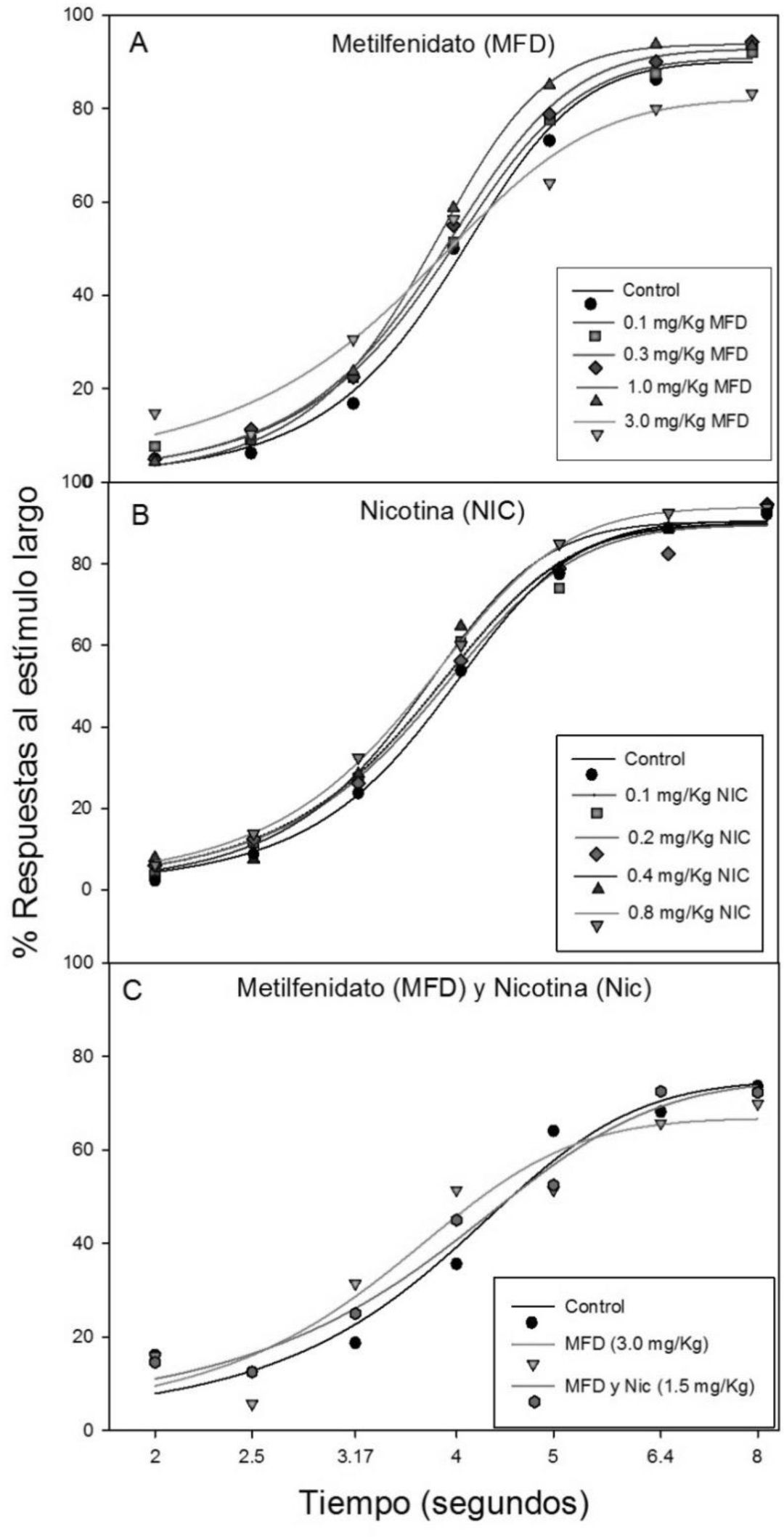
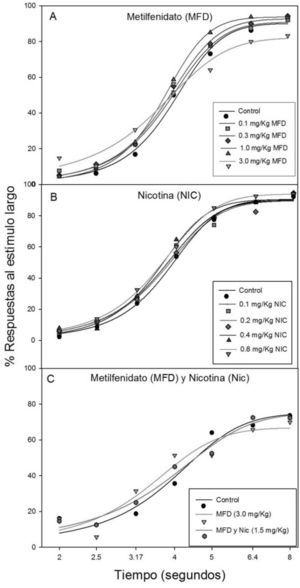
ResultadosLa Gráfica 1 muestra el porcentaje de respuestas a la palanca asociada al estímulo largo para cada condición control y experimental. El panel A muestra la curva sigmoidal con la administración aguda de metilfenidato en las dosis 0.1mg/kg, 0.3mg/kg, 1.0mg/kg y 3.0mg/kg, así como el grupo control. Se puede observar una tendencia de desplazamiento dosis-dependiente de la curva hacia la izquierda.
El panel B muestra el porcentaje de respuestas a la palanca asociada al estímulo largo para la administración de nicotina (0.1, 0.2, 0.4, 0.8mg/kg) así como la condición control. Y el panel C muestra la gráfica sigmoidal de la condición control y de la administración repetida de metilfenidato (3.0mg/Kg) durante 7 días, así como la administración repetida y simultánea de metilfenidato (3.0mg/Kg) y nicotina (1.5mg/Kg) durante 7 días.
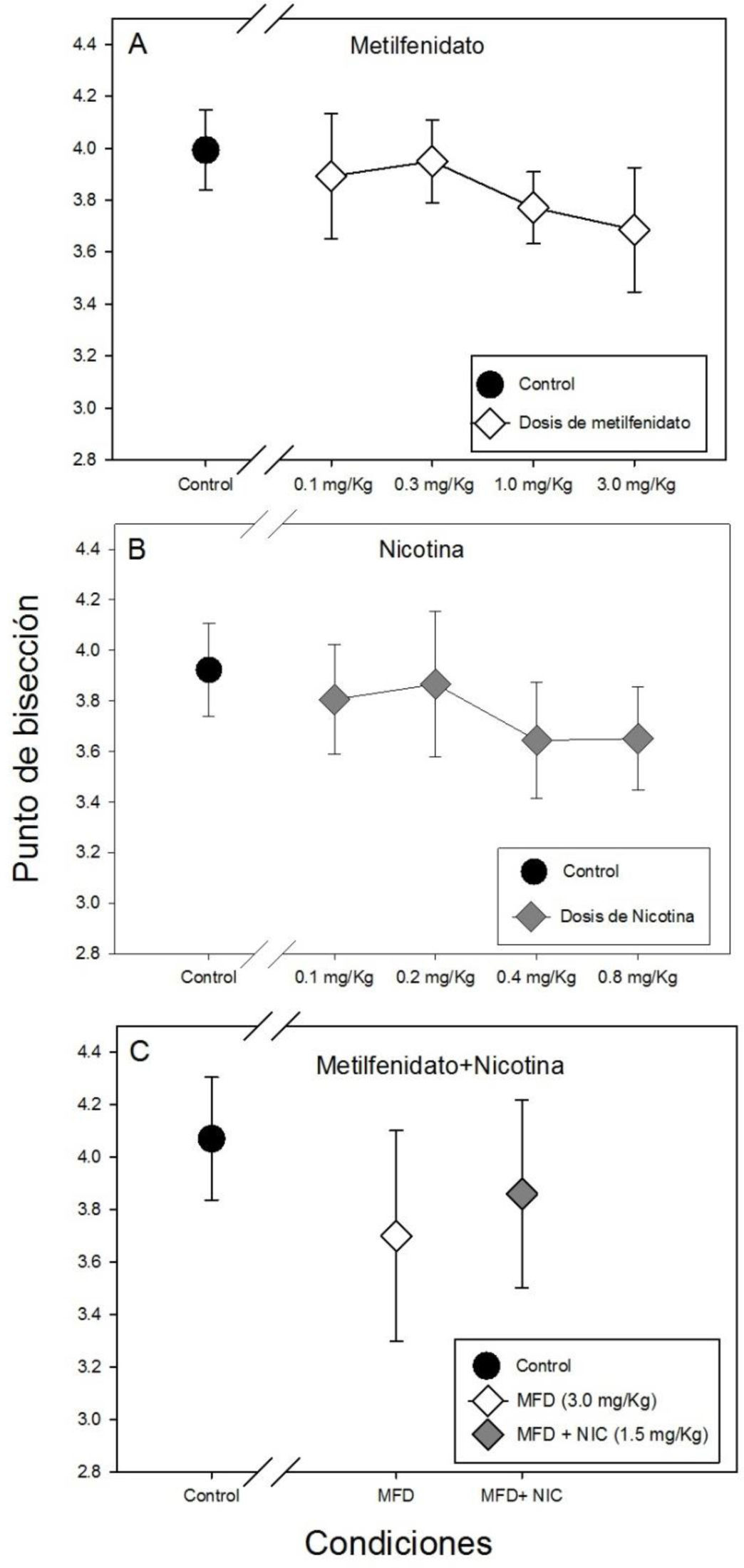
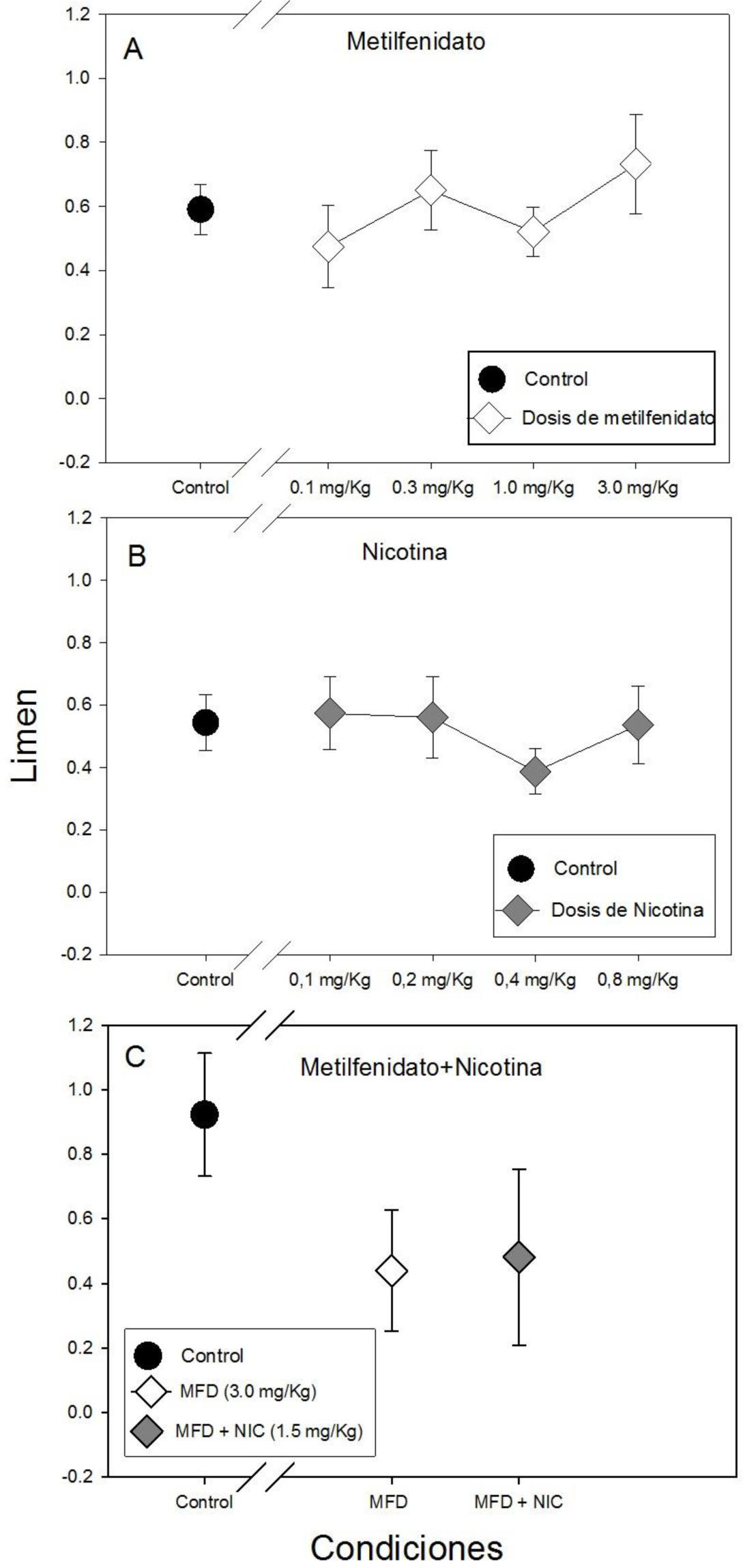
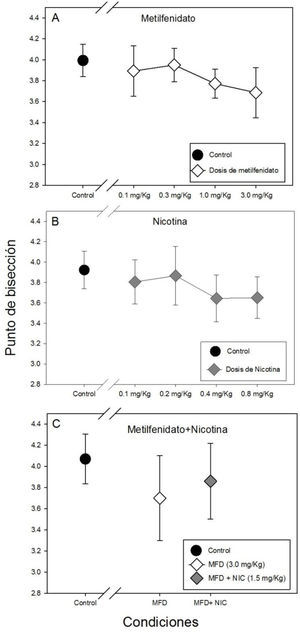
La Gráfica 2 muestra el punto de bisección para todas las condiciones controles y experimentales. No se encontraron diferencias estadísticamente significativas en el punto de bisección entre la administración de las cuatro dosis de metilfenidato ni con respecto al control (F(4, 34)=0.436, p=0.782). Sin embargo, se puede observar una tendencia de disminución de punto de bisección (panel A de la Gráfica 2) mostrando el menor punto de bisección con la dosis más alta de metilfenidato (3.0mg/kg).
Tampoco se hallaron diferencias estadísticamente significativas en el punto de bisección con la administración de las cuatro dosis de nicotina y el control (H(4)= 2.22, p=0.695)(panel B de la gráfica 2), ni con la administración repetida de metilfenidato (3.0mg/kg), metilfenitado (3.0mg/kg) más nicotina (1.05mg/kg) y el control (F(2, 21)=0.301, p=0.743), que se puede observar en el panel C de la gráfica 2.
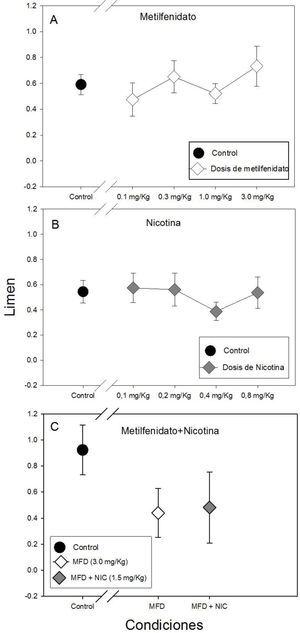
La Gráfica 3 muestra el limen para todas las condiciones experimentales y el control. No se hallaron diferencias estadísticamente significativas en el limen entre las dosis de metilfenidato ni con respecto al control (F(4, 34)=0.775, p= 0.549). Sin embargo se observa el limen más alto con la dosis de 3.0mg/kg de metilfenidato (panel A de la Gráfica 3).
No existieron diferencias estadísticamente significativas en el limen entre la administración de las cuatro dosis de nicotina ni con respecto al control (F(4, 35)=0.481, p= 0.750), sin embargo, se puede observar una el limen más bajo con la dosis de 0.4mg/kg de nicotina (panel B de la Gráfica 3).
Tampoco se hallaron diferencias estadísticamente significativas ni con la administración repetida de metilfenidato (3.0mg/kg), metilfenitado (3.0mg/kg) más nicotina (1.05mg/kg) y el control (H(2)=4.02, p= 0.134), como se puede observar en el panel C de la Gráfica 3.
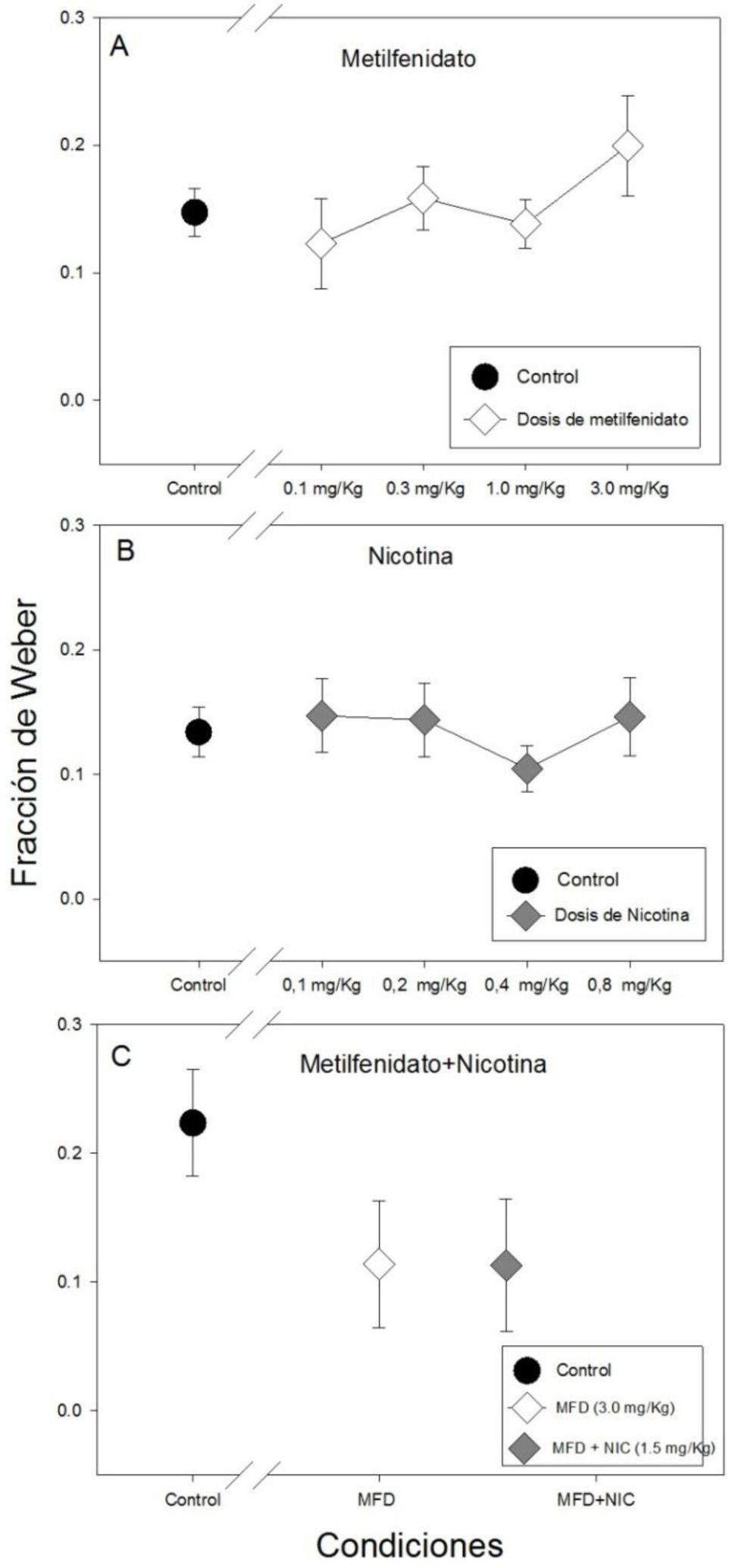
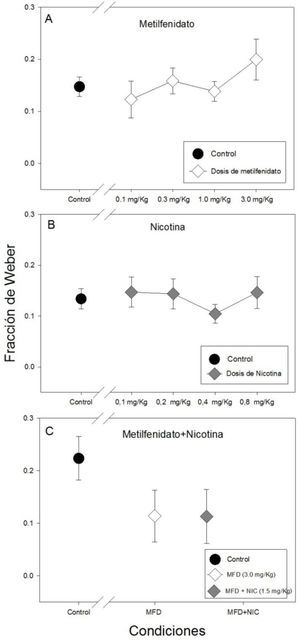
La Gráfica 4 muestra la fracción de Weber para todas las condiciones experimentales y controles. No se hallaron diferencias estadísticamente significativas en la fracción de Weber entre las cuatro dosis de metilfenidato ni con respecto al control (F(4, 34)= 1.002, p=0.420).Sin embargo, también se puede observar la fracción de Weber más alta con la dosis de 3.0mg/kg de metilfenidato (panel A de la Gráfica 4).
Asimismo, no hubo diferencias estadísticamente significativas en la fracción de Weber entre la administración de las cuatro dosis de nicotina ni con respecto al control (F(4, 45)=0.463, p=0.762), no obstante, se puede observar la fracción de Weber más baja con la dosis de 0.4mg/kg de nicotina (panel B de la Gráfica 4).
Tampoco se hallaron diferencias estadísticamente significativas con la administración repetida de metilfenidato (3.0mg/kg), metilfenitado (3.0mg/kg) más nicotina (1.05mg/kg) y el control (H(2)=4.087, p= 0.130) pero se puede observar que la fracción de Weber es muy similar entre las dos condiciones experimentales (panel C de la Gráfica 4).
DiscusiónLas curvas sigmoidales demuestran que las respuestas de los sujetos estaban bajo el control temporal ya que la proporción de respuestas a la palanca asociada al estímulo largo es creciente en función de la duración de la muestra (Ward et al., 2012).
El hecho de que no se hallaran diferencias estadísticamente significativas en las medidas psicométricas con la administración de metilfenidato podría sugerir que la precisión temporal no se vio afectada de manera significativa en el modelo propuesto, sin embargo, se puede observar una tendencia de decremento del punto de bisección, tal como se ha encontrado en investigaciones previas con personas con esquizofrenia (Carroll et al., 2008; Carroll et al., 2009).
Asimismo, una disminución en los máximos de repuestas, así como el mayor desplazamiento de la curva hacia la izquierda se observa gráficamente con la dosis de 3.0mg/kg. Este resultado concuerda con estudios clásicos (Maricq et al., 1981) que sugieren que la estimulación dopaminérgica tiene un efecto sobre el punto de bisección (desplazamiento de la curva sigmoidal hacia la izquierda) sin embargo, en este caso, sólo se pudo observar una tendencia, ya que la diferencia no fue significativa. Por otro lado, el aplanamiento de la curva sigmoidal (disminución de las respuestas máximas) se ha asociado a una disminución de la precisión temporal (McClure et al., 2011), por lo que esta dosis específicamente puede ser explorada en futuras investigaciones.
Se puede observar una tendencia de incremento del limen con la dosis 3.0mg/kg de metilfenidato con respecto al resto de las dosis y el control, así como un aumento de la fracción de Weber, lo que sugiere una disminución en la capacidad de categorización y sensibilidad para distinguir intervalos de tiempo con esta dosis de metilfenidato. El efecto de la dosis 3.0mg/kg resultó ser el mismo tanto en la administración aguda como en la administración repetida, lo que muestra consistencia en la acción del metilfenidato.
No se puede decir que el efecto que se obtuvo con la administración de metilfenidato es sólo debido a la hiperactivación dopaminérgica, ya que es un fármaco que parece ser que actúa sobre el sistema catecolinérgico en general (Polanczyk et. al, 2007). Sin embargo puede resultar ser una droga útil para modelar ciertos aspectos de la esquizofrenia ya que en este trastorno también se encuentran alterados múltiples sistemas de neurotransmisión (Miyamoto et al., 2003).
Los resultados de la administración de las cuatro dosis de nicotina (0.1,0.2, 0.4, 0.8mg/kg) sugieren que la nicotina por sí sola no mejora la precisión temporal o las habilidades cognitivas asociadas a la tarea de bisección temporal. Sin embargo, con la dosis de 0.4mg/Kg de nicotina se observó gráficamente una disminución del limen y de la fracción de Weber, por lo que se podría sugerir dicha dosis para evaluar los efectos procognitivos de la nicotina, ya que mostró una tendencia que sugiere que puede aumentar la capacidad de categorización y sensibilidad (Dépatie et al., 2002; Jacobsen et al., 2004; Larrison-Fauchera, Matorinb & Serenoa, 2004; Levin et al., 1996).
Estos resultados son contrarios a los reportados por Ward y colaboradores (2009) que muestran que la administración de nicotina aplana las funciones psicométrica, lo que indica una perturbación en el control de los estímulos. Esta discrepancia puede deberse a las dosis usadas, ya que en dicha investigación se usaron dosis más altas (1.0 y 3.0mg/kg), lo que podría explicar los efectos más pronunciados por la nicotina. Esto es consistente con otras investigaciones que sugieren que la dosis usada es primordial en el efecto que ejerce la nicotina; por ejemplo Popke et al. (2000), encontraron un efecto de U invertida en la acción de la nicotina sobre la mejora cognitiva.
Por otra parte, los resultados de la presente investigación concuerdan con diversos estudios en los que no se encuentra mejora en el rendimiento cognitivo con la sola administración de nicotina. Por ejemplo, Attaway et al. (1999) no reportaron ningún efecto de la nicotina sobre la adquisición de un patrón serial en ratas. Además, Levin y Torry (1996) encontraron que la administración crónica de la nicotina no tuvo ningún efecto sobre el rendimiento en el laberinto de brazos radiales en ratas. Mirza y Bright (2001) no encontraron ninguna mejora de la atención sostenida con la administración de nicotina, mientras que Moragrega, Carrasco, Vicens y Redolat (2003) reportaron que la administración aguda de nicotina disminuye rendimiento en un laberinto de agua en ratones.
Aunque las investigaciones indican que la nicotina mejora el rendimiento cognitivo, no lo hace de manera uniforme a través de los estudios, y se ha demostrado que tal mejora depende de una variedad de procedimientos y otros factores, incluyendo las dosis usadas, el régimen de dosificación usado, la cepa de los animales, el entrenamiento previo a la administración, los sistemas neurales subyacentes a las tareas usadas y su interacción con otros fármacos (Popke et al., 2000). Por ejemplo, se ha apuntado que el efecto de la nicotina es diferencial dependiendo de la complejidad de la tarea, señalando que la ejecución de tareas simples es la que se ve facilitada por la nicotina, mientras que ejecución de tareas más complejas se ve afectada por nicotina (Popke et al., 2000).
De ese modo, el hecho de que la nicotina no tenga efecto sobre ciertas tareas sugiere que las habilidades específicas necesarias para llevar a cabo estas tareas pueden implicar áreas cerebrales o procesos neuronales que son mínimamente afectados por la nicotina o que cuentan con importantes sistemas para compensar algunos de sus efectos cognitivo-conductuales (Ward et al., 2012).
En ese sentido, una alternativa para explicar los efectos diferenciales de la nicotina en la ejecución de diversas tareas operantes puede implicar las diferencias en los sustratos neurales que influyen en cada una de las conductas operantes complejas. En este caso, su efecto puede estar influenciado por los circuitos dopaminérgicos a través de los ganglios basales que están implicados en la estimación temporal (Buhusi et al., 2005).
Dado que se sabe que la nicotina influye en la función dopaminérgica en los ganglios basales (Lendvai & Vizi, 2008) es posible que los efectos de la nicotina encontrados en la presente investigación de la administración conjunta de nicotina con metilfenidato sea el resultado de la interacción de la nicotina con los sistemas dopaminérgicos implicados con la percepción temporal.
De ese modo, los resultados pueden sugerir una recuperación de las habilidades cognitivas por el efecto de la nicotina sobre la percepción temporal debida a la interacción de los sistemas dopaminérgico y colinérgico ya que se observó un desempeño casi sobrelapado de la función sigmoidal de la condición control y con la función sigmoidal de la administración repetida de metilfenidato (3.0mg/kg) más nicotina (1.5mg/kg).
Sin embargo, no se hallaron diferencias estadísticamente significativas en las medidas psicométricas, posiblemente debido a que la administración por sí sola de metilfenidato no generó un deterioro significativo en la percepción temporal, por lo que sólo se puede observar la recuperación de la función a su estado inicial.
Los resultados de la presente investigación sugieren que la nicotina podría intervenir parcialmente con la disfunción de la dopamina. Sin embargo, el efecto producido fue modesto, por lo que se sugiere que explorar su acción con otros tipos de tareas que no implican la categorización explícita entre dos categorías discretas de duración, tales como el procedimiento de pico, que podría ser más sensible a los efectos selectivos de diversas manipulaciones farmacológicas.
Gracias a que el campo de estudio de la estimación temporal permite un espectro muy amplio de evaluación de diferentes efectos motores, mnémicos, y de toma de decisiones, se puede proponer como idóneo para explorar con otras tareas que permitan la integración de parámetros diferentes que pueden ser sensibles a un efecto más pronunciado de la nicotina (Ward et al., 2012).