La parálisis de Bell es la forma más común de paresia o parálisis facial. Sin embargo, no todos los pacientes con parálisis facial tienen una parálisis de Bell. Otras causas frecuentes incluyen las secuelas del tratamiento del neurinoma del viii par, el cáncer de cabeza y cuello, la iatrogenia, el zóster ótico y los traumatismos. El abordaje de cada una de estas situaciones es totalmente diferente. El objetivo de esta guía es servir de consejo para el tratamiento y el seguimiento de los pacientes con parálisis facial. Nuestra idea es que la guía sea práctica, haciendo hincapié en recomendaciones efectivas y útiles en el manejo diario de los pacientes. Esta guía ha sido promovida por la Sociedad Española de ORL y escrita por médicos con experiencia en la enfermedad del nervio facial, incluyendo al menos un especialista de cada comunidad autónoma. Redactada en un formato de preguntas y respuestas, incluye 56 cuestiones relevantes relacionadas con el nervio facial.
Bell's palsy is the most common diagnosis associated with facial nerve weakness or paralysis. However, not all patients with facial paresis/paralysis have Bell's palsy. Other common causes include treatment of vestibular schwannoma, head and neck tumours, iatrogenic injuries, Herpes zoster, or trauma. The approach to each of these conditions varies widely. The purpose of this guideline is to provide clinicians with guidance on the treatment and monitoring of patients with different causes of facial paralysis. We intend to draft a practical guideline, focusing on operationalised recommendations deemed to be useful in the daily management of patients. This guideline was promoted by the Spanish Society of Otolaryngology and developed by a group of physicians with an interest in facial nerve disorders, including at least one physician from each Autonomous Community. In a question and answer format, it includes 56 relevant topics related to the facial nerve.
La parálisis facial es una disminución o ausencia completa de movimiento en algunos o en todos los músculos de la cara, que aparece por afectación del vii par craneal. Habitualmente, aparece en un lado de la cara, pero puede ser bilateral. Una parálisis facial periférica es aquella neuropatía que cursa con denervación del tronco del nervio facial en un trayecto comprendido entre su salida del tronco cerebral y sus ramas terminales en la cara. La parálisis facial periférica completa determina un cuadro clínico muy característico. En reposo, el surco nasogeniano del lado afectado está borrado y la boca se desvía hacia el lado sano. Existe dificultad para cerrar el ojo del lado paralizado; al intentar cerrarlo, el globo ocular puede desviarse hacia arriba y ligeramente hacia dentro (signo de Bell). El párpado inferior cae y se puede evertir (lagoftalmos), por lo cual la hendidura palpebral resulta más ancha. La afectación motora puede acompañarse de alteraciones de la secreción lagrimal y salival, y de la sensibilidad gustativa. El termino parálisis debería utilizarse para la afectación completa y paresia para la afectación parcial.
2. ¿Cuáles son las causas más frecuentes de parálisis facial?La parálisis facial idiopática o de Bell es la forma más frecuente de parálisis facial periférica. Con una incidencia anual de 20-30 casos/100.000 habitantes, supone el 60-75% de las parálisis faciales unilaterales1,2. Otras causas de parálisis facial se encuentran recogidas en la tabla 13. Tras la parálisis de Bell, las causas más frecuentes son las secuelas del tratamiento del neurinoma del viii par, el cáncer de cabeza y cuello, la iatrogenia, el zóster ótico y los traumatismos4.
Causas de parálisis facial
| Otras causas de parálisis facial | |
|---|---|
| Infecciosas | Víricas: Herpes simple, herpes zóster, CMV, VEB, VIH, HepatitisBacterianas: enfermedad de LymeEncefalitis/meningitis, sífilis, TBC |
| Iatrogénicas | Cirugía del ángulo pontocerebeloso, oído y parótida |
| Traumáticas | Fracturas del hueso temporalTrauma obstétricoHerida facial |
| Congénitas | Síndrome de MoebiusParálisis congénita del labio inferiorMicrosomía hemifacialSíndrome de Goldenhar |
| Tumorales | Tumor maligno del hueso temporal, tumores intrínsecos del nervio facial (schwannoma, hemangioma), meningioma, tumor de parótida, metástasis |
| Otógenas | ColesteatomaOtitis media aguda/crónicaOtitis externa maligna |
| Neurológicas | Síndrome de Guillain-BarréDistrofia miotónicaACVEsclerosis múltiple |
| Enfermedades generales | Diabetes, sarcoidosis, amiloidosis, síndrome de Melkersson-Rosenthal, enfermedad de Kawasaki, granulomatosis de Wegener |
ACV: accidente cerebrovascular; CMV: citomegalovirus; TBC: tuberculosis; VEB: virus de Epstein-Barr; VIH: virus de la inmunodeficiencia humana.
La anamnesis irá orientada a establecer el modo de inicio de la parálisis, brusco o progresivo, y la presencia de episodios previos. Se debe preguntar por enfermedades infecciosas recientes, antecedentes oncológicos, enfermedades vasculares, cardiopatías y alteraciones de la coagulación, así como la existencia de sintomatología asociada (dolor, vértigo, otorrea o hipoacusia). La exploración permitirá descartar afectación central (pregunta 5). Es importante cuantificar el grado de parálisis (pregunta 35) fijándonos en el grado afectación de cada una de las ramas del nervio facial, así como valorar el cierre ocular y el signo de Bell (pregunta 1), que es independiente del grado de parálisis y varía de un individuo a otro. Cuando el signo de Bell es evidente, la córnea queda más protegida aunque el cierre ocular sea incompleto y, por tanto, existen menos posibilidades de complicaciones oculares. Debe explorarse también la sensibilidad corneal (v par) y hacer hincapié en los cuidados del ojo si se encuentra disminuida5,6 (preguntas 4 y 52).
Una vez descartado el origen central, la exploración física incluirá una palpación de la región parotídea y una otoscopia, que nos permitirá valorar la presencia de enfermedad en el oído medio, así como la existencia de vesículas en el conducto auditivo externo (CAE) o en el pabellón auricular. Ante la presencia de enfermedad en el oído medio, se debe ingresar al paciente y se procederá al tratamiento oportuno según la causa (preguntas 29, 30 y 31). Si existe erupción vesicular asociada a la parálisis, enfocaremos el caso como un síndrome de Ramsay Hunt, y si la otoscopia es normal, como una parálisis de Bell. En caso de parálisis facial completa o dolor intenso desde el inicio, aun en ausencia de vesículas, consideraremos la posibilidad diagnóstica del síndrome de Ramsay Hunt, ya que hasta en un 30% de los casos puede presentarse sin vesículas (zóster sine herpete)6 (pregunta 9).
Para el tratamiento se utilizan corticoides, pudiendo asociarse también antivirales (preguntas 7, 9, 10 y 11). Es importante insistir en las recomendaciones orientadas a la protección ocular (pregunta 52)5,7. Se recomendará al paciente una revisión en consulta a las 3 semanas para valorar la evolución del cuadro. La mayoría de las parálisis de Bell presentan una resolución completa al mes y todas deben estarlo a los 6meses, con o sin secuelas. Una parálisis que no mejora en 6 meses no es una parálisis de Bell5,8.
4. ¿Cuándo debemos consultar con Oftalmología?La mayoría de las parálisis faciales son transitorias y parciales, por lo que no suelen precisar control oftalmológico siempre que se hayan prescrito cuidados generales del ojo en forma de lágrimas artificiales y oclusión nocturna (pregunta 52). La valoración oftalmológica es recomendable en las parálisis faciales completas y definitivas. El cuidado del ojo es el aspecto más importante en una parálisis facial debido a las consecuencias que se derivan de una mala protección ocular. La queratopatía por exposición es la complicación más frecuente cuando los pacientes con parálisis facial llegan al oftalmólogo. Un ojo rojo persistente, escozor continuo o pérdida de agudeza visual hacen imprescindible una valoración oftalmológica. Esta debe ser urgente si aparece dolor en el ojo y preferente cuando la parálisis facial se asocia a cambios en la sensibilidad ocular, como en aquellos casos en los que se asocian las parálisis del v y el vii par9.
5. ¿Qué debe hacernos pensar que una parálisis facial es central?La presencia de factores de riesgo de enfermedad vascular cerebral (cardiopatías, alteraciones de la coagulación, enfermedad vascular periférica) y la edad avanzada son factores predisponentes para una parálisis central.
La parálisis facial periférica presenta afectación de todas las ramas del nervio. Por el contrario, la parálisis facial central afecta predominantemente a la musculatura de la mímica facial inferior, contralateral al lugar de instauración de la lesión. No se suelen afectar los músculos frontales y orbiculares de los párpados, o si lo hacen presentan una afectación mínima. Pero existen casos excepcionales en los que la parálisis facial puede afectar esos grupos musculares. En estos casos hay que tener en cuenta 2factores:
La parálisis de los músculos del entorno del ojo no suele tener la misma intensidad que la de los de la boca.
Es fundamental estudiar el resto de pares craneales, así como la función motora y sensitiva del resto del cuerpo, pues la parálisis facial central puede asociarse con frecuencia a alteraciones a estos niveles10.
6. ¿Qué signos deben hacernos pensar que una parálisis facial no es una parálisis de Bell?Parálisis progresiva en lugar de brusca, bilateral, empeoramiento a partir de la tercera semana o tras una mejoría inicial, ausencia de recuperación en 4 meses, parálisis recurrente en el mismo lado de la cara, debilidad asimétrica en las distintas zonas de la cara o combinación de signos de flacidez y espasmo en el mismo paciente11,12. En estos casos está indicada la realización de pruebas de imagen para descartar enfermedad tumoral del nervio facial (pregunta 13).
Si el paciente presenta dolor facial persistente en el contexto de una parálisis facial establecida, es importante descartar malignidad, especialmente en pacientes con antecedentes oncológicos13. En estos casos debe valorarse la biopsia del nervio facial si las pruebas de imagen son negativas14.
7. ¿Cómo debe tratarse una parálisis de Bell?Al margen de los cuidados del ojo (preguntas 4 y 52), el tratamiento de la parálisis de Bell se basa en el uso de corticoides15. Existen 2pautas de tratamiento avaladas en los últimos documentos de consenso: prednisona 50mg durante 10 días o prednisolona 60mg durante 5 días con pauta descendente de 10mg/día durante los 5 días siguientes, empezando el tratamiento en las primeras 72 h desde el inicio de la parálisis5,7. Otros autores recomiendan utilizar prednisona de 50mg durante 5 días y una pauta descendente los siguientes 5 días16. En la práctica clínica, una pauta sencilla consiste en utilizar prednisona ajustada a 1mg/kg/día durante 5 días con reducción progresiva de 10mg/día los días sucesivos hasta llegar a cero. A modo de ejemplo, en la tabla 2 mostramos la pauta a seguir para un paciente de 75kg de peso tratado con prednisona de 30mg. Se recomienda añadir protección gástrica durante el tratamiento con corticoides17. Los corticoides deben prescribirse con precaución en pacientes con antecedentes médicos de diabetes mellitus, úlcera gástrica o duodenal, hipertensión arterial mal controlada, insuficiencia renal, enfermedad hepática, glaucoma, embarazo, traumatismo craneal reciente o enfermedad psiquiátrica.
Ejemplo de pauta de corticoides
| Días de tratamiento | Prednisona 30 mg |
|---|---|
| Del 1.° al 5.° | 2 + 1/2 comprimidos (75 mg) |
| 6.° | 2 + 1/3 comprimidos (70 mg) |
| 7.° | 2 comprimidos (60 mg) |
| 8.° | 1 + 2/3 comprimidos (50 mg) |
| 9.° | 1 + 1/3 comprimidos (40 mg) |
| 10.° | 1 comprimido (30 mg) |
| 11.° | 2/3 comprimido (20 mg) |
| 12.° | 1/3 comprimido (10 mg) |
Existen presentaciones de prednisona de 30mg (p. ej., Dacortín®) en las que en un lado del comprimido existe una marca para dividirlo por la mitad (15-15) y en el otro lado existe otra marca para dividirlo en tercios (10-10-10). Con la pauta descrita harían falta 22 comprimidos y la caja trae 30 comprimidos.
El tratamiento con esteroides es efectivo si se inicia en las primeras 72 h desde el comienzo de la parálisis facial18. Aunque no existe evidencia, la mayoría de los autores lo realiza hasta 7 a 10 días desde el inicio19,20.
9. ¿Cuándo deben asociarse antivirales en una parálisis de Bell?El uso de antivirales es controvertido y en la actualidad no se recomienda de forma rutinaria en la parálisis de Bell. En la parálisis facial por herpes zóster existen varias pautas de tratamiento (pregunta 18). Hay que tener en cuenta que hasta un 30% de las parálisis por herpes zóster pueden presentarse sin vesículas (zóster sine herpete) por lo que ante una supuesta parálisis de Bell con parálisis facial completa desde el inicio, acompañada de mucho dolor, también estaría indicado el tratamiento con antivirales por la posibilidad de que se deba a un herpes zóster. Siempre debe asociarse a corticoterapia21,22.
10. ¿Cómo debe tratarse la parálisis de Bell durante el embarazo?La mayoría de los casos de parálisis de Bell en el embarazo se dan durante el tercer trimestre o en la primera semana tras el parto y, en general, el pronóstico es peor que en mujeres no embarazadas23. El tratamiento de elección son los corticoides en las pautas descritas previamente (pregunta 7). Si bien durante el tercer trimestre de embarazo pueden utilizarse corticoides de forma segura, para minimizar riesgos para el feto se recomienda utilizar prednisolona o metilprednisolona, ya que atraviesan la barrera placentaria en menor medida. La utilización de antivirales es controvertida y se debe valorar la relación riesgo-beneficio teniendo en cuenta la posibilidad de infección por herpes zóster. En cualquier caso, es recomendable la consulta a ginecología23,24.
11. ¿Cómo debe tratarse la parálisis de Bell en la infancia?En general, la parálisis de Bell tiene mejor pronóstico en la infancia que en los adultos, con mayores índices de recuperación espontánea (90% frente al 70% de los adultos)5,25. Se recomienda tratamiento con prednisolona 1mg/kg/día, 10 días, comenzando en las primeras 72 h. Si se sospecha infección por herpes zóster, se debe valorar la relación riesgo-beneficio de la utilización de antivirales26,27.
12. ¿Cuál es el papel de las terapias alternativas como la acupuntura, la homeopatía o las vitaminas?Existen multitud de recomendaciones procedentes de terapias alternativas como la acupuntura, la homeopatía o el uso de vitaminas. Sin embargo, estas no ofrecen una evidencia científica basada en ensayos clínicos o en estudios calificados como de alta evidencia. Las revisiones sistemáticas realizadas sobre la efectividad de las terapias alternativas en el tratamiento de la parálisis facial concluyen que el nivel de evidencia sobre su utilidad es muy bajo28,29.
13. ¿Cuándo debemos pedir pruebas de imagen ante una parálisis de Bell?Ante un cuadro clínico indicativo de una parálisis de Bell o una parálisis por herpes zóster no se deben pedir pruebas de imagen. En la parálisis de Bell la resonancia magnética (RM) suele mostrar una captación de contraste (gadolinio) en el trayecto laberíntico del nervio, y a veces en las porciones intracanalicular y timpánica. En el caso de la parálisis por herpes zóster, la zona de captación suele ser aún mayor30. Si bien la captación del nervio en una parálisis facial indica simplemente que existe inflamación, su constatación nos obliga a realizar un seguimiento periódico con nuevas RM hasta que desaparezca la captación, pues puede confundirse con un tumor del nervio facial. Esta captación puede existir incluso en personas sin parálisis31. Por ello, solamente deben pedirse pruebas de imagen si existen signos o síntomas que sugieran que no se trata de una parálisis de Bell y sospechamos un tumor del nervio facial (pregunta 6).
La tomografía computarizada (TC) y la RM cerebrales son muy poco sensibles para descartar un tumor del nervio facial. Si lo sospechamos, debemos pedir una TC de peñascos y una RM con gadolinio para estudio de recorrido de nervio facial que incluya secuencias cerebrales centradas en la región de ángulo pontocerebeloso-conducto auditivo interno (APC-CAI) y secuencias de cuello que incluyan la glándula parótida.
14. ¿Cuándo debemos pedir pruebas neurofisiológicas ante una parálisis de Bell?Los principales estudios neurofisiológicos del nervio facial son la electroneurografía (ENG) y la electromiografía (EMG). En la ENG, tras la estimulación del nervio facial en su salida por el orificio estilomastoideo, se obtiene el potencial motor evocado, en el que valoramos amplitud, duración y latencia. La amplitud es proporcional al número de fibras musculares activadas, por lo que expresa la función de los axones que las inervan. Se compara la respuesta con la del lado sano. En la EMG se estudia la actividad del músculo en reposo y durante la contracción voluntaria. En condiciones normales, en un músculo en reposo no se registra actividad eléctrica (silencio eléctrico). Durante la contracción voluntaria las unidades motoras (UM) se activan de forma creciente con la intensidad del esfuerzo: aumenta la frecuencia de descarga y se reclutan nuevas UM. Debemos recordar que el comienzo de la denervación en el EMG se produce aproximadamente a las 3semanas, siempre que se haya producido lesión axonal. En la neurapraxia no se produce denervación, solamente existe un bloqueo de la conducción-desmielinización.
Si la parálisis de Bell es incompleta, los estudios neurofisiológicos no aportan ningún valor pronóstico, por lo que no están indicados5. Si la parálisis de Bell es completa, la ENG en las primeras 2semanas (a partir del tercer día) tiene valor pronóstico32,33 y puede indicar un tratamiento rehabilitador precoz para minimizar las secuelas a largo plazo, si bien por cuestiones operativas no es una exploración que se realice de forma rutinaria en la mayor parte de los hospitales. Algunos autores se basan en este resultado para indicar un tratamiento quirúrgico (descompresión del nervio facial), pero en general es una medida poco respaldada en nuestros días (pregunta 17). Si el paciente continúa con una parálisis completa, la EMG realizada a partir de las 3 semanas nos indicará si existe lesión axonal y si existen signos de recuperación (potenciales polifásicos) con la idea de valorar un eventual tratamiento rehabilitador34.
15. ¿Cuándo se deben hacer ejercicios en casa, masticar chicle y gesticulaciones frente al espejo?Cuando el paciente presenta una parálisis facial completa debe abstenerse de intentar movilizar el lado paralizado. Es útil ponerle el ejemplo de la pierna escayolada, que no se moviliza hasta que se retira la escayola y comienza la rehabilitación. La realización de ejercicios sin supervisión médica en la fase de parálisis (hinchar globos, masticar chicle) no aporta ningún beneficio y facilita la reinervación aberrante y el reclutamiento de UM en exceso, favoreciendo patrones anormales de movimiento y la aparición de sincinesias, movimientos en masa y áreas hipertónicas cuando se produce la reinervación35,36. Del mismo modo, debe evitarse en todo momento la electroestimulación (pregunta 54).
16. ¿Cuándo debemos mandar a rehabilitación un paciente con parálisis de Bell?No existen unos criterios específicos pero se aconseja en aquellos casos en los que clínicamente o por el estudio electrofisiológico se prevé una probabilidad alta de presentar secuelas: ENG indicativa de axonotmesis, gradación en la escala de House-Brackmann superior o igual a iii37 o una puntuación de Sunnybrook inferior a 60-70 al mes del inicio de la parálisis38.
17. ¿Existe indicación actualmente de descompresión quirúrgica en una parálisis de Bell?Si bien en el siglo pasado (1960-1990) se planteaba con frecuencia la descompresión quirúrgica de la parálisis de Bell, en la actualidad quedan pocos que la defiendan. Existe consenso sobre la poca efectividad tanto de la descompresión quirúrgica más allá de los 2meses desde la instauración de la parálisis, como del abordaje transmastoideo, por su incapacidad para exponer la porción laberíntica del nervio. Sin embargo, existen autores que aún defienden el tratamiento quirúrgico de la parálisis de Bell cuando la ENG en las 2primeras semanas muestra una pérdida de activación superior al 90%, siempre que la descompresión incluya el segmento laberíntico del nervio facial y se realice en las primeras 2semanas. El principal argumento a favor de esta actitud es que menos del 50% de los pacientes que presentan estos signos de mal pronóstico llegan a tener un grado i o ii de House-Brackmann39-41. Las revisiones sistemáticas sobre los trabajos que estudian la efectividad de este tipo de tratamiento no son concluyentes debido a que la calidad de esos estudios es mejorable42.
18. ¿Cómo debe tratarse una parálisis facial por zóster ótico?El síndrome de Ramsay Hunt se debe tratar con corticoides utilizando pautas similares a las descritas previamente para la parálisis de Bell (pregunta 7), a los que se deben acompañar antivirales y analgésicos. Por vía oral, utilizamos aciclovir (800mg cada 4 h omitiendo la dosis nocturna), valaciclovir (1.000mg cada 8 h) o famciclovir (500mg cada 8 h), siendo más cómoda la posología de los 2últimos, durante 7 días. En pacientes inmunocomprometidos, con dolor severo, o con afectación de otros pares craneales por infección visceral, diseminada u ocular se recurre a aciclovir intravenoso (10mg/kg cada 8 h durante 7 días)43,44. Se deben añadir sedantes vestibulares si existe vértigo asociado.
19. ¿Cómo deben tratarse las lesiones cutáneas de un zóster ótico?Los antivirales por vía oral a las dosis mencionadas anteriormente son también el tratamiento de elección para las lesiones cutáneas. Se deben administrar lo antes posible, idealmente dentro de las primeras 72 h. Las vesículas y las costras deben mantenerse limpias y secas para evitar sobreinfección bacteriana, pudiendo aplicarse vendaje oclusivo antiadherente o gasas estériles. No existe consenso sobre la aplicación de otros tratamientos tópicos45.
20. ¿Cuál debe ser la actitud ante una parálisis facial bilateral?La causa más frecuente de parálisis facial bilateral (PFB) es la parálisis de Bell, que representa aproximadamente un tercio de las PFB46. Sin embargo, ante una PFB debe practicarse un abordaje multidisciplinario para descartar la presencia de una enfermedad grave. Debe incluir una completa historia clínica y exploración física, estudios en sangre periférica y de diagnóstico por la imagen16 (tabla 3). Otras causas frecuentes de PFB son: enfermedad de Lyme, síndrome de Moebius, síndrome de Guillain-Barré, neoplasias (neurofibromatosis tipo 2 [NF-2]), traumatismos y malformaciones vasculares46.
Pruebas complementarias en una parálisis facial bilateral
| Hematología | Hemograma completo, VSG, estudio de coagulación |
| Bioquímica | Bioquímica básica, ionograma, perfil férrico, magnesio, TSH y T4 |
| Microbiología | FTA-ABS/VDRL, rubéola, toxoplasma, Brucella, Borrelia, VHB, VIH, herpes virus (VHS-1, VHS-2, CMV, VEB, VVZ, VHS-6) |
| Inmunología | PCR, ANA, ANCA, ECA, FR, SSA/SSB,anticuerpos antifosfolípido, porfobilinógeno |
| Otros | Radiografía de tórax (si existe sospecha de sarcoidosis),estudio de LCR (si existe sospecha meningitis) |
ANA: anticuerpos antinucleares; ANCA: anticuerpos anticitoplasma de neutrófilos; FTA-ABS/VDRL: test diagnósticos para sífilis; CMV: citomegalovirus; EBV: virus de Epstein-Barr; FR: factor reumatoide; LCR: líquido cefalorraquídeo; PCR: reacción en cadena de la polimerasa; SSA/SSB: anticuerpos anti-Ro/anti-La; TSH: tirotropina; T4: tiroxina; VHB: virus de la hepatitis B; VHS: virus herpes simple; VIH: virus de la inmunodeficiencia humana; VSG: velocidad de sedimentación globular; VVZ: virus de la varicela zóster.
Uno de los aspectos clave para evitar una lesión del nervio facial es localizarlo en todas las intervenciones en las que puede estar en riesgo. Si bien la monitorización del nervio puede ser de gran ayuda, el conocimiento de las referencias anatómicas del nervio facial en cada región intervenida y su localización son cruciales (tabla 4)47.
Referencias anatómicas para localizar el nervio facial
| Referencias anatómicas para localización del nervio facial | |
|---|---|
| APC-CAI | El nervio facial sale del tronco por delante e inferiormente al viii par craneal. En el fondo del CAI se sitúa en posición anterosuperior |
| Oído medio | El nervio facial transcurre superior a la ventana oval e inmediatamente medial y superior al proceso cocleariforme (pico de cuchara) |
| Mastoides | Conducto semicircular horizontal y yunqueCuerda del tímpanoRanura digástrica |
| Parótida | Inserción del músculo digástricoPointer (cartílago del trago)Sutura timpanomastoidea |
APC-CAI: ángulo pontocerebeloso-conducto auditivo interno.
La monitorización del nervio facial es recomendable en todas aquellas cirugías en las que se espere manipular el propio nervio o exista riesgo de dañarlo. Su efectividad minimizando los daños es clara. En toda cirugía de base de cráneo, en la cirugía del oído interno (tanto en su parte coclear como en su parte laberíntica), en la cirugía de oído medio en la que existe un riesgo de daño evidente del nervio facial (como en los colesteatomas que afectan al trayecto del nervio) y en la cirugía parotídea se recomienda el uso de la monitorización48,49. Uno de los aspectos más importantes de la monitorización es la curva de aprendizaje. Para que sea útil en un caso complejo, el cirujano debe estar acostumbrado al funcionamiento habitual del equipo en casos sencillos. Lógicamente, la monitorización no es útil si el paciente tiene una parálisis facial completa.
23. ¿Cómo debemos evaluar la función facial tras una intervención quirúrgica?El momento en que somos conscientes de que un paciente presenta una parálisis facial inesperada tras una intervención suele ser angustioso para el cirujano50. Debemos mantener la cabeza fría y tener claras las pautas a seguir. Lo primero es explorar la función facial, mejor con algún compañero que tenga más experiencia. En función del nivel de consciencia del paciente, lo haremos en el quirófano, en la reanimación o ya en la planta. Hay que considerar la posibilidad de que la parálisis se haya producido por la anestesia local. La infiltración del CAE o de la región retroaricular puede difundir la anestesia local hacia el facial extratemporal. En estos casos, la parálisis desaparecerá en 4-5 h. Si no es así, debemos ver si la parálisis es o no completa50. Esto a veces no es fácil. En pacientes mayores, la parálisis suele ser desfigurante, pero en jóvenes, y aún más en niños, suele mantenerse el tono de reposo y la valoración del cierre del ojo puede ser engañosa. Uno de los errores más frecuentes en el explorador menos experimentado es la valoración del cierre ocular. Hay pacientes con parálisis completa que consiguen cerrar el ojo por relajación del músculo elevador del párpado superior, sin que tengan una verdadera contracción del orbicular de los ojos. En estos casos, es habitual valorar como incompleta una parálisis completa.
24. Cuando un paciente se despierta con una parálisis completa: ¿en qué casos y cuándo se debe realizar una revisión quirúrgica?Depende de varios factores, entre ellos el tipo de intervención quirúrgica. El mecanismo de la parálisis es muy variable según la zona lesionada4. Como regla general, seremos conservadores con las parálisis incompletas o diferidas, puesto que no es previsible que el nervio esté seccionado. Por el contrario, es recomendable revisar quirúrgicamente las parálisis completas e inmediatas, si bien la decisión debe ser individualizada. En el caso de la cirugía del APC, no suele aplicarse esta regla. Si el nervio facial se secciona, lo habitual es repararlo intraoperatoriamente. Si está íntegro, la actitud habitual es esperar unos meses (pregunta 26). Tras una cirugía de oído, la causa de la parálisis facial suele estar relacionada con la manipulación del segmento timpánico, muchas veces dehiscente, o con el fresado del segundo codo o el segmento mastoideo. Suele ocurrir tras una timpanoplastia, una mastoidectomía, aunque también puede ocurrir tras una canaloplastia, en la que el fresado se realiza sin referencias anatómicas del nervio facial y este puede transcurrir lateral al annulus timpánico en lugar de medial, que es lo habitual. Es más frecuente tras cirugías de revisión. Si la parálisis es completa unas horas después de la intervención y el cirujano no tiene muy claro cómo y dónde se ha podido lesionar el nervio, la indicación de revisión quirúrgica es clara y no debe demorarse. Lo más sensato es volver a abrir la incisión y revisar el campo quirúrgico, identificando todo el trayecto del nervio que haya podido estar expuesto durante la intervención51 (pregunta 25). La grabación de las cirugías para su posterior visualización, autocrítica y ayuda por parte de un cirujano otológico experto puede ser de utilidad en caso de lesión accidental del nervio facial. Una parálisis facial completa tras una parotidectomía por un proceso benigno es poco habitual. Es más frecuente en cirugías de revisión, tras una parotidectomía total o en el contexto de un proceso maligno. Si el nervio se secciona durante la intervención, debe realizarse la reparación inmediata del tronco o de las ramas. Si el cirujano ha localizado el tronco y las ramas del nervio y tiene la seguridad de que no están seccionadas, es razonable controlar la evolución de la parálisis antes de indicar una revisión quirúrgica52.
Al margen del tipo de intervención y de la localización de la lesión del nervio, en todo momento debemos asumir nuestra responsabilidad y transmitir información clara y concisa al paciente y sus familiares sobre la evolución previsible de la parálisis. Es recomendable realizar la intervención con un cirujano que tenga experiencia en reconstrucción del nervio facial.
25. ¿Si el nervio está lesionado en el oído, es mejor descompresión o injerto?En una revisión quirúrgica, el abordaje suele ser el mismo, si bien puede estar condicionado por la audición del paciente (debemos confirmar que el paciente tiene una audiometría previa).
Si el nervio está lesionado (inflamado, edematoso) pero con nula o mínima pérdida de sustancia, es suficiente con exponerlo. Debemos identificar la porción lesionada y descomprimir suficiente trayecto del nervio, proximal y distal a la zona lesionada, para minimizar la isquemia asociada a la inflamación del mismo. Solamente se debe retirar la cobertura ósea, no debemos abrir el epineuro, puesto que su conservación facilitará la regeneración axonal51.
Si el nervio está seccionado, hay que restablecer su continuidad. Es fundamental que la reconstrucción no tenga tensión alguna, por lo que suele ser necesario interponer un injerto (pregunta 47). Si la reparación se realiza en el hueso temporal, no es necesario utilizar suturas, solamente aproximar los bordes y colocar unas gotas de pegamento de fibrina. En caso contrario, utilizaremos puntos sueltos de monofilamento de 9/0.
Probablemente, la decisión más difícil se presenta cuando el nervio facial está parcialmente seccionado. En estos casos, el cirujano debe decidir si descomprimirlo y recolocar los axones o bien seccionarlo completamente y colocar un injerto. En la duda, es preferible la segunda opción52.
26. ¿Cuál debe ser la actitud cuando, tras la exéresis de un neurinoma del viii par, el nervio facial se conserva anatómicamente pero no obtenemos respuesta al estimularlo?Lo previsible es que el paciente tenga una parálisis facial completa. La actitud tradicional ha sido esperar 12 meses y si no hay signos de recuperación espontánea, plantear una técnica de reinervación, habitualmente con nervio hipogloso o maseterino. Cada vez más estudios recomiendan acortar este periodo a 6 meses cuando no existen signos clínicos ni electrofisiológicos (EMG) de reinervación53,54.
27. ¿Qué importancia tiene la dirección de la fractura (longitudinal/transversal) en una fractura de peñasco?Las fracturas transversales afectan frecuentemente a la cóclea, el vestíbulo y los conductos semicirculares. Hasta el 50% asocia parálisis facial, la mayoría por lesión en la porción laberíntica del nervio. En las fracturas longitudinales suele haber dislocación de la cadena osicular, presentando parálisis facial en un 20% de los casos, principalmente por afectación del ganglio geniculado55,56. Sin embargo, muchas veces las fracturas son mixtas o no es fácil determinar la dirección de la fractura.
28. ¿En qué casos de parálisis facial en el contexto de una fractura de peñasco se debe realizar una revisión quirúrgica y hasta cuánto tiempo se puede esperar?Tradicionalmente, se ha recomendado revisar quirúrgicamente los pacientes con parálisis completa e inmediata, y adoptar una actitud conservadora en las incompletas o diferidas57. Si el trayecto de la fractura en la TC atraviesa el recorrido intrapetroso del nervio facial o se aprecia la impactación de esquirlas óseas en el trayecto del nervio, y la ENG muestra una pérdida de activación mayor del 90% en comparación con el lado sano, la probabilidad de que exista una sección del nervio es mayor y la indicación de revisión quirúrgica es aún más clara58. Muchas veces el estado general y las lesiones asociadas del paciente como consecuencia del traumatismo condicionan el momento de la intervención, que en ocasiones puede demorarse hasta 2-3 meses58,59. La tendencia actual es más conservadora, especialmente en las fracturas longitudinales no desplazadas60.
29. ¿Cómo debe manejarse una parálisis facial en el contexto de una otitis media aguda?Se deben prescribir antibióticos orales para tratar la otitis media, pudiendo requerir una miringotomía (con o sin inserción de tubo de drenaje) si la membrana timpánica no se ha perforado espontáneamente. Solo los casos que no mejoran precisarían una mastoidectomía o eventualmente una descompresión quirúrgica del nervio facial61.
30. ¿Cómo debe manejarse una parálisis facial en el contexto de una otitis media crónica o un colesteatoma?Se ha de realizar una descompresión del nervio por vía transmastoidea, con eliminación del tejido de granulación existente o el colesteatoma. Debe realizarse lo antes posible, independientemente de la severidad de la parálisis facial, la presencia o no de colesteatoma, el tipo de inicio (súbito o gradual), la duración de la parálisis, la edad del paciente o la existencia de antecedentes de cirugía otológica previa62-64.
31. ¿Cómo debe manejarse una parálisis facial en el contexto de una otitis externa maligna?La otitis externa maligna es una osteomielitis del hueso temporal propia de pacientes diabéticos e inmunodeprimidos. Cursa con otalgia severa, otorrea, erosión progresiva de la base del cráneo y afectación de pares craneales incluyendo el nervio facial. El diagnóstico se basa en técnicas de neuroimagen (TC, RM), siendo también útil la gammagrafía con tecnecio; la gammagrafía con indio o galio ayuda a determinar la duración del tratamiento. La emergencia de cepas de Pseudomonas aeruginosa resistentes a fluoroquinolonas indica la antibioterapia por vía intravenosa basada en los resultados del antibiograma, habitualmente con ceftazidima y ciprofloxacino, durante 6 semanas. La cirugía se reserva para casos con secuestros óseos o abscesos que impiden la llegada del antibiótico al hueso65,66.
32. ¿Cómo debe manejarse un paciente con una sospecha de tumor de nervio facial con una función facial normal?Los tumores del nervio facial incluyen schwannomas, hemangiomas y otras lesiones menos frecuentes. La actitud es similar en todos ellos. Si el paciente presenta una función facial normal, se recomienda una actitud expectante mientras no empeore hasta un grado iii o incluso iv de House-Brackmann. Esta premisa se basa en que la exéresis del tumor con reconstrucción del nervio conseguirá ese resultado en el mejor de los casos11.
Una excepción a esta regla son los schwannomas voluminosos con origen en el trayecto extratemporal del nervio. En estos casos, la deformación de la cara por el tumor justifica el tratamiento quirúrgico. En ocasiones, es posible preservar la integridad del nervio, a diferencia de los tumores del trayecto intratemporal. Del mismo modo, algunos tumores intratemporales voluminosos con extensión a la fosa media o la fosa posterior pueden tener indicación quirúrgica por su tamaño, al margen de la función facial.
Determinar el tiempo exacto de evolución de la parálisis es un problema habitual. Mientras que en los casos de traumatismo o iatrogenia es fácil establecer el momento de inicio, los pacientes con tumores del nervio facial suelen tener paresias de larga evolución, clínica de espasmo y flaccidez coincidentes, siendo difícil establecer el tiempo exacto de parálisis completa, lo que dificulta la toma de decisiones.
33. ¿Qué función desempeña la radioterapia en los tumores del nervio facial?El tratamiento de elección para las tumoraciones del nervio facial es un tema todavía hoy de debate. Las opciones incluyen la observación, la descompresión o la resección microquirúrgica, la radiocirugía y la radioterapia fraccionada. La elección depende de la presentación clínica (grado de parálisis facial y función auditiva), el tamaño y la localización de la tumoración. En los pacientes asintomáticos, la opción más aceptada es la observación.
En los últimos años se ha incrementado el uso de la radiocirugía estereotáxica para los tumores pequeños con buena función facial. La radioterapia estereotáxica fraccionada es una alternativa para tumoraciones de mayor tamaño y buena función facial, reduciendo la tasa de toxicidad. Ambas técnicas presentan buenos resultados en control del tamaño tumoral, observándose una reducción en el 30-40% de los casos con la estabilización o mejoría de la función facial. Las complicaciones son infrecuentes y habitualmente transitorias67. La microcirugía suele reservarse para casos con parálisis facial mayor o igual a iii en la escala de House-Brackmann67-71.
34. ¿Cuándo debe reconstruirse el nervio facial en los tumores malignos de parótida?Como regla general, siempre. Si la extensión del tumor y el estado general del paciente son favorables para indicar la exéresis quirúrgica, la reconstrucción del nervio facial debe plantearse en la misma intervención72,73. La exposición del facial mastoideo combinada con la parotidectomía permite completar la exéresis tumoral incluyendo el orificio estilomastoideo en la pieza quirúrgica, así como la toma de biopsias intraoperatorias para descartar invasión tumoral a este nivel. Además, facilita la reconstrucción del nervio facial con un injerto de nervio en el lecho óseo de la mastoides. El tratamiento del carcinoma adenoide quístico supone un reto añadido por su capacidad de infiltración perineural y la posibilidad de encontrar metástasis discontinuas en el nervio facial74,75.
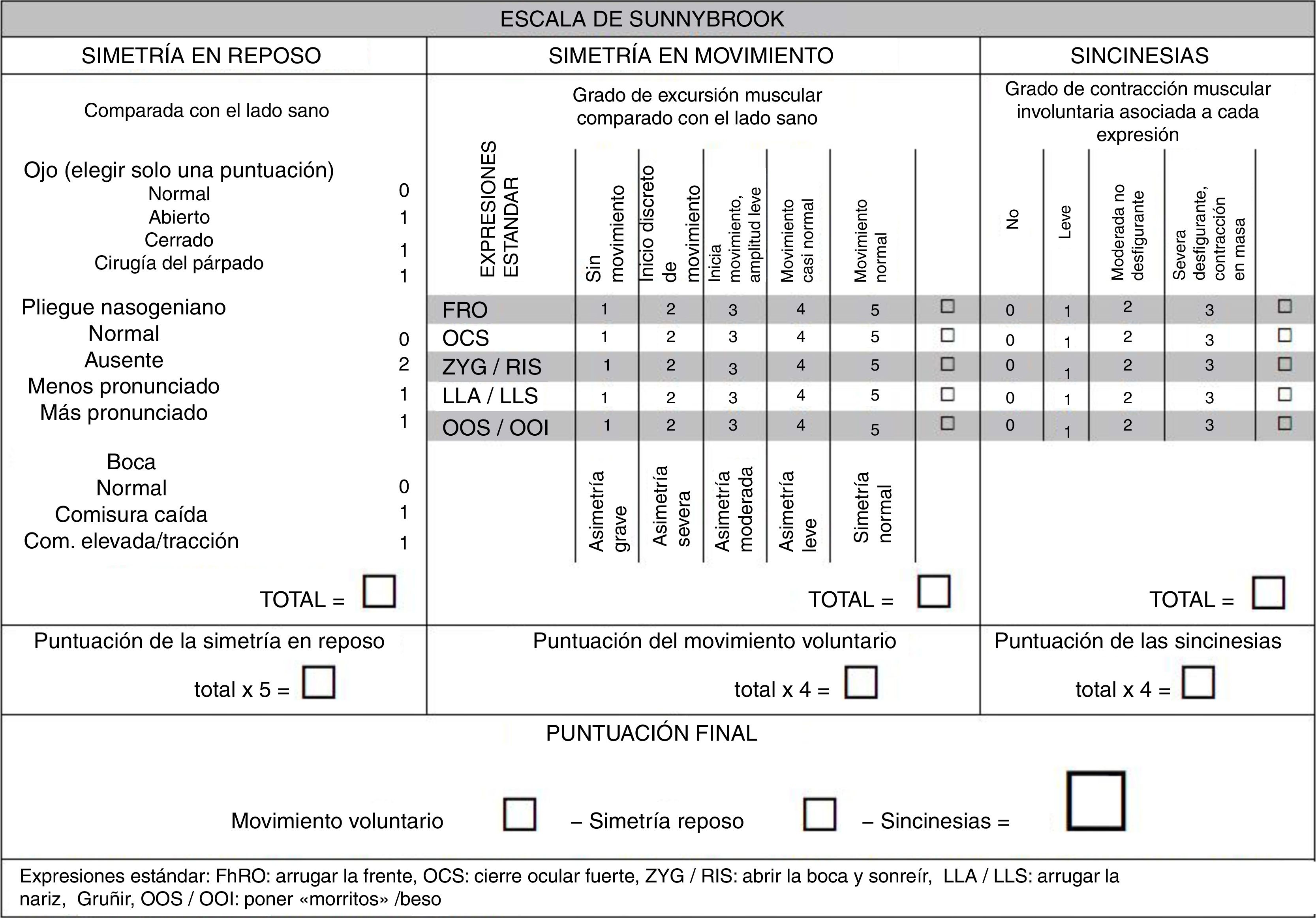
35. ¿Cómo debe evaluarse la función facial? ¿Cuál es la mejor escala?Se recomienda utilizar escalas que permitan valorar, con poca variabilidad entre los observadores, la función estática y dinámica de cada rama del nervio, la presencia de sincinesias y la evolución de la parálisis en el tiempo o tras el tratamiento76. Aunque la escala de House-Brackmann (tabla 5) se creó específicamente para valorar la función facial tras la cirugía del neurinoma del viii par, sigue siendo la más utilizada entre los especialistas en ORL para cualquier tipo de parálisis facial77. Establece una categorización de i a vi otorgando un grado i a la función normal y vi a la parálisis completa, pero es poco sensible a los cambios producidos durante la recuperación de la función facial y no valora la presencia de sincinesias. Los médicos rehabilitadores suelen emplear la escala de Sunnybrook (fig. 1)78. Su puntuación final es continua, de 0 a 100, siendo 0 la ausencia de función y 100 la función normal. Esta escala valora de manera independiente la simetría en reposo, en movimiento y la presencia de sincinesias. El resultado se obtiene restando a la puntuación del movimiento voluntario la puntuación de la simetría en reposo y la puntuación sincinética. Permite evaluar la aparición de secuelas y al ser una escala continua es muy sensible a los cambios producidos en la evolución de la parálisis.
Más recientemente, se ha propuesto el sistema de gradación eFACE76,79,80. Es una escala analógica-visual en formato digital con 15 medidas (4 estáticas, 7 dinámicas y 4 para evaluar sincinesias) (fig. 2). En cada parámetro evaluado cero es la peor puntuación y 100 implica normalidad. Existen algunas medidas en las que el estado patológico puede ser por exceso y no solo por defecto; en estos casos, la escala mide entre cero y 200, por ejemplo, la altura de la ceja en reposo (ptosis < 100, normal = 100, elevada > 100). Las puntuaciones de esta escala se pueden valorar de manera numérica y de manera gráfica, por apartados y con una puntuación global. La posibilidad de evaluar de manera individualizada apartado por apartado permite valorar, por ejemplo, el resultado de cirugías encaminadas a mejorar la situación en reposo.
Al margen de la escala utilizada, es importante sistematizar la exploración. Se han propuesto 10 expresiones estándar para evaluar la expresión facial, útiles para documentar la función con fotografías (tabla 6). Además de la evaluación fotográfica es útil documentar con vídeo la movilidad espontánea, las sincinesias y el habla. Para ello pediremos al paciente que repita palabras o frases con fonemas oclusivos (p, b, t, d) y le mostraremos alguna imagen o vídeo gracioso para valorar la sonrisa espontánea81,82.
Expresiones estándar para valorar la función facial
| Expresiones estándar para valorar función facial | |
|---|---|
| 1. Reposo | 6. Sonrisa con boca cerrada |
| 2. Elevar cejas | 7. Sonrisa enseñando dientes |
| 3. Cerrar ojos suavemente | 8. Fruncir labios («morritos») |
| 4. Cerrar ojos fuerte | 9. Decir «iiiiiii» con dientes cerrados |
| 5. Arrugar nariz | 10. Vista nasal inferior |
El factor pronóstico más importante en la recuperación de la función facial tras un procedimiento reconstructivo es el tiempo de evolución. Cuanto antes se reconstruya el nervio, mejores son los resultados.
En las primeras horas o días tras una sección del nervio, lo ideal es realizar una reconstrucción del mismo mediante una sutura directa o interponiendo un injerto. Si por algún motivo la reparación directa no es posible (extremo proximal del nervio no accesible, por ejemplo, tras cirugía del APC) o ante un nervio anatómicamente conservado en el que no se produce recuperación espontánea después de unos meses, se debe recurrir a técnicas de reinervación.
En general, por debajo de un año de evolución (incluso 2años) deben intentarse técnicas de reinervación con diferentes nervios donantes (facial contralateral, hipogloso, maseterino).
Por encima de los 2años se produce atrofia de la musculatura facial y es necesario aportar tanto nervio como músculo, por lo que se recurre a transposiciones musculares o injertos microvascularizados83.
Además de las técnicas quirúrgicas descritas, existen procedimientos estáticos para mejorar diferentes zonas de la cara, que pueden realizarse en cualquier momento de la evolución de la parálisis. Algunos de ellos son: reparación de la ptosis de la ceja, colocación de pesas palpebrales de oro o platino, cirugía palpebral, reconstrucción de la válvula nasal, ritidectomía del sistema musculoaponeurótico superficial (SMAS), suspensión estática con fascia o lipoinfiltración facial84.
37. ¿Por qué deben tratarse los casos complejos en el contexto de una unidad de parálisis facial?La superespecialización y el trabajo multidisciplinar son las claves necesarias para ofrecer al paciente un tratamiento de excelencia. Una unidad de parálisis facial está formada por diferentes especialistas que aportan su conocimiento de cada una de las parcelas correspondientes al nervio facial, muchas veces una combinación de técnicas de diagnóstico, tratamiento quirúrgico y rehabilitación. Se trata de buscar para cada paciente la mejor solución, muchas veces aportada por diferentes especialistas, al contrario de la visión clásica de adaptar la enfermedad del paciente a la técnica que un especialista domina85,86.
38. ¿Cuándo debemos pedir pruebas neurofisiológicas ante una parálisis facial establecida?El estudio neurofisiológico distingue neurapraxia (bloqueo de la conducción-desmielinización) de axonotmesis (pérdida de axones), pero no entre axonotmesis y neurotmesis (no nos puede confirmar si un nervio está seccionado o no). Esto se debe a que las capas que rodean a los axones no transmiten eléctricamente. Al no ser un tejido eléctricamente activo, la neurotmesis aparece como una axonotmesis completa.
En la pregunta 14 se explican las aplicaciones de los estudios neurofisiológicos en la parálisis de Bell. Otras aplicaciones del estudio neurofisiológico son:
- –
Parálisis traumáticas: la ENG en las primeras semanas apoya la indicación quirúrgica si existe pérdida de activación mayor del 90% del lado enfermo comparado con el sano (pregunta 38). Es una técnica útil a partir de las 48-72h desde el traumatismo, pues es el tiempo que tarda en comenzar la degeneración walleriana3.
- –
Tras una parálisis iatrogénica con nervio en principio íntegro, la ENG en las primeras 3 semanas es un factor pronóstico que puede indicar una revisión o reconstrucción del nervio, si bien no puede asegurarnos si el nervio está íntegro. Si se decide una actitud expectante, la EMG es útil en el control de la reinervación espontánea, a partir de las 3 semanas.
- –
Tras la reconstrucción del nervio facial (directa o con injerto), esperaremos una recuperación espontánea que se manifestará clínicamente y en la EMG. Si no es así tendremos que recurrir lo antes posible a una técnica de reinervación con nervio donante (hipogloso o maseterino). La EMG es útil para complementar el seguimiento clínico de cualquier técnica de reinervación.
- –
En parálisis de 1-2 años de evolución la EMG puede indicarnos si la musculatura es aún viable para un procedimiento de reinervación (inicialmente por la presencia de potenciales de fibrilación, y cuando estos desaparecen, por la actividad eléctrica generada al insertar o movilizar la aguja en el músculo). Si, por el contrario, indica que existe atrofia muscular, deberemos recurrir a transposiciones musculares o injertos microvascularizados (pregunta 43).
- –
Cuando se valora un procedimiento de reinervación, la EMG puede valorar otros nervios donantes, como el maseterino o el hipogloso, que pueden estar lesionados, especialmente en casos de NF-2 o tumores de base de cráneo34.
En cualquier caso, los resultados de las pruebas neurofisiológicas tienen que valorarse en el contexto de la situación clínica del paciente y no deben considerarse absolutos.
39. ¿Qué factores debemos considerar para elegir la técnica de reinervación?Los principales nervios donantes son el hipogloso, el maseterino y el facial contralateral. La mayor parte de las técnicas de reinervación con nervio donante utilizan el nervio hipogloso o el maseterino. La elección de uno u otro suele estar condicionada por las preferencias del cirujano más que por los aspectos clínicos87. Recientemente, se ha empezado a combinar ambos nervios donantes, hipogloso y maseterino, en el mismo paciente88.
El uso del nervio facial contralateral está condicionado por el tiempo de evolución de la parálisis. Para llegar desde el lado sano hasta el paralizado se requiere un injerto (largo) de nervio sural. El impulso nervioso tarda varios meses en atravesar este injerto, por lo que como técnica aislada solamente es útil cuando se realiza de forma precoz tras una sección del nervio facial en una zona poco accesible (p. ej., el APC en la cirugía del neurinoma del viii par) y el nervio no se reconstruye intraoperatoriamente.
40. ¿Qué ventajas e inconvenientes tiene la anastomosis hipogloso-facial?El uso del nervio hipogloso (anastomosis hipogloso-facial) aporta un buen tono de reposo, que se consigue en el 90% de los pacientes, y una sonrisa social aceptable. Puede asociarse a un injerto cruzado de nervio sural para conseguir una sonrisa emocional. Su principal inconveniente es la atrofia de la hemilengua asociada a la técnica clásica, en la que se secciona la totalidad del nervio. La anastomosis término-lateral o hemitérmino-terminal requiere utilizar el nervio facial intratemporal, que se sutura a la mitad del nervio hipogloso, permitiendo la conservación de la función lingual en la práctica totalidad de los casos89,90. Una opción intermedia entre la técnica clásica y la término-lateral es la llamada «jump anastomosis», en la que se interpone un injerto de nervio auricular mayor entre el facial extratemporal y el hipogloso seccionado parcialmente. En general, la sección parcial del hipogloso es muy bien tolerada por los pacientes, habiéndose descrito incluso la sección parcial bilateral91.
41. ¿Qué ventajas e inconvenientes tiene la anastomosis maseterino-facial?El nervio maseterino se encuentra muy próximo a las ramas bucal o cigomática del nervio facial, lo que permite realizar una sutura directa sin necesidad de interponer un injerto53. En comparación con el hipogloso, los pacientes intervenidos con una anastomosis maseterino-facial obtienen menor tono de reposo y menos contracciones en masa, especialmente cuando se comparan con la técnica de hipogloso clásica (no con las técnicas de sección parcial del hipogloso). Una de las mayores ventajas del uso del maseterino es la mayor excursión de la comisura bucal, lo que genera una sonrisa con mayor recorrido. El tiempo hasta el comienzo de la reinervación es menor en el caso del maseterino (3-4 meses) en comparación con el hipogloso (8-10 meses). La localización del nervio maseterino es algo más dificultosa que la del nervio hipogloso. La morbilidad del procedimiento es mínima, con algunos casos descritos de disfunción de la articulación temporomandibular.
42. ¿Qué ventajas e inconvenientes tiene la reinervación cruzada del nervio facial?La reinervación con los nervios hipogloso o maseterino consigue una sonrisa social aceptable. Para obtener una sonrisa emocional (espontánea) con un procedimiento de reinervación, el impulso debe llegar al lado paralizado desde el lado sano. La conexión entre ambos lados hace que el paciente sonría con el lado paralizado cuando lo hace con el sano, obteniendo una sonrisa emocional más o menos simétrica. Esto se consigue mediante un injerto cruzado (cross-face) de nervio sural, que se sutura a una rama bucal en el lado sano y se pasa por debajo del labio hasta el lado paralizado, donde se sutura a una rama bucal. Este procedimiento puede hacerse en uno o 2tiempos. La principal limitación de esta técnica es el periodo de hasta 9 meses que tardan los axones en atravesar los 15-20cm de distancia entre ambos lados de la cara, así como el reducido número de axones (20-50%) que llegan al injerto de nervio distal72, con lo que la actividad motora puede verse reducida. Para solucionar este problema, puede utilizarse el nervio hipogloso como «baby-sitter»92. De este modo, combinando los 2procedimientos se consigue una reinervación más rápida con el hipogloso mientras llegan los axones del injerto cruzado.
43. ¿Cómo debe plantearse el tratamiento de una parálisis facial de larga evolución?A partir de los 2o 3años de parálisis completa, la atrofia muscular progresiva con pérdida de UM impide que sean efectivas las técnicas de reinervación con nervio donante (hipogloso o maseterino). En estos casos, además de asegurar un cierre palpebral y una protección ocular adecuados, se emplean 2grupos de técnicas principales, los injertos microvascularizados y las transposiciones musculares.
El injerto microvascularizado más empleado es de músculo gracilis, que se coloca junto con un injerto cruzado de nervio sural, suturado desde el nervio facial sano hasta el nervio obturador (el nervio del músculo gracilis) en uno o 2tiempos quirúrgicos. Cuando el nervio facial contralateral está afectado, el nervio obturador puede suturarse al nervio maseterino. Últimamente, se han descrito casos en los que el nervio obturador se anastomosa con ambos nervios (nervio sural desde el facial sano y nervio maseterino). El injerto de gracilis ofrece los mejores resultados de reanimación facial en casos de larga evolución, con una excursión de la sonrisa de unos 8mm, que además es emocional cuando se emplea el injerto cruzado16.
En ocasiones, la enfermedad asociada, la edad del paciente, o por su preferencia, no está indicado realizar técnicas de reconstrucción microquirúrgica. En estos casos, se recurre a transposiciones o elongaciones musculares. El músculo temporal es el más utilizado, especialmente con la modificaciones realizadas por Labbé (elongación del músculo temporal)72, con la que se consigue simetría en reposo y cierta excursión de la comisura con la sonrisa93.
44. ¿Existe un límite de tiempo de evolución para tratar una parálisis facial?El límite de tiempo para realizar una técnica de reinervación es de unos 2 años. Pero no hay límite temporal para tratar una parálisis facial completa. Aunque hayan pasado muchos años desde la instauración de la parálisis, se puede plantear un tratamiento quirúrgico mediante transposiciones musculares o injertos microvascularizados (pregunta 43).
45. ¿Cómo se pueden tratar las sincinesias y el espasmo? ¿Y el espasmo hemifacial?Las sincinesias y el espasmo son características de la reinervación aberrante que se produce bien tras una lesión severa del nervio facial de forma espontánea, o bien tras una técnica de reconstrucción o reinervación del mismo. En general, se tratan con rehabilitación y toxina botulínica. En casos rebeldes puede realizarse un tratamiento quirúrgico mediante neurectomías selectivas94.
El espasmo hemifacial es una entidad diferente. Se trata de la presencia de espasmos involuntarios repentinos en un lado de la cara, atribuidos a la compresión vascular del nervio facial en su salida del tronco cerebral. El tratamiento sintomático se basa en la aplicación periódica de toxina botulínica en la musculatura afectada, si bien la descompresión microvascular por vía retrosigmoidea es el único tratamiento definitivo95.
46. ¿Cómo y a qué edad debe tratarse la parálisis facial congénita?La mayor parte de las parálisis faciales congénitas son de causa traumática y están relacionadas con el parto. Son unilaterales y se resuelven espontáneamente, siendo excepcional la necesidad de descomprimir o reconstruir el nervio facial. Es importante diferenciar estas parálisis congénitas de las asociadas al desarrollo embrionario, tanto por cuestiones legales como terapéuticas (las traumáticas suelen mejorar espontáneamente pero las del desarrollo no). La parálisis facial debida a un defecto del desarrollo embrionario puede aparecer aislada o asociada a síndromes como el síndrome de Moebius, el síndrome de Goldenhar o el síndrome de Charge.
El síndrome de Moebius presenta una parálisis facial habitualmente bilateral, que suele ir asociada a una parálisis del vi par y ocasionalmente a parálisis de otros pares craneales. El tratamiento quirúrgico suele realizarse mediante un injerto microvascularizado de músculo gracilis anastomosado al nervio facial contralateral en los casos unilaterales o a sendos nervios maseterinos en los casos bilaterales96. Se recomienda demorar el procedimiento hasta los 5-6 años de edad por el tamaño de los nervios y vasos.
47. ¿Qué nervio donante debe elegirse para reconstruir el nervio facial en el oído y en la parótida?El nervio auricular mayor y el nervio sural son las opciones más utilizadas para la reconstrucción del nervio facial. La selección de uno u otro se realiza en función de la longitud necesaria, la necesidad de ramificación del injerto o la naturaleza de la lesión resecada83. Por ello, para lesiones menores de 6cm, el nervio auricular mayor es ideal. La anestesia resultante en el lóbulo auricular es bien tolerada y el nervio tiene un diámetro y un calibre suficientes para proporcionar un injerto adecuado. La principal contraindicación para su uso es la presencia de tumoraciones malignas cercanas, como en el caso de enfermedad parotídea o temporal oncológica, en los que el nervio auricular mayor contralateral o el nervio sural serán mejores opciones.
El nervio sural nos proporciona un injerto de una longitud de hasta 30cm. Las mejoras en su obtención quirúrgica (pequeñas incisiones horizontales, uso de endoscopio) han hecho de él una buena opción para la rehabilitación del nervio facial97.
48. ¿Tiene alguna importancia la dirección en la que se coloca el injerto nervioso?Tradicionalmente, se postulaba la idea de mantener la dirección del flujo axonal del injerto para favorecer la reinervación y evitar la reinervación en dirección aberrante. Por ejemplo, en el caso del nervio auricular mayor con flujo de distal a proximal, se recomendaba colocarlo en esa misma dirección desde la zona de facial proximal a distal. Con las disparidades en los resultados publicados en la literatura actual, dicha pregunta sigue hoy en día vigente. Tras realizar una revisión bibliográfica, basándonos en datos histológicos, morfométricos, electrofisiológicos y de funcionalidad, ningún estudio ha demostrado diferencias significativas en los resultados entre la colocación en dirección normal o reversa. Un artículo postula que el injerto invertido podría ayudar a que las fibras nerviosas regeneradas no se pierdan en los puntos de unión; sin embargo, esto podría no traducirse en una mejor función. Hoy en día, carecemos de suficiente bibliografía al respecto para tomar una decisión98,99.
49. ¿Cuánto tarda en producirse la reinervación con un injerto?La viabilidad del injerto nervioso depende de la neurotización del donante al nervio diana, la coaptación nerviosa de ambos extremos y la presencia de un lecho vascular adecuado en la zona de la lesión. La coaptación nerviosa se da aproximadamente a los 15-30 días, siendo posteriormente el crecimiento de 1mm/día. Esto supone 3cm/mes o 36cm/año. Conociendo el lugar en el que se coloca el injerto, podemos estimar el tiempo en que tardarán en verse signos de reinervación100.
50. ¿Qué resultado podemos esperar tras la reconstrucción/reinervación del nervio facial?Una frase clásica atribuida a Mario Sanna, otólogo italiano, dice que «No existe ninguna técnica reconstructiva del nervio facial que consiga un grado de House-Brackmann mejor de iii»101. Es decir, no se consigue una restitución total de la función facial. Una lesión severa del nervio supone casi siempre la aparición de sincinesias y movimientos en masa. En general, los mejores resultados se obtienen con la reparación directa del nervio, con o sin injerto, seguidos de la reinervación con un nervio donante83.
51. ¿Qué efecto tiene sobre el facial su movilización, su transposición parcial o su transposición completa?Cualquier técnica que desplace el nervio facial de su canal puede tener implicaciones sobre su funcionalidad. Aunque sí es cierto que con distinta repercusión.
- –
Movilizar la tercera porción parcialmente no suele tener ningún impacto sobre la función del nervio facial. Si bien, ocasionalmente, el compromiso de la vascularización a través de agujero estilomastoideo puede generar una pérdida de función que suele ser transitoria volviendo en casi la totalidad de los casos a una función normal102.
- –
El llamado «rerouting parcial del nervio facial»103 supone una transposición anterior permanente desde el ganglio geniculado hasta la bifurcación o la trifurcación parotídea. Esta maniobra es delicada y, al contrario que la movilización, excepcionalmente puede realizarse sin implicación para la función del nervio facial, ocasionalmente una debilidad transitoria y en la mayor parte de los casos suele dejar alguna secuela, que no suele ser peor de un grado iii de House-Brackmann.
- –
El llamado «rerouting total del nervio facial»104 es una transposición posterior permanente desde el poro acústico (o incluso la porción cisternal) hasta el agujero estilo mastoideo. Es una maniobra aún más delicada, que implica la sección de los nervios petrosos y, por tanto, la pérdida de la vascularización proveniente de ellos (la más importante del nervio facial). Esta maniobra ocasiona, casi en la totalidad de los casos, la pérdida completa de la función del nervio facial, que al igual que en su interrupción nunca recuperará más allá de un grado iii, aunque con mejores resultados funcionales globales que si se secciona el nervio.
Las medidas de protección ocular son una prioridad en el paciente con parálisis facial, e incluyen:
- –
Uso de gafas de sol con protección lateral, para evitar la irritación por los rayos solares, el efecto traumático del polvo y para prevenir la lesión corneal por desecación105.
- –
Lubricación ocular mediante ungüento oftálmico especialmente sin conservantes (Xilinnight® [NicOx. Sophia Antipolis, Francia], Lipolac® [Chem.-pharm. Fabrik GmbH, Berlín-Alemania]), que se indicará al ocluir el ojo para dormir o más veces al día dependiendo de la afectación ocular.
- –
Lágrimas artificiales (metilcelulosa, hipromelosa o hipotónicas con ácido hialurónico). Es posible que unas gotas funcionen mejor en unos pacientes que en otros. En pacientes con más tendencia al ojo seco, se ha demostrado mejor eficacia de las gotas hipotónicas enriquecidas con ácido hialurónico (Hyabak® [Thea Pharmaceuticals Ltd, Newcastle Under Lyme, Inglaterra], Hylo-gel® [URsAPHARM, Saarbrücken-Alemania])106.
- –
Oclusión ocular nocturna mediante parche oclusor o cámara de retención de humedad (Ortolux® [Trusetal Verbandstoffwerk GmbH. Schloss Holte-Stukenbrock-Alemania]), que aportan alivio y protección frente a la desecación ocular. Se debe evitar aquellas medidas que supongan simplemente tapar el ojo quedando abierto debajo sin protección105.
- –
Lentillas escleróticas, descritas para la queratoplastia por exposición asociada a problemas neurotróficos, pero también recientemente para pacientes en los que las medidas iniciales no son suficientes107.
Es necesario tener en cuenta distintos factores, como la posibilidad de recuperación, el grado de lagoftalmos, la edad, etc.
En parálisis faciales con una recuperación esperada de menos de 6-8 semanas, mantendremos únicamente cuidados oculares. En parálisis con una duración de hasta 6 meses (lesiones axonales leves-moderadas) se ha descrito el uso de toxina botulínica sobre el músculo elevador del párpado para favorecer el cierre ocular108, así como el uso de ácido hialurónico como peso palpebral109. Las 2técnicas tienen descritos algunos riesgos que es preciso conocer. La toxina botulínica puede inducir una diplopía si se difunde al músculo recto superior y el ácido hialurónico puede crear un granuloma crónico que precise de hialuronidasa.
En pacientes con parálisis de mayor duración y mayor severidad, la técnica de mayor difusión es la implantación de una pesa en el párpado superior, que puede ser de oro o de platino-iridio articulada. Estas últimas tienen la ventaja de ser más estéticas, tener menor probabilidad de extrusión y disminuir la aparición de astigmatismo al adaptarse mejor a la córnea, evitando zonas de mayor presión110.
En los pacientes con lesiones severas se debe restaurar la laxitud del párpado inferior. En este sentido, hay descritas distintas técnicas de cantoplastia en función del grado de ectropión posparalítico. En pacientes con gran laxitud, hay descritas técnicas de injertos tendinosos (tendón del palmar largo) o cartilaginosos para ayudar a reponer la posición del párpado111.
54. ¿Cuándo está indicada la rehabilitación en un paciente con una parálisis facial?La mayor parte de los pacientes con parálisis de Bell se recuperan sin secuelas, pero hay algunos que por la gravedad de la lesión van a presentar sincinesias o contracción muscular mantenida. Asimismo, los pacientes con parálisis facial de otras etiologías (traumáticas, tumorales, posquirúrgicas) con lesión axonal establecida van a tener siempre secuelas. En este caso, se recomienda la terapia física rehabilitadora, mejorando tanto las secuelas desarrolladas como ayudando a que sean menores si actuamos en el momento adecuado112-114 (pregunta 16). En general, se debe remitir a rehabilitación a los pacientes con secuelas establecidas y a aquellos con una parálisis completa que no mejora en 6-8 semanas, ya que esto indica que muy probablemente tendrán secuelas. Igualmente se recomienda el tratamiento rehabilitador precoz en pacientes con una parálisis completa que presentan signos de mal pronóstico en las pruebas neurofisiológicas (ENG y EMG) durante las primeras semanas, con la idea de minimizar las secuelas (pregunta 14). La rehabilitación no tiene sentido mientras haya una ausencia total de función facial. Se debe iniciar cuando aparecen signos clínicos de reinervación. Durante el tiempo que dure la parálisis completa, el paciente debe evitar cualquier esfuerzo o estimulación facial más allá de masajes suaves (pregunta 15).
55. ¿En qué consiste la rehabilitación de la parálisis facial?La rehabilitación de la parálisis facial trata de mejorar la función del lado parético, minimizar las secuelas (sincinesias/contracción muscular mantenida) y aportar la mayor simetría posible, tanto en reposo como en movimiento, incluye actuaciones sobre el lado sano. El método más efectivo es la reeducación neuromuscular facial, muchas veces acompañada de infiltración de toxina botulínica. Utiliza el biofeedback, habitualmente con espejo, aunque también puede hacerse con EMG. Habitualmente, después de 6-8 sesiones de aprendizaje, se continúa el programa domiciliario115. La mimoterapia también se ha mostrado efectiva36,114. La electroestimulación es un método de rehabilitación que debe evitarse puesto que no ha demostrado ser eficaz y favorece la reinervación aberrante y los movimientos en masa115. En general, la rehabilitación enfatiza en la enseñanza de estrategias de autocontrol del paciente. El objetivo no es tanto que consiga una gran movilización del lado parético, sino que el movimiento sea armónico y simétrico en comparación con el lado sano116.
56. ¿Qué función desempeña la toxina botulínica en la rehabilitación de la parálisis facial?Se utiliza fundamentalmente para el tratamiento de la parálisis facial con secuelas, mediante la infiltración de las zonas sincinéticas o hipertónicas en el lado parético o infiltrando la hemicara sana para mejorar la simetría, tanto en reposo como en movimiento117,118. El patrón y la intensidad de las sincinesias son muy variables entre los pacientes, por lo que la dosis y los lugares de infiltración se deben individualizar119. La toxina botulínica también es útil para facilitar los ejercicios de reeducación, así como los movimientos de la cara durante la gesticulación115.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A Miryam Calvino, por su inestimable contribución en la edición de la guía clínica.