Las metaloproteasas (MMP) y el inhibidor tisular de metaloproteasas 3 (TIMP-3) se han relacionado con el riesgo de padecer cáncer y con la agresividad de varios tumores. En ocasiones, existen muchas dificultades para diagnosticar el cáncer de próstata y la expresión de MMP y del TIMP-3 en biopsias negativas nos podría ayudar a realizar una sospecha diagnóstica en estos casos. El objetivo es hacer un estudio comparativo de la expresión de MMP y TIMP-3 en las biopsias previas negativas y las prostatectomías radicales (PR).
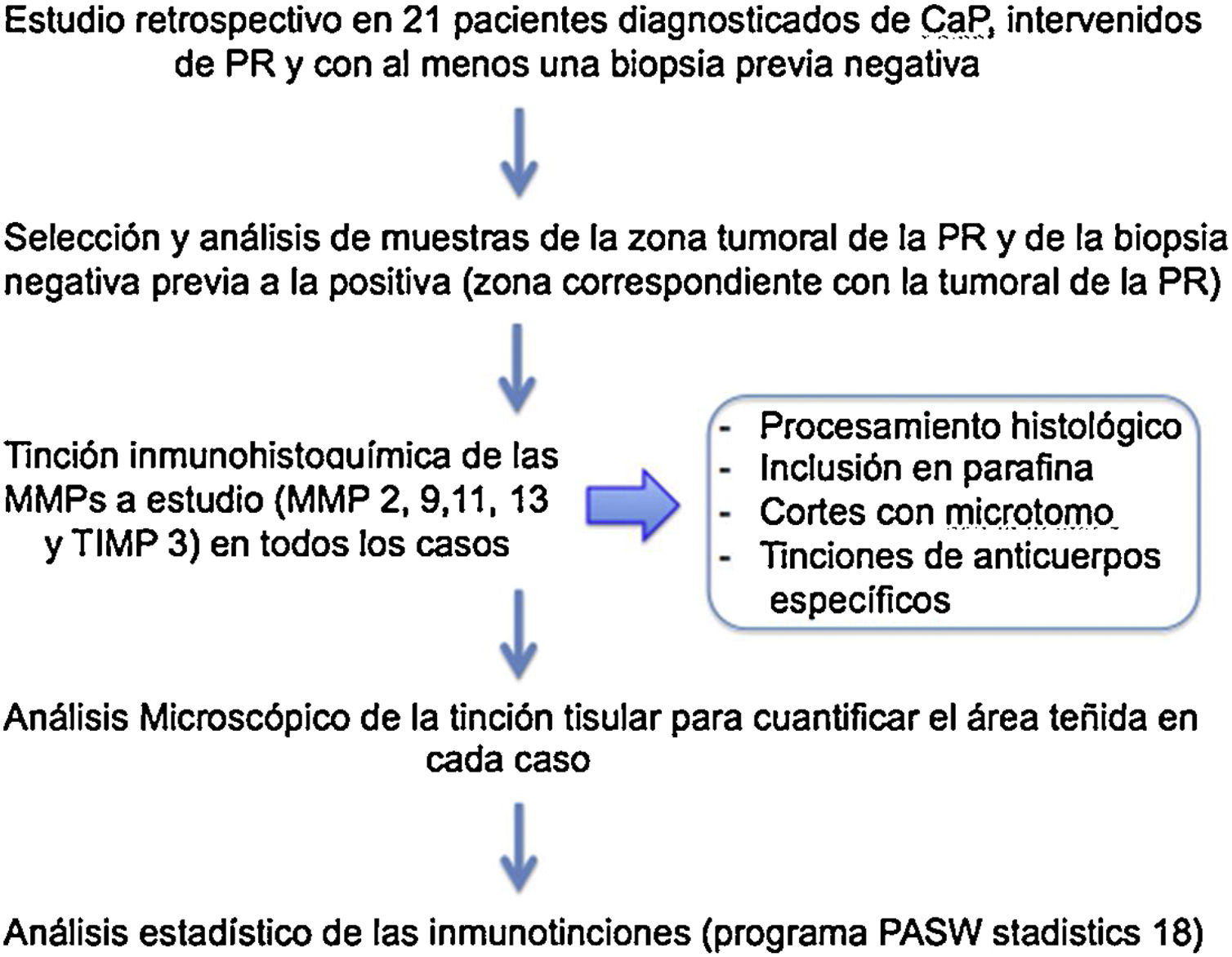
Material y métodosAnálisis retrospectivo de una cohorte de base hospitalaria que incluye a 21 pacientes con sospecha de carcinoma prostático en los que se analizaron por técnica inmunohistoquímica las expresiones de MMP-2, 9, 11 y 13 y el TIMP-3 en la zona tumoral, tanto de las biopsias previas negativas como de las PR.
ResultadosLos valores de tinción inmunohistoquímicos (score) para las MMP (-11 y -13) y TIMP-3 no mostraron diferencias significativas al comparar las áreas de las biopsias negativas donde luego se desarrolló tumor con las de la PR. Sin embargo, sí que observamos una diferencia significativa aumentando la expresión de la MMP-2 (p=0,002) y MMP-9 (p=0,001) en la zona tumoral de la PR con respecto al área correspondiente de la biopsia previa negativa.
ConclusionesNuestros datos indican una mayor expresión global de la MMP-2 y la MMP-9 en la zona tumoral de la PR en comparación con las áreas correspondientes de la biopsia previa negativa, lo que parece estar en relación con el proceso de transformación maligna.
Metalloproteases (MMPs) and tissue inhibitor of metalloprotease-3 (TIMP-3) have been associated to the risk of having cancer and tumor aggressiveness. When facing the difficulties of prostate cancer diagnosis, the expression of MMPs and TIMP-3 in negative biopsies could be helpful to evaluate a diagnostic suspicion. Our objective is to carry out a comparative study of the expression of MMPs and TIMP-3 in previous negative biopsies and radical prostatectomies (RP).
Material and methodsRetrospective analysis of a hospital-based cohort including 21 patients with suspicion of prostate carcinoma, whose expressions of MMP-2, 9, 11 and 13 and TIMP-3 were evaluated by immunohistochemistry in the tumor area from previous negative biopsies and RP.
ResultsImmunohistochemical staining values (Score) for MMPs (-11 and -13) and TIMP-3 showed no significant differences when comparing the areas of negative biopsies where tumors subsequently developed with those of the RP. However, we did observe a significant difference in the increased expression of MMP-2 (P=.002) and MMP-9 (P=.001) in the tumor area of the RP with respect to the corresponding area of the previous negative biopsy.
ConclusionsOur data indicate a higher overall expression of MMP-2 and MMP-9 in the tumor area of the RP compared to the corresponding areas of the negative previous biopsy, which seems to be associated to the process of malignant transformation.
El cáncer de próstata (CaP) representa el tumor más frecuentemente diagnosticado en varones en España1. A pesar de ello, en muchos casos encontramos dificultades para realizar un diagnóstico adecuado, siendo necesario en muchas ocasiones realizar numerosas pruebas diagnósticas que no están exentas de posibles complicaciones para los pacientes.
La biopsia prostática tiene una alta tasa de falsos negativos, que puede llegar hasta el 47%2, motivo por el que actualmente están adquiriendo gran interés las técnicas de imagen que nos permitan disminuir el número de biopsias de próstata innecesarias.
La resonancia magnética multiparamétrica prostática es un procedimiento no invasivo que puede ayudarnos a resolver estos problemas y realizar un diagnóstico más preciso, gracias a que tiene una gran resolución espacial lo cual permite un gran detalle anatómico de la próstata localizando de forma muy precisa los carcinomas en aquellos pacientes con sospecha clínica. Mediante la realización de biopsia por fusión es posible detectar de forma selectiva los cánceres clínicamente significativos, además de disminuir la detección de aquellos tumores de bajo riesgo, ello nos permite evitar sobretratamientos que en muchos casos dan lugar a posibles efectos secundarios, ya que nos ofrece una imagen en 3D de la próstata más precisa y permite dirigir la aguja y puncionar las zonas sospechosas3. Las ventajas para la realización del diagnóstico del CaP utilizando la biopsia por fusión de imágenes son indudables, pero del mismo modo debemos tener en cuenta una serie de limitaciones tales como su precio elevado, escasa accesibilidad, dificultad técnica, etc.
Por todo ello, interesa encontrar algún biomarcador que nos informe sobre la progresión de la enfermedad y nos permita identificar a pacientes con tumores de alto riesgo.
Actualmente, muchos diagnósticos histopatológicos de enfermedades se centran en la interacción que tiene lugar entre la célula tumoral y la matriz extracelular (MEC)4. Los tumores se producen como consecuencia de mutaciones en genes que dan lugar a un crecimiento no controlado del tejido celular, siendo las metaloproteasas (MMP) las principales mediadoras durante la progresión tumoral5. La MEC desempeña unas funciones vitales para la célula y los tejidos en cuanto a su multiplicación y preservación que son indispensables para su supervivencia6, además de proteger los tejidos de la infiltración por las células tumorales7.
Las MMP de la MEC en los últimos años han planteado un importante interés en la investigación del cáncer debido al papel que tienen en la degradación de la membrana basal y de la MEC, facilitando la invasión tumoral y las metástasis. Las MMP regulan las vías de señalización que controlan el crecimiento celular, la inflamación y la angiogénesis8, además de intervenir en la carcinogénesis, en la invasión y la producción de metástasis tumorales, debido a que desempeñan un papel esencial en la degradación del tejido conectivo del estroma y de la membrana basal.
Las MMP 2, 9, 11 y 13, se expresan en muchos de los tejidos humanos, sobre todo en los fibroblastos y las células endoteliales y epiteliales. Los pacientes con CaP tienen una mayor expresión tanto de los niveles séricos como de los tisulares de la MMP-9 9. El inhibidor tisular de metaloproteasas 3 (TIMP-3) inhibe la actividad proteolítica de las MMP de la matriz, siendo una proteína secretada que se une fuertemente a la MEC.
El objetivo de nuestro estudio es realizar una comparación de la expresión global de las MMP y TIMP-3 entre las áreas donde luego se desarrolla el tumor en las biopsias previas negativas y en la prostatectomía radical (PR) de pacientes diagnosticados de CaP.
Material y métodosSe realizó un análisis retrospectivo, tras seleccionar a 21 pacientes diagnosticados de CaP que se sometieron a una PR siempre que tuvieran al menos una biopsia previa negativa.
En todos los casos se analizaron las principales características de los pacientes mediante los datos de filiación del paciente (nombre, edad, número de historia clínica, número de la biopsia y número de la pieza de PR) y se evaluaron los factores pronósticos previos al tratamiento (PSA) y posteriores al mismo (PSA, estadio clínico, Gleason de la pieza de prostatectomía y localización del tumor).
En este estudio, el material histológico utilizado ha sido obtenido de las biopsias prostáticas negativas para tumor y en pacientes que fueron sometidos a una PR una vez diagnosticados de CaP mediante una biopsia posterior positiva siempre que la enfermedad se encontrase en estadio localizado.
Con el objetivo de determinar la expresión de las MMP (-2, -9, -11 y -13) y del TIMP-3 en las muestras de los pacientes a estudio en la zona tumoral (tanto en las biopsias previas negativas como en las áreas neoplásicas de las PR posteriores) hemos procesado 1.320 determinaciones, 1.056 de la expresión de MMP-2, -9, -11 y -13 y 264 de la expresión TIMP-13. Para ello, analizamos de forma rutinaria en anatomía patológica las muestras de los tejidos mediante su fijación en formol tamponado al 4% durante un mínimo de 24h, tras lo cual se realizó un estudio macroscópico, incluyendo en parafina las secciones representativas para el diagnóstico anatomopatológico. Para su inclusión se llevó a cabo el siguiente proceso: formol 15’ - alcohol 70 ̊C 30’ - 96 ̊C 30’- 100 ̊C 30’ - 100 ̊C 30’ - 100 ̊C 45’ - xilol 60’ - xilol 60’.
Tras la obtención de bloques de tejido y con la ayuda de micrótomo, se cortaron muestras a un grosor de 3μm, para posteriormente ser colocadas en bloques de parafina que se introducen en una estufa a 65° para favorecer la correcta unión del tejido a los bloques de parafina.
Sobre estas secciones, se ha realizado el estudio inmunohistoquímico utilizando para ello anticuerpos específicos frente a MMP-2, -9, -11 y -13 y al TIMP-3.
Esta técnica lleva a cabo la aplicación de los principios y técnicas inmunológicas al estudio de células y tejidos que tiene por objetivo la identificación, localización in situ y cuantificación de células y/o tejidos.
Para obtener un resultado fiable y exitoso con estas técnicas, no es suficiente con realizar correctamente los diferentes pasos de la inmunotinción; siendo preciso también que el tejido sobre el que estamos trabajando haya sido bien tratado, fijado y procesado.
Las tinciones se realizaron con el anticuerpo a estudio y fueron contrastadas con la tinción con hematoxilina, puesto que cada tipo de tinción tiene umbrales ópticos diferentes.
Cada una de las 4 muestras de cada paciente se analizó con un objetivo de 100X-400X estudiando 4 áreas que fueron seleccionadas buscando las zonas que representaban tinción positiva para la proteína estudiada.
De la relación entre el área teñida (marrón) y el área no teñida (blanquecina) (fig. 1), se ha obtenido un porcentaje de área teñida de cada campo. Se ha calculado el valor de tinción, es decir, la expresión global o score, mediante una hoja de cálculo, multiplicando la intensidad de la misma por el porcentaje de área teñida.
Un patólogo certificado, que es completamente ajeno al resultado clínico de los pacientes, realizó el examen histológico y la valoración de la expresión de cada proteína por los diferentes tipos celulares.
Los resultados obtenidos de las inmunotinciones han sido analizados estadísticamente mediante el programa PASW statistics 18 (analiSIS, Soft imaging system). Los valores de tinción para cada proteína han sido expresados en forma de mediana, con un intervalo mínimo y máximo. Para la determinación de las diferencias en la expresión global de los factores (score), hemos utilizado la prueba U de Mann-Whitney o de Kruskal-Wallis. Las diferencias entre grupos se consideraron significativas cuando el valor de p fue igual o inferior a 0,05 (fig. 2).
ResultadosLos pacientes incluidos presentaban una mediana de edad al realizar la biopsia negativa de 59 años (intervalo de 52-70 años) con una mediana de PSA de 5,04ng/dl (intervalo de 4,14-10,84). La mediana de edad de los pacientes al realizar la PR era de 65 años (intervalo de 53-71) con una mediana de PSA de 7,24ng/ml (intervalo de 4,92-13,75). El estadio tumoral tras la PR fue: 4 T2a, 4 T2b, 11 T2c y 2 T3b; el Gleason en la pieza fue 10 Gl. 6; 9 Gl. 7 y 2 Gl. 8) y la afectación tras la PR fue 6 unilateral y 15 bilateral.
La tabla 1 recoge la distribución de los estadios tumorales, grados histológicos y alcance de la afectación prostática de la pieza de la PR
Características clinicopatológicas de 21 pacientes con cáncer de próstata sometidos a prostatectomía radical y su relación con la expresión de los diferentes factores
| Características | N (%) |
|---|---|
| Edad en el momento de la biopsia (años) | |
| ≤59 | 12 |
| >59 | 9 |
| PSA en el momento de la biopsia positiva | |
| ≤10ng/ml | 19 |
| >10ng/ml | 2 |
| Edad en el momento de la PR (años) | |
| ≤65 | 14 |
| >65 | 7 |
| PSA en el momento de la PR | |
| ≤10ng/ml | 17 |
| >10ng/ml | 4 |
| Estadio tumoral tras PR | |
| T2a | 4 |
| T2b | 4 |
| T2c | 11 |
| T3b | 2 |
| Score Gleason | |
| 6 | 10 |
| 7 | 9 |
| 8 | 2 |
| Localización tumoral positiva | |
| Unilateral | 6 |
| Bilateral | 15 |
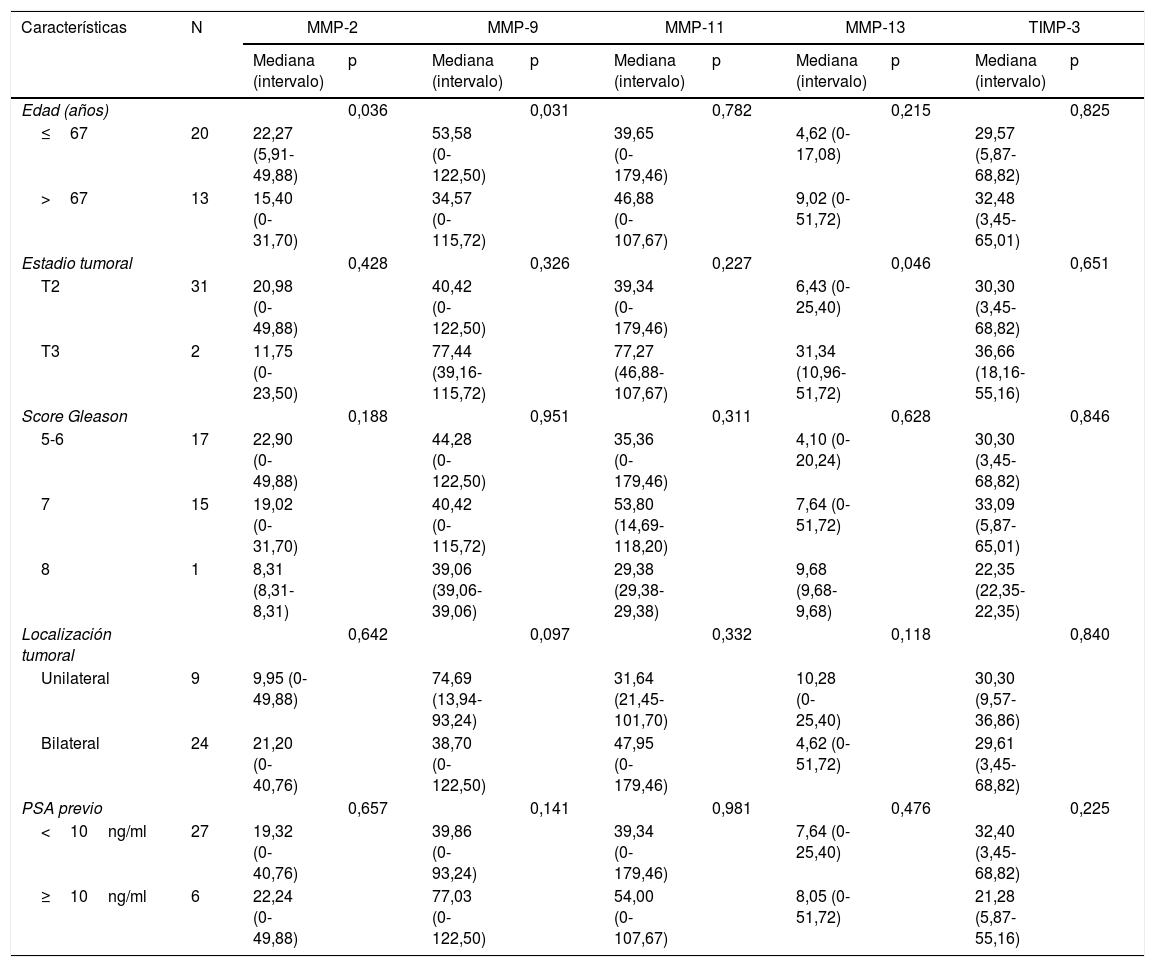
Cuando analizamos la relación entre los scores de los diferentes factores con las características clinicopatológicas tan solo encontramos una asociación significativa de la expresión de la MMP-13 con el estadio tumoral, siendo la expresión de esa MMP más elevada en los tumores con un estadio más avanzado (p=0,046) (tabla 2).
Relación de la expresión global de MMP y TIMP-3 (score) en la zona tumoral de la prostatectomía radical con las características clinicopatológicas de los pacientes
| Características | N | MMP-2 | MMP-9 | MMP-11 | MMP-13 | TIMP-3 | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Mediana (intervalo) | p | Mediana (intervalo) | p | Mediana (intervalo) | p | Mediana (intervalo) | p | Mediana (intervalo) | p | ||
| Edad (años) | 0,036 | 0,031 | 0,782 | 0,215 | 0,825 | ||||||
| ≤67 | 20 | 22,27 (5,91-49,88) | 53,58 (0-122,50) | 39,65 (0-179,46) | 4,62 (0-17,08) | 29,57 (5,87-68,82) | |||||
| >67 | 13 | 15,40 (0-31,70) | 34,57 (0-115,72) | 46,88 (0-107,67) | 9,02 (0-51,72) | 32,48 (3,45-65,01) | |||||
| Estadio tumoral | 0,428 | 0,326 | 0,227 | 0,046 | 0,651 | ||||||
| T2 | 31 | 20,98 (0-49,88) | 40,42 (0-122,50) | 39,34 (0-179,46) | 6,43 (0-25,40) | 30,30 (3,45-68,82) | |||||
| T3 | 2 | 11,75 (0-23,50) | 77,44 (39,16-115,72) | 77,27 (46,88-107,67) | 31,34 (10,96-51,72) | 36,66 (18,16-55,16) | |||||
| Score Gleason | 0,188 | 0,951 | 0,311 | 0,628 | 0,846 | ||||||
| 5-6 | 17 | 22,90 (0-49,88) | 44,28 (0-122,50) | 35,36 (0-179,46) | 4,10 (0-20,24) | 30,30 (3,45-68,82) | |||||
| 7 | 15 | 19,02 (0-31,70) | 40,42 (0-115,72) | 53,80 (14,69-118,20) | 7,64 (0-51,72) | 33,09 (5,87-65,01) | |||||
| 8 | 1 | 8,31 (8,31-8,31) | 39,06 (39,06-39,06) | 29,38 (29,38-29,38) | 9,68 (9,68-9,68) | 22,35 (22,35-22,35) | |||||
| Localización tumoral | 0,642 | 0,097 | 0,332 | 0,118 | 0,840 | ||||||
| Unilateral | 9 | 9,95 (0-49,88) | 74,69 (13,94-93,24) | 31,64 (21,45-101,70) | 10,28 (0-25,40) | 30,30 (9,57-36,86) | |||||
| Bilateral | 24 | 21,20 (0-40,76) | 38,70 (0-122,50) | 47,95 (0-179,46) | 4,62 (0-51,72) | 29,61 (3,45-68,82) | |||||
| PSA previo | 0,657 | 0,141 | 0,981 | 0,476 | 0,225 | ||||||
| <10ng/ml | 27 | 19,32 (0-40,76) | 39,86 (0-93,24) | 39,34 (0-179,46) | 7,64 (0-25,40) | 32,40 (3,45-68,82) | |||||
| ≥10ng/ml | 6 | 22,24 (0-49,88) | 77,03 (0-122,50) | 54,00 (0-107,67) | 8,05 (0-51,72) | 21,28 (5,87-55,16) | |||||
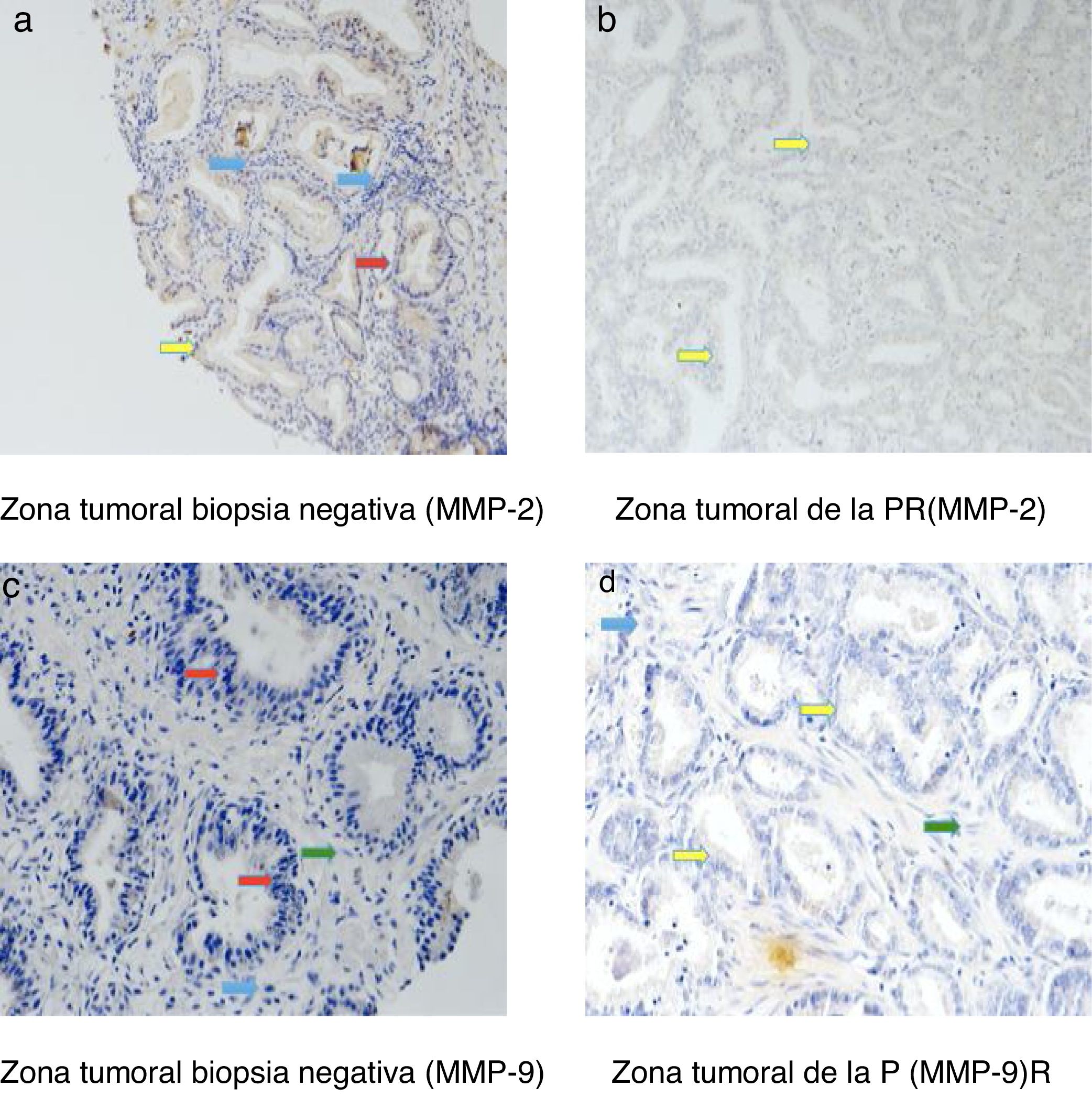
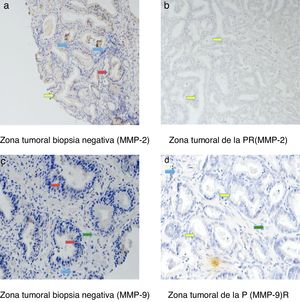
La figura 3 muestra ejemplos de tinciones inmunohistoquímicas para los diversos factores en los que hemos encontrado diferencias en nuestro estudio. Mediante flechas se indica la zona teñida de cada una de la MMP en todos los grupos que hemos analizado: las células epiteliales (flecha roja), las células tumorales (flecha amarilla), los fibroblastos (flecha verde) y las células mononucleares inflamatorias (flecha azul).
Las tinciones inmunohistoquímicas se localizaron en las células epiteliales de las biopsias negativas y en las células tumorales de las PR, pero también en los fibroblastos y en las células mononucleares inflamatorias en ambas muestras tisulares.
La tabla 3 recoge los valores de tinción global (score) para cada factor en las muestras tisulares correspondientes a las biopsias negativas y en la zona tumoral de las piezas de PR. Como se puede observar en esa tabla, no existieron diferencias significativas en la expresión de la MMP-11, MMP-13 o TIMP-3 entre esas 2 muestras tisulares diferenciadas. Sin embargo, observamos que las expresiones de MMP-2 y MMP-9 fueron significativamente más elevadas en la zona tumoral de las PR que en las biopsias prostáticas previamente negativas (p=0,002 y p=0,001, respectivamente).
Comparación de la expresión de factores (score) entre la zona tumoral en las biopsias negativas y en las prostatectomías radicales
| Zona tumoral: biopsias negativas | Zona tumoral: prostatectomía radical | ||||||
|---|---|---|---|---|---|---|---|
| MMP | Mediana | Mínima | Máxima | Mediana | Mínima | Máxima | Valor de p |
| MMP-2 | 8,52 | 0 | 39,88 | 20,98 | 0 | 49,88 | 0,002 |
| MMP-9 | 16,96 | 0 | 64,36 | 40,42 | 0 | 122,5 | 0,001 |
| MMP-11 | 30,68 | 8,35 | 90,8 | 42,09 | 0 | 179,46 | 0,058 |
| MMP-13 | 8,57 | 0 | 27,22 | 7,64 | 0 | 51,72 | 0,223 |
| TIMP-3 | 16,38 | 0 | 88,08 | 30,30 | 3,45 | 68,82 | 0,58 |
Actualmente, la realización de un diagnóstico adecuado de CaP sobre todo con PSA más bajos representa un problema clínico debido a las comorbilidades que se le producen a los pacientes (necesidad de biopsias de repetición con sus posibles complicaciones, ansiedad en los pacientes y sus familiares ante la falta de un diagnóstico claro, ya que no se puede descartar la existencia de un tumor). Por ello, hemos investigado el posible valor del análisis de MMP en la zona tumoral de las biopsias previas negativas y de las PR, por si existieran cambios que nos indicaran un posible desarrollo de tumor en estos pacientes.
Se analizaron factores que previamente se encontraron elevados en el CaP. La expresión de la MMP-2 se encuentra aumentada en el CaP10, asociándose en la mayoría de los casos a un peor pronóstico11, incrementando la agresividad de los tumores12 y creando un ambiente favorable para el desarrollo y el crecimiento de las células tumorales13. Hemos encontrado diferencias al comparar la biopsia previa negativa y la PR, observando un aumento de la expresión en las células tumorales de la MMP-2 en la PR con respecto a las células epiteliales de la biopsia (p=0,002).
Los pacientes con CaP tienen una mayor proporción tanto de los niveles séricos como de los tisulares de la MMP-99. Además de asociarse con una mayor actividad en el tejido prostático tumoral frente a tejido hiperplásico14, su expresión se encontró más elevada en pacientes con carcinoma metastásico respecto a pacientes con carcinoma localizado15. Del mismo modo que en la MMP-2, encontramos una mayor expresión de la MMP-9 en la zona tumoral de la PR en comparación con las biopsias previas negativas.
La MMP-11 se expresa fundamentalmente por las células estromales peritumorales16, siendo esta es su principal diferenciación con otras MMP. La expresión de MMP-11 se ha relacionado con tumores prostáticos agresivos17 y con una disminución en la supervivencia específica para cáncer18, sin que se haya relacionado con el diagnóstico del tumor. En nuestro estudio no encontramos diferencias en la expresión de la MMP-11 entre la zona tumoral y la de las biopsias negativas.
La MMP-13 se expresa por diferentes líneas celulares de CaP, tejido de CaP y HBP19. Sin embargo, no hemos obtenido diferencias al comparar la expresión de la MMP-13 entre el tejido neoplásico y el no neoplásico analizados.
Tanto la MMP-11 como la MMP-13 pueden ser muy buenos objetivos terapéuticos para la inhibición en el CaP tal y como se ha descrito en estudios previos20.
El TIMP-3 tiene capacidad para inhibir el crecimiento, la invasión y la metástasis de varios tipos de cánceres21 como de cerebro, colon y pulmón de células no pequeñas. Al realizar el estudio, no se encontraron diferencias en la expresión del TIMP-3 entre las muestras tumorales y no tumorales.
Teniendo en cuenta la importancia que el CaP tiene en nuestra práctica clínica habitual, necesitamos biomarcadores que puedan predecir con más precisión el riesgo de padecer CaP significativo y con ello evitar biopsias innecesarias a los pacientes.
La carcinogénesis de la próstata es compleja, motivo por el cual resulta difícil analizar y estudiar la genética molecular del CaP. El aumento de los conocimientos sobre los fenómenos genéticos relacionados con el CaP nos ha ayudado a comprender mejor los mecanismos que lo producen, siendo de gran utilidad para llegar a un conocimiento más profundo de la biología subyacente a la conversión de tumores «benignos» desde el punto de vista histológico en procesos agresivos en el aspecto clínico, con el objetivo de poder desarrollar nuevas estrategias preventivas y terapéuticas en esta enfermedad. En este sentido, durante los últimos años han ido apareciendo nuevos biomarcadores que pueden ser útiles para esos propósitos. El PTEN es un gen que codifica una fosfatasa proteico/lipídica y sufre importantes mutaciones o deleciones, en tumores de la próstata tanto localizados como metastásicos22. El Ki67 es un antígeno relacionado como la proliferación celular, que se expresa en tejido prostático tanto benigno como maligno. Además, el incremento de su expresión en el CaP se ha relacionado con las expresiones de Ki67 y p53 23. El p27 es una proteína que suprime el ciclo celular, ralentizando la división celular. La pérdida de su expresión puede acelerar la tumorogénesis al posibilitar el progreso de las células a través del ciclo celular y se asoció con recurrencia bioquímica en pacientes con CaP sometidos a PR24. El bcl-2 es un regulador esencial de la apoptosis y puede actuar como un oncogén y un gen supresor de tumores. Puede expresarse en tejido prostático tanto normal como tumoral, impide la apoptosis y su sobreexpresión se ha relacionado con el alto grado de Gleason, desarrollo de hormono-refractariedad y peor pronóstico25. El p53 es uno de los genes de supresión hormonal más importantes en el cáncer, desempeña un papel importante en la apoptosis y en el control del ciclo celular. La disminución de su expresión se asocia con proliferación celular descontrolada, reducción de la apoptosis, pudiendo desempeñar un papel importante en la progresión tumoral de cáncer localmente avanzado y metastásico26. Sin embargo, ninguno de esos biomarcadores se utiliza en la rutina clínica actualmente. Las MMP tienen una dimensión multifactorial pues están involucradas en diferentes vías de desarrollo tumoral.
Los resultados del presente estudio indican una variabilidad en la expresión de MMP/TIMP en los tejidos prostáticos con sospecha de cáncer, las MMP-2 y -9 pueden ser útiles cuando aparecen sobreexpresadas de la presencia de un tumor a pesar de que la biopsia haya sido negativa. En el futuro, la combinación con otros marcadores puede facilitar la determinación de perfiles moleculares que seleccionen a los pacientes con biopsias negativas que pueden requerir biopsias adicionales y la zona en las que con más probabilidad se requiera repetir la biopsia. La reciente aplicación de la resonancia magnética multiparamétrica y las biopsias por fusión han facilitado este proceso, pero la asociación de biomarcadores como las MMP estudiadas pueden hacerlo todavía más fiable.
Por tanto, consideramos que el estudio de la expresión de MMP con algunos de los factores señalados en nuestro trabajo puede contribuir a una mayor precisión diagnóstica y/o pronóstica en el CaP, además de mostrar una efectividad que debería explorarse en estudios posteriores.
Al realizar el estudio nos hemos encontramos con varias limitaciones, la principal viene dada como consecuencia de la dificultad para lograr encontrar un mayor tamaño muestral, ya que se precisan pacientes que presenten un CaP en estadio localizado que se hayan sometido a una PR y que al menos tenga una biopsia negativa antes de ser diagnosticados del CaP. Además, es necesaria una adecuada muestra histológica en la biopsia y tener clara la localización del tejido a analizar tanto en la biopsia como en la PR, motivo por el que fueron descartados un número importante de pacientes, lo que limita la obtención de casos. Otra de las limitaciones con la que nos encontramos fue la amplia heterogeneidad de nuestra serie y el largo tiempo que se precisó para la recogida de datos.
ConclusionesCuando analizamos las zonas tumorales, tanto de las biopsias negativas como de las PR, se evidenció una mayor expresión global de la MMP-2 y la MMP-9 en las PR respecto a las biopsias negativas, sin que hayamos encontrado diferencias entre las expresiones de la MMP-11, la MMP-13 y el TIMP-3 al analizar las biopsias previas negativas con las PR. Por tanto, según los datos obtenidos en nuestro estudio, podría considerarse que un aumento de la expresión de la MMP-2 y de la MMP-9 pudiera favorecer la progresión tumoral.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.