El tratamiento de los pacientes con cáncer de próstata (CaP) está establecido en las guías de práctica clínica, las cuales se basan en estudios aleatorizados según el nivel de evidencia. En España se desconoce el grado de cumplimiento de estas guías en la práctica clínica.
ObjetivosDescribir los perfiles de los pacientes con CaP en el momento del diagnóstico y el manejo de los pacientes con CaP localizado y con recurrencia bioquímica (RBQ) en España.
Materiales y métodosSe realizó una encuesta médica en 3 especialidades médicas (85 urólogos [URO], 64 oncólogos radioterápicos [OR] y 21 oncólogos médicos [OM]). Para este estudio se elaboraron 3 cuestionarios, 2 con 22 preguntas (URO y OR) y uno con 21 preguntas (OM).
ResultadosLa incidencia anual de CaP en los hospitales participantes (N=131) fue de 24.057 casos. La incidencia anual extrapolada a España fue de 40.531 casos. La prevalencia estimada de CaP en España es de 221.689. Cabe destacar que el 79 y el 80% de los pacientes atendidos por URO y OR, respectivamente, presentaban CaP localizado en el momento del diagnóstico. La biopsia fue la prueba diagnóstica más utilizada en las 3 especialidades, seguida de la tomografía computarizada abdominopélvica. Más del 90% de los pacientes con RBQ se sometieron a pruebas estándar. Las técnicas de imagen de nueva generación y la PET con colina/PSMA se siguen utilizando en menor medida. Actualmente, la mayoría de los pacientes con CaP localizado reciben tratamiento con cirugía o radioterapia, pero en el caso de los pacientes con RBQ, los URO y OR prefieren la radioterapia y los OM la terapia de privación androgénica exclusiva o combinada.
ConclusiónEste estudio describe los perfiles de los pacientes en el momento del diagnóstico y proporciona una visión general del manejo terapéutico actual del CaP localizado y con RBQ en la práctica clínica en España.
The management of patients with prostate cancer (PCa) is established in clinical practice guidelines, which are based on randomized studies according to the level of evidence. In Spain, the degree of compliance with these guidelines in clinical practice is unknown.
ObjectivesTo describe the profiles of PCa patients at the time of diagnosis and the management of patients with localized PCa and those with biochemical recurrence (BCR) in Spain.
Materials and methodsA medical survey was conducted in specialized care (85 urologists [UROs], 64 radiation oncologists [ROs], and 21 medical oncologists [MOs]). Three questionnaires were developed for this study with 22 (UROs and ROs) or 21 questions (MOs).
ResultsThe annual incidence of PCa was 24,057 in participating hospitals (N=131). The extrapolated annual incidence in Spain is 40,531 cases. The estimated prevalence of PCa in Spain is 221,689. Of note, 79 and 80% of patients seen by UROs and ROs, respectively had localized PCa at diagnosis. Biopsy was the most used diagnostic test among the 3 specialties, followed by abdominopelvic computer tomography. More than 90% of patients with BCR underwent standard tests. Next generation imaging tests and PET-choline/PSMA are still used residually. Most patients with localized PCa are currently treated with either surgery or radiotherapy, while for BCR patients, UROs and ROs prefer radiotherapy and MOs androgen deprivation therapy alone or in combination.
ConclusionThis study describes patient profiles at the time of diagnosis and provides an overview of the current therapeutic management of localized PCa and BCR in clinical practice in Spain.
El cáncer de próstata (CaP) es la neoplasia más frecuente en los varones españoles y la tercera causa de mortalidad por cáncer1. En un informe publicado recientemente por la Sociedad Española de Oncología Médica (SEOM), la incidencia del CaP en España en 2023 se estimó en 29.002 nuevos casos, y la prevalencia en 259.788 pacientes en 20201. La mayoría de los pacientes son diagnosticados a partir de los 65 años, ya que se trata de una enfermedad de crecimiento relativamente lento2. En sus fases iniciales, el CaP es asintomático en la mayoría de los casos. En estadios más avanzados, los síntomas pueden incluir fatiga, anemia, eventos relacionados con el esqueleto como dolor, fracturas o compresión medular, e insuficiencia renal debido a obstrucción ureteral bilateral3. A pesar de las controversias, el diagnóstico se basa principalmente en las pruebas del antígeno prostático específico (PSA) y las biopsias3. Cuando se detecta un valor elevado de PSA, se recomienda realizar una resonancia magnética (RM) antes de la biopsia, y ante una RM positiva debe realizarse una biopsia4.
Los estadios de la enfermedad en el CaP se caracterizan por el estado del tumor primario, la presencia de metástasis, el tratamiento y los niveles de testosterona5. El CaP localizado se caracteriza por la ausencia de extensión más allá de la glándula prostática, mientras que el CaP localmente avanzado puede invadir parte del tejido periprostático y los ganglios linfáticos locales6. La recurrencia bioquímica (RBQ) se define como un aumento del PSA después de recibir tratamiento primario con intención curativa, pero depende de si el tratamiento primario fue cirugía o radioterapia (RT)7. Aunque no hay consenso sobre la definición exacta de RBQ, la definición más utilizada es el aumento del PSA>0,2ng/mL en 2 determinaciones consecutivas, ya que estos se asocian a una mayor tasa de progresión bioquímica8. Después de la RT, se diagnostica RBQ ante cualquier aumento del PSA≥2ng/mL por encima del nadir del PSA9.
El CaP avanzado incluye un amplio espectro de enfermedades, que van desde el cáncer hormonosensible hasta la enfermedad resistente a la castración (incluyendo estados metastásicos y no metastásicos)10. Los estadios de la enfermedad que preceden al CaP resistente a la castración metastásico (CPRCm) son el CaP hormonosensible metastásico (CPHSm), caracterizado por el desarrollo de metástasis mientras el paciente sigue respondiendo a la castración médica o quirúrgica, y el CaP resistente a la castración no metastásico (CPRCnm), caracterizado por el aumento de los niveles de PSA a pesar de los niveles de castración con testosterona sin que se detecten metástasis mediante técnicas de imagen convencionales11,12. Se ha determinado que aproximadamente la mitad de los pacientes que fallecen por un CaP presentan metástasis en el momento del diagnóstico13.
El tratamiento para los diferentes estadios del CaP se describe en las guías de práctica clínica. En los últimos años se han producido cambios cruciales en el manejo terapéutico del CaP metastásico que mejoran significativamente la supervivencia14. El tratamiento del CaP localizado, incluida la vigilancia activa para pacientes con enfermedad de bajo riesgo, la prostatectomía radical (PR), la RT externa y la braquiterapia, deben considerarse como referencia en el tratamiento con intención curativa para hombres con una esperanza de vida>10 años. En algunos casos, el tratamiento local se combina con terapia hormonal (TH)15,16. El grupo de riesgo, el estadio tumoral y las comorbilidades deben tenerse en cuenta a la hora de elegir el tratamiento para los pacientes con CaP localizado, considerando la toma de decisiones compartida basada en las preferencias del paciente. A pesar de que la terapia local es curativa en muchos pacientes, se estima que entre el 27 y el 53% de los pacientes experimentarán una RBQ9. Las guías clínicas recomiendan realizar PET/TC con PSMA (si está disponible) o PET/TC con fluciclovina o colina en pacientes aptos para tratamiento curativo de rescate. La RT de rescate estaría indicada en pacientes con RBQ sin evidencia de enfermedad metastásica tras la PR15,17. Ante la presencia de factores de riesgo, puede ofrecerse TH además de RT de rescate a los hombres con RBQ. Después de la RT, como tratamiento de rescate se puede ofrecer PR, reirradiación con braquiterapia, terapia de protones o RT de intensidad modulada guiada por imagen, ultrasonidos focalizados de alta intensidad o ablación por criocirugía en pacientes seleccionados15. Para el tratamiento sistémico de rescate, la terapia de privación de andrógenos (TPA) no debe ofrecerse a pacientes M0 con un tiempo de duplicación del PSA>12 meses15,18. En la RBQ, la TH precoz debe reservarse a los pacientes con alto riesgo de progresión de la enfermedad, definido como un tiempo de duplicación del PSA corto en el momento de la recaída (<6-12 meses) o un grado ISUP inicial alto (>2/3) y una esperanza de vida larga4,15. Debe ofrecerse tratamiento sistémico inmediato con TPA a los pacientes con CaP metastásico. La terapia combinada, que incluye TPA más terapia sistémica como docetaxel con o sin acetato de abiraterona o darolutamida, acetato de abiraterona más prednisona, apalutamida o enzalutamida, debe considerarse en todos los pacientes. Además, debe ofrecerse RT prostática a los pacientes con enfermedad de bajo volumen.
Este estudio tiene como objetivo describir los perfiles de los pacientes con CaP en el momento del diagnóstico y el manejo de los pacientes con CaP localizado y aquellos con RBQ en España, así como contextualizar los resultados con respecto a las recomendaciones de las guías de práctica clínica.
MétodosSe realizó una encuesta médica en 3 especialidades (urología [URO], oncología radioterápica [OR] y oncología médica [OM]) para describir el manejo de los pacientes con CaP localizado y pacientes con RBQ.
El estudio se realizó mediante entrevistas estructuradas guiadas por cuestionarios a sendas muestras de URO (N=85), OR (N=64) y OM (N=21) distribuidos de forma representativa por toda España, con base en las poblaciones existentes en las comunidades autónomas. Las entrevistas se realizaron entre julio y agosto de 2022. El cálculo del tamaño muestral se basó en un universo de 2.676 URO, 2.502 OR y 1.066 OM identificados en hospitales públicos. El error de la muestra fue inferior al 10,46% para URO, al 21,30% para OR y al 11,88% para OM. Para ser elegibles para la entrevista, los médicos debían tener al menos 5 años de experiencia tras completar su periodo de formación (MIR), trabajar en un hospital público a tiempo completo o parcial, y haber tratado a un mínimo de 15 pacientes con CaP en los 12 meses previos.
Para este estudio se elaboraron 3 cuestionarios: uno para URO (Q1) y otro para OR (Q2), que difería ligeramente del Q1, ambos de 22 preguntas; y otro para OM (Q3), donde se trata a pacientes en estadios más avanzados de la enfermedad. El Q3 contenía 21 preguntas. Los 3 cuestionarios constaban de 3 secciones: a) una sección de cribado para hacer de filtro y asegurar que los entrevistados cumplían el perfil requerido según los criterios de inclusión (10 preguntas iguales en todos los cuestionarios que recogían información sobre especialidad, hospital, experiencia y responsabilidad en la prescripción del tratamiento del CaP); b) una sección de manejo de los pacientes para estimar el número de pacientes tratados por especialidad según el estadio de la enfermedad y su manejo terapéutico (11 preguntas en Q1 y Q2 y 10 en Q3 sobre el número de facultativos que trabaja en su servicio, el número de pacientes diagnosticados en los últimos 12 meses y pruebas utilizadas para elegir el tratamiento, y los perfiles de los pacientes recién diagnosticados), y c) una sección de coordinación (una pregunta en Q1, Q2 y Q3) para conocer cómo se comparte el seguimiento de los pacientes con CaP entre especialidades. Cabe destacar que a URO y OR también se les preguntó sobre el perfil y tratamiento de los pacientes con CaP localizado, el número de pacientes que presentaban RBQ, las pruebas complementarias utilizadas en estos pacientes y sobre las diferencias en el porcentaje de pacientes con CaP localizado que acaban desarrollando RBQ según la primera línea de tratamiento. Por otro lado, se preguntó a OM sobre los estadios más avanzados de la enfermedad, es decir, los pacientes presentados al comité multidisciplinar de tumores.
Se realizó un análisis descriptivo de las variables del estudio mediante frecuencias absolutas y relativas. El número de pacientes prevalentes e incidentes, con RBQ o CaP localizado, se obtuvo a través de la encuesta médica de los hospitales incluidos en la muestra del estudio. El porcentaje de la población hospitalaria recogida en la encuesta médica en cada pregunta se determinó con base en la estructura de Sanibricks de IQVIA para las áreas sanitarias. Para extrapolar los resultados de la encuesta médica a toda la población nacional, se dividió el número de pacientes obtenidos en la encuesta médica entre el porcentaje de población española cubierto en cada pregunta. Finalmente, según los requerimientos del análisis, se consideró el porcentaje de pacientes que estaban siendo tratados de forma compartida por múltiples especialidades para evitar sobrestimaciones.
ResultadosCaracterización de la muestraUn total de 170 facultativos procedentes de 131 hospitales españoles fueron entrevistados (85 URO, 64 OR y 21 OM). Las entrevistas se distribuyeron en función de la población, por lo que las comunidades autónomas con más hospitales presentaron una muestra más grande (Fig. S1, Material suplementario).
Los facultativos entrevistados tenían una media de 17 años (rango 5-40) de experiencia. La mayoría de OR y OM entrevistados (80 y 76%, respectivamente) pertenecían al sector público exclusivamente, en comparación con el 32% de URO entrevistados. En promedio, los URO habían visitado a 400 pacientes en los últimos 12 meses (27% eran pacientes nuevos), los OR a 175 pacientes (42% eran pacientes nuevos) y los OM a 58 pacientes con nuevos diagnósticos de CaP. Los URO entrevistados eran responsables del 38% de los nuevos diagnósticos de CaP de todos los pacientes que llegaban a su servicio, mientras que las cifras correspondientes a OR y OM eran del 43 y 78%, respectivamente. Cabe destacar que los servicios de OR y OM contaban, en promedio, con 10 facultativos. En estos servicios, el 50% de los URO y el 40% de los OR iniciaban el tratamiento de los pacientes con CaP, mientras que solo el 19% de los OM eran responsables de la prescripción o el seguimiento del tratamiento de los pacientes con CaP. Más de la mitad de los hospitales disponían de consultas monográficas de CaP, en su mayoría pertenecientes al servicio de urología, aunque este porcentaje variaba entre el 55%, según las respuestas de OR, y el 73% según URO y el 81% según las respuestas de OM. Más del 90% de los hospitales contaban con un comité multidisciplinar de tumores.
Estimación de la incidencia y prevalencia del cáncer de próstata según los datos de la encuesta médicaA partir de los datos de las entrevistas, 24.057 nuevos pacientes fueron diagnosticados de CaP durante los últimos 12 meses en los hospitales participantes (N=131), cubriendo el 59% de la población total española. Extrapolando la muestra al conjunto de España, la incidencia anual puede estimarse en 40.531 nuevos diagnósticos.
En cuanto a la prevalencia de pacientes con CaP, 97.167 pacientes visitaron URO, 64.476 OR y 45.405 OM en los hospitales incluidos en la muestra. Con base en lo anterior, y corrigiendo el sesgo derivado de que algunos pacientes son tratados por múltiples especialidades, la prevalencia estimada de CaP en España es de 221.689 pacientes.
Diagnóstico y perfiles de los pacientes con cáncer de próstata en el momento del diagnóstico y de la derivaciónEn cuanto al estadio de la enfermedad en el momento del diagnóstico, el 79% de los pacientes atendidos por URO y el 80% de los atendidos por OR presentaban un CaP localizado en el momento del diagnóstico (el 21 y el 20%, respectivamente, correspondían a enfermedad metastásica). A los OM se les preguntó por el estadio del CaP en el momento de la derivación de los pacientes, y se obtuvieron las siguientes cifras: CaP localizado (29%), CPRCnm (10%), CaP no metastásico con RBQ (10%), CPRCm (22%), CPHSm sincrónico (15%) y CPHS metacrónico (14%).
En cuanto a las pruebas utilizadas para el diagnóstico del CaP, la biopsia fue la prueba más utilizada entre las 3 especialidades (90% URO y 92% OR y OM), seguida de la TC abdominopélvica (58% URO, 74% OR y 72% OM), la RM multiparamétrica (51% URO y 61% OR) y la TC torácica (54% OM) (tabla 1). Se realizaron biopsias a la mayoría de los pacientes independientemente de su edad, estado de salud y riesgo de CaP, mientras que el riesgo de CaP fue el principal factor decisivo a la hora de elegir entre las demás pruebas, especialmente las pruebas de imagen de nueva generación (PET/TC con PSMA/colina). (Tabla S1, Material suplementario).
Tratamiento de pacientes con cáncer de próstata localizadoSegún la encuesta, la mayoría de los pacientes diagnosticados de CaP localizado recibieron tratamiento radical tanto por parte de URO (61%) como en OR (57%) (Tabla S2, Material suplementario). Los pacientes no tratados y aquellos en vigilancia activa presentaban habitualmente un CaP de bajo riesgo. Considerando todos los pacientes diagnosticados en los últimos 12 meses por grupos de riesgo (tabla 2), el 58% de los pacientes de bajo riesgo recibieron tratamiento radical y el 38% estaban en vigilancia activa, mientras que estos porcentajes fueron del 91 y el 2% para los pacientes de riesgo intermedio y del 86 y el 1% para los pacientes de alto riesgo, respectivamente. Los pacientes en tratamiento exclusivo con TPA constituían el 1% de los pacientes de bajo riesgo, el 6% de los pacientes de riesgo intermedio y el 13% de los pacientes de alto riesgo, mientras que los pacientes sin tratamiento constituían el 2% de los pacientes de bajo riesgo, el 0% de los pacientes de riesgo intermedio y el 1% de los pacientes de alto riesgo. Extrapolando el número de pacientes incidentes diagnosticados de CaP localizado en el último año, según el tratamiento que recibían, 17.582 pacientes recibieron tratamiento radical, 3.753 vigilancia activa, 1.422 TPA exclusiva y 683 permanecieron sin tratamiento. De todos los pacientes diagnosticados de CaP localizado incidente, 2.590 experimentaron RBQ postoperatoria: 1.601 post-RT, 1.286 recidiva locorregional y 1.288 recidiva metastásica.
Tratamiento de pacientes con cáncer de próstata localizado en los servicios de urología y oncología radioterápica según los grupos de riesgo
| Tratamiento radical | Vigilancia activa | TPA exclusiva | Sin tratamiento | |
|---|---|---|---|---|
| Riesgo bajo, % | 58 | 38 | 1 | 2 |
| Riesgo intermedio, % | 91 | 2 | 6 | 0 |
| Riesgo alto, % | 86 | 1 | 13 | 1 |
Pacientes diagnosticados en los últimos 12 meses.
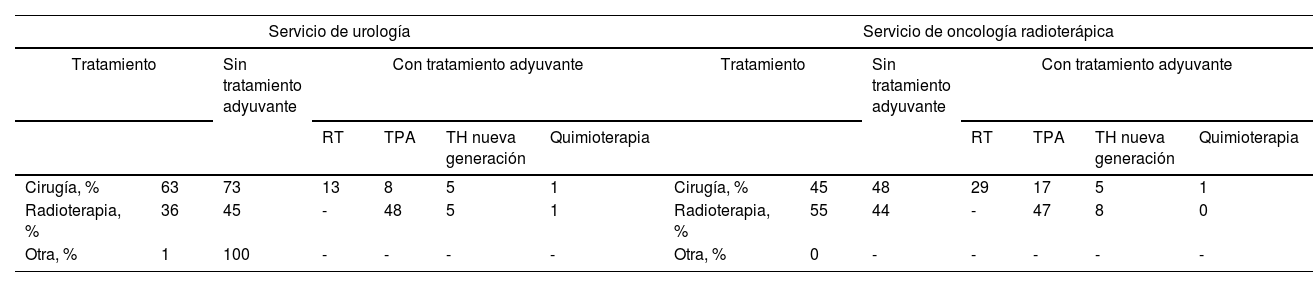
La mayoría de los pacientes con CaP localizado sometidos a tratamiento radical fueron tratados con cirugía (63% en el caso de URO y 45% en el de OR). En cuanto al perfil de los pacientes, se realizó cirugía a los más jóvenes (<70 años), a aquellos con puntuación ECOG de 0 a 1 (buen estado de salud) y a los de riesgo intermedio; se realizó RT a los pacientes de entre 70 y 85 años con buen estado de salud y riesgo intermedio; y se prescribió TPA a los pacientes de más edad (>85 años) y riesgo alto, independientemente de la puntuación ECOG. Se indicó tratamiento adyuvante por URO y OR a los pacientes con alto riesgo de CaP (tabla 3).
Tratamiento radical del cáncer de próstata localizado en los servicios de urología y oncología radioterápica
| Servicio de urología | Servicio de oncología radioterápica | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Tratamiento | Sin tratamiento adyuvante | Con tratamiento adyuvante | Tratamiento | Sin tratamiento adyuvante | Con tratamiento adyuvante | ||||||||
| RT | TPA | TH nueva generación | Quimioterapia | RT | TPA | TH nueva generación | Quimioterapia | ||||||
| Cirugía, % | 63 | 73 | 13 | 8 | 5 | 1 | Cirugía, % | 45 | 48 | 29 | 17 | 5 | 1 |
| Radioterapia, % | 36 | 45 | - | 48 | 5 | 1 | Radioterapia, % | 55 | 44 | - | 47 | 8 | 0 |
| Otra, % | 1 | 100 | - | - | - | - | Otra, % | 0 | - | - | - | - | - |
| Perfil más común de pacientes según el tipo de tratamiento(edad, estado de salud, riesgo CaP) | Perfil más común de pacientes según el tipo de tratamiento(edad, estado de salud, riesgo CaP) | ||||||
|---|---|---|---|---|---|---|---|
| Cirugía | <70; Bueno; Intermedio | Radioterapia | 70-85; Bueno; Intermedio | Cirugía | <70; Bueno; Intermedio | Radioterapia | 70-85; Bueno; Intermedio |
| Cirugía+TPA | Indif.; Bueno; Alto | Radioterapia+TPA | 70-85; Bueno; Alto | Cirugía+TPA | <70; Bueno; Intermedio | Radioterapia+TPA | 70-85; Bueno; Alto |
| Cirugía+RT adyuvante | <70; Bueno; Alto | TPA | > 85; Indif.; Alto | Cirugía+RT adyuvante | <70; Bueno; Alto | TPA | >85; Indif.; Alto |
Pacientes diagnosticados en los últimos 12 meses.
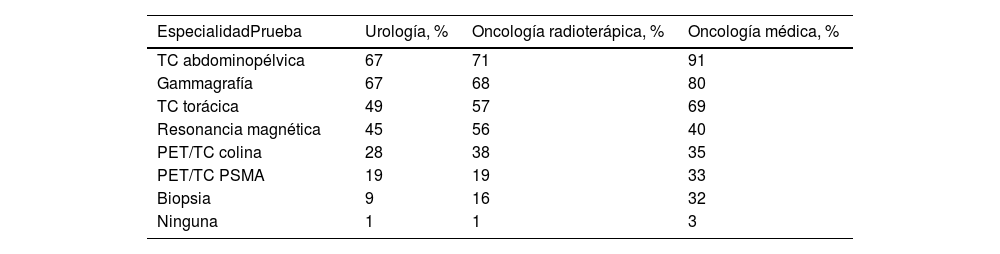
Extrapolando las cifras, se estima que en la actualidad un total de 6.144 pacientes prevalentes presentan RBQ no metastásica, independientemente del momento del diagnóstico de CaP. En los últimos 12 meses, 5.063 pacientes incidentes presentaban RBQ (metastásica o no metastásica). Más del 90% de los pacientes con RBQ se sometieron a las pruebas habituales. La TC abdominopélvica y la gammagrafía fueron las pruebas más utilizadas en los pacientes con RBQ en todas las especialidades, seguidas de la TC torácica (en las especialidades de URO y OR) y la RM (en la especialidad de OM). Se realizó PET/TC colina en el 28-38% de los pacientes, mientras que la PET/TC con PSMA se realizó en el 19% (URO y OR) y 33% (OM) de los pacientes. La biopsia, por el contrario, tuvo un uso limitado (tabla 4). Según la mayoría de los especialistas, la selección de pruebas no estaba relacionada con la edad, el estado de salud o el riesgo de RBQ del paciente.
Pruebas empleadas en pacientes con recurrencia bioquímica
| EspecialidadPrueba | Urología, % | Oncología radioterápica, % | Oncología médica, % |
|---|---|---|---|
| TC abdominopélvica | 67 | 71 | 91 |
| Gammagrafía | 67 | 68 | 80 |
| TC torácica | 49 | 57 | 69 |
| Resonancia magnética | 45 | 56 | 40 |
| PET/TC colina | 28 | 38 | 35 |
| PET/TC PSMA | 19 | 19 | 33 |
| Biopsia | 9 | 16 | 32 |
| Ninguna | 1 | 1 | 3 |
En cuanto al manejo de la RBQ por parte de OM, en el 81% de los centros, todos los pacientes fueron presentados al comité de tumores, mientras que en el 19% restante, solo los pacientes de alto riesgo y peor evolución fueron presentados al comité de tumores.
De todos los pacientes con CPHSm, el 44% recidivó después de haber recibido tratamiento para el CaP localizado (aproximadamente el 50% de ellos tratados con PR), y el 56% eran CPHSm sincrónicos. De todos los pacientes con CPRCm, el 47% eran CaP metastásico metacrónico y el 53% eran CaP metastásico sincrónico.
Alrededor de un tercio de los URO y OR entrevistados percibieron diferencias en la tasa de pacientes con CaP localizado que progresarían a RBQ en 5 años, dependiendo de la primera línea de tratamiento. En cuanto a los pacientes que presentaban RBQ, cuanto mayor era el riesgo de CaP, mayor era la probabilidad de presentar RBQ (Tabla S3, Material suplementario).
Tratamiento de pacientes con recurrencia bioquímicaEn cuanto a las opciones de tratamiento prescritas a los pacientes con RBQ, la RT sola o con TPA fue el tratamiento preferido por los URO (60%) y los OR (70%), mientras que la TPA sola fue preferida por el 15% de los URO y el 11% de los OR. La cirugía fue la opción preferida principalmente por los URO y los OR, mientras que la cirugía combinada con TPA fue utilizada esporádicamente por los URO y los OR. La opción de observación no fue contemplada por los OM; solo la consideraron los URO (6%) y los OR (3%) (tabla 5). La TPA sin pruebas de imagen fue prescrita por el 10% de los URO y el 15% de los OR, en promedio, para entre el 27 y el 29% de sus pacientes. Cabe destacar que el 63% de los pacientes tratados con TPA sin pruebas de imagen por los URO ya habían agotado todas las opciones de tratamiento de rescate; esta cifra era del 44% para los pacientes de OR. Por otra parte, alrededor del 30% de los OM prescribieron tratamientos de TPA sin pruebas de imagen a alrededor del 36% de los pacientes con RBQ. Cuando se les preguntó por el perfil de paciente en el que prescribir TPA sin pruebas de imagen previas, los URO, los OR y los OM mencionaron a pacientes de edad avanzada, con muchas comorbilidades y/o una esperanza de vida reducida. La principal razón citada por los URO y OR fue mejorar la calidad de vida, mientras que los OM mencionaron la voluntad del paciente de evitar tratamientos complejos.
Coordinación entre serviciosRespecto a URO, el 69% de los pacientes fueron tratados exclusivamente en el servicio de urología, el 20% en colaboración con oncología radioterápica y el 10% en el servicio de oncología médica. En OR declararon que el 37% de los pacientes eran tratados en el servicio de urología, el 52% exclusivamente por OR y el 11% en colaboración con el servicio de oncología médica. Según OM, el 47% de los pacientes eran tratados solo en el servicio de oncología médica, el 33% en colaboración con urología y el 19% en coordinación con el servicio de oncología radioterápica.
DiscusiónEl CaP es la neoplasia más prevalente en los varones españoles. Esta enfermedad constituye un problema relevante de salud pública debido al fuerte impacto en la calidad de vida de los pacientes y a los costes asociados al elevado número de consultas generadas por los pacientes, las bajas laborales y pruebas complementarias requeridas11,12. El presente estudio se realizó para conocer con mayor profundidad el perfil de los pacientes con CaP en el momento del diagnóstico y el manejo actual de los pacientes con CaP localizado y RBQ en España, desde el punto de vista de las 3 especialidades implicadas: URO, OR y OM.
La incidencia de CaP extrapolada reportada en este estudio (40.551) es superior a la reportada en el último informe de la SEOM (29.002 pacientes para 2022)1. Sin embargo, la prevalencia calculada a partir de las entrevistas realizadas en el presente estudio (221.689) es inferior a la reportada por la SEOM (259.788 pacientes en 2020). A pesar de tratarse de un estudio de percepción, los resultados entre URO y OR son consistentes con las estimaciones de la SEOM, si bien las estimaciones de incidencia y prevalencia de la SEOM no consideran los efectos de la pandemia de COVID-19.
En cuanto a la pregunta sobre el estadio de los pacientes en el momento del diagnóstico durante los últimos 12 meses, se estimó que el 21% eran pacientes con CaP metastásico sincrónico, cifras considerablemente superiores a las comunicadas anteriormente. Según la SEOM, actualmente la mayoría de los casos de CaP reciben un diagnóstico precoz19, con solo un 10% de casos avanzados (metastásicos) en el momento del diagnóstico20. Esto podría tratarse de una subestimación, aunque con la pandemia de COVID-19, el número de pacientes metastásicos sincrónicos podría haber aumentado debido al posible retraso en el diagnóstico21. Teniendo en cuenta que los pacientes metastásicos sincrónicos reciben un seguimiento más activo y que los entrevistados responden en función de lo que recuerdan, los pacientes de este grupo podrían haber sido sobrestimados.
Según los resultados, cerca del 30% de los pacientes son derivados a OM cuando su estadio es localizado, la cual es una cifra considerablemente superior a la esperada. Este resultado podría tener su explicación si algunos centros sin RT en OM tuvieran que derivar al paciente a otro hospital. La mayoría de los URO colaboran estrechamente con los servicios de oncología en la práctica clínica. Sin embargo, se estima que menos del 5% de los pacientes son derivados a un OM antes de desarrollar enfermedad resistente a castración22. Según las respuestas de las 3 especialidades, más del 90% de los pacientes se someten a biopsia tras el diagnóstico de CaP para la elección del tratamiento, lo que contrasta con los estudios de la vida real que determinan que alrededor del 20% de los pacientes no se someten a diagnóstico histológico23,24, seguido de RM tanto para URO como OR y TC torácica para OM. Las guías del RADAR III y de la EAU señalan que las técnicas de imagen convencional siguen teniendo un papel importante en la estadificación del CaP, a pesar de que la imagen de nueva generación (NGIs) es más sensible y consistente15,25. Estudios recientes, como el ProPSMA, demuestran que la PET-PSMA es más precisa para la detección inicial de metástasis26. Sin embargo, según las respuestas, PET colina/PSMA es la prueba menos utilizada, aunque con un uso ligeramente mayor por parte de los OM. En el momento de realizar este estudio, estas pruebas no eran parte de la práctica habitual en los estadios iniciales del CaP; solo se realizaban en pacientes con RBQ y en aquellos con sospecha de metástasis. Por otro lado, estas pruebas podrían realizarse en ensayos clínicos, que serían llevados a cabo principalmente por OM.
Según los especialistas, la mayoría de los pacientes con CaP localizado reciben tratamiento radical (cirugía o RT), mientras que un bajo porcentaje recibe TPA como tratamiento primario, ya que las guías recomiendan ofrecerlo a pacientes de alto riesgo y a pacientes seleccionados (tiempo de duplicación del PSA<12 meses y PSA>50ng/mL o un tumor poco diferenciado y en pacientes que no desean intentar un tratamiento curativo)15. Esto contrasta con los resultados de estudios de vida real realizados en España, como el AfroDiTa (n=103), que mostró que el 75% de los pacientes incluidos (CPRC-MX) no recibieron tratamiento con intención curativa en el momento del diagnóstico inicial, y el Registro Español de Cáncer de Próstata, donde el 14% de los pacientes recibieron TPA como primer tratamiento24,27. Además, la mayoría de los pacientes con CPRCnm incluidos en el ensayo clínico SPARTAN tampoco habían recibido tratamiento con intención curativa28, y según el grupo GESCAP, el 15,66% de los pacientes con CaP localizado recibieron TH como primer tratamiento29. Se esperan cambios en el panorama actual con la futura introducción de nuevas TH como tratamientos neoadyuvantes y adyuvantes a la PR o a la RT30,31.
En caso de PSA recurrente después de la PR, las directrices de la EAU recomiendan (grado débil) realizar PET/TC con PSMA si el nivel de PSA es>0,2ng/mL y si los resultados pueden influir en las decisiones terapéuticas posteriores. En los casos en los que no se disponga de PET/TC con PSMA y el nivel de PSA sea>1ng/mL, se recomienda realizar pruebas de imagen con PET/TC con fluciclovina o colina si los resultados pudieran influir en las decisiones terapéuticas posteriores. En caso de recurrencia del PSA tras la RT, las guías recomiendan (grado débil) la realización de una RM prostática para localizar las áreas anormales y dirigir las biopsias en pacientes aptos para tratamiento local de rescate, y recomiendan (grado fuerte) la realización de PET/TC con PSMA (si está disponible) o PET/TC con fluciclovina o colina en pacientes aptos para tratamiento curativo de rescate. En cuanto a las pruebas más utilizadas en la RBQ, la biopsia ya no sería la más utilizada, sino la TC abdominopélvica y la gammagrafía. Para la OR, la gammagrafía sería la prueba principal, seguida de la TC abdominopélvica y la RM, lo que parece coherente, ya que la RM ha demostrado excelentes resultados en la detección de recidivas locales tras la RT14. La PET/TC con PSMA es más precisa para la estadificación que la TC y la gammagrafía ósea para la enfermedad de alto riesgo, pero hasta la fecha no existen datos de resultados para informar sobre el manejo posterior15. Llama la atención la elevada tasa de TC y gammagrafías utilizadas en pacientes con RBQ (>60%). Esto podría deberse a que, en muchos centros, se requiere de una prueba previa para solicitar PET colina/PSMA. El escaso uso de NGIs es alarmante, dada la baja sensibilidad de las pruebas convencionales y la recomendación actual de guías que avalan las NGIs en este escenario14,25. Centrándonos solo en el tratamiento con TPA, la mayoría de los facultativos entrevistados afirmaron que no prescribían TPA sin pruebas de imagen previas, lo que contrasta con estudios anteriores realizados en la vida real, en los que entre el 23 y el 33% de los pacientes tratados con TPA continua no disponían de pruebas de imagen basales23,24. Hay que tener en cuenta que hasta hace poco no se disponía de pruebas de imagen sensibles a valores bajos de PSA, por lo que en el contexto de los pacientes que recibían RT de rescate (es decir: con PSA inferiores a 1ng/mL) no era habitual solicitarlas.
Este estudio tiene algunas limitaciones inherentes a su metodología; la información se recopiló a partir de entrevistas con los facultativos, por lo que no puede excluirse un sesgo de recuerdo. Otra limitación es relativa al panel, que se supone representativo de toda España; sin embargo, estos médicos pueden diferir de los que no participaron, lo que puede dar lugar a un sesgo de selección. A pesar de estas limitaciones, este estudio describe los perfiles de los pacientes en el momento del diagnóstico y proporciona una visión del manejo terapéutico actual del CaP localizado y de la RBQ en la práctica clínica en España. Una fortaleza importante de este estudio es que se han incluido en la encuesta las 3 especialidades que habitualmente tratan a los pacientes con CaP, además de diferentes tipos de hospitales (diferente tamaño, población de cobertura, con y sin comité multidisciplinar, etc.) en toda España, y por lo tanto proporciona una visión muy realista de la práctica clínica real en España.
ConclusionesEn conclusión, este es el primer estudio realizado mediante encuestas a médicos especialistas que permite conocer sus percepciones y esbozar las similitudes y diferencias con los estudios de práctica clínica y las recomendaciones de las guías. En nuestro estudio, realizado sobre una muestra de las diferentes especialidades que actualmente tratan el CaP, el número de pacientes con CaP obtenido supera otras estimaciones previamente comunicadas que podrían no haber tenido en cuenta el retraso en el diagnóstico provocado por la pandemia. A pesar de la baja sensibilidad de las pruebas convencionales en algunos estadios del CaP y de las recomendaciones de las guías de utilizar pruebas ING, la PET con colina/PSMA se sigue utilizando de forma residual, aunque la edad de los pacientes, más que su estado de salud, parece ser el principal factor determinante a la hora de elegir entre las diferentes pruebas diagnósticas. Actualmente, la mayoría de los pacientes con CaP localizado reciben tratamiento con cirugía y RT, mientras que para los pacientes con RBQ, los URO y OR prefieren la RT y los OM prefieren la TPA sola o en combinación. Teniendo en cuenta las recomendaciones de las directrices actuales, nuestros resultados muestran una proporción de pacientes tratados con TPA sola o sin biopsia previa mayor que la esperada.
AutoríaTodos los autores contribuyeron en la elaboración del concepto y los cuestionarios y aportaron su experiencia en el tratamiento del cáncer de próstata. Todos los autores han leído y aportado comentarios sobre el borrador del manuscrito, y han aprobado el borrador final del manuscrito para su presentación.
FinanciaciónEste trabajo fue apoyado por Janssen.
Conflicto de interesesRocío Marcos, Jacobo Muñoz del Toro, Xavier Moix y Alba Quesada son empleados de Janssen.
Jesús Muñoz-Rodríguez informa haber colaborado en consultoría o asesoría con Astellas, AstraZeneca, Bayer y Janssen; honorarios de conferencias con Astellas, Bayer, Casen Recordati, Ipsen y Janssen; fondos de investigación con Astellas, Ipsen y Janssen; viajes y alojamiento con Astellas, Bayer, Casen-Recordati, Ipsen y Janssen.
Natalia Vidal informa de haber colaborado en consultoría y asesoría con Janssen y Astellas; conferenciante con Sanofi, AstraZeneca, Astellas, Janssen, Roche, MSD e Ipsen; viajes con Pfizer, Pierre Fabre y BMS.
Raquel Correa declara no tener ningún conflicto de intereses.