PRESENTACION
Cuando se aprobó por la Sociedad Española de Inmunología Clínica y Alergia Pediátrica y por la Sociedad Española de Neumología Pediátrica la organización de una reunión conjunta en Mayo de 2004, fue iniciativa de ambas directivas crear una comisión mixta que redactara un documento en el que se recogiera lo esencial en el tratamiento del asma en el niño en una visión unificadora de criterios, hasta ahora, aparentemente diversos.
La primera reunión de esta comisión tuvo lugar en Junio de 2003 y en ella se sentaron las bases para este documento. Se acordó dedicar una especial atención a las épocas de la vida en la que el asma es más complicada, tanto en su diagnóstico como en su tratamiento. Por primera vez en una guía de este tipo se ha incluido la predicción del fenotipo de asma como una variable a tener en cuenta en algunas decisiones terapéuticas.
No se ha pretendido que este documento sea una guía exhaustiva, y por lo tanto aspectos tan fundamentales como la educación y los autocuidados no se han tratado debido a que son temas en los que el consenso es universal.
Lo más importante del documento es la conjunción de dos visiones hasta ahora aparentemente antagónicas sobre el asma en el niño. Cada una de las frases de este documento ha sido revisada cuidadosamente y es asumida corporativamente tanto por una Sociedad como por la otra. El objetivo fundamental es, por tanto, ofrecer un criterio claro y uniforme sobre el tratamiento del asma en pediatría.
Ambas Sociedades hacen votos para que esta colaboración no acabe aquí, sino que continúe regularmente con otras iniciativas, incluyendo la futura actualización de este documento.
INTRODUCCION
Epidemiología
La epidemiología del asma en España es bien conocida en los niños de más de 6 años, pero no hay estudios por debajo de esa edad. A diferencia de los países sajones, la prevalencia del asma en España es relativamente baja: aproximadamente un 9 % de los niños de 13-14 años reconocen haber tenido síntomas durante el año anterior; y el 10 % de padres de niños de 6-7 años informan que sus hijos han padecido sibilancias en el mismo período. Esta prevalencia ha permanecido constante en los niños mayores entre 1994 y 2002, mientras que ha aumentado ostensiblemente (de 7 % a 10 %) en los niños de 6-7 años. Las sibilancias graves son mucho menos frecuentes en ambas edades (en torno al 2 %) y también han aumentado en el grupo de 6-7 años, mientras se mantienen en el grupo de 13-14 años. En estas edades, parece existir una mayor prevalencia y gravedad del asma en las zonas costeras en relación a la meseta.
Definición
Para el propósito de este documento, referido al niño (con especial atención a las edades tempranas de la vida) donde la fisiopatología del asma es en buena parte desconocida, la definición más adecuada es la de los consensos pediátricos1,2, como sigue: "Sibilancias recurrentes y/o tos persistentes en una situación en la que el asma es probable y se han descartado otras enfermedades menos frecuentes". A partir de los 3 años el asma se hace progresivamente más definitiva y a partir de los 6-7 años, cuando ya pueden aplicarse las definiciones fisiopatológicamente más estrictas de los consensos generales (GINA, NHLBI, etc.).
Fenotipos de asma
Aunque la fisiopatología del asma en la infancia está lejos de ser comprendida, sí parecen existir diferentes fenotipos clínicos de esta enfermedad que han sido bien caracterizados en diversas cohortes en varios países3-13 y de las que existen numerosas publicaciones. Aún con cierta cautela, creemos posible aplicar estos fenotipos a la población española. Este documento pretende establecer la mejor pauta de tratamiento para cada fenotipo de acuerdo con las evidencias científicas disponibles. La exacta definición de estos fenotipos es, por consiguiente, básica:
Asma transitoria
Aparece antes de los 3 años y desaparece entre los 6 y 8 años
No es atópico, (IgE total normal y/o pruebas cutáneas y/o Phadiatop negativo, junto con la ausencia de estigmas dermatitis atópica, por ejemplo o de antecedentes alérgicos).
Función pulmonar disminuida desde el nacimiento y normal a los 11 años.
Asma persistente precoz
Aparece antes de los 3 años y persiste más allá de los 6-8 años.
Función pulmonar normal al año y disminuida a los 6 años.
Se pueden diferenciar dos sub-fenotipos.
Atópica
IgE total elevada y/o pruebas cutáneas positivas, generalmente con estigmas y antecedentes familiares.
Hiperreactividad bronquial positiva.
Suele persistir a los 13 años.
La primera crisis suele aparecer después del año.
Predominio en varones.
No atópica
IgE total normal y pruebas cutáneas negativas, sin estigmas ni antecedentes.
Sin hiperreactividad bronquial.
Suele desaparecer a los 13 años.
La primera crisis suele ser antes del año y relacionada con una bronquiolitis por virus sincitial respiratorio.
Afecta por igual a ambos sexos.
Asma tardía
Se inicia entre los 3 y 6 años.
Función pulmonar normal a los 6 años que se deteriora posteriormente.
Frecuentemente atópica (antecedentes en la madre, rinitis durante los primeros años y pruebas cutáneas positivas a los 6 años).
Predominio en varones.
Es el asma persistente atópica, pero de comienzo tardío.
Predicción del fenotipo asmático
Desde el punto de vista práctico, es importante intentar clasificar el fenotipo de un determinado niño en las primeras crisis. Un niño que presenta sibilancias precoces y posee un factor de riesgo mayor y dos menores de los indicados abajo tendrá una probabilidad alta de padecer un asma persistente atópica. Sin embargo, debe tenerse en cuenta que estos criterios ofrecen una sensibilidad baja (39.3 %; es decir, incluyen bastantes falsos positivos) pero una especificidad bastante alta (82.1 %; es decir, excluyen casi todos los falsos negativos)14.
Factores de riesgo mayores
Diagnóstico médico de asma en los padres.
Diagnóstico médico de dermatitis atópica.
Factores de riesgo menores
Diagnóstico médico de rinitis.
Sibilancias no relacionadas con resfriados.
Eosinofilia ≥ 4 %.
El desarrollo de IgE específica frente al huevo durante el primer año de vida es un índice predictivo de riesgo de enfermedad atópica, siendo el principal y más precoz marcador serológico de una posterior sensibilización a alergenos inhalantes y del desarrollo de patología alérgica respiratoria15,16. Además, cuando la alergia al huevo se asocia a dermatitis atópica la probabilidad de presentar a los 4 años patología alérgica respiratoria se eleva al 80 %17.
DIAGNOSTICO DEL ASMA BRONQUIAL EN LA INFANCIA
Diagnóstico clínico
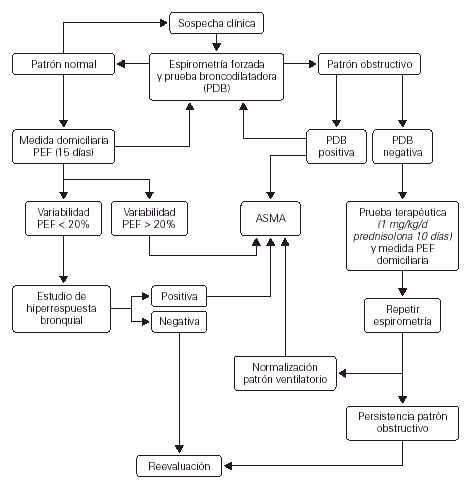
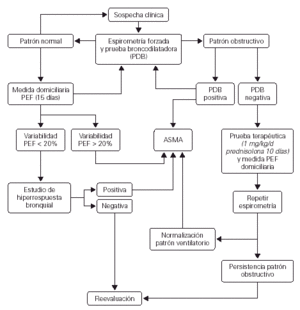
La historia clínica debe ir encaminada a esclarecer los aspectos más importantes relacionados con el asma, en especial en lo referente al diagnóstico diferencial. Deben constatarse los síntomas y signos y las características de las crisis, valorar los períodos intercrisis e identificar los factores precipitantes y agravantes (véase en la figura 1 el algoritmo diagnóstico).
Figura 1.--Algoritmo para el diagnóstico de asma. (Modificada de18.)
Diagnóstico funcional
La exploración funcional respiratoria sirve para confirmar el diagnóstico de asma, cuantificar la gravedad de la enfermedad, monitorizar la evolución y objetivar la respuesta al tratamiento. En niños colaboradores debe realizarse por espirometría (espirómetros o neumotacógrafos) que por su sencillez y coste es la prueba principal para objetivar la obstrucción bronquial. En niños no colaboradores se utilizan otras pruebas, como la pletismografía corporal, la oscilometría por impulsos, las resistencias por oclusión o la compresión tóraco-abdominal.
Se debe estudiar la reversibilidad de dicha obstrucción bronquial y/o el grado de hiperreactividad de los bronquios. Para ello se utilizan las pruebas broncodinámicas, como la prueba de broncodilatación y las de hiperreactividad bronquial inespecífica (metacolina, ejercicio, etc.).
Prueba broncodilatadora
Consiste en realizar una espirometría basal y, tras comprobar que existe un patrón obstructivo, repetirla a los 10 minutos de haber administrado un beta-adrenérgico inhalado de corta duración (salbutamol 200 mcg o equivalente). El parámetro espirométrico más empleado para valorar esta prueba es el FEV1. El PEF, al ser dependiente del esfuerzo, es menos fiable.
Hay distintos métodos o índices para expresar la respuesta broncodilatadora y, de ellos, el más utilizado es el cambio porcentual respecto al valor inicial en el FEV1; es decir: Δ % = [(FEV1 post - FEV1 pre)/ FEV1 pre] × 100. Se considera positivo un incremento del FEV1 de un 12 %18 (Evidencia C).
Hiperrespuesta bronquial
Las pruebas de provocación bronquial demuestran la presencia o ausencia de hiperreactividad bronquial inespecífica y/o específica (por alergenos). Habitualmente no son necesarias para el diagnóstico y seguimiento del niño asmático, pero pueden ser muy útiles para el diagnóstico diferencial.
Diagnóstico alergológico
El objetivo del diagnóstico alergológico es determinar el alergeno implicado en la patología del niño con asma o confirmar la sospecha del alergeno desencadenante puesta de manifiesto a través de la historia clínica.
La técnica fundamental en el diagnóstico alergológico son las pruebas cutáneas: prick test (sencilla, rápida y segura) o intradermorreacción; sin embargo en ocasiones podemos encontrar falsos positivos o negativos, siendo preciso complementar con otras técnicas diagnósticas como la determinación de IgE antígeno específica en suero (RAST o CAP system). En ocasiones puede ser necesaria la prueba de provocación bronquial específica, con el fin de llegar al diagnóstico etiológico definitivo.
TRATAMIENTO DEL EPISODIO AGUDO EN PEDIATRIA
Consideraciones generales
El abordaje terapéutico de la crisis aguda de asma dependerá de su gravedad.
Existen escasos protocolos sobre el episodio agudo del lactante, basándose la utilización de fármacos en la experiencia clínica y la extrapolación de datos obtenidos de niños más mayores.
Sería recomendable que los centros de salud dispusieran de un pulsioxímetro para mejorar la valoración de la gravedad de la crisis de asma.
A la hora de tratar el episodio agudo debe tenerse en cuenta:
* El tiempo de evolución de la agudización.
* La medicación administrada previamente.
* El tratamiento de mantenimiento que pueda estar recibiendo.
* La existencia de enfermedades asociadas.
Las crisis leves y moderadas pueden tratarse en Atención Primaria.
Deberá derivarse al niño a Urgencias Hospitalarias cuando haya:
* Crisis grave.
* Sospecha de complicaciones.
* Antecedentes de crisis de alto riesgo.
* Imposibilidad de seguimiento adecuado.
* Falta de respuesta al tratamiento.
Hay que modificar las dosis de los fármacos y los tiempos de administración en relación a la gravedad de la crisis y a la respuesta al tratamiento.
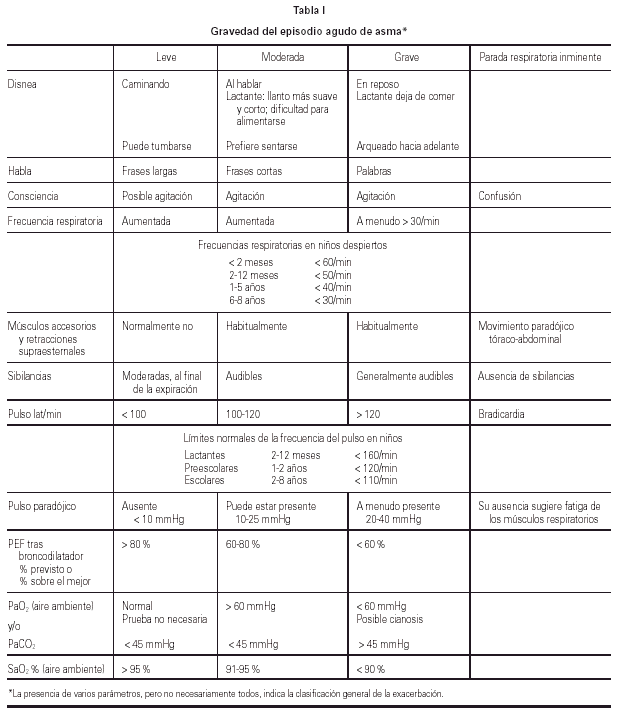
Valoración de la gravedad
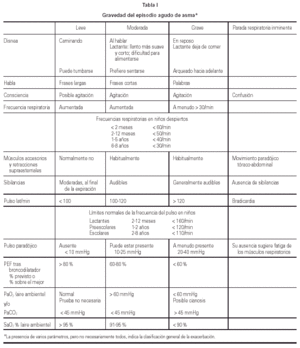
En la tabla I se establece un sistema de evaluación de la gravedad del episodio agudo de asma tomado de la GINA19.
Fármacos
β2 adrenérgicos de acción corta. Constituyen la primera línea de tratamiento. Sus beneficios en el tratamiento de la crisis a esta edad han sido suficientemente contrastados20-29 (Evidencia B). La vía inhalatoria es la de elección por presentar una mayor efectividad con menos efectos secundarios.
El sistema de inhalador presurizado con cámara espaciadora es tan efectivo, si no más, que los nebulizadores en el Servicio de Urgencias, siendo de elección en el tratamiento de episodio leve o moderado de asma 27,30,31 (Evidencia B).
Bromuro de Ipratropio. En algunos estudios se ha mostrado útil asociado a los β2 agonistas de acción corta en las crisis moderadas o graves32-34 aunque la evidencia de su uso en lactantes es limitada y contradictoria35-37. Las dosis nebulizadas son 250 mcg/4-6 h en menores de 30 kg y 500 mcg/4-6 h en mayores 30 kg.
Corticoides. Han mostrado su beneficio cuando se usan precozmente38,39 (Evidencia B) siendo la vía oral la de elección, sobre la parenteral40,41. No existen evidencias suficientes para utilizar los corticoides inhalados en las crisis agudas42-44 (Evidencia B). La dosis recomendada es de 1-2 mg/kg/día (máximo 60 mg) durante 3-5 días, suspendiéndose sin reducción de dosis.
Antibióticos. La mayoría de estos episodios son debidos a infecciones virales, por lo que la administración de antibióticos debe ser excepcional.
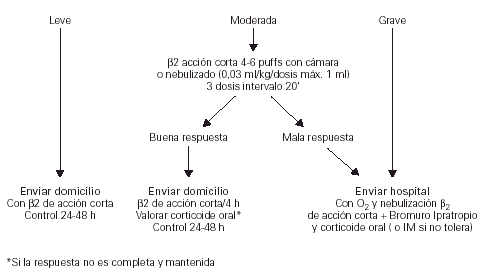
Tratamiento en Atención Primaria
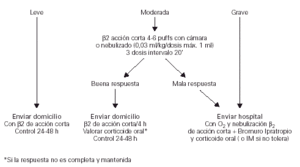
El algoritmo del tratamiento del episodio agudo de asma en Atención Primaria se recoge en la figura 2.
Figura 2.--Tratamiento del episodio agudo de asma en Atención Primaria.
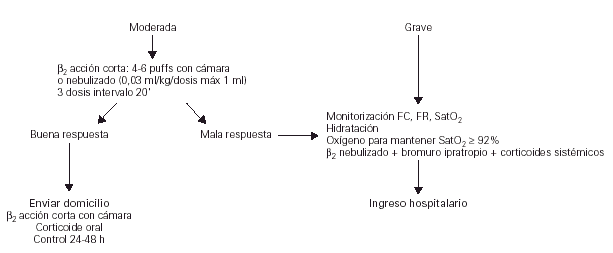
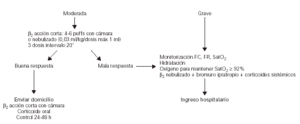
Tratamiento en Urgencias
En la figura 3 se indica el algoritmo del tratamiento del episodio agudo de asma en Urgencias del Hospital.
Figura 3.--Tratamiento del episodio agudo de asma en Urgencias del Hospital. (FC, frecuencia cardíaca; FR, frecuencia respiratoria; SaO2, saturación de oxígeno.)
TRATAMIENTO DE MANTENIMIENTO EN PEDIATRIA
El tratamiento de mantenimiento incluye la evitación de los desencadenantes (alergenos o irritantes), el tratamiento farmacológico, el tratamiento alergológico y la educación y entrenamiento en los autocuidados. Este documento no pretende ser exhaustivo y, por tanto, para temas generales de evitación de desencadenantes, de educación o de farmacología de la medicación antiasmática se aconseja acudir a guías cortas como los protocolos promovidos por la Asociación Española de Pediatría (AEP)45,46 o las guías más extensas como Guía para la Atención del Niño Asmático de la SEICAP47, Asma en Pediatría48, Guía Española para el Manejo del Asma (GEMA), o "Global Strategy for Asthma Management and Prevention" de la Global Initative for Asthma (GINA)19.
Tratamiento farmacológico
Esta sección se divide en dos apartados de acuerdo a la edad del paciente a tratar: niños de hasta 2 años y niños de más de 2 años. La mayoría de las guías se centran en el adulto aunque tengan algún apartado dedicado al niño. Ninguna especifica un tratamiento para el lactante de acuerdo con su clasificación fenotípica.
La clasificación del asma de un niño tiene el exclusivo interés de orientar el tratamiento a elegir en un primer momento. Posteriormente deberá ser la evolución clínica y la consecución de los objetivos de control los que dicten las modificaciones del tratamiento.
Independientemente de la clasificación de la gravedad o situación clínica del asma de un determinado paciente, el objetivo final es el buen control del asma (tabla II).
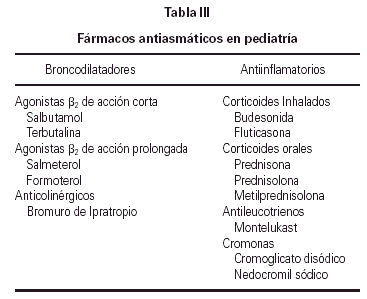
Los fármacos antiasmáticos se dividen en dos grupos fundamentales: broncodilatadores (utilizados habitualmente como aliviadores de síntomas) y antiinflamatorios (controladores de la enfermedad) (tabla III).
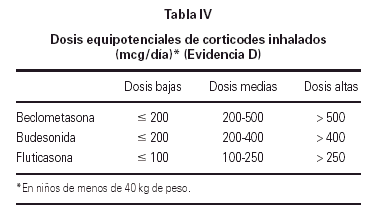
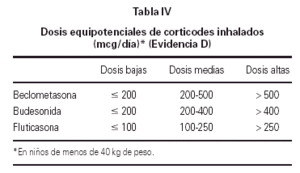
Los fármacos fundamentales en el control del asma son los corticoides inhalados. Las dosis equipotenciales de estos fármacos se recogen en la tabla IV.
La adición de agonistas b2 de acción prolongada a los corticoides inhalados permite utilizar dosis menores de éstos. Estas combinaciones terapéuticas has sido extensamente probadas en adultos y niños de edad escolar49,50.
La medicación inhalada debe ser administrada por medio de los sistemas más adecuados a cada edad (véase apartado sobre sistemas de inhalación).
Inmunoterapia específica
Un reciente meta-análisis pone de manifiesto un efecto beneficioso en términos de reducción de síntomas, de medicación de alivio y de hiperrespuesta bronquial, tanto específica como inespecífica, pero sólo cuando se utilizan extractos estandarizados biológicamente51-54 (Evidencia A).
La inmunoterapia específica puede estar indicada55,56 (Evidencia D):
* Asma mediada por IgE de gravedad leve o moderada. En el asma grave no debe iniciarse hasta que la gravedad de ésta se reduzca con tratamiento farmacológico.
* Cuando existe sensibilización a un único alergeno, o a un alergeno predominante, o a un grupo de alergenos con reactividad cruzada.
La inmunoterapia específica está contraindicada55,56 (Evidencia D):
* En niños con inmunopatías graves o hepatopatía crónica.
* Situaciones psicosociales que no permitan un adecuado seguimiento.
* No debe iniciarse en la adolescente embarazada, aunque se pueden administrar las dosis de mantenimiento correspondientes en pacientes que empezaron a ser tratadas antes del embarazo.
No existe una edad mínima para la administración de la inmunoterapia específica55,56 (Evidencia D).
Aunque no existen datos objetivos, se considera que el tiempo mínimo de tratamiento ha de ser de tres años y el máximo de cinco55,56 (Evidencia D).
La inmunoterapia sublingual puede ser una alternativa a la subcutánea57,58 (Evidencia C) y no suele tener los efectos adversos sistémicos que en rarísimas ocasiones ha tenido la subcutánea59.
Tanto en la inmunoterapia específica subcutánea como sublingual sólo deben utilizarse extractos alergénicos que estén estandarizados biológicamente55,56 (Evidencia B).
La Inmunoterapia subcutánea debe administrarse por personal entrenado. El paciente permanecerá en observación durante 30 minutos después de la inyección.
Niños de menos de 2 años
Consideraciones generales
Muchos de los lactantes con sibilancias durante los primeros meses de vida dejarán de tener síntomas (sibilantes transitorios) con independencia del tratamiento de mantenimiento que se instaure60.
La mayoría de estos episodios son secundarios a infecciones virales8.
La inflamación subyacente en estos casos es probablemente distinta a la del asma atópico del escolar o del adolescente61.
Existen pocos trabajos en los que se puedan basar con seguridad los criterios de tratamiento en estas edades, por lo que en muchos casos habrá que iniciar un tratamiento y variarlo o interrumpirlo si no es efectivo29,62.
Las recomendaciones que se pueden hacer, por tanto, son en buena manera empíricas y de acuerdo con las siguientes suposiciones:
* El lactante posee receptores b2 funcionantes25,63.
* Los fármacos anti-inflamatorios tanto sistémicos como tópicos poseen las mismas propiedades anti-inflamatorias en la edad de la lactancia que posteriormente.
* Los efectos secundarios de los fármacos antiasmáticos en el lactante son superponibles a los que acontecen en edades posteriores.
Se debe tener en cuenta que en los lactantes se hace necesario un diagnóstico diferencial con otras enfermedades como: reflujo gastro-esofágico, fibrosis quística, malformaciones broncopulmonares, inmunodeficiencias, etc.
Fármacos
Corticoides inhalados. No existen suficientes trabajos en esta edad para que se puedan hacer extensivas las indicaciones de estos fármacos en edades posteriores. Sin embargo, los niños con clínica persistente de asma y con factores de riesgo de desarrollar asma persistente posterior pueden responder adecuadamente a este tratamiento64-70 (Evidencia A). Por otro lado, en los lactantes con sibilancias post-bronquiolitis o con episodios de sibilancias relacionados únicamente con infecciones virales la utilidad de los corticoides inhalados es dudosa71-73.
Antileucotrienos. no existen trabajos en estas edades. En un estudio reciente las recurrencias se retrasaron en un seguimiento de un mes tras un episodio de bronquiolitis74. Por tanto, su utilización no está recomendada en la actualidad.
Agonistas β2 de acción prolongada. En este grupo de edad no están actualmente recomendados de forma rutinaria.
Asociación de agonistas β2 de acción prolongada y corticoides inhalados. Aún no existen trabajos en niños de estas edades y, por tanto, no están recomendados en este grupo de edad de forma rutinaria.
Tampoco otros fármacos antiasmáticos como las cromonas o las teofilinas han demostrado su utilidad en lactantes75-81.
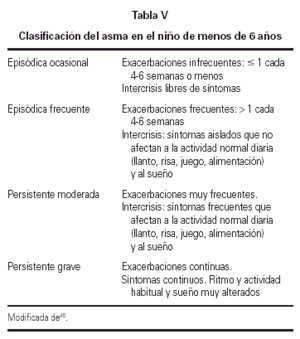
Clasificación
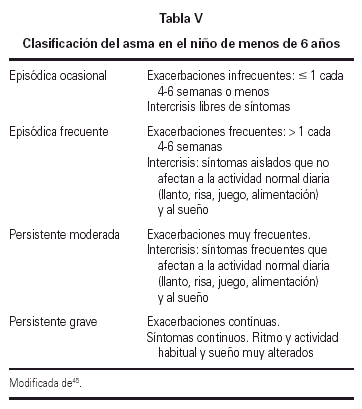
En la tabla V se indica el sistema de clasificación del asma en el niño de esta edad.
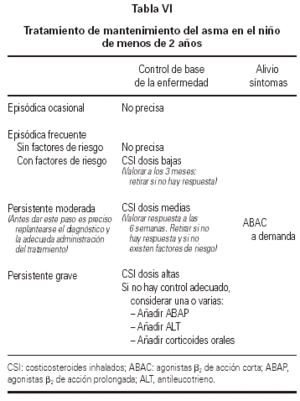
Tratamiento
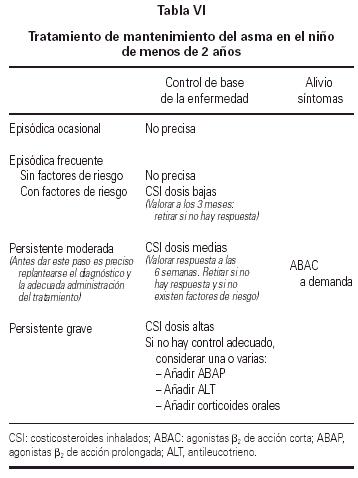
La tabla VI recoge el tratamiento de me mantenimiento en el niño de menos de 2 años.
Niños de más de 2 años
Niños de 2 a 6 años
Consideraciones generales
A estas edades se solapan niños que pertenecen al grupo de asma transitoria y niños que tendrán asma persistente precoz. Otros niños comenzarán a tener asma por primera vez constituyendo el grupo de asma persistente de comienzo tardío10.
El papel de la atopia a partir de esta edad debe ser aclarado por medio de un diagnóstico alergológico adecuado ya que constituye el principal factor de riesgo de asma persistente8.
Fármacos
Corticoides inhalados. Su eficacia en estas edades está lo suficientemente bien contrastada como para que su utilidad no deje lugar a dudas. Es probable, sin embargo, que esa eficacia no sea igual en los niños con asma transitoria que en los niños con asma persistente43,62,82-92 (Evidencia A).
Agonistas β2 de acción prolongada. Aunque escasos, hay algunos ensayos clínicos que incluyen niños de estas edades, tanto con salmeterol como con formoterol, que obtienen buenos resultados con efectos secundarios superponibles a los de los agonistas de acción corta93-95 (Evidencia B).
Antileucotrienos. También hay algunos datos de ensayos clínicos a estas edades con resultados favorables. Al igual que ocurre en edades posteriores los escasos datos de que se dispone apuntan a que estos fármacos son más eficaces mejorando parámetros subjetivos (calidad de vida) que objetivos (función pulmonar)96-98 (Evidencia B).
Cromonas. Los resultados de los pocos estudios que hay en estas edades son conflictivos; unos concluyen que no tienen efecto y otros que tienen un efecto comparable a los de la metilxantinas75,81.
La inmunoterapia específica (si se dan las indicaciones que se especifican en el apartado dedicado a ella) puede jugar un papel en el control de la enfermedad.
Clasificación
La clasificación del asma en el niño de 2 a 6 años se realiza de la misma forma que en el niño menor de 2 años, tal y como de indica en la tabla V.
Niños mayores de 6 años
Consideraciones generales
A partir de los seis años probablemente son pocos los niños afectos de sibilancias transitorias, por lo que la mayoría de estos niños sufren sibilancias persistentes bien de comienzo precoz o de comienzo tardío8,10,11,13.
El asma a esta edad se parece más al del adulto, por lo que la aproximación a su clasificación y tratamiento puede ser parecida.
Fármacos
Corticoides inhalados. Su eficacia no ofrece dudas43,62,82-92 (Evidencia A).
Agonistas β2 de acción prolongada. Existen varios ensayos clínicos en niños de estas edades, tanto con salmeterol como con formoterol, que obtienen buenos resultados con efectos secundarios superponibles a los de los agonistas de acción corta. Existen datos de su papel en el control del asma en terapia combinada con corticoides inhalados en esta edad 49,50,95,99,100 (Evidencia A).
Antileucotrienos. Hay datos suficientes de su efectividad en estas edades, aunque su capacidad antiinflamatoria es menor que la de los corticoides inhalados. La dimensión de su efecto como ahorradores de corticoides está por determinar98,101-103 (Evidencia A).
Cromonas. Una reciente revisión sistemática de 24 ensayos clínicos concluye que en tratamiento a largo plazo, el efecto del cromoglicato sódico no es mejor que el del placebo, por lo que su utilización es actualmente dudosa104 (Evidencia A).
Clasificación
La clasificación del asma en el niño de más de 6 años se refleja en la tabla VII.
Tratamiento
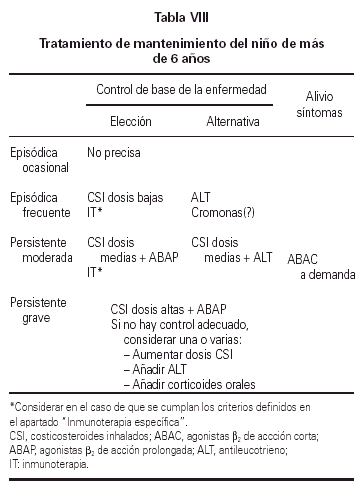
La tabla VIII recoge el tratamiento de mantenimiento del niño de más de 6 años.
SISTEMAS DE INHALACION
Consideraciones generales
La cantidad de fármaco que se administra a un niño con asma dependerá del tipo de medicación, el sistema de inhalación, las características del paciente y de la interacción entre estos factores.
De las diferentes vías de administración de fármacos de que disponemos, actualmente la vía inhalatoria es la de elección105,106 (aunque no todos los fármacos antiasmáticos están disponibles por esta vía, como los antileucotrienos y las metil-xantinas).
La prescripción de cualquier sistema de inhalación debe hacerse solamente después de que el niño y sus padres hayan recibido entrenamiento en su uso y hayan demostrado una técnica satisfactoria (Evidencia B).
La reevaluación de la técnica debe formar parte de las visitas clínicas de control.
En niños de 0 a 5 años existe poca o ninguna evidencia en la que basar las recomendaciones que se indican.
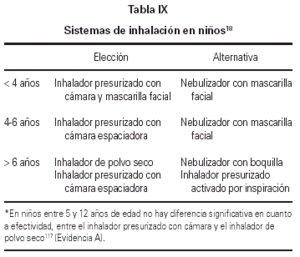
En general, y a priori, la edad es la que nos orientará a utilizar un tipo de sistema u otro, y la franja divisoria se sitúa entre los 4 y 6 años107 (tabla IX).
Inhaladores presurizados
Los problemas habituales con la técnica de administración provocan que más del 50 % de los niños que reciben tratamiento con un inhalador presurizado con aplicación directa (sin cámara) obtengan mucho menos beneficio que con otros sistemas108. Por tanto, los inhaladores presurizados con aplicación directa a la boca NO se deben utilizar durante la infancia; deben utilizarse siempre con cámaras espaciadoras.
Cámaras espaciadoras
La utilización de una cámara espaciadora con un inhalador presurizado soluciona el problema de la coordinación, disminuye la impactación orofaríngea y mejora la distribución y cantidad de fármaco que llega al árbol bronquial109 (Evidencia A). Su utilización con corticoides inhalados disminuye la biodisponibilidad sistémica de estos y el riesgo de efectos sistémicos110 (Evidencia B).
Hasta los 4 años se recomiendan cámaras de volumen pequeño, que son las que ya llevan acoplada una mascarilla facial. La respiración nasal que se produce en estos casos disminuye de forma importante el depósito pulmonar111, por ello, a partir de los 4 años de edad, en cuanto sea posible y colaboren de forma adecuada, hay que pasar a una cámara de volumen grande y sin mascarilla112,113.
Inhaladores de polvo seco
Los inhaladores de polvo seco no contienen propelentes, las dosis son homogeneas, la técnica de inhalación es más fácil que con el inhalador presurizado, y son de tamaño pequeño y manejable, lo que facilita que el niño lo lleve consigo en sus actividades. El depósito pulmonar es superior al que produce el inhalador presurizado pero los resultados son similares cuando éste se utiliza con cámara espaciadora.
La cantidad de fármaco que queda impactada en la orofaringe es superior a la de los inhaladores presurizados con cámara de inhalación pero inferior a la que se produce con los inhaladores presurizados sin cámara114,115. El riesgo de efectos secundarios aumenta con la deposición orofaríngea. Los más utilizados son los de sistema multidosis (Accuhaler y Turbuhaler). Con ambos sistemas es suficiente un flujo inspiratorio de 30 L/min. Estos dispositivos se recomiendan a partir de los 5-6 años de edad.
Nebulizadores
En la actualidad el uso de los nebulizadores en el domicilio para el tratamiento de mantenimiento queda restringido a casos especiales116, y los tipo "jet" con fuente de oxígeno, sólo para los servicios de urgencias.
RELACION ENTRE ATENCION PRIMARIA Y ESPECIALIZADA
1. La atención al niño asmático debe llevarse a cabo de forma coordinada entre Atención Primaria y Especializada.
2. Cada área sanitaria necesitará concretar esta coordinación de acuerdo con los recursos que existan en ella.
3. La organización de planes de atención al niño asmático deberá llevarse a cabo contando con Atención Primaria y Especializada.
4. Los principios generales de esta coordinación son los siguientes:
La atención especializada tendrá más protagonismo a medida que el asma sea más grave y viceversa.
El pediatra de atención primaria remitirá al niño a la unidad de alergia o neumología cuando:
* Necesite un diagnóstico alergológico y/o funcional.
* No pueda controlar el asma adecuadamente.
* Se den circunstancias personales y/o familiares del niño que lo aconsejen.
El pediatra de atención especializada (alergólogo o neumólogo):
* Hará un diagnóstico funcional/alergológico del que informará al pediatra de atención primaria.
* Recomendará unas pautas de tratamiento que el pediatra de atención primaria procurará seguir teniendo en cuenta la meta de control de la enfermedad.
5. La espirometría forzada con prueba de broncodilatación puede ser una técnica útil en Pediatría de Atención Primaria tanto para el diagnóstico como para el seguimiento del niño asmático. Sin embargo para la realización de estas pruebas se requiere un entrenamiento adecuado. Deberá ponerse en marcha algún sistema de adiestramiento para que los pediatras que dispongan de tiempo y lo deseen puedan ser entrenados correctamente en estas técnicas en las Unidades de Neumología o Alergia Pediátricas correspondientes. Este hecho, además, creará una relación fluida entre esos pediatras y su Unidad de referencia.
6. El Phadiatop podría ser útil como orientación alergológica en Atención Primaria.