INTRODUCCION
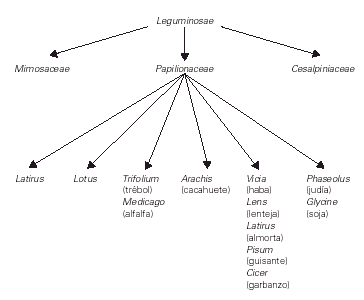
Las leguminosas son plantas dicotiledóneas del orden botánico de las Fabales que comprende 3 familias: Mimosaceae, Papilionaceae y Cesalpiniaceae (fig. 1). Las principales especies responsables de reacciones alérgicas (lenteja, garbanzo, guisante, cacahuete, soja, altramuz) pertenecen a la familia Papilionaceae, conocidas habitualmente como legumbres (1).
Figura 1.--Clasificación de las leguminosas.
Al ser una fuente barata de proteínas que equilibra las deficiencias en ciertos aminoácidos de las proteínas de los cereales, las leguminosas se cultivan prácticamente en todo el mundo y son la base de alimentación en muchos países en vías de desarrollo.
En el área mediterránea y oriente medio se consumen principalmente lenteja y garbanzo. Su introducción en la alimentación es común a partir del año o año y medio de vida. En cambio, en países anglosajones y en el sureste asiático se consumen de preferencia cacahuete y soja, respectivamente. En países del área mediterránea la introducción de frutos secos, entre ellos el cacahuete, no se realiza antes de los 2-3 años de vida, si bien en los últimos tiempos la utilización del cacahuete, soja, altramuz como aditivos hace que se consuman más precozmente y, además, de forma oculta, lo que podría estar contribuyendo a aumentar la incidencia de la alergia a legumbres.
El cacahuete (Arachis hypogaea) es originario de América del Sur. Contiene un alto porcentaje de proteínas (24-35 %) y grasas (42-52 %); es rico en azúcares, fósforo, calcio, hierro y vitaminas del grupo B, así como inhibidores de tripsina y plasmina.
La soja (Glycine max) es la base del tofú, la pasta de soja y la leche de soja, también se consume fresca. Es causa frecuente de reacciones adversas, posiblemente favorecido por su amplia utilización en Occidente como aditivo y como alimento dietético para enriquecer el contenido proteico de otros alimentos, como el pan. También su empleo en fórmulas dietéticas, se ha considerado como causa de sensibilización en lactantes (2).
El altramuz (Lupinus sativus) se utiliza como enriquecedor proteico, en bollería y para enriquecer otros alimentos por su alto contenido en sustancias nitrogenadas, grasas y sales minerales. Recientemente se ha identificado en Europa como causa de reacciones anafilácticas (3).
El guisante (Pisum sativum) es una leguminosa herbácea procedente de Asia. Es rico en prótidos, lípidos, lisina, vitaminas A, B y E, fósforo y calcio. En niños su ingestión no es habitual antes de los 2-3 años de vida. Se han comunicado escasas reacciones alérgicas a esta leguminosa.
La lenteja (Lens sculenta) es la legumbre más consumida en España. En nuestro país, con una dieta tradicionalmente mediterránea, las lentejas son las legumbres que con más frecuencia causan hipersensibilidad mediada por IgE, seguidas, en segundo lugar, del garbanzo (4). Constituyen la cuarta o quinta causa de alergia alimentaria en la población pediátrica. Más de la mitad de los casos comienzan entre el primero y tercer año de vida, predominantemente en el segundo año (5).
El garbanzo (Cicer arietinum) es, igualmente, causa muy importante de reacciones alérgicas en Oriente y en nuestro medio, debido a su alto consumo (6).
La judía o alubia (Phaseolus vulgaris) es originaria de América Central y del Sur. Existen muchas especies comestibles y pueden ser divididas de forma general en dos tipos diferentes: las que se comen con vaina cuyas semillas no se han desarrollado (judías verdes) y aquellas de las que solamente se comen sus semillas (alubias, fríjoles, judía pinta) (7).
MANIFESTACIONES CLINICAS DE LA ALERGIA A LEGUMBRES
Las manifestaciones clínicas son similares para todas ellas y abarcan desde síndrome de alergia oral a urticaria, angioedema, rinitis, crisis asmáticas e, incluso, anafilaxia. Síntomas orofaríngeos y urticaria aguda son las situaciones clínicas descritas más frecuentemente.
Se han publicado casos de urticaria y angioedema tras ingesta y/o contacto con garbanzo, judías, lentejas, cacahuete, soja, harina de altramuz (6-9), provocados en numerosas ocasiones por más de una legumbre, aunque algunos autores consideran que la hipersensibilidad sintomática a más de una legumbre es poco frecuente (10). Están descritas crisis asmáticas (11-13) e, incluso, neumonitis (14) por inhalación de polvo de soja. También por inhalación de vapores de cocción de lenteja (15, 16), garbanzo (10, 15), harina de altramuz (17, 18), guisante (19) y judía (7, 20). Algunos de estos cuadros se produjeron por inhalación de vapores de legumbres distintas a las que el paciente estaba sensibilizado (15, 16, 19). Recientemente se ha publicado la presencia de asma ocupacional en trabajadores de laboratorio en contacto con harina de altramuz (21). En España se han descrito dos epidemias de asma por inhalación de polvo de soja (22, 23). También se ha comunicado algún caso de obstrucción intestinal tras ingesta de soja (24).
El choque anafiláctico ha sido frecuentemente descrito tras ingesta de cacahuete, lenteja, garbanzo, altramuz y otras legumbres (3, 10, 25, 26). La muerte por anafilaxia es la manifestación más grave de la alergia a legumbres (26).
El cacahuete es el principal alergeno alimentario en EE.UU. y primera causa de anafilaxia. Se estima que la alergia en la población general de EE.UU. estaría entre el 0,6-1,3 % (27). Según algunos autores sería el principal alergeno alimentario en niños mayores de 3 años (28), pero también se encuentra sensibilización a edades más tempranas (29, 30).
En Europa, más concretamente en países anglosajones, su importancia alergénica está aumentando en los últimos años por la similitud del patrón alimentario con EE.UU., debido tanto a los cambios en los hábitos dietéticos (aumento del consumo de comida rápida, inmigración y sus diferentes costumbres dietéticas) como a su papel como alergeno oculto. Este mismo hecho ocurre con la soja que puede encontrarse en pan, pasteles, helados, cereales de desayuno, sopas de sobre, atún enlatado, perritos calientes, salsas y comida china (31).
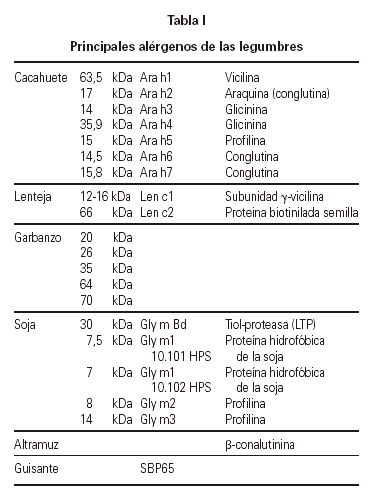
ALERGENOS DE LAS LEGUMBRES (tabla I)
El primer alergeno aislado y caracterizado parcialmente en las legumbres, fue el alergeno principal del cacahuete, conocido como Ara h1 (una vicilina) (32), con un peso molecular de 63,5 kDa (33). Posteriormente se aísla un segundo alergeno, Ara h2, con peso molecular de 17 kDa, identificado como una conglutina (34-35). Hasta el momento actual se han descrito, además, Ara h3 y Ara h4 (glicininas), Ara h5 (profilina), Ara h6 y Ara h7, ambas conglutinas (36). Se ha secuenciado el alergeno mayor del cacahuete, también expresado como proteína recombinante (37, 38).
En la lenteja se han descrito una banda proteica entre 12 y 16 kDa, que sería una subunidad g -vicilina denominada Len c1, y otra de un peso aproximado a 66 kDa, Len c2, correspondiente a una proteína biotinilada de la semilla. Se ha identificado a Len c1 como un alergeno mayor y a Len c2 como un alergeno menor de la lenteja. Len c1 muestra un 45 % de similitud con Ara h1, alergeno mayor del cacahuete. Len c2 tiene un 83 % de identidad con SBP65, proteína del guisante que se encuentra también en la soja (39).
Pascual et al estudian el poder de inhibición de Len c1 y Len c2 sobre lenteja y otras legumbres, como garbanzo, soja y cacahuete, en un grupo de pacientes pediátricos con hipersensibilidad inmediata a lentejas. Mediante inhibición de fijación de IgE, obtienen una inhibición sobre lenteja del 64 % por Len c1 y del 45 % por Len c2; para garbanzo, del 43 y 34 %; para el cacahuete, del 55 y 44 %, respectivamente y, finalmente, para soja, del 30 % por ambas proteínas (40), lo que refleja su importancia en la alergenicidad de las legumbres.
En el garbanzo se han detectado dos bandas proteicas en un grupo de niños alérgicos; una de 62,4 kDa y otra de 18,6 kDa, a las que se ha considerado como alergenos mayores del garbanzo. La banda de más alto peso molecular es similar al alergeno mayor del cacahuete, de peso molecular 63,5 kDa (Ara h1) y la de 18,6 kDa es similar al segundo alergeno mayor del cacahuete, Ara h2, de peso molecular 17 kDa (41, 42).
Se han purificado dos isoalergenos de bajo peso molecular de la soja (43). La secuencia del alergeno mayor, Gly m1, de 7 kDa que se encuentra en la cascarilla de la soja, coincide con la de una proteína hidrofóbica aislada anteriormente a partir de extractos de semilla de soja. Las fracciones con peso molecular 13-14 y 22-25 kDa, son las más alergénicas en 3 grupos distintos de extracto: soja entera, polvo y cáscara, y han demostrado su capacidad alergénica tanto por vía inhalatoria como por vía digestiva (44, 45).
En el altramuz, se ha identificado una b conglutinina (un tipo de vicilina), similar a Ara h2 (46).
Se ha aislado también, el alergeno mayor de la alubia que es una judía verde en un estado de maduración muy avanzado y muy rica en albúmina. Este alergeno es una albúmina que apenas existe en la judía verde, lo que podría explicar la tolerancia a la judía verde, que se encuentra en algunos pacientes con reacciones graves a judía blanca (47).
CALOR Y ALERGENICIDAD
En ciertos casos el tratamiento con calor de algunos alimentos vegetales, como verduras y frutas, puede disminuir la alergenicidad, ya que provoca cambios importantes en la estructura de la proteína. Este hecho puede ser cierto en caso de alergia a proteínas cuya función depende de su estructura, pero no necesariamente en la hipersensibilidad a legumbres, puesto que es un hallazgo repetido que el calor no reduce su alergenicidad.
Existe una capacidad potencial de aumento de la antigenicidad de la proteína durante el proceso de calentamiento a través de interacciones químicas y físicas, ya que la desnaturalización puede originar epitopos nuevos o exponer otros ocultos, no expresados en la proteína nativa, como es el caso del cacahuete, cuya alergenicidad aumenta con el tostado. En China se ha observado una baja incidencia de reacciones alérgicas por cacahuete, a pesar de su elevado consumo; este hecho se ha relacionado con la forma de ingesta del cacahuete, ya que habitualmente se toma cocido, mientras que en EE.UU. y países anglosajones suele consumirse tostado. Además, en niños chinos con residencia desde la infancia en EE.UU. y con costumbres alimentarias americanas, la incidencia de reacciones alérgicas por cacahuete es similar a la de los niños americanos, por lo que el factor genético no parece que ejerza un papel protector (48).
La resistencia a la desnaturalización térmica, química y proteolítica es una característica común a las legumbres. El extracto de lenteja contiene alergenos termoestables y su alergenicidad se mantiene tras 15 min de cocción e incluso puede potenciarse. Se ha visto que el tratamiento con calor provoca cambios importantes en el patrón electroforético de la lenteja, aumentando las bandas de bajo peso molecular (12-16 kDa) y disminuyendo las bandas de 25-45 kDa (49).
Martínez-San Ireneo et al estudian la composición alergénica de extracto de garbanzo crudo y cocido. Comparan la respuesta en niños alérgicos y con tolerancia, observando que los primeros reconocían similar número de bandas proteicas en el extracto crudo y cocido, mientras que los tolerantes detectaban bandas proteicas casi exclusivamente en el extracto crudo (41). En otro trabajo de estos mismos autores en pacientes con sensibilización clínica a lentejas, se concluye que con el extracto cocido, el tamaño del habón es mayor, y aumenta el porcentaje de pruebas cutáneas positivas (50).
REACTIVIDAD CRUZADA
En general la reactividad cruzada (RC) refleja las relaciones filogénicas entre organismos y la posible analogía funcional de las proteínas. La RC inmunológica es un concepto de laboratorio que en la mayoría de los casos no es superponible a la clínica. A pesar de la gran cantidad de publicaciones, la base molecular y celular completa de la RC, no es bien conocida. Aalberse estudia la estructura biológica de los alergenos dividiendo 40 proteínas alergénicas en familias estructurales según su conformación (51).
Reactividad cruzada entre legumbres
Las legumbres han demostrado un alto grado de RC inmunológica y diversos autores han descrito RC entre diferentes legumbres (52-55).
La mayoría de los alergenos responsables de esta RC están relacionados con la superfamilia de proteínas de almacenamiento 2S, que son pequeñas proteínas globulares ricas en arginina, glutamina, asparragina y, a menudo, cisteína (56).
En estudios in vitro con cacahuete y otras leguminosas se ha visto que la RC entre leguminosas, respecto a la fijación de IgE, es más fuerte entre cacahuete, guisante y soja (52). Se ha encontrado un 4 % de reacciones alérgicas cruzadas con soja y guisante (57).
También, en un estudio de Ibáñez et al, se ha observado que un 54 % de pacientes con hipersensibilidad inmediata a lenteja estaban clínicamente sensibilizados a guisante y hasta un 80 % a garbanzo (49). Sin embargo en otra serie sólo se encontró un 27 % sensibilizados a garbanzo (58). Estos últimos autores también estudian RC inmunológica en sueros con positividad a varias legumbres (lenteja, garbanzo, cacahuete y soja) y concluyen que existe un grado similar de reactividad cruzada inmunológica entre lenteja y las otras legumbres estudiadas, particularmente garbanzo y cacahuete y que las diferencias en la reactividad clínica en pacientes sensibilizados a varias legumbres con reactividad cruzada, podrían estar más relacionadas con los hábitos de consumo que exclusivamente con factores inmunológicos (40).
La RC clínica entre legumbres, es decir, la presencia de manifestaciones clínicas a varias legumbres, es rara en niños según un estudio pionero de Bernhisel-Broadbent y Sampson en 1989, que incluye 69 niños con prueba cutánea positiva a una o más legumbres, en el que 41 pacientes tuvieron 43 provocaciones positivas y sólo 2 pacientes tuvieron hipersensibilidad sintomática a 2 legumbres. No se incluyeron en el estudio garbanzo ni lenteja. Sin embargo el 79 % de los pacientes mostraron RC inmunológica a dos o más legumbres (59). En un segundo trabajo, los mismos autores presentan un estudio in vitro concordante con los hallazgos previos (60).
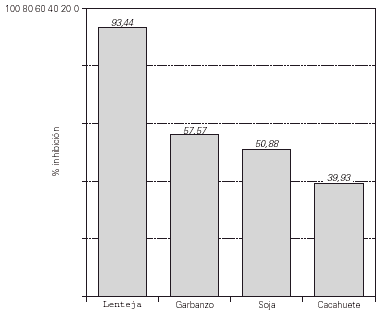
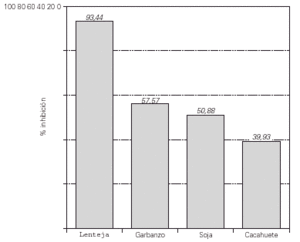
Pascual et al llevan a cabo un estudio sobre RC entre legumbres en pacientes pediátricos en el área mediterránea, llegando a la conclusión de que existe RC entre legumbres consideradas como mediterráneas (lenteja y garbanzo) y las llamadas legumbres anglosajonas (soja y cacahuete) (61) (fig. 2).
Figura 2.--Inhibición por lenteja cocida (1 mg/ml) de la fijación de IgE a otras legumbres. Según referencia 61, con autorización.
Reactividad cruzada de las legumbres con otros alergenos
Diversos autores han estudiado la RC y su expresión clínica entre alergenos vegetales (62). Como agentes responsables de esta RC se ha definido entre otros, a las profilinas, proteínas asociadas con el citoesqueleto, presentes en las células eucariotas y con un importante papel en el crecimiento celular y germinación del polen. Su amplia difusión hace que sean consideradas como un panalergeno y como causa de RC entre frutas, verduras y algunos pólenes (63-65). También se ha analizado el papel de la profilina en la RC entre látex y alimentos como soja y cacahuete (66) y la asociación entre hipersensibilidad a pólenes y alergia a vegetales comestibles, entre ellas las legumbres (67, 68).
Otros panalergenos de importancia creciente son las proteínas de transferencia lipídica (LTP), pequeñas moléculas de 10 kDa estables a la digestión por pepsina, con alto grado de RC comparable al de las profilinas (69). Su importancia se ha demostrado en la RC entre polen de artemisa, castaña y frutas rosáceas, habiéndose encontrado un 50 % de identidad en la secuencia proteica de las LTP de la castaña y la artemisa (70).
Se ha descrito RC entre tomate, cacahuete y pólenes de gramíneas. Se ha observado que un 23 % de niños alérgicos a gramíneas, presentaba alergia a cacahuete (71). También se ha encontrado relación entre alergia a polen de artemisa y a algunos alimentos, como avellana, pistacho, almendra, cacahuete, camomila, miel, cerveza, etc. (72-74), así como RC entre soja y látex (75).
Recientemente se ha identificado el alergeno mayor del anacardo, Ana o1, como una vicilina (76) que presenta un 27 % de similitud con la secuencia de aminoácidos del alergeno mayor del cacahuete Ara h1 (vicilina).
EVOLUCION DE LA ALERGIA A LEGUMBRES
La diferente incidencia de la alergia a legumbres encontrada en diversos países, se debe posiblemente a los hábitos alimentarios y a la edad de introducción de las legumbres en la dieta. Así, en Estados Unidos, se encuentra una alta incidencia de sensibilización a cacahuete, incluso en niños lactantes (por probable sensibilización a través de la leche materna), en estrecha relación con la amplia difusión de su ingestión, no sólo como aperitivo, sino como componente de la mantequilla de cacahuete, alimento habitual desde la primera infancia (77).
La prevalencia de sensibilización a cacahuete en países anglosajones parece estar elevándose. Un 6 % de la población americana presenta IgE específica frente a cacahuete, aunque la mayoría no ha tenido reacciones alérgicas con su ingestión. Este fenómeno parece ser exclusivo para el cacahuete, y no para el resto de legumbres. Las 3 proteínas alergénicas principales del cacahuete (Ara h 1, 2, 3) son similares a las de otras legumbres, presentando la mayoría de los pacientes con alergia al cacahuete anticuerpos IgE contra ellas. Además menos de un 15 % de estos pacientes reaccionan frente a otras leguminosas. Un 25-35 % de pacientes con alergia a cacahuete desarrollaran alergia a frutos secos de diferente familia botánica (fundamentalmente nuez, anacardo y pistacho) (78).
Hay pocos trabajos, que valoren la evolución de la alergia a legumbres a largo plazo. García-Ara et al, en un estudio retrospectivo de 5 años, sobre la evolución de 105 niños alérgicos a diversos alimentos, encuentran que un 18 % de los niños alérgicos a legumbres y/o a frutos secos se hacen tolerantes al cabo de 5 años (79).
Otro estudio reciente sobre la evolución de niños alérgicos a legumbres, concluye que los menores de 3 años desarrollan más fácilmente tolerancia a una o varias legumbres que los mayores de 3 años (80). Según este trabajo, después de un período de tiempo con dieta de exclusión, que osciló entre 1 y 3,8 años, de la legumbre responsable, toleraron el 23 % de los niños alérgicos a lenteja, el 12,5 % de los alérgicos a garbanzo, el 11 % de los alérgicos a guisante y el 5,5 % de los alérgicos a cacahuete. Sin embargo, con respecto a la lenteja, llegan a tolerarla el 40 % de los niños menores de 3 años alérgicos a lenteja, pero sólo el 8,7 % de los que tenían más de 3 años. Un menor nivel de IgE específica al diagnóstico se asoció con una frecuencia mayor de desarrollo de tolerancia (80).
A pesar de su importancia, la historia natural de la alergia al cacahuete no está clara. Varios autores llegan a la conclusión de que tendría una larga duración, incluso toda la vida (78). Sin embargo, otros estudios describen tolerancia a cacahuete en algunos niños alérgicos (81-83); este hecho podría deberse al tipo de unión que existe entre el alergeno y la IgE. Los tolerantes estarían sensibilizados frente a alergenos con epitopos conformacionales que son menos estables y menos absorbibles; los alérgicos lo estarían a alergenos con epitopos lineales, más estables y más fácilmente absorbibles (82).
Estudios recientes sugieren que cerca de un 20 % de niños alérgicos a cacahuete desarrollarán tolerancia, considerándose los valores bajos de IgE específica (menores de 5 kU/l) y la negativización de pruebas cutáneas como marcadores de buen pronóstico (84).
Se están investigando nuevos agentes terapéuticos para el tratamiento de la alergia a cacahuete que podrían ser aplicables a otras legumbres. Se están realizando experimentos con administración de anticuerpos recombinantes anti-IgE que podrían reducir los niveles de IgE en cantidad suficiente para prevenir la activación de respuesta alérgica, al menos para cantidades pequeñas de alergeno. Otros ensayos utilizan proteínas de cacahuete recombinantes modificadas por ingeniería genética en los que se sustituye los aminoácidos críticos de los epitopos ligados a la IgE, evitando de este modo la activación de las reacciones mediadas por IgE (84). Sin embargo, no se ha establecido aún la utilidad clínica que puedan tener estas investigaciones.