INTRODUCCIÓN
Desde mediados de los años 80 se conocen dos poblaciones distintas de linfocitos T en función del tipo de receptor para antígeno que expresan en su membrana: los linfocitos T αβ, que expresan el receptor para antígeno TcR-αβ, y los linfocitos T γδ, que expresan el TcR-γδ. Los primeros se encuentran principalmente en bazo y ganglios linfáticos y median respuestas inmunes específicas, mientras que los linfocitos T γδ aparecen principalmente en epitelios, donde se conocen como linfocitos intraepiteliales γδ (LIE γδ). Las características, tanto fenotípicas como funcionales, de los linfocitos T γδ son mucho menos conocidas que las de los linfocitos T αβ, debido en parte a que su descubrimiento es relativamente reciente. Debido a sus características, se ha propuesto que los linfocitos T γδ participan activamente en el sistema inmune innato o inespecífico, respondiendo a antígenos comunes de estrés celular en lugar de a una variedad de antígenos microbianos, como ocurre en el caso de los linfocitos T αβ. De los hallazgos que se han sucedido en los últimos años se deduce que la relevancia de estas células es mayor de lo que se pensaba, pudiendo tener funciones muy importantes en la defensa de los epitelios así como implicaciones en enfermedades alérgicas y autoinmunes tanto del aparato digestivo como del respiratorio.
El objeto de esta revisión es, por un lado, resumir lo que hasta ahora se conoce de las características generales de los linfocitos T γδ y, por otro, poner de manifiesto la emergente importancia de estas células en los compartimentos epiteliales del organismo, haciendo una especial mención de la población de LIE γδ presente en la mucosa digestiva y en la respiratoria.
CARACTERISTICAS GENERALES DE LOS LINFOCITOS T γδ
El receptor clonotípico TcR-γδ y su similitud a un anticuerpo
A finales de la década de los setenta, todas las respuestas inmunes específicas conocidas se consideraban mediadas por linfocitos T que expresaban receptores TcR de tipo αβ. Este paradigma tuvo que rehacerse cuando, en la búsqueda de los genes que codificaban para estos TcRs, se descubrió un nuevo cDNA específico del linfocito T que también codificaba para una proteína con homología a las Inmunoglobulinas (Ig) y cuyos genes se reordenaban en algunos de estos linfocitos T (1). Este cDNA codifica para un polipéptido, denominado γ o TcR-γ, que se encuentra asociado a un segundo polipéptido, δo TcR-δ (fig. 1). A su vez el heterodímero γδ, como su homólogo αβ, se asocia al complejo CD3 en la membrana celular. A los linfocitos portadores de este nuevo tipo de TcR se les denominó "linfocitos T γδ", observándose que no existía solapamiento entre los αβ y los γδ, es decir, cada linfocito T expresaba sólo un tipo de TcR. Esto se explica porque el conjunto de genes que codifica para la cadena d se encuentra totalmente incluido en el complejo de genes del TcR-α y, como consecuencia, cualquier reordenamiento de los genes de la cadena α, inactiva el reordenamiento de los genes de la cadena δ (2).
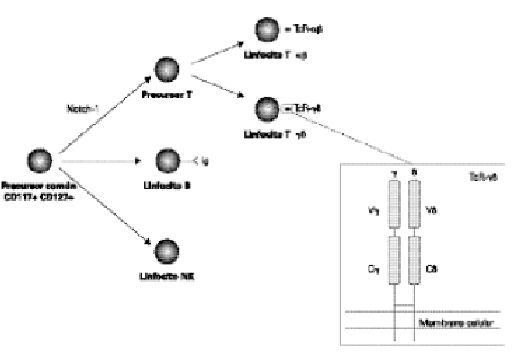
Figura 1.--Diferenciación de los linfocitos T γδ tímicos y representación esquemática del TcR-γδ. Ig: Inmunoglobulina; V: dominios variables; C: dominios constantes
Se ha visto que existen diferencias estructurales entre el TcR-γδ y el TcR-αβ, tanto en las regiones variables como en las constantes, como demuestra el análisis cristalográfico detallado del TcR-γδ llevado a cabo recientemente (3). Además, se ha demostrado que el TcR-γδ es más parecido a las Igs que al TcR-αβ en la longitud de las regiones hipervariables (4), que son las encargadas de llevar a cabo el reconocimiento del antígeno. Esta peculiaridad podría condicionar el modo en que los linfocitos T γδ llevan a cabo el reconocimiento antigénico, como se detallará más adelante.
La distribución anatómica de los linfocitos T γδ es preferentemente epitelial
Los linfocitos T γδse encuentran escasamente representados en los tejidos linfoides periféricos (nódulos linfáticos, placas de Peyer, bazo) donde constituyen entre el 1 y el 5 % de las células CD3+ . Los pocos linfocitos T γδ que se encuentran en el bazo, se localizan en la pulpa roja y las zonas marginales (regiones de alto tráfico celular) en lugar de en las áreas T convencionales (5) lo que es consistente con la hipótesis de que estas células no reconocen, de forma prioritaria, antígenos en la superficie de células presentadoras de antígeno "profesionales", sino que reconocen antígenos directamente en los tejidos (6).
Sin embargo, los linfocitos T γδabundan en los tejidos epiteliales, estando especialmente representados en el intestino, donde aparecen como linfocitos intraepiteliales (LIE) dispersos entre los enterocitos, mientras que apenas son detectables en la lámina propia. En humanos, la razón γδ/αβ en el GALT ("gut-associated lymphoid tissue" o tejido linfoide asociado a la mucosa intestinal) es de aproximadamente 1/5, mientras que en el nódulo linfático es de 1/50 (7).
El confinamiento de los linfocitos T γδa las superficies epiteliales, junto con una limitada diversidad del repertorio TcR-γδ, a diferencia del TcR-αβ, sugiere que los linfocitos T γδ forman parte de la primera línea de defensa del organismo, donde estas células no responderían a una diversidad de antígenos microbianos, sino a antígenos de estrés comunes, que serían marcadores de infección celular o transformación.
Características fenotípicas y funcionales de los linfocitos T γδ
La mayoría de los linfocitos T γδperiféricos son dobles negativos para CD4 y CD8; sin embargo, los linfocitos T γδ intestinales (i-LIE γδ) expresan frecuentemente CD8 (50 % de i-LIE γδ), siendo común la expresión del homodímero CD8αα, un marcador de diferenciación extratímica (8). Un porcentaje variable de linfocitos T γδ periféricos expresan CD28 (9) (coestimulador de linfocitos T αβ), CD40L (10) (lo que implica su capacidad para interaccionar con linfocitos B) y receptores de células NK como el NKG2D, que es un mediador de actividad citolítica (11).
En cuanto a moléculas efectoras, los linfocitos T γδ poseen capacidad de producción de efectores citolíticos como perforina y granulolisina (lo que les confiere capacidad citotóxica) (12), pueden mediar apoptosis vía CD95/CD95L (Fas/FasL) (13) y producir citocinas como el interferón-γ (IFN-γ), implicado en la activación de macrófagos (14). Por último, los linfocitos T γδ producen factores de crecimiento para mantener la integridad de los epitelios (p. ej., KGF en el ratón) (7).
Las modalidades de reconocimiento de antígeno por los linfocitos T γδlos diferencian del resto de linfocitos
Se ha constatado que las dianas moleculares de los linfocitos T γδ sistémicos son muy amplias, de tal forma que estas células tienen la capacidad de reconocer bacterias, protozoos y células propias infectadas. De la misma forma, parece que los LIE γδ humanos reconocen un amplio rango de células epiteliales autólogas infectadas o dañadas (7).
El proceso de reconocimiento del antígeno por los linfocitos T γδ es poco conocido. Se sabe que estas células reconocen una gran variedad de productos no peptídicos de bajo peso molecular (como pirofosfatos y aminas) (7), y también pueden llevar a cabo el reconocimiento de proteínas en su estructura nativa (2), del modo como lo hace la molécula de anticuerpo.
Por otra parte, se ha demostrado que los linfocitos T γδ reconocen MHC de clase I (15) y de clase II (16) y moléculas relacionadas con MHC de clase I denominadas MIC (MIC-A y MIC-B) así como CD1 (6), todas ellas con capacidad de presentación antigénica. MIC-A y MIC-B se localizan en el locus MHC y se expresan por promotores inducibles por proteínas de choque térmico en las células epiteliales, lo que apoyaría la hipótesis de que los linfocitos T γδ responden a situaciones de estrés celular (6).
Todos estos mecanismos, permiten a los linfocitos T γδ una respuesta rápida (por la ausencia, en algunos casos, de necesidad de procesamiento) y amplia (por su variedad en los modos de reconomiento), lo que se corresponde con su importante papel en la inmunidad innata o inespecífica.
Papel de los linfocitos T γδen el sistema inmune innato
El sistema inmune innato se caracteriza por ser inespecífico y carecer de "memoria inmunológica". Participan en él macrófagos, neutrófilos y eosinófilos y es fundamental para limitar el avance de la infección (17).
Además del reconocimiento antigénico y la actividad citotóxica, las capacidades funcionales de los linfocitos T γδ en el sistema inmune innato incluyen la síntesis de quimiocinas que atraen células inflamatorias a los lugares de daño tisular (18) y la secreción de citocinas, como el IFN-γ, que activan macrófagos y otras células relacionadas con la respuesta inmune innata (14). De esta forma, los linfocitos T γδ tienen un papel muy importante en el control de infecciones parasitarias por Plasmodium o Eimeria vermiformis, infecciones bacterianas por Listeria monocytogenes o Klebsiella pneumoniae e infecciones virales por virus vaccinia (19).
Ontogenia de los linfocitos T γδtímicos
La mayoría de los linfocitos T (T de "tímicos") han de seguir un proceso de diferenciación y selección que tiene lugar en el timo. También existen algunos linfocitos T que no experimentan este proceso (denominados "extratímicos"), lo que sucede fundamentalmente con los LIE γδ.
Los linfocitos T γδ, como el resto de células sanguíneas, derivan de células madre hematopoyéticas pluripotenciales presentes en el hígado fetal o la médula ósea del adulto. Durante el desarrollo T, las células precursoras se enfrentan a tres "decisiones" distintas (fig. 1): a) Un precursor linfoide común CD117+ CD127+ (es decir, cKit+ y receptor de IL-7+, respectivamente), que ha perdido el potencial mieloide y eritroide, pero es capaz de originar linfocitos (T, B y NK), debe "decidir" si adoptar un destino de linfocito T (20). El gen Notch-1 desempeña un papel esencial en esta decisión (21). b) Una vez que se ha especificado el linaje T, una célula pro-T del timo debe elegir entre los linajes αβo γδ. Las células que reordenan satisfactoriamente los genes para el TcR-β expresan en la membrana un pre-TcR formado por la cadena β y la cadena invariante pre-Tα, que precederá a la expresión del TcR-αβ definitivo. Por el contrario, las células que reordenen satisfactoriamente de forma inicial la cadena δ, se diferenciarán a linfocitos T γδ. Sin embargo, desde hace algunos años se están llevando a cabo estudios cuyos resultados apoyan el denominado modelo "selectivo" de diferenciación (22) que propone que la elección de linaje αβ o γδsería, al menos en parte, independiente o anterior a la existencia del TcR. Es decir, existirían dos subpoblaciones de células pro-T con distinto potencial de desarrollo: una subpoblación produciría al linaje αβ, y la otra al γδ. c) Finalmente, los timocitos comprometidos hacia el linaje αβdeben diferenciarse hacia los linajes CD4+ o CD8+ de linfocitos T αβ maduros, mientras que los timocitos comprometidos con el linaje γδ darán lugar fundamentalmente a linfocitos T γδ CD4 CD8. Posteriormente, los linfocitos T γδ maduros deberán abandonar el timo y dirigirse a los tejidos periféricos, fundamentalmente al intestino, como veremos en el siguiente apartado.
LINFOCITOS T γδINTRAEPITELIALES INTESTINALES (I-LIE γδ)
Colonización de los epitelios por los linfocitos T γδ
Los primeros linfocitos T intestinales que aparecen durante el desarrollo embrionario son linfocitos T γδ. En el ratón, donde el desarrollo del sistema inmune puede estudiarse en detalle, los linfocitos T γδ aparecen en forma de "oleadas": la primera oleada de linfocitos T γδ se dirige específicamente a la epidermis donde se denominan "células T epidermales dendríticas", mientras que la segunda oleada coloniza las capas epiteliales del aparato reproductivo. Posteriormente, hay una producción continua de linfocitos T (en lugar de oleadas), haciéndose mayoritarios los linfocitos T αβ, constituyendo más del 95 % de los timocitos. Es durante este período cuando se produce la colonización por los linfocitos T αβ y γδdel epitelio intestinal. Los linfocitos T γδque se producen en este estadio son distintos a los que se produjeron en las oleadas tempranas, con mucha más diversidad en los TcRs, los cuales contienen varios segmentos génicos V distintos y abundantes N-nucleótidos. La mayoría de estos linfocitos T αβ y γδse encuentran en los tejidos linfoides periféricos en lugar de en epitelios específicos a los que se dirigían los linfocitos T γδ tempranos (23).
En humanos, el repertorio TcR-δ intestinal es policlonal en el neonato y durante los primeros años de vida, mientras que en la segunda década de vida el repertorio TcR-d intestinal es oligoclonal y se asemeja al del adulto (24) siendo común la expresión de TcRs que contienen la región Vd1 de la cadena d (V de "región variable", ver fig. 1) (25) a diferencia de los linfocitos T γδ periféricos que expresan mayoritariamente TcRs con cadenas d de tipo Vδ2 (26). Se ha propuesto que los linfocitos T γδ que expresan un repertorio tan diverso al nacer podrían ser importantes en la defensa de la mucosa en la primera etapa de la vida cuando el sistema de IgA de secreción no está completamente desarrollado (27).
Moléculas implicadas en la migración de los linfocitos T γδ hacia el intestino
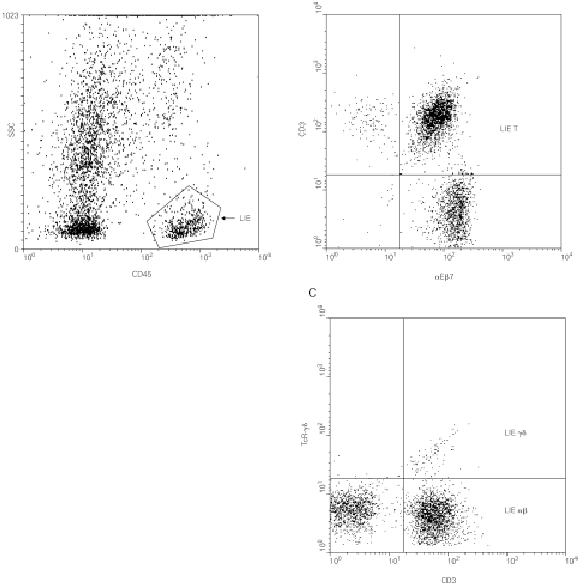
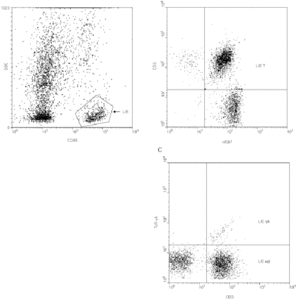
La expresión diferencial de determinadas moléculas de adhesión regula la migración específica de los linfocitos a los diferentes tejidos (proceso conocido como "homing" o "anidamiento"). En el intestino, dos integrinas β7 están implicadas en este proceso: la integrina α4β7 que dirige la extravasación (28) de los linfocitos desde la circulación sanguínea a la mucosa intestinal y la integrina αEβ7 o CD103 que contribuye a la retención de los linfocitos intraepiteliales en dicha mucosa, ya que media la adhesión de los linfocitos a la E-cadherina de las células epiteliales (29). Más del 90 % de los i-LIE T (incluyendo linfocitos T αβy linfocitos T γδ) son positivos para aEb7 (fig. 2).
Figura 2.--Caracterización de los LIE γδ intestinales por citometría de flujo. Para determinar la cantidad de LIE γδ y sus marcadores fenotípicos, se desepiteliza un fragmento de mucosa intestinal según técnicas descritas (42) y se marcan con anticuerpos monoclonales los antígenos de superficie de las células así individualizadas. El marcaje con anti-CD45 permite realizar una ventana de análisis sobre los LIE (A) sobre la que se analiza la expresión de la integrina αEβ7 (confirmando su origen epitelial, B) y del TcR-γδ (C).
Por otra parte, en estudios recientes se ha descrito una nueva quimiocina denominada TECK ("Thymus Expressed Chemokine") y su receptor, el CCR9, que podría estar implicada en procesos de migración linfocitaria al epitelio intestinal. TECK se expresa en las células estromales tímicas (30) y de forma abundante en el epitelio intestinal, mientras que CCR9 se expresa en la mayoría de i-LIE y linfocitos de la lámina propia (31). TECK podría tener un papel adicional en la extravasación selectiva de linfocitos T intestinales y/o en la migración de linfocitos T CCR9+ una vez que han cruzado el endotelio vascular y entrado en la mucosa intestinal.
Una parte de los i-LIE γδson de origen extratímico
Hay varios estudios que demuestran que los linfocitos T γδ intestinales de ratón pueden desarrollarse extratímicamente así como en el timo. Algunos de ellos son:
a) Se encuentran linfocitos T γδ en el intestino de ratones "nude" (carentes de timo) (32). b) Los linfocitos T γδ intestinales de ratón expresan, por una parte, RAG-1 (esencial para el reordenamiento del TcR y marcador de precursores T) (27) y por otra, una forma homodimérica aa del marcador CD8 en lugar del heterodímero αβcaracterístico de linfocitos que se desarrollan en el timo (8, 33). c) Se han descrito en ratón unas estructuras intestinales denominadas "criptoplacas" que contendrían precursores linfoides capaces de originar linfocitos T γδ (34).
En humanos, si bien no está demostrada la existencia de i-LIE γδ extratímicos, el hecho de que un 45 % de los i-LIE γδ CD8+ sean CD8aa (León F. et al, manuscrito remitido para su publicación) es sugerente de que esta población CD8αα pueda tener, al menos en parte, un origen extratímico.
Aunque todavía no está claro, el epitelio intestinal podría, pues, desempeñar un papel en el desarrollo de linfocitos T γδ de la mucosa, análogo al papel que el epitelio tímico tiene en el desarrollo intratímico de los linfocitos T.
Los i-LIE γδse encuentran aumentados en determinadas situaciones de hipersensibilidad inmunológica
Además del papel antiinfeccioso y, posiblemente, antitumoral de los LIE γδ (35, 36), se especula que están también implicados en la modulación de reacciones de tipo autoinmune y de hipersensibilidad. En la alergia alimentaria se ha descrito un ligero, pero significativo, aumento de los i-LIE γδ (37), que cesa tras la retirada del alergeno de la dieta. Una situación muy diferente es la observada en la enfermedad celíaca (EC). La EC es una enfermedad del intestino delgado, originada por la intolerancia permanente al gluten, componente de trigo, cebada y centeno, cereales habituales de la dieta occidental (38) y en la que tiene lugar una respuesta autoinmune frente a la enzima transglutaminasa tisular (39). La EC se presenta normalmente en la infancia e incluye síntomas como diarrea crónica, distensión abdominal y retraso en el crecimiento (40), aunque también puede presentarse en la edad adulta con síntomas como la anemia, pérdida de peso, diarrea y síntomas neurológicos (41). A diferencia de lo que ocurre en la alergia alimentaria, los pacientes con EC tienen un aumento sistemático (más del 99 % de los pacientes) (42), intenso (triplicando los valores normales) y permanente (no se normalizan en dieta sin gluten) de los i-LIE γδ. Por último, algunos pacientes esporádicos con enfermedad inflamatoria intestinal presentan también un aumento de los i-LIE γδ (43).
En este contexto de auto-agresión inmunológica, se cree que los i-LIE γδ actuarían como inmunorreguladores, respondiendo a factores liberados por los linfocitos T αβ activados, o bien a moléculas de estrés liberadas por las células epiteliales con el fin de compensar el daño inflamatorio (7).
LINFOCITOS INTRAEPITELIALES γδDE LA MUCOSA RESPIRATORIA
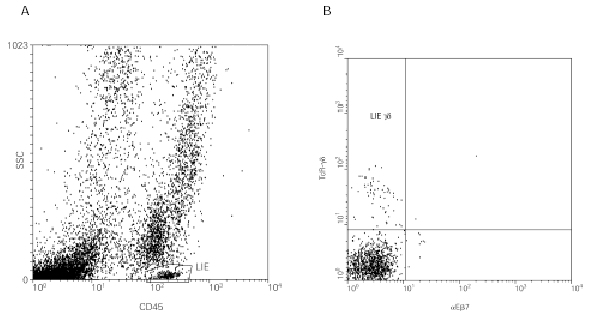
Al igual que ocurre en el intestino, la mucosa respiratoria contiene una proporción abundante de linfocitos T γδ (44). Sin embargo, aunque se conoce que los linfocitos T γδ pulmonares se encuentran en los tejidos intersticiales, en lavados broncoalveolares y en esputos inducidos (fig. 3), no está bien caracterizada su ubicación dentro de la mucosa, existiendo la posibilidad de que en los distintos compartimentos pulmonares existan distintas subpoblaciones de linfocitos T γδ.
Figura 3.--Caracterización de los LIE γδ de la mucosa respiratoria por citometría de flujo. El procesamiento es similar al descrito en la figura 2, excepto en la muestra inicial, que en este caso es un esputo inducido. Se puede apreciar que los LIE γδ respiratorios son negativos para la integrina aEb7 (B).
Los linfocitos γδparticipan en la defensa de la mucosa respiratoria
Hallazgos recientes demuestran que los linfocitos T γδ desempeñan un papel fundamental en la defensa de la mucosa respiratoria frente a agentes patógenos del aparato respiratorio (45). Por ejemplo, en uno de los experimentos llevados a cabo en ratón (46), se inocularon ratones carentes de linfocitos T γδ (debido a mutaciones en los genes del TcR-d) con la bacteria grampositiva intracelular Nocardia asteroides por vía intranasal. Este patógeno invade el epitelio traqueobronquial y provoca una fuerte respuesta inflamatoria con abundante infiltración de neutrófilos. Se pudo constatar, que tanto el daño pulmonar como la mortalidad eran mucho mayores en los ratones carentes de linfocitos T γδ que en los ratones control, por lo que estos linfocitos deben tener una función muy relevante en la protección de la mucosa respiratoria frente a determinados agentes patógenos de la misma.
Papel de los linfocitos T γδen la rinitis alérgica y el asma alérgica
La prevalencia de enfermedades alérgicas como la rinoconjuntivitis, el asma y la dermatitis atópica ha aumentado considerablemente en las últimas décadas, alcanzando una proporción entre el 10 y el 20 % de la población general (47).
Los linfocitos T tienen un papel fundamental en las enfermedades alérgicas, pues llevan a cabo el reconocimiento del antígeno y la producción de citocinas, que no sólo promueven la síntesis de IgE, sino también el reclutamiento de células efectoras, como los eosinófilos, a los lugares de inflamación alérgica. Los linfocitos T que llevan a cabo estas funciones efectoras se denominan Th2, mientras que los linfocitos Th1, que secretan IFN-γ o IL-2, están implicados en reacciones de hipersensibilidad retardada.
Los linfocitos T γδcomprenden aproximadamente entre el 25 y el 30 % de los linfocitos T de la mucosa nasal alérgica, mientras que constituyen menos del 10 % en la mucosa nasal normal (48). La proporción, el fenotipo y los estadios de activación de los linfocitos T γδ nasales son distintos a los que se dan en los linfocitos T γδ periféricos; de hecho, la población aumentada de linfocitos T γδ nasales en pacientes con rinitis alérgica crónica es fundamentalmente CD4+ y CD4 CD8 a diferencia de los linfocitos T γδ periféricos en los que la expresión del marcador CD4 es mucho menos frecuente (48).
Se ha constatado que los linfocitos T γδde la mucosa nasal de pacientes con rinitis alérgica son órgano-específicos y se expanden oligoclonalmente bajo condiciones de estimulación antigénica in vitro (49) y, aunque parece claro que los linfocitos T γδ desempeñan un papel importante en el desarrollo de la rinitis alérgica crónica (50), los mecanismos efectores no están todavía bien definidos. Varios estudios muestran que los linfocitos T γδ pueden producir niveles altos de IFN-γ, lo que resultaría en la inhibición de la síntesis de IgE (51). Pero, por otra parte, también se ha demostrado que los linfocitos T γδ son esenciales en la inducción de la síntesis de IgE dependiente de IL-4 (50) y que los linfocitos T γδ de la mucosa nasal de pacientes con rinitis alérgica crónica producen fundamentalmente IL-4, -5 y 13 (48), lo que sugiere un papel favorecedor de mecanismos alérgicos. También se ha demostrado un aumento en la proporción de linfocitos T γδ CD4+ productores de citocinas de tipo Th2 en lavados broncoalveolares de pacientes con asma alérgica (52, 53) por lo que los linfocitos T γδ estarían implicados directamente en la respuesta inmune alérgica del asma y serían productores de citocinas Th2 que contribuirían a la síntesis de mediadores químicos relacionados con el proceso de daño epitelial. Además, los linfocitos T γδ nasales producen quimiocinas como RANTES y factores de crecimiento como el SCF ("stem cell factor") (49), lo que sugiere que tienen un papel importante en la quimiotaxis de eosinófilos y mastocitos hacia el tejido epitelial (RANTES) así como en el crecimiento y supervivencia de los mastocitos (SCF).
En definitiva, los linfocitos T γδpodrían exhibir una heterogeneidad funcional y fenotípica similar a la de los linfocitos T αβ convencionales, es decir, existiría una población de linfocitos T γδ que produciría citocinas de tipo Th1 como el IFN-γ y otra que produciría citocinas de tipo Th2 como la IL-4 y que sería la que predominaría en la mucosa respiratoria en situaciones de hipersensibilidad.
CONCLUSIONES
Los linfocitos T γδmuestran características únicas, entre las que destacan: a) poseer un TcR cuyas regiones variables recuerdan más a las regiones variables de las Igs que a las del TcR-αβ, y que posibilita, por un lado, el reconocimiento directo de antígenos proteicos sin procesamiento previo, y por otro, el reconocimiento de antígenos no peptídicos que podrían ser presentados en moléculas relacionadas con el MHC; b) localizarse mayoritariamente en epitelios, principalmente en el intestino delgado y la mucosa respiratoria, donde se conocen como LIE γδ, haciendo muy probable que los linfocitos T γδ formen parte de la primera línea de defensa del organismo y que respondan a situaciones de estrés celular; c) la implicación de los linfocitos T γδ en la defensa anti-microbiana y/o anti-tumoral, y d) el posible papel que los linfocitos T γδ tienen tanto como células efectoras como inmunorreguladoras en la perpetuación de la inflamación alérgica.
En definitiva, los linfocitos T γδconstituyen una población de linfocitos T que debido a sus peculiares características, podría ser considerada como nexo de unión entre la inmunidad innata y la adquirida, y cuya posible implicación en la patogenia de la hipersensibilidad inmunológica los convierte en futuras dianas de inmunorregulación farmacológica.
AGRADECIMIENTOS
Agradecemos a la Dra G. Roy del Hospital Ramón y Cajal el compartir con nosotros su experiencia en inmunología de mucosas.