INTRODUCCION
Se entiende por reacción adversa a un medicamento (RAM) cualquier efecto perjudicial o indeseado, que ocurre tras la administración de una dosis de un fármaco normalmente utilizado para la profilaxis, diagnóstico y/o tratamiento.
Los antiinflamatorios no esteroideos (AINEs) son los fármacos de elección en el tratamiento de las artropatías crónicas en niños, también juegan un papel importante en el tratamiento de otras conectivopatías y además son utilizados de forma general en el tratamiento de los procesos febriles e inflamatorios agudos. No todos están autorizados para su uso en edades pediátricas, pero el espectro de utilización es variable teniendo en cuenta la entidad para la que se indican y las diferentes legislaciones entre países.
Las reacciones adversas al ácido acetilsalicílico (aspirina, AAS) y otros AINEs son la segunda causa de RAM tras los beta-lactámicos, son diversas, pudiendo involucrar a distintos órganos. Por un lado, las reacciones digestivas (pirosis, vómitos, gastralgias), neurológicas (tinnitus, sordera, vértigos), discrasias sanguíneas, nefrotóxicas y hapatotóxicas son bien conocidas1.
En general, en los últimos años, el AAS es menos utilizado en las edades pediátricas, debido a la mayor frecuencia de efectos adversos, en concreto el Síndrome de Reye, sin embargo, continua siendo el medicamento de elección en el tratamiento de la enfermedad de Kawasaki y como antiagregante.
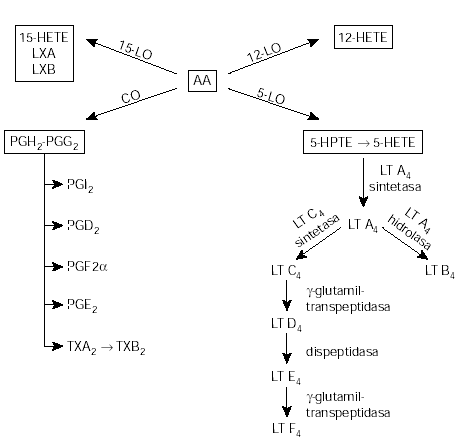
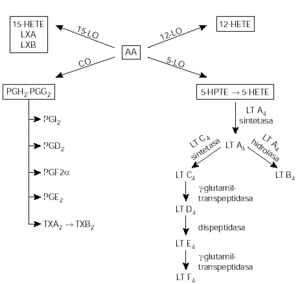
Los AINEs, producen su efecto antiinflamatorio por inhibición de la ciclooxigenasa en el metabolismo del ácido araquidónico para la producción de prostaglandinas, tromboxanos y prostaciclinas (fig. 1). Los AINEs habitualmente disponibles (excepto el diclofenaco y la indometacina) tienen muy poco efecto sobre la otra vía en el metabolismo del ácido araquidónico, la vía de la lipoxigenasa.
Figura 1.--Metabolismo del ácido araquidónico. AA: ácido araquidónico; CO: cicloxigenasa; 12-15-HETE: ácido 12 y ácido 15-hidroxieicosatetraenoico; 5-HPTE: 5-hidroperóxidoeicosatetraenoico; LO: lipoxigenasa; LT: leucotrienos; LX: lipoximas; PG: prostaglandinas; PGI: protaciclina; TX: tromboxano.
Con el descubrimiento de las dos isoformas de las enzimas de la ciclooxigenasa, la COX-1 y la COX-2, se ha proporcionado un gran avance en la comprensión del mecanismo de acción de los AINEs, así como aclara el problema de la reactividades cruzadas.
En el aspecto diagnóstico se hace una revisión sobre la indicaciones y las técnicas de provocación, y de la desensibilización. Por último, se comentan las nuevas alternativas terapéuticas, así como las particularidades pediátricas de la intolerancia a AINEs.
PREVALENCIA
Existen numerosos trabajos que han estudiado la prevalencia de la intolerancia al AAS en pacientes con asma bronquial, con resultados bastante discordantes. Estas diferencias se pueden achacar a:
1. El método de selección de la muestra de asmáticos estudiada, pues varía si se estudia una muestra de asmáticos en general o bien asmáticos corticodependientes.
2. El método utilizado para el diagnóstico, bien sea por criterios clínicos o mediante un test de provocación oral, nos dará un número diferente de enfermos diagnosticados del síndrome.
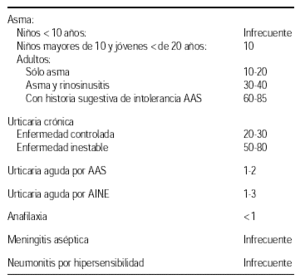
Según Giraldo et al2 utilizando métodos clínicos detectan una intolerancia a AINES en un 3 % de sus pacientes asmáticos. Chafee y Settipane3 en un estudio realizado en pacientes que acudían a la consulta de alergia encuentran que un 4,3 % de sus pacientes asmáticos eran intolerantes al AAS cuando el diagnóstico se establecía por criterios clínicos, aumentando esta prevalencia al 6,8 % cuando para el diagnóstico se utilizaba el test de provocación. Castillo y Picado4 encuentran entre sus pacientes asmáticos una prevalencia de intolerancia del 16 % por criterios clínicos y del 19 % cuando usaban el test de provocación oral. Refieren que la sensibilidad de la historia clínica para el diagnóstico era del 71 % y la especificidad del 97 %.
Estos trabajos evidencian que no todos los enfermos con historia clínica de intolerancia presentan un test de provocación positivo, ni todos los que reaccionan de forma positiva al test refieren historia de intolerancia, así pues, o bien la anamnesis no es correcta, o en algunos casos la sensibilidad ha desaparecido o ha modificado el tipo de respuesta.
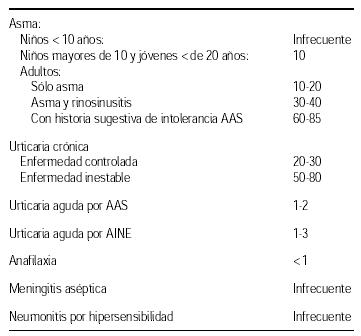
Prevalencia de sensibilización a AAS en pacientes con5:
PATOGENIA
Hasta ahora se han sugerido diversas hipótesis para explicar la patogenia de las diferentes reacciones adversas por AINEs.
Hipótesis inmunológica
Teniendo en cuenta las características clínicas de estas reacciones, sobre todo en lo que respecta, a los cuadros clínicos de urticaria y angioedema, se especuló que podría estar implicado un mecanismo IgE mediado.
Se ha descrito una forma anhidrido de aspirina que aparece como un contaminante de los preparados comerciales de ASA y que tiene la capacidad de conjugarse con la albúmina y de inducir la formación de anticuerpos del tipo IgE.
Existen numerosos argumentos en contra de este mecanismo; las pruebas cutáneas son negativas, los niveles de IgE suelen estar en límites de normalidad6, diferentes autores no han podido demostrar una IgE específica7.
Sin embargo, Minden y Farr8 comunicaron que el suero de pacientes que recibían aspirina contenía anticuerpos que reaccionan frente a la albúmina humana acetilada, pero que la presencia de estos anticuerpos no se correlacionaba con clínica de intolerancia a la aspirina.
En otro estudio, Amos et al9 utilizando técnicas de hemaglutinación encontraban anticuerpos en suero pero también sin correlación clínica. Ninguno de estos estudios había sido diseñado para detectar anticuerpos de clase IgE.
Phills y Perelmutter10 comunicó en una serie de seis pacientes con urticaria por aspirina, los cuales presentaban tests cutáneos inmediatos positivos con acetil salicilato de lisina. También DeWeck11 comunicó una serie de tres pacientes con urticaria por aspirina con tests cutaneos positivos a acetil salicilato de lisina.
J.K. Weltman et al12 con una serie de 30 pacientes, encontró que los niveles de IgE total en los pacientes intolerantes a aspirina eran similares a los hallados en la población no atópica. Por el contrario, los recuentos de eosinófilos estaban elevados en el grupo de intolerantes, tanto entre los que presentaban asma (57 %) como en los que tenían urticaria (25 %) por aspirina. Investigaron la presencia de anticuerpos anti-AAS y anti-tartracina del tipo IgE, siendo sólo detectados anticuerpos anti-AAS en un paciente pero que no se correlacionaban con la clínica, y concluían que era sumamente raro que los síntomas y la eosinofilia de la intolerancia a la aspirina y tartracina sean mediadas por anticuerpos de clase IgE.
Blanca13 presenta un caso de un paciente asmático, atópico, que tuvo dos episodios de angioedema tras la administración de aspirina, previamente había tolerado otros AINES, y tras estos episodios fue provocado con indometacina con buena tolerancia, demostrándose IgE específica (RAST para un conjugado de ASA-albúmina sérica humana preparado por dos métodos: método de ácido clorhídrico y método Carbodimida). Las determinaciones seriadas de la IgE específica mostraron que tras un periodo de seis meses el valor del RAST descendió al mismo nivel que el del grupo control, sin embargo la persistencia de anticuerpos antihapteno era variable y en algunos casos se negativizaban algún tiempo después de la aparición de un episodio agudo, concluye diciendo que aunque la presencia de anticuerpos IgE específicos no es común, este caso demuestra que es posible descubrir casos con anticuerpos IgE a la aspirina y manifestaciones clínicas tras la administración del medicamento. Además que en la investigación de anticuerpos específicos a la aspirina, hay dos hechos importantes a tener en cuenta: la ausencia de reactividad cruzada con otros inhibidores de la cicloxigenasa y el intervalo entre la reacción adversa y la obtención de la muestra de sangre para el estudio.
No está claro de qué forma la aspirina podría inducir respuestas cutáneas positivas, dado que es un hapteno monovalente, pues de forma espontánea no forma conjugados y estos se requieren para puentear las moléculas de IgE en la superficie del mastocito. La intolerancia a otros AINES, no relacionados químicamente, hacen pues difícil asumir una reacción cruzada por mecanismo reagínico, por último no se ha podido transferir pasivamente la sensibilidad a la aspirina a animales14.
En los pacientes con AIA, las crisis de asma pueden precipitarse tanto por la aspirina, como por otros AINES con diferentes estructuras químicas, hecho que hace muy rara la reactividad cruzada sea de origen inmunológico15.
MECANISMOS PATOGENICOS PROPUESTOS EN EL ASMA INDUCIDA POR ASPIRINA
La vía de la ciclooxigenasa
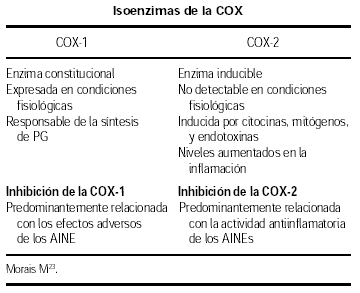
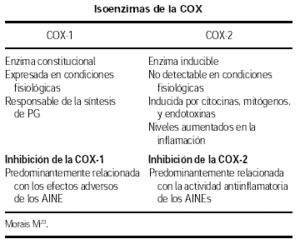
Durante muchos años, se creyó que solo existía una forma de ciclooxigenasa (CO), presente de forma constitutiva en la mayoría de los tejidos, sin embargo recientemente se han identificado dos isoenzimas de la ciclooxigenasa: La COX-1 y la COX-2, codificadas por genes diferentes16. La COX-1 es una enzima constitucional, expresada en condiciones fisiológicas en la mayoría de los tejidos, dando origen a la síntesis de prostaglandinas responsables para el mantenimiento de una actividad celular normal, principalmente de la hemostasis vascular y de las funciones gástrica y renal, por ejemplo, las células gástricas sintetizan PGE2 que disminuye la secreción de ácido, incrementa el flujo sanguíneo y disminuye la secreción de la capa mucosa viscosa17. La inhibición de la COX-1 por el AAS o los AINEs interrumpe las citadas funciones.
Recientemente se ha identificado la COX-2, enzima que no es detectable en la mayoría de los tejidos en condiciones fisiológicas, siendo inducida por estímulos proinflamatorios: citocinas, mitógenos y endotoxinas en condiciones patológicas, sus niveles aumentan marcadamente durante la infección o inflamación y se inhibe por los glucocorticoides18,19.
Se ha sugerido que la actividad antiinflamatoria de los AINEs sería debida a la inhibición de la COX-2, en tanto que los efectos adversos de los mismos, como son la toxicidad renal y gástrica, surgirían por la inhibición de la COX-1, cuyos productos tienen una acción protectora de los tejidos.
Se sabe que la PGE2 es protectora en los pacientes con asma inducida por aspirina (AIA). La PGE2 se sintetiza en la mayoría de las células del organismo, incluyendo células epiteliales y endoteliales del tracto respiratorio, por la enzima constitutiva COX-1, por tanto, y según la hipótesis de Stevenson5, las reacciones respiratorias inducidas por aspirina son la consecuencia de la depleción de la PGE2 protectora. Esto produce dos consecuencias; la liberación de la inhibición de la 5-LO, permitiendo la síntesis descontrolada de leucotrienos, y la liberación de histamina junto con otros mediadores preformados. Cuanto más eficaz es un AINE como inhibidor de la COX-1, menos dosis de fármaco es necesario para producir reacciones cruzadas en pacientes asmáticos con sensibilidad conocida al AAS.
Por el contrario, la COX-2 se produce localmente durante la inflamación y sólo se inhibe cuando se administra la aspirina a altas dosis. Dado que durante las provocaciones, las reacciones por AAS ya se dan con dosis bajas, es poco probable que la inhibición de la COX-2 desempeñe algún papel en las reacciones inducidas por AAS.
En 1999 llegaron al mercado los primeros inhibidores específicos de la COX-2, el Celecoxib y el Rofecoxib. Los estudios de provocación con estos fármacos han sido negativos en pacientes con AIA5, así pues se puede asumir que los inhibidores selectivos de la COX-2 no son capaces de liberar suficientemente el tejido pulmonar de PGE2 para poder producir una reacción inducida por AAS.
Mas aún, ambas ciclooxigenasas parecen ser farmacologicamente diferentes, y los AINEs tienen diferentes potencias relativas como inhibidores de la COX-1 y la COX-2, por ejemplo la aspirina y otros AINEs inhiben ambas isoformas, sin embargo son mucho menos activos frente a la COX-2 que a la COX-1 (la aspirina es sobre 150 veces mas activa frente a la COX-1 que a la COX-220.
El diferente efecto inhibidor de los AINEs sobre las dos isoenzimas varía, dependiendo del tejido usado para determinar su actividad, y es posible que la hipótesis original de una susceptibilidad aumentada de la ciclooxigenasa en los pacientes ASA sensibles, se debiera a una expresión y/o inhibición preferentes de una de las isoformas por los AINEs en los tejidos diana de los pacientes ASA sensibles comparados con los ASA tolerantes21.
Otra explicación posible para las diferentes reactividades a los AINEs en pacientes ASA-sensibles, podría ser una mayor sensibilidad de los tejidos en esos pacientes a los leucotrienos, de hecho se ha demostrado mayor reactividad bronquial al LTE4 en los ASA sensibles que en los tolerantes y no así frente a la histamina22.
La teoría de la ciclooxigenasa24 propone que las crisis de asma por aspirina, no está basada en reacciones del tipo antígeno-anticuerpo, pero depende de la acción farmacológica del medicamento25, la inhibición específica de la enzima COX en el tracto respiratorio y que ha sido reiterada y consistentemente confirmada26,27.
IMPLICACION DE LAS PLAQUETAS
En los pacientes con AIA, la provocación con aspirina puede producir la activación de plaquetas de sangre periférica, al mismo tiempo que se produce la respuesta asmática28, sin embargo el factor activador plaquetario endógeno (PAF) no se ha encontrado de una forma constante, así pues la broncoconstricción inducida por aspirina no puede achacarse a las propiedades contráctiles del PAF.
Otros autores, plantearon la posibilidad de que la aspirina produciría un aumento del 12-HETE plaquetario, debido a un disbalance entre ciclooxigenasa y 12-lipooxigenasa. Este 12-HETE podría activar la 5-lipooxigenasa de leucocitos circulantes y macrofagos pulmonares, y los leucotrienos liberados podían precipitar el asma29.
Nizankowska et al30, midieron la producción de 12-HETE en plaquetas de 10 asmáticos sensibles a aspirina y 10 controles sanos, antes y después de la administración de aspirina. Después de la provocación, el 12-HETE se elevó a niveles similares en ambos grupos. Estos datos no apoyan el concepto de que exista una alteración generalizada del metabolismo oxidativo del ac. araquidónico en las plaquetas de los pacientes asmáticos sensibles a la aspirina.
Si a esto añadimos la ausencia de un efecto protector con la infusión de prostaciclina en la provocación con aspirina, la participación de las plaquetas en las reacciones asmáticas por aspirina es más que dudosa31.
INFECCION VIRAL
Szczeklik et al32, postularon la hipótesis de que el asma inducida por aspirina es fruto de una infección viral crónica, tras la exposición inicial al virus, se producirían linfocitos citotóxicos. Su actividad sería inhibida por la PGE2 originada en los macrófagos alveolares. Los fármacos anticiclooxigenasa, aspirina y AINEs, bloquean la producción de PGE2 y permiten que los linfocitos citotóxicos ataquen y eliminen las células del tracto respiratorio infectadas por virus. Durante esta reacción, se liberan enzimas lisosómicas y mediadores, que pueden precipitar una crisis de asma. Estas crisis se podrían prevenir evitando los AINEs. Sin embargo, el asma presenta un curso prolongado debido a la infección viral crónica.
Esta hipótesis la basa en los siguientes conceptos:
La evolución clínica del ASA recuerda a una infección viral.
La infección latente que producen ciertos virus en el hombre como es la infección por virus de Epstein-Barr, algunas de sus manifestaciones clínicas (hepatitis, supresión de la hematopoyesis) pueden deberse a respuestas inmunes secundarias a linfocitos con infección latente.
El número de linfocitos T citotóxicos aumentan en las infecciones virales y forman parte de sistema inmune en las vías respiratorias del hombre.
Los macrófagos pulmonares producen PGE2, que inhibe la respuesta citotóxica de los linfocitos, esta inhibición sería abolida por los AINEs, que depleccionan la PGE2 de los macrófagos.
Una vez desarrollada el asma, esta sigue su curso, a pesar de suprimir AAS y otros AINEs. La inflamación de la vía aérea podría resultar de una reacción no IgE mediada a un antígeno endógeno o exógeno, como una infección viral32. Estas posibilidades son apoyadas por los hallazgos de marcadores de autoinmunidad aumentados, una síntesis aumentada de IgG459 y una asociación del HLA con el AIA33,34.
Una infección vírica latente podría modificar el mensaje genético de la molécula COX, facilitándose la producción de metabolitos desconocidos que estimulan los cisteinil-leucotrienos (cis-LT) en respuesta a AINEs, o evocar una respuesta inmunológica, dominada quizás por linfocitos citotóxicos específicos y eosinófilos, suprimidos por PGE232. Es interesante que el aciclovir, antiviral especialmente efectivo en la infección por virus herpes, fue recientemente relacionado con la inhibición de la respuesta broncoconstrictora y de la excreción urinaria de LTE4 en pacientes con AIA. La búsqueda de un virus, no identificado como patógeno causante en el AIA, podría dar respuestas a los misterios que encierra en AIA35.
LOS LEUCOTRIENOS EN LA PATOGÉNESIS DE LA SENSIBILIDAD A LA ASPIRINA
Durante los últimos años se ha sugerido que los cis-LT juegan un papel preponderante en el asma y en concreto en el AIA. El ácido araquidónico (AA) a través de la vía de la 5-lipoxigenasa (5-LO) produce leucotrienos (LT). Los LTB4 atraen neutrófilos a los tejidos, los LTC4-D4-E4 son un potente estímulo para la broncoconstricción, permeabilidad de la mucosa y para la secreción de moco. También se ha apuntado, como vía de producción de LT, la hiperproducción de 12-HETE o la ausencia de PGE2, ambas consecuencia de la inhibición de la vía de la CO.
Existen datos experimentales que apoyan la teoría de un desvío del metabolismo del AA. La mayoría de los pacientes con AIA presentan una excreción basal elevada de cis-LT, y esta aumenta tras la administración de AAS36,37,38. Además tras la provocación con AAS, se evidencia una liberación de cis-LT tanto en la cavidad nasal como en tracto bronquial39.
La 5-lipooxigenasa (5-LO) es la primera enzima en la vía de producción de leucotrienos (fig. 1), la expresión de esta enzima está controlada por factores transcripcionales, según un estudio de In40 la variación genética de la 5-LO no parece contribuir a la susceptibilidad de padecer AIA.
La enzima terminal en la cadena de producción de cis-LT es la LTC4 sintetasa, su gen ha sido localizado en el cromosoma 541, la expresión de esta enzima se encuentra hasta 5 veces más elevada en biopsias bronquiales de pacientes con AIA que en pacientes asmáticos que toleran AAS. Por el contrario, la expresión de otras enzimas de la vía de los leucotrienos (5-LO, LTA4 hidrolasa) son similares en todos los grupos de asmáticos. Un aumento en la expresión de la LTC4 sintetasa, es el único marcador que correlaciona significativamente con la respuesta broncoconstrictora tras la provocación bronquial con acetil-salicilato de lisina. La disponibilidad de la LTC4 sintetasa puede estar aumentada por una disregulación genética, la LTC4 sintetasa está presente en eosinófilos y mastocitos, la IL5 parece ser uno de los factores que correlaciona con la expresión de la LTC4 sintetasa en los eosinófilos.
Recientemente se ha descrito el polimorfismo genético de la región promotora de la LTC4 sintetasa, alelo C-44442, este alelo es dos veces más común en los pacientes con AIA corticodependientes que en otros asmáticos o en sujetos normales. Mientras no hay relación entre el polimorfismo de LTC4 sintetasa y la excreción urinaria de LTE4 basal, la provocación con AAS produce un drástico aumento de LTE4 urinaria en los portadores del alelo C-44443.
Sin embargo, casi el 30 % de los pacientes con AIA no tiene esta variante genética de la LTC4 sintetasa, mientras que un 25 % de los controles sanos si la tienen, y aparentemente sin consecuencias, tal hallazgo es común en estudios de predisposición genética a enfermedades multifactoriales, relacionadas a una herencia no mendeliana y a factores desencadenantes desconocidos, como en el AIA.
LA PGE2 COMO NEXO ENTRE LAS VIAS COX Y 5-LO
La razón del por qué en el AIA la inhibición de la COX por la aspirina permite una liberación de los cis-LT no está aclarada. La respuesta alterada a la aspirina puede deberse a una alteración adquirida en el gen de la COX, bien en su regulación o en su transcripción, o quizás como consecuencia de una infección vírica latente32.
Una molécula de COX alterada, en reacción con la aspirina podría producir metabolitos desconocidos que estimulen la vía de la 5-LO. Podría también imaginarse que en el AIA, la señal para la activación de la 5-LO proviene de la supresión de la PGE2 por la aspirina, la PGE2 es el principal prostanoide antiinflamatorio liberado en el pulmón. La PGE2 inhibe la producción de citocinas por infiltración de linfocitos y macrófagos. La expresión de la COX-1 constitutiva en el epitelio respiratorio y en fibroblastos es una fuente constante de PGE2. La administración de aspirina u otros AINEs inhibe la COX-1 y causa la supresión de la liberación de PGE2. En consecuencia, unas células inflamatorias desinhibidas comienzan a producir sus mediadores, una prostaglandina que inhibe la biosíntesis de leucotrienos reduce la transmisión colinérgica disregulada muy posiblemente por una infección viral crónica, y previene la descarga de los mastocitos. Esta idea se ve apoyada indirectamente por comunicaciones que indican:
1. La inhalación de PGE2 efectivamente previene tanto las crisis de asma precipitadas por AAS como la liberación urinaria de cis-LT que acompaña a estas crisis44.
2. En pacientes con AIA, la COX-2 mRNA tiene una expresión disminuida en los pólipos nasales45, y los cultivos células epiteliales nasales producen menos cantidad de PGE246, estos hallazgos concuerdan con la reciente comunicación47 de la susceptibilidad aumentada de la COX a la aspirina en pólipos nasales de pacientes con AIA.
3. Los niveles basales de PGE2 procedentes de leucocitos de sangre periférica en pacientes con AIA son inferiores a los de pacientes tolerantes a AAS.
LAS LIPOXINAS Y LA CRONICIDAD DEL ASMA
Los ASA tienen disminuida la biosíntesis de lipoxinas, estas tienen propiedades muy potentes antiinflamatorias. La LXA4 inhibe la quimiotaxis de neutrófilos y eosinófilos y la migración leucocitaria hacia los tejidos inflamados43.
La biosíntesis de las lipoxinas procede de dos fases de la lipoxidación del ácido araquidónico. En sangre, los neutrófilos estimulados liberan LTA4, un sustrato que se difunde libremente para la síntesis de LTB4. En las plaquetas, LTA4 puede ser oxigenado por la 12-lipoxigenasa a un epóxido intermedio, el cual es hidroxilado a lipoxina A4.
Alternativamente, células como los eosinófilos o macrófagos por medio de la 15-LO pueden producir lipoxinas (LX A4).
Las células del epitelio respiratorio muestran actividad de 15-LO, y por vía de la producción de 15-HETE, células 5-LO positivas (eosinófilos, macrófagos) pueden ser oxidadas por la 5-LO y formar lipoxinas.
CARACTERISTICAS CLINICAS
Las manifestaciones clínicas producidas por las reacciones adversas a AINEs suelen aparecer a partir de la tercera década de la vida, siendo de predomino en los adultos el asma y en los niños los síntomas cutáneos; así mismo difiere la incidencia por sexos. Estrada et al48, encuentran en niños un predominio en el sexo masculino 2:1 frente al femenino. En adultos49 el predominio se da en el sexo femenino.
Se han identificado cinco tipos de reacciones a la aspirina y AINEs, según Stevenson50:
1. Enfermedad respiratoria con sensibilidad a aspirina (ERSA), la enfermedad no es causada por la aspirina, se caracteriza por: congestión nasal constante, poliposis nasal, anosmia, sinusitis purulenta de repetición, asma de gravedad variable: leve, moderada o grave. Durante las agudizaciones de sinusitis, el asma suele ser grave y en otros momentos ser leve. Lumry et al51 describieron una ERSA pura del tracto respiratorio superior, sin asma asociada.
2. Enfermedad urticarial por aspirina, es lo que se corresponde con Urticaria crónica idiopática, la aspirina no produce la enfermedad, sin embargo tras su ingesta o cualquiera de los AINEs que inhiben la COX-1 se producen reagudizaciones graves de la urticaria que disminuyen y se normalizan al cabo de las 24-48 horas de suspender el AINEs. En las biopsias cutáneas no aparecen lesiones de vasculitis. Cuanto más activa sea la urticaria más probables son las reagudizaciones tras la ingesta con AINEs.
3. Reacciones alérgicas a AINEs: existe un grupo de pacientes, aproximadamente 1-2 % de los que ingieren AINEs que presentan reacciones de hipersensibilidad inmediata frente a un solo fármaco, las reacciones presentan un patrón clínico típico de una reacción tipo I, desde urticaria/angioedema hasta anafilaxia. La reacción se produce frente a un solo fármaco tolerando el resto de los AINEs. Se debe efectuar provocación con otros AINEs en busca de terapias alternativas.
4 y 5. Meningitis aséptica y Neumonitis por hipersensibilidad. Estas reacciones son raras y están publicadas como casos clínicos, nunca se han asociado con al AAS o paracetamol, y suelen darse en pacientes con tratamientos prolongados (artritis reumatoidea).
POLIPOSIS NASAL
La poliposis nasal son formaciones saculares mucosas de contenido líquido, que se originan habitualmente en el interior de los senos paranasales, generalmente etmoidales, maxilares. En niños su incidencia es baja y suele estar asociada con fibrosis quística, en adultos se sitúa entre 1-2 % de la población general y entre el 37 y 61 % de los pacientes intolerantes2.
Suelen ser múltiples, bilaterales y con tendencia a la recidiva. Clínicamente se caracteriza por anosmia y obstrucción nasal como síntomas predominantes. Se asocia a asma, un 20-50 % de pacientes afectos de poliposis padecen asma, esta no suele ser alérgica y suele ser corticodependiente.
La etipatogenia es desconocida, se apuntan diferentes teorías: infecciosa, inmunológica, etc. No hay evidencia que la atopia predisponga a la poliposis nasal más que otras afecciones inflamatorias.
Esta asociada en un 36 % de pacientes a intolerancia a AAS, en cambio si se estudia una población de intolerantes al ASA, hasta un 60 % puede estar afectado de poliposis nasal.
En 1922 Widal describe la denominada triada ASA52 caracterizada por poliposis nasal, asma bronquial e intolerancia a AAS.
Además la poliposis nasal puede ser una manifestación de otras enfermedades: síndrome de discinesia ciliar primaria (rinosinusitis recurrente, y otitis media debida a disfunción ciliar), síndrome de Kartegener (sinusitis crónica, situs inversus, bronquiectasias y polipos nasales), fibrosis quística (6-48 %), sinusitis alérgica fúngica (85 %), síndrome de Churg-Straus (50 %), intolerancia al alcohol (50 %), síndome de Young y Nares (19 %).
Respuesta broncodilatadora por AINEs
Algunos pacientes asmáticos refieren que la aspirina mejora su sintomatología respiratoria, Szczeklik53 describió los primeros casos, los asmáticos que mejoran con los AINEs no se diferencian clínicamente de los que empeoran, y el mecanismo de esta reacción broncodilatadora es desconocido, una hipótesis aportada por Okazaki54 según estudios in vitro, sugiere que el AAS suprime más significativamente la producción monocitaria de PGF2a que la de PGE2, justificando así el efecto broncodilatador que produce en ciertos pacientes.
REACTIVIDAD CRUZADA
El AAS y los AINEs más antiguos presentan una reactividad cruzada del 100 % en los pacientes con asma inducida pos AAS55 y en una tercera parte de los pacientes con urticaria crónica56. AAS y AINEs comparten efectos farmacológicos similares, principalmente la inhibición de los enzimas de la ciclooxigenasa. Este es el hecho que predomina en todas las teorías que explican los mecanismos de reactividad cruzada entre AAS y los AINEs antiguos. Además, los mismos mecanismos deben actuar en la desensibilización cruzada entre AAS y AINEs.
Tartracina
Es un colorante azo amarillo, utilizado para colorear alimentos, bebidas, fármacos y cosméticos. La tartarcina no inhibe la actividad ciclooxigenasa57. Sin embargo, en algunos individuos con sensibilidad a la aspirina se ha observado bronconstricción semejante a la inducida por AAS tras la ingesta de tartracina. Ya en 1984, Simon58 publicó un trabajo de revisión de los estudios que referían una alta incidencia de intolerancia a la tartracina, aduciendo en los mismos defectos de método (no control con placebo, criterios vagos y subjetivos a la hora de evaluar la reacción, labilidad clínica de los pacientes por supresión de medicación sintomática al iniciar los estudios, etc.). En un estudio multicéntrico59, bien documentado de 166 pacientes con sensibilidad probada a AAS solo hubo 4 reacciones positivas tras provocación con tartracina.
Glucocorticoides
Se han descrito reacciones de broncoespasmo grave en pacientes sensibles a ASA tras la inyección de hidrocortisona60. Szczeklik et al61, estudiaron los efectos de la inyección intravenosa de succinato de hidrocortisona en comparación con la de su diluyente en 31 pacientes con AIA, encontrando que 3 pacientes presentaban caídas significativas del FEV1 tras la inyección de 300 mgr de hidrocortisona, ninguno de los 31 pacientes presentaban problema con metilprednisolona, dexametasona o betametasona.
El mecanismo de producción de estas reacciones es desconocido, los esteroides inhiben la liberación de ácido araquidónico a través de las lipocortinas, una familia de proteínas antifosfolipasa62,63, aunque este mecanismo es dudoso, dado que esta acción no se limita a la hidrocortisona, sino que abarca a otros glucocorticoides: prednisona, prednisolona, betametasona, etc. Taniguchi et al64 han sugerido que serían los ésteres succinato de glucocorticoides los que presentaban estas reacciones, en consecuencia la broncoconstricción sería precipitada por las sales succinato tanto de la hidrocortisona como de la metilprednisolona, pero no por las sales fosfato.
Independientemente del modo de acción, debe emplearse con precaución la hidrocortisona en pacientes con AIA, y es aconsejable utilizar corticosteroides en forma de sales sin succinato.
Salicilatos
Los salicilatos, son los AINEs más antiguos, y entre ellos difieren por el tipo de sustitución que se efectúe sobre el grupo carboxil o hidroxil de la molécula: ácido acetilsalicílico, salsalato, salicilato de colina, salicilato de magnesio, salicilato sódico. Todos ellos, son hidrolizados in vivo a ácido salicílico. Otros compuestos relacionados, como son el diflunisal y la salicilamida no son hidrolizados a ac. salicílico y por tanto no son considerados salicilatos.
El AAS difiere de otros AINEs en ciertos aspectos específicos. El efecto antiinflamatorio se produce en parte por la acetilación irreversible y la inactivación de la ciclo-oxigenasa, inhibiendo la síntesis y liberación de prostaglandinas, la inhibición de la protaciclina PGI2 por células endoteliales y de tromboxano A2 (TXA2), es un efecto dosis dependiente. Otros salicilatos producen una inhibición no irreversible65.
El ácido salicílico no tiene efecto sobre la ciclo-oxigenasa de la mucosa gástrica, de los macrófagos o de los trombocitos66,67, ya en 1968 Samter y Beers68 concluían que: "la intolerancia al AAS ciertamente no es una intolerancia a los salicilatos". Más recientemente esto se ha cuestionado, y las diferencias de tolerancia a los salicilatos en los asmáticos sensibles a la aspirina, podrían estar relacionadas con la actividad de estos fármacos sobre la ciclooxigenasa, alguno de los salicilatos son inhibidores en grado leve, así el diflunisal es un inhibidor moderado de la ciclooxigenasa, el salsato lo es de forma más débil y por el contrario el salicilato sódico, la salicilamida o el ester guayacólico del acido acetilsalicílico, sin actividad anticiclooxigenasa, son bien tolerados por asmáticos sensibles a la aspirina en estudios controlados67,68,69.
Paracetamol
El paracetamol es un medicamento de uso muy frecuente y raramente ocasiona reacciones adversas, sin embargo se han descrito síntomas de bronconstricción en pacientes con ASA. Barles et al70 observan bronconstricción leve en un 15 % de una serie de 32 pacientes con AIA. Settipane et al en 199571 encuentra una frecuencia del 34 % de reactividad cruzada cuando utiliza dosis de 1.000 y 1.500 mg. Estos autores sugieren una relación entre la reacción a dosis bajas de AAS y reactividad cruzada con paracetamol, así estos pacientes deberían evitar dosis elevadas de paracetamol.
Se desconoce cual es el mecanismo por el que se producen estas reacciones adversas, in vivo, el paracetamol no tiene efecto anticiclooxigenasa, e in vitro en condiciones standar tampoco, pero si se reduce el nivel de lípidos peróxidos, el paracetamol puede convertirse en un inhibidor de la cicloxigenasa72.
Estas reacciones deben diferenciarse de la hipersensibilidad de tipo inmediato al paracetamol, que no se asocian con intolerancia a AAS y probablemente son IgE mediadas.
AINEs con reactividad cruzada con AAS
Baja incidencia de reactividad cruzada con ASA
Paracetamol (1.500 mg o más).
Acido disalicílico (2.000 mg o más).
(Son fármacos poco inhibidores de las enzimas COX-1 y sólo a altas dosis.)
DIAGNOSTICO
El diagnóstico de la intolerancia a los AINEs se basa habitualmente en la historia clínica detallada. Los tests cutáneos no se realizan de forma sistemática, dada la rara incidencia de un origen inmunológico de la reacción. No se disponen de tests in vitro adecuados para el diagnóstico clínico de rutina, aunque se mantiene esta línea de investigación.
Por tanto, las provocaciones con AAS y AINEs deben llevarse a cabo con el fin de identificar definitivamente a los pacientes sensibles. El hecho de que si estas provocaciones deberían llevarse a cabo debe ser motivo de reflexión y análisis. La mayoría de los pacientes pueden provocarse evitando el AINE sospechoso de estar implicado en el cuadro clínico, y por tanto, realizarse con otro AINE para comprobar tolerancia, y ofrecer así una terapia alternativa.
Las diferentes situaciones clínicas que deberían plantear la necesidad de hacer la provocación diagnóstica son las siguientes:
Asma con sensibilidad a AAS: debe efectuarse provocación con otros AINEs para ofrecer medicación alternativa, si el paciente precisase AAS/AINE por otra enfermedad y si resulta positiva la provocación podría valorarse la desensibilización.
Urticaria crónica idiopática; la mayoría de estos pacientes reaccionarán con AAS/AINE en la fase activa de la enfermedad, las provocaciones solo se llevarán a cabo en quienes precisen esta medicación por otra enfermedad.
Urticaria aguda por AAS/AINEs, según la historia clínica, salvo en los adultos sometidos a angioplastias, donde el AAS es el fármaco de elección para prevenir tromboembolismos, la provocación se efectuará con otro AINE para probar tolerancia.
Anafilaxia, según la historia clínica, se debe asumir esta sensibilidad y provocar con otro AINE, salvo que se precisase AAS como antiplaquetario, en cuyo caso se plantearía la provocación y siempre en UCI.
Asociación potencial de AINE y meningitis aséptica: provocar siempre con otro AINE, la aspirina y el paracetamol no han sido implicados como causa de esta entidad clínica.
Asociación potencial entre AINE y neumonitis por hipersensibilidad: se debe provocar siempre con otro AINE: La aspirina y el paracetamol tampoco se han relacionado con esta entidad clínica.
Una vez realizado el diagnóstico, hay que entregarle al paciente un listado detallado de fármacos conocidos como principales causantes, así como una lista de fármacos alternativos seguros.
Test de provocación oral con AAS
1. Observar las restricciones terapéuticas en los días previos a la provocación.
2. Examen físico completo y valoración de la función respiratoria basal, mediante espirometría.
3. La provocación se llevará a cabo con cápsulas de gelatina opacas.
4. Se realizarán por la mañana, en medio hospitalario, por personal experto y con el material y medicación necesarios para el tratamiento de emergencia en caso de reacción.
5. El primer día se realizará provocación con placebo, lactosa.
6. Al día siguiente se procederá a la provocación con fármaco, dosis 10, 20, 50, 100, 150, 250, 300, 400, 500 mg. Siendo la dosis máxima de la provocación la dosis terapéutica. En caso de cuadros clínicos graves, se debe comenzar por dosis más bajas 1-5 mg.
7. Intervalo entre dosis, varía según los autores: Szczeklik73 realiza la provocación en un día, otros autores efectúan los incrementos de dosis en los días sucesivos y según Stevenson74, el intervalo entre dosis debe de ser de 72 horas, dado que existe un periodo refractario de 48 horas tras una provocación oral, en dicho periodo si se somete al paciente a una nueva dosis se puede obtener una tolerancia al fármaco.
8. Controles a efectuar tras cada dosis:
Niños con asma y menores de 6 años: control de síntomas clínicos.
Niños con asma mayores de 6 años: síntomas clínicos y espirometrías cada 30 minutos.
9. La prueba se considerará positiva, cuando tenga lugar de uno o varios de los siguientes hechos:
a) Sintomatología naso-ocular: rinorrea, prurito, obstrucción nasal, inyección conjuntival, lagrimeo.
b) Disminución del FEV1 mayor o igual al 15 % con respecto al FEV1 obtenido previamente con placebo.
c) Aparición de Urticaria y/o Angioedema.
10. Una vez obtenido un resultado positivo se finaliza la prueba, a no ser que se pretenda la inducción de tolerancia.
11. Administrar medicación para controlar los síntomas, si la prueba es positiva y el cuadro clínico lo requiere; observación durante las 48 horas siguientes a la provocación.
Otras técnicas de provocación
Inhalación de aerosol de acetilsalicilato de lisina75, que se puede realizar en una mañana, con dosis cada 30 minutos.
Provocación nasal con solución de acetilsalicilato de lisina.
Recientemente varios grupos han propuesto la mucosa oral como un modelo in vivo para investigar los mecanismos implicados en las reacciones alérgicas y no alérgicas76,77, las pruebas de provocación nasal utilizando una solución de acetil salicilato de lisina se han empleado para el diagnóstico de la sensibilización a AAS manifestada por síntomas bronquiales, aunque también hay estudios utilizando esta técnica en pacientes con Urticaria/Angioedema por AAS78. Esta técnica es más segura, menos laboriosa y las reacciones que pueden producir son más leves y fáciles de controlar:
1. Observar las restricciones terapéuticas en los días previos a la provocación.
2. El paciente debe estar asintomático en el momento de la prueba.
3. Instilación nasal de solución salina (ClNa al 0,9 %: solución control).
4. El acetilsalicilato de lisina se aplica por instilación en soluciones preparadas en fresco, conteniendo 6 y 12 mg. Las soluciones se preparan con suero salino, con 90 y 180 mg/ml, respectivamente, equivalentes a 50 y 100 mg de AAS. Se calibra el peso de un frasco nebulizador de cristal oscuro (volumen medio de spray 0,12 ml). Dependiendo de la solución utilizada, el spray contiene 6 o 12 mg de AAS.
5. Control por rinomanometría anterior o por la medición del pico-flujo nasal (PFEN) y también espirometría, que se efectuarán antes de la instilación, tras el control y a los 15 y 60 minutos después de cada instilación. En cada paso de la provocación, el paciente repite la prueba hasta tres veces, tomando la mejor de ellas.
6. Se consideran positivas caídas superiores al 20 % del flujo o PFEN.
7. Dada la amplia variabilidad en los patrones de respuesta entre individuos, conviene además efectuar evaluación de síntomas.
Consideraciones para la provocación
Los pacientes asmáticos deben estar en remisión y con un FEV1 superior a 70 % del valor teórico predicho para su edad, peso, talla y sexo.
Los enfermos deben continuar con el tratamiento habitual para el asma, incluyendo los corticoides, pero suspendiendo los simpaticomiméticos, xantinas diez horas antes y los antihistamínicos 8 horas antes de la provocación. Cabe esperar que las reacciones inducidas por aspirina en pacientes intolerantes tratados con corticoides se vuelvan más intensas cuando se suspenden estos.
Los glucocorticoides atenúan las reacciones por AAS79, debe tenerse en cuenta la posibilidad de resultados falsos negativos en relación con tratamiento con corticoides, esto puede ser más relevante en pacientes con sensibilidad de grado leve (dosis umbral de aspirina > 200 mg).
El cromoglicato y el ketotifeno 72 horas antes de la provocación, el cromoglicato sódico puede aliviar las reacciones por aspirina80,81. El ketotifeno y otros antihistamínicos puede bloquear y modificar respectivamente la reacción a la aspirina82,83.
PARTICULARIDADES DE LA INTOLERANCIA A AINES EN NIÑOS
Las principales diferencias entre las intolerancias a AINES de niños y adultos radican en la incidencia:
En niños el asma inducida por AINES suele presentarse simultáneamente con el asma extrínseca, siendo excepcional encontrarla en asmáticos no sensibilizados a neumoalergenos, aunque es una causa de asma menos frecuente en estas edades (2-6 %) de todos los asmáticos, que en los adultos (10-16 %), y aumenta al 30-40 % de los pacientes con asma y poliposis84,85.
La prevalencia de urticaria crónica por hipersensibilidad a AAS/AINEs varía entre el 21 y 30 %86,87.
En individuos asintomáticos, población adulta y pediátrica, la prevalencia de la hipersensibilidad a AAS es del 0,3 %
Por sexos, el 68 % de los niños intolerantes a AINES son varones, y la relación varón/hembra en niños intolerantes es similar a la del niños que padecen asma extrínseca88, doble en varones que en hembras. Mientras que entre adultos el predominio es femenino, 61 %, en las series de pacientes intolerantes89.
En pacientes pediátricos intolerantes a AINES, la urticaria asociada con síntomas de asma es más frecuente (62,5 %)88, que en los adultos (6 %)2.
En relación con la reactividad cruzada, los hallazgos suelen ser similares cuando se analizan poblaciones adultas o pediátricas, siendo los resultados de provocaciones con otros AINEs parecidos a los obtenidos en adultos.
En cuanto a patología sinusal, es muy rara la presentación de poliposis nasal entre los niños intolerantes88,90,91. En adultos la presencia de poliposis oscila según distintos autores, entre el 37 y el 61 %2. Sin embargo en un estudio del grupo de Ojeda88, en un trabajo realizado en 151 niños asmáticos seleccionados, de edades en 2 y 14 años encuentran una diferencia estadísticamente significativa (p < 0,01) en relación con la presencia de velamiento, edema o hiperplasia mucosa entre los grupos de asmáticos intolerantes y asmáticos extrínsecos tolerantes.
La intolerancia a AINEs puede aparecer a cualquier edad, en la serie de Botey92 6 de los 9 pacientes comenzaron con síntomas antes de los tres años de edad.
La variabilidad de los datos aportados en diferentes estudios radica en:
1. Si la sensibilidad se evidencia por la historia clínica o por provocación.
2. Técnicas de evaluación de la provocación: síntomas, PEF, espirometría.
3. En la población de asmáticos estudiada: grupos no homogéneos, edades, gravedad.
TRATAMIENTO
Desensibilización
El término desensibilización se emplea en un sentido amplio. Dado que no se han establecido mecanismos mediados por IgE en las reacciones inducidas por AAS, el término se refiere básicamente a la inducción de una tolerancia, por la exposición repetida y creciente de AAS por vía oral, para lograr una reducción y posterior eliminación de la reacción a AAS. Zeiss y Lockey93, observaron un periodo refractario de unas 72 horas tras una crisis asmática inducida por AINEs. Posteriormente, Stevenson et al94, publicaron dos casos de pacientes asmáticos sensibles a AAS, que presentaron un periodo refractario tras crisis de asma por AAS.
En 1996, Stevenson95 comunicó los datos de seguimiento de 65 pacientes sensibles a AAS y en tratamiento con AAS durante un periodo entre 1 y 6 años, en los que revelaba la eficacia del tratamiento en la disminución de los síntomas de sinusitis, polipectomías/cirugía sinusal, hospitalizaciones, recuperación del olfato y reducción de medicación (corticoides).
Los diferentes protocolos de desensibilización se basan en la administración oral de dosis crecientes de AAS en tres días hasta alcanzar una dosis terapéutica. Durante el periodo de desensibilización es más seguro alternar un AINE por otro. La duración del periodo refractario varía entre 2 y 5 días, y la sensibilización completa se desarrolla alrededor del 7.º día.
Indicaciones
Hay muchas cuestiones pendientes sobre la desensibilización a AAS, dosis óptima, duración del intervalo hasta la mejoría clínica, selección del paciente candidato, métodos de evaluación de su eficacia, y efecto del tratamiento con AAS sobre la inflamación de la vía aérea, así pues admitiendo el estado de controversia existente en torno a las indicaciones de la desensibilización, podría recomendarse en pacientes con asma inducida por la aspirina con difícil control con dosis bajas de corticoides sistémicos, en pacientes que requieren tratamiento quirúrgico repetido (polipectomías), y en aquellos enfermos que precisen AINE por un proceso articular crónico o fenómeno tromboembólico.
Antagonistas de los leucotrienos
Los leucotrienos se encuentran implicados en la patogenia de distintos modelos de asma, entre los que se encuentra el asma inducida por AAS y otros AINEs. Los antagonistas de los leucotrienos han mostrado una inhibición casi completa de los síntomas bronquiales y extrapulmonares producidos por la provocación oral con AAS en pacientes sensibles96. Pero frente a esta efectividad clínica, en estos pacientes solo se observa una reducción parcial en la liberación urinaria de LTE4. Se sugiere que únicamente un bloqueo parcial sería suficiente para prevenir la respuesta clínica. Recientemente Nasser et al97 observaron que tras una desensibilización con AAS en pacientes sensibles, la ingestión de AAS seguía liberando cantidades significativas de LTE4 por la orina, sin acompañarse de cambios en la función pulmonar. Estas observaciones indican que la producción de leucotrienos puede ser una parte importante de la reacción al AAS, y desde el punto de vista clínico es importante establecer qué leucotrienos están implicados en la fisiopatología de la inflamación de la vía respiratoria del paciente asmático.
Sin embargo, Enrique E. et al98, comunicaron el caso de un paciente que estaba recibiendo montelukast regularmente, y la administración de un inhibidor de la ciclooxigenasa le precipitó un grave ataque de asma.
Alternativas terapéuticas
El paracetamol y los salicilatos no acetilados, habitualmente son bien tolerados, y se consideran desde hace años como alternativas terapéuticas. Sin embargo, teniendo en cuenta la incidencia de reacciones adversas al paracetamol, que aunque son poco frecuentes, y la no disponibilidad de salicilatos no acetilados en el mercado nacional, hay que destacar la importancia de buscar nuevas alternativas terapéuticas, como son los antiinflamatorios preferentemente inhibidores de la COX-2.
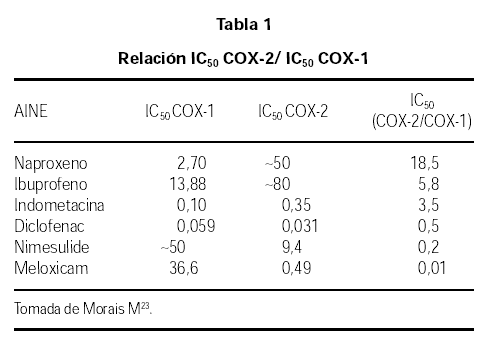
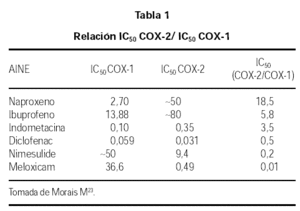
Los AINEs presentan diferentes grados de selectividad en relación a la COX-1 y a la COX-2, estos se pueden expresar por la relación entre las concentraciones necesarias para producir una inhibición in vitro del 50 %, así cuanto menor sea la relación IC50 COX-2/IC50 COX 1, mayor es la selectividad COX-2 (tabla 1).
La mayoría de los AINEs más utilizados, AAS, ibuprofeno, naproxeno, indometacina, inhiben preferentemente la COX-1. El diclofenaco, ketorolaco inhiben por igual ambas enzimas. Y entre los que inbiben preferentemente la COX-2 tenemos en el mercado farmacéutico español tres AINEs selectivos de la COX-2: la Nimesulida, el meloxicam, la nabumetona y dos AINEs altamente selectivos de la COX-2: rofecoxib y celecoxib.
Nimesulida
La nimesulida (4-nitro-2-fenoximetanosulfonanilida), posee propiedades antiinflamatoria, antipirética y analgésica, proponiéndose varios mecanismos para su actividad antiinflamatoria102,103,104:
Inhibición preferencial de la COX-2
Inhibición del metabolismo oxidativo de los neutrófilos.
Captación de radicales libres de oxígeno.
Prevención en la inactivación de la Alfa 1 antitripsina.
Inhibición de la activación de las moléculas de adhesión CD11a/CD18-CD54.
Inhibicición de la síntesis de PAF y leucotrienos.
Inhibición de la liberación de histamina de mastocitos y basófilos.
Inhibición del factor de necrosis tumoral alfa (TNF-α).
De estos datos se deduce una eficaz actividad antiinflamatoria, asociada a una mejor tolerancia digestiva, junto con una actividad antioxidante, anti-histamínica y antianfiláctica, ligadas estas últimas a la inhibición que produce en la liberación de histamina y LTC4 por basófilos y mastocitos de pulmón y piel101 y a la inactivación de las moléculas de adhesión (CD11a/CD18-CD54), importantes en la inflamación alérgica.
En los últimos años se han realizado diversos estudios para demostrar y cuantificar la tolerancia a la nimesulida en pacientes con reacciones adversas a ASA/AINE, siendo los resultados de los estudios realizados en población adulta, variables, desde un 71,5 % de tolerancia encontrada por Faria et al103, al 100 % que refieren Bianco et al85. Esta variabilidad se achaca a diferencias de metodología.
En los pacientes con intolerancia al AAS, se recomienda, que cuando esté indicado la utilización de nimesulida, no utilizar dosis superiores a 5 mg/kg/dia (con una dosis total diaria inferior a 200 mg)23.
Meloxicam
Ha revelado una actividad inhibitoria de la COX-2, IC50COX-1/IC 50COX2 muy baja104, pudiéndose clasificar como un inhibidor preferencial de la COX-2. En estudios efectuados en pacientes reumatológicos, revelan una eficacia anti-inflamatoria, analgésica equivalente a otros AINE habitualmente utilizados (naproxeno, diclofenaco, piroxican)105,106,107. Comprobándose una mejor tolerancia digestiva y renal.
Rofecoxib
En un estudio de Martín108 en un grupo de 50 pacientes adultos con asma por AINEs, diagnosticados por la historia clínica, realizaron prueba de tolerancia oral con rofecoxib 25 mg a simple ciego y controlado con placebo obteniendo un 100 % de pacientes tolerantes al rofecoxib.
Stevenson et al110, en un estudio doble ciego, con placebo en 60 pacientes diagnosticados de asma por AAS mediante prueba de provocación, obtenienen un 100 % de tolerancia con el rofecoxib.
Borges et al109, en un estudio con 110 pacientes diagnosticados de urticaria-angioedema por AINEs, efectuaron prueba de tolerancia oral doble ciego, con placebo y rofecoxib, obtieniendo un 3 % de reacciones cutáneas.
Celecoxib
Martín108, en un grupo de 50 pacientes adultos con asma por AINEs, diagnosticados en base a la historia clínica, realizó prueba de tolerancia oral con 200 mg de celecoxib, a simple ciego controlada con placebo, obteniendo un 100 % de pacientes tolerantes al celecoxib.
Borges et al109, en un estudio con 110 pacientes diagnosticados de urticaria-angioedema por AINEs, efectuaron prueba de tolerancia oral doble ciego, con placebo y celecoxib, obteniendo un 33,3 % de reacciones cutáneas.
CONCLUSIONES
En la edad pediátrica el paracetamol es considerado como la alternativa terapéutica en los casos de intolerancia a AAS/AINEs.
Se necesitan más estudios en edades pediátricas en relación con medicamentos alternativos.
Los recientes avances de investigación, en el control de la inflamación, para los inhibidores selectivos de la COX-2, son un campo de investigación en crecimiento en el terreno de la inflamación alérgica.
Se precisan más estudios con el rofecoxib y el celecoxib, que aclaren si con dosis superiores estos dos fármacos no producirían inhibición de la COX-1, y que sucederá tras la administración continuada de ellos
Aunque las reacciones adversas por AINEs, y particularmente el AIA continúa siendo una incógnita, atrae cada vez a más científicos, convencidos de que desvelar los misterios de este síndrome nos ofrecerá nuevas perspectivas sobre la patogenia del asma.
AGRADECIMIENTOS
A los laboratorios ALK-Abelló por su colaboración en la documentación bibliográfica de esta ponencia.