Describimos la experiencia inicial de nuestro equipo con una disección novedosa de la aorta infrarrenal y la arteria ilíaca asistida con robot para el tratamiento de la arteriopatía oclusiva aortoilíaca y el aneurisma aortoilíaco abdominal. Siete pacientes se sometieron al procedimiento usando el sistema quirúrgico de manipulación da Vinci. La disección transabdominal, retroperitoneal de la aorta y las arterias ilíacas se completó usando el sistema robótico; más tarde se efectuaron una minilaparotomía y una anastomosis aorta a injerto suturada manualmente. En esta serie de pacientes no se produjo mortalidad. Esta nueva técnica puede resolver las dificultades de la disección aórtica en la cirugía aórtica laparoscópica pura y sirve como paso intermedio hacia la cirugía aórtica robótica total.
Se ha descrito el tratamiento laparoscópico de la arteriopatía oclusiva aortoilíaca (AOAI) y del aneurisma aórtico abdominal1-3 (AAA) pero también ha suscitado críticas la prolongada curva de aprendizaje4. La estrategia robótica es viable y tiene la posibilidad de reducir las complicaciones perioperatorias y el tiempo de restablecimiento. El uso de un dispositivo robótico puede mejorar la precisión quirúrgica y aumentar la destreza manual, lo que resuelve las dificultades de la disección y anastomosis aórtica. Se han publicado informes previos donde se ha usado el dispositivo robótico Zeus para estos procedimientos5,6. En la actualidad, el sistema robótico da Vinci para la enfermedad aórtica se limita a la ejecución de la anastomosis aórtica. La disección aórtica se efectúa utilizando la técnica laparoscópica y la anastomosis aorta a injerto se realiza usando el robot7-10. El objetivo de este dispositivo es proporcionar a los cirujanos los instrumentos necesarios para mejorar la disección aórtica y los resultados técnicos. Describimos nuestra experiencia inicial y los primeros resultados de los procedimientos asistidos con robot para la disección de la aorta infrarrenal y de la arteria ilíaca.
Materiales y métodosDesde febrero a noviembre de 2006, siete pacientes se sometieron a procedimientos aórticos abdominales asistidos con robot para AOAI y AAA. Los criterios de inclusión para la AOAI fueron pacientes con lesiones C o D de los criterios del TransAtlantic Inter-Society Consensus11 (TASC) y síntomas de claudicación grave, dolor en reposo o pérdida de tejido. Los criterios de inclusión para los AAA fueron lesiones infrarrenales, sin rotura, > 5cm de diámetro, aneurisma ilíaco>4cm de diámetro y ausencia de patología intraabdominal concomitante. Se excluyeron los pacientes que se sometieron a un tratamiento laparoscópico o robótico total de una endofuga tipo II y con cualquier contraindicación para anestesia general. Los pacientes sometidos a una intervención abdominal previa no se excluyeron. Los datos se obtuvieron de modo prospectivo y se analizaron retrospectivamente.
Sistema quirúrgico robóticoEl robot da Vinci Surgical System (Intuitive Surgical, Sunnyvale, CA) no ha sido aprobado por la US Food and Drug Administration (FDA) para los procedimientos aórticos abdominales. La técnica asistida con robot se completó según un protocolo de investigación y fue aprobada por el comité de investigación del hospital Henry Ford. Todas las intervenciones se efectuaron tras obtener el consentimiento informado y la aprobación del protocolo por el comité de investigación. Este sistema quirúrgico consiste en una consola del cirujano diseñada ergonómicamente, un carro quirúrgico, situado junto a la mesa de operaciones, que da soporte a tres brazos robóticos electromecánicos, interactivos, uno de los cuales porta las luces y la cámara de vídeo de alta definición con dos imágenes de doble canal que se funden y proporcionan una imagen estereoscópica tridimensional. El sistema de visión incluye un endoscopio tridimensional de alta resolución con dos canales independientes acoplados a dos monitores. Todos los pacientes recibieron anestesia general. El equipo quirúrgico consistió en un cirujano vascular con experiencia, un cirujano asistente residente y un asistente vascular instrumentista.
Técnica laparoscópica asistida con robotSe colocó al paciente en posición de decúbito supino en un ligero Trendelunburg de 10 grados con el lado izquierdo ligeramente elevado (o el derecho en el caso de arteriopatía oclusiva de la ilíaca derecha) sobre una almohadilla y un colchón de bolas de porespán. El abdomen y las ingles se prepararon del modo quirúrgico estándar. Para la arteriopatía oclusiva, inicialmente utilizó un abordaje de disección inguinal usando una técnica abierta estándar; para el clampaje vascular de las arterias femorales utilizamos vessel-loop con un clip laparoscópico y los abordajes inguinales se cerraron temporalmente con grapas para prevenir la fuga del neumoperitoneo.
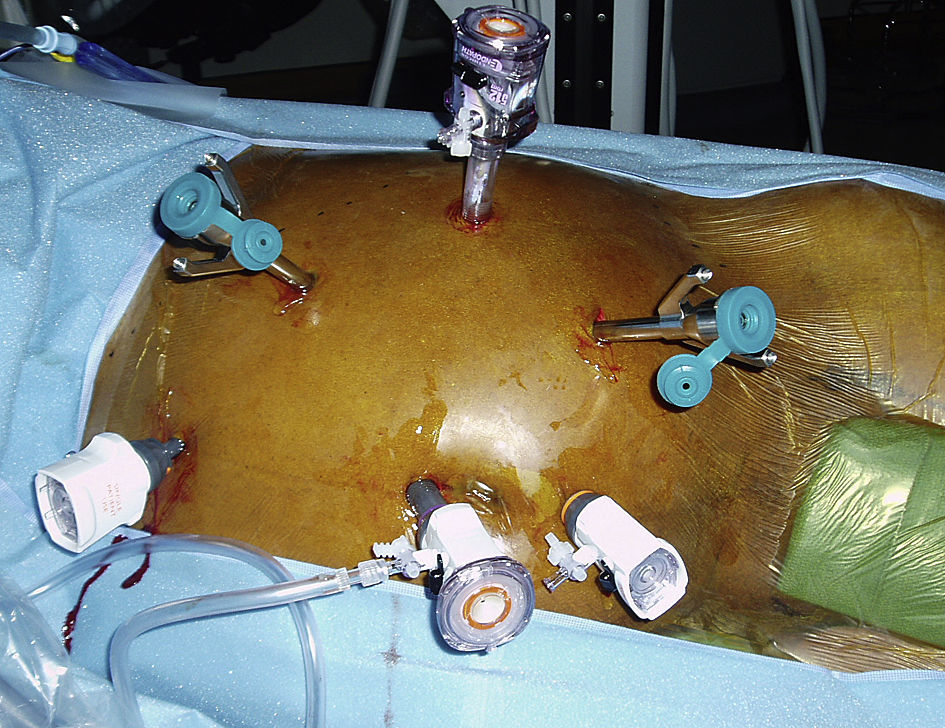
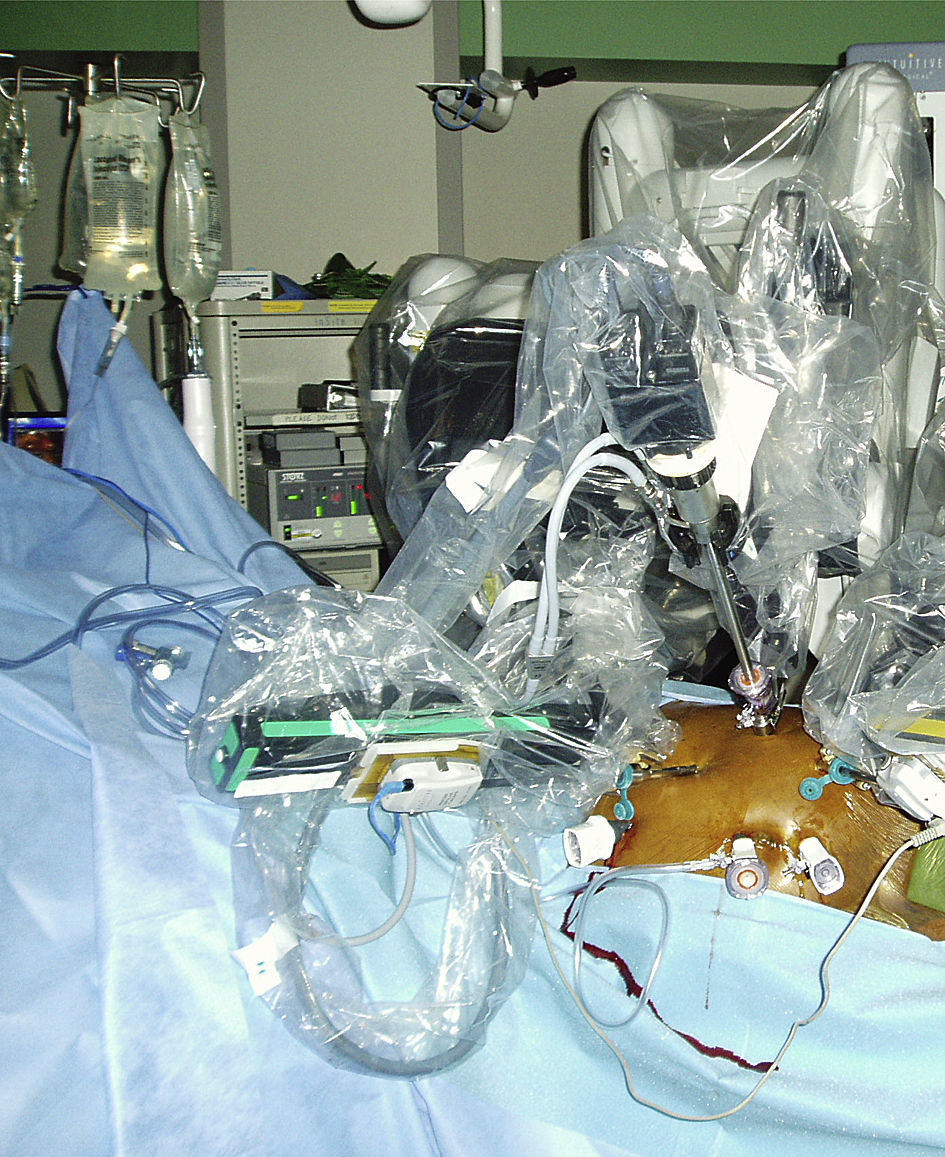
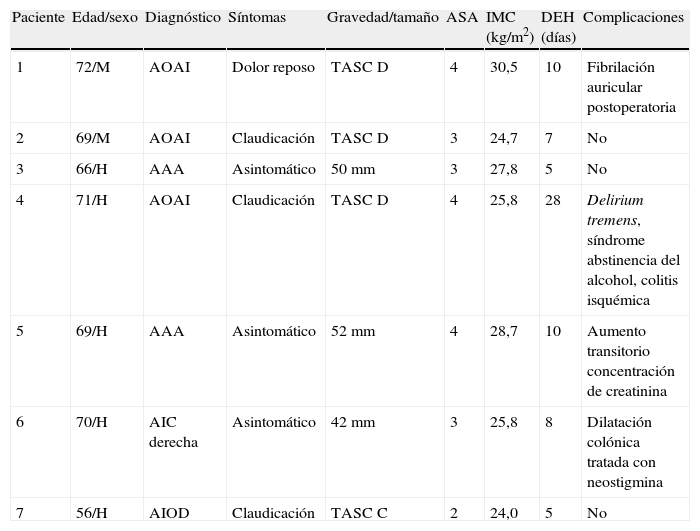
Se penetró en el abdomen a través de aguja de Veress y se estableció un neumoperitoneo de hasta 15 mmHg de dióxido de carbono con un ritmo de perfusión de 6 l/min. El endoscopio tridimensional de alta resolución da Vinci de 0 o 30 grados, provisto de cámara dual de triple chip para visualización, se acopló a una fuente de luz de xenón de alta intensidad y al InSite Vision System. Con la mesa girada por completo hacia la derecha, se rotó al paciente hasta una posición de decúbito de 45 grados. Dicha posición movilizó el intestino delgado un poco más a la derecha del paciente, usando el peso de la gravedad. Se insertaron seis o siete trócares mediante visualización directa (Ethicon Inc., Somerville, NJ; USSC, Norwalk, CT). Los instrumentos quirúrgicos robóticos dispuestos en plataformas de 8mm (Intuitive Surgical, Sunnyvale, CA) y los instrumentos quirúrgicos laparoscópicos en plataformas de 5 o 10mm (Karl Store, Tuttlingen, Alemania) se introdujeron en el abdomen mediante visualización directa (fig. 1). Los tres puertos robóticos se colocaron en triángulo a lo largo de la línea clavicular anterior entre el borde costal y el nivel umbilical, con una distancia de 10cm entre sí. Los tres puertos laparoscópicos se colocaron a lo largo de la línea media del paciente: uno de ellos se insertó 10cm por encima del ombligo, el otro en el ombligo y el otro 10cm por debajo. Acto seguido, se acopló el robot quirúrgico en los puertos (fig. 2).
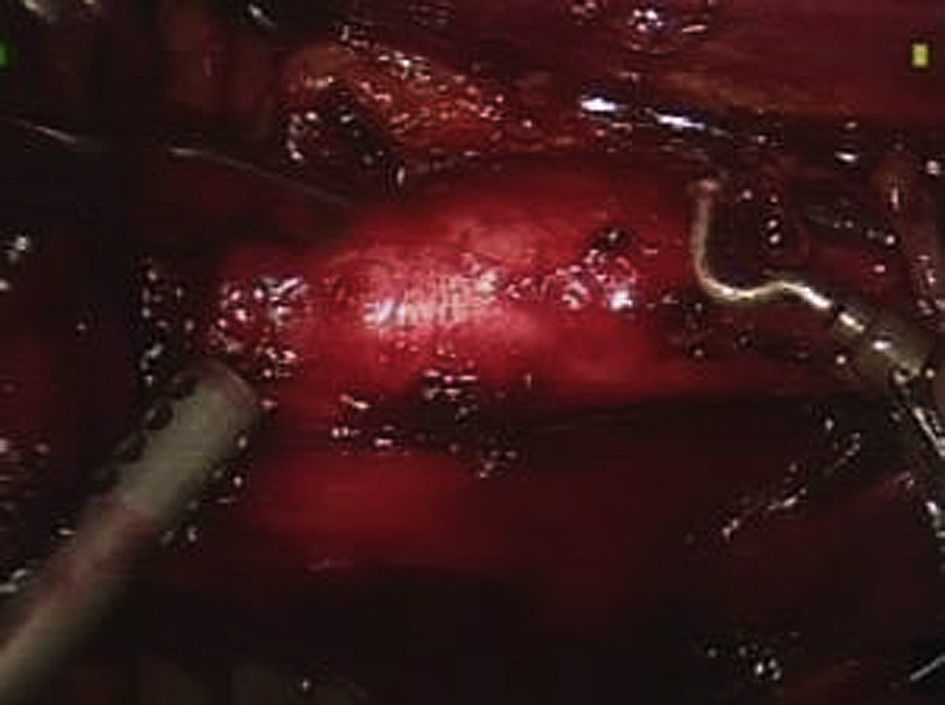
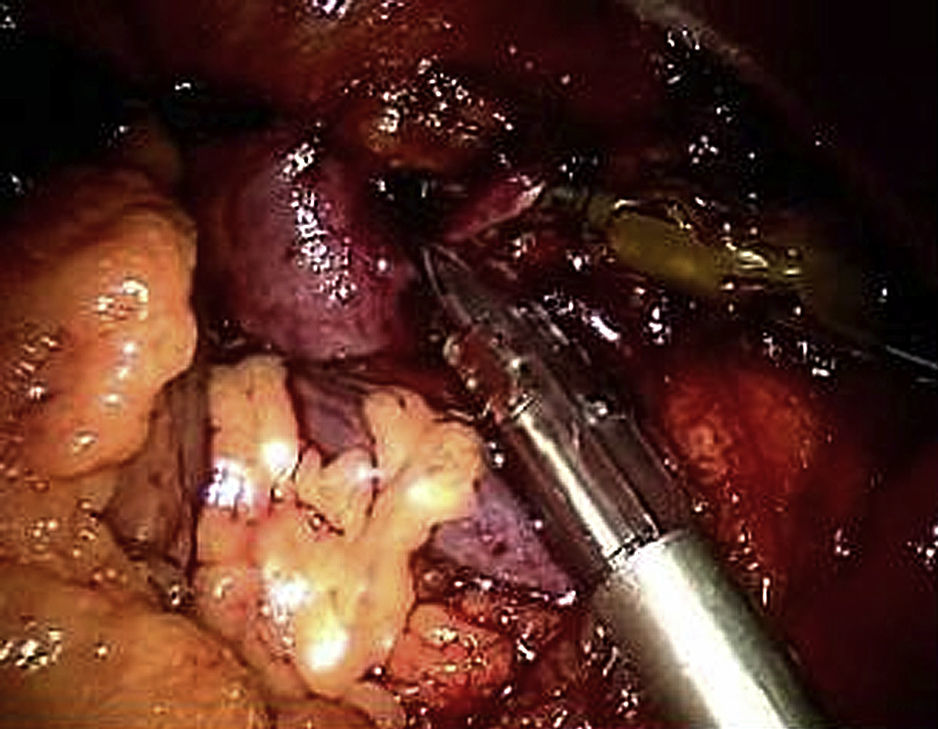
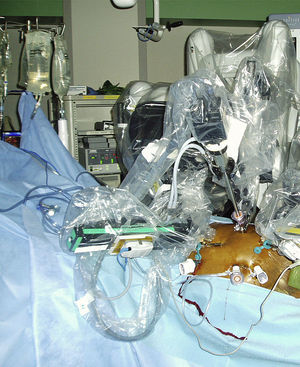
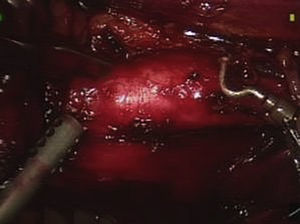
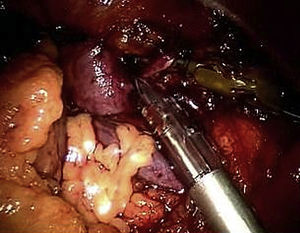
Usando el dispositivo robótico, se movilizó el colon izquierdo en la línea de Toldt y se retrajo medialmente hasta que se visualizó posteriormente el músculo psoas. El peritoneo no se elevó sino que permaneció in situ. La disección de la cara lateral izquierda de la aorta se inició a nivel de la arteria ilíaca izquierda y hasta la arteria renal (fig. 3). Cuando se alcanzó el cuello aórtico, se clampó y dividió la vena gonadal cuando fue necesario (fig. 4). Se efectuó una disección de la arteria mesentérica inferior y se clampó, se disecó la pared posterior de la aorta y se clamparon las arterias lumbares a partir de un abordaje lateral. La sangre retrógrada de las arterias lumbares se cerró con un aplicador de endoclip (Ethicon). Para disecar la aorta abdominal infrarrenal y las arterias ilíacas, se utilizó el sistema robótico.
Al término de la disección robótica, se desacopló el dispositivo y se efectuó una minilaparotomía de 12cm para la implantación del injerto4. El abordaje se realizó en la línea media o en disposición transversa, según la localización de la patología. Después de administrar las dosis apropiadas intravenosas de heparina y manitol, se ocluyeron los vasos ilíacos o la aorta distal, y se introdujo un tubo o un injerto de Dacron bifurcado o de PTFE en la cavidad retroperitoneal para la corrección del aneurisma o el bypass. Al término del procedimiento, la fascia de los puntos de inserción de los trócares se cerró secuencialmente con sutura de vicrilo del 0 para impedir la formación de una hernia incisional o del trócar.
ResultadosSe incluyeron cinco hombres y dos mujeres cuya edad media era de 67,6 años (límites 56-72 años) y con un índice de masa corporal de 26,8kg/m2 (24-30,5kg/m2). Como se cita en la tabla I, cuatro pacientes presentaban arteriopatía oclusiva aortoilíaca (TASC C o D), tres aneurisma aórtico abdominal infrarrenal y otro, un aneurisma de la ilíaca común. Los siete pacientes tenían antecedentes de coronariopatía, hipertensión arterial e hiperlipemia, y dos tenían insuficiencia cardíaca congestiva. De ellos, cuatro eran ex fumadores y tres fumadores activos. En la clasificación de la American Society of Anesthesiologists todos obtuvieron una clase II, III o IV. El tiempo quirúrgico medio fue de 333min (214-617min). La pérdida hemática estimada fue de 700ml (400-1.250ml). La estancia mediana en la unidad de cuidados intensivos (UCI) fue de 2 días (1-25 días), y la duración mediana de la estancia hospitalaria (DEH) fue de 8 días (4-28 días).
Variables y resultados de los pacientes
| Paciente | Edad/sexo | Diagnóstico | Síntomas | Gravedad/tamaño | ASA | IMC (kg/m2) | DEH (días) | Complicaciones |
| 1 | 72/M | AOAI | Dolor reposo | TASC D | 4 | 30,5 | 10 | Fibrilación auricular postoperatoria |
| 2 | 69/M | AOAI | Claudicación | TASC D | 3 | 24,7 | 7 | No |
| 3 | 66/H | AAA | Asintomático | 50mm | 3 | 27,8 | 5 | No |
| 4 | 71/H | AOAI | Claudicación | TASC D | 4 | 25,8 | 28 | Delirium tremens, síndrome abstinencia del alcohol, colitis isquémica |
| 5 | 69/H | AAA | Asintomático | 52mm | 4 | 28,7 | 10 | Aumento transitorio concentración de creatinina |
| 6 | 70/H | AIC derecha | Asintomático | 42mm | 3 | 25,8 | 8 | Dilatación colónica tratada con neostigmina |
| 7 | 56/H | AIOD | Claudicación | TASC C | 2 | 24,0 | 5 | No |
AOAI: arteriopatía oclusiva aortoilíaca; AAA: aneurisma aórtico abdominal; AIC: aneurisma ilíaco común; ASA: American Society of Anesthesiologists; DEH: duración de la estancia hospitalaria; H: hombre; IMC: índice de masa corporal; M: mujer; TASC: Trans-Atlantic Inter-Society Consensus.
No se produjo mortalidad. Las complicaciones incluyeron fibrilación auricular, colitis isquémica, insuficiencia renal crónica e íleo postoperatorio. La paciente 1 experimentó fibrilación auricular intermitente y desarrolló la arritmia en el postoperatorio, lo que prolongó su estancia hospitalaria. El paciente 4, un gran fumador y alcohólico, desarrolló síndrome de abstinencia del alcohol, delirium tremens y colitis isquémica que requirió colectomía y una colostomía temporal.
El paciente 5, portador de una insuficiencia renal crónica preoperatoria, presentó un aumento transitorio de la concentración sérica de creatinina desde 2,9mg/dl hasta 4,9mg/dl; la concentración disminuyó hasta 3,2mg/dl después de 10 días. No requirió hemodiálisis pero la insuficiencia renal crónica prolongó su hospitalización. El paciente 6 desarrolló un íleo prolongado que se trató con una descompresión mediante sonda nasogástrica. Todos los pacientes seguían vivos y sus injertos estaban permeables después de un período de seguimiento medio de 16,6 meses (12-22 meses).
DiscusiónLa FDA ha aprobado el uso del sistema da Vinci Surgical System para su uso en adultos y pacientes pediátricos en procedimientos urológicos, laparoscópicos generales, ginecológicos, toracoscópicos no cardiovasculares generales y procedimientos de cardiotomía torácica. Este sistema robótico proporciona una visualización tridimensional, movimiento intuitivo de los instrumentos controlados por el cirujano y una maniobrabilidad de 360 grados de los extremos del instrumento a través de los puertos laparoscópicos. En la actualidad, el equipo de urología de Vattikuti de nuestro hospital ha completado más de 3.000 casos de prostatectomía robótica y en su estudio se describieron numerosos beneficios del procedimiento asistido con robot sobre la técnica abierta convencional12.
Entre las complicaciones descritas, tres pudieron relacionarse con la técnica robótica. El paciente 4, gran fumador y alcohólico, se sometió a colectomía sigmoidea debido a colitis isquémica. La tomografía computarizada (TC) efectuada preoperatoriamente demostró una aorta calcificada y la oclusión de la aorta distal. El tronco celíaco, arteria mesentérica superior y arteria mesentérica inferior eran permeables. Se ocluyeron las arterias ilíaca izquierda, ilíaca interna y externa; la arteria ilíaca interna izquierda se llena a través de colaterales. Estaba ocluida la arteria ilíaca común derecha; y las arterias ilíaca interna y externa derechas estaban estenosadas pero estaban permeables, y se rellenaban a través de colaterales. El paciente se sometió a una sigmoidoscopia en el segundo día postoperatorio que demostró una colitis isquémica leve. Sin embargo, fue necesaria su reincubación ante la aparición de disminución del nivel de conciencia y agitación debido al síndrome de abstinencia del alcohol. En ese momento, era difícil evaluar su estado mental y efectuar un examen abdominal debido al delirio. También desarrolló fiebre y leucocitosis; por lo tanto, se realizó una hemicolectomía y sigmoidectomía con colostomía terminal. La muestra biópsica confirmó una colitis isquémica leve, no transmural.
El paciente 5, con antecedentes, presentaba insuficiencia renal crónica, desarrolló un aumento transitorio de la concentración sérica de creatinina. Esto podría atribuirse al neumoperitoneo y, por tanto, relacionarse con la técnica robótica. Su concentración sérica de creatinina no recuperó los valores basales. Aunque el paciente no requirió hemodiálisis, estos acontecimientos prolongaron su hospitalización.
El paciente 6 desarrolló un íleo postoperatorio que se trató satisfactoriamente con medidas conservadoras. Movilizamos el colon derecho para tener un mejor abordaje de la arteria ilíaca común derecha proximal y aorta distal para un control proximal. Los puertos se colocaron intraabdominalmente y el colon derecho se disecó hasta acceder al espacio retroperitoneal. Es posible que la manipulación del colon derecho contribuyera a las complicaciones postoperatorias de este paciente. En el número limitado de pacientes del presente estudio, observamos que aquellos con comorbilidades más graves (pacientes 1, 4, 5 y 6) tuvieron más probabilidades de desarrollar complicaciones, presentar hospitalización prolongada y un período de recuperación más largo. Por lo tanto, la selección de los pacientes fue importante en los resultados clínicos.
El equipo de cirugía vascular de nuestro hospital ha efectuado otras ocho intervenciones aórticas laparoscópicas sin el uso de un dispositivo robótico. En el presente estudio, con un número limitado de pacientes, creemos que el uso de un robot quirúrgico para la cirugía aórtica permitió una mejor visualización y facilitó la disección aórtica durante los procedimientos laparoscópicos. Al reducir a un mínimo el traumatismo de un abordaje abdominal extenso, los pacientes pueden restablecerse con mayor rapidez y experimentan menos dolor. Por lo tanto, el desarrollo de la técnica robótica con beneficios a largo plazo demostrados para el tratamiento de la arteriopatía oclusiva y enfermedad aneurismática aórtica está destinado a mejorar los resultados del paciente.
Las técnicas robóticas y laparoscópicas actuales siguen requiriendo un tiempo quirúrgico prolongado en la curva de aprendizaje inicial de nuestro equipo. Probablemente, los modelos de formación adicional de laboratorio con el dispositivo robótico mejorarán la técnica y reducirán el tiempo quirúrgico13. La aplicación de las intervenciones aórticas robóticas puede expandirse para complementar los procedimientos endovasculares, como el tratamiento de las endofugas persistentes de tipo II tras tratamiento endovascular de un aneurisma. Esperamos que la técnica robótica pueda resolver las dificultades de la disección aórtica en la cirugía aórtica laparoscópica pura, servir de paso intermedio hacia la cirugía aórtica robótica total, y ampliar esta tecnología avanzada, mínimamente cruenta a otras áreas de cirugía vascular.