La lesión por isquemia-reperfusión, debida al estrés oxidativo, sigue siendo uno de los principales inconvenientes durante la cirugía cardíaca. El desequilibrio en la producción de radicales libres y antioxidantes in vivo determina el grado de estrés oxidativo. En la cardioplejía el uso de antioxidantes se ha convertido en una importante estrategia para el tratamiento del miocardio frente a la agresión de estos radicales. El objetivo del presente estudio fue analizar el efecto cardioprotector de la N-acetilcisteína (NAC) sobre la lesión precoz por reperfusión en pacientes sometidos a bypass coronario para lo que se utilizaron marcadores bioquímicos. Se seleccionaron 53 pacientes con una fracción de eyección ventricular izquierda > 0,4 programados para cirugía de bypass coronario con bypass cardiopulmonar y se les dividió en dos grupos. El primer grupo (n = 25) sólo recibió cardioplejía isotérmica, mientras que el segundo grupo de pacientes (n = 28) recibió cardioplejía enriquecida con NAC (50 mg/kg de peso corporal). En el período preoperatorio y postoperatorio se evaluaron los radicales libres, antioxidantes, troponina I cardíaca y propiedades hemodinámicas y clínicas de los pacientes en cinco intervalos de tiempo diferentes. La concentración de malondialdehído como parámetro de los radicales libres fue significativamente más baja en el grupo de cardioplejía + NAC durante la reperfusión (p < 0,05) y después de 12 (p < 0,05) y 24 h (p < 0,001) de la cirugía. En el grupo de prueba durante el período de reperfusión se identificó un aumento de todos los antioxidantes (p < 0,01). En este grupo se observó una mejora significativa (p = 0,001) de la fracción de eyección postoperatoria. No se observaron diferencias significativas entre grupos para los valores de troponina I cardíaca (p = no significativa). En pacientes sometidos a bypass coronario utilizando bypass cardiopulmonar la administración de NAC disminuyó sustancialmente el estrés oxidativo. No obstante, en el presente estudio, no dio lugar a una mejora de los valores de troponina I cardíaca, un marcador de lesión miocárdica. Por lo tanto, es preciso estudiar extensamente el efecto cardioprotector de esta molécula y la adaptación del miocardio al estrés oxidativo.
Durante la cirugía mediante bypass coronario (CBC) con bypass cardiopulmonar (BCP) se produce una interrupción total del flujo sanguíneo miocárdico (isquemia) debido al clampaje de la aorta, lo que da lugar a disfunción del miocito. Aunque es decisiva para el salvamento miocárdico y la supervivencia del paciente, paradójicamente la reperfusión del corazón isquémico favorece reacciones fisiopatológicas perjudiciales (es decir, una lesión de reperfusión), mediadas, en parte, por las especies reactivas del oxígeno1 (ERO). Normalmente, los efectos lesivos de las ERO son contrarrestados por el sistema de defensas antioxidante, que principalmente incluye la superóxido dismutasa (SOD), la catalasa y la glutatión peroxidasa. El estrés oxidativo debido al desequilibrio de la producción de radicales libres y antioxidantes in vivo es responsable de diversos cambios, como una lesión macromolecular, la peroxidación lipídica, lesión tisular y alteraciones de la permeabilidad de membrana y de la configuración de las proteínas celulares2,3.
Aunque en los estudios se ha descrito un efecto cardioprotector de los antioxidantes en la resolución del estrés oxidativo4,5, también se ha documentado la imposibilidad de observar el mismo efecto6,7. Las diferencias en los métodos experimentales, períodos de tiempo de isquemia y reperfusión y la naturaleza de los antioxidantes son algunas de las razones de los resultados contradictorios.
La N-acetilcisteína (NAC) es un derivado del aminoácido cisteína con un grupo acetilo unido al nitrógeno. Es un tiol hidrosoluble que contiene un antioxidante con un bajo peso molecular (163,20) y se ha usado clínicamente y en experimentos durante décadas8. La NAC produce una repleción de los depósitos de glutatión, lo que confiere una actividad antioxidante y el fragmento tiol de la molécula le confiere propiedades antioxidantes directas9,10. Los estudios han demostrado sus efectos beneficiosos a través de la reducción del estrés oxidativo en modelos animales y en seres humanos sometidos a cirugía cardíaca11,12. Sin embargo, debido a las diferencias en la dosis de los fármacos y su modo de administración, los resultados son poco concluyentes. Apenas se han publicado estudios que corroboren sus efectos cardioprotectores, y, por lo tanto, la NAC todavía no se ha aprobado para su uso en un contexto clínico.
El objetivo del presente estudio fue investigar la eficiencia de la NAC en la reducción del estrés oxidativo durante la lesión de isquemia/reperfusión analizando su influencia en los marcadores bioquímicos y clínicos de pacientes sometidos a CBC. La hipótesis fue que la infusión de NAC daría lugar a una mejora de la protección miocárdica en pacientes sometidos a CBC sin circulación extracorpórea.
Materiales y métodosPoblación de pacientesSe efectuó un estudio prospectivo, aleatorizado, doble ciego, en el Institute of Cardiovascular Diseases, Madras Medical Mission, India, tras la aprobación del comité de investigación del hospital y de obtener el consentimiento informado por escrito de los pacientes. Entre agosto de 2006 y octubre de 2007, se seleccionaron 53 pacientes programados para CBC aislada primaria, electiva, y se les dividió en dos grupos. El grupo 1 (n = 25, edad media 53,04 ± 8,06 años) fue el de control, que sólo recibió cardioplejía isotérmica. El grupo 2 (n = 28, edad media 54,18 ± 9,89 años) incluyó a los pacientes que recibieron NAC en una dosis de 50 mg/kg de peso corporal en la cardioplejía isotérmica. Los criterios de exclusión fueron cirugía urgente, fracción de eyección < 0,4, diabetes mellitus y otras enfermedades neurológicas y endocrinas.
Protocolo clínicoLa administración de anestesia se estandarizó para todos los pacientes. Como premedicación, se usaron morfina en dosis de 0,1 mg/kg y prometacina en dosis de 0,5 mg/kg. Los pacientes fueron inducidos con una combinación de fentanilo, midazolam y pancuronio. Después de la intubación, se inició ventilación mecánica con oxígeno y nitrógeno y la anestesia se mantuvo con pancuronio, fentanilo e isoflurano. Todos los pacientes se sometieron a CBC con BCP en condiciones de hipotermia moderada (34°C) y fueron intervenidos por el mismo grupo quirúrgico.
Después del clampaje de la aorta, se infundió de manera anterógrada una solución isotérmica, hiperpotasémica de cardioplejía, con o sin NAC a una tasa de 400 ml/h durante 4 min a todos los pacientes a través de los senos coronarios, seguido de revascularización miocárdica. La solución cardiopléjica estaba constituida por 60 ml de 120 Meq/l de K+, 40 ml de un 7,5% de HCO3, 10 ml de un 50% de dextrosa y 20 ml de un 50% de Mg++. Después, se infundió la misma solución a una tasa de 200 ml/h cada 20 min.
Las anastomosis distales se realizaron durante un solo período de oclusión aórtica y los extremos proximales se anastomosaron después de liberar el clampaje. En todos los casos se utilizó la arteria mamaria interna izquierda para la coronaria descendente anterior izquierda. Para liberar el bypass, se utilizó adrenalina como inotrópico de primera elección. Después de completar el CBC, los pacientes fueron trasladados a la unidad de cuidados intensivos (UCI) con un plan de extubación precoz. Los cuidados postoperatorios se estandarizaron para todos los pacientes.
Se extrajeron muestras de sangre venosa de forma seriada en cinco intervalos de tiempo diferentes: antes del bypass (pre-bypass), 10 min después del clampaje de la aorta (isquemia), 10 min después de la liberación del clampaje (reperfusión), y después de 12 y 24 h del procedimiento quirúrgico. Las muestras sanguíneas se centrifugaron; para el análisis bioquímico se usaron plasma y el hemolizado.
Determinaciones bioquímicasLa troponina I cardíaca (CTnI) se determinó en plasma con la fase sólida de un análisis enzimoinmunométrico quimioluminiscente (Vitros Immunodiagnostic Products; Ortho Diagnostic Systems, Raritan, NJ) utilizando un analizador Immulite. El límite de referencia superior del intervalo normal se estableció en 0,08 ng/ml.
Tras la extracción del plasma, los eritrocitos se lavaron tres veces en suero salino isoosmótico frío, amortiguado con fosfato (0,160 M Na H2PO4, 0,121 M Na H2PO4 • H2O, 0,154 M NaCl; pH –7,45). Después de incubación a 37°C durante 15 min, los hematíes se hemolizaron. El hemolizado 1:20 (50 μl de hematíes en 950 μl de agua destilada enfriada con hielo) se usó para las determinaciones de hemoglobina13, catalasa14, SOD15, y glutatión reducido16. El agua se reemplazó con una solución estabilizadora (2,7 mM de ácido etilendiaminotetracético [EDTA] y 0,7 mM de 2-mercaptoetanol) para las determinaciones de la actividad de la glutatión peroxidasa17 y glutatión reductasa18. Para el análisis de la concentración de malondialdehído (MDA) (mediante el método de Okhawa et al19) como marcador de estrés oxidativo, se utilizó una dilución 1:5 v/v del hemolizado en agua destilada enfriada con hielo19. Todas las determinaciones mencionadas previamente se efectuaron utilizando el espectrofotómetro UV-1601 Shimadzu (Kyoto, Japón).
Determinaciones hemodinámicasLos datos hemodinámicos, incluida la frecuencia cardíaca y la presión arterial, se registraron cada hora durante los 3 primeros días postoperatorios. El gasto cardíaco y la fracción de eyección se evaluaron preoperatoriamente un día antes de la cirugía y 5 días después de ésta mediante ecocardiografía bidimensional.
Análisis estadísticoTodos los datos se analizaron con la ayuda del departamento de bioestadística del instituto. La normalidad de los datos se evaluó usando la prueba de Kolmogorov-Smirnov. Para la comparación de todas las variables categóricas se usó la prueba de la Chi2. La comparación entre ambos grupos se efectuó con la prueba de la U de Mann-Whitney para variables sin una distribución normal y la prueba t de Student para variables de distribución normal. Dentro de cada grupo, también se compararon los diversos perfiles bioquímicos durante los diferentes períodos de tiempo con una prueba t bilateral (dos colas). Todos los resultados se expresan como media ± desviación estándar y se aceptó como estadísticamente significativo un valor de p < 0,05.
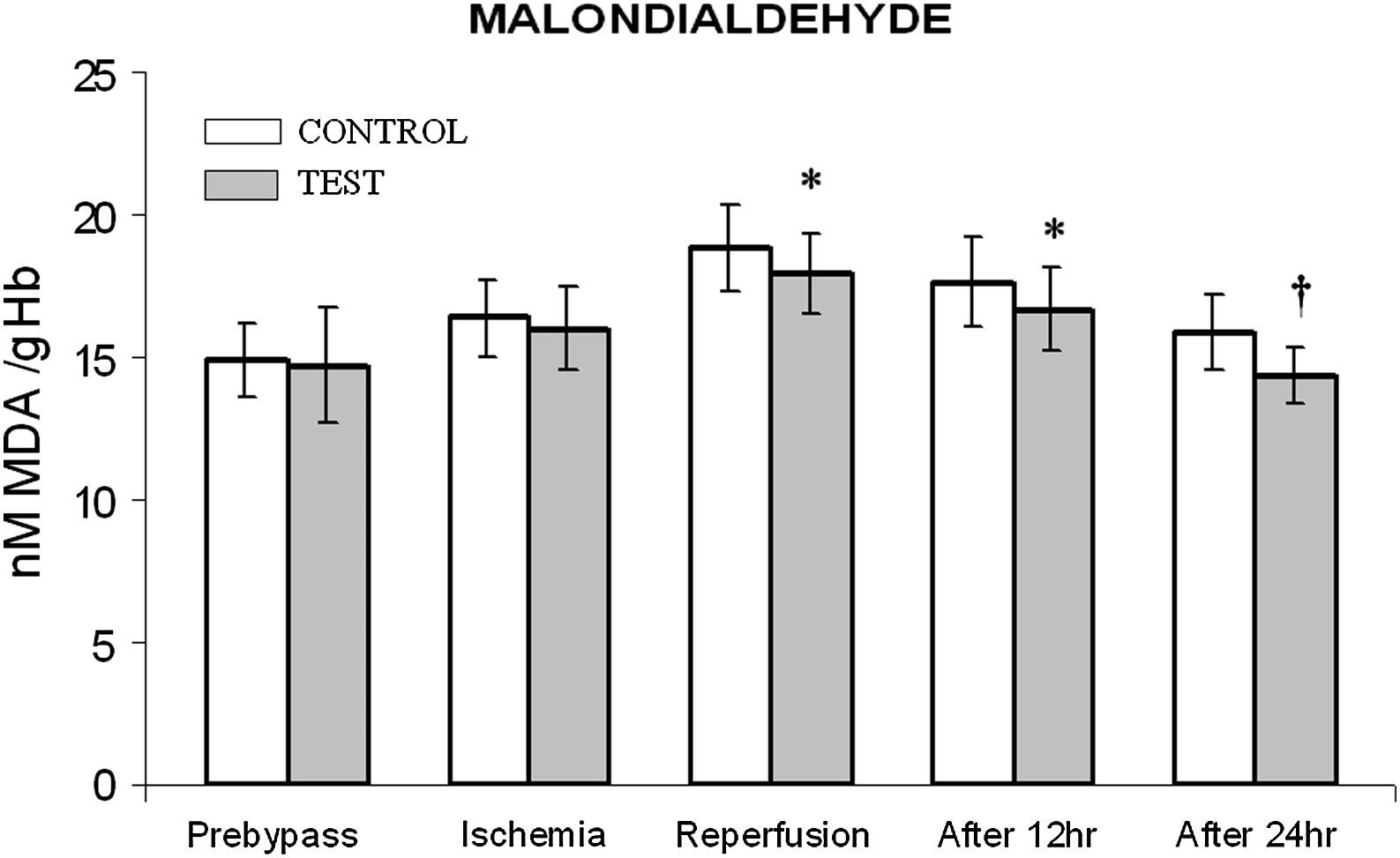
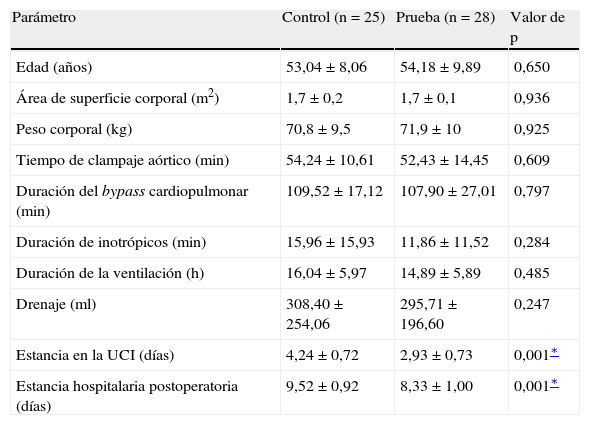
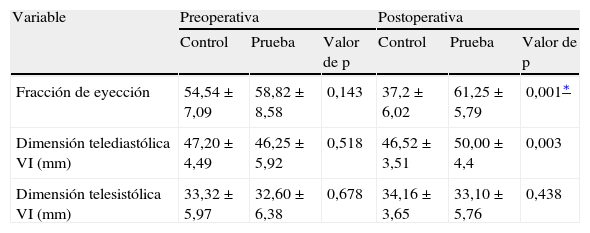
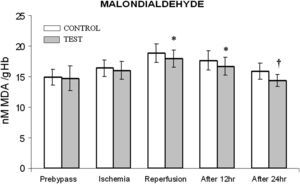
ResultadosEn las tablas I y II se muestran los datos demográficos, preoperatorios y postoperatorios de los grupos de pacientes. Ninguno de los pacientes había experimentado un infarto miocárdico preoperatorio. No hubo diferencias significativas en la duración del BCP y el tiempo de clampaje. Tampoco se observaron diferencias significativas en la administración de inotrópicos, duración de la ventilación y drenaje postoperatorio entre ambos grupos. El grupo de prueba se caracterizó por una estancia más breve en la UCI (p = 0,001), al igual que hospitalaria postoperatoria (p = 0,001) que el grupo de control. Aunque, entre ambos grupos, no se identificó una diferencia estadísticamente significativa en la dimensión telediastólica ventricular izquierda (DTDVI) y la dimensión telesistólica ventricular izquierda (DTSVI), se observó una diferencia significativa (p = 0,001) en la fracción de eyección durante el período postoperatorio (tabla II). La concentración basal de MDA (valor previo al bypass) (fig. 1) fue similar en ambos grupos. Durante la intervención quirúrgica, en particular durante el período de reperfusión, la concentración aumentó al máximo. Cuando comparamos ambos grupos durante el período de reperfusión, en el tratado con NAC se demostró una disminución significativa (p < 0,05) sobre el grupo de control. Incluso después de 12 y 24 h de la cirugía, en el grupo de prueba se demostró una disminución significativa con un valor de p < 0,05 y < 0,01, respectivamente, comparado con el grupo de control.
Datos demográficos, preoperatorios, quirúrgicos y postoperatorios
| Parámetro | Control (n = 25) | Prueba (n = 28) | Valor de p |
| Edad (años) | 53,04 ± 8,06 | 54,18 ± 9,89 | 0,650 |
| Área de superficie corporal (m2) | 1,7 ± 0,2 | 1,7 ± 0,1 | 0,936 |
| Peso corporal (kg) | 70,8 ± 9,5 | 71,9 ± 10 | 0,925 |
| Tiempo de clampaje aórtico (min) | 54,24 ± 10,61 | 52,43 ± 14,45 | 0,609 |
| Duración del bypass cardiopulmonar (min) | 109,52 ± 17,12 | 107,90 ± 27,01 | 0,797 |
| Duración de inotrópicos (min) | 15,96 ± 15,93 | 11,86 ± 11,52 | 0,284 |
| Duración de la ventilación (h) | 16,04 ± 5,97 | 14,89 ± 5,89 | 0,485 |
| Drenaje (ml) | 308,40 ± 254,06 | 295,71 ± 196,60 | 0,247 |
| Estancia en la UCI (días) | 4,24 ± 0,72 | 2,93 ± 0,73 | 0,001∗ |
| Estancia hospitalaria postoperatoria (días) | 9,52 ± 0,92 | 8,33 ± 1,00 | 0,001∗ |
UCI: unidad de cuidados intensivos.
p = 0,001, nivel de significación del 0,1%. Todos los datos se muestran como media ± desviación estándar y se aceptó como significativo un valor de p < 0,05. El grupo de control representa a los pacientes a los que sólo se administró cardioplejía. El grupo de prueba representa a los pacientes a quienes se administró N-acetilcisteína (NAC) (50 mg/kg de peso corporal) en la solución de cardioplejía.
Características ecocardiográficas de los pacientes que recibieron N-acetilcisteína y sin ella
| Variable | Preoperativa | Postoperativa | ||||
| Control | Prueba | Valor de p | Control | Prueba | Valor de p | |
| Fracción de eyección | 54,54 ± 7,09 | 58,82 ± 8,58 | 0,143 | 37,2 ± 6,02 | 61,25 ± 5,79 | 0,001∗ |
| Dimensión telediastólica VI (mm) | 47,20 ± 4,49 | 46,25 ± 5,92 | 0,518 | 46,52 ± 3,51 | 50,00 ± 4,4 | 0,003 |
| Dimensión telesistólica VI (mm) | 33,32 ± 5,97 | 32,60 ± 6,38 | 0,678 | 34,16 ± 3,65 | 33,10 ± 5,76 | 0,438 |
VI: ventrículo izquierdo.
p = 0,001, nivel de significación del 0,1%. Todos los datos se muestran como media ± desviación estándar y se aceptó como significativo un valor de p < 0,05. El grupo de control representa a los pacientes a los que sólo se administró cardioplejía. El grupo de prueba representa a los pacientes a quienes se administró N-acetilcisteína (NAC) (50 mg/kg de peso corporal) en la solución de cardioplejía.
Cambios de la concentración de malondialdehído (MDA). El grupo de control representa a los pacientes a quienes sólo se administró cardioplejía. El grupo de prueba representa a los pacientes a los que en la solución de cardioplejía se añadió N-acetilcisteína (NAC) (50 mg/kg de peso corporal). ∗p < 0,05, †p < 0,001 en comparación con el grupo de control. After 12 hr: después de 12 h; After 24 hr: después de 24 h; Ischemia: isquemia; MALONDIALDEHYDE: malondialdehído; nM MDA /gHb: nM de MDA/g Hb; Prebypass: pre-bypass; Reperfusion: reperfusión; TEST: prueba.
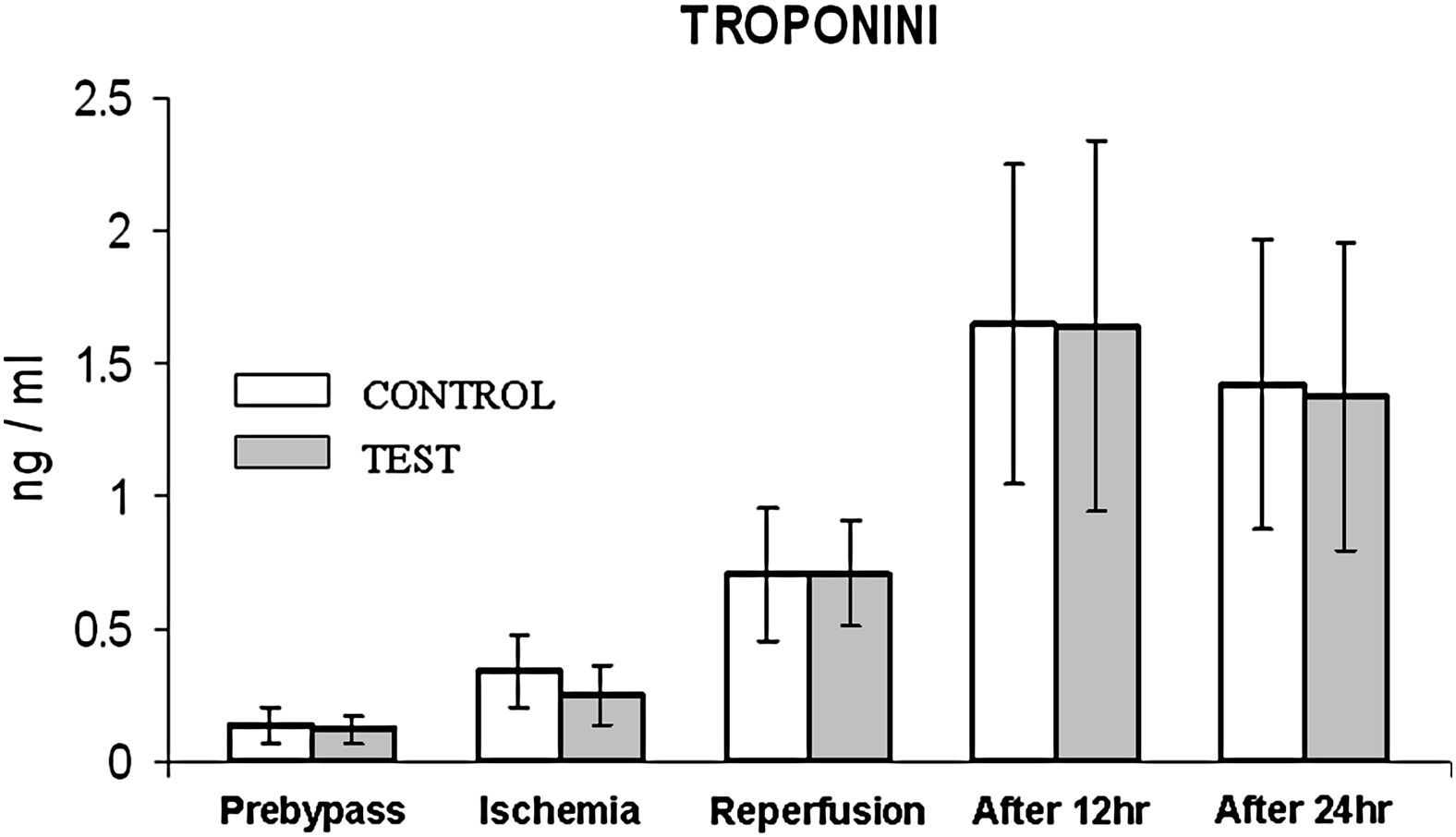
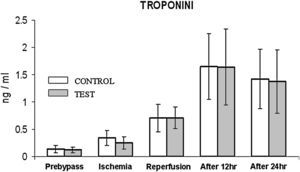
Durante la isquemia/reperfusión y a las 12 h de la cirugía (fig. 2), en ambos grupos se observó un aumento de la concentración de CTnI comparado con los valores basales. La concentración fue máxima a las 12 h del procedimiento, sin diferencias significativas entre grupos; y disminuyó durante las 24 h siguientes a la cirugía.
Cambios de la concentración de troponina I cardíaca. El grupo de control representa a los pacientes a quienes sólo se administró cardioplejía. El grupo de prueba representa a los pacientes a los que en la solución de cardioplejía se añadió N-acetilcisteína (NAC) (50 mg/kg de peso corporal). After 12 hr: después de 12 h; After 24 hr: después de 24 h; Ischemia: isquemia; TROPONINI: troponina I; Prebypass: pre-bypass; Reperfusion: reperfusión; test: prueba.
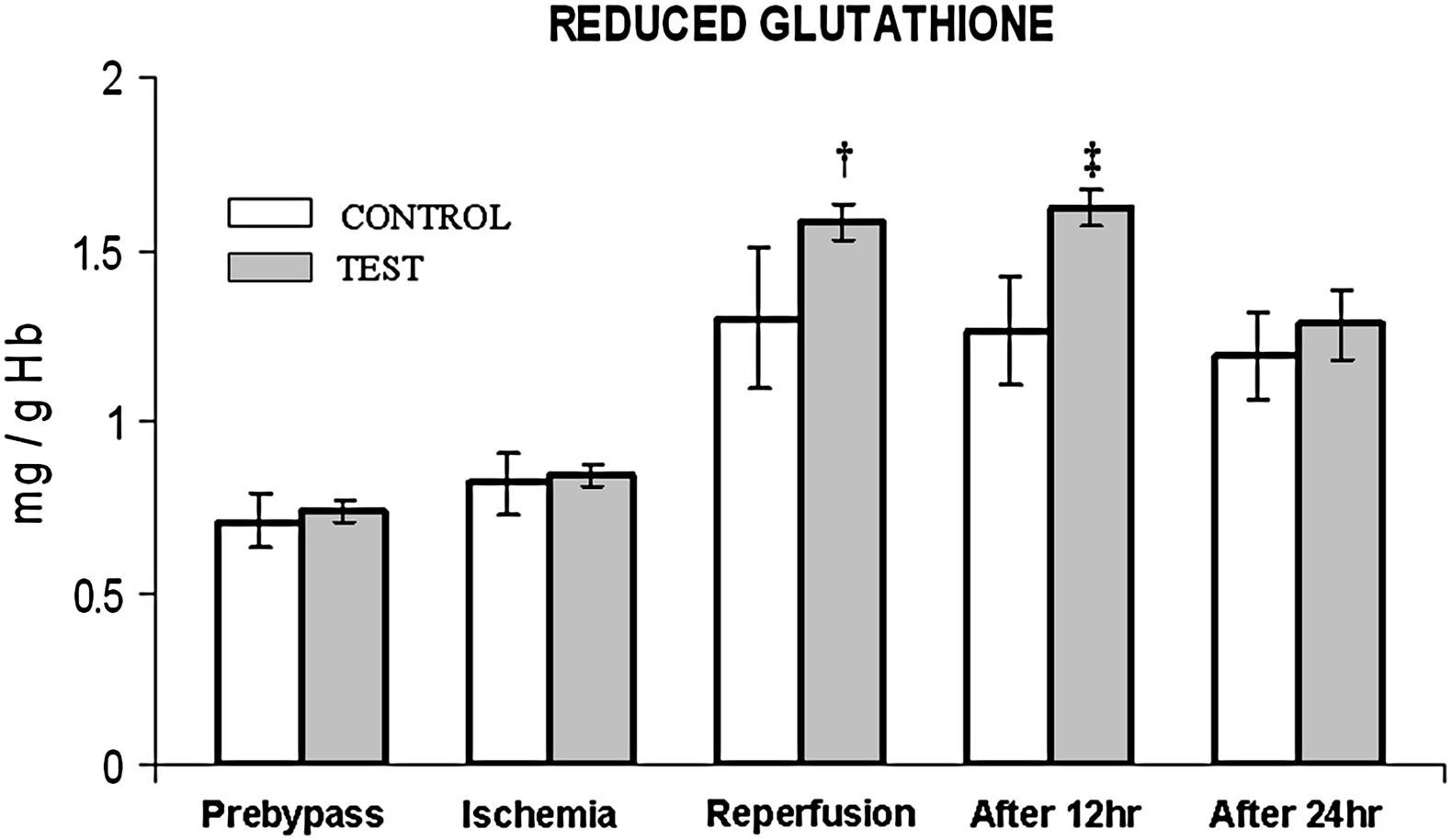
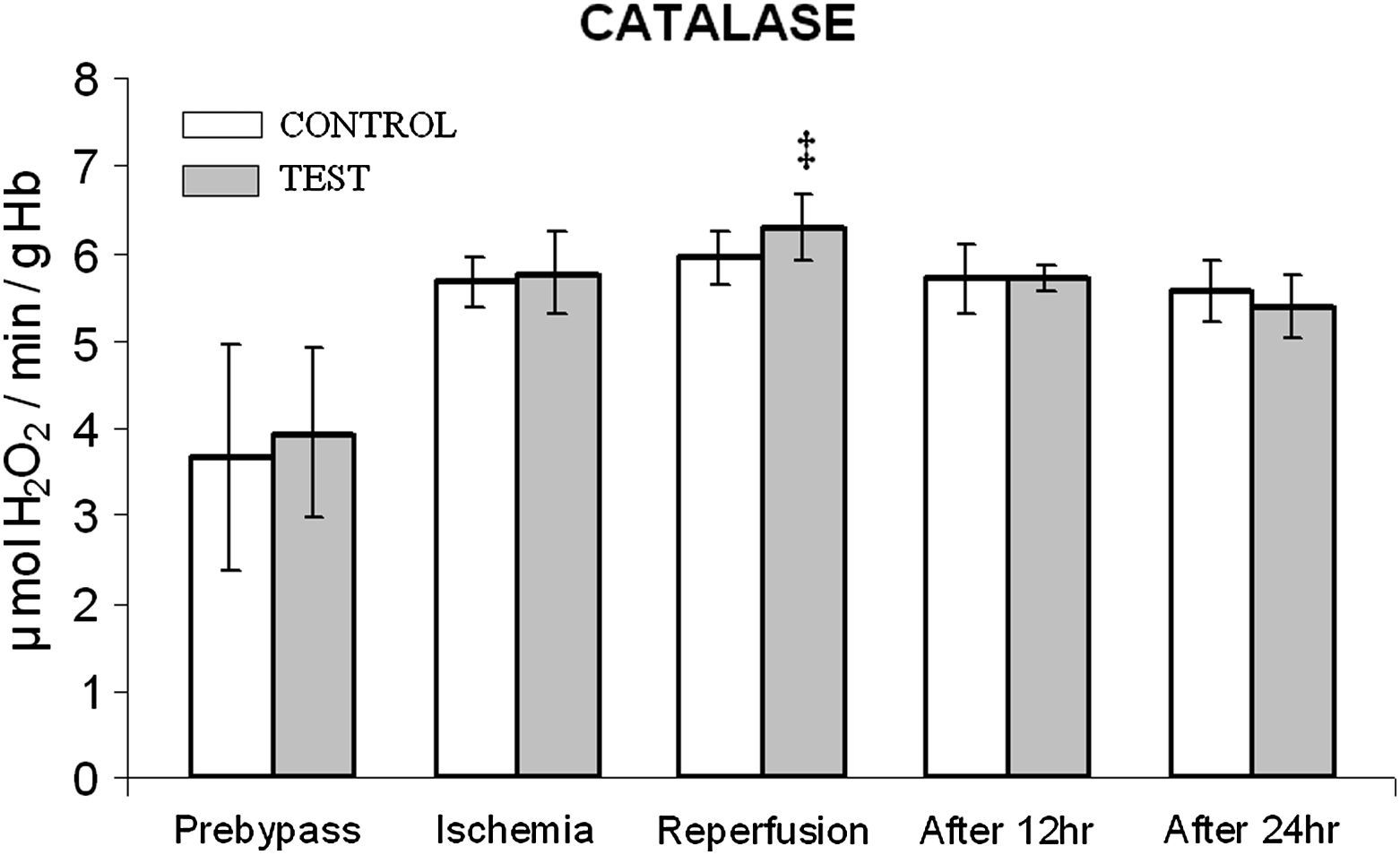
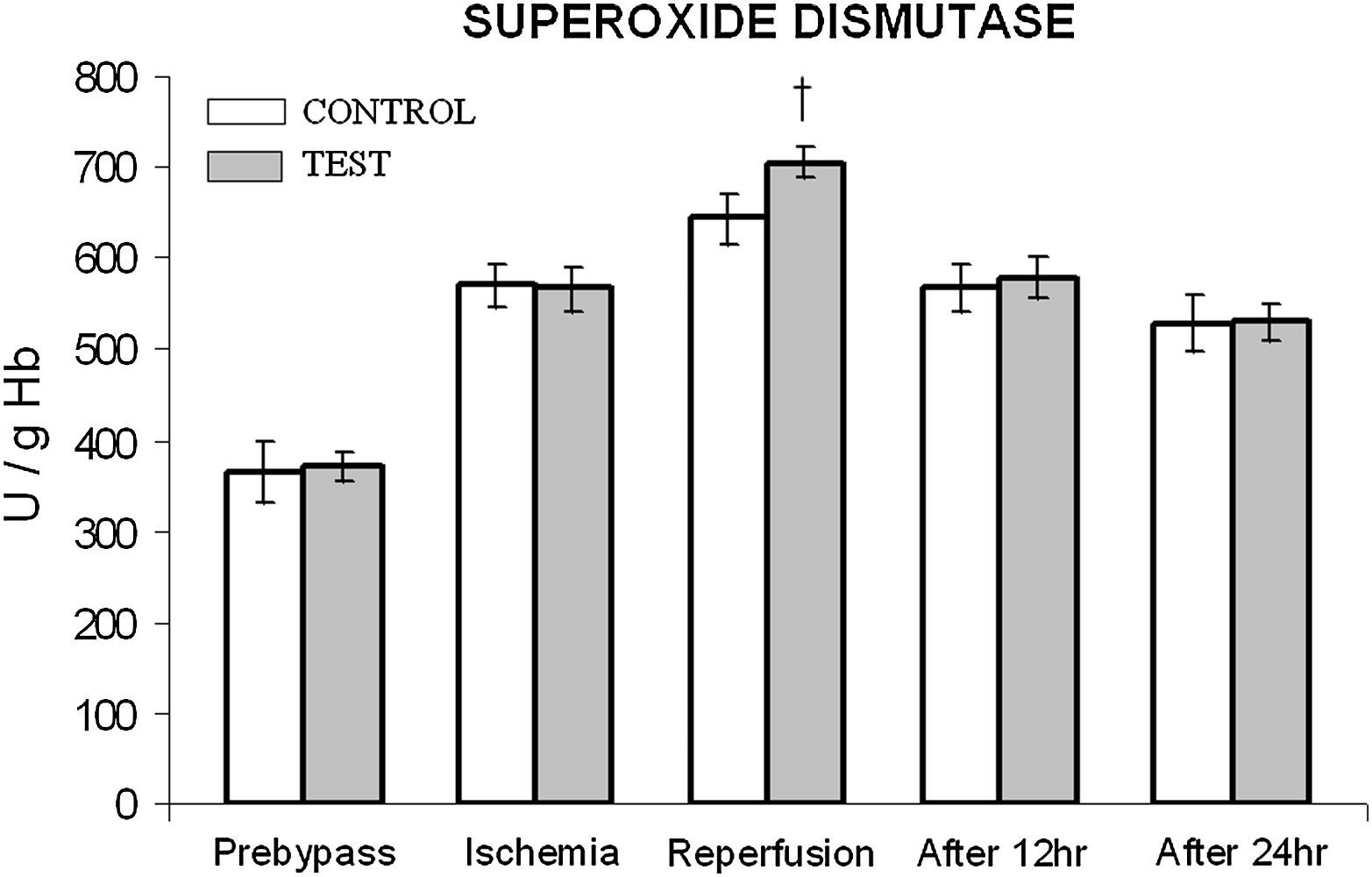
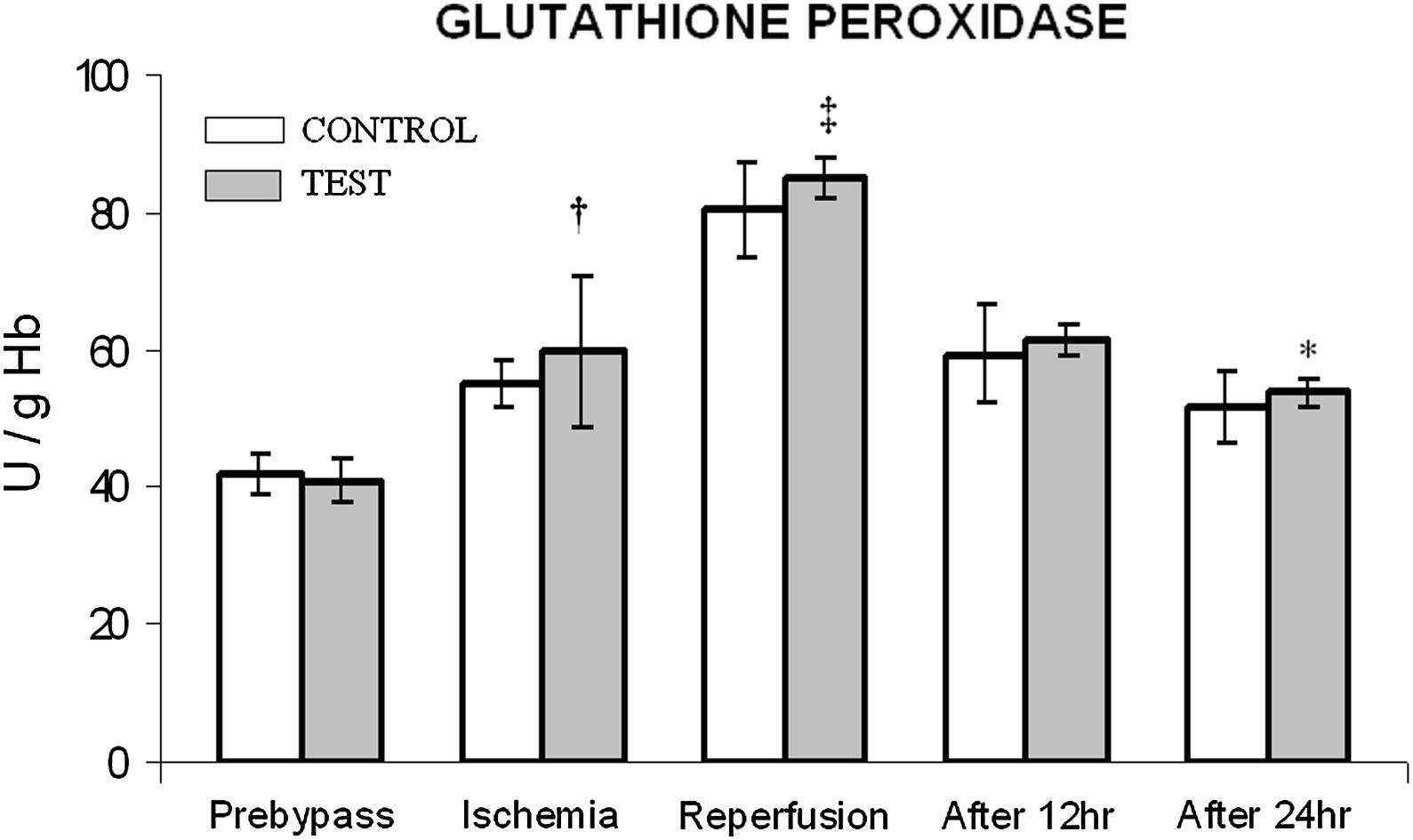
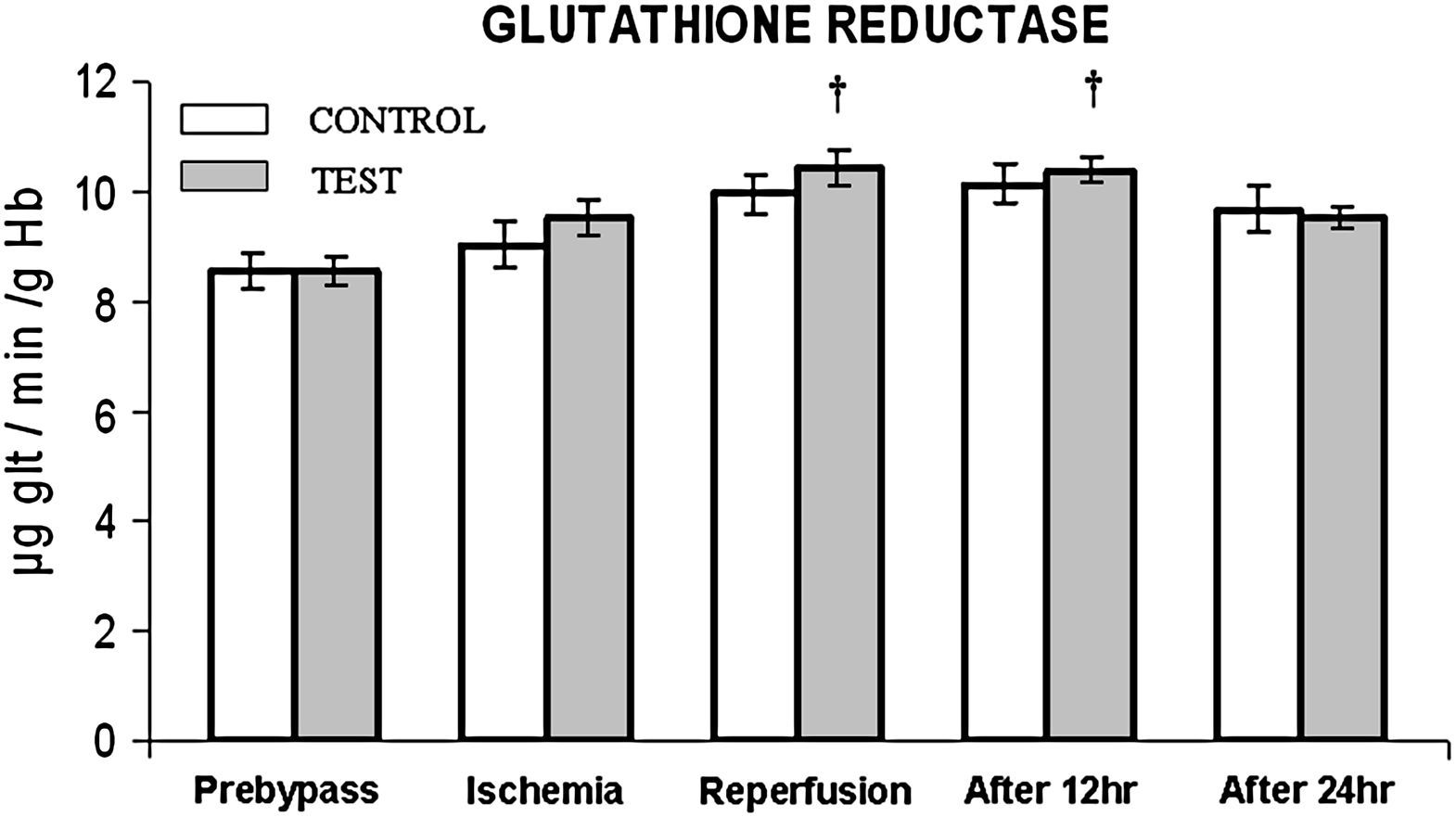
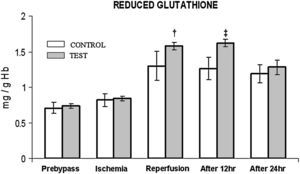
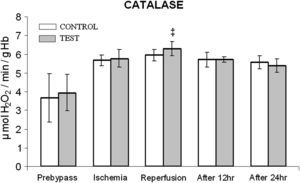
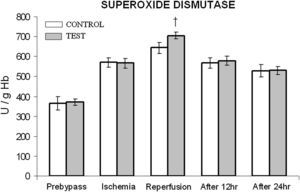
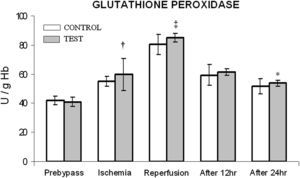
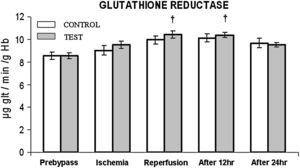
En ambos grupos, durante la reperfusión, comparado con los valores basales, se observó una actividad máxima de diversos antioxidantes, como glutatión reducido, catalasa, SOD, glutatión peroxidasa y glutatión reductasa (figs. 3 a 7). Cuando se compararon ambos grupos, en el grupo de prueba se detectaron valores más altos de todos los antioxidantes, lo que fue estadísticamente significativo (p < 0,01).
Cambios de la concentración de glutatión reducido. El grupo de control representa a los pacientes a quienes sólo se administró cardioplejía. El grupo de prueba representa a los pacientes a los que en la solución de la cardioplejía se añadió N-acetilcisteína (NAC) (50 mg/kg de peso corporal). †p < 0,001, ‡p < 0,01 en comparación con el grupo de control. After 12 hr: después de 12 h; After 24 hr: después de 24 h; Ischemia: isquemia; Prebypass: pre-bypass; REDUCED GLUTATHIONE: glutatión reducido; Reperfusion: reperfusión; TEST: prueba.
Cambios en la actividad de la catalasa. El grupo de control representa a los pacientes a quienes sólo se administró cardioplejía. El grupo de prueba representa a los pacientes a los que en la solución de cardioplejía se añadió N-acetilcisteína (NAC) (50 mg/kg de peso corporal). ‡p < 0,01 en comparación con el grupo de control. After 12 hr: después de 12 h; After 24 hr: después de 24 h; CATALASE: catalasa; Prebypass: pre-bypass; Ischemia: isquemia; Reperfusion: reperfusión; TEST: prueba.
Cambios en la actividad de superóxido dismutasa (SOD). El grupo de control representa a los pacientes a quienes sólo se administró cardioplejía. El grupo de prueba representa a los pacientes a los que en la solución de cardioplejía se añadió N-acetilcisteína (NAC) (50 mg/kg de peso corporal). †p < 0,001 en comparación con el grupo de control. After 12 hr: después de 12 h; After 24 hr: después de 24 h; Ischemia: isquemia; Prebypass: pre-bypass; Reperfusion: reperfusión; SUPEROXIDE DISMUTASE: superóxido dismutasa; TEST: prueba.
Cambios en la actividad de la glutatión peroxidasa. El grupo de control representa a los pacientes a quienes sólo se administró cardioplejía. El grupo de prueba representa a los pacientes a los que en la solución de cardioplejía se añadió N-acetilcisteína (NAC) (50 mg/kg de peso corporal). ∗p < 0,05, †p < 0,001, ‡p < 0,01 en comparación con el grupo de control. After 12 hr: después de 12 h; After 24 hr: después de 24 h; GLUTATHIONE PEROXIDASE: glutatión peroxidasa; Ischemia: isquemia; Prebypass: pre-bypass; Reperfusion: reperfusión; TEST: prueba.
Cambios en la actividad de la glutatión reductasa. El grupo de control representa a los pacientes a quienes sólo se administró cardioplejía. El grupo de prueba representa a los pacientes a los que en la solución de cardioplejía se añadió N-acetilcisteína (NAC) (50 mg/kg de peso corporal). †p < 0,001 en comparación con el grupo de control. After 12 hr: después de 12 h; After 24 hr: después de 24 h; GLUTATHIONE REDUCTASE: glutatión reductasa; Ischemia: isquemia; Prebypass: pre-bypass; Reperfusion: reperfusión; TEST: prueba.
Aunque la concentración de todos los antioxidantes disminuyó a las 12 y 24 h después de la intervención, comparado con los valores durante la reperfusión, fueron más altos que los valores basales.
Entre ambos grupos, durante períodos diferentes del de reperfusión no se detectaron diferencias significativas en la concentración de catalasa y SOD (figs. 4 y 5). En el grupo de prueba, durante la reperfusión y 12 h después de la cirugía, se observó un aumento estadísticamente significativo (p < 0,01) de la concentración de glutatión reducido.
DiscusiónLos resultados del presente estudio demuestran que la administración de NAC a pacientes sometidos CBC primaria con BCP da lugar a una mejora mínima del desenlace bioquímico y postoperatorio durante y después de la cirugía cardíaca. En el presente estudio se han dilucidado claramente los cambios de la concentración de diversos antioxidantes durante y después de la cirugía. Durante décadas, se ha estudiado el papel de la isquemia y la reperfusión posterior en el curso de la CBC. En diversos experimentos se ha documentado la formación de ROS durante la reperfusión después de cardioplejía, según lo demostrado por la determinación directa de radicales libres que dan lugar a la alteración de la estructura y función de la célula20. El estrés oxidativo se desarrolla debido a un desequilibrio en la concentración de antioxidantes y radicales libres. Los antioxidantes tanto endógenos como exógenos mejoran el grado de la lesión del miocardio provocada por los radicales libres. Por lo tanto, durante los procedimientos quirúrgicos, son de uso difundido los antioxidantes como parte de la intervención clínica. En el presente estudio se administró NAC como un antioxidante que también produce una repleción de los depósitos intracelulares de glutatión reducido.
En el presente estudio el aumento de la concentración de MDA durante los diversos períodos de tiempo después del procedimiento respalda claramente la hipótesis del estrés oxidativo en los eritrocitos tal como se ha descrito previamente21,22. La adición de NAC junto con la cardioplejía produce un profundo efecto disminuyendo significativamente el MDA durante la reperfusión y el período postoperatorio. Los hallazgos del presente estudio coinciden con los resultados de los estudios previos11,12,23. Menasche et al24 pusieron de relieve un aumento de la reserva de tiol reducido por la NAC, que se tradujo en una mejora del restablecimiento después de la isquemia, debido supuestamente a la mayor capacidad del miocardio reperfundido para afrontar el aumento brusco de la producción de radicales libres después de la isquemia. Aunque la NAC actúa principalmente eliminando los radicales hidroxilo y el ácido hipocloroso, también reacciona lentamente con el peróxido de hidrógeno y el superóxido25. Por lo tanto, los resultados del presente estudio confirman que, durante el BCP, se generan radicales libres que difunden a los eritrocitos.
Aunque, en el corazón isquémico, se ha observado una depleción de antioxidantes con la reperfusión, los estudios también han documentado un aumento de su concentración21,26. Por lo tanto, el presente estudio coincide con estos últimos hallazgos, que definen claramente el mecanismo protector natural del organismo para combatir los efectos lesivos de los oxidantes. En el grupo de prueba, durante la reperfusión, el aumento significativo de la concentración de antioxidantes refuerza el papel de la NAC en su preservación, lo que ejemplifica la posibilidad de que todos actúen de manera concertada ejerciendo un papel protector frente a la agresión oxidativa. Así mismo, está claro que los eritrocitos están influidos por el estrés oxidativo del miocardio y esta situación es más destacada, en particular, en el período de reperfusión.
En diversos estudios se ha descrito que la producción de superóxido y peróxido de hidrógeno empieza poco después del inicio de la isquemia miocárdica y cesa con la reperfusión ulterior. Ésta podría ser la razón de la disminución postoperatoria de la concentración de SOD y catalasa en ambos grupos. Así mismo, en el miocardio también se ha descrito una disminución de la actividad de la catalasa. Durante la reperfusión, en el grupo tratado con NAC, el aumento significativo de SOD y catalasa podría deberse al aumento de la concentración génica a través de una cascada de transducción de señales mediada por los productos de la oxidación de aquella molécula27. El estudio efectuado por Jablonska et al28 respalda parcialmente las observaciones del presente estudio con respecto a la actividad de estas dos enzimas. Aunque, en modelos animales se ha descrito un papel protector de la SOD y la catalasa en combinación en la mejora del estrés oxidativo, en seres humanos esto mismo parece ser motivo de controversia. Por lo tanto, estas dos enzimas podrían desempeñar un papel secundario en la reducción de la lesión de isquemia-reperfusión sólo después del sistema glutatión.
Al igual que en el mencionado anteriormente, en el presente estudio se demuestra que, durante la reperfusión, tiene lugar un aumento del nivel de glutatión reducido junto con un aumento concomitante de la actividad de la glutatión peroxidasa y la glutatión reductasa. En un número cada vez mayor de investigaciones se ha demostrado la importancia de la primera en la protección del miocardio frente a la lesión de isquemia-reperfusión21,26,29. En el presente estudio, el aumento de la concentración de este sistema enzimático en el grupo de prueba es una novedad y se asoció con una reducción significativa de la estancia en la UCI y la estancia hospitalaria total, junto con una mejora de la fracción de eyección. Consideramos que esta correlación es fundada debido a dos razones. Principalmente, en los estudios que usaron inhibidores de la glutatión peroxidasa, como el ácido málico y el dietiléster, se demostró una menor reducción del restablecimiento de la disfunción contráctil30; secundariamente, la NAC por sí misma puede aumentar la eficiencia de la glutatión reductasa9. Por lo tanto, en el presente estudio, a través de estas observaciones, queda claro el papel protector de este compuesto en la reducción del estrés oxidativo.
La CTnI se usa como biomarcador para el diagnóstico de la necrosis de pequeñas áreas miocárdicas en el perioperatorio. Los cambios de su concentración pueden detectar una lesión del tejido miocárdico, ya que es una enzima muy sensible y específica de ésta31. La incapacidad de la NAC para reducir significativamente la lesión miocárdica postoperatoria según lo evidenciado a partir de la concentración de este biomarcador es la característica más destacada del presente estudio. Los resultados contrastan con los de Kormaz et al23, que describieron una disminución significativa de la lesión miocárdica demostrando una disminución de su concentración en pacientes a los que se administró NAC. Sin embargo, los resultados del presente estudio son paralelos a los descritos por Ismail et al32, que documentaron que la adición de NAC no redujo significativamente la lesión miocárdica por lo que respecta a los desenlaces tanto bioquímicos como clínicos. El presente estudio es el único que aborda la imposibilidad de este compuesto para reducir la lesión miocárdica inducida por CBC en función de las determinaciones de CTnI. Especulamos que el efecto observado podría deberse a la dosis más baja utilizada en el presente estudio, que podría ser insuficiente para reducir de forma óptima el estrés oxidativo.
El camino de los radicales libres y los antioxidantes que da lugar a una lesión de isquemia/reperfusión ha cambiado de paradigma. Los estudios sobre el mecanismo de precondicionamiento han demostrado claramente la acción de los buscadores de los radicales libres (como la NAC) en la abolición del efecto cardioprotector33. Las ERO participan en vías diferentes de transducción de señales, aunque siguen asociadas con el proceso patológico. Por lo tanto, a partir del presente estudio, es evidente que la preservación de los grupos tiol y el aumento de la actividad antioxidante sola no confieren una protección frente a la lesión de isquemia/reperfusión. Es preciso analizar extensamente los mecanismos implicados durante las intervenciones quirúrgicas con el objetivo de instituir una protección miocárdica con fármacos.
ConclusiónEn el presente estudio, la N-acetilcisteína redujo el estrés oxidativo inducido durante la cirugía de bypass coronario con bypass cardiopulmonar. Sin embargo, se ha observado la imposibilidad de reducir el grado de lesión miocárdica según lo evidenciado a partir de la concentración de CTnI, a pesar de la mejora de la fracción de eyección. Por lo tanto, en estos momentos es prematuro confirmar los efectos cardioprotectores de la NAC. Es necesario un estudio exhaustivo adicional sobre el papel beneficioso de los radicales libres en la protección y la adaptación miocárdica. En un ensayo a gran escala, multicéntrico y aleatorizado deben evaluarse dosis más altas de este fármaco en pacientes en alto riesgo.