A pesar de la existencia de numerosos resultados en la investigación sobre la disfunción endotelial arterial, sus efectos a nivel del endotelio venoso no están bien definidos. Las metaloproteinasas de matriz (MPMs) desempeñan un papel importante en el remodelado vascular. Las MPMs son endopeptidasas capaces de degradar las proteínas de la matriz extracelular. Evaluamos la hipótesis de que el inhibidor tisular de la metaloproteinasa-1 (ITMP-1) actúa como indicador de disfunción endotelial venosa aguda en un modelo murino de lesión oxidativa. Los grupos experimentales evaluados fueron los siguientes: ratas no sometidas a lesión oxidativa (controles), iluminación mediante rosa de Bengala pero no láser (simulación) e iluminación mediante rosa de Bengala y láser, provocando una lesión oxidativa. Los animales se evaluaron al inicio (control, simulación) y al cabo de 1h y 1 día tras la lesión oxidativa. Se determinó la expresión del ARNm mediante tecnología de matriz génica y reacción de polimerasa en cadena en tiempo real; las concentraciones de la proteína ITMP-1 en plasma y en la pared venosa se determinaron mediante ELISA, y se realizó la morfometría de la pared venosa (cél/5 HPF). La expresión del gen Bcl2l1 se reguló al alza al cabo de 1h y 1 día de la lesión. La proteína ITMP-1 y la expresión del ARNm aumentaron de forma significativa tras la lesión oxidativa. Una hora después de la lesión, se observó un número significativo de leucocitos polimorfonucleares en la pared venosa. Nuestros resultados apoyan la hipótesis de que el aumento de la expresión del ITMP-1 en el endotelio venoso y sus niveles plasmáticos pueden actuar como indicador temprano de disfunción endotelial.
Las arterias y las venas son dos componentes del sistema vascular con diferencias tanto estructurales como funcionales. Debido a dichas diferencias, su contractilidad inherente y sus propiedades sintéticas influyen en la función cardiovascular global1. El papel de la lesión oxidativa de las arterias ha sido ampliamente estudiado en lo que se refiere a la aterosclerosis. Sin embargo, apenas existe información sobre el papel de la lesión oxidativa en el endotelio venoso. El término ‘‘disfunción endotelial'’ se utiliza para identificar varios procesos patológicos que pueden provocar alteraciones en la coagulación, inflamación, alteraciones en el crecimiento vascular, y remodelado vascular2,3. Este proceso está asociado con la disminución del óxido nítrico y un aumento del estrés oxidativo en el lecho vascular tras su lesión4,5. Ciertos factores de riesgo, como la infección aguda y crónica o la reacción inmunitaria local, así como factores permanentes, como hipertensión arterial, diabetes, obesidad e hiperhomocisteinemia, pueden inducir la disfunción de las células endoteliales, facilitando que el factor tisular active la cascada de la coagulación6,7. Las metaloproteinasas de la matriz (MPMs) son endopeptidasas que degradan las proteínas de la matriz extracelular8. Los radicales libres y el consiguiente estrés oxidativo podrían afectar la actividad de las MPMs tanto de forma directa como indirecta9. Las MPMs han demostrado aumentar la disfunción endotelial en el lecho arterial ya que degradan los componentes de la matriz extracelular de la pared arterial10-12. Estudios anteriores han demostrado que la regulación al alza del inhibidor tisular de la metaloproteinasa-1 (ITMP-1) protege la integridad de la pared vascular frente a la actividad de las MPMs13-16.
En este estudio se desarrolló un modelo murino de lesión oxidativa en la vena cava inferior (VCI) para determinar los efectos de la disfunción endotelial aguda. La disfunción endotelial puede comportar un aumento de la incidencia de patología venosa. Nuestra hipótesis es que la expresión del ITMP-1 puede actuar como indicador satisfactorio de la disfunción endotelial venosa temprana en un modelo murino.
Materiales y métodosModelo animalOchenta y una ratas macho adultas Sprague-Dawley (peso corporal promedio: 262,3g) fueron sometidas a lesión fotoquímica en la VCI. Los animales fueron anestesiados con una mezcla inhalatoria de isoflurano (2%) y oxígeno (100%). Se realizó una laparotomía por la línea media exponiendo la VCI, justo por debajo del nivel de las venas renales. Para inducir la lesión oxidativa se administró rosa de Bengala (50mg/kg) por vía intravenosa en la vena de la cola, seguido de la exposición directa de la VCI (segmento de 3mm de diámetro por debajo de las venas renales) a láser de luz verde (540nm; Melles Groit Laser Group, Carlsbad, CA) durante 10min17. El rosa de Bengala se acumula en la bicapa lipídica de las células endoteliales. La exposición de rosa de Bengala a la luz láser desencadena una reacción fotoquímica que produce “single” oxígeno, lo que favorece la formación de otros radicales libres que lesionan el endotelio vascular. Se evaluaron los siguientes grupos experimentales: 1) las ratas no sometidas a lesión oxidativa (laparotomía, sin rosa de Bengala ni láser) actuaron como controles, 2) los animales sometidos a laparotomía y tratados con rosa de Bengala pero sin láser actuaron como simulación, y 3) las ratas sometidas a laparotomía y tratadas con rosa de Bengala y láser desarrollaron una lesión oxidativa. Todos los animales se sacrificaron al final del estudio para ser sometidos a diferentes análisis. Los grupos experimentales se evaluaron en el momento inicial (controles n=6, simulación n=6), al cabo de 1h (n=6), y 1 día (n=6) tras la lesión oxidativa. En cada grupo experimental se utilizaron 3 subgrupos de animales (6 animales por subgrupo) para evaluar el ARNm del gen Bcl2l1 mediante matriz génica y reacción en cadena de la polimerasa (PCR) cuantitativa y a tiempo real, ARNm del ITMP-1 mediante PCR a tiempo real, ITMP-1 en plasma y pared venosa mediante ensayo inmunoabsorbente ligado a enzimas (ELISA), y células inflamatorias/histología de la pared venosa.
Matriz génicaSe utilizó tecnología de matriz génica para determinar la expresión del gen Bcl2l1 (GenBank Lumber NM_031535, con respuesta al estrés oxidativo, regulador de la apoptosis) en la pared venosa tras la lesión oxidativa (Oligo GEArray® Rat Endothelial Cell Biology Microarray; SuperArray Bioscience, Frederick, MD). Se realizó la comparación de las diferentes expresiones génicas en muestras agrupadas entre los grupos control y experimentales. Se aisló el ARN mediante el método TRIzol® según las instrucciones del fabricante (SuperArray Bioscience). El ARN se convirtió después enzimáticamente en un ARNc diana biotinilado mediante un kit TrueLabeling-AMP 2.0 (SuperArray Bioscience) en un ciclador térmico estándar Perkin-Elmer (Waltham, MA) 2400. La membrana se prehibridó y luego se hibridó con la sonda diana marcada con ARNc (60°C durante toda la noche) en un horno de hibridación estándar. Las muestras se prepararon y se procesaron según las instrucciones del fabricante. Los resultados se analizaron con el software del fabricante (GEArray Expression Analysis Suite Software, SuperArray Bioscience). El análisis se basó en la comparación del gen doméstico (aldolasa), cuya expresión se mantuvo de forma constante (intensidad de mancha) en todas las membranas génicas. La expresión duplicada o más que duplicada del gen Bcl2l1 se analizó posteriormente mediante PCR en tiempo real.
Análisis PCR a tiempo real de la pared venosaSe utilizó la PCR en tiempo real para cuantificar el ITMP-1 y la expresión del gen Bcl2l1. Se realizó la transcripción inversa de 1 microgramo de ARN total según el protocolo del fabricante utilizando cebadores Oligo (dT) y M-MLV (Invitrogen, Carlsbad, CA). Se utilizó 1 microlitro de una dilución 1:5 del ARN transcrito de forma inversa como plantilla en una PCR de 25ml. Se encargaron los siguientes cebadores a Integrated DNA Technologies (Coralville, IA): SABiosciences RT2qPCR primers Timp1 rat (adquisición NM_053819, ancho de banda 156bp) y Bcl2l1 rat (adquisición NM_031535.2, ancho de banda 183bp).
La expresión del ARNm de Bcl2l1 se evaluó en muestras de pared venosa obtenidas de 3 animales de cada uno de los 3 grupos (control, 1h, 1 día) para confirmar la lesión oxidativa del endotelio venoso.
El análisis se basó en la comparación frente a un gen doméstico (actina beta o aldolasa). La duplicación o el aumento de la expresión se determinó utilizando la ecuación ΔCT: ΔCT=gen doméstico CT – gen de interés CT (diferencia de los valores CT). Expresión relativa=2ΔCT.
Determinación de la proteína ITMP-1Se utilizó un kit de ELISA para ITMP-1 murino a fin de determinar la concentración de ITMP-1 en el plasma y el tejido de la pared venosa de las ratas en el momento de la eutanasia. Los reactivos y las muestras se prepararon según las instrucciones del fabricante (Quantikine, Rat ITMP-1 Immunoassay RTM100; R&D Systems, Mineápolis, MN). Se añadieron 50 microlitros de diluyente de prueba al centro de cada pocillo. Se añadieron 50 microlitros del estándar, control, o la muestra al centro de cada pocillo. Se leyó la densidad óptica de la solución final de cada pocillo a 450nm. La sensibilidad de la prueba se estableció en 75pg/ml. La expresión proteica se normalizó hasta la proteína total determinada utilizando un ensayo colorimétrico BCA (Pierce, Rockford, IL).
Análisis de la pared venosaLas venas se examinaron al microscopio óptico a gran aumento con aceite de inmersión (x100). Los cortes tisulares (3mm) se incluyeron en parafina y se tiñeron con hematoxilina y eosina (H&E). Se examinaron 5 campos a gran aumento representativos (HPF, aceite de inmersión x1.000) alrededor de la pared venosa y se realizó el recuento de las poblaciones de células inflamatorias de la forma descrita anteriormente18.
Métodos estadísticos y uso de los animalesEl análisis estadístico incluyó la media ± error estándar de la media (EEM) y un test t de Student de datos no aparejados para datos paramétricos (SPSS Sigma Stat 2.0; Aspire Software International, Leesburg, VA). Las comparaciones de los niveles de transcripción de cada uno de los 3 grupos (control, 1h, 1 día) se realizaron utilizando el test de comparación de Kruskal-Wallis. La significancia se estableció en p≤0,05. Todos los animales fueron mantenidos por la “Unit for Laboratory Animal Medicine” y estaban libres de patógenos. El protocolo de investigación fue autorizado por el Committee on Use and Care of Animals de la Universidad de Míchigan.
ResultadosBcl2 y estrés oxidativoLa familia Bcl2 está formada por miembros pro y antiapoptósicos19. Esta proteína está localizada en la mitocondria, una zona intracelular primaria para la generación de especies reactivas de oxígeno (ERO). Se ha observado que Bcl2 protege frente a la muerte celular inducida por los agentes oxidantes de forma similar a los antioxidantes20.
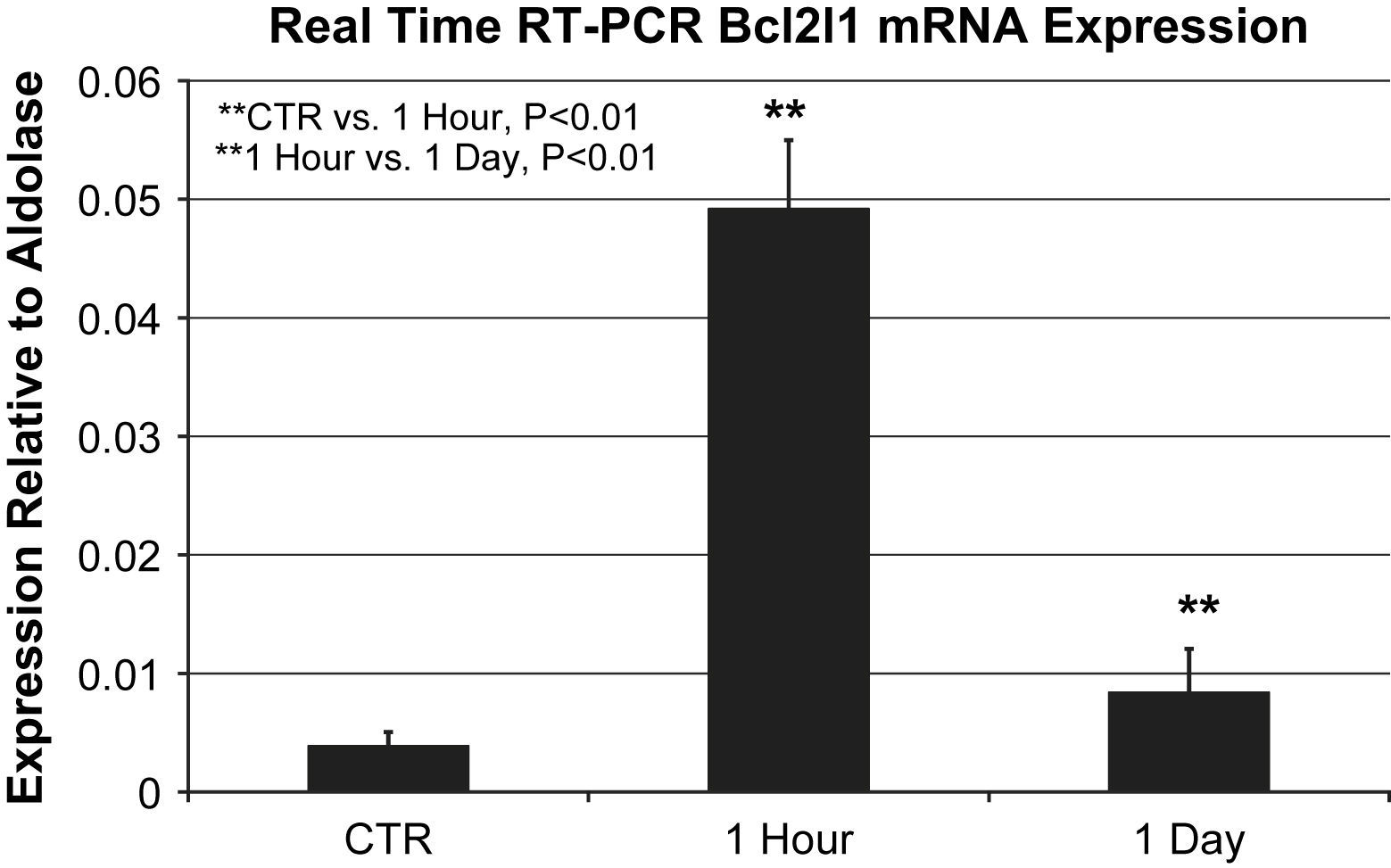
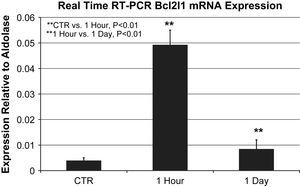
La expresión del gen Bcl2l1 (cambio múltiplo) aumentó 37 veces al cabo de 1h y 61 veces al cabo de 1 día en comparación con los controles. La expresión del ARm de Bcl2l1, un indicador de la lesión oxidativa, mostró diferencias significativas entre grupos como lo determina la PCR en tiempo real (expresión relativa a la aldolasa, análisis de varianza de Kruskal-Wallis, p=0,001).
La comparación directa mostró que la expresión del ARNm de Bcl2l1 aumentó significativamente 1h después de la lesión oxidativa en comparación con los controles (0,049±0,006 frente a 0,0039±0,001 en relación con la expresión de la aldolasa, p=0,002). La expresión del ARNm de Bcl2l1 después de 1h aumentó de forma significativa en comparación con 1 día después (0,049±0,006 frente a 0,0084±0,004 en relación con la expresión de la aldolasa, p=0,004) (fig. 1).
Expresión del ARNm de Bcl2l1 mediante PCR a tiempo real en relación con la aldolasa (n=3 animales/grupo). La expresión del ARNm de Bcl2l1 en el grupo de 1h aumentó significativamente en comparación directa con el control (0,049±0,006 frente a 0,0039±0,001 en relación con la expresión de la aldolasa, p=0,002) y en el grupo 1 día (0,049±0,006 frente a 0,0084±0,004 en relación con la expresión de la aldolasa, p=0,004). ∗∗1 Hour vs. 1 Day, P<0.01: ∗∗1 hora vs. 1 día, p<0,01; ∗∗CTR vs. 1 Hour, P<0.01: control vs. 1 hora, p<0,01; 1 Day: 1 día; 1 Hour: 1 hora; CTR: control; Expression Relative to Aldolase: expresión en relación con la aldolasa; Real Time RT-PCR BcI2I1 Mrna Expression: expresión del ARNm de Bcl2l1 mediante PCR a tiempo real.
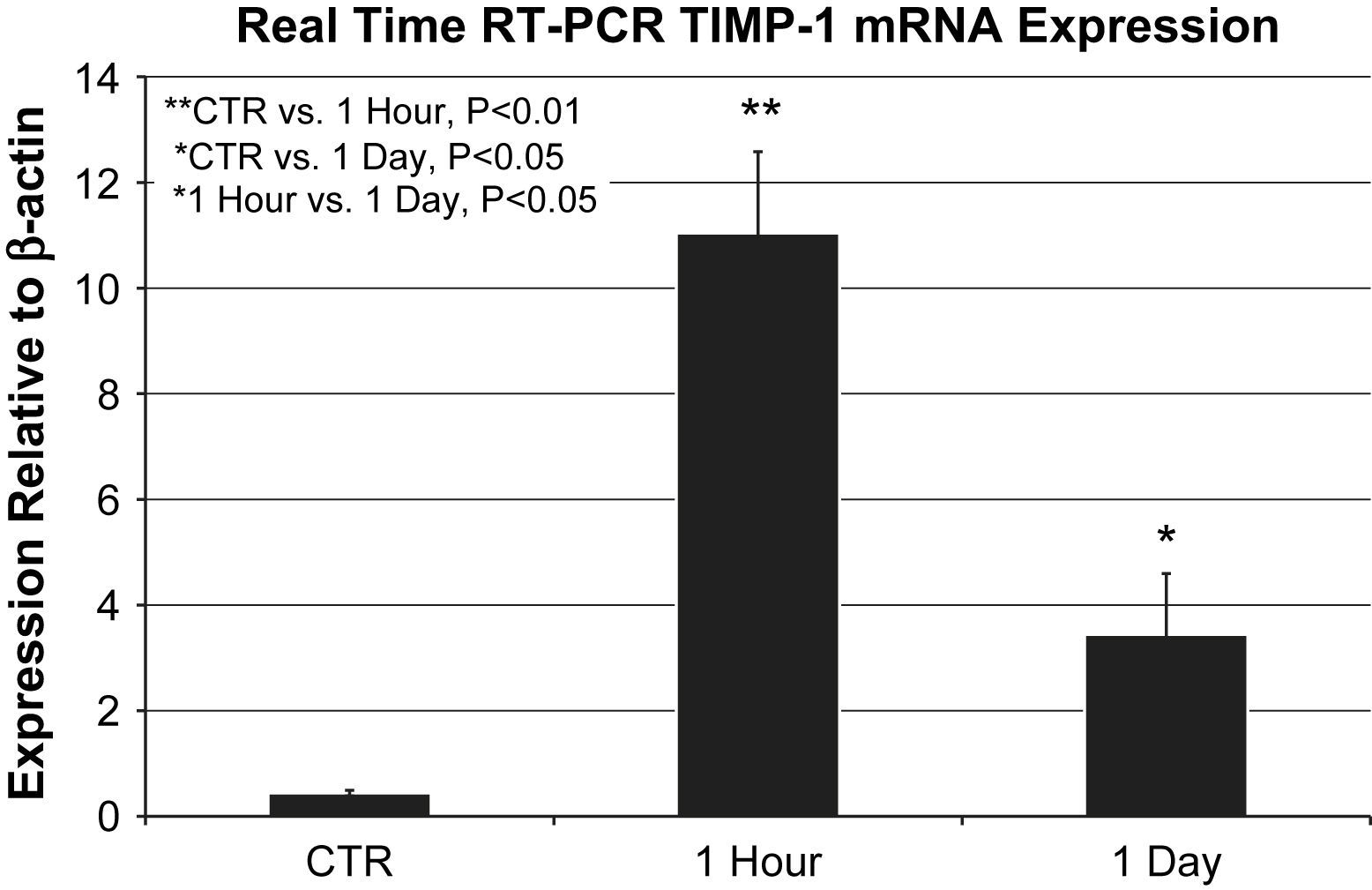
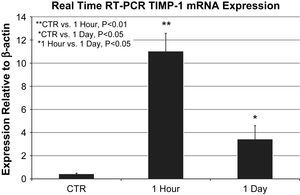
Las muestras de ARNm de cada grupo (n=6 agrupadas por grupo) se analizaron por triplicado. La expresión del ARNm de ITMP-1 aumentó tanto al cabo de 1h (11,8±1,5 frente a 0,4±0.05 en relación con la expresión de la actina beta, p=0,002) como al cabo de 1 día (3,4±1,1 frente a 0,4±0,05 en relación con la expresión de la actina beta, p=0,04) en comparación con los controles; ambos aumentos fueron significativos. La expresión del ARNm de ITMP-1 al cabo de 1h aumentó de forma significativa frente al aumento al cabo de 1 día (11,8±1,5 frente a 3,4±1,1 en relación con la expresión de la actina beta, p=0,039) (fig. 2).
Expresión del ARNm del ITMP-1 mediante PCR a tiempo real en relación con la actina beta (n=6 animales agrupados/grupo realizado por triplicado). La expresión del ARNm del ITMP-1 al cabo de 1h (11,8±1,5 frente a 0,4±0.05 en relación con la expresión de la actina beta, p=0,002) y 1 día (3,4±1,1 frente a 0,4±0,05 en relación con la expresión de la actina beta, p=0,04) estuvo aumentada de forma significativa en comparación con los controles. La comparación directa entre los grupos 1h y 1 día también mostró una expresión significativa del ARNm del ITMP-1 (p=0,039). ∗1 Hour vs. 1 Day, P<0.05: ∗1 hora vs. 1 día, p<0,05; ∗CTR vs. 1 Day, P<0.05: ∗control vs. 1 día, p<0,05; ∗∗CTR vs. 1 Hour, P<0.01: ∗∗control vs. 1 hora, p<0,01; 1 Day: 1 día; 1 Hour: 1 hora; CTR: control; Expression Relative to β-actin: expresión en relación con la actina beta; Real Time RT-PCR TIMP-1 Mrna Expression: expresión del ARNm del ITMP-1 mediante PCR a tiempo real.
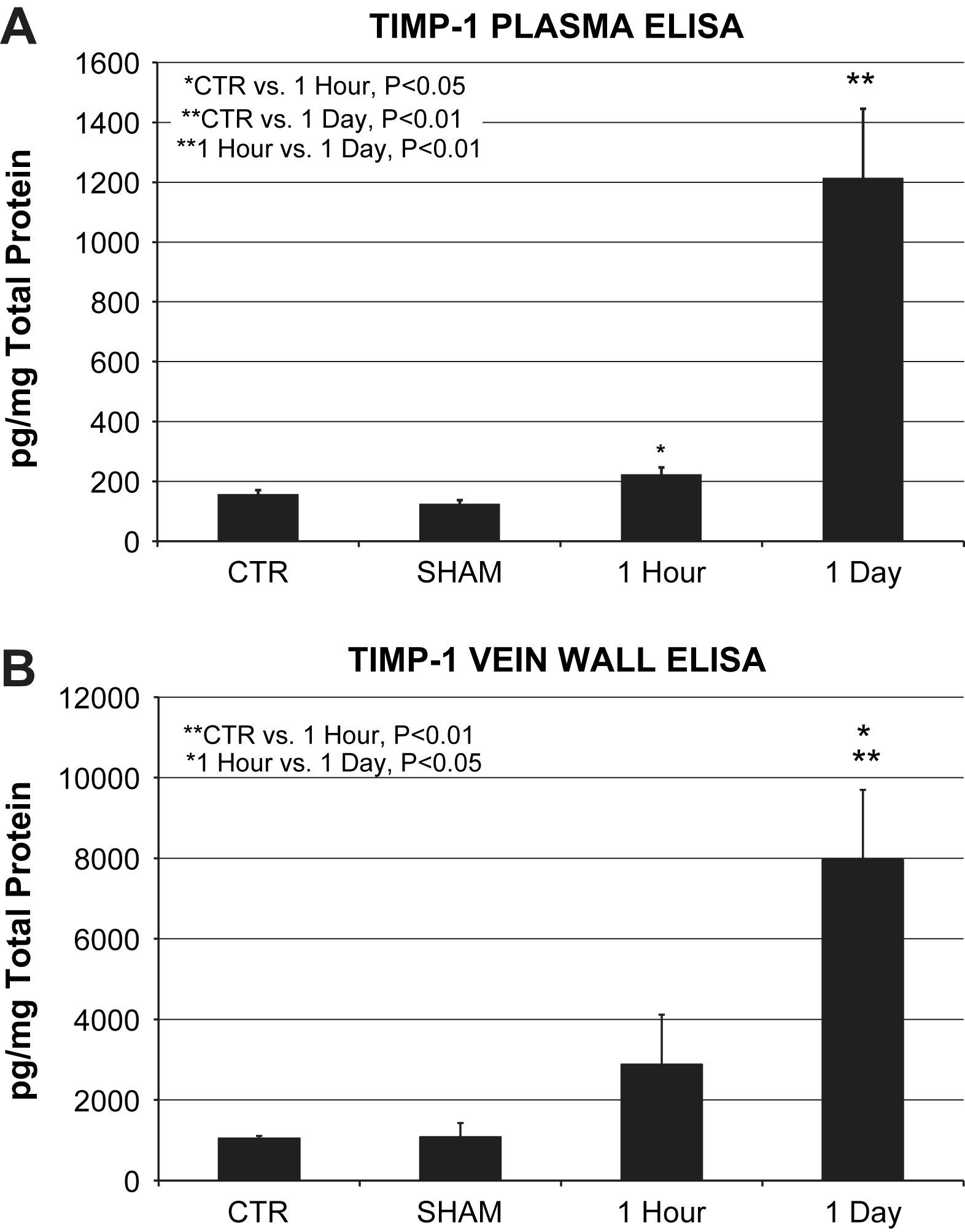
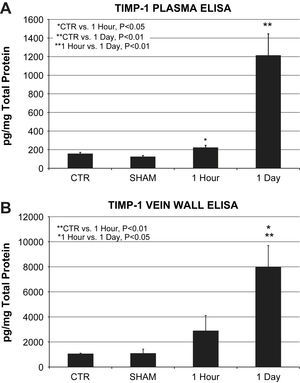
Las muestras plasmáticas mostraron un aumento significativo de las concentraciones de la proteína ITMP-1 al cabo de 1h (224±22 frente a 158±13pg/mg de proteína total, p=0,027) y al cabo de 1 día (1.214±231 frente a 158±13pg/mg de proteína total, p=0,002) de la lesión oxidativa en comparación con los controles. Las concentraciones plasmáticas de la proteína ITMP-1 al cabo de 1 día fueron significativamente más altas que al cabo de 1h (1.214±231 frente a 224±22pg/mg de proteína total, p=0,022) (fig. 3A).
A Determinación de la proteína plasmática ITMP-1 (n=6 animales/grupo). Las concentraciones de la proteína plasmática ITMP-1 al cabo de 1h (224±22 frente a 158±13pg/mg de proteína total, p=0,05) y al cabo de 1 día (1.214±231 frente a 158±13pg/mg de proteína total, p=0,01) tras la lesión oxidativa se elevaron de forma significativa en comparación con los controles. La comparación directa entre los grupos 1 día y 1h también mostró una concentración significativa de proteína plasmática ITMP-1 (p=0,01). B Determinación de la proteína ITMP-1 en la pared venosa (n=6 animales/grupo). Las concentraciones de proteína estuvieron significativamente elevadas en los homogenizados de pared venosa al cabo de 1 día en comparación directa con el control (7.955±1.746 frente a 1.045±66pg/mg de proteína total, p=0,01) y al cabo de 1h (7.955±1.746 frente a 2.877±1.244pg/mg de proteína total, p=0,05). ∗1 Hour vs. 1 Day, P<0.05: ∗1 hora vs. 1 día, p<0,05; ∗CTR vs. 1 Hour, P<0.05: ∗control vs. 1 hora, p<0,05; ∗∗1 Hour vs. 1 Day, P<0.01: ∗∗1 hora vs. 1 día, p<0,01; ∗∗CTR vs. 1 Day, P<0.01: ∗∗control vs. 1 día, p<0,01; ∗∗CTR vs. 1 Hour, P<0.01: ∗∗control vs. 1 hora, p<0,01; 1 Day: 1 día; 1 Hour: 1 hora; CTR: control; pg/mg Total Protein: proteína total pg/mg; SHAM: simulación; TIMP-1 PLASMA ELISA: proteína plasmática ITMP-1 ELISA; TIMP-1 VEIN WALL ELISA: proteína ITMP-1 ELISA en la pared venosa.
Las concentraciones de la proteína ITMP-1 en la pared venosa siguieron el mismo patrón de aumento que el observado en las muestras de plasma. Las concentraciones de proteína el día 1 aumentaron significativamente en comparación con los controles (7.955±1.746 frente a 1.045±66pg/mg de proteína total, p=0,002) y aumentaron cuando se compararon directamente con el grupo de 1h (7.955±1.746 frente a 2.877±1.244pg/mg de proteína total, p=0,026) (fig. 3B).
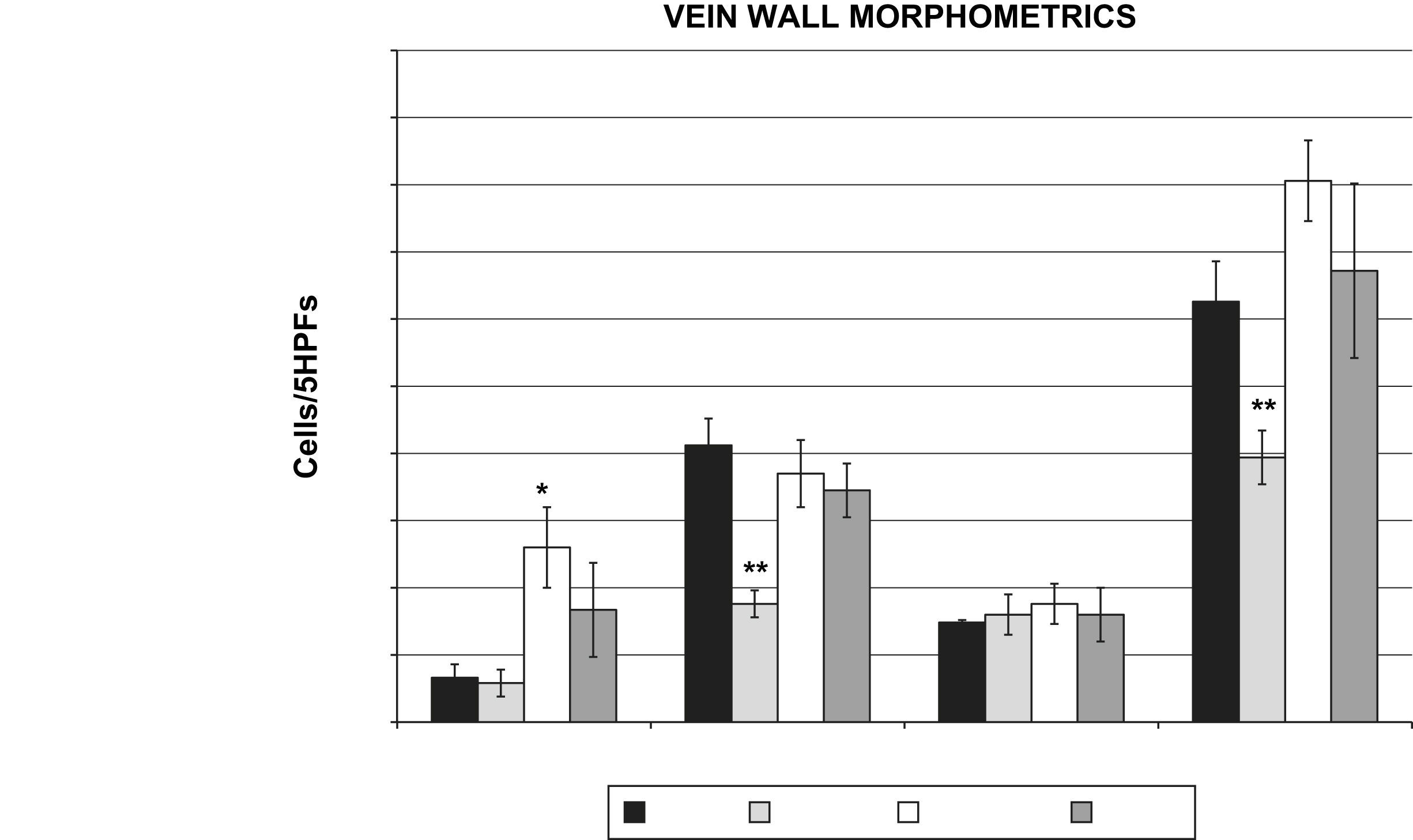
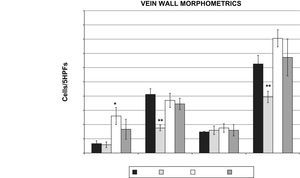
La lesión oxidativa aumenta la extravasación temprana de leucocitos a través de la pared venosaSe produjo un aumento significativo en los leucocitos polimorfonucleares (PMNN) en el grupo 1h post-láser en comparación con el grupo control (26±13,5 frente a 6,6±4,6 cél/5 HPF, p=0,016) (fig. 4). Se observaron reducciones significativas en los monocitos de la pared venosa (17,6±4,2 frente a 41,2±9,1 cél/5 HPF, p=0,001) y en las poblaciones totales de células inflamatorias (39,4±8,2 frente a 62,6±12,4 cél/5 HPF, p=0,008) en el grupo de simulación (lesión por rosa de Bengala pero sin láser) en comparación con los controles (fig. 4). Este resultado sugiere que el colorante rosa de Bengala por sí solo no estimula una respuesta inflamatoria sistémica.
Morfometría de la pared venosa (poblaciones de células inflamatorias evaluadas en los 5 HPF, n=6 animales/grupo). Los PMNN estuvieron aumentados de forma significativa en el grupo 1h en comparación con los controles (26±13,5 frente a 6,6±4,6 cél/5 HPF, p=0,05). Los monocitos de la pared venosa (17,6±4,2 frente a 41,2±9,1 cél/5 HPF, p=0,01) y las células inflamatorias totales (39,4±8,2 frente a 62,6±12,4 cél/5 HPF, p=0,01) disminuyeron de forma significativa en el grupo simulación frente a los controles. ∗CTR vs. 1hour PMN, P<0.05: ∗PMNN control vs. 1 hora, p<0,05; ∗∗CTR vs. SHAM MONO, TC P<0.01: ∗∗monocitos control vs. simulación, células inflamatorias totales p<0,01; 1 DAY: 1 día; 1 HOUR: 1 hora; Cells/5HPFs: cél/5 HPF; CTR: control; LYMPH: linfocitos; MONO: monocitos; PMN: leucocitos polimorfonucleares; SHAM: simulación; TC: células inflamatorias totales; VEIN WALL MORPHOMETRICS: morfometría de la pared venosa.
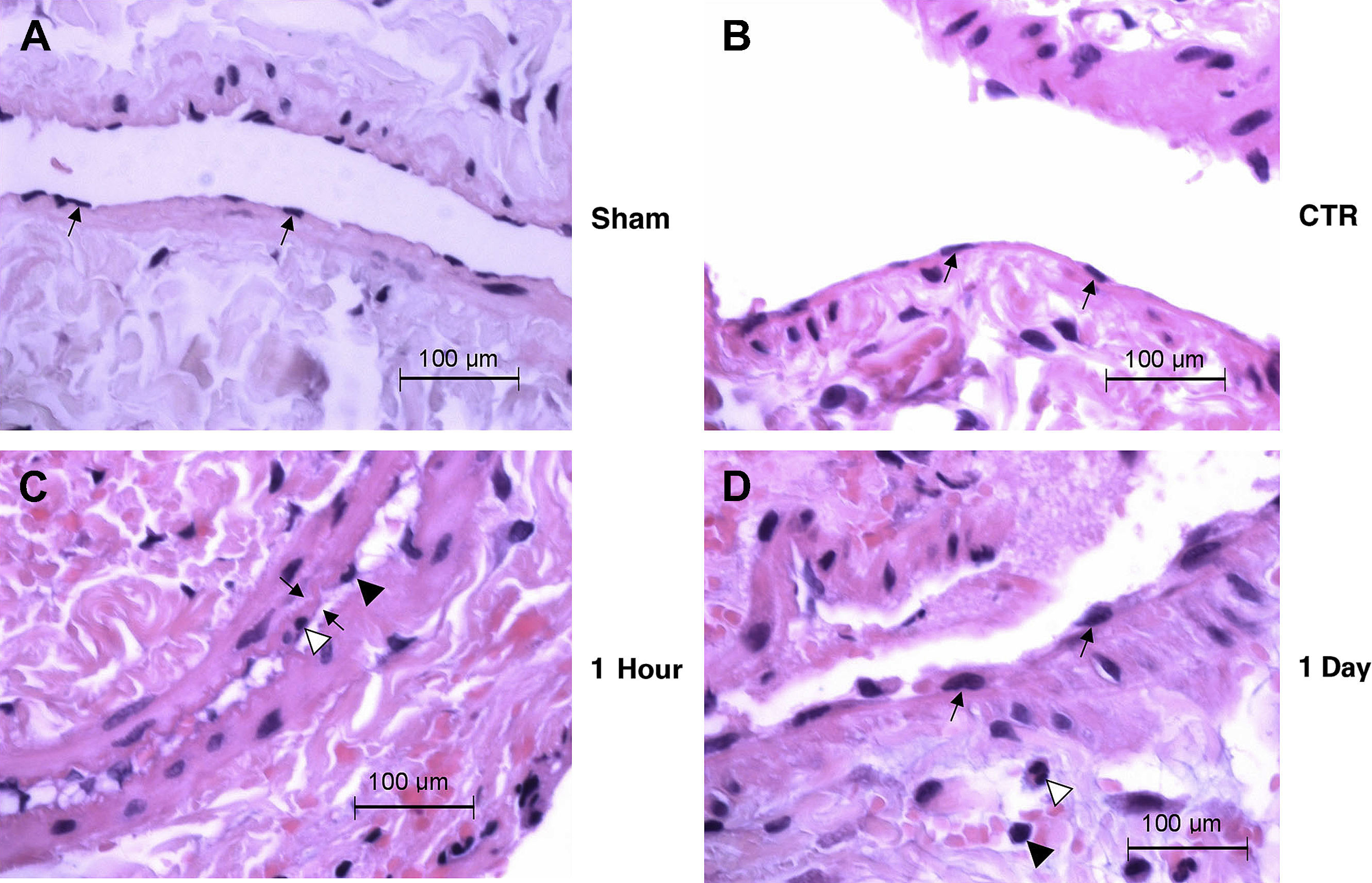
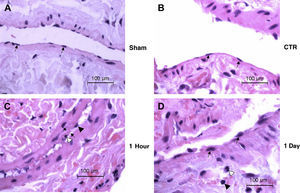
Los cortes histológicos de la pared venosa procedentes de animales seleccionados de cada grupo experimental fueron evaluados de forma ciega por un veterinario especializado en anatomía patológica. Las células y las capas de la íntima de los grupos control y simulación del endotelio venoso eran normales. En el grupo 1h, los núcleos de las células endoteliales aparecían redondeados, lo que con gran probabilidad se debió a la lesión; sin embargo, pudo haber sido debido al colapso de la pared venosa y la contracción de la VCI sobre sí misma. Hay que destacar que la capa íntima se veía engrosada de forma subjetiva y existían núcleos apoptósicos y un influjo de células inflamatorias, pero estos cambios no eran significativos. El grupo 1 día también presentaba núcleos de las células endoteliales redondeados y células inflamatorias perivasculares (fig. 5). En general, existían regiones (una porción de la circunferencia interna) en las que las células endoteliales eran redondas; esto se observó en el 20-40% de los HPF de una vena dada. Con frecuencia, las células endoteliales eran redondas cerca de las zonas con denudación endotelial en estos primeros momentos tras la lesión. Cabría esperar que en períodos de tiempo posteriores las células endoteliales mostrasen una morfología alargada cerca de las zonas de denudación o la reendotelialización de las zonas lesionadas.
Cortes histológicos de la pared venosa de animales seleccionados en cada grupo experimental (n=6 animales/grupo). Aumento original x100. (A) (Simulación) Vena normal con núcleos endoteliales separados regularmente (flechas) en una íntima muy delgada. (B) (Control) Morfología de la vena normal con núcleos endoteliales alargados (flechas) y una capa íntima delgada. (C) (1h) Redondeamiento de los núcleos endoteliales (punta de flecha negra) y una zona de engrosamiento de la íntima (flechas). En la zona del engrosamiento se observa el núcleo de una célula apoptósica (punta de flecha blanca). En la esquina inferior derecha de la imagen se aprecian linfocitos perivasculares diseminados y un neutrófilo. (D) (1 día) células endoteliales redondeadas (flechas) revistiendo el vaso y neutrófilos perivasculares diseminados (punta de flecha blanca) y linfocitos (punta de flecha negra). 1 Day; 1 día; 1 Hour: 1 hora; CTR: control; Sham: simulación.
El endotelio venoso desempeña un papel importante en el control de la expresión de numerosas moléculas pro y antiinflamatorias que regula la función vascular normal. Este estudio mostró que la lesión oxidativa focal en el endotelio venoso favorece la expresión génica de los indicadores de disfunción endotelial. El método de lesión fotoquímica aguda (1h, 1 día) utilizado en este estudio fue una modificación de otros métodos utilizados con anterioridad para iniciar una trombosis arterial y venosa en múltiples especies animales utilizando vasos de diferente tamaño21-27. La regulación al alza del gen Bcl2l1 al cabo de 1h y 1 día de la lesión confirma firmemente que este modelo indujo realmente una lesión oxidativa con la formación de ERO que, a su vez, activaron el gen Bcl2l1, un gen fundamental en los mecanismos de defensa celular al aumentar la resistencia celular a los oxidantes, así como la expresión de las defensas intracelulares frente a las ERO20.
Las MPMs han demostrado intervenir en el remodelado vascular y la consiguiente corrección de la matriz extracelular. El ITMP-1 se expresa de forma constitutiva a través de las células endoteliales y tiene varias funciones biológicas; es un inhibidor natural de las MPMs, que tienen la capacidad de degradar las proteínas de la matriz celular como colágenos, fibronectina, vitronectina, laminina, elastina y proteoglicanos28. Es posible que se identifiquen sustratos adicionales. El ITMP-1 también estimula la proliferación celular de múltiples tipos celulares29-31.
Las condiciones clínicas que afectan al sistema cardiovascular, como hipertensión arterial, hipercolesterolemia y diabetes, están implicadas en el aumento de la producción de ERO32-34. También se cree que muchos de los factores de riesgo mencionados que favorecen la aterosclerosis34 favorecen la inflamación y la disfunción de las células endoteliales en el lecho vascular venoso. Este aumento de las ERO inicia una respuesta inflamatoria sutil en el endotelio venoso, iniciando así la regulación al alza del ITMP-1 para modular la respuesta de la MPMs durante el proceso de remodelado vascular. Estudios que han utilizado genes murinos deficientes en ITMP-1 han mostrado un aumento del influjo de las células musculares lisas y un aumento de los cocientes íntima/media en comparación con los ratones de tipo silvestre tras una lesión en la pared vascular35,36. Por el contrario, la sobreexpresión de ITMP-1 en modelos murinos y leporinos de lesión arterial redujo tanto la hiperplasia de la neoíntima como el engrosamiento de la íntima, respectivamente35,37,38.
En estados patológicos, el remodelado vascular podría, hipotéticamente, alterar la distensibilidad de la pared venosa, lo que se asemejaría clínicamente a una insuficiencia venosa, y aumentaría el riesgo de trombosis. En este modelo murino de lesión oxidativa en el endotelio venoso, la presencia aguda de ERO pudo haber favorecido la expresión del ITMP-1 para inhibir los efectos perjudiciales de las MPMs en la matriz extracelular (no evaluado en este estudio). Son necesarios estudios adicionales para determinar los mecanismos exactos que regulan los efectos agudos y crónicos de la expresión del ITMP-1 en la pared venosa tras una lesión oxidativa. Los datos actuales sugieren que el ITMP-1 se activa en la vena cava tras la lesión oxidativa e interviene en el proceso de remodelado de la pared venosa en nuestro modelo murino. Este aumento constante de la expresión del ITMP-1 podría actuar como biomarcador útil de la respuesta inflamatoria asociada con la disfunción del endotelio venoso.
La inflamación aguda se caracteriza por una filtración vascular temprana y el reclutamiento masivo de neutrófilos que liberan mediadores proinflamatorios y ERO, provocando la lesión tisular39. El aumento significativo de los PMNN en el grupo 1h indica que la lesión oxidativa indujo la inflamación y, por tanto, una respuesta neutrofílica temprana. Un trabajo anterior en nuestro laboratorio documentó una respuesta inflamatoria aguda, y posteriormente crónica, con la extravasación temprana (día 2) de neutrófilos en la pared venosa seguido de una extravasación posterior (día 6) de monocitos en la pared venosa en modelos murinos de trombosis venosa inducida por estasis40-43. En este estudio, la lesión oxidativa en el endotelio venoso de las ratas inició una respuesta inflamatoria aguda con predominio de los neutrófilos en la zona de la lesión de la pared venosa. La tinción inmunohistoquímica (cortes de parafina) de la expresión del ITMP-1 (datos no mostrados) no fue concluyente debido a la elevada tinción del fondo. Sin embargo, el examen directo de estos cortes tisulares teñidos de todos los grupos experimentales por parte de un patólogo que desconocía el grupo al que pertenecían las muestras determinó que la expresión del ITMP-1 en este estudio no estuvo asociada de forma directa con la presencia de leucocitos.
Es interesante destacar que se produjo una reducción significativa de los monocitos de la pared venosa y del total de células inflamatorias en el grupo de simulación en comparación con los controles. El número de monocitos fue muy variable en todos los vasos examinados en este estudio. En este estudio, no se determinó el significado de la reducción de los monocitos en el grupo de simulación del rosa de Bengala. Además, no se considera que los monocitos sean parte importante en la respuesta aguda en el marco temporal que estaba siendo estudiado. No obstante, este hallazgo sugiere que el rosa de Bengala solo no estimula una respuesta inflamatoria y que fue necesaria la posterior exposición al láser para inducir la reacción fotoquímica y la lesión oxidativa en este estudio. La lesión endotelial parece ser un episodio inicial que se caracteriza por alteraciones en la forma, aumento de la permeabilidad, edema, hiperplasia de la íntima, necrosis y olcusión44. Las proteínas de la matriz intersticial endotelial se escinden durante la apoptosis45, lo que provoca el aspecto redondeado de las células normalmente planas, la retracción de las conexiones intercelulares y, en algunos casos, el desprendimiento de la membrana basal subyacente46. La evaluación histológica de las paredes venosas tanto de los grupos control como simulación reveló la presencia de células endoteliales y capas íntimas normales. Por el contrario, los grupos 1h y 1 día tras la lesión oxidativa mostraron cambios indicativos de lesión.
ConclusiónLos resultados de nuestro estudio sugieren que el aumento de la expresión de ITMP-1 puede ser un indicador preciso de disfunción aguda de las células endoteliales venosas en nuestro modelo murino de lesión oxidativa focal. Estos resultados indican que la lesión oxidativa afecta a una crucial en los mecanismos del remodelado vascular. La lesión oxidativa en la vena cava de las ratas de este estudio produjo una disfunción endotelial moderada, caracterizada por un aumento de la expresión del ARNm del ITMP-1 y la producción de la proteína. Están justificados estudios que ayuden a determinar la secuencia y mecanismos genéticos y celulares implicados en la lesión del endotelio venoso. Este estudio es el primero que demuestra que la lesión oxidativa centrada en el endotelio venoso facilita el aumento de la expresión del ITMP-1. Estos resultados indican que la regulación al alza del ITMP-1 puede actuar como indicador temprano de disfunción endotelial venosa y desempeñar un papel importante en pacientes con enfermedades vasculares.
Agradecemos la financiación de este proyecto al Dr. David Gordon y a la Diversity and Career Development Office, la Unit for Laboratory Animal Medicine, y a los Jobst Vascular Research Laboratories (a D. D. M.).