El objetivo de este trabajo fue evaluar, en términos de actividad y resultados postoperatorios inmediatos, las modificaciones de nuestro tratamiento quirúrgico programado de los aneurismas aórticos abdominales (AAA) infrarrenales como consecuencia del uso de endoprótesis para tratar los AAA, siguiendo las recomendaciones publicadas por la French Health Products Safety Agency (AFSSAPS) en diciembre de 2003. Este estudio monocéntrico y retrospectivo utilizó los datos clínicos de los pacientes intervenidos por AAA asintomáticos entre enero de 2001 y diciembre de 2006. El tratamiento endovascular de los AAA con endoprótesis aórtica fue introducido en nuestra práctica actual en enero de 2004, siguiendo las recomendaciones de la AFSSAPS (pacientes de alto riesgo ante cirugía abierta que se presentaron con un AAA≥50mm). El grupo I estuvo formado por pacientes intervenidos entre enero de 2001 y diciembre de 2003 según la técnica abierta estándar. El grupo II estuvo formado por pacientes intervenidos entre enero de 2004 y diciembre de 2006 mediante cirugía abierta estándar o cirugía endovascular. Los principales criterios de valoración fueron el número de pacientes intervenidos, la puntuación de su riesgo quirúrgico según la American Society of Anesthesiology (ASA), y la morbilidad y mortalidad intrahospitalarias. El número de pacientes tratados aumentó de forma significativa entre estos dos períodos (grupo I n=49, grupo II n=88, con 38 tratamientos endovasculares; p<0,001), sin ningún cambio en la media de edad (70 frente a 72 años), porcentaje de hombres (93,7% frente a 95,5%), y tamaño medio de los AAA (57,8 frente a 56mm) entre ambos grupos. Las puntuaciones ASA fueron significativamente más elevadas en el grupo II (ASA III y IV, grupo I=20,4% frente a grupo II=55,7%; p<0,0001), mientras que la tasa de mortalidad intrahospitalaria (4,1 frete a 3,4%) y la tasa de complicaciones postoperatorias mayores (16,3 frente a 11%) permanecieron estables. En el grupo II, la duración media de la hospitalización se vio significativamente reducida (12 frente a 9 días, p<0,001). En resumen, en nuestro centro, siguiendo las recomendaciones de la AFSSAPS, la introducción del tratamiento endovascular nos ha permitido tratar de forma programada un mayor número de pacientes con AAA y alto riesgo quirúrgico, sin menoscavo de los resultados postoperatorios inmediatos globales.
Ensayos multicéntricos recientes han validado los resultados a corto1,2 y medio plazo3,4 de la reparación endovascular (REVA) de los aneurismas aórticos abdominales (AAA) infrarrenales. En diciembre de 2003, la French Health Products Safety Agency (AFSSAPS) publicó recomendaciones que siguen siendo válidas sobre el uso de endoprótesis y restringió su uso a los pacientes con un elevado riesgo quirúrgico5.
El objetivo de este estudio retrospectivo fue evaluar las modificaciones de la actividad y de los resultados del postoperatorio inmediato tras la introducción de la REVA siguiendo estas recomendaciones.
MétodosDesde enero de 2001, en nuestro Departamento de Cirugía Vascular y Torácica se han registrado los datos clínicos y anatómicos de los pacientes intervenidos de forma programada por AAA infrarrenales según los estándares predefinidos6. Estos datos incluyeron: información demográfica, comorbilidad y factores de riesgo cardiovascular, evaluación del riesgo quirúrgico según la puntuación de la American Society of Anesthesiology7,8 (ASA), análisis preoperatorio del AAA mediante angiografía por tomografía computerizada (ATC), información quirúrgica detallada, y morbilidad y mortalidad perioperatorias.
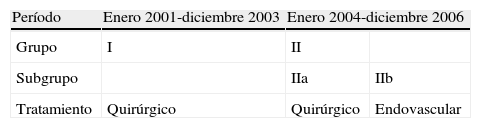
Tendiendo en cuenta esta base de datos prospectiva, comparamos de forma retrospectiva dos grupos de pacientes que habían sido intervenidos de forma programada y consecutiva por AAA infrarrenal asintomático entre enero de 2001 y diciembre de 2006. Separamos dos períodos de 3 años, uno antes y otro después de la introducción de nuestra práctica actual de REVA en enero de 2004, siguiendo las recomendaciones de la AFSSAPS en diciembre de 20035 (tabla I). El grupo I estuvo formado por pacientes intervenidos mediante la técnica abierta estándar (TAE) entre enero de 2001 y diciembre de 2003. El grupo II estuvo formado por los pacientes intervenidos mediante TAE (grupo IIa) o mediante REVA (grupo IIa) entre enero de 2004 y diciembre de 2006 (tabla II).
Recomendaciones de la AFSSAPS para el uso de endoprótesis aórticas en el tratamiento endovascular de los AAA infrarrenales (actualizado en diciembre de 2003)5
| Se ha demostrado que solamente pueden tratarse los aneurismas con un diámetro máximo>5cm o que han aumentado como mínimo 1cm en el último año (quirúrgicamente o mediante REVA). Una vez definido el tratamiento, los expertos de la AFSSAPS recomendaron utilizar endoprótesis solamente para tratar a los pacientes con un riesgo quirúrgico elevado. Para que quede constancia, según los expertos, este riesgo quirúrgico elevado existe cuando está presente uno de los siguientes factores: |
|
| Una vez se ha detectado una indicación para el tratamiento, la implantación de la endoprótesis debe realizarse siempre que se respeten las instrucciones del fabricante, especialmente con respecto a los criterios anatómicos y las contraindicaciones |
CV, capacidad vital; FEVI, fracción de eyección ventricular izquierda; REVA: reparación endovascular; VEF1: volumen expirado forzado en 1 s.
Las indicaciones para el tratamiento quirúrgico programado fueron AAA con un diámetro máximo≥5cm, AAA con un diámetro máximo≥4cm que había aumentado como mínimo 1cm en un año, o AAA asociado a aneurisma ilíaco con un diámetro máximo≥3cm.
Los criterios anatómicos selectivos para la REVA incluyeron AAA con un cuello proximal mayor de 10mm y un diámetro de 30mm como máximo, angulación máxima de 75°, y diámetro de las arterias ilíacas≥7mm sin excesiva tortuosidad, calcificaciones, o estenosis.
Las endoprótesis que se utilizaron habían sido autorizadas por el comité de expertos de la AFSSAPS: Excluder (W. L. Gore, Flagstaff, AZ), Talent (Medtronic, Santa Rosa, CA), y Zenith9 (William Cook Europe, Biaeverskow, Dinamarca).
Estas endoprótesis fueron bifurcadas o aortouniilíacas asociadas a una oclusión ilíaca contralateral o un bypass cruzado fémoro-femoral. La elección de la opción de tratamientos mediante endoprótesis se realizó en función de las medidas preoperatorias de la anatomía del aneurisma que se habían calculado gracias a la ATC abdominal pélvica10.
Todas las intervenciones endovasculares se realizaron bajo anestesia general por un equipo de cirujanos en un quirófano convencional. Durante la cirugía se evaluó el posicionamiento y la exclusión del AAA mediante una aortografía y en el postoperatorio mediante eco-Doppler. Se obtuvieron radiografías simples laterales y antero-posteriores del abdomen antes de que los pacientes abandonasen el hospital. Se realizó un seguimiento, que incluyó un examen clínico y una TC, al cabo de 1, 6, 12, 18, y 24 meses de la cirugía y posteriormente cada año, siempre que no se hubiesen detectado endofugas o migración de la endoprótesis11.
Los principales criterios de valoración fueron el número de pacientes intervenidos, la puntuación de su riesgo quirúrgico (ASA), la morbilidad (complicaciones mayores que afectasen al pronóstico vital y/o que requiriesen cirugía adicional), y mortalidad postoperatoria intrahospitalaria.
Los datos nominales se compararon utilizando el test chi cuadrado y las variables continuas utilizando el test de Student. El nivel de significancia se estableció en p<0,05.
ResultadosEn el grupo I fueron intervenidos 49 pacientes y en el grupo II, 88 (p<0,001). En el grupo II, 49 pacientes fueron intervenidos mediante TAE (grupo IIa) y 39 pacientes mediante REVA (grupo IIb). Las endoprótesis utilizadas fueron 1 Excluder, 8 Talent, y 30 Zenith. Siete de ellas (18%) fueron aortouniilíacas con bypass cruzado fémoro-femoral y 32 bifurcadas (82%).
La indicación media del uso de la TAE ha permanecido estable entre los 2 períodos: 16,3 por año.
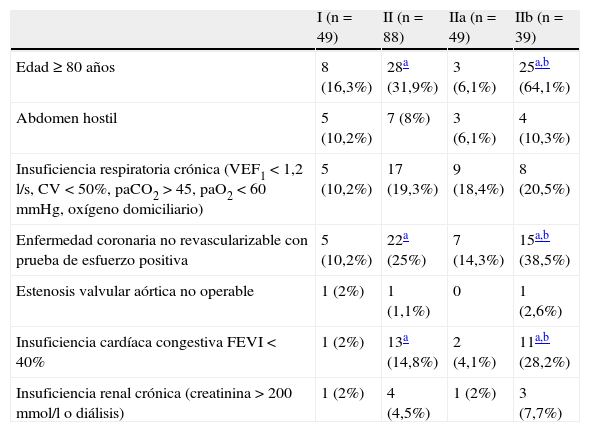
Los factores de riesgo de los diferentes grupos, definidos por la AFSSAPS, se muestran en la tabla III. En el grupo IIb, 19 pacientes presentaron un solo factor de riesgo, 13 presentaron dos factores, 6 presentaron tres, y 1 cuatro factores. El diámetro medio de los AAA tratados (grupo I: 57,8mm, intervalo 40-130; grupo II: 56mm, intervalo 40-100) y la media de edad de los pacientes (grupo I: 70,5 años, intervalo 53-90; grupo II: 71,9 años, intervalo 51-92) no fueron significativamente diferentes entre grupos. En el grupo IIb, los pacientes tratados con REVA fueron significativamente más mayores (79,5 años, intervalo 59-92) que los pacientes del grupo IIa (66,1 años, intervalo 51-79; p<0,001) y los pacientes del grupo I (70,5 años, intervalo 53-90; p<0,01).
Factores de riesgo quirúrgico según la definición de la AFSSAPS
| I (n=49) | II (n=88) | IIa (n=49) | IIb (n=39) | |
| Edad≥80 años | 8 (16,3%) | 28a (31,9%) | 3 (6,1%) | 25a,b (64,1%) |
| Abdomen hostil | 5 (10,2%) | 7 (8%) | 3 (6,1%) | 4 (10,3%) |
| Insuficiencia respiratoria crónica (VEF1<1,2 l/s, CV<50%, paCO2>45, paO2<60 mmHg, oxígeno domiciliario) | 5 (10,2%) | 17 (19,3%) | 9 (18,4%) | 8 (20,5%) |
| Enfermedad coronaria no revascularizable con prueba de esfuerzo positiva | 5 (10,2%) | 22a (25%) | 7 (14,3%) | 15a,b (38,5%) |
| Estenosis valvular aórtica no operable | 1 (2%) | 1 (1,1%) | 0 | 1 (2,6%) |
| Insuficiencia cardíaca congestiva FEVI<40% | 1 (2%) | 13a (14,8%) | 2 (4,1%) | 11a,b (28,2%) |
| Insuficiencia renal crónica (creatinina>200mmol/l o diálisis) | 1 (2%) | 4 (4,5%) | 1 (2%) | 3 (7,7%) |
CV, capacidad vital; FEVI, fracción de eyección ventricular izquierda; VEF1: volumen expirado forzado en 1 s.
En el grupo I, 10 pacientes (20%) fueron evaluados como ASA III y IV en comparación con 49 pacientes (56%) del grupo II (p<0,001). En el grupo IIb, 30 pacientes (77%) fueron evaluados como ASA III y IV en comparación con 21 pacientes (43%) del grupo IIa (p<0,01).
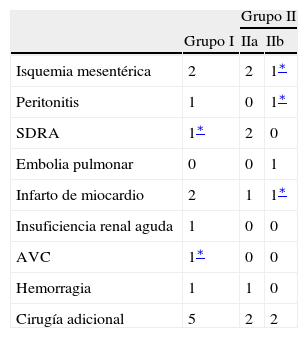
La duración de la hospitalización se redujo significativamente en el grupo II, con una media de 9 días (intervalo 2-30; IIa: media=10 días, IIb: media=8 días) en comparación con una media de 12 días en el grupo I (intervalo 4-100, p<0,001). La tasa de complicaciones postoperatorias mayores fue del 16,3% en el grupo I (n=8) y del 11,3% en el grupo II (n=10) (no significativa [NS]). Las complicaciones postoperatorias mayores se detallan en la tabla IV.
Complicaciones postoperatorias mayores
| Grupo II | |||
| Grupo I | IIa | IIb | |
| Isquemia mesentérica | 2 | 2 | 1∗ |
| Peritonitis | 1 | 0 | 1∗ |
| SDRA | 1∗ | 2 | 0 |
| Embolia pulmonar | 0 | 0 | 1 |
| Infarto de miocardio | 2 | 1 | 1∗ |
| Insuficiencia renal aguda | 1 | 0 | 0 |
| AVC | 1∗ | 0 | 0 |
| Hemorragia | 1 | 1 | 0 |
| Cirugía adicional | 5 | 2 | 2 |
AVC: accidente vascular cerebral; SDRA: síndrome de dificultad respiratoria aguda.
La tasa de mortalidad intrahospitalaria fue del 4,1% en el grupo I (n=2) y del 3,4% en el grupo II (n=3) (NS). En el grupo II, 3 pacientes fallecieron tras la REVA: 2 tras la conversión quirúrgica y 1 debido a una isquemia intestinal tras la exclusión de la arteria hipogástrica. Estos 3 fallecimientos se observaron durante el último año de este ensayo comparativo. La tasa de conversión de REVA a TAE fue del 5,3% (n=2) y los 2 pacientes fallecieron. En el grupo IIb, la tasa de mortalidad intrahospitalaria tras la REVA fue del 7,7%, mientras que no se registraron fallecimientos tras la TAE en el grupo IIa (p<0,05).
DiscusiónEn nuestro centro, siguiendo las recomendaciones de la AFSSAPS, la introducción del tratamiento endovascular nos ha permitido tratar de forma programada a un mayor número de pacientes con AAA con un alto riesgo ante una cirugía abierta sin aumentar los efectos adversos postoperatorios inmediatos.
Esta experiencia de tratamiento de AAA corresponde a un hospital universitario que ha estado esperando las recomendaciones de la AFSSAPS (sin anticiparse a ellas) para introducir la REVA en su arsenal terapéutico. Por tanto, nos permite evaluar de forma objetiva el impacto de estas recomendaciones en el rendimiento de la corrección programada de AAA sin el sesgo del ‘‘exceso de entusiasmo'’ o de la ‘‘hostilidad más absoluta'’. Es más, esta experiencia es un buen reflejo de lo que sucede en muchos hospitales franceses, en los que el tratamiento programado de los AAA, si bien realizado de forma regular, no está en primera línea.
La realización de REVA en pacientes de alto riesgo frente a la cirugía abierta no ha reducido el número de TAE, que ha permanecido estable. Sin embargo, nos ha brindado la oportunidad de obtener un entrenamiento con las nuevas técnicas12,13.
Antes de 2004, no se habían definido criterios particulares de exclusión o contraindicaciones y la AFSSAPS no había emitido ninguna recomendación en particular. Las indicaciones de la TAE solían determinarse solamente tras la evaluación individualizada del riesgo/beneficio en cada paciente. No ha sido posible registrar el número de pacientes rechazados antes de 2004 o sus comorbilidades; por tanto, no podemos analizarlos de forma precisa.
Desde enero de 2004, las recomendaciones para realizar la REVA en pacientes con alto riesgo ante cirugía abierta han aumentado considerablemente el número de indicaciones de corrección programada de AAA en los pacientes que no eran candidatos a la TAE. Por tanto, la actividad del tratamiento de AAA se ha multiplicado por 1,8 según nuestro estudio. A pesar de la duración significativamente corta de la hospitalización, los pacientes con endoprótesis requieren un seguimiento periódico, que muy probablemente aumentará el coste global del tratamiento de AAA14,15.
Se ha tratado una población mayor con un riesgo elevado ante la cirugía abierta, con una tasa de mortalidad perioperatoria global del 3,4%. La mortalidad perioperatoria de la REVA fue del 7,7%, que se corresponde con los resultados de la literatura europea en lo que respecta a los pacientes de alto riesgo ante una cirugía abierta16-18. Este resultado se ve equilibrado por la ausencia de mortalidad perioperatoria en los pacientes tratados con TAE. Esta mejora contemporánea de los resultados de la TAE con mayor probabilidad se deba a la forma sesgada en que han sido seleccionados los pacientes, habiéndose escogido la REVA para aquellos de más riesgo y los de mayor edad.
Dos de los 3 fallecimientos estuvieron asociados a problemas técnicos perioperatorios que requirieron conversión. La evaluación tanto anatómica como de la comorbilidad de los pacientes con un riesgo elevado ante la cirugía abierta es crucial. Una anatomía AAA difícil aumenta el riesgo de dificultades técnicas preoperatorias y por tanto la conversión a TAE19, que es extremadamente peligrosa en estos pacientes de alto riesgo20.
Incluso aunque la tasa de mortalidad es comparable con los resultados de la literatura europea, en lo que respecta a los pacientes con alto riesgo ante la cirugía abierta16-18, es obvio que comparar una serie histórica anterior a 2004 con dos series contemporáneas conlleva un fuerte sesgo. Este sesgo es más importante en tanto que la serie contemporánea IIb incluye a los primeros pacientes intervenidos mediante la técnica endovascular, con un período inevitable de curva de aprendizaje. Estos resultados a corto plazo no nos permiten concluir que la REVA no es una solución adecuada en los pacientes con alto riesgo ante la cirugía abierta o que las recomendaciones de la AFSSAPS son cuestionables. Por otro lado, varios ensayos recientes norteamericanos han informado de tasas de mortalidad a corto plazo mucho más aceptables (2,9-3,7%) de la REVA realizada en pacientes con riesgo elevado ante la cirugía abierta21-23. Por tanto, esta cuestión sigue siendo motivo de controversia.
Este ensayo constituye el primer paso en el uso de la REVA para los AAA siguiendo las recomendaciones de la AFSSAPS. Este primer paso cauteloso ha brindado a los equipos quirúrgicos la oportunidad esencial de ser formados para realizar técnicas endovasculares y para planificarlas sin transgredir las indicaciones de la TAE. Por lo que respecta al tratamiento del AAA, este primer paso también ha aumentado la experiencia global de los cirujanos en 2 técnicas complementarias, con sus ventajas e inconvenientes.
Presentado en el 22°. Annual Meeting of the French Society for Vascular Surgery, Lyon, Francia, 5-7 de junio de 2007.