Antes de la autorización por parte de la Food and Drug Administration de EE. UU. de las endoprótesis de tamaño grande (diámetro del cuerpo principal de hasta 36 mm), los aneurismas aórticos abdominales pequeños (AAA, < 5,5 cm) demostraron ser más adecuados para el tratamiento endovascular (TEVA) que los AAA mayores (≥ 5,5 cm). El objetivo de este estudio fue evaluar los cambios en la compatibilidad del TEVA con el uso potencial de endoprótesis de mayor tamaño en pacientes consecutivos no seleccionados. Se evaluó además la influencia de la edad, el tamaño del aneurisma y la evaluación preoperatoria del riesgo quirúrgico de los pacientes en dicha compatibilidad con el TEVA. Estudiamos a 186 pacientes hombres remitidos para la evaluación de un AAA no complicado estudiados mediante tomografía computerizada con contraste con reconstrucciones tridimensionales. Se determinaron las características morfológicas del AAA y las características del cuello según los parámetros normalizados de la Society for Vascular Surgery para determinar la compatibilidad del TEVA. La evaluación preoperatoria del riesgo quirúgico se realizó mediante el cálculo del índice de probabilidad personalizado, un sistema de puntuación validado para la valoración preoperatoria del riesgo quirúrgico para intervenciones de cirugía vascular. La compatibilidad del TEVA se determinó en función de la anatomía del cuello, la morfología de las arterias ilíacas, y la angulación y la tortuosidad totales del aneurisma aórtico según la experiencia del clínico y la práctica actual. La mediana de la edad de la cohorte a estudio era 72 años (intervalo intercuartil [IIC] 65-79 años). La mediana del diámetro máximo fue 5,4 cm (IIC 4,1-5,9). La mediana de la puntuación de la valoración preoperatoria del riesgo quirúrgico fue +7 (IIC –7 a +14). La compatibilidad del TEVA en los AAA de gran tamaño aumentó de forma significativa con las endoprótesis de mayor tamaño (35-63%, p < 0,001). Los cambios en la compatibilidad del TEVA en los AAA de pequeño tamaño no fueron significativos (69-75%, p = 0,06). El diámetro máximo de los AAA no fue un factor predictivo independiente de la compatibilidad del TEVA con las endoprótesis de mayor tamaño tras realizar el ajuste para la anatomía del cuello. La longitud del cuello aórtico (odds ratio [OR] = 1,2, intervalo de confianza del 95% [IC] 1,1-1,2) y el diámetro (OR = 0,78, IC 95% 0,63-0,96) fueron los únicos factores predictivos independientes de la compatibilidad del TEVA con las endoprótesis de mayor tamaño. No se observaron diferencias en la edad, el tamaño del AAA, y la valoración preoperatoria del riesgo quirúrgico entre los pacientes candidatos y no candidatos para el TEVA con endoprótesis de gran tamaño. En conclusión, la introducción de endoprótesis de mayor tamaño (hasta 36 mm de diámetro del cuerpo principal) en EE. UU. ha dado lugar a un aumento significativo de la compatibilidad anatómica del TEVA con los AAA de gran tamaño. Por el contrario, no se observaron cambios significativos en dicha compatibilidad con los AAA de pequeño tamaño. En conjunto, la compatibilidad del TEVA no se ve afectada por la edad, el tamaño del aneurisma o el resultado de la valoración preoperatoria del riesgo quirúrgico de los pacientes con AAA.
No se ha demostrado que la edad, el tamaño del aneurisma aórtico abdominal (AAA), y el sexo influyan en la compatibilidad del tratamiento endovascular de los aneurismas (TEVA) en estudios observacionales1,2. Contrariamente, en un estudio previo realizado en nuestro centro para determinar la compatibilidad anatómica del TEVA, en el que se siguieron de forma estricta las instrucciones del fabricante, el 64% de los pacientes con un AAA de pequeño tamaño fueron candidatos para el TEVA en comparación con el 39% de los pacientes con un AAA de tamaño mayor3. Los AAA de pequeño tamaño presentaron una anatomía menos compleja con cuellos aórticos más largos, menos angulación del cuello y menos tortuosidad. Otros estudios morfológicos han demostrado también que el diámetro máximo de los AAA está inversamente relacionado con la longitud del cuello aórtico4. Además, se ha demostrado que el diámetro del aneurisma es el determinante indirecto más útil para determinar la compatibilidad del TEVA4,5. En un estudio posterior, sin embargo, demostramos que los cambios morfológicos asociados con el crecimiento del aneurisma durante el seguimiento de los AAA de pequeño tamaño no fueron clínicamente significativos y tuvieron un efecto mínimo en la compatibilidad global del TEVA6. De hecho, la compatibilidad del TEVA no varió de forma significativa el seguimiento a medio plazo (74 frente a 69%), lo que sugiere que dicha compatibilidad no se ve afectada por el tamaño del AAA hasta alcanzar el umbral de diámetro en el que se indica el tratamiento.
En octubre de 2004, la Food and Drug Administration de EE. UU. autorizó el uso de endoprótesis de mayor tamaño (diámetro del cuerpo principal hasta 36 mm) para el TEVA. Si bien algunos estudios europeos han evaluado la compatibilidad del TEVA con el uso de estas endopótesis de mayor tamaño2,7, la mayoría de los estudios americanos han utilizado criterios de selección para el TEVA utilizando endoprótesis con un diámetro del cuerpo principal de hasta 28 o 32 mm3,8.
El riesgo quirúrgico preoperatorio del paciente ha sido identificado como un factor determinante mayor de la necesidad y los resultados del tratamiento de los AAA, incluido el TEVA9,10. El índice de probabilidad personalizado (IPP) basado en las comorbilidades y el uso de estatinas y beta-bloqueantes ha demostrado ser un factor predictivo válido para la determinación de la morbilidad y la mortalidad perioperatorias tras las intervenciones de cirugía vascular, incluido el TEVA9,11. Hasta la fecha, y en conocimiento de los autores, no se ha evaluado la relación de los resultados de la valoración preoperatoria del riesgo quirúrgico con la compatibilidad del TEVA.
El objetivo de este estudio fue determinar los cambios en la compatibilidad del TEVA con el uso potencial de endoprótesis de mayor tamaño en pacientes consecutivos no seleccionados. Se evaluó además la influencia de la edad, el tamaño del aneurisma, y los resultados de la valoración preoperatoria del riesgo quirúrgico en la compatibilidad del TEVA.
MétodosDurante un período de 3 años, 186 pacientes consecutivos remitidos para la evaluación de un AAA fueron estudiados mediante tomografía computerizada (TC) helicoidal en el Dallas Veterans Affairs Medical Center. Todas las TC se realizaron con el sistema helicoidal Hi Speed I de GE Medical Systems (Milwaukee, WI) con el colimador ajustado a 3 mm y con un paso de 2,0. Todas las TC se evaluaron utilizando una reconstrucción tridimensional en un terminal Vitrea (Vital Images, Plymouth, MN). Las características morfológicas del AAA se determinaron a partir de cada TC según los parámetros normalizados de la Society for Vascular Surgery12,13 (SVS). Entre ellas, destacaron la longitud y el diámetro del cuello aórtico corregidos para el ángulo, el ángulo del cuello aórtico suprarrenal e infrarrenal, la cuantificación de trombo y calcificaciones en el cuello aórtico, el diámetro ortogonal máximo del aneurisma, el índice de tortuosidad del aneurisma8 (distancia media entre la línea central de la luz/línea recta), la cuantificación de trombo en el saco aneurismático, la cuantificación de trombo y calcificación en la arteria ilíaca, el diámetro y la longitud de la arteria ilíaca común, la tortuosidad de la arteria ilíaca (distancia media entre la línea central de la luz/línea recta), y el diámetro de la arteria ilíaca externa. Las mediciones obtenidas de todas las TC fueron introducidas en una base de datos diseñada para este estudio, que fue autorizada por el comité de revisión del centro.
La compatibilidad anatómica del TEVA se determinó según la anatomía del cuello (diámetro, longitud y angulación), la morfología de la arteria ilíaca, y la angulación y la tortuosidad total del aneurisma aórtico, que se definieron según los parámetros normalizados de la SVS12,13. La compatibilidad anatómica de la EVAR se determinó principalmente según el consenso de los clínicos, su experiencia y la práctica actual con las endoprótesis comercializadas en la actualidad en EE. UU., es decir, los dispositivos AneuRx (Medtronic, Minneápolis, MN), Excluder (W. L. Gore, Flagstaff, AZ), PowerLink (Endologix, Irvine, CA), y Zenith (Cook, Bloomington, IN), incluidos los endoimplantes con un cuerpo principal mayor de 36 mm. De forma específica, se definió la compatibilidad del TEVA según la expectativa del clínico de situar un dispositivo potencial y conseguir su fijación segura en las zonas de anclaje proximal y distal del cuello aórtico y las arterias ilíacas. Si bien el cuello proximal del aneurisma aórtico podría ser adecuado para el TEVA cuando la zona de anclaje fuera menor de 15 mm, la angulación del cuello tendría que ser mínima en estos casos. La longitud mínima del cuello aórtico cuando no existió angulación fue de 10 mm, mientras que el diámetro máximo del cuello fue de 32 mm. Las características de la arteria ilíaca se evaluaron en términos de limitación para el abordaje y de la posibilidad de permitir la progresión tanto del cuerpo principal como de las extensiones de la extremidad contralateral del dispositivo. En los casos en los que no era posible realizar el TEVA con un dispositivo, se evaluó la posibilidad de realizarlo con cada uno de los dispositivos restantes.
La valoración preoperatoria del riesgo quirúrgico del tratamiento del AAA se determinó utilizando el IPP, un sistema de puntuación validado previamente desarrollado para evaluar la mortalidad perioperatoria en pacientes sometidos a cirugía vascular9. El IPP utiliza 7 características clínicas: la insuficiencia renal (definida como una concentración sérica de creatinina igual o mayor de 2 mg/dl) suma 16 puntos, la insuficiencia cardíaca no controlada suma 14 puntos, la cardiopatía isquémica suma 13 puntos, la hipertensión arterial suma 7 puntos, y la enfermedad pulmonar crónica (definida como volumen de fuerza espiratoria < 60% del valor predicho) también suma 7 puntos. Se considera que el tratamiento con beta-bloqueantes y/o estatinas reduce el riesgo de mortalidad perioperatoria y, por tanto, resta puntos de la puntuación global. El tratamiento con un beta-bloqueante resta 15 puntos, y el tratamiento con estatinas resta 10 puntos. Este enfoque de la evaluación preoperatoria del riesgo quirúgico utilizando el IPP ha sido comprobado y validado también por Greenhalgh et al11 utilizando los datos obtenidos de los pacientes participantes en el ensayo 1 de la EVAR y en el ensayo 2, como el mejor indicador del riesgo quirúrgico preoperatorio.
Las estadísticas descriptivas de las variables categóricas se presentan como frecuencias relativas (porcentajes), y se compararon con el test chi cuadrado (χ2 para grupos independientes, valor p de dos colas). Los cambios morfológicos en la medición del aneurisma se clasificaron según los parámetros normalizados para el TEVA12,13. Las variables continuas se expresaron como medias e intervalos intercuartil (IIC), y se analizaron con el test U de Mann-Whitney. Se utilizó el análisis de regresión logística multivariable gradual para identificar los factores predictivos independientes de compatibilidad del TEVA. Las variables con un valor p menor de 0,25 en el análisis univariable y las variables conocidas como factores posibles o importantes de confusión fueron introducidas en el modelo de regresión y consideradas significativas mediante selección gradual directa a p < 0,05 en la ecuación de regresión final. Los resultados se consideraron estadísticamente significativos para el criterio de valoración primario, es decir, la compatibilidad del TEVA, con un valor de p < 0,05. Las odds ratio (OR) del análisis multivariable se muestran con un intervalo de confianza del 95% (IC 95%). Los cambios en la compatibilidad del TEVA con la introducción de endoprótesis de mayor tamaño se evaluaron mediante comparaciones emparejadas y pareadas de la compatibilidad del TEVA con el uso potencial de endoprótesis de menor y mayor tamaño (diámetro del cuerpo principal del endoimplante ≤ 32 mm y ≤ 36 mm, respectivamente) utilizando el test χ2 de McNemar (χ2 para grupos emparejados, valor p de dos colas). Para el análisis de los datos se utilizaron los programas SPSS versión 14.0 (SPSS Inc., Chicago, IL) y MedCalc para Windows versión 8.1.0.0 (MedCalc Software, Mariakerke, Bélgica).
ResultadosLa mediana de la edad de la población del estudio era 72 años (IIC 65-79). Todos los pacientes fueron hombres. La mediana del diámetro máximo del AAA era 5,4 cm (IIC 4,1-5,9). La mediana de la puntuación de la valoración preoperatoria del riesgo quirúrgico (IPP) era +7 (IIC –7 a +14). Entre los 186 pacientes estudiados mediante angiografía por TC, 136 (73%) presentaban AAA con una anatomía compatible con el TEVA, mientras que 50 (27%) no eran candidatos a la EVAR. Ciento veintinueve pacientes (69%) presentaban un AAA de pequeño diámetro (diámetro máximo < 5,5 cm), mientras que 57 (31%) presentaban un AAA de gran tamaño (diámetro máximo ≥ 5,5 cm). La mediana de la edad de los pacientes candidatos y no candidatos para el TEVA era la misma (72 años [IIC 65-80] frente a 72 años [IIC 67-77], respectivamente; p = 0,74). El resultado de la valoración preoperatoria del riesgo quirúrgico no presentaba diferencias significativas entre los pacientes candidatos y los no candidatos al TEVA (mediana de las puntuaciones de la IPP, +7 [IIC, –3 a +14] frente a +5 [–3 a +14], respectivamente; p = 0,28).
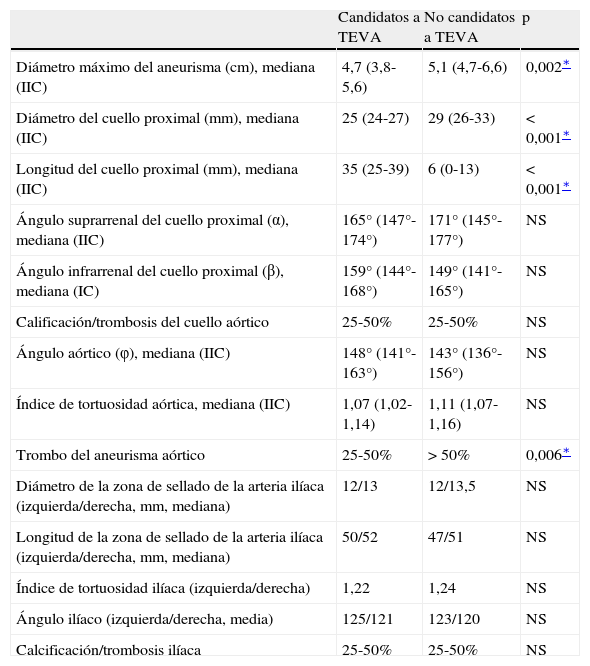
La mediana del diámetro máximo del aneurisma aórtico de los pacientes candidatos al TEVA (4,7 cm, IIC 3,8-5,6) era significativamente menor en comparación con los pacientes no candidatos a dicho tratamiento (5,1 cm, IIC 4,7-6,6; p = 0,002). La mediana del diámetro del cuello aórtico de los pacientes candidatos al TEVA era significativamente menor (25 mm, IIC 24-27, frente a 29 mm, IIC 26-33; p < 0,001) en comparación con los pacientes no candidatos. La mediana de la longitud del cuello aórtico de los pacientes no candidatos al TEVA era significativamente menor (6 mm, IIC 0-13, frente a 35 mm, IIC 25-39; p < 0,001) que la de los pacientes que sí eran candidatos al TEVA. Las características morfológicas de las arterias ilíacas no presentaban diferencias significativas entre los pacientes candidatos y los no candidatos al TEVA (tabla I).
Mediciones anatómicas de los AAA candidatos y no candidatos a TEVA (n = 186)
| Candidatos a TEVA | No candidatos a TEVA | p | |
| Diámetro máximo del aneurisma (cm), mediana (IIC) | 4,7 (3,8-5,6) | 5,1 (4,7-6,6) | 0,002∗ |
| Diámetro del cuello proximal (mm), mediana (IIC) | 25 (24-27) | 29 (26-33) | < 0,001∗ |
| Longitud del cuello proximal (mm), mediana (IIC) | 35 (25-39) | 6 (0-13) | < 0,001∗ |
| Ángulo suprarrenal del cuello proximal (α), mediana (IIC) | 165° (147°-174°) | 171° (145°-177°) | NS |
| Ángulo infrarrenal del cuello proximal (β), mediana (IC) | 159° (144°-168°) | 149° (141°-165°) | NS |
| Calificación/trombosis del cuello aórtico | 25-50% | 25-50% | NS |
| Ángulo aórtico (φ), mediana (IIC) | 148° (141°-163°) | 143° (136°-156°) | NS |
| Índice de tortuosidad aórtica, mediana (IIC) | 1,07 (1,02-1,14) | 1,11 (1,07-1,16) | NS |
| Trombo del aneurisma aórtico | 25-50% | > 50% | 0,006∗ |
| Diámetro de la zona de sellado de la arteria ilíaca (izquierda/derecha, mm, mediana) | 12/13 | 12/13,5 | NS |
| Longitud de la zona de sellado de la arteria ilíaca (izquierda/derecha, mm, mediana) | 50/52 | 47/51 | NS |
| Índice de tortuosidad ilíaca (izquierda/derecha) | 1,22 | 1,24 | NS |
| Ángulo ilíaco (izquierda/derecha, media) | 125/121 | 123/120 | NS |
| Calcificación/trombosis ilíaca | 25-50% | 25-50% | NS |
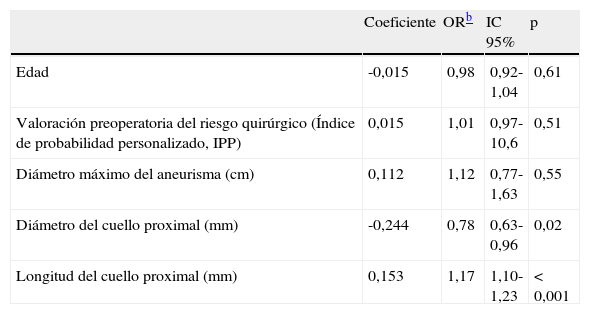
Los análisis de regresión logística multivariable revelaron que la media de la longitud y el diámetro del cuello aórtico fueron los únicos determinantes independientes de la compatibilidad del TEVA. La edad, la valoración preoperatoria del riesgo quirúrgico (puntuación IPP) y el tamaño del aneurisma (mediana del diámetro máximo) no estuvieron asociados de forma independiente con la compatibilidad del TEVA (tabla II).
Análisis multivariable de los factores asociados con la compatibilidad del TEVAa
| Coeficiente | ORb | IC 95% | p | |
| Edad | -0,015 | 0,98 | 0,92-1,04 | 0,61 |
| Valoración preoperatoria del riesgo quirúrgico (Índice de probabilidad personalizado, IPP) | 0,015 | 1,01 | 0,97-10,6 | 0,51 |
| Diámetro máximo del aneurisma (cm) | 0,112 | 1,12 | 0,77-1,63 | 0,55 |
| Diámetro del cuello proximal (mm) | -0,244 | 0,78 | 0,63-0,96 | 0,02 |
| Longitud del cuello proximal (mm) | 0,153 | 1,17 | 1,10-1,23 | < 0,001 |
IC: intervalo de confianza; OR: odds ratio.
La aparición de endoprótesis de mayor tamaño provocó un aumento de la compatibilidad del TEVA en todos los AAA evaluados en esta serie (59-73%, p < 0,001). Los análisis estratificados según el tamaño del AAA revelaron además que la compatibilidad del TEVA aumentó de forma significativa con el uso potencial de las endoprótesis de mayor tamaño, en comparación con las de tamaño menor en los pacientes con AAA grandes (35-63%, p < 0,001). Los cambios en la compatibilidad del TEVA en los AAA de pequeño tamaño no fueron significativos (69-75%, p = 0,06). Los análisis de regresión logística multivariable estratificados revelaron que el diámetro máximo del AAA no fue un factor predictivo independiente de la compatibilidad del TEVA con las endoprótesis de tamaño menor o mayor tras el ajuste para la anatomía del cuello.
DiscusiónLos resultados de nuestro estudio indican que la introducción de endoprótesis de mayor tamaño (diámetro del cuerpo principal de hasta 36 mm) en EE. UU. ha provocado un aumento significativo de la compatibilidad anatómica del TEVA de AAA de gran tamaño. Por el contrario, dicha compatibilidad no ha variado de forma significativa en los aneurismas pequeños. Nuestros resultados, por tanto, sugieren que las endoprótesis de mayor diámetro han ampliado las opciones de TEVA en AAA de gran tamaño. No obstante, la eficacia y la durabilidad del TEVA con el uso de endoimplantes de mayor tamaño están todavía por determinar. Nuestros datos revelaron también que la compatibilidad anatómica del TEVA no está afectada por la edad, el riesgo quirúrgico estimado o el tamaño del aneurisma. En su lugar, el diámetro y la longitud del cuello proximal del aneurisma aórtico son los principales factores que determinan la compatibilidad del TEVA.
Si bien en un estudio anterior realizado en nuestro centro se observó que el tamaño de los AAA era un factor predictivo independiente de la compatibilidad del TEVA, otros estudios y nuestra serie actual no han conseguido demostrar una asociación independiente entre el diámetro máximo del AAA y la compatibilidad anatómica para el TEVA1,2. Varias razones pueden explicar esta diferencia de resultados. En primer lugar, en el estudio original de Welborn et al3, la compatibilidad del TEVA se evaluó utilizando criterios conservadores basados en las instrucciones publicadas por los fabricantes de los dispositivos con un diámetro del cuerpo principal de hasta 32 mm. En nuestra serie, la compatibilidad del TEVA se determinó a partir del uso potencial de endoprótesis de mayor tamaño comercializadas en la actualidad en EE. UU. En el estudio actual se utilizó también un planteamiento más liberal para evaluar la compatibilidad del TEVA, que se basó en el tratamiento actual de los AAA por parte de operadores más experimentados. En segundo lugar, Welborn et al3 excluyeron de los análisis multivariables las características anatómicas del cuello del aneurisma porque estas variables se utilizaron para determinar la compatibilidad del TEVA. Por el contrario, nuestros datos actuales y otros estudios previos incluyeron la longitud, el diámetro y la angulación del cuello en los modelos de regresión logística multivariable ya que la evaluación de su asociación independiente con la compatibilidad del TEVA es crítica si se consideran otras variables anatómicas, demográficas y clínicas en el análisis2.
Al igual que en nuestro estudio previo, en el que evaluamos los cambios morfológicos que se produjeron en una cohorte de pacientes no seleccionados con aneurismas de pequeño tamaño bajo observación6, nuestros datos actuales demuestran que el diámetro y la longitud del cuello aórtico proximal son los factores con mayor significación en la predicción de la compatibilidad del TEVA de AAA de diferente tamaño. Estudios anteriores han sugerido esta relación1,2,14,15. Bayle et al4 observaron que los aneurismas de mayor tamaño tenían cuellos proximales cortos y un aumento de la tortuosidad ilíaca. Armon et al14 observaron que los aneurismas con un diámetro máximo > 7 cm tenían cuellos aórticos más anchos y más cortos. Arko et al1 de forma análoga observaron que, a medida que aumentaba el tamaño del aneurisma, la longitud del cuello aórtico disminuía en un 27%. Estos estudios previos, al igual que nuestro estudio actual, incluyeron un grupo no seleccionado de aneurismas de tamaño grande y pequeño. El planteamiento de nuestro estudio es único, al evaluar la compatibilidad del TEVA utilizando criterios modificados basados no en las intrucciones del fabricante, sino en el planteamiento actual de facultativos experimentados, teniendo en cuenta todos los dispositivos comercializados en EE. UU.
Nuestros resultados muestran que la edad del paciente y el riesgo quirúrgico estimado no influyeron en las tasas de compatibilidad del TEVA. Esto sugiere que los pacientes de edad avanzada y los que presentan un alto riesgo quirúrgico para la práctica de un tratamiento convencional no tienen una anatomía más desfavorable que descarte el TEVA en comparación con los pacientes más jóvenes y con menor riesgo. Si bien se han descrito resultados similares en términos de edad y su asociación con la compatibilidad del TEVA2, nuestro estudio es el primer estudio, del que tengamos constancia, que sugiere que no existe una asociación entre los resultados de la valoración preoperatoria del riesgo quirúrgico y la presencia de características anatómicas desfavorables para el TEVA.
En nuestro estudio anterior, la principal contraindicación del TEVA fue un diámetro del cuello aórtico proximal dilatado (57%), mientras que una longitud inadecuada del cuello fue el principal factor limitante en el 37% de los aneurismas6. Por el contrario, en nuestra serie actual, el TEVA no era compatible en el 41% de los AAA debido a una longitud inadecuada del cuello proximal, mientras que un diámetro del cuello aórtico proximal > 32 mm, que es el mayor tamaño en el que se puede implantar el último dispositivo comercializado Zenith de 36 mm, fue el factor limitante de la compatibilidad del TEVA en el 31% de los pacientes. En ambas series, la anatomía desfavorable del cuello aórtico proximal fue el único factor que justificó la exclusión de los pacientes para el TEVA.
Dada la mejoría en los resultados descritos con la práctica del TEVA en los AAA de pequeño tamaño en comparación con los AAA de mayor tamaño, se ha sugerido que debería reducirse el umbral del tamaño de los AAA para establecer la indicación de tratamiento5,16. Otro estudio observacional a gran escala, sin embargo, mostró que los resultados a medio plazo del TEVA precoz en los AAA de pequeño tamaño fueron subóptimos debido a la frecuente necesidad de reintervenciones y al continuo crecimiento del saco aórtico, lo que representa un argumento en contra de la extensión del TEVA a los AAA de pequeño tamaño17. Hasta que no finalicen los ensayos con asignación aleatoria actualmente en curso que comparan el TEVA frente a la observación en el manejo de los AAA de pequeño tamaño, y siempre que se demuestre un tamaño y una potencia adecuados de la muestra, el TEVA precoz de los AAA de pequeño tamaño sigue sin estar justificado.
Si bien nuestros datos sugieren una relación directa entre el tamaño de los AAA y el diámetro del cuello aórtico proximal, el diámetro máximo del aneurisma per se no afecta de forma significativa a la compatibilidad anatómica del TEVA. De hecho, los AAA de pequeño tamaño presentan ocasionalmente cuellos proximales cortos y anchos. Es más, parece que la compatibilidad de un aneurisma para su tratamiento endovascular está predeterminada de forma temprana en la vida morfológica del aneurisma, probablemente antes de que el diámetro aórtico máximo alcance los 5 cm. Debido a que el riesgo de rotura del aneurisma en AAA de pequeño tamaño es mínimo y a que el tratamiento de hasta un cuarto de los pacientes con AAA pequeños sometidos a observación no llega a ser necesario nunca18,19, la necesidad de un TEVA precoz en caso de aneurismas con un diámetro máximo < 5 cm probablemente no está justificado. Un enfoque más sensato para el tratamiento de los AAA de pequeño tamaño debería centrarse en la anatomía del cuello proximal del aneurisma. En caso de que la longitud y el diámetro del cuello aórtico infrarrenal tengan unas dimensiones límite, el TEVA precoz puede estar justificado ya que durante la observación continuada se podría producir el crecimiento del AAA con la pérdida asociada de la compatibilidad para el TEVA. Por el contrario, los AAA de pequeño tamaño con cuellos aórticos infrarrenales largos y diámetros adecuados del cuello pueden permanecer en observación de forma segura puesto que es poco probable que su crecimiento comporte una pérdida de compatibilidad para el TEVA. En relación con esto, la longitud del cuello aórtico proximal es probablemente el factor más importante que determina la necesidad de tratamiento, ya que la disponibilidad de endoprótesis de mayor tamaño ha dado lugar a un aumento de la compatibilidad del TEVA en los pacientes con AAA. No es probable que la intervención en una etapa temprana de la vida del aneurisma comporte una mejora en el margen de oportunidad para realizar el TEVA, cuando se repara antes de que alcance el tamaño de 5 cm, a no ser que la longitud del cuello proximal esté limitada.
Aunque este estudio incluye una gran serie de pacientes remitidos para la evaluación de AAA no complicados que fueron estudiados mediante TC con contraste con reconstrucciones tridimensionales, deben destacarse algunas limitaciones importantes. En primer lugar, la mayoría de los AAA (69%) referidos para su evaluación fueron de pequeño tamaño. En segundo lugar, todos los pacientes de este estudio fueron hombres; así pues, nuestros resultados no se aplican a mujeres con AAA. En tercer lugar, si bien se evaluaron todos los componentes del IPP en todos los pacientes, no se realizaron evaluaciones cardíacas y pulmonares completas de forma rutinaria debido a que no se ofreció practicar el tratamiento del AAA a todos los pacientes, fuera TEVA o tratamiento convencional. Finalmente, no siempre se pudieron definir de forma estricta las características anatómicas y otras características específicas de los pacientes que pudiesen ser exploradas como criterios posibles para determinar la compatibilidad del TEVA, ya que ésta sigue siendo subjetiva en muchas circunstancias y depende de la experiencia del clínico y de las prácticas actuales.
Presentado en el 18th Annual Winter Meeting de la Peripheral Vascular Surgery Society's, Snowmass, CO, 1-3 de febrero de 2008.