Los aneurismas de las arterias viscerales (AAV) son lesiones poco frecuentes y su patogenia sigue sin comprenderse por completo. Afectan a la arteria hepática en alrededor del 20% de los casos. Es la segunda localización más frecuente después de la arteria esplénica1. Sólo el 17-25% de estos aneurismas son intrahepáticos2.
Los aneurismas viscerales asintomáticos se identifican con una frecuencia cada vez mayor por tres razones principales. En primer lugar, las modalidades transversales de diagnóstico por la imagen se usan más ampliamente para diagnosticar una extensa variedad de patologías intraabdominales3. En segundo lugar, los procedimientos terapéuticos percutáneos y endoscópicos se usan con más frecuencia para el tratamiento de las enfermedades de las vías biliares, provocando aneurismas viscerales debido al traumatismo relacionado con dichos procedimientos3. En tercer lugar, el traumatismo hepático contuso se trata de forma no quirúrgica3. Dichas lesiones tienen una notable importancia clínica porque suelen ser asintomáticas. En el 80% de los pacientes con aneurismas de la arteria hepática (AAH), su rotura es el acontecimiento clínico inicial.
Para pacientes con AAV, están disponibles diversas opciones terapéuticas. Además de las técnicas quirúrgicas tradicionales, durante los últimos años, también se han desarrollado la cirugía laparoscópica y los métodos endovasculares de embolización y aplicación de stents 4,5. La elección de una modalidad de tratamiento depende de la presentación clínica, localización del aneurisma, factores de riesgo asociados, y estado general del paciente. Cuando se considera si se debe intervenir quirúrgicamente es esencial tener en cuenta la elevada sensibilidad del parénquima hepático a las agresiones isquémicas.
No disponemos de conocimientos científicos suficientes para proporcionar directrices firmes de tratamiento. La mayor parte de la información usada para conducir el tratamiento se ha extraído de alrededor de 3.000 casos publicados. Estos casos se obtuvieron de forma retrospectiva y se publicaron en forma de series de pequeño o mediano tamaño de instituciones individuales. No se dispone de estudios que demuestren la eficacia o ineficacia comparativa de un tratamiento en concreto de modo que, en la actualidad, no se han establecido indicaciones precisas para determinar qué tipo de tratamiento debe usarse, por lo que ésta suele ser una cuestión de preferencia del cirujano.
En el presente informe, describimos el caso de un gran AAH en un hombre de 50 años de edad. Se estableció el diagnóstico preoperatoriamente y se trató con una estrategia quirúrgica y endovascular combinada. Además, revisamos los estudios publicados sobre AAH.
CASO CLÍNICOUn hombre de 59 años de edad sufrió una caída por las escaleras y experimentó una contusión cerebral. Durante su exploración en un hospital de distrito en otro lugar, se practicó una ecografía abdominal para excluir cualquier otra posible patología intraabdominal relacionada con el traumatismo.
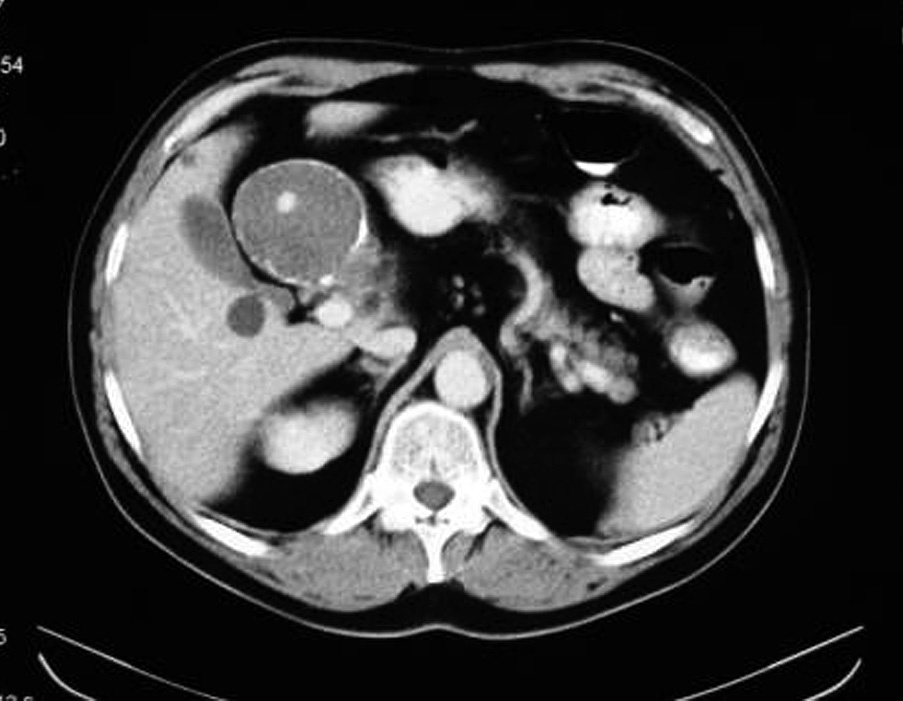
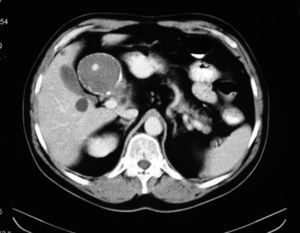
Esta exploración reveló un aneurisma, que medía alrededor de 5 cm de diámetro, y se originaba de la arteria hepática. La ecografía no mostró la presencia de líquido libre en la cavidad peritoneal. La exploración física y las pruebas de laboratorio sistemáticas fueron normales, y el paciente no presentaba ictericia. El abdomen no era doloroso y el paciente no tenía antecedentes de intervenciones quirúrgicas intraabdominales, traumatismos abdominales o intervenciones endoscópicas. La tomografía computarizada con realce de contraste (TC) confirmó la presencia de un AAH, que incluía la arteria hepática común (7 cm de diámetro), la arteria hepática común (7 cm de diámetro), un aneurisma de la areteria hepático izquierda (4 cm de diámetro), y un aneurisma de la arteria hepática derecha (4 cm de diámetro) sin extensión intraparenquimatosa pero que alcanzaba el hilio hepático (fig. 1). Se aconsejó al paciente que se sometiera a un tratamiento quirúrgico y se le remitió a nuestro hospital para un tratamiento adicional.
Fig. 1. Tomografía computarizada (TC) preoperatoria que demuestra un gran aneurisma de la arteria hepática.
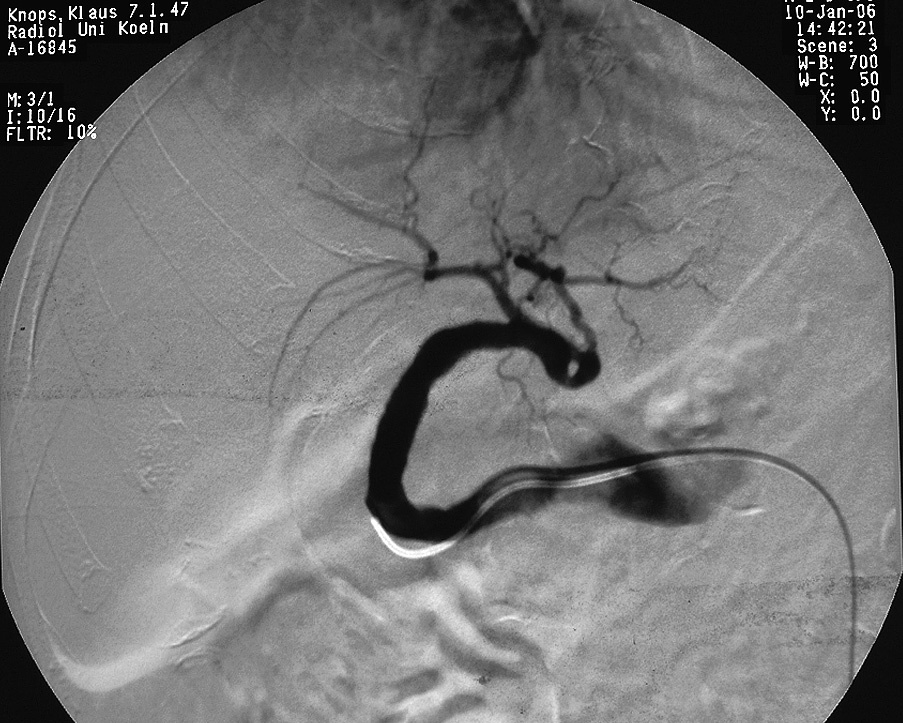
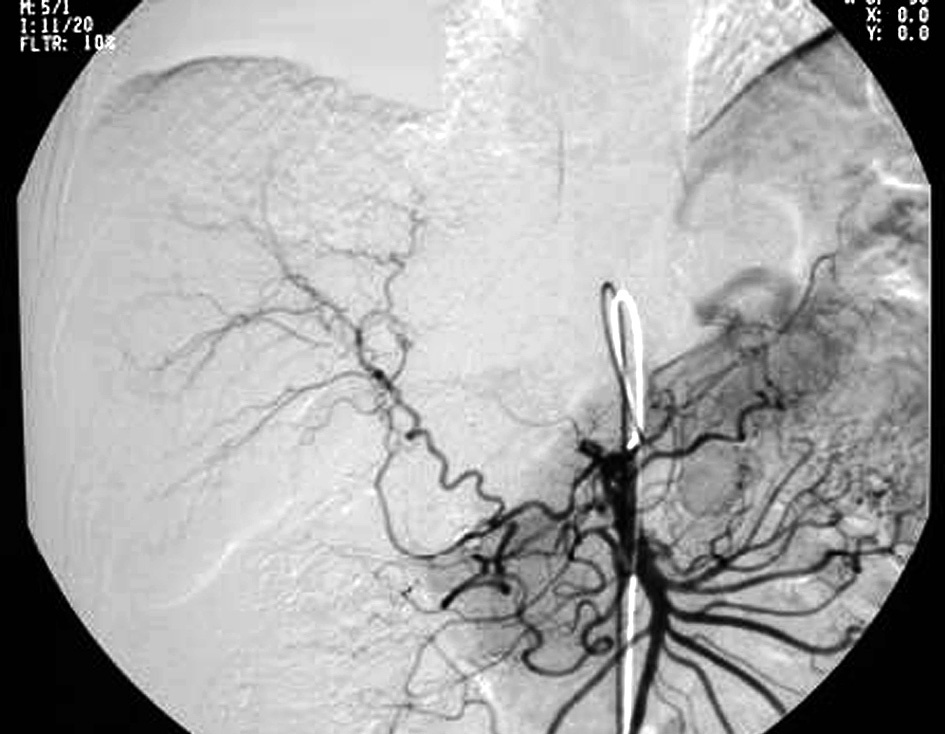
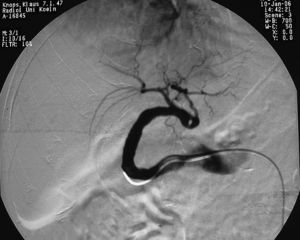
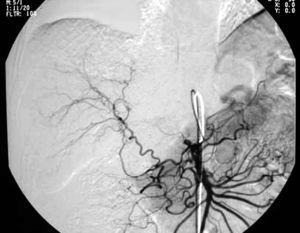
Se practicó una aortografía con arteriografía del eje celíaco. El aneurisma surgía del origen de la arteria hepática común e incluía la arteria hepática común y las arterias hepática izquierda y derecha. El aneurisma entero tenía una morfología fusiforme, y la luz perfundida medía 3-4 cm de diámetro (fig. 2). Pequeñas ramas colaterales que se originaban de la arteria mesentérica superior garantizaban el riego arterial del lóbulo hepático derecho (fig. 3). La arteria gastroduodenal estaba ocluida. Las arterias mesentéricas superior, esplénica y renal izquierda y derecha eran normales. La mesentericoportografía indirecta era normal desde un punto de vista morfológico y hemodinámico.
Fig. 2. Angiografía del aneurisma de la arteria hepática. El aneurisma surgía del origen de la arteria hepática común e incluía la arteria hepática común y la arteria hepática izquierda y derecha. Todo el aneurisma tenía una morfología fusiforme y la luz perfundida medía 3-4 cm de diámetro.
Fig. 3. El riego arterial del glóbulo hepático derecho quedó garantizado por las ramas de pequeño calibre que se originaban de la arteria mesentérica superior.
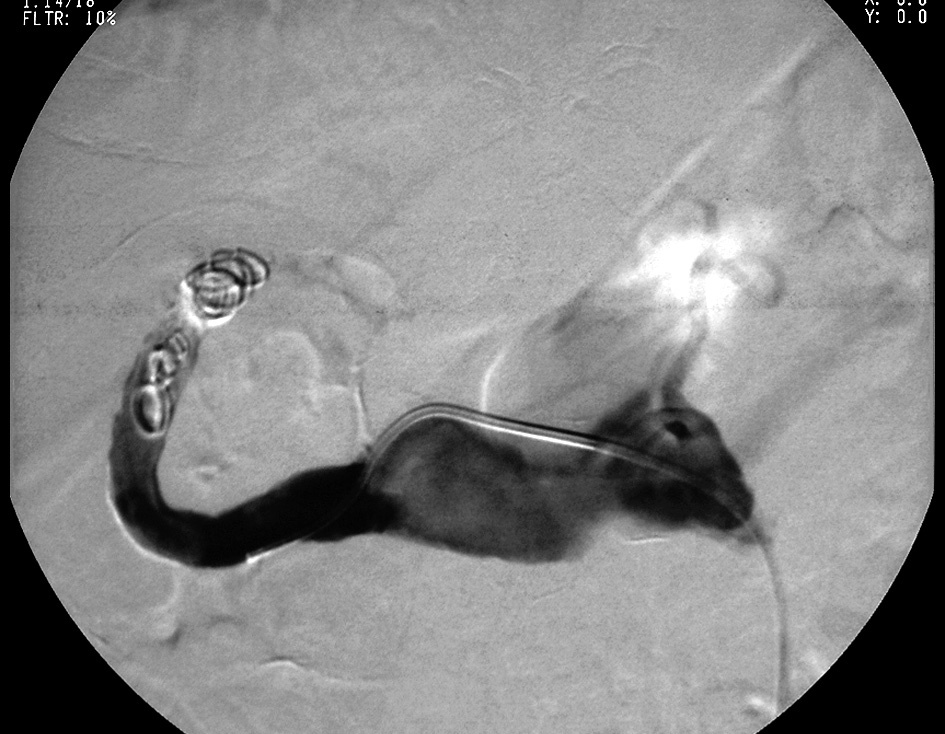
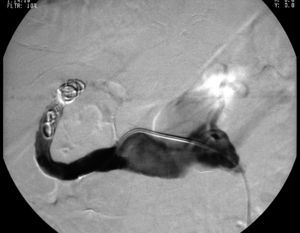
Con el objetivo de reducir la hemorragia digestiva distal efectuamos un procedimiento endovascular y quirúrgico abierto combinado. En primer lugar se embolizó la porción distal del aneurisma hepático a través de un abordaje transfemoral percutáneo. Se utilizaron diversas espirales combinadas con una inyección de Ethibloc (Ethicon, Hamburgo, Alemania), un adhesivo líquido (fig. 4). Después de este procedimiento, el paciente fue trasladado a la sala. Las extracciones seriadas de sangre después de la intervención demostraron una concentración de hemoglobina y una función hepática normales.
Fig. 4. Angiografía hepática selectiva después de la embolización satisfactoria con espiral de la arteria hepática mostrada en proyección anteroposterior. La tomografía computarizada y la arteriografía celíaca selectiva (proyección oblicua anterior izquierda) demostraron un aneurisma de la arteria hepática común. Obsérvese la presencia de un aneurisma concomitante de la aorta abdominal.
A los 6 días del procedimiento, se practicó una resección quirúrgica del aneurisma mediante una laparotomía transversa. Se efectuó la ligadura de la arteria gastroduodenal, y se estableció un control de las arterias hepática común, común, izquierda y derecha. Acto seguido, se abrió el aneurisma. Se escindieron sus paredes anteriores y se conservaron para examen bacteriológico e histológico. El extremo distal se suturó. Durante la disección, se identificaron diversas arterias de pequeño calibre con un recorrido paralelo a la arteria hepática que se preservaron cuidadosamente dado que se supuso que eran vasos colaterales.
El curso postoperatorio del paciente se desarrolló sin incidentes y fue dado de alta del hospital el séptimo día postoperatorio. El examen bacteriológico de la pared del aneurisma no reveló la presencia de bacterias. El examen histológico confirmó el diagnóstico de degeneración arteriosclerótica Los exámenes con eco-Doppler color a las 6 y 12 semanas postoperatorias y a los 6 meses demostraron una perfusión hepática normal.
DISCUSIÓNEpidemiologíaLa edad media de los pacientes con AAH es de 40 años, con un cociente hombres:mujeres de 2:16,7. Alrededor del 80% de estos aneurismas son extrahepáticos, afectando el 63% a la arteria hepática común, 28% a la arteria hepática derecha, 5% a la izquierda y 4% tanto a la izquierda como a la derecha7. El 20% restante de aneurismas son intrahepáticos, afectando en general a la arteria hepática derecha7. En el 31 y 42% de los pacientes con aneurismas hepáticos, respectivamente, se observan aneurismas concomitantes dentro de la circulación visceral y no visceral8. Los AAH tienen numerosas etiologías (tabla I).
Tabla I. Etiología del AAH en orden decreciente6,22,43-49
DiagnósticoNo se han descrito hallazgos físicos patognomónicos de los AAH. Alrededor del 60% son sintomáticos. En estos casos, los hallazgos más frecuentes son: dolor epigástrico o en el cuadrante superior derecho, seguido de hemorragia gastrointestinal e ictericia9. El riesgo de rotura esvariable a partir de los estudios publicados, fluctuando del 20 al 80%10. En la actualidad no se dispone de datos que correlacionen el tamaño de la lesión con la probabilidad de rotura7. La mortalidad asociada con ésta oscila entre el 21 y 35%11.
Diversas técnicas de diagnóstico por la imagen pueden contribuir al diagnóstico de esta entidad. La ecografía se utiliza para el diagnóstico inicial, el estudio de la vascularización hepática y la evaluación de la tríada portal. Revela una formación hipoecoica que puede ser pulsátil y relacionada con las estructuras vasculares12. La TC y la resonancia magnética (RM) pueden mostrar una lesión en el ligamento gastroduodenal y contribuyen a describir el curso del vaso antes del tratamiento. Se utilizan para definir las dimensiones de los aneurismas, para distinguir entre la luz real y el trombo parietal, para revelar los signos de fisura o rotura inicial, y para determinar la relación con las estructuras vecinas. La angiografía por sustracción digital se utiliza para mostrar los vasos nutricios, fístulas o múltiples aneurismas o para confirmar el diagnóstico antes de la embolización. Además, evalúa la viabilidad de una ligadura quirúrgica o percutánea sin la necesidad de reconstruir la vascularización y, por lo tanto, evitando la isquemia del parénquima hepático. La colangiografía y la esofagogastroduodenoscopia (EGD) pueden mostrar la compresión de los vasos del desfiladero torácico y del árbol biliar13.
Estrategias de tratamientoPara el tratamiento del AAH están disponibles diversas posibilidades. Aunque la corrección quirúrgica de estas lesiones sigue siendo el patrón de referencia, las técnicas endoluminales ofrecen una alternativa viable. La elección de la modalidad de tratamiento depende de la presentación clínica, localización anatómica y características morfológicas (sacular o fusiforme, con o sin cuello) del aneurisma, factores de riesgo asociados, y estado general del paciente (sintomático o asintomático, con buena o mala salud general). De acuerdo con los estudios publicados14,15, se considera una intervención en pacientes con lesiones asintomáticas > 2 cm de diámetro o un crecimiento rápido de su tamaño, síntomas atribuibles a la lesión y mujeres en edad fértil. Debido al mayor riesgo de rotura, también se recomienda la reparación para las lesiones asintomáticas siguientes: 1) aneurismas hepáticos en pacientes con periarteritis nudosa o displasia fibromuscular, 2) pseudoaneurimas intrahepáticos.
Las opciones de tratamiento quirúrgico abierto para el AAH incluyen la ligadura, escisión, injerto venoso, injerto sintético y resección hepática16. Los aneurismas intrahepáticos pueden tratarse con resección, ligadura o embolización17. Tres aspectos determinan las opciones de tratamiento quirúrgico abierto para esta entidad: la localización anatómica, estado general del paciente y tamaño del aneurisma.
Localización anatómica.
Las opciones de tratamiento quirúrgico abierto para los AAH están determinadas predominantemente por la localización anatómica. Para los aneurismas proximales a la arteria gastroduodenal, la escisión con ligadura proximal y distal puede ser suficiente puesto que la arteria gastroduodenal sirve de vaso colateral para el suministro arterial al hígado12,18. En diversos informes sobre necrosis hepática central después de la ligadura de lesiones hepáticas proximales, se ha sugerido la reconstrucción arterial con injerto autólogo para todos los pacientes de bajo riesgo, en particular cuando la arteria gastroduodenal es pequeña19. Se ha sugerido que, para evaluar los cambios de color en el parénquima hepático antes de la ligadura definitiva, la oclusión temporal de la arteria hepática es un adyuvante intraoperatorio útil; pero todavía no disponemos de pruebas que lo respalden o descarten.
Cuando el aneurisma se localiza distalmente al origen de la arteria gastroduodenal, se dispone de diversas opciones tanto para el tratamiento electivo como urgente. El riesgo de isquemia hepática se reduce a un mínimo restaurando el flujo arterial del hígado. Esto se obtiene mediante una endoaneurismorrafia con restauración de la luz, escisión con una anastomosis terminoterminal, escisión con interposición de un injerto autólogo o protésico, escisión con anastomosis esplenohepática, derivación arterial aortohepática o interposición de un injerto con reimplantación de la arteria gastroduodenal20. La evaluación intraoperatoria del efecto de la ligadura de la arteria hepática puede efectuarse con una observación en busca de cianosis hepática durante un período de prueba de oclusión20. Otros autores han recomendado una escisión, acompañada de la resección del área del hígado irrigada por el vaso afectado, cuando no puede restaurarse el flujo21.
Sin embargo, en diversos informes de ligadura satisfactoria de un AAH distal a la arteria gastroduodenal se documenta que no siempre es necesario restablecer el flujo sanguíneo arterial22,23. Los estudios anatómicos han revelado que en el 45% de la población están presentes colaterales, lo que significa que la ligadura de la arteria hepática común no privará de sangre arterial la circulación he-pática23-26.
En el caso descrito en el presente informe, durante la escisión de la pared anterior del aneurisma para la evaluación bacteriológica e histológica, se identificaron numerosas arterias de pequeño calibre suprayacentes al aneurisma, con un recorrido hacia el hilio hepático en el epiplón menor. Estos vasos se preservaron cuidadosamente porque se supuso que eran colaterales. Es posible que se hubieran desarrollado como respuesta a la oclusión parcial de la arteria hepática por el trombo del aneurisma. Si el vaso ya está trombosado por completo, el problema se obvia porque, naturalmente, dicho vaso ya no es decisivo para la vida y puede escindirse sin riesgos. Es posible que la oclusión lenta a partir de la trombosis facilite en cierto grado la lenta expansión de colaterales hasta que, por sí solas, son capaces de irrigar por completo el órgano.
No se recomienda practicar la ligadura de la arteria hepática en presencia de cirrosis o de cualquier otra hepatopatía grave. Después de la interrupción de la arteria hepática común o derecha, puede producirse una necrosis de la vesícula biliar; por consiguiente, debe practicarse simultáneamente una colecistectomía27. Las opciones quirúrgicas abiertas para el tratamiento de los aneurismas intrahepáticos son limitadas, con frecuencia requiriendo la resección del parénquima hepático afectado.
Se ha descrito que la embolización arterial transcatéter es un procedimiento sin riesgo y eficaz con apenas morbilidad28 para los aneurismas y pseudoaneurismas intrahepáticos28-30. Los criterios de inclusión de este procedimiento incluyen la adecuación anatómica, la ausencia de contraindicaciones de la administración de contraste intravenoso, un cuello proximal y distal suficiente si se requiere la colocación de un stent, un calibre y curso suficiente de los vasos que permitan la colocación sin riesgos del catéter y una circulación colateral suficiente al órgano diana para la embolización con espiral y la permeabilidad del sistema porta.
La embolización se ha recomendado para los aneurismas que afectan a la arteria hepática común distal a la arteria gastroduodenal y, en particular, para las lesiones en lugares que apenas son accesibles al tratamiento quirúrgico, como los aneurismas intrahepáticos y los aneurismas que afectan a la arteria gastroduodenal, arteria pancreaticoduodenal, arterias gastroepiploicas, arteria mesentérica superior o arteria mesentérica inferior. La embolización endovascular no siempre es viable desde un punto de vista técnico31. En estos casos, se ha demostrado que la embolización transhepática percutánea directa es un método práctico de tratamiento32, en particular en los casos de arterias de calibre muy pequeño33, anatomía difícil31,32, ligadura o embolización arterial previa, o disección de la íntima34. Para las lesiones intrahepáticas, la embolización utilizando espirales, microesferas o adhesivo acrílico es el método de elección debido a su eficacia y porque no requiere una resección del parénquima hepático. Cuando es posible la cateterización selectiva de las arterias aferente y eferente, la tasa de eficacia de la embolización transcatéter varía del 70 al 100%29,35, fluctuando las tasas de morbilidad del 14 al 25%36-38. No obstante, la mayoría de las series han sido apequeña escala y con un seguimiento breve.
Sólo en unos pocos casos se describe la exclusión del pseudoaneurisma hepático con un stent recubierto. La mayoría de los casos clínicos publicados ha resultado técnicamente eficaces Los datos a largo plazo sobre el uso de injertos con stent en los vasos viscerales son muy limitados y, en consecuencia, no pueden recomendarse como opción de tratamiento primario de los AAV39-42.
CONCLUSIÓNDebido a la elevada variabilidad anatómica del riego arterial del hígado, la estrategia de tratamiento de los AAH ha de determinarse individualmente en cada caso. El tratamiento con una estrategia quirúrgica y endovascular combinada puede reducir el riesgo de isquemia y morbilidad hepática.
Presentado en el 22.º congreso de la German Society of Vascular Surgery, Mülheim an der Ruhr, Alemania, 8 de septiembre de 2006.
Correspondencia: Thomas Luebke, MD, Division of Vascular Surgery, University of Cologne, Joseph-Stelzmann-Strasse 9, 50924 Colonia, Alemania. Correo electrónico: thomas_luebke@yahoo.de
Ann Vasc Surg. 2007;•:1-6 DOI: 10.1016/j.avsg.2007.06.002©Annals of Vascular Surgery Inc. Publicado en la red: ••,•