Se ha recomendado el uso de estimulación de la médula espinal (EME) para el tratamiento del dolor isquémico y la prevención de las amputaciones en pacientes con isquemia crítica de la extremidad (ICE) inoperable, aunque los datos sobre sus beneficios son conflictivos. En diversos artículos publicados, se han descrito efectos aparentemente diferentes del tratamiento en distintos subgrupos. El objetivo del presente estudio fue analizar los datos existentes sobre eficacia de la EME y clarificar los criterios de preselección. Se han identificado cinco ensayos aleatorizados con un número total de 332 pacientes. Las variables primarias analizadas fueron la mortalidad y la supervivencia de la extremidad. En el ensayo multicéntrico aleatorizado a mayor escala (n=120), que comparó el tratamiento EME con el mejor tratamiento médico solo en pacientes con ICE inoperable, determinamos la incidencia de amputación y su relación con diversos factores de riesgo predefinidos. Utilizamos un análisis de Kaplan-Meier y una regresión de Cox para cuantificar los efectos pronósticos y los efectos diferenciales del tratamiento. El metaanálisis deparó un riesgo relativo de amputación de 0,79 y una diferencia de riesgo de –0,07 (p=0,15). El análisis de factores de riesgo reveló claramente que los pacientes con lesiones cutáneas isquémicas (ulceraciones o gangrena) tuvieron un peor pronóstico (es decir, mayor riesgo de amputación) (riesgo relativo 2,30, p=0,01). No observamos interacciones significativas entre este factor pronóstico (o cualquier otro) y el efecto de la EME. El análisis no indicó que un subgrupo de pacientes pudiera beneficiarse específicamente de la EME. El metaanálisis, que incluyó todos los datos aleatorizados, muestra pruebas insuficientes de una mayor eficacia del tratamiento EME comparado con el mejor tratamiento médico solo. Aunque algunos factores proporcionan información pronóstica, por lo que respecta al riesgo de amputación en pacientes con ICE, no se dispone de datos suficientes que respalden un efecto más favorable del tratamiento en ningún grupo.
El éxito o fracaso del tratamiento, al igual que otras variables, determina la evolución y pronóstico de los pacientes con isquemia crítica de la extremidad1-3 (ICE). Los estudios prospectivos proporcionan una excelente base para identificar los factores de riesgo de amputación. En la práctica moderna de la cirugía vascular, en pocos estudios se ha abordado la historia natural de este proceso. A partir de encuestas y estudios más antiguos en pacientes en los que no pudo efectuarse reconstrucción arterial por diversas razones, se dedujo que fue necesaria una amputación mayor de la extremidad en el 60-80% al cabo de un año1,4-9. En una tentativa de reducir esta elevada incidencia de amputación, diversos autores han recomendado el uso de estimulación de la médula espinal (EME) para pacientes con el proceso en los que no es posible una reconstrucción vascular10-15.
La EME incluye la implantación de un marcapasos con activación del electrodo epidural de los cordones posteriores de la médula espinal. La estimulación a nivel de T10-L1 induce parestesias en la extremidad inferior, lo que alivia el dolor isquémico. El cambio del tono simpático y el aumento del flujo sanguíneo nutricional se han postulado como posibles mecanismos de su mejora clínica. Desde 1976, se han publicado múltiples artículos10-17 sobre la supuesta eficacia de la EME en diversas vasculopatías obstructivas periféricas graves. Se ha descrito que la técnica mejora la supervivencia de la extremidad en caso de ICE11,13-16,18,19 (inoperable). No obstante, en estos artículos se describían principalmente series de pacientes sin un grupo de control. En un ensayo aleatorizado, a pequeña escala (51 pacientes), efectuado en Suecia20, sólo se demostró una disminución de la tasa de amputación como respuesta a la EME en un subgrupo de pacientes sin hipertensión arterial. En otros estudios, incluido el ensayo ESES multicéntrico, aleatorizado, efectuado en Holanda21-24, no se demostró un efecto significativo sobre el salvamento de la extremidad. En revisiones recientes se sugirió que la EME podría producir efectos positivos en pacientes seleccionados25,26.
En el presente artículo, analizamos las pruebas sobre este tratamiento en pacientes con isquemia crítica de la extremidad, con especial atención a los diversos factores de riesgo de amputación y al efecto del tratamiento en distintos subgrupos de pacientes.
MétodosDiseño de estudio del ensayo aleatorizado (ensayo ESES)En otra publicación se han descrito el diseño y los procedimientos del ensayo de manera detallada27. Los pacientes candidatos presentaban ICE sin posibilidad de reconstrucción vascular. Los criterios de inclusión fueron dolor en reposo persistente durante más de 2 semanas o lesiones cutáneas isquémicas, una presión en el tobillo inferior a 50 mmHg o, en pacientes con diabetes y vasos no compresibles, ausencia de pulsos distales palpables. Desde 1991 hasta 1996, se incluyeron 120 pacientes en 17 hospitales de Holanda. Aprobaron el protocolo del estudio los comités de investigación de cada centro y los pacientes dieron su consentimiento informado por escrito. Además del mejor tratamiento médico, las estrategias de tratamiento EME (“tratamiento EME”) y el mejor tratamiento medico solo (“tratamiento estándar”) se asignaron aleatoriamente a los pacientes candidatos. La aleatorización se estratificó para diabetes, hospital y presión distal.
TratamientoEl tratamiento estándar incluyó analgésicos, fármacos antitrombóticos (aspirina y cumarina), fármacos hemorreológicos (como la pentoxifilina, buflomedilo y ketanserina), cuidados locales de la herida y antibióticos si estuvo indicado. Se utilizó lista de fármacos recomendados pero no una pauta fija de tratamiento. Se registró el uso de analgésicos y se cuantificó mediante una escala de cuantificación de la medicación28 (ECM). No se excluyeron la simpatectomía lumbar química y los prostanoides pero sólo se usaron en tres pacientes. Los pacientes asignados al tratamiento EME recibieron adicionalmente un sistema implantable de estimulación de la médula espinal. Se implantó un electrodo cuadripolar (Medtronic, Mineápolis, Estados Unidos) en el espacio epidural y se conectó con un generador de pulsos Itrell II (Medtronic). Inicialmente ambas pautas de tratamiento estaban destinadas a la supresión del dolor. Durante el seguimiento, se optimizó el efecto del tratamiento alterando la medicación, los ajustes de estimulación, o ambos. Un neurocirujano o un anestesista revisaron con regularidad a los pacientes tratados con EME.
SeguimientoTodos los pacientes se evaluaron a 1, 3, 6, 12, y 18 meses después de la aleatorización y al término del estudio. Entre las visitas de seguimiento, los pacientes acudieron al hospital tan a menudo como fue necesario. La principal variable analizada fue la supervivencia de la extremidad a los 2 años. Ésta se definió como la ausencia de amputación mayor29.
Factores pronósticosAdemás de los parámetros demográficos, como la edad y el sexo, se registraron las variables de comorbilidad: diabetes, tabaquismo, hipertensión arterial, antecedentes de infarto de miocardio, accidente vascular cerebral (AVC) o episodios isquémicos transitorios (EIT). Las reconstrucciones vasculares previas se resumieron como el número de procedimientos vasculares y endovasculares de la extremidad afectada. Los parámetros clínicos incluyeron la presencia de lesiones cutáneas isquémicas (ulceraciones y gangrena), presión del tobillo e índice de presión tobillo:brazo (IPTB). No sólo estudiamos el valor pronóstico de estas variables para el riesgo de amputación sino también su influencia potencial en el efecto del tratamiento. En un análisis multivariante, el efecto del tratamiento se estimó tras el ajuste simultáneo de los factores de riesgo que surgieron de nuestro análisis con un valor de p<0,20 o que se consideraban importantes en los estudios publicados1,2,13,20,30-35.
MetaanálisisEfectuamos una búsqueda en la base de datos PubMed, en Google y los registros de ensayos controlados. Se usó una combinación de los medical subject headings (MSH) y las palabras clave: “estimulación de la médula espinal”, “vascular” y “vasculopatía periférica”. Esta estrategia de búsqueda permitió identificar 417 estudios, sobre todo series de pacientes sin un grupo de control (n=9-177). Los estudios candidatos eran ensayos aleatorizados, controlados, que comparaban la EME con cualquier tratamiento conservador de la vasculopatía periférica grave, crónica (ICE) en pacientes adultos. La combinación de la estrategia de búsqueda mencionada previamente con “ensayo aleatorizado” generó seis artículos sobre ensayos aleatorizados20,22-24,36,37. De estos, tres describían la misma población de pacientes24,36,37. Se revisaron las bibliografías de los manuscritos para identificar otros artículos potencialmente candidatos a su inclusión. Se identificó un artículo adicional en el que se describía una población diferente de pacientes, publicado en un libro21. En consecuencia, se dispuso de cinco estudios aleatorizados, con poblaciones de pacientes que variaron desde 37 a 12020-24. En un estudio prospectivo19 se describían 112 pacientes que recibieron o no recibieron EME en función de las determinaciones transcutáneas de PO2. Este estudio fue un ensayo sobre pronóstico en el que se determinó los valores de PO2 transcutánea pero no una comparación adecuada de tratamientos. En un estudio11 (n=34) se usaban controles históricos y también se excluyó.
Las principales variables analizadas fueron la mortalidad y la supervivencia de la extremidad. La evaluación de la calidad incluyó diversos criterios: el informe de los ajustes y localizaciones cuando se obtuvieron los datos y las fechas que definieron el período de inclusión, aleatorización (si la secuencia fue verdaderamente aleatoria, p. ej., generada por ordenador, tablas de números aleatorios), ocultación de la asignación (si se describió un método de aleatorización que no permitía al investigador o al participante conocer o influir en el grupo de intervención antes de la inclusión de un participante candidato), y la inclusión y el seguimiento de pacientes completados según el protocolo. En ningún ensayo se utilizó enmascaramiento después de la asignación. Clasificamos el riesgo de sesgo como reducido en un estudio24 (se cumplieron todos los criterios), moderado en dos20,22 (se cumplieron uno o más criterios) y alto en dos21,23 (no se cumplieron los criterios).
El metaanálisis contenía los datos íntegros de los cinco estudios aleatorizados disponibles20-24. Todos los estudios asignaron a pacientes con ICE no candidatos para una reconstrucción vascular (adicional). El tratamiento de control consistió en un tratamiento medico óptimo más o menos similar entre estudios, aunque el uso de medicación sólo se observó y describió adecuadamente en uno24. En el estudio alemán, se administró tratamiento adicional con prostaglandinas a ambos grupos y la variable primaria analizada fue la curación de la úlcera22. Todos los autores describían tasas de mortalidad y tasas de amputación mayor (n=5 a los 12 meses, n=4 a los 18 meses, n=3 a los 24 meses).
Análisis estadístico del ensayo aleatorizadoTodos los datos se registraron en formularios estandarizados y se introdujeron en una base de datos diseñada al efecto. El análisis de las variables clínicas siguió el principio por intención de tratar e incluyó a todos los pacientes que se sometieran a aleatorización. La supervivencia de los pacientes y de la extremidad se estimó con el método de Kaplan-Meier y los tratamientos se compararon utilizando pruebas de log-rank. En el análisis de la supervivencia de la extremidad, se censuraron los pacientes en el momento de la muerte. Se utilizó un modelo de riesgos proporcionales de Cox para (1) el análisis con los factores pronósticos, (2) el análisis de las interacciones entre los factores pronósticos y el tratamiento. Se estimaron los cocientes de riesgo (CR) para cuantificar el efecto de los factores pronósticos. Cuando el CR fue>1, el riesgo de amputación o mortalidad fue mayor en presencia del factor pronóstico que en su ausencia. En los análisis multivariantes, seleccionamos los factores pronósticos con un valor de p<0,20 y la variable indicativa de tratamiento EME. Para todas las pruebas de hipótesis, se consideró estadísticamente significativo un valor de p<0,05.
Análisis estadístico del metaanálisisLos datos del metaanálisis se procesaron con el programa Review Manager (RevMan) y sus resultados se expresaron como riesgos relativos o diferencias de riesgo. Debido a la heterogeneidad clínica, metodológica y estadística de los estudios, se usaron modelos de efectos aleatorios. No efectuamos un análisis de sensibilidad debido al número reducido de ensayos incluidos.
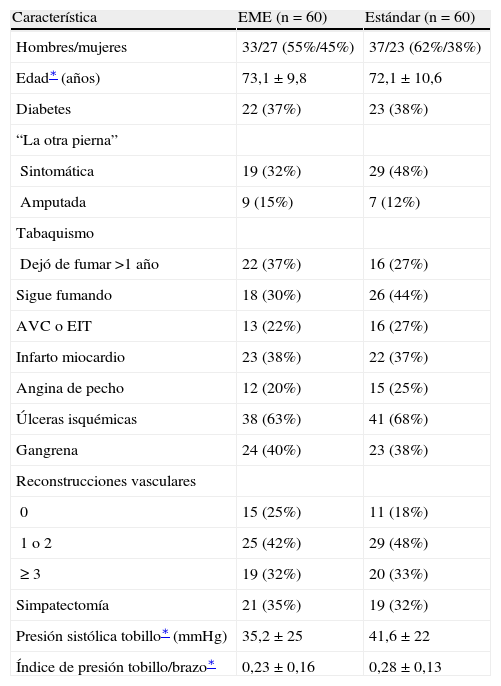
ResultadosEn el ensayo ESES, 60 pacientes fueron asignados aleatoriamente a recibir tratamiento EME y 60, al tratamiento estándar. Los grupos eran comparables desde un punto de vista de las características demográficas y clínicas (tabla I). El seguimiento mediano fue de 2 años (límites 244-1.171 días). La edad media fue de 72,6 años, casi el 40% de los pacientes eran diabéticos y, además del dolor en reposo, más del 60% presentaban ulceraciones o gangrena. Se identificó una extensa comorbilidad: el 24% de los pacientes habían experimentado un AVC o un EIT, el 37% un infarto de miocardio, el 23% episodios de angina de pecho y el 68% eran (ex) fumadores. Muchos pacientes se habían sometido a (múltiples) reconstrucciones vasculares de la extremidad afectada. La presión media del tobillo determinada mediante eco-Doppler era de 38 mmHg, y el IPTB medio era de 0,26.
Características basales del grupo de estimulación de la médula espinal (EME) y el de tratamiento estándar
| Característica | EME (n=60) | Estándar (n=60) |
| Hombres/mujeres | 33/27 (55%/45%) | 37/23 (62%/38%) |
| Edad∗ (años) | 73,1±9,8 | 72,1±10,6 |
| Diabetes | 22 (37%) | 23 (38%) |
| “La otra pierna” | ||
| Sintomática | 19 (32%) | 29 (48%) |
| Amputada | 9 (15%) | 7 (12%) |
| Tabaquismo | ||
| Dejó de fumar >1 año | 22 (37%) | 16 (27%) |
| Sigue fumando | 18 (30%) | 26 (44%) |
| AVC o EIT | 13 (22%) | 16 (27%) |
| Infarto miocardio | 23 (38%) | 22 (37%) |
| Angina de pecho | 12 (20%) | 15 (25%) |
| Úlceras isquémicas | 38 (63%) | 41 (68%) |
| Gangrena | 24 (40%) | 23 (38%) |
| Reconstrucciones vasculares | ||
| 0 | 15 (25%) | 11 (18%) |
| 1 o 2 | 25 (42%) | 29 (48%) |
| ≥ 3 | 19 (32%) | 20 (33%) |
| Simpatectomía | 21 (35%) | 19 (32%) |
| Presión sistólica tobillo∗ (mmHg) | 35,2±25 | 41,6±22 |
| Índice de presión tobillo/brazo∗ | 0,23±0,16 | 0,28±0,13 |
AVC: accidente vascular cerebral; EIT: episodios isquémicos transitorios.
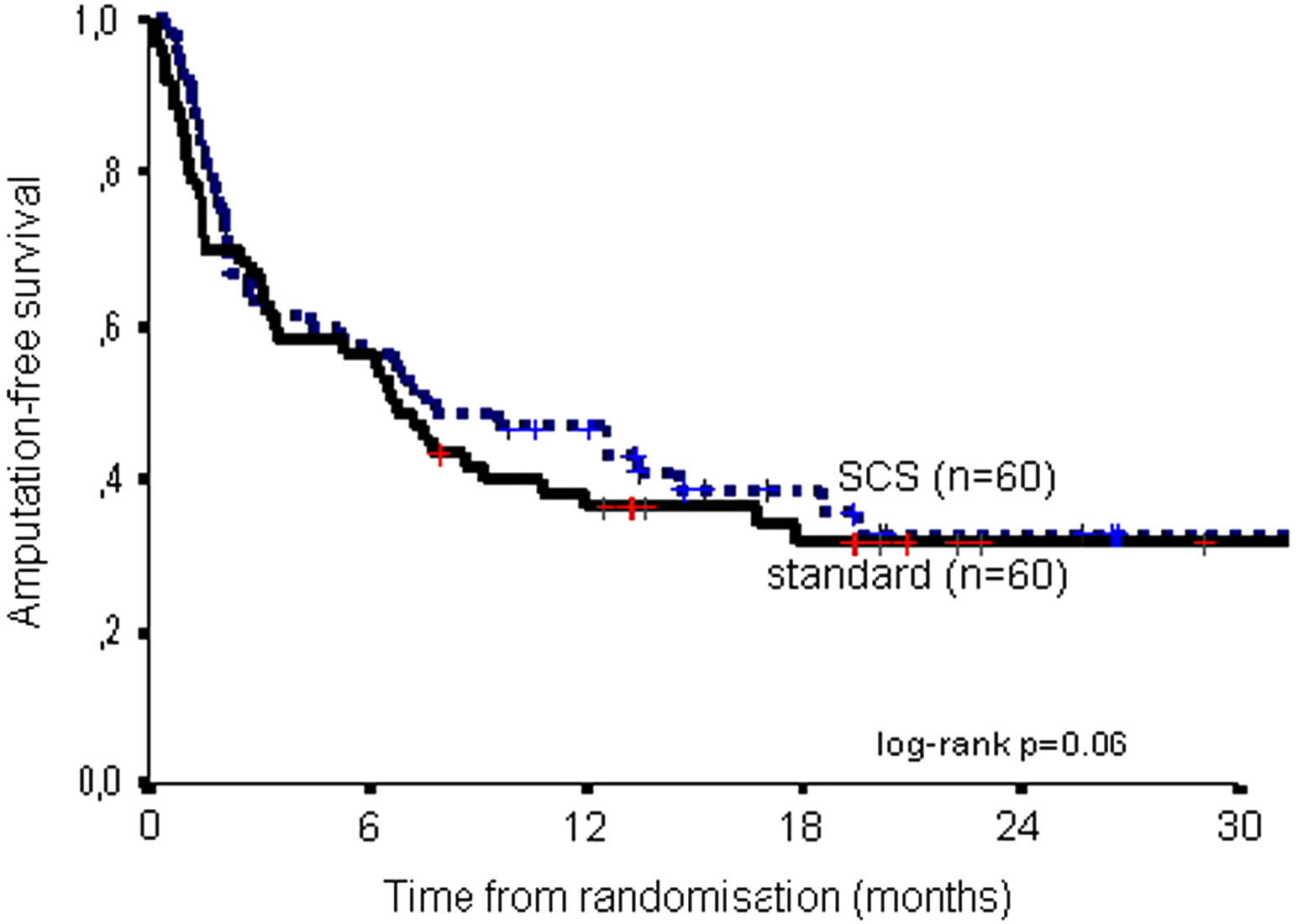
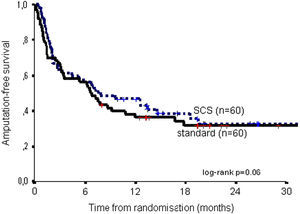
Estos datos se presentaron previamente. La mortalidad fue comparable en ambos grupos de tratamiento: a los 6 meses, el 17% en ambos grupos y a los 2 años, el 36% del grupo EME comparado con el 37% del grupo de tratamiento estándar (log-rank, p=0,96). A los 6 meses, la supervivencia de la extremidad era del 66% en el grupo de EME frente al 68% en el grupo de tratamiento estándar; a los 2 años, del 52% frente al 46% (log-rank, p=0,47). El riesgo relativo de amputación en el grupo EME comparado con el de tratamiento estándar fue de 0,81 (intervalo de confianza [IC] del 95%, 0,47-1,42). Como variable combinada, en la figura 1 se muestra la supervivencia libre de amputación.
Supervivencia libre de amputación para el grupo de tratamiento con estimulación de la médula espinal (EME) y estándar. Amputation-free survival: supervivencia libre de amputación; log-rank p=0.06: prueba del log-rank p=0,06; SCS (n=60): EME (n=60); standard (n=60): estándar (n=60); Time from randomisation (months): tiempo desde la aleatorización (meses).
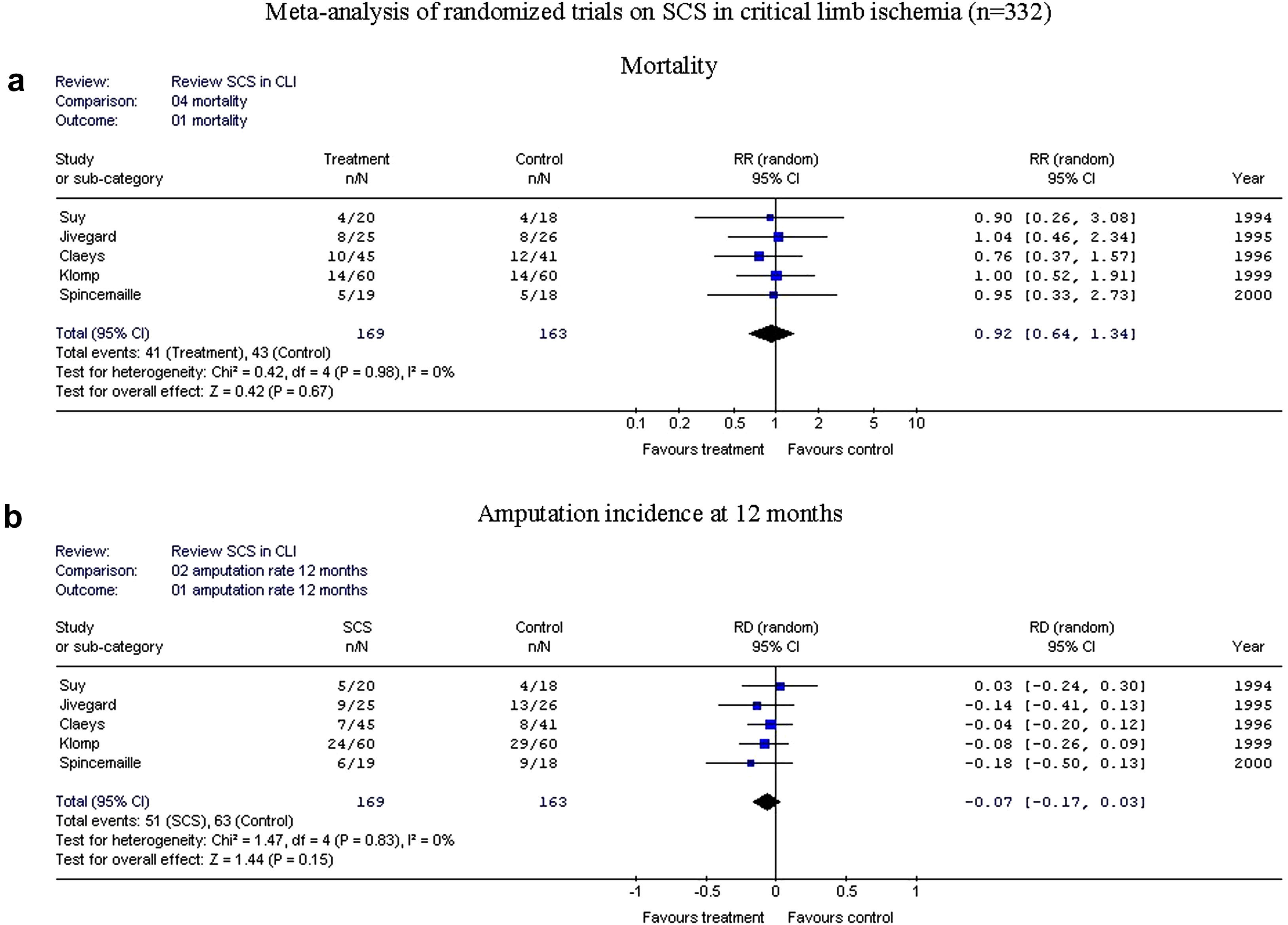
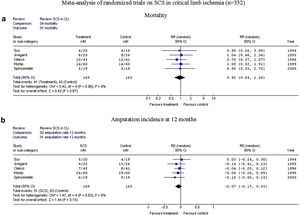
En los cinco ensayos aleatorizados se incluyeron 332 pacientes: 169 recibieron tratamiento EME, y 163 recibieron tratamiento de control. La mortalidad fue comparable en ambos grupos (41 de 169 comparado con 43 de 163, p=0,67). En la figura 2 se muestra el análisis de la supervivencia de la extremidad a los 12 meses (51 de 169 frente a 63 de 163, p=0,15), lo que generó un riesgo relativo de 0,79 (IC del 95%, 0,59-1,06) con una diferencia del riesgo absoluto de –0,07 (IC del 95%, –0,17 a +0,03).
Metaanálisis de los ensayos aleatorizados sobre estimulación de la médula espinal (EME) en la isquemia crítica de la extremidad (ICE) (n=332). Arriba, mortalidad; abajo, incidencia de amputación a los 12 meses. 02 amputation rate 12 months: 02 tasa de amputación a los 12 meses; Amputation incidence at 12 months: incidencia de amputación a los 12 meses; Comparison: 04 mortality: comparación: 04 mortalidad; Favours control: favorece al grupo de control; Favours treatment: favorece al tratamiento; Meta-analysis of randomized trials on SCS in critical limb ischemia (n=332): metaanálisis de los ensayos aleatorizados sobre EME en la isquemia crítica de la extremidad (n=332); Mortality: mortalidad; Outcome: 01 mortality: variable: 01 mortalidad; RD (random) Aleatorio IC del 95%; Review: Review SCS in CLI: revisión: revisión EME en ICE; RR (random) 95% CI: riesgo relativo (modelo de efectos aleatorios) intervalo de confianza del 95%; SCS: EME; Study or sub-category: estudio o subcategoría; Test for heterogeneity: Chi2=0.42, df=4 (P=0.98), I2=0%: prueba para la heterogeneidad: Chi2=0,42, grados de libertad (gl)=4 (p=0,98), I2=0%; Test for overall effect: Z=0.42 (P=0.67): prueba para el efecto global: Z=0,42 (p=0,67); Total (95% CI): total (intervalo de confianza del 95%); Total events: 41 (Treatment), 43 (Control): acontecimientos totales: 41 (tratamiento), 43 (control); Total events: 51 (SCS), 63 (Control): acontecimientos totales: 51 (EME), 63 (control); Treatment: tratamiento; Year: año.
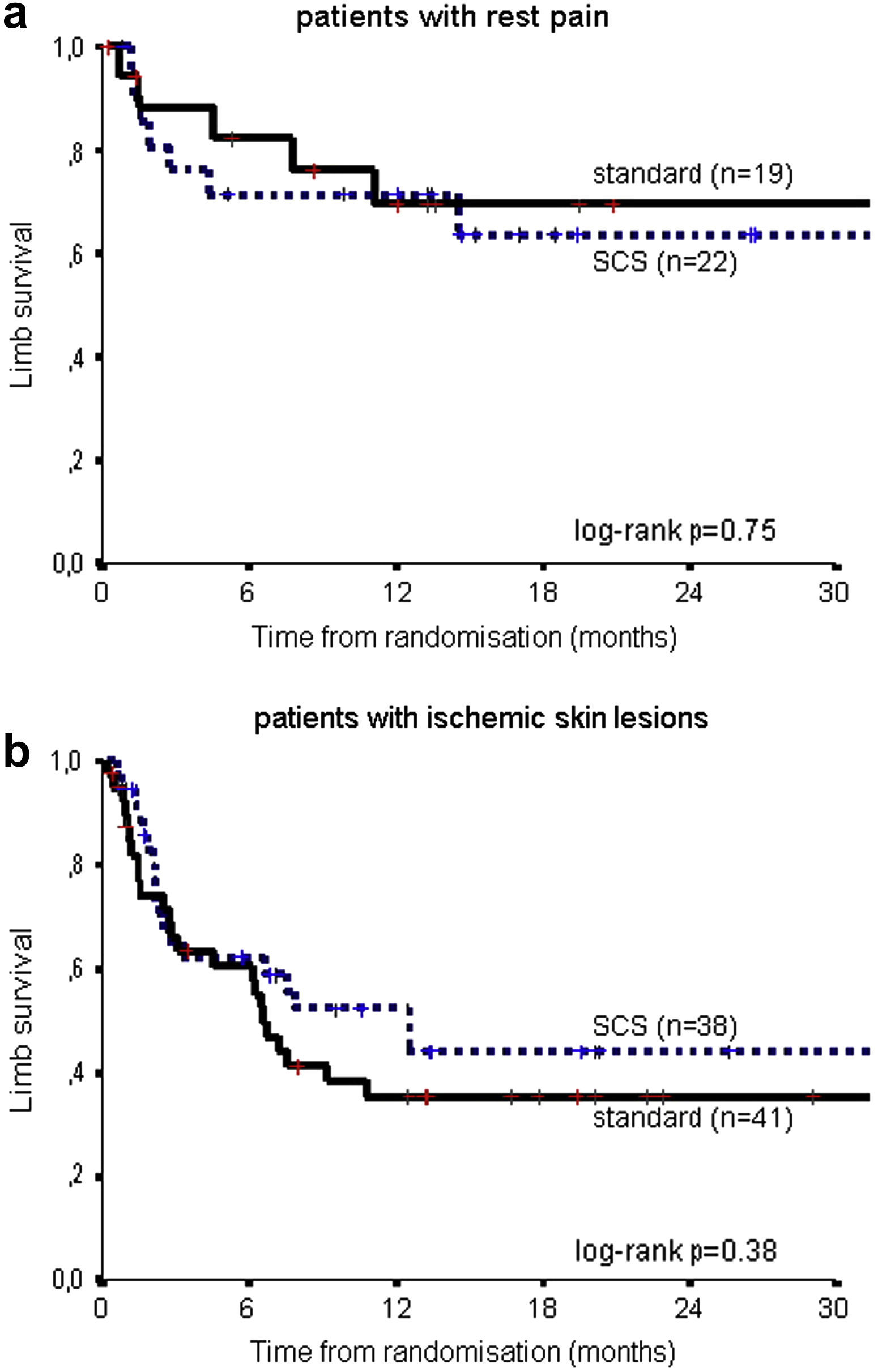
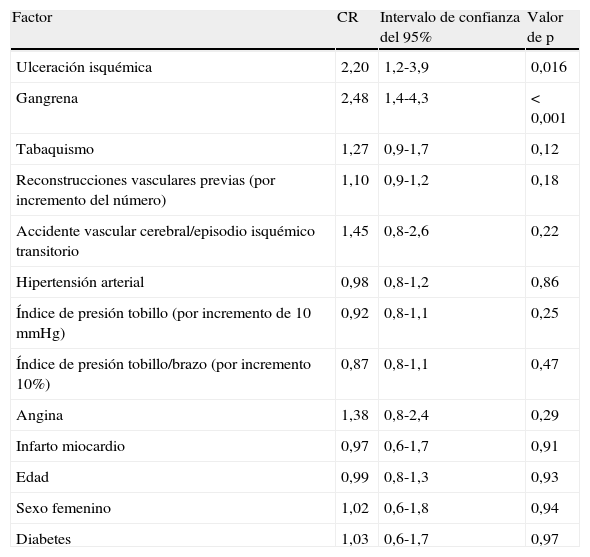
En la tabla II se resume el significado pronóstico de las variables estudiadas para el riesgo de amputación. En el análisis no se demostró una influencia pronóstica significativa para la edad, sexo, diabetes, hipertensión arterial, antecedentes de infarto de miocardio o síntomas vasculares cerebrales, reconstrucciones vasculares previas, presión del tobillo o IPTB. Un factor de riesgo con un efecto moderado fue el tabaquismo (CR=1,27, p=0,12). Obviamente, los pacientes con lesiones cutáneas isquémicas (ulceraciones o gangrena) tuvieron un peor pronóstico (es decir, mayor riesgo de amputación) (CR=2,30, p=0,01). En la figura 3, se muestra la supervivencia de la extremidad en ambos grupos de tratamiento para pacientes con dolor en reposo solo y con úlceras establecidas y gangrena. Para los grupos combinados de pacientes, a los 6 meses la supervivencia de la extremidad fue del 76% en aquellos con dolor en reposo y del 62% en aquellos con lesiones cutáneas isquémicas; a los 2 años, fue del 65% y 40%, respectivamente (p<0,01).
Cociente de riesgo (CR) de amputación con los valores de p para 14 variables predefinidas
| Factor | CR | Intervalo de confianza del 95% | Valor de p |
| Ulceración isquémica | 2,20 | 1,2-3,9 | 0,016 |
| Gangrena | 2,48 | 1,4-4,3 | < 0,001 |
| Tabaquismo | 1,27 | 0,9-1,7 | 0,12 |
| Reconstrucciones vasculares previas (por incremento del número) | 1,10 | 0,9-1,2 | 0,18 |
| Accidente vascular cerebral/episodio isquémico transitorio | 1,45 | 0,8-2,6 | 0,22 |
| Hipertensión arterial | 0,98 | 0,8-1,2 | 0,86 |
| Índice de presión tobillo (por incremento de 10 mmHg) | 0,92 | 0,8-1,1 | 0,25 |
| Índice de presión tobillo/brazo (por incremento 10%) | 0,87 | 0,8-1,1 | 0,47 |
| Angina | 1,38 | 0,8-2,4 | 0,29 |
| Infarto miocardio | 0,97 | 0,6-1,7 | 0,91 |
| Edad | 0,99 | 0,8-1,3 | 0,93 |
| Sexo femenino | 1,02 | 0,6-1,8 | 0,94 |
| Diabetes | 1,03 | 0,6-1,7 | 0,97 |
Supervivencia de la extremidad de acuerdo con el tratamiento (estimulación de la médula espinal [EME] frente a estándar) en los subgrupos de pacientes con dolor en reposo (arriba, n=41) y lesión cutánea isquémica (abajo, n=79). Limb survival: supervivencia de la extremidad; log-rank: prueba del log-rank; patients with ischemic skin lesions: pacientes con lesiones cutáneas isquémicas; patients with rest pain: pacientes con dolor en reposo; SCS: tratamiento EME; standard: tratamiento estándar; Time from randomisation (months): tiempo desde la aleatorización (meses).
Como se ha mencionado previamente, en el grupo de tratamiento EME el riesgo global de amputación no fue significativamente diferente comparado con el tratamiento estándar. Posteriormente se estimó el CR para el efecto del tratamiento con un ajuste para cada factor pronóstico. No se observaron desviaciones sustanciales a partir del efecto global según lo examinado por los términos de interacción de los factores pronósticos con el efecto del tratamiento.
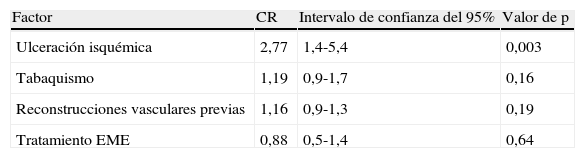
Análisis multivariablePor último, efectuamos un análisis multivariante para estimar el efecto del tratamiento tras la corrección simultánea de los factores pronósticos pertinentes. Los resultados se resumen en la tabla III. Los factores pertinentes se seleccionaron a partir del análisis de los factores de riesgo combinado con los estudios publicados disponibles34,38,39. Los factores de riesgo incluidos fueron el tabaquismo, lesiones cutáneas isquémicas y número de intervenciones vasculares previas. La presencia de ulceraciones y gangrena produjo un efecto potente sobre el riesgo de amputación (p=0,003). Cuando se ajustó para estas características basales, se estimó que el CR de amputación en el grupo de tratamiento EME comparado con el estándar era de 0,88 (p=0,64).
Influencia de los factores pronósticos y estimación del efecto del tratamiento en el análisis multivariante
| Factor | CR | Intervalo de confianza del 95% | Valor de p |
| Ulceración isquémica | 2,77 | 1,4-5,4 | 0,003 |
| Tabaquismo | 1,19 | 0,9-1,7 | 0,16 |
| Reconstrucciones vasculares previas | 1,16 | 0,9-1,3 | 0,19 |
| Tratamiento EME | 0,88 | 0,5-1,4 | 0,64 |
CR: cociente de riesgo; EME: estimulación de la médula espinal.
La conclusión de nuestro ensayo aleatorizado24 es que la EME no fue más eficaz que el mejor tratamiento médico solo en la prevención de amputaciones. Aún así, surge el debate sobre si un subgrupo de pacientes podría beneficiarse de este tratamiento. Se afirmó que “los mejores candidatos al procedimiento son los pacientes con dolor isquémico en reposo sin pérdida de tejido” o que “el tratamiento EME parece beneficiar a un subgrupo de pacientes con ICE”25,26,40. En una revisión sistemática41 se sugería una mejora de la supervivencia de la extremidad en pacientes tratados con EME y una expansión de la indicación de la ICE.
En esta revisión se incluyeron seis estudios19-24. Uno de ellos fue la serie no aleatorizado de Amann et al19, en el que los pacientes con ICE se clasificaron de acuerdo con las determinaciones transcutáneas de PO2 y si recibieron o no tratamiento basado en esta clasificación y una estimulación de prueba. Mas del 30% de los pacientes en el grupo de “control” (no EME) se sometieron a amputación al cabo de 2 semanas (¡!), lo que ilustra el intenso sesgo de selección. Éste debería considerarse un estudio sobre pronóstico basado en determinaciones transcutáneas de PO2 y no como una comparación entre tratamientos. Merece la pena mencionar que las curvas de supervivencia de la extremidad fueron comparables tras las semanas iniciales. Se excluyó del estudio a menor escala a los pacientes con “enfermedad de Buerger”21, lo que es injustificable y compromete la objetividad. El diagnostico no se especificó, no se aplicaron criterios clínicos42 (es decir, en este estudio no se cumplió el criterio de edad<45 años) y no fue un factor de estratificación. En los otros estudios aleatorizados, no fue un criterio de exclusión explícita (excepto en el estudio de Claeys)22, y no se dispone de datos de que el efecto del tratamiento EME, si produce alguno, sea particularmente diferente en pacientes con enfermedad de Buerger. Además, los datos seleccionados para la “tasa de amputación a los 12 meses” fueron incorrectos en ambos estudios. La principal conclusión de esta revisión, que la EME es significativamente mejor que el tratamiento conservador solo para obtener una reducción del riesgo de amputación, no está justificada. El metaanálisis de los cinco estudios aleatorizados disponibles produce una reducción del riesgo relativo de –0,07 (p=0,15). Las puntuaciones de calidad de vida y de dolor sólo se evaluaron en el ensayo aleatorizado a mayor escala24 y no mejoraron en los sometidos a EME.
Por consiguiente, ¿el tratamiento no produce efectos? Retrospectivamente, todos los estudios aleatorizados individuales se caracterizaron por una potencia insuficiente. Esto se debió principalmente a la presunción de que la supervivencia de la extremidad en el grupo de control sería mucho menor (en función de los datos de los estudios publicados, del 20-40% al año)1,4-9 y que se alcanzaría fácilmente una mejora del 20-30% de la supervivencia de la extremidad14,18,43-45. Sin embargo, los grupos de tratamiento conservador (médico) evolucionaron mucho mejor. Respaldan esta observación los datos de Marston et al46, que demuestran que, en la mayoría de los pacientes con insuficiencia arterial y úlceras crónicas no complicadas que no curan de la extremidad, puede obtenerse el salvamento de la extremidad cuando son tratados en un programa especializado de curación de las heridas, incluso en aquellos con un IPTB<0,50.
Partiendo de una supervivencia al año de la extremidad con el tratamiento estándar de al menos un 45%, una prueba del log-rank de una cola, con un tamaño de la muestra de n=120, se asocia a una potencia del 80% con un nivel de significación del 5% para detectar una diferencia del 18% (es decir, una mejora de la supervivencia de la extremidad hasta el 63%). Con un tamaño de la muestra de n=332, la diferencia detectable es del 11% (es decir, una supervivencia de la extremidad de hasta el 56%). El metaanálisis examinado para la equivalencia con una potencia del 80% y un nivel de significación del 5% permite una diferencia máxima del 10% a los 12 meses (utilizando una prueba de equivalencia de proporciones de una cola). En consecuencia, si se tiene en cuenta la exageración probable de los efectos del tratamiento debido a una ocultación poco clara de la asignación del tratamiento en algunos estudios47, el posible efecto beneficioso de la EME desde un punto de vista de la incidencia de amputación sería pequeño, muy probablemente del 5-7%. El número necesario a tratar para evitar una amputación sería de como mínimo 14, con un coste de más de 110.000 euros por extremidad salvada37,48 (alrededor de 200.000 euros por año de vida ajustado por calidad).
¿Puede identificarse un subgrupo de pacientes que en realidad podría beneficiarse de la EME? Este estudio confirma la impresión general de que la tasa de amputación es mayor en pacientes con ICE y lesiones cutáneas isquémicas que en aquellos con dolor en reposo sólo. Los factores pronósticos de amputación fueron la ulceración isquémica, gangrena y quizá el tabaquismo y el número de intervenciones vasculares previas. En un análisis multivariante, la presencia de lesiones cutáneas isquémicas resultó ser el factor de riesgo más importante. Sin embargo, no identificamos subgrupos con efectos del tratamiento EME significativamente diferentes (mejores o peores). A partir de los estudios iniciales, se implicó que este tratamiento podría ser una alternativa terapéutica beneficiosa, en particular en pacientes con gangrena establecida10,14,25,43. Esta idea surgió de la observación de que la tasa de amputación es mayor en pacientes con gangrena, lo que sugiere que la EME no produjo efectos de salvamento de la extremidad en ellos. Sin embargo, la obtención retrospectiva de los datos y la ausencia de un grupo de control bien definido limitan las tentativas de identificar factores de riesgo y especialmente factores que modifiquen los efectos del tratamiento. Como muestran los resultados de este estudio, la presencia de lesiones cutáneas isquémicas es un importante factor de riesgo de amputación. Si la EME produce efectos, el presente estudio sugiere que estuvieron especialmente presentes en pacientes con ulceraciones y gangrena (CR=0,75, p=0,30). Este hallazgo de subgrupo en sí no es lo suficientemente convincente para limitar este tratamiento a pacientes con lesiones cutáneas isquémicas. Por otra parte, si el tratamiento produce un efecto relativo constante entre subgrupos, el beneficio absoluto será mayor en aquellos con los mayores riesgos (es decir, con lesiones cutáneas isquémicas).
La misma línea de razonamiento se aplica a las evaluaciones microcirculatorias. Aunque diversas clasificaciones y valores de corte proporcionan buena información pronóstica por lo que respecta al riesgo de amputación en pacientes con ICE49, esto no se asocia necesariamente con efectos diferenciales del tratamiento. Si es previsible un mayor beneficio de la EME en pacientes con este proceso y una reserva de flujo preservada, este efecto debe examinarse de manera aleatorizada. Puesto que los costes son considerables (7.900 euros [28%] mayores, por paciente, que los del tratamiento estándar)24 y la incidencia media de complicaciones fue del 20%41,50, en nuestra opinión, el beneficio de dicho tratamiento debería superar un 15-20%.
Jivegard et al20 describieron una disminución de la tasa de amputación a los 18 meses como respuesta a la EME en pacientes sin hipertensión arterial. No pudimos confirmar este hallazgo. La hipertensión arterial no fue una variable pronóstica significativa. Se estimó un CR de 0,98 (p=0,86), lo que sugiere riesgos similares de amputación en pacientes hipertensos y no hipertensos. En este estudio, la respuesta al tratamiento EME en pacientes sin hipertensión arterial fue similar a la respuesta global (ausencia). Aunque los pacientes diabéticos tienen más probabilidades de desarrollar ICE y su tasa de mortalidad es mayor1,51, en este estudio, su riesgo de amputación es similar al de los otros pacientes, una vez está presente isquemia crítica de la extremidad. Se observaron efectos similares del tratamiento en pacientes diabéticos y no diabéticos. Así mismo, no observamos un pronóstico significativamente peor para aquellos con reconstrucciones vasculares previas (fracasadas).
ConclusiónAunque la idea general sigue siendo que “la ICE no tratada” suele dar lugar a una amputación, en realidad, un número sorprendentemente alto de pacientes puede, temporalmente, permanecer estable o mejorar con un tratamiento médico adecuado (incluidos los analgésicos). Es probable que la EME no mejore sustancialmente la evolución desde un punto de vista de la supervivencia (de la extremidad). Los pacientes con lesiones cutáneas isquémicas (ulceraciones o gangrena) corren mayor riesgo de amputación que aquellos con dolor en reposo solo. No pudimos identificar a un subgrupo de pacientes que pudieran beneficiarse específicamente de la EME. Si son de esperar beneficios clínicamente importantes en subgrupos de pacientes con isquemia crítica de la extremidad, se requieren estudios aleatorizados con una potencia suficiente.
La presente investigación se financió con la beca OG-90053 de la Dutch Fund for Investigative Medicine (Health Insurance Council), Holanda.




![Supervivencia de la extremidad de acuerdo con el tratamiento (estimulación de la médula espinal [EME] frente a estándar) en los subgrupos de pacientes con dolor en reposo (arriba, n=41) y lesión cutánea isquémica (abajo, n=79). Limb survival: supervivencia de la extremidad; log-rank: prueba del log-rank; patients with ischemic skin lesions: pacientes con lesiones cutáneas isquémicas; patients with rest pain: pacientes con dolor en reposo; SCS: tratamiento EME; standard: tratamiento estándar; Time from randomisation (months): tiempo desde la aleatorización (meses). Supervivencia de la extremidad de acuerdo con el tratamiento (estimulación de la médula espinal [EME] frente a estándar) en los subgrupos de pacientes con dolor en reposo (arriba, n=41) y lesión cutánea isquémica (abajo, n=79). Limb survival: supervivencia de la extremidad; log-rank: prueba del log-rank; patients with ischemic skin lesions: pacientes con lesiones cutáneas isquémicas; patients with rest pain: pacientes con dolor en reposo; SCS: tratamiento EME; standard: tratamiento estándar; Time from randomisation (months): tiempo desde la aleatorización (meses).](https://static.elsevier.es/multimedia/11302542/0000002300000003/v1_201304291539/S1130254209001100/v1_201304291539/es/main.assets/thumbnail/gr3.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)