Evaluamos nuestra experiencia con los aloinjertos venosos de cadáver criopreservados (AVC) para la revascularización infragenicular en pacientes con antecedentes de fracaso de una derivación o con vena autóloga no adecuada. Se revisaron las historias clínicas de los pacientes tratados mediante revascularización de la extremidad inferior con AVC por isquemia crítica. Se analizaron las características demográficas de los pacientes, los vasos tratados, y el curso postoperatorio. Se compararon los pacientes tratados mediante derivación iterativa con vena de cadáver con los pacientes revascularizados con vena de cadáver de forma primaria. Se determinaron mediante el método de Kaplan-Meier con el riesgo proporcional de Cox las tasas acumulativas de permeabilidad, salvamento de la extremidad y mortalidad, y los factores asociados con resultados. Entre enero de 2000 y diciembre de 2006, se realizó la implantación de 66 AVC en 56 pacientes de un total de 1.726 procedimientos de derivación. Se intervinieron 36 hombres y 20 mujeres, con una media de edad de 71,67 ± 10,50 años. La media del seguimiento fue de 12,12 ± 14,16 meses. El 78% de los pacientes habían sido tratados previamente mediante técnicas de derivación, y el 50% de todas las oclusiones de injerto se produjeron en injertos de politetrafluoroetileno expandido. Las indicaciones quirúrgicas fueron: lesión trófica (73%) y dolor en reposo (27%) isquémicos. La media del índice tobillo-brazo preoperatorio fue 0,43 ± 0,16; y aumentó hasta 0,89 ± 0,18 a los 30 días (p = 0,001). Las complicaciones relacionadas con la intervención fueron: infección del injerto (3, 4%), trombosis del injerto (3, 4%), pseudoaneurisma (3, 4%), y hemorragia (2, 3%). Los índices acumulativos de permeabilidad primaria, primaria asistida, secundaria, salvamento de la extremidad, y supervivencia a 1 año, con los intervalos de confianza, fueron: 0,19 (0,10-0,36); 0,29 (0,18-0,47); 0,42 (0,29-0,60); 0,73 (0,62-0,86) y 0,77 (0,65-0,90). Las reintervenciones tuvieron los mismos resultados que los procedimientos. El análisis multivariable demostró que los factores predictivos del aumento de riesgo de pérdida de permeabilidad secundaria fueron la edad > 70 (razón del riesgo [RR] = 3,13; p = 0,009) y la revascularización secundaria (RR = 3,36; p = 0,015). Los pacientes de mayor edad (RR = 2,92; p = 0,042) y los que presentaban insuficiencia renal (RR = 2,92; p = 0,019) tuvieron un mayor riesgo de mortalidad. La utilización de AVC sigue siendo una opción en la revascularización iterativa de la extremidad inferior para el salvamento de la extremidad si no se dispone de una vena autóloga. Sin embargo, las tasas de permeabilidad son bajas, y los pacientes mayores de 70 años tienen más probabilidades de presentar resultados peores.
IntroducciónLa vena safena autóloga (VSA) es el conducto de elección en los procedimientos de derivación realizados en la extremidad inferior1. Si bien la vena autóloga de cualquier procedencia (safena, safena externa y venas de los brazos) es el conducto de elección en casos de revascularización distal de la extremidad inferior, especialmente en la derivaciones iterativas, no está disponible en un número significativo de casos debido a una extracción previa para revascularización coronaria o de la extremidad inferior2,3 (10-20%). En tal caso, los cirujanos vasculares deben buscar un conducto alternativo, como los injertos de politetrafluoroetileno expandido (PTFEe), poliéster y los aloinjertos venosos criopreservados de cadáver (AVC), todos ellos con una conocida permeabilidad menor. Se ha descrito el tratamiento agresivo de la oclusión de injerto mediante revascularización secundaria utilizando venas autólogas con índices favorables de salvamento de la extremidad y una baja mortalidad operatoria4. Por otro lado, la amputación mayor es generalmente una opción menos deseable debido a las elevadas tasas de mortalidad y a la dificultad de la rehabilitación.
En general, la revascularización iterativa del miembro inferior mediante injertos protésicos tiene unas tasas de permeabilidad y de salvamento de la extremidad peores, a pesar de los prometedores resultados de las intervenciones primarias publicados en series selectivas5-7. Sin embargo, estos estudios no son aplicables a las reintervenciones. Mientras las AVC han dado lugar a resultados diversos, con tasas de permeabilidad y salvamento de la extremidad que oscilan entre buenas y malas8-13, no se han evaluado de forma exhaustiva las tasas de salvamento de extremidad en las reintervenciones. La variabilidad de la permeabilidad documentada en estos trabajos es el resultado de la existencia de poblaciones mixtas de pacientes, técnicas de extracción y conservación de los aloinjertos venosos diferentes, indicaciones quirúrgicas diversas, e intervenciones de revascularización primarias frente a secundarias. El principal objetivo de este estudio fue evaluar los resultados de la revascularización con AVC en relación con las tasas de permeabilidad, salvamento de la extremidad y mortalidad tras la revascularización iterativa de la extremidad inferior con AVC y compararlos con los de los pacientes sometidos a la intervención sin antecedentes de revascularización homolateral. Un segundo objetivo fue determinar la existencia de otros factores clínicos y quirúrgicos que pudieran predecir la permeabilidad, el salvamento de la extremidad y la mortalidad.
Materiales y MétodosSe revisaron de forma retrospectiva las historias clínicas de todos los pacientes tratados mediante la revascularización de la extremidad inferior con un AVC en la Cleveland Clinic Foundation entre enero de 2000 y enero de 2007. Este estudio estuvo autorizado por el comité de ética del centro. Se incluyeron únicamente los casos de revascularización infrainguinal. Se registraron los antecedentes, características demográficas, comorbilidades, indicación quirúrgica, vasos tratados, y vasos aferentes y eferentes. Las comorbilidades analizadas fueron: tabaquismo, hipertensión arterial, arteriopatía coronaria, infarto de miocardio, bypass coronario, ictus, diabetes mellitus, enfermedad pulmonar obstructiva crónica, insuficiencia renal e hiperlipidemia. Se registraron las intervenciones vasculares anteriores, como revascularizaciones homolaterales y contralaterales, y procedimientos percutáneos previos. Se realizó un mapeo venoso preoperatorio en todos los pacientes para asegurar que no disponían de vena autóloga adecuada. Dicha ausencia de disponibilidad de venas autólogas se clasificó en 3 subgrupos según la causa: injerto para derivación homolateral o contralateral previa, para derivación coronaria y diámetro venoso inadecuado. El suministro comercial de los AVC vino de Cryolife (Marietta, GA) y LifeNet Health (Virginia Beach, VA).
Detalles de la intervenciónLos injertos se descongelaron según el protocolo justo antes de su implantación, y se registró el grupo sanguíneo (ABO, Rh) y la compatibilidad de los injertos. No se utilizaron inmunosupresores tras la intervención. Se revisaron los posibles efectos adversos durante el postoperatorio, como trombosis aguda intrahospitalaria y fallecimiento precoz. Todos los pacientes recibieron anticoagulación postoperatoria según un protocolo discutido con anterioridad12,14. Durante la intervención, se administró heparina intravenosa a una dosis que prolongara el tiempo de coagulación activada el doble de lo normal. Durante el postoperatorio no se revirtió la heparina y se administró a los pacientes una infusión de heparina a dosis baja (500 U/h), que se aumentó lentamente hasta mantener el tiempo de tromboplastina parcial activada (TTPa) en 55-65 s. Posteriormente, se administró warfarina como anticoagulante para lograr un índice internacional normalizado (INR) terapéutico de 2-3. Se continuó la administración de ácido acetilsalicílico y warfarina de forma indefinida a no ser que el estado clínico obligase a su suspensión. Se obtuvieron los datos del seguimiento a partir de las historias clínicas hospitalarias y del centro de atención primaria. Se realizó un seguimiento mediante eco-Doppler antes del alta, al cabo de 1 mes, cada 3 meses durante el primer año, y posteriormente cada 6 meses. Se utilizó el examen clínico junto con el índice tobillo-brazo (ITB), el registro del volumen de pulso (RVP), y la vigilancia con eco-Doppler para evaluar la permeabilidad de los AVC.
Criterios de evaluación y estadísticasLa permeabilidad, el salvamento de la extremidad y la supervivencia acumulativas fueron analizadas con la prueba de log-rank de Kaplan-Meier. Las razones del riesgo (RR) que comparan los riesgos de la pérdida de permeabilidad y la mortalidad entre grupos, definidos por las determinaciones pre y perioperatorias, se estimaron utilizando el modelo de riesgos proporcionales de Cox. Dado que algunos pacientes presentaron múltiples procedimientos de derivación con AVC, se utilizaron modelos marginales de Cox para ajustar las estimaciones del error estándar de los RR que reflejasen la posible correlación entre las observaciones realizadas en el mismo paciente. El análisis se realizó utilizando el programa R (http://www.r-project.org), y en todas las pruebas se asumió un nivel de significancia de 0,05.
ResultadosEntre enero de 2000 y enero de 2007, se realizaron en nuestro centro 1.726 procedimientos de derivación en extremidades inferiores, entre los cuales se realizaron 66 con AVC en 56 pacientes (3,8%). Treinta y seis pacientes eran hombres y 20 mujeres, con una media de edad de 71,7 ± 10,5 años (mediana = 72; límites 49-92). La media del seguimiento fue 12,2 ± 14,2 meses (mediana = 6,5; rango 0-75). Entre las comorbilidades figuraban: hipertensión arterial (83%), tabaquismo (73%), arteriopatía coronaria (70,5%), diabetes (53%), infarto de miocardio (30%), cirugía de derivación coronaria (CABG, 39%), enfermedad pulmonar obstructiva crónica (30%), ictus (31%), insuficiencia renal (30%) e hiperlipidemia (57%).
El 78% de los pacientes había sido sometido a una revascularización previa de la extremidad (72% homolateral y 6% contralateral) y el 50% de las oclusiones se produjo en injertos de PTFEe. No se pudo disponer de vena autóloga en el 89% de los casos debido a revascularizaciones previas de la extremidad o coronaria. En el 11% restante, el tamaño de la vena no era adecuado. Las indicaciones quirúrgicas fueron: lesión trófica en el 73% de los casos (que incluye 3 pacientes que presentaron una infección del injerto de PTFEe) y dolor en reposo en el 27% isquémicos. No hubo pacientes con claudicación intermitente en nuestra serie. Los vasos revascularizados fueron la arteria poplítea infragenicular (14%) y las arterias tibiales (86%). El 70% presentó un único vaso tibial de salida, y el 22% presentó dos vasos de salida. Únicamente un paciente presentó permeabilidad de los 3 vasos tibiales. En el 6% restante no existieron vasos tibiales permeables y la anastomosis distal se realizó en la arteria pedia dorsal. La media del ITB preoperatorio fue 0,43 ± 0,16; y aumentó hasta 0,89 ± 0,18 a los 30 días. No se pudo determinar la compatibilidad ABO y Rh en 12 intervenciones. De las 54 venas de cadáver restantes, únicamente 6 fueron incompatibles.
Las complicaciones relacionadas con la intervención fueron: infección del injerto (3, 4%), trombosis intrahospitalaria del injerto (3, 4%), pseudoaneurisma (2, 3%) y hemorragia (2, 3%). La cicatrización de la herida se retrasó en 12 pacientes (18%). La tasa de mortalidad perioperatoria (< 30 días tras la intervención) fue del 4%.
Los fracasos de las AVC se trataron mediante angioplastia percutánea en 18 pacientes (27%), revisión con corrección directa en 2 pacientes (3%), o derivación con AVC en 10 pacientes (15%). Sin embargo, se realizó una amputación mayor en 17 pacientes (25%) a pesar de estos esfuerzos. En un paciente se realizó la amputación debido a una infección tisular masiva, a pesar de que el injerto era permeable.
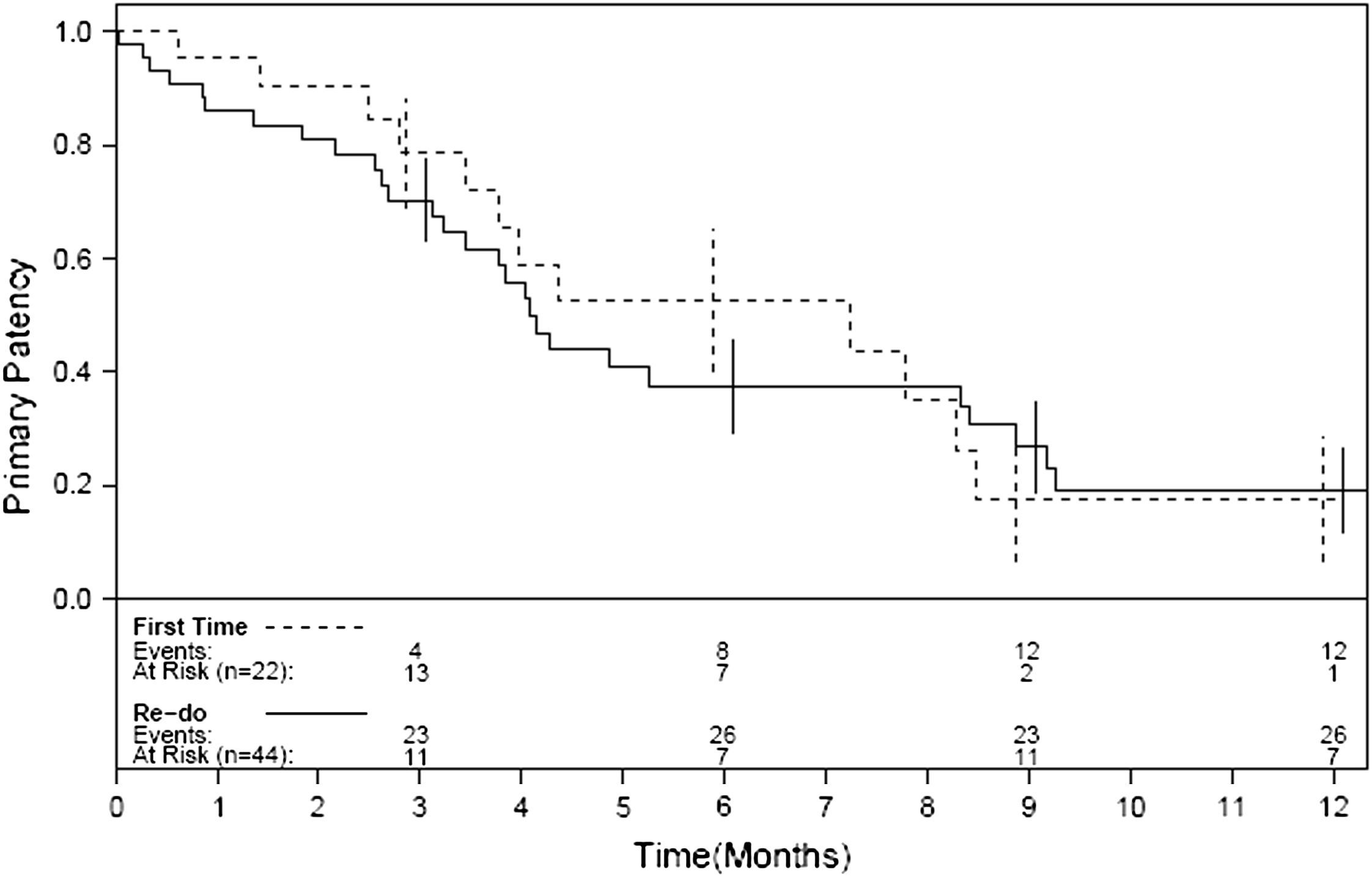
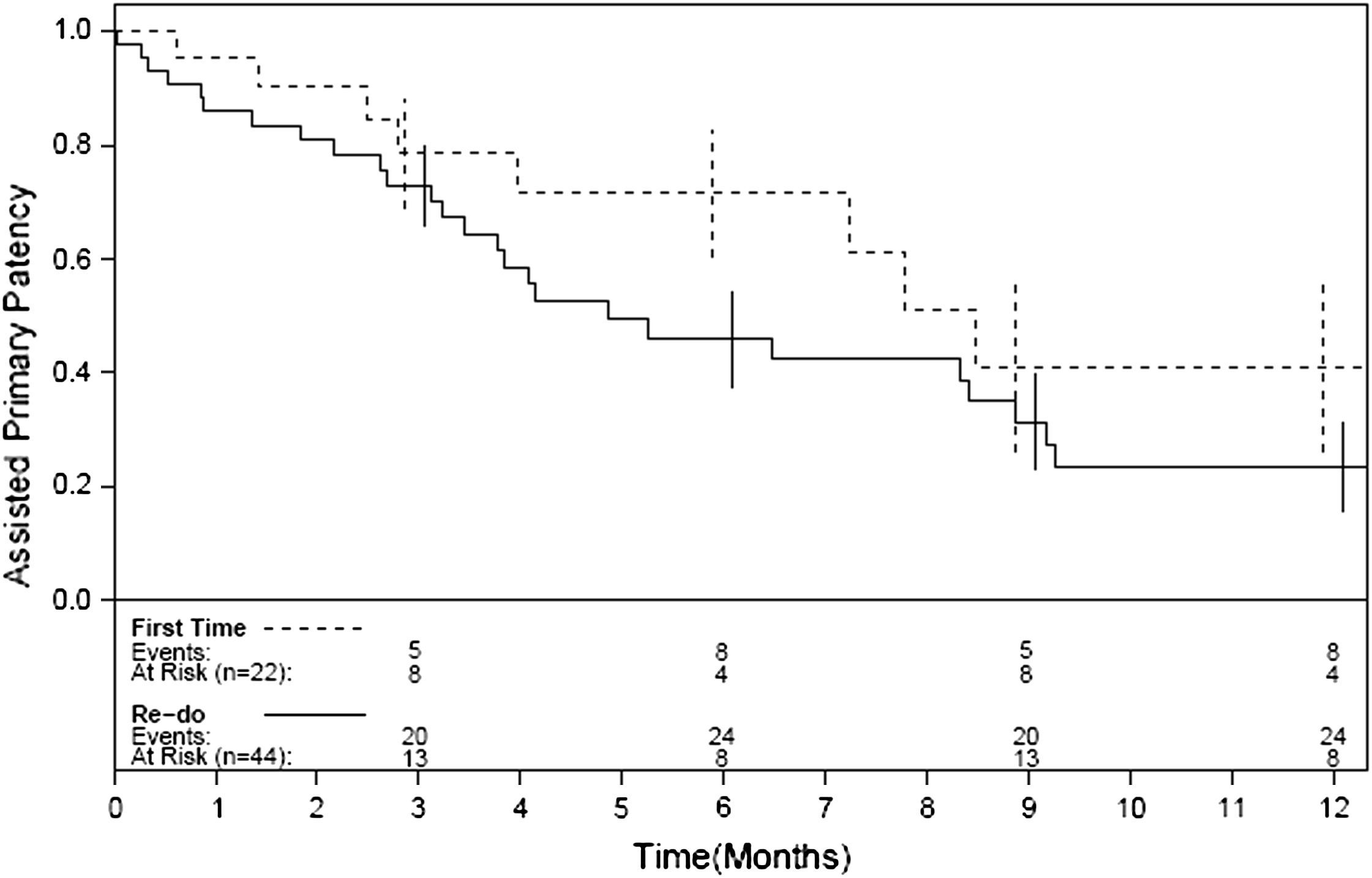
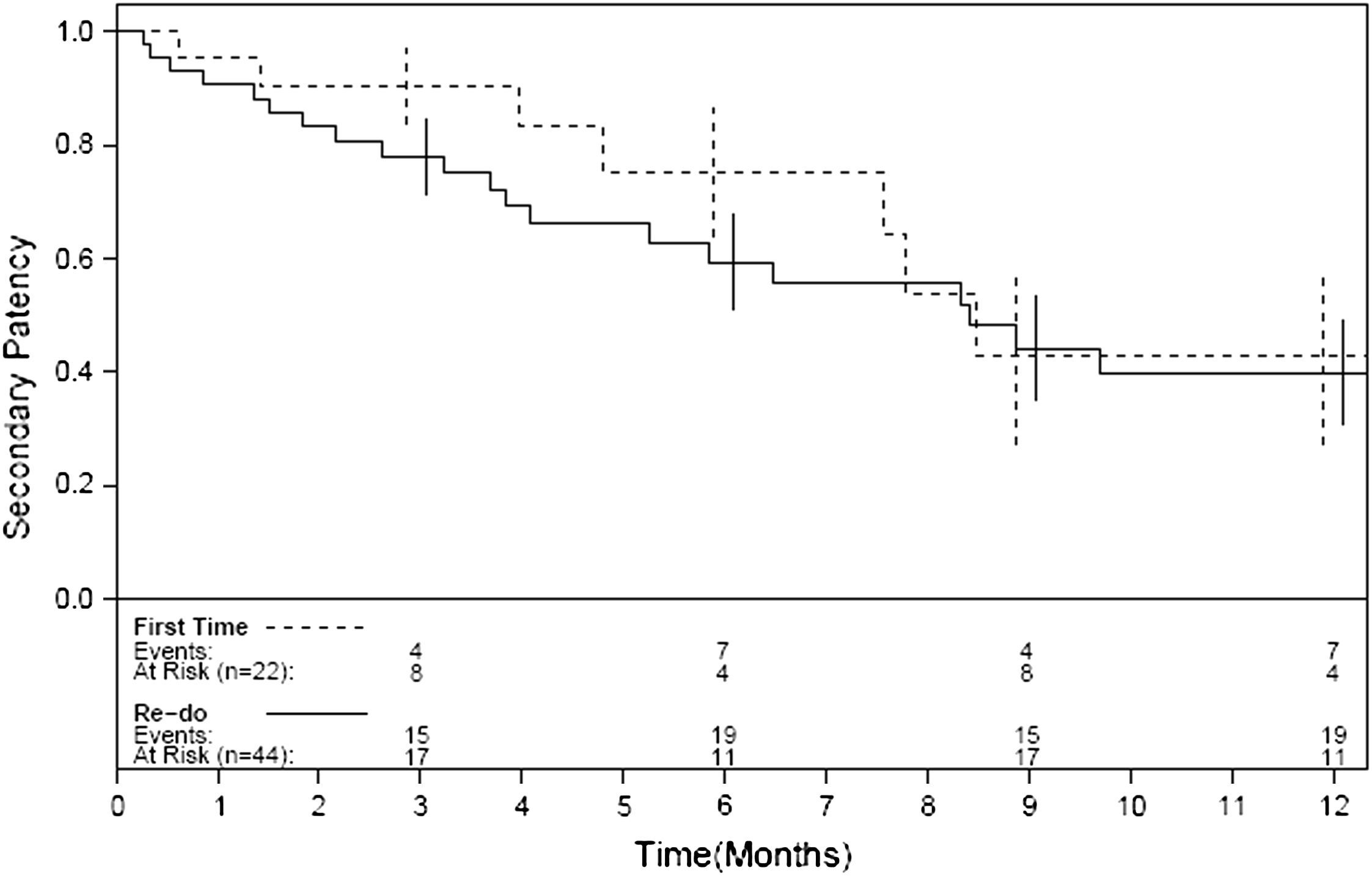
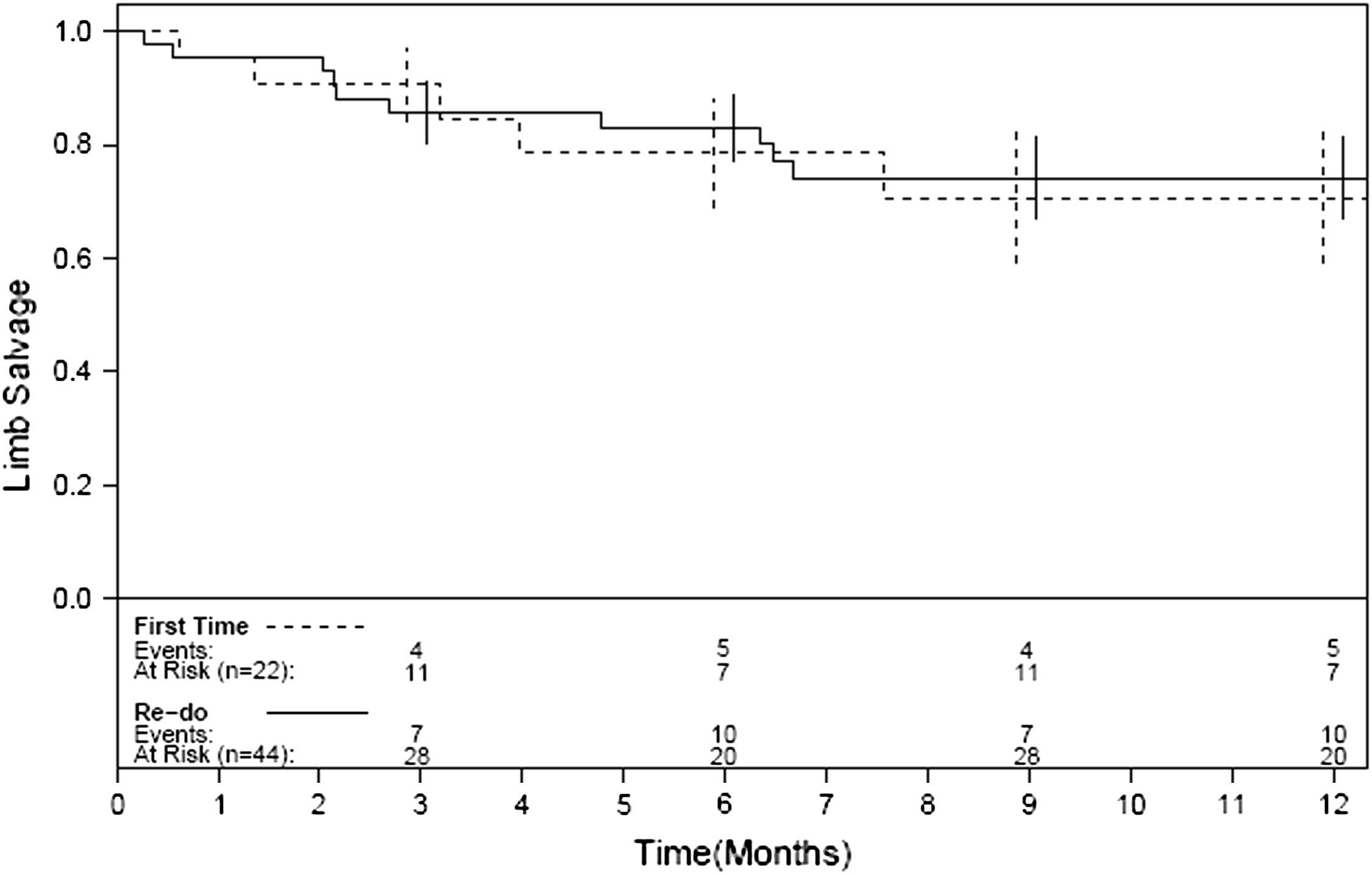
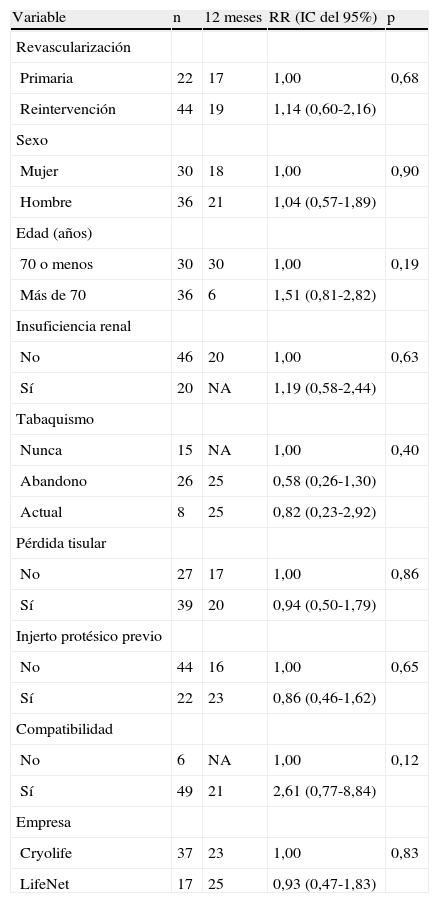
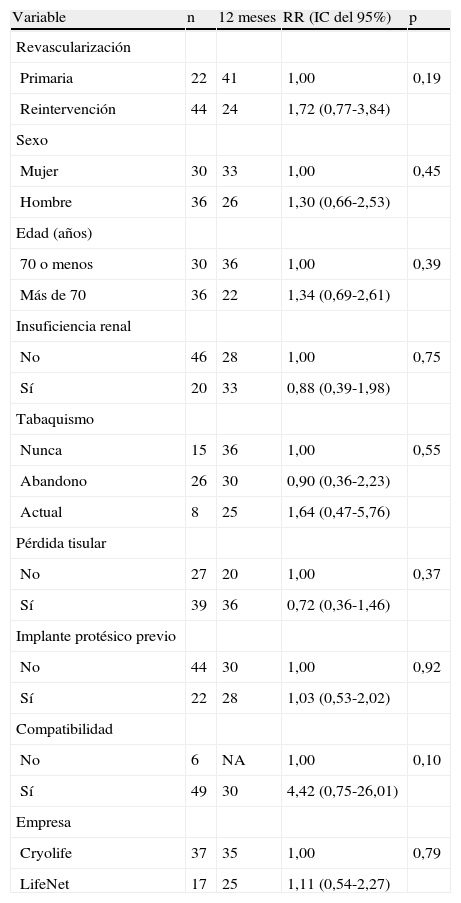
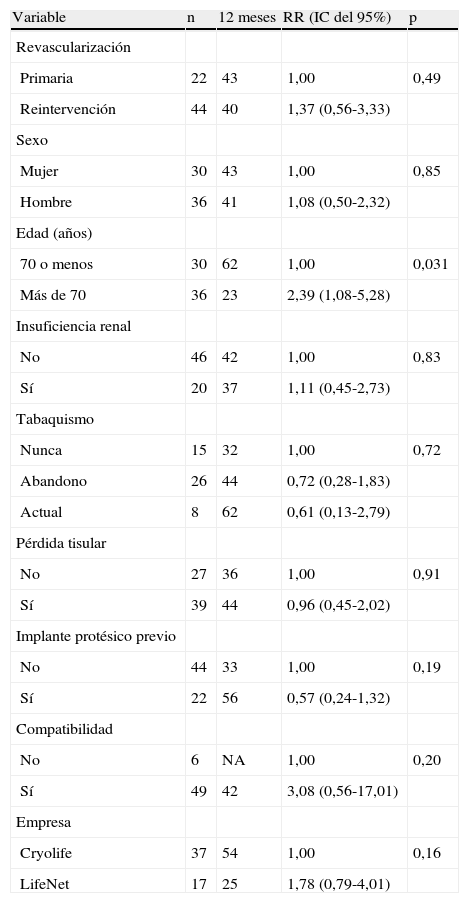
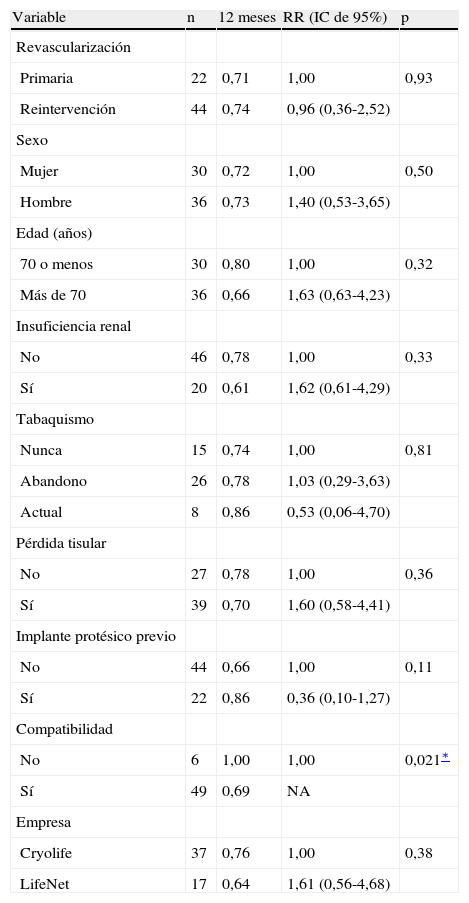
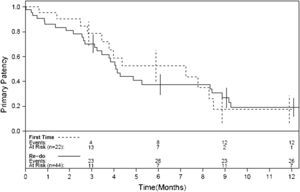
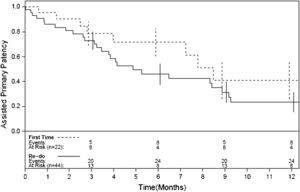
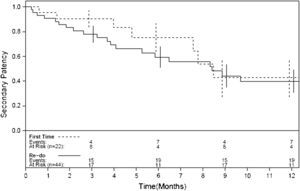
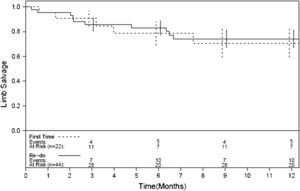
Las Figuras 1-4 muestran la permeabilidad primaria, permeabilidad primaria asistida, permeabilidad secundaria, y salvamento de la extremidad de las reintervenciones para la revascularización con AVC frente a las intervenciones primarias. Las tasas acumuladas de permeabilidad a 1 año fueron del 19% (IC del 95% 10-36) para la permeabilidad primaria, del 29% (IC del 95% 18-47) para la permeabilidad primaria asistida, y del 42% (IC del 95% 29-60) para la permeabilidad secundaria. La comparación mediante el análisis univariable de los factores de riesgo preoperatorio y de los factores predictivos de las tasas de permeabilidad y de salvamento de la extremidad se presentan en las Tablas I-IV. De entre todos los factores predictivos, solamente una edad mayor de 70 años presentó un aumento del riesgo de pérdida de permeabilidad secundaria (RR = 2,39; p = 0,031) en comparación con los pacientes más jóvenes. No existieron diferencias en cuanto a las tasas de permeabilidad primaria, permeabilidad primaria asistida, permeabiliad secundaria y salvamento de la extremidad entre los pacientes intervenidos de forma primaria y los reintervenidos (p = 0,68; p = 0,19; p = 0,49 y p = 0,93; respectivamente). Ningún otro factor predictivo estuvo relacionado de forma significativa con el riesgo de pérdida de la permeabilidad. El análisis multivariable no identificó ninguna de las variables analizadas como factor predictivo de permeabilidad primaria, permeabilidad primaria asistida ni de salvamento de la extremidad. Sin embargo, los pacientes con una edad > 70 (RR = 3,13; p = 0,009) y los reintervenidos (RR = 3,36; p = 0,015) tuvieron un mayor riesgo de pérdida de la permeabilidad en la valoración de la permeabilidad secundaria.
Comparación entre grupos de las tasas de permeabilidad primaria junto con las RR
| Variable | n | 12 meses | RR (IC del 95%) | p |
| Revascularización | ||||
| Primaria | 22 | 17 | 1,00 | 0,68 |
| Reintervención | 44 | 19 | 1,14 (0,60-2,16) | |
| Sexo | ||||
| Mujer | 30 | 18 | 1,00 | 0,90 |
| Hombre | 36 | 21 | 1,04 (0,57-1,89) | |
| Edad (años) | ||||
| 70 o menos | 30 | 30 | 1,00 | 0,19 |
| Más de 70 | 36 | 6 | 1,51 (0,81-2,82) | |
| Insuficiencia renal | ||||
| No | 46 | 20 | 1,00 | 0,63 |
| Sí | 20 | NA | 1,19 (0,58-2,44) | |
| Tabaquismo | ||||
| Nunca | 15 | NA | 1,00 | 0,40 |
| Abandono | 26 | 25 | 0,58 (0,26-1,30) | |
| Actual | 8 | 25 | 0,82 (0,23-2,92) | |
| Pérdida tisular | ||||
| No | 27 | 17 | 1,00 | 0,86 |
| Sí | 39 | 20 | 0,94 (0,50-1,79) | |
| Injerto protésico previo | ||||
| No | 44 | 16 | 1,00 | 0,65 |
| Sí | 22 | 23 | 0,86 (0,46-1,62) | |
| Compatibilidad | ||||
| No | 6 | NA | 1,00 | 0,12 |
| Sí | 49 | 21 | 2,61 (0,77-8,84) | |
| Empresa | ||||
| Cryolife | 37 | 23 | 1,00 | 0,83 |
| LifeNet | 17 | 25 | 0,93 (0,47-1,83) |
IC: intervalo de confianza; NA: no aplicable; RR: razón del riesgo.
Comparación entre grupos de las tasas de permeabilidad primaria asistida junto con las RR
| Variable | n | 12 meses | RR (IC del 95%) | p |
| Revascularización | ||||
| Primaria | 22 | 41 | 1,00 | 0,19 |
| Reintervención | 44 | 24 | 1,72 (0,77-3,84) | |
| Sexo | ||||
| Mujer | 30 | 33 | 1,00 | 0,45 |
| Hombre | 36 | 26 | 1,30 (0,66-2,53) | |
| Edad (años) | ||||
| 70 o menos | 30 | 36 | 1,00 | 0,39 |
| Más de 70 | 36 | 22 | 1,34 (0,69-2,61) | |
| Insuficiencia renal | ||||
| No | 46 | 28 | 1,00 | 0,75 |
| Sí | 20 | 33 | 0,88 (0,39-1,98) | |
| Tabaquismo | ||||
| Nunca | 15 | 36 | 1,00 | 0,55 |
| Abandono | 26 | 30 | 0,90 (0,36-2,23) | |
| Actual | 8 | 25 | 1,64 (0,47-5,76) | |
| Pérdida tisular | ||||
| No | 27 | 20 | 1,00 | 0,37 |
| Sí | 39 | 36 | 0,72 (0,36-1,46) | |
| Implante protésico previo | ||||
| No | 44 | 30 | 1,00 | 0,92 |
| Sí | 22 | 28 | 1,03 (0,53-2,02) | |
| Compatibilidad | ||||
| No | 6 | NA | 1,00 | 0,10 |
| Sí | 49 | 30 | 4,42 (0,75-26,01) | |
| Empresa | ||||
| Cryolife | 37 | 35 | 1,00 | 0,79 |
| LifeNet | 17 | 25 | 1,11 (0,54-2,27) |
IC: intervalo de confianza; NA: no aplicable; RR: razón del riesgo.
Comparación entre grupos de las tasas de permeabilidad secundaria junto con las RR
| Variable | n | 12 meses | RR (IC del 95%) | p |
| Revascularización | ||||
| Primaria | 22 | 43 | 1,00 | 0,49 |
| Reintervención | 44 | 40 | 1,37 (0,56-3,33) | |
| Sexo | ||||
| Mujer | 30 | 43 | 1,00 | 0,85 |
| Hombre | 36 | 41 | 1,08 (0,50-2,32) | |
| Edad (años) | ||||
| 70 o menos | 30 | 62 | 1,00 | 0,031 |
| Más de 70 | 36 | 23 | 2,39 (1,08-5,28) | |
| Insuficiencia renal | ||||
| No | 46 | 42 | 1,00 | 0,83 |
| Sí | 20 | 37 | 1,11 (0,45-2,73) | |
| Tabaquismo | ||||
| Nunca | 15 | 32 | 1,00 | 0,72 |
| Abandono | 26 | 44 | 0,72 (0,28-1,83) | |
| Actual | 8 | 62 | 0,61 (0,13-2,79) | |
| Pérdida tisular | ||||
| No | 27 | 36 | 1,00 | 0,91 |
| Sí | 39 | 44 | 0,96 (0,45-2,02) | |
| Implante protésico previo | ||||
| No | 44 | 33 | 1,00 | 0,19 |
| Sí | 22 | 56 | 0,57 (0,24-1,32) | |
| Compatibilidad | ||||
| No | 6 | NA | 1,00 | 0,20 |
| Sí | 49 | 42 | 3,08 (0,56-17,01) | |
| Empresa | ||||
| Cryolife | 37 | 54 | 1,00 | 0,16 |
| LifeNet | 17 | 25 | 1,78 (0,79-4,01) |
IC: intervalo de confianza; NA: no aplicable; RR: razón del riesgo.
Comparación entre grupos de las tasas de salvamento de la extremidad junto con las RR
| Variable | n | 12 meses | RR (IC de 95%) | p |
| Revascularización | ||||
| Primaria | 22 | 0,71 | 1,00 | 0,93 |
| Reintervención | 44 | 0,74 | 0,96 (0,36-2,52) | |
| Sexo | ||||
| Mujer | 30 | 0,72 | 1,00 | 0,50 |
| Hombre | 36 | 0,73 | 1,40 (0,53-3,65) | |
| Edad (años) | ||||
| 70 o menos | 30 | 0,80 | 1,00 | 0,32 |
| Más de 70 | 36 | 0,66 | 1,63 (0,63-4,23) | |
| Insuficiencia renal | ||||
| No | 46 | 0,78 | 1,00 | 0,33 |
| Sí | 20 | 0,61 | 1,62 (0,61-4,29) | |
| Tabaquismo | ||||
| Nunca | 15 | 0,74 | 1,00 | 0,81 |
| Abandono | 26 | 0,78 | 1,03 (0,29-3,63) | |
| Actual | 8 | 0,86 | 0,53 (0,06-4,70) | |
| Pérdida tisular | ||||
| No | 27 | 0,78 | 1,00 | 0,36 |
| Sí | 39 | 0,70 | 1,60 (0,58-4,41) | |
| Implante protésico previo | ||||
| No | 44 | 0,66 | 1,00 | 0,11 |
| Sí | 22 | 0,86 | 0,36 (0,10-1,27) | |
| Compatibilidad | ||||
| No | 6 | 1,00 | 1,00 | 0,021∗ |
| Sí | 49 | 0,69 | NA | |
| Empresa | ||||
| Cryolife | 37 | 0,76 | 1,00 | 0,38 |
| LifeNet | 17 | 0,64 | 1,61 (0,56-4,68) |
IC: intervalo de confianza; NA: no aplicable; RR: razón del riesgo.
La tasa de supervivencia acumulada a 1 año fue del 77% (IC del 95% 64-89). La comparación mediante análisis univariable de los factores de riesgo de la mortalidad demostró una disminución significativa de la mortalidad en los pacientes reintervenidos en comparación con los intervenidos de forma primaria (RR = 0,37; IC del 95% 0,16-0,89; p = 0,026). Esto se ajustó mediante la comparación de la comorbilidad entre grupos, que reveló que los pacientes de nuestra serie tratados mediante la revascularización con AVC de forma primaria fueron significativamente mayores (p = 0,036) y tuvieron una probabilidad de presentar insuficiencia renal mayor (p = 0,014). La insuficiencia renal fue un factor predictivo de mortalidad con significación estadística (RR = 2,67; IC del 95% 1,14-6,24; p = 0,024). En el análisis multivariable de la supervivencia, tanto los pacientes de edad más avanzada (RR = 2,92; p = 0,042) como los que presentaron insuficiencia renal (RR = 2,92; p = 0,019) tuvieron un mayor riesgo de mortalidad.
DiscusiónLa reconstrucción arterial iterativa de la extremidad inferior por isquemia crítica en presencia de un conducto autólogo inadecuado constituye un desafío para cualquier cirujano vascular. En el 21% de los pacientes que presentan la oclusión de un injerto de derivación femorotibial, la extremidad es viable a pesar de dicha oclusión; sin embargo, el 79% sufrirá una recaída de isquemia crítica del miembro15. Si la oclusión del injerto no puede resolverse mediante trombólisis, trombectomía o revisión, los cirujanos vasculares se enfrentan a un dilema entre una revascularización secundaria o una amputación mayor. Si bien inicialmente en estos casos se debe considerar la trombectomía simple y la revisión del injerto, con frecuencia esto es técnicamente imposible y los implantes de PTFEe ocluidos son difíciles de salvar6,15. Sin embargo, considerando las elevadas tasas de mortalidad y las dificultades que supone la rehabilitación en casos de amputación mayor4, el tratamiento agresivo de la isquemia crítica de la extremidad mediante revascularización secundaria es una opción más deseable.
La revascularización secundaria se suele asociar con resultados inferiores en comparación con la intervención primaria debido a la falta de disponibilidad de conductos autólogos, al deficiente flujo de salida, y a la progresión de la aterosclerosis en la extremidad afectada. En nuestro estudio, no se disponía de vena autóloga en el 89% de los casos debido a una revascularización previa de la extremidad o coronaria. En el 11% restante no se disponía de venas adecuadas a pesar de no tener antecedentes de procedimientos de revascularización periférica o coronaria. Si bien los injertos protésicos se han utilizado como alternativa a la vena safena, las tasas de permeabilidad de las derivaciones con prótesis a los vasos tibiales distales de la extremidad inferior han sido variables5,6,7,16. La tasa de salvamento de la extremidad con injertos de PTFEe a los vasos tibiales descrita por Kacoyanis et al5 fue solamente del 38% a los 5 años. Dennis et al6 demostraron que en prácticamente el 60% de los pacientes tratados de forma secundaria mediante revascularización con injertos de PTFEe fue necesaria una amputación mayor en los primeros 3 meses tras la intervención. En nuestra serie, la mitad de los pacientes revascularizados con AVC habían presentado la oclusión de una derivación previa con un injerto de PTFEe, lo que hacía de la utilización de conductos protésicos menos deseable para la reintervención en este subgrupo.
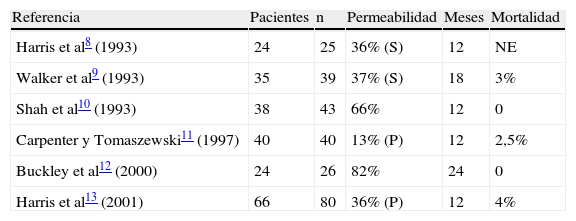
El estudio tiene varias limitaciones. Se trata de una revisión retrospectiva, y no comparamos las derivaciones con AVC frente a las derivaciones protésicas. Sin embargo, nunca ha existido un ensayo con asignación aleatoria que compare las venas criopreservadas de cadáver con los injertos protésicos en la revascularización primaria o secundaria de la extremidad inferior. Las tasas de permeabilidad de las derivaciones con AVC varían notablemente en las diferentes series descritas (Tabla V). Las diferencias existentes en las poblaciones de pacientes, las pautas de anticoagulación, y los orígenes comerciales de los aloinjertos dificultan la comparación de los resultados. En esta serie, los injertos venosos Cryolife presentaron tasas de permeabilidad secundaria mayores, aunque de forma no estadísticamente significativa.
Series de injertos venosos criopreservados
| Referencia | Pacientes | n | Permeabilidad | Meses | Mortalidad |
| Harris et al8 (1993) | 24 | 25 | 36% (S) | 12 | NE |
| Walker et al9 (1993) | 35 | 39 | 37% (S) | 18 | 3% |
| Shah et al10 (1993) | 38 | 43 | 66% | 12 | 0 |
| Carpenter y Tomaszewski11 (1997) | 40 | 40 | 13% (P) | 12 | 2,5% |
| Buckley et al12 (2000) | 24 | 26 | 82% | 24 | 0 |
| Harris et al13 (2001) | 66 | 80 | 36% (P) | 12 | 4% |
NE: no especificada; P: primaria; S: secundaria.
Nuestra tasa de fracaso de injertos fue más alta de lo esperada, pero no diferente de otras series de forma significativa. En el fracaso del AVC, se ha implicado a la respuesta inmunitaria frente al aloinjerto venoso criopreservado. Posner et al17 describieron tasas de permeabilidad mejoradas con el uso de inmunosupresores sistémicos en comparación con un grupo control. Sin embargo, se produjeron con mayor frecuencia complicaciones del injerto, como aneurisma y rotura, en aquellos casos tratados con inmunosupresores sistémicos. Carpenter y Tomaszewski11 demostraron una actividad inmunitaria persistente en los AVC; sin embargo, no lograron demostrar que el uso de un inmunosupresor mejora la permeabilidad del aloinjerto. En nuestra serie, no utilizamos inmunosupresores. Los resultados publicados por Shah et al10 son mejores, con una permeabilidad a 1 año del 66%. Las elevadas tasas de permeabilidad de esta serie se pueden explicar por el hecho de que en el 56% de los pacientes la intervención fue realizada como revascularización primaria. Informaron de tasas de permeabilidad significativamente elevadas en los procedimientos de revascularización primarios respecto a las reintervenciones. Otro factor importante es que en la serie de Shah et al10 la anastomosis distal se realizó en la arteria poplítea en el 60% de los casos. En nuestro estudio, la arteria poplítea infragenicular representó el 14% de los vasos distales revascularizados, los vasos tibiales el 80%, y vasos plantares el 6%. Buckley et al12 describieron, cuando se realizó el procedimiento de derivación con AVC como técnica de revascularización primaria, prometedoras tasas de permeabilidad primaria del 82% y de salvamento de la extremidad del 80% a los 24 meses. Dichos autores recomiendan un protocolo con ácido acetilsalicílico, heparina a dosis bajas, dextrano de bajo peso molecular, dipiridamol, y warfarina para mejorar el salvamento y la permeabilidad de la extremidad. En nuestro estudio, todos los pacientes recibieron un protocolo similar de anticoagulación (menos dipiridamol). Tuvimos pocas complicaciones hemorrágicas, con hematoma y hemorragia solamente en 2 pacientes y sin que se produjeran hemorragias digestivas.
Nuestras tasas de permeabilidad fueron peores de lo esperado, pero el porcentaje de salvamento de la extremidad fue aceptable con un 73%. Estos resultados no fueron significativamente diferentes de los de otras series descritas8-13. Walker et al9 describieron tasas de permeabilidad primaria del 28 y del 14% a los 12 y 18 meses en su serie de 39 derivaciones de extremidad inferior. Las tasas de permeabilidad secundaria fueron mayores, del 46 y el 37% a los 12 y 18 meses. La tasa de salvamento de la extremidad fue del 67%. Harris et al13 describieron de forma análoga una permeabilidad secundaria del 36% a 1 año en su serie de 25 revascularizaciones y tasas de salvamento de la extremidad a 1 año del 65,5% y a los 3 años del 62,3%.
En nuestra serie, las tasas de permeabilidad primaria a 1, 6, y 12 meses fueron del 89%, 42%, y 19%, respectivamente. Las tasas de permeabilidad empezaron a disminuir tras los primeros 6 meses (Figures 1-3), de forma que se recomienda un meticuloso seguimiento y vigilancia del injerto, y deben investigarse más a fondo cualquier velocidad anormalmente alta o baja en el estudio por eco-Doppler. A pesar de que la permeabilidad fue baja, las tasas de salvamento de la extremidad fueron significativamente mayores (95%, 82%, y 73% al cabo de 1, 6, y 12 meses, respectivamente). Teniendo en cuenta que la mayoría de nuestros pacientes habían sido revascularizados previamente y que un número significativo presentaba lesiones tróficas (68%), nuestro porcentaje de salvamento de la extremidad a 1 año del 73% justifica la utilización de los AVC en este subgrupo particular de pacientes sin conducto autólogo disponible. En nuestra serie, los pacientes mayores de 70 años presentaron un aumento del riesgo de pérdida de permeabilidad secundaria (p = 0,031), lo que hace al AVC menos favorable en pacientes de mayor edad. Si bien el fracaso de derivaciones anteriores y las lesiones tróficas limitan el uso de conductos protésicos para la reconstrucción arterial, la infección del injerto de cadáver se produjo solamente en el 4% de nuestros pacientes, los cuales presentaban un riesgo más elevado de infección tras la revascularización distal. De forma similar, otro trabajo describe el uso de venas de cadáver en campos infectados y en ninguno de los pacientes se observó la recurrencia de la infección18.
En resumen, la revascularización secundaria con venas criopreservadas de cadáver está asociada con una reducción de la permeabilidad y con porcentajes de salvamento de la extremidad aceptables. Los AVC siguen siendo una opción para la reintervención en casos de revascularización de la extremidad inferior para el salvamento de la extremidad si no se dispone de una vena autóloga o si el campo quirúrgico está gravemente infectado. Por último, los pacientes mayores de 70 años tienen más probabilidades de responder peor. Es necesario disponer de un conducto alternativo mejor en casos de ausencia de vena autóloga.
Presentado en el Annual Midwestern Vascular Society Meeting, Chicago, IL, EE. UU., 6-8 de septiembre de 2007.