El presente estudio se diseñó para valorar la hipótesis de que los pacientes tratados con stents recubiertos premontados sobre balón presentan una permeabilidad aceptable a lo largo de su seguimiento constituyendo una buena alternativa al tratamiento de las estenosis recurrentes en el lugar de implantación del dispositivo. Todos los stents utilizados eran Atrium iCast, dispositivo recubierto de politetrafluoroetileno, montado sobre balón cuyo sistema tiene un calibre entre 6F y 7F. Se realizó una revisión retrospectiva de 49 pacientes (66 lesiones) en los que se realizó tratamiento endovascular. Los datos se analizaron con tablas de vida, y pruebas t. Los vasos tratados con más frecuencia fueron las arterias ilíacas (61%) y las renales (24%). Las indicaciones para la implantación de endoprótesis cubierta fueron: lesiones ateromatosas inestables (50%), estenosis recurrentes en lesiones tratadas previamente con stents (24%), aneurismas (8%), reconstrucciones de la bifurcación aórtica (7,5%), disecciones relacionadas con la reparación endovascular previa de un aneurisma (4,5%), y fracturas de stent (1,5%). La permeabilidad se evaluó mediante angiografía o eco-Doppler. La variable principal analizada fue la permeabilidad del procedimiento mientras que las variables secundarias fueron el resultado técnico y las complicaciones en el lugar de abordaje. El seguimiento medio fue de 13 meses (límites 1,5-25). La tasa de resultado técnico fue del 97%. Los desenlaces no satisfactorios se debieron a un error en el despliegue del dispositivo (n = 1) y a la colocación inapropiada del mismo (n = 1). Las tasas de permeabilidad primaria de la cohorte (n = 64) a los 6 y 12 meses fueron del 96% y 84%, respectivamente. La tasa de permeabilidad primaria asistida a los 12 meses fue del 98%. Para los stents de la arteria ilíaca (n = 38), la tasa de permeabilidad primaria fue del 97% a los 6 meses y del 84% a los 12 meses, con una tasa de permeabilidad primaria asistida del 100% a los 12 meses. En los stents de la arteria renal (n = 16) se obtuvo una tasa de permeabilidad primaria del 92% a los 6 meses y del 72% a los 12 meses con una tasa de permeabilidad primaria asistida del 92% a los 6 y 12 meses. En los tratamientos realizados por estenosis recurrente de zonas tratadas previamente mediante stent (n = 16) se obtuvo una tasa de permeabilidad primaria del 85%, permeabilidad primaria asistida del 93%, y una tasa de reestenosis del 15% a los 12 meses. Específicamente, para los dispositivos implantados por estenosis recurrente de la arteria renal en zonas tratadas previamente (n = 10) se obtuvo una tasa de permeabilidad primaria del 73%, permeabilidad primaria asistida del 82%, y tasa de reestenosis del 27%. La tasa de reestenosis incluyó dos oclusiones de la arteria renal en pacientes que no cumplieron el tratamiento con clopidogrel y dieron lugar a la pérdida del riñón homolateral en ambos casos. Las velocidades sistólicas máximas en el stent disminuyeron significativamente (p < 0,05) desde el preoperatorio hasta los 12 meses en los dispositivos ilíacos y hasta los 18 meses en los renales. El índice tobillo/brazo aumentó significativamente en los stents ilíacos desde el período preoperatorio (0,62 ± 0,18) hasta los 18 meses (0,86 ± 0,16). La exclusión satisfactoria de las lesiones ateromatosas, aneurismas, disecciones y endofugas fue del 100%. Las complicaciones en el lugar de abordaje en forma de pseudoaneurisma (n = 2), disección (n = 1), y hemorragia (n = 1) se produjeron en un 6% de los casos. Con los stents recubiertos montados sobre balón se obtiene una permeabilidad primaria aceptable, con una permeabilidad asistida excelente tras angioplastia de rescate. Esta técnica tiene una gran utilidad clínica para el tratamiento de aneurismas, extravasaciones, lesiones ateromatosas inestables y reestenosis de lesiones tratadas previamente con stent.
En la actualidad, las técnicas endovasculares representan la vanguardia de la cirugía vascular. Las contribuciones iniciales de Dotter y Gruentzig en la angioplastia y de Palmaz en los stents expandibles montados sobre balón prepararon el terreno para las intervenciones endoluminales. Las técnicas endovasculares, antaño consideradas una alternativa a la cirugía abierta para pacientes de alto riesgo, sirven hoy día como tratamiento mínimamente invasivo de primera línea para muchos problemas vasculares. Se ha demostrado que el stent es el tratamiento de rescate más eficaz para los fracasos de la angioplastia1-3 (recoil de la pared vascular o la disección del vaso). Lamentablemente, esta eclosión de las técnicas endovasculares ha dado lugar a nuevos problemas, como las endofugas y las reestenosis en las zonas de implantación del stent. Estas últimas se deben a la hiperplasia neointimal que se extiende a través del soporte metálico del dispositivo. Las tasas de reestenosis varían según el lecho vascular, el tamaño del vaso y las comorbilidades del paciente.
Los stents recubiertos constan de un esqueleto metálico tapizado de material sintético y se han utilizado principalmente en las patologías coronarias así como en estructuras no vasculares, como el árbol biliar y el árbol traqueobronquial4. Aunque fue considerada por primera vez por Dotter en 1969, su reciente utilización en el sistema vascular periférico ha sido prometedora para la exclusión de patología relacionada con aneurismas, fístulas arteriovenosas y extravasaciones vasculares5. Los stents recubiertos también resultan útiles en la reestenosis de lesiones tratadas con técnicas endovasculares previamente porque proporcionan una barrera mecánica a la hiperplasia neointimal. Estas técnicas tenían inicialmente limitaciones relacionadas con el grueso calibre de los sistemas de soporte debido al volumen del material del injerto adicional y la falta de precisión debida a la reducción inherente de un diseño autoexpandible. Los stents recubiertos expandibles (montados sobre balón) ofrecen tanto una fuerza radial como circular elevadas y muestran un acortamiento mínimo. El iCast (Atrium Medical, Hudson, EE. UU.) es el único stent recubierto montado sobre un balón disponible comercialmente en EE. UU. El objetivo del presente estudio fue determinar los resultados de este stent en pacientes con patología vascular compleja. Se incluyeron lesiones ateromatosas inestables, aneurismas, disecciones, extravasaciones y reestenosis de zonas tratadas previamente con stent.
Materiales y MétodosEste estudio fue aprobado por el comité de investigación de la University of Tennessee Chattanooga del Erlanger Medical Center. Mediante una revisión retrospectiva de las historias clínicas, tanto hospitalarias como de la consulta, se obtuvo información demográfica y sobre los procedimientos realizados. Desde febrero de 2005 hasta agosto de 2007, 60 pacientes recibieron un total de 80 stents iCast. Para el objetivo de este estudio, sólo se incluyeron los dispositivos arteriales; los criterios de exclusión consistieron en un seguimiento insuficiente (sin visitas postoperatorias en la consulta o el hospital) y la implantación de stents venosos. En dos pacientes el seguimiento fue insuficiente y en seis se habían implantado stents venosos, para un total de 10 excluidos. En esta población de estudio se produjeron tres muertes no relacionadas con la implantación del stent: una insuficiencia respiratoria, un accidente vascular cerebral y una sepsis por aneurisma micótico. Así pues permanecieron en el grupo de estudio primario 49 pacientes –37 hombres con una media de edad de 66 años, con límites entre 45 y 85 años– y se trataron con stent 66 lesiones. Los cálculos de la permeabilidad incluyeron sólo 64 dispositivos debido a dos fracasos en la implantación, que dieron lugar a una retirada y a un bypass inmediato. Los pacientes experimentaron las típicas comorbilidades vasculares descritas en la tabla I.
Para crear las tablas de vida en el análisis de permeabilidad, se utilizó el programa Statistical Package for the Social Science (SPSS, Inc., Chicago). Se usó la t de Student para la comparación de los índices tobillo-brazo (ITB) y las velocidades sistólicas máximas (VSM). La significación estadística se definió como un valor de p < 0,05. En el apartado de “Resultados” se proporcionan las determinaciones del error estándar para las tablas de vida.
La variable principal analizada fue la permeabilidad. Las variables secundarias incluyeron el resultado técnico y las complicaciones del lugar de abordaje. La permeabilidad se evaluó mediante la revisión del eco-Doppler de seguimiento o una angiografía de control. El eco-Doppler se efectuó en el laboratorio de diagnóstico Vascular (Chattanooga, TN), acreditado por la Intersocietal Commission for the Acreditation of Vascular Laboratories. La ecografía se efectuó según el protocolo a las 6 y 12 semanas; posteriormente cada 6 meses durante 2 años y, a partir de esta fecha, con carácter anual. Los criterios de estenosis mencionados en la tabla II se utilizaron para la vigilancia del stent; sin embargo, representan los valores establecidos para los vasos nativos. Estos criterios se utilizan en nuestro centro como secundarios a la falta de valores establecidos específicamente para los stents. Efectuaron e interpretaron todas las angiografías de control cirujanos vasculares de la University of Tennessee Chattanooga, certificados por un tribunal. La permeabilidad primaria se definió como un stent permeable sin ninguna intervención. La permeabilidad primaria asistida se definió como un stent permeable tras una intervención endovascular. La permeabilidad secundaria se definió como un stent permeable después de una reintervención por oclusión del mismo. El seguimiento finaliza cuando se produce una oclusión no tratable. El resultado técnico requirió el despliegue e implantación apropiado del stent. Las complicaciones en el lugar de abordaje incluyeron pseudoaneurismas, disecciones y hemorragias.
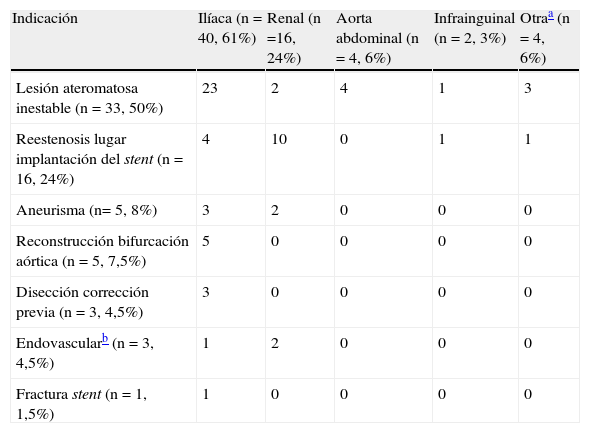
Las indicaciones para la implantación de un stent recubierto fueron: lesiones ateromatosas inestables (50%), estenosis recurrente en zonas de implantación de stent previas (24%), aneurismas (7,5%), reconstrucciones de la bifurcación aórtica (7,5%), disecciones yatrógenas seguidas de angioplastia (4,5%); relacionadas con la reparación endovascular de un aneurisma (4,5%), y por último fracturas del stent (1,5%). Las arterias diana incluyeron ilíaca común (59,1%), renal (24,3%), aorta abdominal (6,1%), tronco innominado (3%), ilíaca externa (1,5%), subclavia (1,5%), mesentérica superior (1,5%), femoral común (1,5%) y tronco tibioperoneo (1,5%). Estas arterias se analizaron por grupos: ilíacas, renales, aorta abdominal, infrainguinal y otras (tabla III). A todos los pacientes seleccionados se les prescribió un tratamiento indefinido con aspirina y clopidogrel durante 6 semanas después del procedimiento.
Vasos objetivo e indicaciones para la implantación
| Indicación | Ilíaca (n = 40, 61%) | Renal (n =16, 24%) | Aorta abdominal (n = 4, 6%) | Infrainguinal (n = 2, 3%) | Otraa (n = 4, 6%) |
| Lesión ateromatosa inestable (n = 33, 50%) | 23 | 2 | 4 | 1 | 3 |
| Reestenosis lugar implantación del stent (n = 16, 24%) | 4 | 10 | 0 | 1 | 1 |
| Aneurisma (n= 5, 8%) | 3 | 2 | 0 | 0 | 0 |
| Reconstrucción bifurcación aórtica (n = 5, 7,5%) | 5 | 0 | 0 | 0 | 0 |
| Disección corrección previa (n = 3, 4,5%) | 3 | 0 | 0 | 0 | 0 |
| Endovascularb (n = 3, 4,5%) | 1 | 2 | 0 | 0 | 0 |
| Fractura stent (n = 1, 1,5%) | 1 | 0 | 0 | 0 | 0 |
El iCast es un stent expandible, recubierto de politetrafluoroetileno (PTFE) Advanta, montado sobre un balón con un sistema de navegación de 6F/7F6. Advanta es una membrana de PTFE ultrafina, microporosa, diseñada para la biocompatibilidad que presenta un despliegue uniforme6. La tecnología de encapsulación moldeada con película fija los soportes de acero inoxidable en el PTFE para impedir el contacto con la pared luminal y proporcionar así una expansión uniforme en un intento de reducir al mínimo la protrusión de la íntima en el stent6. El iCast también está provisto de un sistema de despliegue de un solo paso, montado sobre balón, lo que permite una reducción mínima y un despliegue de precisión6.
ResultadosLa tasa de resultado técnico en la implantación del stent fue del 97% (64/66). De los dos fracasos acontecidos, el primero afectó a un paciente con estenosis de alto grado de ambas arterias ilíacas primitivas en el que se habían implantado previamente stents autoexpandibles bilaterales. La porción proximal del stent de la arteria ilíaca común izquierda se fracturó durante la tentativa de atravesar la bifurcación aórtica con el balón. Se tomó la decisión de reconstruir la bifurcación con stents recubiertos y excluir la fractura; sin embargo, cuando el iCast izquierdo salió del dispositivo introductor, el fracturado previamente emigró sobre la guía hacia la aorta. Se efectuó una tentativa de retirada del stent iCast izquierdo para recuperar el fracturado; sin embargo, el iCast emigró y salió del balón al intentar su reentrada en el dispositivo introductor. Como consecuencia de este accidente, fue necesario realizar la captura abierta del stent a través de una arteriotomía. El segundo afectó a un paciente con estenosis aortoilíaca. Los stents iCast se implantaron en la aorta abdominal y las arterias ilíacas comunes bilaterales; no obstante, el stent de la ilíaca común izquierda se solapó de forma inadecuada por detrás del stent aórtico. Por tanto, se tuvo que efectuar un bypass femoro-femoral de derecha a izquierda para subsanar la limitación del flujo en el eje ilíaco izquierdo. La exclusión satisfactoria de los aneurismas, disecciones y endofugas fue del 100% (9/9).
El seguimiento medio fue de 13 meses (límites entre 1,5 y 25 meses). El seguimiento para dos stents (3%) fue de 24 meses o más prolongado, para 30 (47%) de 12-23 meses, para 14 (22%) de 6-11 meses y para 18 (28%) de menos de 6 meses.
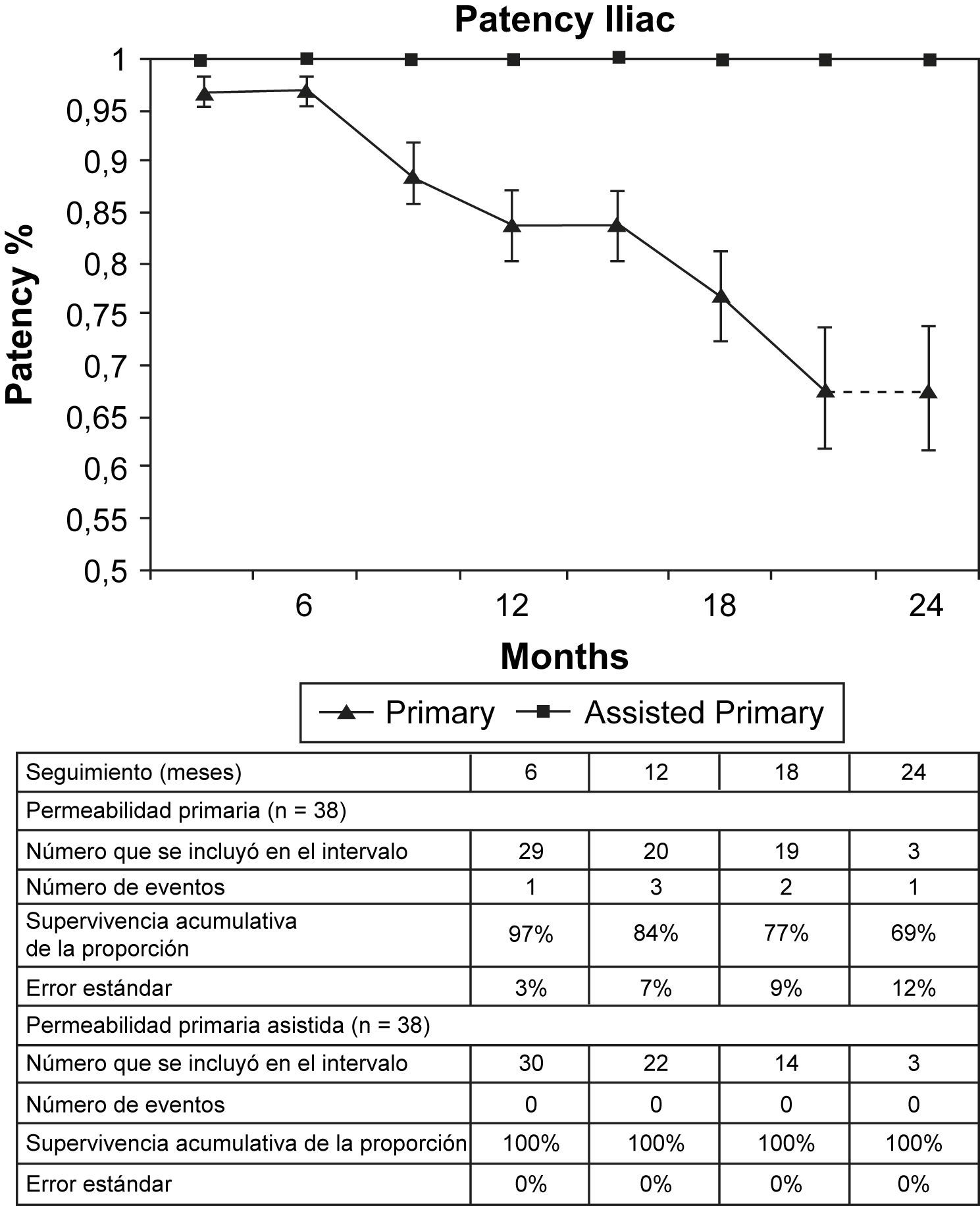
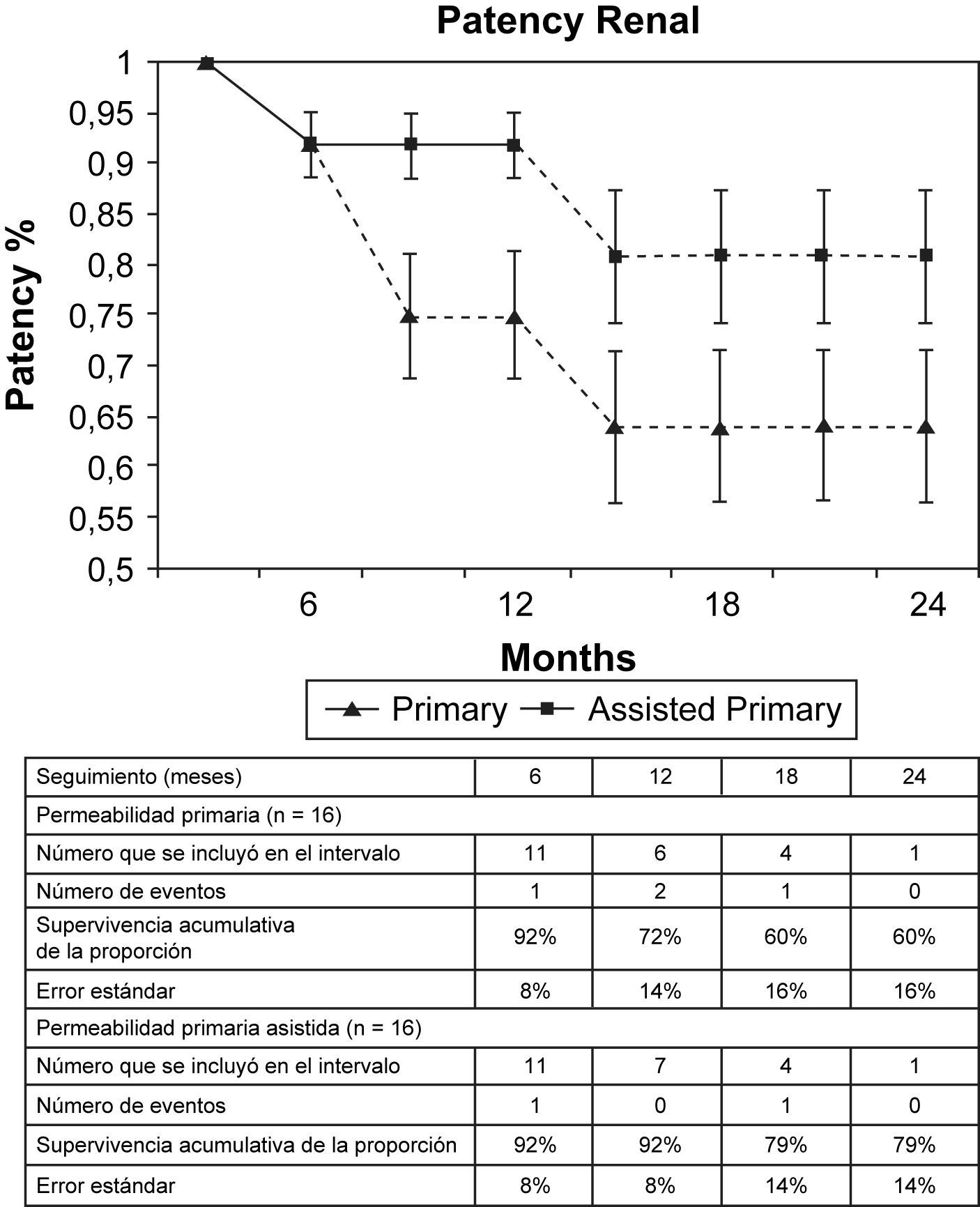
La tasa de permeabilidad primaria fue del 96% a los 6 meses, 84% a los 12 meses y 77% a los 18 meses para toda la cohorte (fig. 1). La tasa de permeabilidad primaria asistida fue del 98% a los 12 meses y del 95% a los 18 meses para toda la cohorte (fig. 1). El error estándar no superó el 10% a los 24 meses para la permeabilidad primaria o primaria asistida. Las tasas de permeabilidad primaria asistida y secundaria fueron las mismas debido a las dos oclusiones que no se pudieron solventar. Los stents en la arteria ilíaca (n = 40) tuvieron una permeabilidad primaria del 97% a los 6 meses, 84% a los 12 meses y 77% a los 18 meses, con una permeabilidad primaria asistida del 100% a los 18 meses (fig. 2). El error estándar superó el 10% después de los 20 meses para la permeabilidad primaria y fue de menos del 10% a los 24 meses para la permeabilidad primaria asistida. El diámetro medio del stent implantado en las arterias ilíacas fue de 8 mm (entre 7 y 10 mm). Los stents de la arteria renal (n = 16) tuvieron una permeabilidad primaria del 93% a los 6 meses, 72% a los 12 meses y 60% a los 18 meses con una permeabilidad primaria asistida del 92% a los 6 y 12 meses y del 79% a los 18 meses (fig. 3). El error estándar superó el 10% después de 6 meses para la permeabilidad primaria y, para la primaria asistida, después de 12 meses. Las arterias renales tuvieron un diámetro medio de 5 mm y el diámetro medio de los stents implantados fue de 6 mm (límites entre 5 y 7 mm).
La estenosis recurrente en el lugar de implantación previa incluye la de un stent implantado después de al menos una revascularización. Los stents implantados por reestenosis en el lugar de la implantación (n = 16) tuvieron una tasa de permeabilidad primaria del 93% a los 6 meses y del 85% a los 12 meses con una permeabilidad primaria asistida del 93% a los 12 meses (fig. 4). El error estándar superó el 10% después de 12 meses para la permeabilidad primaria y la primaria asistida. La tasa de reestenosis fue del 15% a los 12 meses. La reestenosis en el lugar de implantación del stent afectó a las arterias renales en el 63% (10/16) y reveló una permeabilidad primaria del 73% y una permeabilidad primaria asistida del 82% a los 12 meses. Las dos oclusiones afectaron a los stents renales implantados por reestenosis a los 1,5 meses y 5 meses, dando lugar ambas a la pérdida funcional del riñón homolateral. Uno de los procedimientos se realizó para tratar una reestenosis de un stent implantado 8 meses antes. En ningún otro vaso “diana” se produjeron oclusiones.
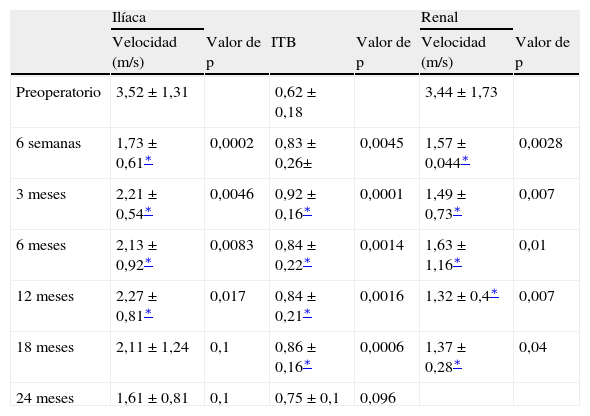
Las VSM medias de las arterias ilíaca y renal, al igual que los ITB, se describen en la tabla IV. La VSM media de los vasos ilíacos disminuyó significativamente desde 3,52 ± 1,31 m/s en el preoperatorio hasta 1,73 ± 0,61 m/s a las 6 semanas del procedimiento. A los 12 meses, se mantenían velocidades significativamente más bajas con un valor de 2,27 ± 0,81 m/s. Los ITB medios en la extremidad homolateral de los stents ilíacos mejoraron significativamente desde 0,62 ± 0,18 en el preoperatorio hasta 0,83 ± 0,26 a las 6 semanas del procedimiento. La mejora significativa de los ITB se mantuvo a los 18 meses con un valor de 0,86 ± 0,16. Las VSM medias para las arterias renales disminuyeron significativamente desde 3,44 ± 1,73 m/s en el preoperatorio hasta 1,57 ± 0,04 m/s a las 6 semanas del procedimiento. A los 18 meses, se mantenían velocidades significativamente más bajas, con un valor de 1,37 ± 0,28 m/s.
Velocidad sistólica máxima e índice tobillo:brazo (ITB)
| Ilíaca | Renal | |||||
| Velocidad (m/s) | Valor de p | ITB | Valor de p | Velocidad (m/s) | Valor de p | |
| Preoperatorio | 3,52 ± 1,31 | 0,62 ± 0,18 | 3,44 ± 1,73 | |||
| 6 semanas | 1,73 ± 0,61∗ | 0,0002 | 0,83 ± 0,26± | 0,0045 | 1,57 ± 0,044∗ | 0,0028 |
| 3 meses | 2,21 ± 0,54∗ | 0,0046 | 0,92 ± 0,16∗ | 0,0001 | 1,49 ± 0,73∗ | 0,007 |
| 6 meses | 2,13 ± 0,92∗ | 0,0083 | 0,84 ± 0,22∗ | 0,0014 | 1,63 ± 1,16∗ | 0,01 |
| 12 meses | 2,27 ± 0,81∗ | 0,017 | 0,84 ± 0,21∗ | 0,0016 | 1,32 ± 0,4∗ | 0,007 |
| 18 meses | 2,11 ± 1,24 | 0,1 | 0,86 ± 0,16∗ | 0,0006 | 1,37 ± 0,28∗ | 0,04 |
| 24 meses | 1,61 ± 0,81 | 0,1 | 0,75 ± 0,1 | 0,096 |
En el lugar de abordaje se produjeron complicaciones en un 6% de los casos (4/66). Se identificaron dos pseudoaneurismas, requiriendo uno de ellos corrección quirúrgica, y el otro, exclusión mediante inyección de trombina. Se produjo una disección que provocó un flap intimal y trombosis de la arteria femoral común y de la femoral superficial. Esta complicación requirió una tromboendarterectomía abierta y la corrección con un parche de vena safena. En la arteria humeral se produjo un evento hemorrágico mayor que requirió abordaje directo y corrección primaria. Durante el seguimiento, no se observó morbilidad adicional relacionada con complicaciones del lugar de abordaje.
DiscusiónEn el presente estudio se evaluó la eficacia y la utilidad clínica del stent iCast, un stent recubierto expandible mediante balón. El resultado técnico fue elevada (97%), y sólo tuvimos dos fracasos, ambos iatrógenos, y es probable que no se relacionaran directamente con el dispositivo. La tasa de permeabilidad primaria del 77% y la primaria asistida del 95% a los 18 meses para toda la cohorte indican la larga permeabilidad del dispositivo en una diversidad de vasos periféricos y viscerales. La subclasificación en vasos ilíacos y renales permitió un análisis de su rendimiento y permeabilidad en los diferentes lechos anatómicos. Las arterias ilíacas son más elásticas pues poseen un elevado contenido de elastina dentro de la media y por esta razón tendrían menos probabilidades de experimentar reestenosis7. Para la arteria ilíaca a los 12 meses, la tasa media documentada de permeabilidad de los stents es del 90%8 (78-97%). La tasa de permeabilidad primaria del 84% a los 12 meses obtenida en el presente estudio es más baja que las medias descritas en los estudios publicados, lo que probablemente se debe a la complejidad de las lesiones tratadas. Se implantaron 23 dispositivos para lesiones ateromatosas inestables, que incluyeron estenosis críticas consideradas de alto riesgo para la embolización o de naturaleza coraliforme (n = 15), lesiones persistentes después de angioplastia subintimal (n = 5) y úlceras penetrantes (n = 3). Se implantaron cuatro stents en otro caso por estenosis en el lugar de implantación previa. No obstante, la tasa de permeabilidad asistida del 100% a los 18 meses muestra las características de rescate de este dispositivo. Las VSM disminuyeron significativamente (p < 0,05) desde los valores preoperatorios hasta los 12 meses y los índices tobillo/brazo aumentaron significativamente desde el período preoperatorio hasta los 18 meses. En conjunto, la tasa de reintervención para los vasos ilíacos fue del 15% (6/40), sin oclusiones.
La estenosis de la arteria renal se ha estudiado extensamente. El ensayo Dutch Renal Artery Stenosis Intervention Cooperative (DRASTIC) reveló una tasa de reestenosis del 48% para la angioplastia transluminal percutánea de la arteria renal9. En un estudio, Van de Ven demostró que la tasa de reestenosis para las lesiones ostiales podía reducirse sustancialmente hasta el 14% con implantación transluminal percutánea de un stent en la arteria renal10. Esta disminución hizo que la intervención percutánea se convirtiera en el tratamiento de elección de la estenosis de la arteria renal. Más tarde, se han efectuado numerosos estudios, en los que se han obtenido unas tasas de reestenosis de la arterial renal del 15-25%7. Tras la implantación de un stent en la arteria renal, Bates et al11 describieron los factores predictivos de la necesidad de revascularización del vaso “diana” y que incluyeron la edad ≤ 67 años, diámetro del stent ≤ 5 mm, riñón solitario funcionante, antecedentes de arteriopatía periférica de la extremidad inferior y antecedentes de ictus. En los vasos que miden < 4 mm de diámetro se observa una mayor tasa de reestenosis que en algunos estudios es de hasta el 40%7,12.
En la serie del presente estudio la mayoría de los stents de la arteria renal se implantaron por reestenosis en zonas tratadas previamente con stent (10/16). La estenosis se trató con angioplastia; sin embargo, la recurrencia de la lesión dio lugar a la implantación de una nueva endoprótesis cubierta. La tasa de permeabilidad primaria en este tipo de tratamientos fue del 75%, la primaria asistida del 92% y la tasa de reestenosis del 25% a los 12 meses. Estos resultados se comparan favorablemente con las tasas medias descritas por otros investigadores en los estudios publicados. No obstante, la media en los estudios publicados corresponde a la implantación de endoprótesis en vasos nativos; y el 63% (10/16) de los del presente estudio se implantaron por reestenosis en zonas tratadas previamente mediante stent. La tasa de reestenosis de vasos nativos fue del 0% (0/5). Para estos pacientes, tratamos de obtener los valores de presión arterial y los cambios de la función renal; sin embargo, debido a la naturaleza retrospectiva de este estudio, no dispusimos de datos suficientes para efectuar un análisis significativo. Zeller et al13 describieron una serie de 33 pacientes con, al menos, una segunda incidencia de reestenosis en el lugar de implantación. A pesar del número reducido de pacientes en los grupos, dicho estudio respaldó el uso de endoprótesis cubiertas (6 pacientes, reestenosis del 17%) y de stents liberadores de fármacos (10 pacientes, reestenosis del 0%) para detener la excesiva hiperplasia neointimal probablemente presente en estos pacientes. En el presente estudio la tasa de estenosis recurrente del 27% (3/11) es alta; no obstante, esto incluye dos oclusiones no revascularizables que acontecieron a los 1,5 y 5 meses. Ambas oclusiones se produjeron en pacientes que no cumplieron el tratamiento con clopidogrel estando considerados de riesgo elevado para la reestenosis por diámetros de los vasos ≤ 4 mm. La vigilancia deparó VSM postoperatorias a los 18 meses significativamente más bajas en las arterias renales. Es probable que las dos oclusiones en arterias de alto riesgo sesgaran los datos de reestenosis ya que sólo uno de los 14 pacientes desarrolló estenosis en el lugar de implantación del iCast.
El diámetro del stent difiere entre lechos anatómicos. El diámetro medio de los dispositivos de la arteria renal fue de 6 mm y el de la arteria ilíaca de 8 mm. Las mayores tasas de permeabilidad de los ilíacos sugieren que es menos probable que los de mayor diámetro experimenten estenosis. No obstante, las dos oclusiones mencionadas previamente combinadas con el reducido número de dispositivos renales hacen que estos datos sean engañosos. Los dispositivos implantados en el tronco tibioperoneo (8,5 mm), la arteria mesentérica superior (6 mm), la arteria subclavia (8,6 mm) y el tronco innominado (7 mm) tenían diámetros que concordaban con los utilizados en las arterias renales, aunque en ninguno se observaron signos de estenosis. A pesar de que el número es demasiado reducido para extraer conclusiones definitivas, esto sugeriría que las endoprótesis de menor diámetro combinadas con la imposibilidad de anticoagulación entraña un mayor riesgo de estenosis y oclusión para el paciente.
Los stents expandibles, montados sobre un balón, muestran un acortamiento mínimo, proporcionando la precisión necesaria para las lesiones ostiales y las muy próximas a ramificaciones de los vasos. Los soportes de acero inoxidable son más rígidos y proporcionan mayor fuerza radial y circular que los autoexpandibles. Aunque esta rigidez confiere resistencia contra el retroceso elástico, también predispone al dispositivo a la deformidad a partir de la presión externa, lo que limita el número de vasos “diana” disponibles. Los stents cubiertos expandibles mediante balón no son apropiados para su implantación en vasos que cruzan una articulación o muy próximos a ella, ya que podrían provocar acodaduras y en último término fracaso. Tres se implantaron en áreas consideradas de riesgo para la deformidad potencial (uno en la femoral común, uno en la subclavia y uno en el tronco tibioperoneo); sin embargo, todos mantuvieron la permeabilidad sin una reintervención.
La tasa de complicaciones del 6% en el lugar de abordaje, obtenida en el presente estudio, coincide con las documentadas del 1-6% con las intervenciones percutáneas14. No obstante, en este sentido, en el presente estudio se incluyeron un menor número de casos en comparación a otras series publicadas.
El bajo perfil del sistema mejora potencialmente la seguridad y permite el uso de dispositivos de cierre vascular que podrían acortar el tiempo operatorio.
ConclusiónEl presente estudio demuestra la seguridad, precisión y eficacia del iCast, un stent recubierto, balón expandible. El seguimiento intermedio sugiere que la permeabilidad se mantiene con una vigilancia longitudinal y los fracasos exhiben un excelente rescate con tratamiento endovascular adyuvante. En el futuro será necesario reanalizar los datos para determinar la permeabilidad a largo plazo. Esta técnica es de gran utilidad clínica en el tratamiento de pseuaneurismas, extravasación (fugas), lesiones intimales inestables e hiperplasia recurrente.