Puntos clave
Las enfermedades neuromusculares se producen por alteración en algún componente de la unidad motora1. Cursan con hipotonía, debilidad, atrofia muscular, alteración de los reflejos osteotendinosos, y asocian contracturas y deformidades. Algunas presentan afectación sensitiva, autonómica, de sistema nervioso central y/o cardiopatía. Son frecuentes los trastornos nutricionales y psicológicos.
Los problemas respiratorios son la principal causa de morbimortalidad, de especial relevancia en las enfermedades neuromusculares que afectan a la musculatura proximal y la función bulbar. El deterioro de la función pulmonar suele ser inicialmente subclínico y progresivo. La ventilación no invasiva (VNI) y nuevas técnicas fisioterápicas han mejorado la calidad de vida y la supervivencia en estos pacientes.
Las enfermedades neuromusculares requieren un tratamiento multidisciplinario bajo la tutela de coordinador, cuya labor debe optimizar la salud del paciente, previniendo y detectando las complicaciones y comorbilidades posibles.
Clasificación de las enfermedades neuromusculares en la edad pediátricaDistrofias muscularesSon miopatías hereditarias que se caracterizan por una degeneración muscular progresiva.
- —
Distrofia muscular de Duchenne: es la enfermedad neuromuscular más frecuente con una incidencia de 1/3.500 varones recién nacidos (RN). Se debe a una mutación en el gen de la distrofina, con herencia ligada al cromosoma X. Es progresiva y se caracteriza por un patrón miogénico en el electromiograma y una elevación de las cifras de creatincinasa. Por lo general, la sintomatología se inicia antes de los 5 años con debilidad proximal, dificultad para la marcha y maniobra de Gowers positiva. Progresivamente se presenta pérdida de la deambulación y disfagia. Se asocia cardiopatía, con riesgo de insuficiencia cardíaca y arritmias, y un porcentaje de estos pacientes tiene retraso cognitivo. El 90% desarrollan escoliosis, especialmente tras la pérdida de la marcha. La afectación respiratoria suele manifestarse en la infancia tardía o adolescencia. El síndrome de apnea-hipoapnea obstructiva del sueño (SAHOS) se inicia en la primera década de la vida y precede en años a la hipoventilación2. Los corticoides (0,75mg/kg/día de prednisolona durante períodos de 6 meses a 2 años) han demostrado mejorar la fuerza y función muscular, el flujo pico durante la tos (PCF) y la capacidad vital forzada (FVC), y reducir la progresión de la escoliosis3,4.
- —
Distrofia muscular de Becker: es menos frecuente y grave, con un inicio más tardío de los síntomas y menos repercusión respiratoria.
- —
Distrofia miotónica de Steinert: es de herencia autosómica dominante, y suele ser de transmisión materna. Las manifestaciones clínicas se suelen iniciar en la adolescencia o en la edad adulta, aunque hay formas neonatales. La afectación más importante es la cardíaca.
Son un grupo de enfermedades hereditarias debido a una mutación en el gen de supervivencia de la motoneurona (gen SNM) situado en el cromosoma 5, de transmisión generalmente autosómica recesiva. Produce una degeneración de las neuronas del asta anterior de la médula, con atrofia y déficit funcional de los músculos correspondientes, así como hipo/arreflexia. En la raza caucásica, es la segunda causa de muerte por enfermedad recesiva después de la fibrosis quística.
Hay varias formas clínicas en función de la gravedad y momento de aparición de los primeros síntomas:
- —
Tipo I o forma aguda de la enfermedad de Werdnig-Hoffmann (comienza antes de los 6 meses de vida).
- —
Tipo II o forma intermedia de Werdnig-Hoffmann (sintomáticos entre los 6 meses y los 2 años de vida).
- —
Tipo III o Kugelberg-Welander (se manifiesta después de los 2 años).
- —
Tipo IV (inicio en la vida adulta).
A pesar de que la incidencia es de 1/6.000 RN (inferior a la de la distrofia de Duchenne) el inicio es más temprano, por lo que se generan más consultas durante la edad pediátrica.
Pueden presentar disautonomía y afectación de pares craneales y musculatura bulbar5. Los pacientes con atrofia muscular espinal tipos I y II presentan disfunción respiratoria temprana, con tórax acampanado, por afectación de la musculatura proximal y debilidad de los músculos intercostales con relativa preservación de la función diafragmática.
Neuropatías periféricasEste grupo engloba la enfermedad de Charcot-Marie-Tooth y la de Dejerine-Sottas y Refsum, entre otras. La enfermedad de Charcot-Marie-Tooth es la neuropatía sensitivomotora hereditaria más frecuente. Está causada por mutaciones en genes que codifican la mielina u otras proteínas encargadas de la integridad y función axonal. La afectación muscular es de predominio distal con relativa preservación de la musculatura respiratoria. Sin embargo, en una minoría de los pacientes, con subtipos específicos como el 2C y el debido a mutaciones en el gen GDAP16,7 se ha descrito una afectación de los nervios frénicos y laríngeos, con paresia diafragmática y de cuerdas vocales.
Síndromes miasteniformesSon enfermedades genéticas que afectan a la unión neuromuscular. Tienen en común la fatigabilidad en el electromiograma pero son diferentes en cuanto a sus manifestaciones clínicas, anatomofisiología y genotipo. Las congénitas no autoinmunes son progresivas.
En la época neonatal se pueden presentar dificultades para la alimentación, ptosis, apneas, dificultad respiratoria y estridor. Más tarde, durante el crecimiento, los pacientes pueden desarrollar hipoventilación, apneas y síndrome aspirativo.
Afecta de manera preferente a los músculos que tienen mayor proporción de placas motoras por número de fibra muscular, como el diafragma y la musculatura bulbar.
Miopatías congénitas y metabólicasDentro de este grupo encontramos miopatías no filiadas, mitocondriales, lipidosis y glucogenosis.
Fisiopatología respiratoria en el paciente neuromuscularLos niños con enfermedades neuromusculares tienen riesgo de desarrollar una importante morbilidad respiratoria, desde infecciones recurrentes hasta insuficiencia ventilatoria, siendo ésta la causa más frecuente de mortalidad8,9.
La insuficiencia respiratoria puede ser hipoxémica debido a enfermedades del parénquima, como las infecciones recurrentes o la neumopatía aspirativa, o hipercápnica, debido a una disfunción de la mecánica ventilatoria, siendo esta última la más frecuente. En ella intervienen alteraciones de la caja torácica, musculatura respiratoria y centro respiratorio.
La progresión de la debilidad muscular no tiene una correlación lineal con la pérdida de fuerza de la musculatura respiratoria, especialmente en aquellos pacientes con debilidad muscular de predominio distal.
En la figura 1 se muestra un esquema de la evolución natural de la enfermedad respiratoria en estos pacientes. La progresión y la afectación de la musculatura proximal y bulbar son fundamentales para establecer el pronóstico.
Cabe destacar que la sintomatología de la insuficiencia respiratoria empieza siendo inicialmente nocturna y poco sintomática por la atonía muscular que se produce durante la fase del sueño REM, especialmente en aquellos pacientes con debilidad diafragmática. La alteración gasométrica en forma de hipercapnia diurna suele ser tardía, por lo que el objetivo debe ser la detección y el tratamiento precoz de la sintomatología nocturna.
Hay 5 factores fisiopatológicos que predisponen a la insuficiencia respiratoria.
Lectura rápida
La disfunción respiratoria es más frecuente en las enfermedades neuromusculares progresivas y con debilidad muscular de predominio proximal y/o afectación bulbar. Cuatro factores determinan el deterioro respiratorio: la debilidad de la musculatura inspiratoria y espiratoria, la patología del sueño —que incluye apneas e hipoventilación nocturna— y la debilidad de la musculatura orofaríngea.
La debilidad de los músculos intercostales externos y accesorios, así como del diafragma, ocasionan una disminución progresiva de la capacidad vital (CV), enfermedad pulmonar restrictiva e hipoventilación. Como se ha señalado previamente, la disfunción ventilatoria empieza siendo nocturna y se asocia a valores de FVC < 60% del teórico10. Con frecuencia es subclínica y pasa desapercibida a menos que se realice una anamnesis y un estudio dirigido. Los pacientes con hipoventilación nocturna no tratada tienen riesgo de insuficiencia respiratoria diurna en los 12–24 meses posteriores. En este caso el inicio de soporte ventilatorio nocturno adecuado durante un tiempo mínimo de 4h suele corregir el trastorno.
La taquipnea compensatoria del bajo volumen corriente (Vc) es un signo precoz de hipoventilación.
La disminución de la CV produce también una tos débil con retención de secreciones y formación de microatelectasias con disminución de la complianza pulmonar. Finalmente los tapones mucosos alteran el cociente ventilación/perfusión (V/Q) produciendo hipoxemia, siendo este un signo tardío.
Debilidad de la musculatura espiratoriaLa espiración es un proceso pasivo, sin embargo en determinadas circunstancias participa la musculatura accesoria, intercostales internos y musculatura abdominal. La afectación de estos grupos musculares, junto con la disminución de la CV condiciona una tos ineficaz y una dificultad para el drenaje de secreciones. Aumenta el riesgo de infección respiratoria y disminuye la efectividad del mecanismo de protección frente a aspiraciones.
Patología del sueñoMás del 80% de los pacientes con enfermedades neuromusculares presentan anomalías ventilatorias de intercambio de gases o de arquitectura del sueño (SAHOS y/o hipoventilación)11,12. Esto puede deberse a 2 mecanismos:
— Los pacientes con enfermedades neuromusculares presentan una incidencia 10 veces mayor a la de la población general de enfermedad respiratoria durante el sueño13 en forma de hipoapneas y apneas, obstructivas y centrales. El principal responsable de la apnea obstructiva es la debilidad de los músculos dilatadores faríngeos con tendencia al colapso de la vía aérea superior. Se presenta con frecuencia en la primera década de la vida y suele preceder en años a la hipoventilación nocturna14.
La hipertrofia adenoamigdalar, la obesidad y las alteraciones anatómicas como la retrognatia o macroglosia pueden empeorar los episodios.
Existe una pobre correlación entre la sintomatología de los trastornos respiratorios durante el sueño y los hallazgos polisomnográficos, siendo coincidentes sólo en el 30-56% de los casos15.
— La debilidad muscular inspiratoria se agrava en la fase REM. Inicialmente la hipoxemia produce arousals que permiten acortar estos períodos, pero con el paso del tiempo se produce una desensibilización de los quimioceptores y una incapacidad de respuesta muscular responsable del agravamiento de los síntomas.
Tanto la hipoventilación nocturna como el SAHOS condicionan un aumento de morbilidad y mortalidad en estos pacientes, cambios de comportamiento, alteraciones del crecimiento somático y desarrollo neurológico, así como disminución de la calidad de vida. A largo plazo pueden desencadenar hipertensión pulmonar8,16. Todas estas complicaciones pueden prevenirse y la mayoría de ellas revierten con tratamiento.
Afectación bulbar y de la musculatura orofaríngeaAdemás de su relación con el SAHOS, produce disfagia, incoordinación deglutoria y aspiraciones. La disfagia es inicialmente a líquidos, con manifestaciones clínicas como tos y atragantamiento. En algunos casos sin embargo, y teniendo en cuenta la debilidad del reflejo tusígeno, las aspiraciones son silentes y habrá que tenerlas en cuenta en pacientes con infecciones respiratorias de repetición.
Deformidad torácicaInicialmente los pacientes con enfermedad neuromuscular tienen una elevada complianza torácica con tendencia a la respiración paradójica toracoabdominal y aumento del trabajo respiratorio. En la edad adulta, por el contrario, la respiración superficial asociada a la debilidad muscular produce anquilosis de las articulaciones costovertebrales y fibrosis de músculos, ligamentos y tendones con una menor complianza torácica, y por tanto menos tendencia al colapso del tórax14.
La cifosis, la escoliosis y las formas mixtas contribuyen al deterioro de la función respiratoria con descenso de la CV. La cirugía correctiva enlentece la pérdida de función, mejora la calidad de vida y el cuidado de los pacientes17,18.
Lectura rápida
La afectación de la musculatura inspiratoria produce una disminución de la capacidad vital y por lo tanto un patrón respiratorio restrictivo. Junto con la disminución de la fuerza espiratoria contribuye a una tos débil e ineficaz que predispone a la formación de atelectasias y neumonías recurrentes. La debilidad muscular se hace más evidente durante la fase de sueño REM (rapid eyes movement), debido a la atonía muscular asociada, por lo que estos pacientes presentan hipoventilación, inicialmente nocturna.
La debilidad de la musculatura orofaríngea y la alteración de los quimioceptores centrales se asocian al síndrome de apnea-hipoapnea obstructiva del sueño (SAHOS), que suele preceder en años a la hipoventilación. Con frecuencia estos cambios son progresivos y subclínicos y se debe indagar sobre ello en cada visita.
En el seguimiento de pacientes con enfermedades neuromusculares debe realizarse anamnesis y exploración física dirigida. En la tabla 1 se recogen los signos y síntomas que se asocian a la disfunción respiratoria.
Signos y síntomas de disfunción respiratoria en las enfermedades neuromusculares
| Respiración superficial |
| Taquicardia y taquipnea |
| Tos débil |
| Habla entrecortada |
| Uso de musculatura accesoria |
| Ortopnea |
| Disnea de reposo |
| Pérdida de apetito |
Síntomas de trastornos del sueño
|
Pruebas funcionales
|
Signos indicativos de afectación diafragmática
|
FVC: capacidad vital forzada; PEM: presión espiratoria máxima; PIM: presión inspiratoria máxima.
Están indicadas diversas exploraciones para la determinación de la función pulmonar en estos pacientes:
— Una manera sencilla de evaluar la función respiratoria y estudiar su evolución es la espirometría. En ella veremos una disminución de la FVC < 80%. El volumen espiratorio en el primer segundo (FEV1) disminuye de forma proporcional al descenso de la FVC por lo que el cociente de ambos (FEV1/FVC) estará normal o aumentado.
Lectura rápida
La taquipnea es un signo clínico precoz de enfermedad restrictiva mientras que la hipoxemia suele aparecer de forma más tardía relacionada con atelectasias y enfermedad restrictiva grave. Las principales herramientas de evaluación funcional son la espirometría forzada, que mostrará una curva pequeña con disminución de la capacidad vital forzada (FVC) e índice volumen espiratorio en el primer segundo/FVC (FEV1/FVC) normal o aumentado. El pico flujo durante la tos (PCF) y la medición de la presión espiratoria máxima (PEM) y presión inspiratoria máxima (PIM) son herramientas de apoyo.
En adultos, una FVC < 1l o < 50% respecto al teórico es un factor predictivo de mortalidad en pacientes sin asistencia respiratoria19.
Mediante pletismografía se objetiva que los enfermos neuromusculares presentan un patrón respiratorio restrictivo con disminución de la capacidad pulmonar total (CPT) < 80% y de la CV. El volumen residual puede estar elevado a expensas de la debilidad de la musculatura espiratoria a diferencia de lo que sucede con la enfermedad restrictiva de origen intraparenquimatoso.
Otras pruebas funcionales de utilidad son la presión inspiratoria máxima (PIM) y la presión espiratoria máxima (PEM). Son más sensibles para detectar la debilidad muscular pero tienen el inconveniente de que son más difíciles de realizar en la edad pediátrica, poco reproducibles y muy dependientes del esfuerzo del paciente y del entrenamiento del personal de laboratorio. En adultos, una PIM < 30 cmH2O o una PEM < 40 cmH2O se asocian a hipoventilación y riesgo de fracaso respiratorio. De hecho, una PIM < 60 cmH2O se considera criterio de apoyo para inicio de VNI nocturna.
La mayoría de estudios con pruebas funcionales se han aplicado en pacientes adolescentes afectados de enfermedad de Duchenne, y son escasos los estudios en otros grupos de enfermos y en edades escolares.
La función diafragmática presenta una afectación variable en estos pacientes. Se manifiesta como respiración abdominal paradójica, que empeora en decúbito supino con tendencia a la desaturación nocturna. Para su estudio es útil comparar la espirometría en decúbito supino y en sedestación. Una disminución > 7% de la FVC en decúbito es indicativa de debilidad diafragmática proporcionalmente superior a la del resto de grupos musculares respiratorios20.
La gasometría, la capnografía y la oximetría de pulso se utilizan con frecuencia como herramientas de apoyo.
Efectividad de la tosDepende de una capacidad inspiratoria adecuada (mínimo 60% de la CV teórica), cierre glótico competente y de una fuerza espiratoria efectiva. El flujo normal durante la tos oscila entre los 6 y 16l/s. Para su evaluación un método fácil y asequible es la realización del pico flujo espiratorio (PEF), aunque se aconseja sustituirlo por la medición del PCF, que es menos dependiente del esfuerzo del paciente. Su valor está relacionado con la edad, el peso y la talla del individuo y se correlaciona con su capacidad de eliminación de secreciones. En adultos, valores de PCF < 160l/min se asocian a infecciones recurrentes y aumento de la mortalidad, por lo que precisan asistencia de la tos diaria. Valores entre 160–270l/ min se relacionan con complicaciones en caso de agudización respiratoria, por lo que se indicará tos asistida en los episodios agudos21. Se ha demostrado que un reconocimiento e intervención temprana reduce el riesgo de atelectasias y neumonía, así como la tasa de hospitalización22,23.
Se dispone de varias modalidades de asistencia de tos:
- —
Asistencia manual con compresión abdominal y/o torácica.
- —
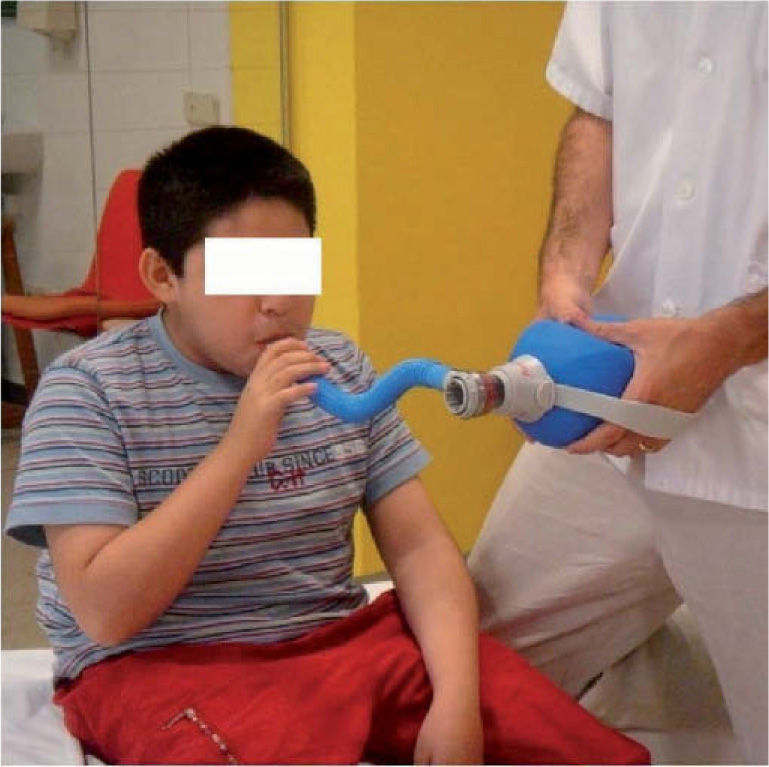
Tos asistida manual con bolsa autohinchable (fig. 2) o VNI: se administra un flujo de aire coordinado con la inspiración del paciente para incrementar su CV antes del esfuerzo espiratorio.
- —
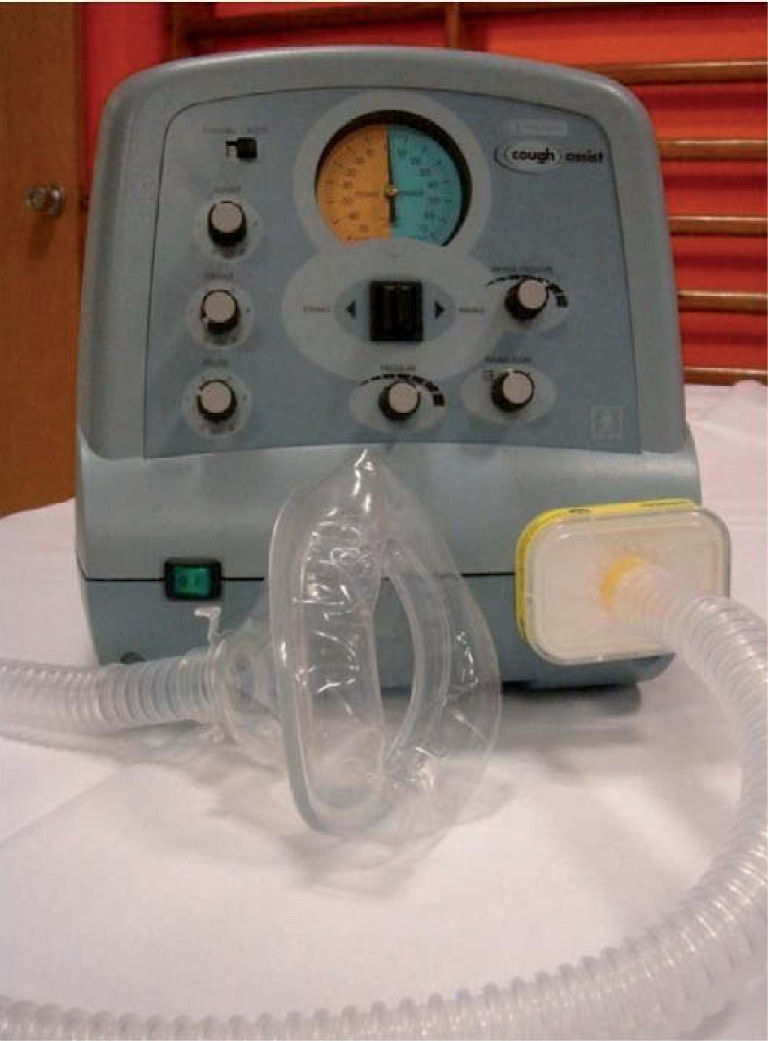
Mechanical in-exsufflation (MIE) (fig. 3): simula la tos generando una presión positiva en la vía aérea seguida de una presión negativa espiratoria24. Su uso parece más efectivo que las técnicas manuales, sobre todo en pacientes con escoliosis en los que resulta difícil la asistencia manual. Incluso en pacientes con traqueostomía, el MIE parece ofrecer ventajas frente a la aspiración convencional ya que permite eliminar tapones mucosos de vías aéreas distales, evita el trauma de las mucosas respiratorias y mejora el bienestar del paciente25,26.
En casos en los que aparezcan atelectasias persistentes sin respuesta al resto de técnicas no invasivas, se puede realizar lavado bronquial mediante fibrobroncoscopia.
¿Cuándo derivar al neumólogo?Los criterios de derivación publicados en diferentes artículos y consensos se recogen en la tabla 227. En general se propone una derivación temprana para obtener un funcionalismo basal y seguimiento puesto que el deterioro suele ser progresivo y subclínico.
Criterios de derivación al neumólogo
Criterios de la ATS en la distrofia muscular de Duchenne27:
|
Revisión Sharma en Pediatrics20:
|
En nuestro centro se remiten bajo los criterios ATS y/o:
|
ATS: American Thoracic Society; FVC: capacidad vital forzada; SAHOS: síndrome de apnea-hipoapnea obstructiva del sueño.
La infección respiratoria en el paciente neuromuscular, tanto de origen viral como bacteriano, es la principal causa de insuficiencia respiratoria aguda. Ello se debe a que la infección de vías superiores produce una disminución de la fuerza respiratoria en pacientes con baja reserva muscular28. Además, la dificultad para el drenaje y eliminación de secreciones aumenta el riesgo de formación de atelectasias y neumonías.
Lectura rápida
Los valores de FVC < 60% y de PCF < 160l/min se asocian a infecciones recurrentes, trastornos del sueño y aumento de la mortalidad. En la gasometría, las cifras de bicarbonato elevadas aun en ausencia de hipercapnia son indicativas de disfunción ventilatoria. La polisomnografía (PSG) es la prueba más sensible para el estudio de los trastornos del sueño, pero de no estar disponible se puede sustituir por determinación continua de oximetría de pulso y capnografía. La desaturación en ausencia de enfermedad parenquimatosa es un signo de hipoventilación. La administración de oxigenoterapia aislada a estos pacientes inhibe el centro respiratorio y aumenta la hipercapnia.
Para la correcta valoración del paciente deben considerarse los siguientes puntos:
- —
Anamnesis y exploración física general.
- —
Exploración respiratoria: excursión torácica, frecuencia respiratoria, uso de musculatura accesoria, movimiento abdominal paradójico y hallazgos auscultatorios.
- —
Saturación de hemoglobina (SatHb). Frecuencias respiratoria y cardíaca.
- —
Antecedentes: edad del paciente y grado de evolución de su enfermedad, apneas nocturnas, uso de VNI previo al episodio, neumonías, ingresos hospitalarios de causa respiratoria, ingresos en unidad de cuidados intensivos, disfagia, cirugía de escoliosis en los últimos 3 meses, capacidad de deambulación y pruebas funcionales en estado basal.
- —
Valores de FVC < 1l, FVC < 50% o PCF < 160l/min constituyen un alto riesgo de infección respiratoria grave29.
La realización de pruebas complementarias dependerá de cada paciente concreto:
- —
Analítica sanguínea: si hay afectación del estado general que oriente a etiología bacteriana grave y/o para obtener el equilibrio acidobásico para el estudio de una posible acidosis respiratoria. El hallazgo de una cifra alta de bicarbonatos, aún con presión de dióxido de carbono en sangre venosa periférica (PvCO2) normal es un signo de hipoventilación crónica30.
- —
Gasometría arterial: en determinados pacientes hipoxémicos, con insuficiencia respiratoria crónica moderada o grave y en caso de duda ante la muestra de gases venosos o capilares.
- —
Radiografía de tórax: si se observan asimetrías auscultatorias, hipoxemia y/o deterioro brusco de la función pulmonar.
- —
Cultivo de esputo o aspirado traqueal (en pacientes traqueostomizados).
Valoración de las distintas medidas terapéuticas:
- —
Hidratación abundante para mantener las secreciones fluidas.
- —
No hay recomendaciones específicas en la literatura médica acerca de la antibioticoterapia. El uso de tratamiento antibiótico de rutina es controvertido y debe valorarse en cada paciente de forma individual21. La amoxicilinaácido clavulánico cubre las principales bacterias responsables de las infecciones respiratorias comunitarias, así como las bacterias anaerobias, importantes en caso de aspiración.
- —
Los mucolíticos orales no tienen evidencia científica sobre la eficacia en el manejo de secreciones en pacientes con neumonía o infección respiratoria aguda31. Su uso se ve limitado al empleo compasivo de DNasa (Pulmozyme®) intratraqueal o nebulizada en pacientes con atelectasias debidas a tapones mucosos32–34.
- —
Los antitusivos están contraindicados, debido a que aumentan el riesgo de atelectasia35,36.
- —
Es importante señalar que en el paciente neuromuscular es mucho más frecuente la disnea por un mal manejo de las secreciones y tos ineficaz que por sibilancias relacionadas con procesos broncoobstructivos de tipo asmático o por hiperreactividad bronquial.
- —
Se debe incrementar la frecuencia de la tos asistida en caso de mal manejo de secreciones por tos ineficaz, y en especial cuando la SatHb sea inferior al 94%37.
- —
Tratar de forma adecuada el dolor y la fiebre para disminuir el trabajo respiratorio y el gasto energético.
- —
Ofrecer soporte nutricional precoz.
- —
El soporte ventilatorio deberá iniciarse por indicación clínica y/o hallazgos gasométricos.
Está indicado el ingreso hospitalario en caso de afectación del estado general, signos clínicos o gasométricos de fracaso ventilatorio, SatHb < 95%, infección grave y pacientes con enfermedad respiratoria restrictiva severa en los que sea preciso intensificar las medidas fisioterapéuticas o el soporte ventilatorio.
Lectura rápida
La asistencia ventilatoria es la base del tratamiento en el paciente con hipoventilación o insuficiencia respiratoria crónica. Se debe realizar derivación precoz al neumólogo porque la detección y el tratamiento temprano de la hipoventilación nocturna y su tratamiento, con ventilación no invasiva, mejora la calidad de vida y la supervivencia. La modalidad empleada es la bifásica, que permite mejorar el intercambio de gases y retrasar el inicio de la hipoventilación diurna. Los procesos infecciosos recurrentes pueden ser indicativos de tos ineficaz y/o síndrome aspirativo. Son importantes la fisioterapia respiratoria y especialmente la asistencia de la tos y los cuidados nutricionales y ortopédicos. La enfermedad restrictiva grave no contraindica la cirugía torácica. Los pacientes deben recibir vacunación antineumocócica y antigripal estacional.
Se pueden clasificar en 2 grandes grupos: SAHOS e hipoventilación nocturna.
Las recomendaciones de la American Thoracic Society (ATS) para el estudio del sueño en pacientes con enfermedad de Duchenne son las siguientes11:
- —
En cada visita revisar la calidad del sueño y los síntomas relacionados con hipoventilación nocturna.
- —
En pacientes en silla de ruedas es necesario un estudio anual de polisomnografía con determinación continua del CO2, siempre que esté disponible; si no lo está, se puede sustituir por oximetría de pulso y determinación continua de CO2 durante el sueño.
Generalmente los trastornos respiratorios del sueño son evidentes cuando la FVC < 60%, por lo que muchos especialistas recomiendan el estudio del sueño anual a partir de ese momento.
Hay varios trabajos que intentan establecer factores predictivos de enfermedad respiratoria durante el sueño y son los siguientes38,39:
- —
Hipercapnia diurna (tardío).
- —
FEV1 < 40%.
- —
Capacidad vital forzada inspiratoria (FIVC) < 60% del teórico se asocia a trastorno en fase de sueño REM y < 25% a hipoventilación diurna.
- —
PIM < 45 cmH2O.
Como en el resto de pacientes pediátricos, está indicada una revisión por el otorrinolaringólogo por si el paciente puede beneficiarse de una adenoamigdalotomía.
Soporte ventilatorioEl soporte ventilatorio, inicialmente nocturno, mejora el intercambio de gases, favorece el reposo de la musculatura inspiratoria, restablece la sensibilidad de los quimioceptores centrales, mejora la complianza pulmonar y reduce la hipercapnia y la somnolencia diurna enlenteciendo el deterioro de la función pulmonar40,41. Con todo ello mejora la calidad de vida y disminuye la morbilidad y mortalidad en los pacientes tratados42,43. Por lo tanto, se debe realizar un diagnóstico y un tratamiento precoz.
Habitualmente se utiliza la VNI con 2 niveles de presión y modalidad spontaneous/timed (S/T) y, con menor frecuencia, modalidad presión soporte (PS). El uso de la presión aérea positiva continua (CPAP) está limitado en estos pacientes, puesto que el SAHOS suele acompañarse también de hipoventilación nocturna, con fatiga muscular y riesgo de apneas prolongadas. Es muy importante tener en consideración que la desaturación nocturna es una manifestación de hipoventilación, por lo que nunca debe tratarse con oxigenoterapia aislada, ya que puede alterar el mecanismo de arousal dependiente de hipoxemia y empeorar la hipercapnia de forma rápida y progresiva. De no tratarse la hipercapnia nocturna se sigue, inevitablemente, de hipercapnia diurna44. Por otro lado, el hallazgo de hipercapnia diurna es un buen predictor del trastorno respiratorio durante el sueño y requiere ser evaluado siempre.
Está indicado iniciar soporte ventilatorio nocturno en aquellos pacientes que tengan sintomatología de SAHOS (no solventable con cirugía adenoamigdalar) o hipoventilación y/o uno o más de los siguientes45:
- —
Presión de dióxido de carbono en sangre arterial (PaCO2) > 45mmHg y/o elevación de bicarbonatos.
- —
SatHb ≤ 88% con duración mínima de 5min durante el sueño.
- —
PIM ≤ 60 cmH2O.
- —
FVC ≤ 50% del predicho.
Si a pesar de un soporte de tos y VNI nocturna correctos persiste hipercapnia, desaturación, disnea diurna y/o infecciones respiratorias recurrentes está indicado añadir soporte ventilatorio diurno46.
Para el caso del soporte diurno se recomienda el uso de ventiladores convencionales ciclados por volumen, aplicados de forma intermitente, con una pieza bucal.
Se debe considerar la traqueostomía en caso de enfermos con intubación prolongada, procesos obstructivos de vía aérea superior, afectación bulbar importante y/o con otras contraindicaciones de uso de la VNI. La traqueostomía tiene la ventaja de que es posible establecer una interfase paciente-ventilador más segura, permite administrar presiones más altas en pacientes con escoliosis graves o enfermedades del parénquima y se pueden aspirar secreciones directamente de la vía aérea. Como inconvenientes presenta mayor riesgo de infección, alteración en la comunicación del paciente y riesgo de obstrucción de la cánula por tapones mucosos47,48.
Otras medidas de apoyo y prevención en el cuidado respiratorio- —
Vacunación: además de la vacunación obligatoria, se recomienda la vacunación antineumocócica y antigripal anual. En pacientes menores de 2 años con enfermedades neuromusculares sintomáticas la administración de anticuerpos monoclonales contra el virus respiratorio sincitial ha demostrado disminuir la tasa de hospitalizaciones49,50.
- —
Control ponderal: son frecuentes la desnutrición y la obesidad, ambas relacionadas con la función respiratoria. La obesidad, generalmente secundaria a la inmovilización, puede empeorar el patrón restrictivo y el SAHOS. La desnutrición puede ser secundaria al aumento del consumo calórico y a las dificultades de deglución.
- —
Descartar neumopatía aspirativa: aparte de la disfagia, algunos pacientes presentan alteraciones autonómicas, gastroparesia y reflujo gastroesofágico.
- —
Medidas ortopédicas y rehabilitadoras.
- —
Apoyo psicológico.
- —
Educación del paciente y de la familia: debe explicarse de forma progresiva el pronóstico y la evolución esperable de la enfermedad, enseñar el reconocimiento de los síntomas respiratorios de alarma y medidas de actuación. En determinados pacientes puede ser de utilidad la oximetría de pulso domiciliaria para identificar el riesgo de hospitalización durante las infecciones intercurrentes. En el caso de pacientes graves, debe abordarse de forma programada y serena, con la familia y el propio paciente según su edad, la posibilidad de complicaciones respiratorias fatales y pactar con ellos medidas terapéuticas al final de la vida.