Puntos clave
La volemia del recién nacido es de 80ml/ kg. Durante el período neonatal y los meses siguientes se producen cambios significativos en la masa de hematíes. Durante las primeras semanas de vida va disminuyendo la producción de hematíes a la vez que aumenta la proporción de hemoglobina (Hb) A (con lo que aumenta la liberación de oxígeno a los tejidos) y se almacena hierro para la posterior hematopoyesis. A las 8-12 semanas los valores de Hb alcanzan su punto más bajo (unos 11g/dl), disminuye la oferta de oxígeno a los tejidos, se estimula la producción de eritropoyetina y, por ende, la de hematíes. Estos cambios no comportan necesariamente una anemia funcional en el recién nacido.
La anemia de la prematuridad es un grado más acentuado de la anemia fisiológica. El nivel mínimo de Hb se alcanza antes que en el neonato a término porque la supervivencia de los hematíes es menor, la velocidad de crecimiento del prematuro es mayor y esta población tiene déficit de vitamina E si no recibe aporte exógeno. El nivel mínimo de Hb también es más bajo que en el recién nacido a término (RNT), de unos 9g/dl, puesto que la eritropoyetina se estimula con valores menores (7-9g/dl) en este grupo, al ser menores sus necesidades de oxígeno1.
Los depósitos de hierro también son menores en el prematuro por lo que se agotan antes en la fase hematopoyética. Además, en el RNT el 70-80% de la Hb es fetal (HbF) mientras que en prematuros llega hasta el 97%. Este tipo de Hb tiene más afinidad por el oxígeno, por tanto en iguales condiciones los prematuros tendrán más dificultad para liberar oxígeno hacia los tejidos, porque habitualmente tienen unas necesidades inferiores.
La anemia neonatal se define como un hematocrito central < 45% (en sangre capilar pueden encontrarse valores hasta 10% superiores) o Hb < 15g/dl, durante la primera semana de vida2, o como un valor de Hb o hematocrito por debajo de más de 2 desviaciones estándar respecto a la media de su mismo grupo de edad3. La necesidad de tratamiento depende de la clínica y de la edad gestacional.
EtiologíaLa anemia fisiológica del recién nacido y la anemia de la prematuridad son las dos causas más frecuentes de anemia en los neonatos. Es importante recalcar que la anemia neonatal está fuertemente relacionada con la cantidad de sangre extraída para procedimientos diagnósticos, especialmente en los niños de extremado bajo peso al nacer3.
La clasificación según las distintas causas de anemia en el neonato se muestra en la tabla 1.
Causas de anemia en el neonato
|
Lectura rápida
Definimos anemia neonatal como un hematocrito central < 45% o hemoglobina (Hb) < 15g/dl durante la primera semana de vida. De forma fisiológica, la Hb desciende hasta alcanzar su nivel más bajo a las 8-12 semanas (9g/dl en el pretérmino y 11g/dl en el niño a término). Así pues, la necesidad de tratamiento dependerá no sólo del valor de hematocrito o Hb sino también de la sintomatología y la edad gestacional. Las causas más frecuentes de anemia son la fisiológica del recién nacido y la anemia de la prematuridad. La anemia neonatal está muy relacionada con la cantidad de sangre extraída para los procedimientos diagnósticos.
En cuanto la sintomatología, en la anemia aguda hemorrágica predominan los signos de hipovolemia y shock. En la anemia hemorrágica crónica, la palidez sin apenas repercusión hemodinámica. En la anemia hemolítica crónica destaca la presencia de ictericia y hepatoesplenomegalia. En la anemia de la prematuridad puede existir una clínica inespecífica como estancamiento ponderal, fatiga relacionada con la alimentación, taquipnea o apneas.
El signo más frecuente es la palidez de piel y mucosas (además de ictericia en la anemia hemolítica). Según la etiología y la velocidad de instauración se acompañará de otras manifestaciones. Así pues, en la anemia aguda con gran pérdida de volumen aparece clínica de hipovolemia y shock, con signos de insuficiencia respiratoria (taquipnea, distrés) y cardíaca (taquicardia, hipotensión, disminución de presión venosa central), mala perfusión periférica y acidosis metabólica. En la anemia hemorrágica crónica predomina la palidez, con escasa o ausente sintomatología respiratoria y hemodinámica. En la anemia hemolítica crónica aparece ictericia además de la palidez, así como hepatoesplenomegalia por aumento de los focos eritropoyéticos extramedulares. Por último, en la anemia del prematuro puede observarse fatiga en la alimentación, estacionamiento ponderal, taquipnea, taquicardia, apneas, aumento del requerimiento de oxígeno (posprandial, por apneas) y acidosis metabólica.
Lectura rápida
Las pruebas diagnósticas de primera línea son el hemograma, recuento de reticulocitos, bilirrubina, grupo ABO y Rh y test de Coombs.
Respecto al tratamiento, cada vez se aboga más por políticas de transfusión restrictivas para evitar transfusiones y, por ende, los efectos adversos derivados de éstas y de la exposición a distintos donantes. La Hb por sí sola no es un criterio para transfundir sino que se tienen en cuenta distintos parámetros como número de apneas o bradicardias, taquipnea o taquicardia, estancamiento ponderal, necesidad de ventilación u oxigenoterapia, la propia patología de base del paciente o el someterse a procedimientos como la oxigenación por membrana extracorpórea (ECMO).
Se ha demostrado que el uso de guías transfusionales menos restrictivas no aportan claros beneficios clínicos en los pacientes y que las guías más restrictivas no implican, en la mayoría de estudios publicados, un mayor número de efectos adversos a corto ni largo plazo.
En la evaluación diagnóstica es importante investigar los antecedentes familiares (anemia, ictericia, cálculos biliares, esplenectomía, grupo sanguíneo y Rh) y la historia obstétrica (alteraciones placentarias, tiempo de ligadura del cordón, hemorragia visible, fármacos, isoinmunización sanguínea).
Las exploraciones complementarias básicas incluyen hemograma o hematocrito, bilirrubina, recuento de reticulocitos y test de Coombs.
- —
Hemograma: la presencia de eritroblastos en el hemograma es normal hasta el cuarto día de vida. En la hemorragia aguda, el hematocrito puede mantenerse normal por vasoconstricción compensadora.
- —
Recuento de reticulocitos: deben ser del 4-6% los primeros 3 días de vida. Durante las 2 semanas de vida pueden bajar hasta alrededor del 1%3. Éstos son el mejor indicador del tipo de anemia (aumento en la pérdida crónica y la hemólisis, descenso en la infección y en los defectos de producción).
- —
Bilirrubina: es tan importante la cifra como su evolución (velocidad de ascenso) en la anemia hemolítica, pues condiciona el tratamiento.
- —
Grupo ABO, Rh y test de Coombs (directo, indirecto): positivo en las anemias hemolíticas inmunes por incompatibilidad ABO o Rh. Puede ser falsamente negativo si el título de anticuerpos es bajo.
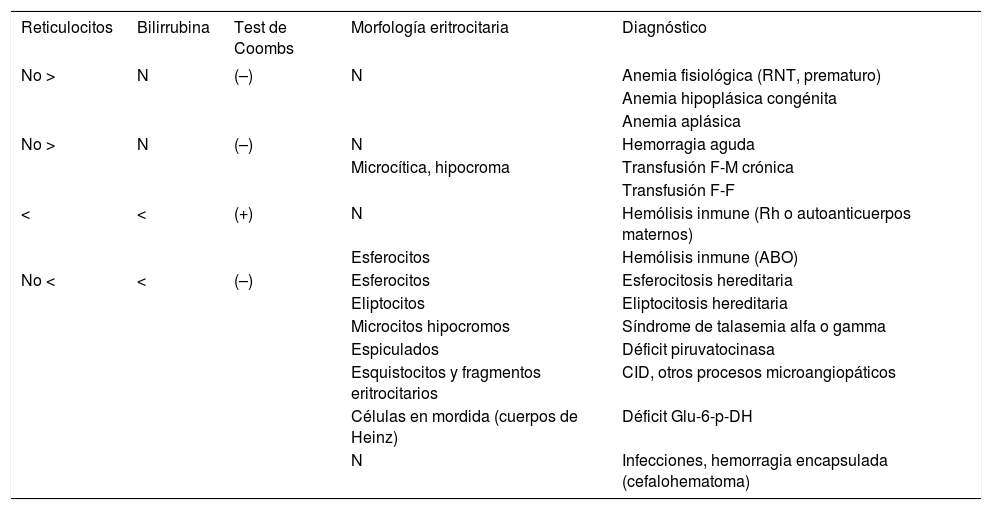
En la anemia hemorrágica aguda existe descenso del hematocrito junto con reticulocitos normales (posteriormente se produce un aumento de bilirrubina si el sangrado es interno). En la anemia hemorrágica crónica se produce un descenso del hematocrito y aumento de los reticulocitos. Si la anemia es hemolítica se aprecia descenso del hematocrito, aumento de reticulocitos y de bilirrubina (con Coombs positivo si es inmune). Finalmente, en la anemia aplásica se produce un descenso del hematocrito y de reticulocitos (< 4%). Este diagnóstico diferencial se muestra en la tabla 2.
Alteraciones analíticas y diagnóstico diferencial
| Reticulocitos | Bilirrubina | Test de Coombs | Morfología eritrocitaria | Diagnóstico |
|---|---|---|---|---|
| No > | N | (–) | N | Anemia fisiológica (RNT, prematuro) |
| Anemia hipoplásica congénita | ||||
| Anemia aplásica | ||||
| No > | N | (–) | N | Hemorragia aguda |
| Microcítica, hipocroma | Transfusión F-M crónica | |||
| Transfusión F-F | ||||
| < | < | (+) | N | Hemólisis inmune (Rh o autoanticuerpos maternos) |
| Esferocitos | Hemólisis inmune (ABO) | |||
| No < | < | (–) | Esferocitos | Esferocitosis hereditaria |
| Eliptocitos | Eliptocitosis hereditaria | |||
| Microcitos hipocromos | Síndrome de talasemia alfa o gamma | |||
| Espiculados | Déficit piruvatocinasa | |||
| Esquistocitos y fragmentos eritrocitarios | CID, otros procesos microangiopáticos | |||
| Células en mordida (cuerpos de Heinz) | Déficit Glu-6-p-DH | |||
| N | Infecciones, hemorragia encapsulada (cefalohematoma) | |||
N: normal, <: aumentado, >: disminuido; (−): negativo, (+): positivo.
CID: coagulación intravascular diseminada; F-F: feto-fetal; F-M: feto-materna; RNT: recién nacido a término. Adaptada de Cloherty et al1.
- —
Extensión de sangre: para la morfología eritrocitaria (hay que orientar el diagnóstico de sospecha pues con frecuencia se ven hematíes dismórficos en el neonatal, que no tienen traducción patológica).
- —
Test de Kleihauer en la madre para descartar transfusión fetomaterna: determina cantidad de HbF en sangre materna (1 hematíe fetal por 100 maternos indica transfusión importante, de unos 25ml); es fiable si no hay otros trastornos que aumenten la cantidad de HbF, como en la isoinmunización ABO (en que aparecen hematíes lisados).
- —
Test de Apt en hemorragia digestiva para descartar sangre deglutida materna. En teoría detecta la presencia de Hb A materna en heces o aspirado gástrico. La técnica habitual es colorimétrica y el resultado es dependiente del observador y poco fiable.
- —
Ecografía cerebral y abdominal para descartar hemorragia interna.
- —
Estudio de la coagulación para orientar a una hemorragia.
- —
Estudio de infecciones: TORCH, herpes, parvovirus, citomegalovirus, lúes.
- —
Estudio de médula ósea: útil en la anemia hemolítica sin reticulocitosis y en la anemia hiporregenerativa. Pocas veces se investiga excepto en casos de insuficiencia medular por hipoplasia o tumor.
- —
Estudio a los padres: útil para descartar causas hereditarias. Según la orientación diagnóstica, se estudia hemograma, extensión de sangre, índices y enzimas eritrocitarias.
- —
Electroforesis de las hemoglobinas y enzimas eritrocitarias: no es valorable en el período neonatal, dado que predomina la HbF.
Lectura rápida
Tan importante es el tratamiento de la anemia como su prevención. Una medida preventiva consiste en el clampaje tardío del cordón umbilical en los recién nacidos pretérmino y los recién nacidos a término. En los niños prematuros entre 30 y 36 semanas que no precisen resucitación inmediata, nos podríamos plantear clampar el cordón umbilical al minuto de vida y no inmediatamente después del parto ya que se asocia a un aumento en la masa se eritrocitos y por tanto a una disminución significativa de los casos de anemia. A diferencia de los niños a término, en los prematuros con clampaje de cordón tardío no se observan casos de policitemia e hiperviscosidad o sobrecarga de líquidos. En este grupo de pacientes se ha observado un incremento de niños sometidos a fototerapia, aunque las cifras a la entrada de la misma no son más altas ni la intensidad de la fototerapia es superior que en los niños prematuros con clampaje de cordón inmediatamente después del parto. Aunque los resultados son prometedores todavía hacen falta más estudios para acabar de confirmar los resultados y sobre todo para definir de forma uniforme el método del clampaje tardío, principalmente en los neonatos más críticos y con menor Apgar al nacer.
En un hospital terciario, el grupo de niños que reciben un mayor número de transfusiones son los niños prematuros4. El 50% de los recién nacidos de < 1.000g recibirán una transfusión durante las primeras 2 semanas de vida y el 80% al menos habrán recibido una transfusión al finalizar la hospitalización5.
La transfusión de concentrado de hematíes no está exenta de riesgos, los cuales deben tenerse en cuenta y ser explicados a la familia, para obtener su consentimiento informado previo a la transfusión. Estos riesgos son la sobrecarga de volumen, la hemólisis (por incompatibilidad de grupo ABO), la hiperpotasemia, reacción hipertermia de tipo leucoplaquetaria, la enfermedad injerto contra huésped, reacción alérgica y shock anafiláctico en déficit de IgA, las infecciones (virus y bacterias) y el daño pulmonar agudo por atrapamiento de leucocitos en la circulación pulmonar (transfusión related acute lung injury, TRALI).
No hay unas indicaciones inamovibles de transfusión. Las tendencias son cada vez más restrictivas y deben sopesarse los riesgos y beneficios antes de utilizar este recurso que algunas veces resulta escaso. Es bien sabido que hay niños que pueden permanecer asintomáticos con bajas concentraciones de Hb y otros ser sintomáticos con concentraciones de Hb iguales o superiores. Esto apoya el concepto de que la Hb por sí sola no es adecuada para decidir la necesidad de la transfusión6. Se ha demostrado que el uso de guías más restrictivas disminuye el número de transfusiones y la exposición a donantes y actualmente cobra interés el establecer si existen riesgos relacionados con el uso de dichas guías, especialmente en pacientes de extremado bajo peso al nacer. Valieva et al7 publicaron recientemente un estudio retrospectivo de recién nacidos de muy bajo peso y concluyeron que con una guía de actuación más liberal no existía un beneficio clínico evidente. Además, observaron una asociación entre las transfusiones y la incidencia de displasia broncopulmonar, enterocolitis necrosante, retinopatía de la prematuridad y el uso de diuréticos. En el estudio de Bifano et al8, 50 niños entre 650 y 1.000g fueron aleatorizados a 2 grupos de valores de hematocrito (< 32 y < 30%) como umbral para decidir transfundirlos. Concluyó que no había diferencias entre los dos grupos en cuanto a crecimiento, morbilidad y mortalidad durante la hospitalización ni en el neurodesarrollo a los 12 meses. Bell et al9 realizaron un estudio aleatorizado en el que incluyeron a 103 niños en 2 guías transfusionales, una más restrictiva y otra más liberal, y objetivó más niños afectados por virus de la inmunodeficiencia humana (VIH) grado IV, leucomalacia y apneas (aunque clínicamente poco relevante pues el incremento de frecuencia de apnea era de < 1 evento por día) en el grupo restrictivo. Estos resultados no se repiten en el estudio multicéntrico de Kirpalani et al10, un estudio aleatorizado de un diseño similar, de 451 prematuros extremos. En el seguimiento a largo plazo de este mismo grupo de pacientes no se encontraron diferencias significativas en cuanto al resultado principal (muerte o alteraciones en el neurodesarrollo) a los 18 o 21 meses de edad corregida, aunque un análisis posthoc mostró una diferencia significativa en cuanto a retraso cognitivo (Mental Development Index < 70) en el grupo restrictivo.
Lectura rápida
Otra medida importante en la sala de partos consiste en la obtención de muestra sanguínea para hemograma o hemocultivo a partir de sangre de cordón.
En la unidad se tienen que evitar extracciones, agrupando las analíticas y utilizando monitorización transcutánea o dispositivos tipo micrométodo siempre que sea posible. En el recién nacido que se transfunda es importante guardar la sangre en alícuotas y reservarla para un mismo paciente para poder así disminuir la exposición a donantes.
En nuestro centro las indicaciones de transfusión se resumen en la tabla 3. Se basan en conceptos clínicos y bioquímicos.
Indicaciones de transfusión de concentrado de hematíes
|
CPAP: presión positiva continua en la vía aérea; ECMO: oxigenación por membrana extracorpórea; FiO2: fracción inspiratoria de oxígeno; MAP: presión media en la vía aérea; VM: ventilación mecánica.
Adaptada de Roseff et al4.
El volumen a transfundir es de 15ml/kg. En niños lábiles o cuando es preciso transfundir cantidades mayores, se tiene que considerar transfundir esta cantidad en 2 veces con un intervalo de 6-12h. La duración de la transfusión es de 1-3h, dejando el tiempo máximo para niños inestables o con riesgo de descompensación por sobrecarga (cardiópatas, persistencia del conducto arterioso, displasia broncopulmonar, etc.), así como en prematuros con riesgo de aumento de presión intracraneal y sangrado intraventricular.
Las indicaciones de transfusión de hematíes irradiados4 son:
- —
Neonatos en los que se sospecha una inmunodeficiencia congénita.
- —
Fetos (transfusiones intrauterinas).
- —
RN previamente transfundidos intraútero.
- —
Prematuros < 1.200g.
- —
RN con inmunodeficiencias adquiridas.
- —
RN receptores de familiar consanguíneo de primer o segundo grado (su utilización es excepcional, pues su uso conlleva mayor riesgo de enfermedad injerto contra huésped).
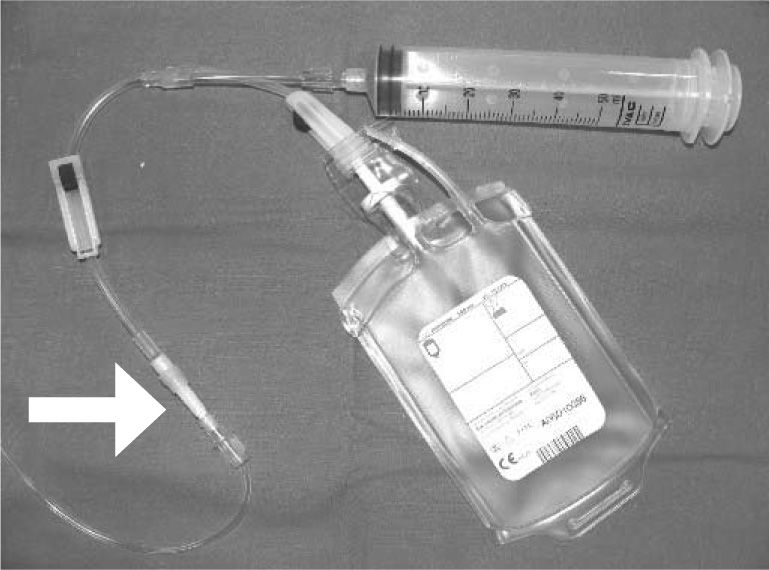
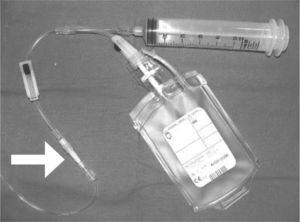
La transfusión tiene que infundirse por una vía única. Por ella no deben pasar otras perfusiones ni fármacos. Ésta puede ser central o periférica, pero de calibre suficiente (no se debe transfundir por catéter central de inserción periférica de 0,2mm porque se obstruye fácilmente). Hay que tener en cuenta que por las vías centrales se puede infundir a ritmos más elevados, pero el riesgo de sobrecarga es mayor. La transfusión puede realizarse con bolsa o con jeringa, en cuyo caso se intercalará una conexión adecuada con filtro, que debe mantenerse durante toda la transfusión (fig. 1).
Existen otras consideraciones que hay que tener en cuenta como descontar el volumen transfundido del aporte hídrico total. Durante la transfusión no se tienen que aportar otros líquidos, aparte de glucosa para mantener la glucemia y los de las bombas de infusión continua de sedantes, analgésicos o inotropos. Si el niño precisa volumen, se puede aumentar el ritmo del concentrado. Es importante controlar la glucemia cada hora. Si es inferior a 45mg/dl, se disminuirá el ritmo de la transfusión y se aumentará el aporte de glucosa. Si es inferior a 40mg/dl, se administrará además un bolus de glucosa 10%, 2ml/kg por vía intravenosa, y si es inferior a 30mg/dl, se administrará el bolus, se suspenderá la transfusión y se reiniciarán los aportes previos hasta que la glucemia está recuperada. Si el recién nacido llevaba insulina en bomba de infusión continua, al suspender o disminuir los aportes de glucosa, probablemente precise disminuir el ritmo o parar la bomba. En estos casos la glucemia deberá controlarse más a menudo (cada 30min). Si el niño recibe alimentación enteral se iniciará la transfusión 1-2h después de la toma y quedará a dieta hasta que ésta finalice. En los niños hemodinámicamente inestables o con riesgo de descompensación se valorará la administración de una dosis de furosemida oral o intravenosa una vez iniciada la transfusión (a los 30min-1h): 0,5-1mg/kg (por vía intravenosa tarda unos 20min en iniciar su efecto).
El diagnóstico precoz debe posponerse hasta por lo menos 10 días después de cualquier transfusión de hemoderivados, para no interferir en sus resultados.
Fraccionamiento y caducidad de la bolsaSi se prevé que el paciente va a ser politransfundido, debe valorarse el fraccionar la bolsa de sangre de un solo donante en alícuotas para minimizar el número de donantes6. Pero al mismo tiempo hay que considerar que la caducidad de las bolsas es variable: 21 días para la sangre irradiada, 42 días si no lo está.
El transporte de oxígeno mejorará rápidamente si el tiempo de almacenamiento de la bolsa es corto (mayor contenido en 2,3 difosfoglicerato). Por lo tanto, es recomendable sangre "fresca" (de 2-3 días) para grandes reposiciones de volemia: cirugía cardíaca, oxigenación por membrana extracorpórea (ECMO), exanguinotransfusión total o reposición de volemia por hemorragia aguda4.
Lectura rápida
El uso de eritropoyetina humana recombinante (rhEPO) como parte del tratamiento de la anemia del prematuro sigue siendo controvertido. La revisión Cochrane de 2006 concluye que la administración precoz de eritropoyetina no reduce significativamente el número de transfusiones recibidas. Tampoco existe suficiente evidencia acerca del potencial beneficio de la rhEPO en la reducción del número de donantes expuestos. Se ha observado un incremento estadísticamente significativo de retinopatía de la prematuridad en los pacientes que reciben rhEPO precozmente. A nivel experimental se ha demostrado un efecto neuroprotector de eritropoyetina reduciendo el daño neuronal secundario a eventos hipóxico-isquémicos. Este hallazgo ha suscitado un creciente interés acerca de sus efectos en prematuros por ser una población de alto riesgo neurológico.
El uso de eritropoyetina humana recombinante (rhEPO) como parte del tratamiento de la anemia del prematuro ha sido ampliamente discutido y sigue siendo controvertido. Ohlsson y Aher12 realizaron una revisión sistemática de la Cochrane Database en 2006 acerca de la efectividad y seguridad del uso precoz frente a tardío de rhEPO en la reducción de las necesidades de transfusión de los recién nacidos prematuros. Los autores concluyeron que la administración precoz de eritropoyetina no reduce el número de transfusiones recibidas. Dado que un porcentaje no despreciable de pacientes (14-30%) había recibido transfusiones antes de ser incluidos en los estudios revisados en el metanálisis no existe evidencia acerca del potencial beneficio de la rhEPO en la reducción del número de donantes expuestos. Asimismo esta revisión objetivó un incremento estadísticamente significativo de retinopatía de la prematuridad (ROP) en los pacientes que recibían rhEPO precozmente. En la misma dirección Suk et al13 encontraron, en un estudio de cohortes retrospectivo, que la administración de rhEPO es un factor de riesgo independiente para el desarrollo de ROP, especialmente en los pacientes que reciben más dosis de rhEPO (> 20), así como en los que la reciben más precozmente (< 20 días de vida). Una posible hipótesis fisiopatológica que explicaría dicha asociación es la similitud de rhEPO con el factor de crecimiento endotelial (VEGF), responsable de la angiogénesis e implicado en la patogenia de la ROP.
Pramod Mainie14 realizó en 2008 otra revisión de la literatura acerca del papel de la rhEPO en la medicina neonatal actual en la que se han instalado políticas restrictivas de transfusión y extracción de sangre y que no han supuesto un incremento en las complicaciones del prematuro, como la hemorragia intraventricular, la enterocolitis necrosante o la displasia broncopulmonar. Dicha revisión incluye varios estudios multicéntricos, controlados y aleatorizados en los que no se hallan reducciones estadísticamente significativas en el número de transfusiones recibidas entre el grupo estudio y el grupo control15. En el caso de la enfermedad hemolítica del recién nacido que suele acompañarse de una anemia hiporregenerativa tampoco la rhEPO parece ofrecer un beneficio. Así pues, dada la evidencia científica actual y las políticas de transfusión y seguridad de éstas, el autor concluye que no está justificado el uso de eritropoyetina en la práctica clínica habitual. Su utilización quedaría reservada para la realización de estudios bien diseñados, aleatorizados y controlados en los que el desarrollo de ROP estuviera monitorizado.
A raíz de estudios en modelos animales16 y en adultos que demuestran una reducción del daño neuronal secundario a hipoxia-isquemia con la administración de altas dosis de rhEPO, existe un interés creciente acerca de su posible aplicación como neuroprotector en los recién nacidos prematuros que son pacientes de alto riesgo neurológico17,18.
Prevención de la anemia neonatalEn la actualidad, y tal y como hemos mencionado en apartados anteriores, se tiende a restringir la indicación de la transfusión de concentrado de hematíes. Por este motivo es esencial intentar minimizar las causas que disminuyen la masa eritrocitaria y potenciar las que la aumentan. Así pues existen distintas actuaciones que podemos realizar, no sólo en la unidad neonatal sino también en sala de partos y en el laboratorio19.
En sala de partosUn procedimiento posible en sala de partos es retrasar el pinzamiento del cordón umbilical. Strauss et al20 publicaron un estudio prospectivo, aleatorizado y parcialmente ciego de recién nacidos entre 30 y 36 semanas de gestación, de los cuales un grupo fue sometido a clampaje antes de los 15s después de nacer y el otro al minuto exacto del nacimiento. El hecho de retrasar un minuto el clampaje de cordón aumentó la masa/volumen eritrocitario de forma significativa aunque esto no se tradujo en un menor número de transfusiones. No observó diferencias entre los 2 grupos en cuanto a puntuación de Apgar, la necesidad de ventilación mecánica con oxigenoterapia o la incidencia de hemorragias intracraneales. En este estudio, ningún niño necesitó flebotomías por síntomas de policitemia o hiperviscosidad. Por otro lado, hubo un número mayor de recién nacidos sometidos a fototerapia en el grupo del clampaje retrasado aunque los valores de bilirrubina que preceden la terapia y la intensidad de la misma no difirieron en los 2 grupos. Este estudio concluye que debería considerarse el clampaje al minuto de vida para incrementar el volumen de hematíes en aquellos neonatos entre 30 y 36 semanas de vida que no necesiten una reanimación inmediata. En neonatos a término está descrito un aumento significativo de casos de niños afectados de policitemia en el grupo de pacientes sometidos a un clampaje tardío de cordón21. En la publicación Cochrane del 200422, que estudia los efectos del clampaje tardío de cordón (de 30 a 120s) en niños prematuros de < 37 semanas, se objetiva una menor necesidad de transfusiones por anemia y un menor riesgo relativo de hemorragia intraventricular. En la revisión Cochrane del 200823, que analiza los efectos del clampaje tardío de cordón en niños a término, se concluye que retardar el pinzamiento del cordón de 2 a 3min aumenta el valor de Hb (aunque no más allá de los 6 meses) y mantiene los niveles de ferritina más elevados incluso a los 6 meses (reflejando un potencial beneficio en grupos de población con un pobre acceso a una adecuada alimentación) pero aumenta, tal y como se veía en otros estudios, el riesgo de fototerapia. Aunque los resultados del clampaje tardío parecen ser prometedores sería necesario ampliar los estudios y definir de una forma uniforme los métodos del clampaje retardado, sobre todo en los pacientes más críticos o con Apgar más bajo al nacer20.
Otra posibilidad es la obtención de sangre de cordón por parte del ginecólogo asistente al parto para poder obtener el hemograma y hemocultivo del recién nacido. El estudio de Khodabux et al24 concluye que la sangre autóloga derivada de sangre de cordón no puede suplir el 50% de las transfusiones alogénicas por la poca cantidad de sangre que se recoge y por tanto la poca disponibilidad del producto, aunque en niños entre 24-28 semanas, a pesar de la baja disponibilidad (17%), se considera un método eficiente por la alta necesidad de transfusiones (87%) en este subgrupo de pacientes. En niños entre 30-32 semanas no se considera su uso por la disponibilidad del 36% y la necesidad menor de transfusiones (19%) objetivadas en dicho estudio.
En la unidad neonatalPara intentar disminuir la anemia de causa iatrogénica sería conveniente evitar extracciones en la medida de lo posible y agrupar analíticas. Es importante anotar el volumen extraído para facilitar el control de pérdidas3. Como ya se ha comentado en el apartado correspondiente, el uso de un protocolo transfusional restrictivo ha disminuido notablemente la necesidad de transfusiones en las unidades neonatales. Dentro de los factores para disminuir el número de extracciones se incluyen métodos de monitorización transcutánea y el uso de dispositivos tipo micrométodo. Madan et al25 objetivaron una disminución del 43% de transfusiones en niños de < 1.000g con el uso del dispositivo micrométodo iSTAT®.
En el laboratorio y banco de sangreYa que la pérdida de sangre iatrogénica contribuye de una forma muy importante en el desarrollo de la anemia del prematuro, es absolutamente necesario desarrollar y utilizar técnicas de micrométodo en el laboratorio25. En caso de precisar transfusión, es útil fraccionar una unidad de un mismo donante en pequeñas bolsas (alícuotas) del volumen de sangre que probablemente precisará el paciente, para disminuir el número de donantes y el número de extracciones para pruebas cruzadas. Una bolsa de 350ml de sangre podría fraccionarse hasta en 10-15 alícuotas (en función del peso del paciente). Si esto no es posible, puede valorarse utilizar la misma bolsa (reservada en banco de sangre) para un solo paciente, hasta su caducidad19 (42 días si sangre no irradiada y 21 días si irradiada). En caso de alícuotas la bolsa de la sangre madre es la que viene irradiada y tendrán por lo tanto una caducidad de 21 días.