La displasia broncopulmonar (DBP) es una enfermedad crónica pulmonar que afecta sobre todo a recién nacidos (RN) con peso al nacer inferior a 1.500g (RN de muy bajo peso [RNMBP]) y que es más frecuente cuanto menor es al nacer la edad posmenstrual (EPM) y el peso de los RN pretérmino, y más del 60% de los RN con peso inferior a 600g y con EPM inferior a 26 semanas puede llegar a presentar formas moderadas o graves1. La enfermedad, descrita inicialmente en 1967 por Northway et al2, debido a la introducción de nuevas estrategias terapéuticas en el cuidado de los RNMBP, ha evolucionado a un nuevo cuadro con características diferentes, tanto clínicas, como anatomopatológicas, que se define como “nueva displasia broncopulmonar”3.
Aunque la DBP se desarrolla en el período neonatal, sus consecuencias pueden extenderse a la edad pediátrica con enfermedad respiratoria residual, alteraciones cardiológicas o trastornos en el neurodesarrollo. El objetivo de esta actualización es revisar los conocimientos actuales acerca de la nueva DBP, cuya incidencia no sólo no ha disminuido, sino que ha aumentado de forma paralela al incremento de supervivencia de los RNMBP.
Puntos clave
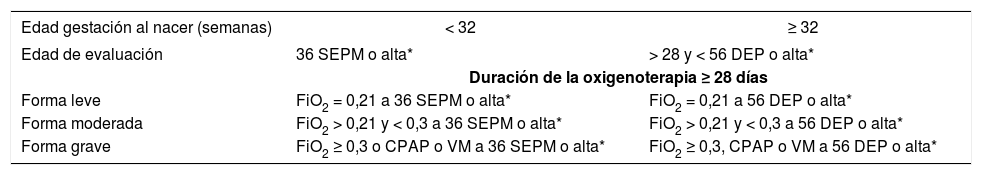
La DBP es una enfermedad multifactorial que se caracteriza por una dependencia prolongada de oxígeno, junto con cambios clínicos y radiológicos, que reflejan una afección pulmonar crónica. El criterio aislado de necesidad de oxígeno suplementario a una edad posnatal (28 días) o posmenstrual (36 semanas) determinada puede no estar relacionado con una DBP, sino con un episodio agudo independiente de la enfermedad o con otras afecciones, como apnea de la prematuridad o relajación diafragmática, y, además, las indicaciones de oxigenoterapia varían considerablemente de unas unidades a otras. Por ello, para establecer el diagnóstico de DBP, es necesario que este dato cronológico se acompañe de signos de dificultad respiratoria y alteraciones gasométricas y radiológicas características1.
En la tabla 1 se resumen los criterios actualmente más aceptados para el diagnóstico de DBP, junto con una clasificación de su gravedad1,3.
Criterios para el diagnóstico de displasia broncopulmonar y su gravedad
| Edad gestación al nacer (semanas) | < 32 | ≥ 32 |
|---|---|---|
| Edad de evaluación | 36 SEPM o alta* | > 28 y < 56 DEP o alta* |
| Duración de la oxigenoterapia ≥ 28 días | ||
| Forma leve | FiO2 = 0,21 a 36 SEPM o alta* | FiO2 = 0,21 a 56 DEP o alta* |
| Forma moderada | FiO2 > 0,21 y < 0,3 a 36 SEPM o alta* | FiO2 > 0,21 y < 0,3 a 56 DEP o alta* |
| Forma grave | FiO2 ≥ 0,3 o CPAP o VM a 36 SEPM o alta* | FiO2 ≥ 0,3, CPAP o VM a 56 DEP o alta* |
CPAP: presión positiva continua en vía aérea; DBP: displasia broncopulmonar; DEP: días de edad posnatal; FiO2: fracción inspirada de oxígeno; SEPM: semanas de edad posmenstrual; VM: ventilación mecánica.
Para obviar las limitaciones del criterio exclusivamente cronológico en el uso de oxígeno suplementario y conseguir una uniformidad mayor en el diagnóstico de DBP, Walsh et al4 han propuesto realizar un test fisiológico en las fechas de evaluación pertinentes a los RN que estén recibiendo oxígeno suplementario. El test se realiza solamente a RN que en la fecha de evaluación mantienen constantes adecuadas y saturación de oxígeno de la hemoglobina (SatO2) > 90% con suplemento de fracción inspirada de oxígeno (FiO2) inferior a 0,3. Tras una determinación de datos basales (frecuencia cardíaca, respiratoria, apnea y SatO2), se realizan descensos progresivos de 2% cada 5min respecto a la FiO2 basal (y flujo si el oxígeno se administra con gafas nasales), y se comprueba que no se produce apnea, bradicardia, ni SatO2 < 90%. Si se llega en estas condiciones a FiO2 21% —lo que puede llegar a suceder en un 44% de casos5—, se excluye el diagnóstico de DBP.
Lectura rápida
La displasia broncopulmonar (DBP) es una enfermedad pulmonar crónica multifactorial que afecta sobre todo a los recién nacidos (RN) más inmaduros (RN de muy bajo peso [RNMBP]).
Definición y conceptoEl diagnóstico se basa en un cuadro clínico de dificultad respiratoria persistente que requiere oxígeno suplementario de forma prolongada. Las edades de valoración son posnatal 28 días (DBP leve) y posmenstrual de 36 semanas (DBP moderada o grave según FiO2 menor o mayor/igual 0,3) para los RN con edad gestacional inferior a 32 semanas.
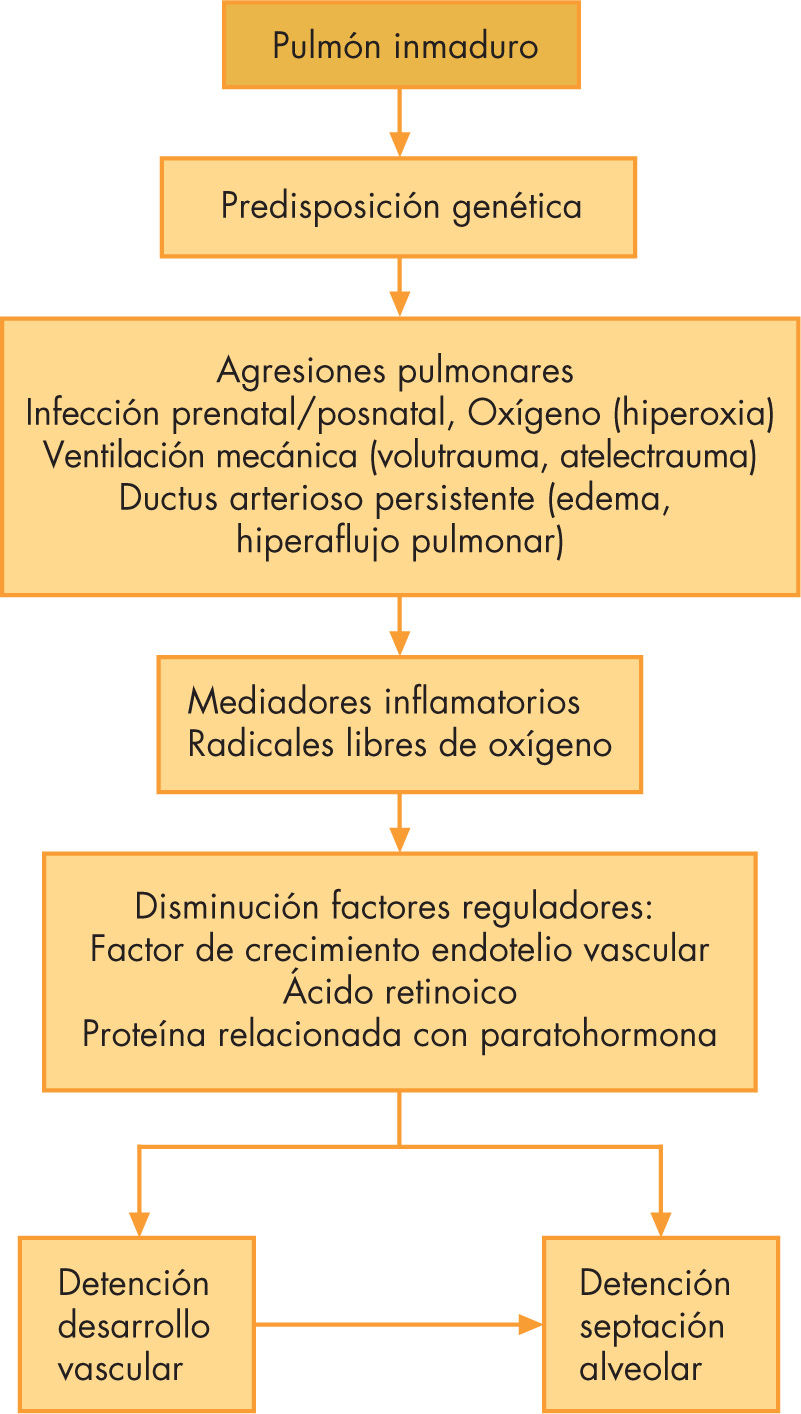
A diferencia de la enfermedad descrita por Northway et al2, en la que se observaba fibrosis, metaplasia escamosa epitelial e hipertrofia de músculo liso en la vía aérea y arteriolas pulmonares, actualmente la DBP se caracteriza por la presencia de estructuras alveolares de gran tamaño y muy simplificadas, así como una configuración anómala de la estructura capilar pulmonar con celularidad intersticial y fibroproliferación variables6. En la figura 1 se resumen los factores condicionantes y los mecanismos que conducen a estas alteraciones. Al actuar sobre un pulmón inmaduro, sometido a una serie de situaciones frecuentes en los RN más inmaduros, como infección prenatal o posnatal, ventilación mecánica (VM), oxigenoterapia (excesiva) o persistencia del conducto arterioso, se desencadena una respuesta inflamatoria con liberación de interleucinas y otros mediadores que condicionan modificaciones en la producción de factores angiogénicos necesarios para la constitución de una red vascular pulmonar normal, e íntimamente asociados con el proceso de septación alveolar que se produce en esta etapa del desarrollo embriológico pulmonar7–9. Se ha demostrado la existencia de una predisposición genética para desarrollar DBP en los grupos de riesgo mediante diferencias raciales y estudios en gemelos monozigóticos y dizigóticos, en los que la incidencia de DBP y la coincidencia en ambos gemelos es significativamente más elevada10. El estudio de algunos genes candidatos que regulan el desarrollo pulmonar y la respuesta inflamatoria (proteína A del surfactante, L-selectina, enzima de conversión de la angiotensina, factor VII, TNF-238, etc.) aumentan o disminuyen el riesgo de DBP en pequeños grupos de pacientes e indican una influencia poligénica, todavía no completamente definida, que, al modular la respuesta a las agresiones ambientales, van a influir en el riesgo de desarrollar la enfermedad11.
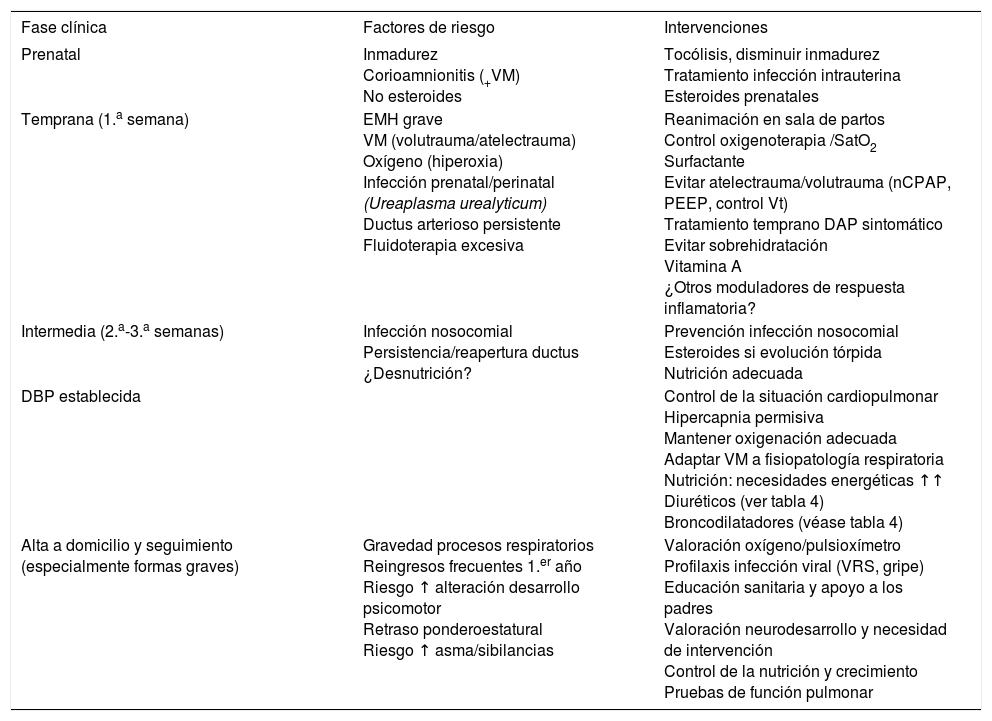
Cuadro clínico. Etapas en el desarrollo de displasia broncopulmonarLa evolución de los pacientes que van a desarrollar una DBP se puede agrupar en diferentes etapas cronológicas que tienen interés tanto desde el punto de vista de la descripción clínica del cuadro, como porque puede ayudar a identificar factores de riesgo y a anticipar datos clínicos indicativos de una evolución hacia DBP, y, consecuentemente, establecer las medidas profilácticas y terapéuticas que eviten o disminuyan la gravedad de la enfermedad12. En la tabla 2 se resumen las características clínicas en estas etapas, según evolucionen hacia formas más o menos graves de DBP, y en la tabla 3, los factores de riesgo a valorar y las intervenciones profilácticas o terapéuticas a aplicar en cada una de estas etapas.
Características clínicas de la nueva displasia broncopulmonar
| 1.a semana de vida | Indistinguible de cualquier RNMBP (valoración según edad gestacional, factores de riesgo prenatales y de los que se presentan en este período) |
| 2.a-3.a semanas | a) Mejoría clínica, extubación, puede llegar a FiO2 ambiental varios días. Posteriormente, aumento lento y progresivo de FiO2, hipercapnia lentamente ascendente, radiografía, edema pulmonar, opacificación pulmonar difusa con buen volumen pulmonar. Evolución en general a DBP leve-moderada |
| b) Episodio concurrente de infección nosocomial, reapertura de DAP, fracaso de extubación, aumento en las necesidades de FiO2 y asistencia respiratoria, radiografía con alteraciones de la enfermedad causante del empeoramiento (bronconeumonía, atelectasia, edema pulmonar, cardiomegalia, etc.). Evolución en general a DBP moderada-grave | |
| 28 días/36 semanas EPM | Dificultad respiratoria + hipercapnia + radiografía característica, según la evolución a forma leve-moderada o grave (definición gravedad según FiO2 y soporte respiratorio) |
DAP: ductus arterioso persistente; DBP: displasia broncopulmonar; EPM: edad posmenstrual; RNMBP: recién nacido de muy bajo peso.
Tramos cronológicos. Factores de riesgo e intervenciones profilácticas y terapéuticas en recién nacidos con riesgo de desarrollar displasia broncopulmonar
| Fase clínica | Factores de riesgo | Intervenciones |
|---|---|---|
| Prenatal | Inmadurez Corioamnionitis (+VM) No esteroides | Tocólisis, disminuir inmadurez Tratamiento infección intrauterina Esteroides prenatales |
| Temprana (1.a semana) | EMH grave VM (volutrauma/atelectrauma) Oxígeno (hiperoxia) Infección prenatal/perinatal (Ureaplasma urealyticum) Ductus arterioso persistente Fluidoterapia excesiva | Reanimación en sala de partos Control oxigenoterapia /SatO2 Surfactante Evitar atelectrauma/volutrauma (nCPAP, PEEP, control Vt) Tratamiento temprano DAP sintomático Evitar sobrehidratación Vitamina A ¿Otros moduladores de respuesta inflamatoria? |
| Intermedia (2.a-3.a semanas) | Infección nosocomial Persistencia/reapertura ductus ¿Desnutrición? | Prevención infección nosocomial Esteroides si evolución tórpida Nutrición adecuada |
| DBP establecida | Control de la situación cardiopulmonar Hipercapnia permisiva Mantener oxigenación adecuada Adaptar VM a fisiopatología respiratoria Nutrición: necesidades energéticas ↑↑ Diuréticos (ver tabla 4) Broncodilatadores (véase tabla 4) | |
| Alta a domicilio y seguimiento (especialmente formas graves) | Gravedad procesos respiratorios Reingresos frecuentes 1.er año Riesgo ↑ alteración desarrollo psicomotor Retraso ponderoestatural Riesgo ↑ asma/sibilancias | Valoración oxígeno/pulsioxímetro Profilaxis infección viral (VRS, gripe) Educación sanitaria y apoyo a los padres Valoración neurodesarrollo y necesidad de intervención Control de la nutrición y crecimiento Pruebas de función pulmonar |
DAP: ductus arterioso persistente; EMH: enfermedad de membrana hialina; nCPAP: presión positiva continua en vía aérea nasal; PEEP: presión positiva al final de la espiración; SatO2: saturación de oxígeno de la hemoglobina; VM: ventilación mecánica; Vt: volumen corriente o tidal; VRS: virus respiratorio sincitial.
Lectura rápida
Son factores de riesgo: antecedentes de corioamnionitis, hiperoxia, membrana hialina, ventilación mecánica (VM), infección nosocomial, fluidoterapia excesiva y ductus arterioso persistente. Como consecuencia de estas afecciones, se inicia una reacción inflamatoria en el ámbito pulmonar. En los estudios anatomopatológicos, el tejido pulmonar muestra una detención y una alteración del desarrollo alveolar y vascular, probablemente por una alteración en la síntesis de factores angiogénicos, fundamentales para este desarrollo. Las diferencias en la regulación genética de la síntesis de estos factores pueden condicionar una predisposición o protección para desarrollar esta enfermedad.
Cuadro clínicoSe caracteriza por una dependencia prolongada de oxígeno, junto con cambios clínicos (polipnea y aumento del trabajo respiratorio, gasométricos [hipercapnia y saturación de oxígeno baja]) y radiológicos (edema pulmonar y en los casos graves zonas de hiperinsuflación y condensación alveolar) que reflejan una enfermedad pulmonar crónica.
Hay niveles de evidencia altos de que la prematuridad (especialmente en RN con EPM inferior a 28 semanas13), la corioamnionitis (sobre todo si es necesario aplicar VM después del nacimiento14,15) y la colonización por Ureaplasma urealyticum, tanto en líquido amniótico, como en sangre de cordón o en muestras de aspirado traqueal, son factores de riesgo de desarrollar DBP16–18, aunque en algunos trabajos no se encuentra esa relación19. Aunque el uso de esteroides prenatales no disminuye la incidencia de DBP, se considera que al disminuir la gravedad de la enfermedad respiratoria inicial mejora las posibilidades de supervivencia de RN candidatos a desarrollar la enfermedad y, por este motivo, se considera que hay evidencia de la utilidad de administrar un ciclo de betametasona a las madres en gestantes con riesgo de parto pretérmino antes de las 34 semanas20. Los acontecimientos que se producen en los primeros días de vida probablemente originan la puesta en marcha de los mecanismos fisiopatológicos anteriormente señalados, por lo que son muy numerosos los estudios realizados. En los últimos años se pueden destacar 5 aspectos de los que se resumen los datos más relevantes.
- 1.
Reanimación al nacer de los RNMBP
- 2.
Medidas de soporte respiratorio y modalidades de ventilación mecánica.
- 3.
Uso de esteroides posnatales tempranos.
- 4.
Otras medidas farmacológicas.
Desde los trabajos de Avery et al21 y posteriormente algunos autores escandinavos22–24, se observó que con el uso intensivo de presión positiva continua en vía aérea nasal (CPAP), tanto al nacer, como posteriormente en cuidados intensivos neonatales (UCIN), la incidencia de DBP era menor que en otros centros con criterios de intubación traqueal menos restrictivos. En varios estudios recientes parece que se confirma esta tendencia25,26. Respecto al empleo de surfactante profiláctico en sala de partos, hay 2 estrategias en RNMBP: a) intubación para surfactante y extubación inmediata a CPAP25, o b) CPAP inicial y sólo surfactante, si ésta fracasa y es necesaria la intubación traqueal24. Los estudios clínicos aleatorizados actualmente en marcha podrán aclarar cuál es la alternativa mejor.
Los objetivos de SatO2 en RNMBP para indicar oxígeno suplementario, tanto en la sala de partos, como en la unidad de cuidados intensivos neonatales, también han sido motivo de estudio por el riesgo potencial de aumentar el daño por radicales libres de oxígeno27; y desde que estudios diseñados para frenar la progresión de retinopatía de la prematuridad (ROP) con SatO2 al 95-98% mostraron un aumento en la incidencia de complicaciones pulmonares de los pacientes que tenían SatO2 más altas28,29, otros estudios observacionales parecen indicar que un uso "restrictivo" de oxígeno suplementario disminuye el riesgo de ROP y también disminuye la incidencia de DBP, sin que se haya detectado un número mayor de secuelas, como parálisis cerebral o trastornos cognitivos a medio y largo plazo en estos pacientes30. Actualmente no hay datos que permitan recomendar unos límites de SatO2 seguros para los RN más inmaduros hasta que finalicen estudios prospectivos en marcha. La mayoría de estudios observacionales se han realizado con límites de SatO2 entre el 85 y el 93%31,32.
Lectura rápida
Medidas como esteroides prenatales, favorecer la reanimación con presión positiva continua en vía aérea, vitamina A las primeras 4 semanas de vida, cafeína para favorecer la extubación, reducen significativamente el riesgo de DBP. Las estrategias para evitar volutrauma y atelectrauma, si hay que usar VM, disminuyen la lesión inflamatoria y pueden reducir el riesgo de DBP.
En numerosos estudios se ha demostrado la importancia del empleo de la VM en la puesta en marcha de la reacción inflamatoria que conduce al desarrollo de DBP1,3,13,15,21,23,26,33,34.
También se ha estudiado la influencia de diferentes modalidades de VM en RNMBP para disminuir la aparición de complicaciones y, fundamentalmente, de DBP. Aunque diferentes modalidades han mostrado resultados clínicos beneficiosos en algunos aspectos33, la incidencia de DBP no se ha visto reducida por la introducción de estas modalidades, tanto en VM convencional, como de alta frecuencia33,35. En el momento actual, aunque no hay datos concluyentes que demuestren una reducción significativa de DBP en los RNMBP, el empleo de ventilación con garantía de volumen o volumen control, con disminución del potencial volutrauma y el riesgo de hipocapnia, produce un incremento menor de mediadores proinflamatorios que las modalidades de presión control36, y el empleo de técnicas de ventilación no invasiva temprana para evitar intubación, y post-VM para acortar la duración de ésta37, parecen ser las estrategias menos agresivas para el pulmón del RNMBP, aunque todavía no hay datos con un grado máximo de evidencia.
El empleo de esteroides posnatales también ha sido objeto de múltiples publicaciones en los últimos años, por su efecto beneficioso en la función pulmonar y la reducción en la incidencia de DBP cuando se emplean en la 1.a o 2.a semanas de vida38,39, pero este efecto beneficioso se acompañaba de una tasa elevada de efectos secundarios, como hipertensión, hiperglucemia, hemorragia digestiva y miocardiopatía hipertrófica38,39, y, lo que es más importante, un impacto negativo significativo en el neurodesarrollo de los pacientes tratados31, que contraindicaban el empleo de este tratamiento temprano. Estudios más recientes parecen indicar que la administración al final de la 2.a o 3.a semanas de vida de dosis más bajas de esteroides en RN con alto riesgo de DBP, con peso inferior a 1.000g, o EPM inferior a 28 semanas (intubación y FiO2 alta a esa edad o dificultad para la extubación), podrían beneficiarse de este tratamiento, sin que se observaran efectos deletéreos en el neurodesarrollo40. Esta parece ser la mejor recomendación en el momento actual referente a la indicación profiláctica en este grupo de RN con riesgo elevado de DBP.
Lectura rápida
El uso de esteroides posnatales (1.a semana) tempranos mejora la función pulmonar y reduce el riesgo de DBP, pero aumenta el riesgo de efectos secundarios inmediatos y, sobre todo, secuelas en el neurodesarrollo, por lo que no está indicado su uso.
Con la evidencia actual, dosis bajas de esteroides a partir de la 2.a-3.a semanas en los casos más graves mejorarían la función pulmonar, sin más riesgo de secuelas graves en el neurodesarrollo.
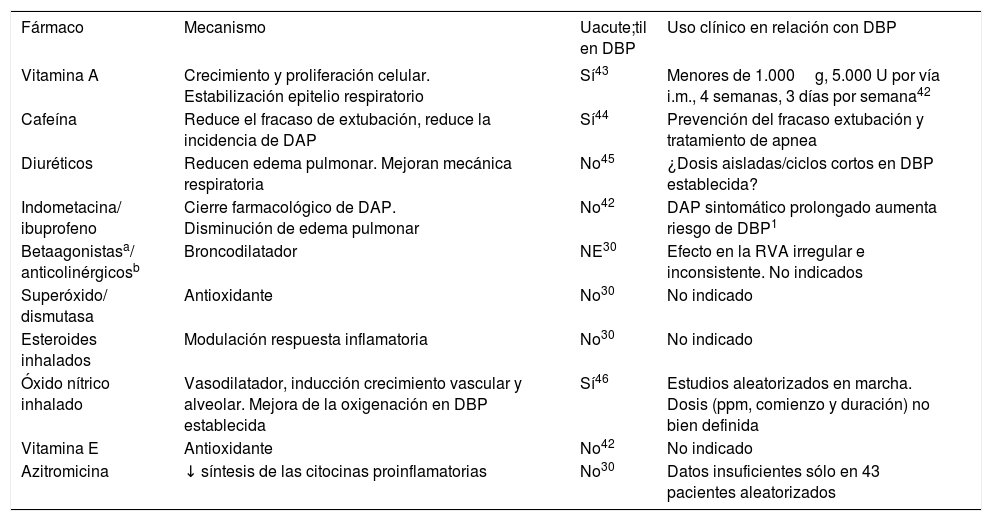
Además de las medidas de control de la oxigenoterapia, soporte respiratorio y empleo de esteroides sistémicos prenatal y posnatal señalados anteriormente, se han realizado numerosos ensayos con fármacos destinados a tratar algunos de los síntomas (diuréticos, broncodilatadores) o a modular el proceso inflamatorio desencadenante de la DBP (antioxidantes, vitamina A, metilxantinas) o a reparar el daño vascular y alveolar (óxido nítrico inhalado). En la tabla 4 se resumen los tratamientos farmacológicos más utilizados, los efectos esperados y el estado actual de aplicación clínica basada en la evidencia disponible41–47.
Utilidad de las medidas farmacológicas para profilaxis/tratamiento de la displasia broncopulmonar
| Fármaco | Mecanismo | Uacute;til en DBP | Uso clínico en relación con DBP |
|---|---|---|---|
| Vitamina A | Crecimiento y proliferación celular. Estabilización epitelio respiratorio | Sí43 | Menores de 1.000g, 5.000 U por vía i.m., 4 semanas, 3 días por semana42 |
| Cafeína | Reduce el fracaso de extubación, reduce la incidencia de DAP | Sí44 | Prevención del fracaso extubación y tratamiento de apnea |
| Diuréticos | Reducen edema pulmonar. Mejoran mecánica respiratoria | No45 | ¿Dosis aisladas/ciclos cortos en DBP establecida? |
| Indometacina/ ibuprofeno | Cierre farmacológico de DAP. Disminución de edema pulmonar | No42 | DAP sintomático prolongado aumenta riesgo de DBP1 |
| Betaagonistasa/ anticolinérgicosb | Broncodilatador | NE30 | Efecto en la RVA irregular e inconsistente. No indicados |
| Superóxido/ dismutasa | Antioxidante | No30 | No indicado |
| Esteroides inhalados | Modulación respuesta inflamatoria | No30 | No indicado |
| Óxido nítrico inhalado | Vasodilatador, inducción crecimiento vascular y alveolar. Mejora de la oxigenación en DBP establecida | Sí46 | Estudios aleatorizados en marcha. Dosis (ppm, comienzo y duración) no bien definida |
| Vitamina E | Antioxidante | No42 | No indicado |
| Azitromicina | ↓ síntesis de las citocinas proinflamatorias | No30 | Datos insuficientes sólo en 43 pacientes aleatorizados |
DAP: ductus arterioso persistente; DBP: displasia broncopulmonar; i.m.: intramuscular; NE: no estudiado; RVA: resistencia en vía aérea; ppm: partes por millón.
Desde el punto de vista de la insuficiencia respiratoria, el tratamiento de los casos más graves de DBP puede resultar muy complejo y no hay estudios bien diseñados que definan estrategias de ventilación mecánica para esta enfermedad. La situación fisiopatológica del pulmón puede ser muy cambiante en períodos breves, pueden coexistir zonas de atelectasia y sobredistención alveolar, aumento de resistencia de la vía aérea y disminución de distensibilidad. En general, en estas condiciones, el empleo de frecuencias algo más bajas que en la fase aguda de la enfermedad de membrana hialina y, en los casos de atelectasia, emplear presión positiva al final de la espiración más altas, incluso con maniobras de reclutamiento, puede permitir abrir zonas de hipoventilación alveolar. En general, la ventilación de alta frecuencia no es de utilidad, dada la inhomogeneidad de la lesión pulmonar subyacente33. En cuanto a la oxigenoterapia, tanto en los casos graves como en las formas leves y moderadas, es necesario asegurar un nivel de oxigenación adecuado (probablemente SatO2 superiores al 90%) por el riesgo de agravar una posible hipertensión pulmonar y fallo cardíaco derecho33,48. El tratamiento con óxido nítrico inhalado, o más recientemente con sildenafilo en fase de fallo respiratorio hipoxémico en alguno de estos casos, debe considerarse experimental33. En las tablas 3 y 4 se resumen otras medidas de tratamiento de los pacientes con DBP. Son fundamentales medidas de cuidado general, mantener un aporte energético y calórico adecuados para suplir las necesidades complementarias impuestas por el trabajo respiratorio aumentado y evitar sobrehidratación e infecciones. Aunque pueden mejorar la sintomatología clínica, se desconoce si los tratamientos farmacológicos (diuréticos, broncodilatadores) tienen alguna repercusión en la evolución de la DBP42,45. Antes del alta, se debe iniciar el calendario vacunal, incluida la vacuna antigripal y la profilaxis de infección por virus respiratorio sincitial.
Lectura rápida
En el momento actual no hay evidencia suficiente para recomendar el empleo profiláctico de óxido nítrico inhalado en pacientes con riesgo de DBP. Algunos datos indican un efecto inductor del crecimiento vascular y alveolar, pero no están bien definidos los criterios de uso, dosis, duración o posibles efectos adversos. Otros factores angiogénicos o moduladores de la respuesta inflamatoria (factor de crecimiento del endotelio vascular, azitromicina) se encuentran todavía en fases experimentales menos desarrolladas.
El tratamiento de la DBP establecida es sintomático. Para la insuficiencia respiratoria, mantener oxigenación adecuada para evitar hipertensión pulmonar y adecuar la VM, si es necesaria, a la situación fisiopatológica del pulmón. Los pilares básicos del tratamiento son una nutrición adecuada, con aporte de calorías alto, y restricción hídrica. Los broncodilatadores, los diuréticos y los esteroides inhalados pueden mejorar la sintomatología clínica de forma transitoria, pero no hay evidencia de que modifiquen el curso de la DBP. Se debe vigilar la aparición de hipertensión arterial sistémica. Los casos más graves pueden desarrollar una hipertensión pulmonar con insuficiencia cardíaca derecha, que pueden requerir tratamiento con vasodilatadores pulmonares.
La DBP tiene repercusiones que se extienden durante la infancia y trastornos subclínicos de la función pulmonar, especialmente aumento de resistencia en vía aérea e hiperreactividad bronquial, al menos en las formas graves de DBP clásica. No hay datos de seguimiento a largo plazo para la nueva DBP, pero algunos estudios indican un incremento menor de resistencia, pero con un volumen pulmonar menor al año de edad49. En la tabla 3 se señalan otros problemas que los RN con DBP tienen más riesgo de presentar, así como las medidas de seguimiento multidisciplinario, que deben programarse para estos pacientes.