Puntos clave
La incidencia de los defectos estructurales del corazón y grandes vasos -cardiopatías congénitas- se sitúa alrededor del 8‰ de recién nacidos vivos. Alrededor del 30% de ellas necesitará tratamiento médico, intervencionista o quirúrgico en el periodo neonatal o dentro del primer año de vida.
El modelo hemodinámico del feto se define como «circulación en paralelo». En el modelo hemodinámico posnatal «en serie», cada ventrículo debe distribuir por separado su volumen sistólico: el derecho al lecho vascular pulmonar, el izquierdo al lecho vascular sistémico.
El miocardio fetal es más rígido y menos complaciente para recibir volumen que su homónimo posnatal o «del adulto» debido a diferencias estructurales, biológicas y metabólicas.
La detección prenatal de las cardiopatías congénitas se apoya en diferentes y secuenciales cortes ecocardiográficos combinados con la técnica Doppler.
El beneficio de la detección prenatal de cardiopatía congénita es consecuencia de un óptimo manejo médico, intervencionista y/o quirúrgico posnatal inmediato. Su impacto clínico sanitario se compara con neonatos sin diagnóstico precoz intraútero.
Los defectos estructurales del corazón (cardiopatías congénitas [CC]) en recién nacidos vivos constituyen una de las principales causas de mortalidad infantil, su incidencia al nacimiento oscila entre 5 y 12‰. Alrededor del 30% de ellas precisará tratamiento médico, quirúrgico o intervencionista en este periodo. La detección prenatal de las CC presupone un beneficio potencial para los afectados en términos de supervivencia posnatal; sin embargo, con frecuencia no se diagnostican en la exploración ultrasónica obstétrica de rutina. La complejidad del estudio del corazón fetal (órgano móvil, anatomía compleja y múltiples anomalías posibles) es en alguna medida un obstáculo para el ecografista obstétrico, quien se sitúa en primera línea de sospecha diagnóstica. Su participación activa en un programa de entrenamiento ecocardiográfico fetal extiende el binomio conocimiento/habilidad para una exploración cardiovascular óptima1–4.
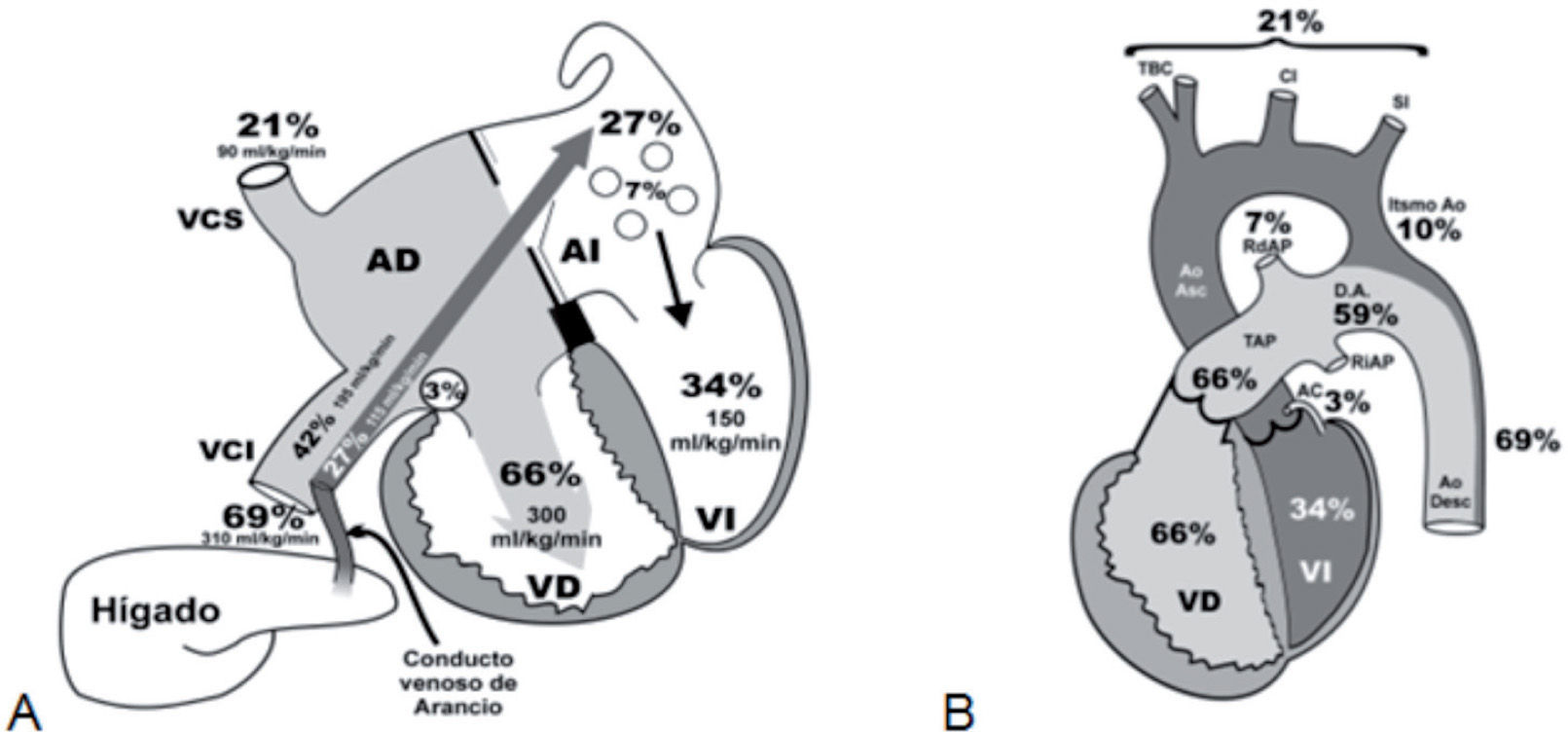
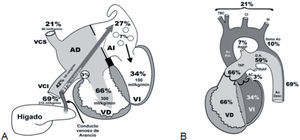
Circulación fetalEl modelo hemodinámico fetal se define como «circulación en paralelo». La sangre que retorna oxigenada desde la placenta hacia el feto lo hace a través de la vena umbilical, para seguir luego 2 caminos: a) una pequeña parte se dirige al lóbulo derecho del hígado, y b) la otra, a través del conducto venoso de Arancio (ductus venoso) se «adosa» (no se mezcla) con el flujo sanguíneo no oxigenado proveniente del retorno venoso de vena cava inferior (VCI) —mitad inferior del cuerpo5,6. En total, este volumen sanguíneo representa el 69% del gasto ventricular combinado (GVC). Los 2 flujos de sangre «adosados» que alcanzan la aurícula derecha (AD) se distribuyen en diferentes rutas: a) el torrente sanguíneo oxigenado proveniente de la vena umbilical pasa directamente a la aurícula izquierda (AI) a través del agujero de Botallo o foramen ovale (representa el 27% del GVC), y b) el remanente flujo no oxigenado de la VCI (representa el 42% del GVC) se dirige por el orificio tricuspídeo hacia el ventrículo derecho (VD). El retorno venoso de la mitad superior del cuerpo llega a la AD a través de la vena cava superior (VCS) (representa el 21% del GVC); por último, el seno coronario aporta a la AD un volumen del 3%. La sumatoria proporcional de estos volúmenes (42% + 21% + 3%) conforman el 66% del flujo sanguíneo que administra el VD; esta cámara lo impulsa a la arteria pulmonar (AP) y a través del ductus arterioso (DA) a la aorta (Ao) descendente (no más de un 3–5% circula por la vasculatura pulmonar). El ventrículo izquierdo (VI) distribuye solo el 34% del GVC (24% para las arterias coronarias, vasos del cuello y cerebro, el 10% restante para la Ao descendente) (fig. 1)4–6.
El desarrollo fetal de las estructuras vasculares es fiel reflejo del volumen sanguíneo que distribuyen, de modo que podemos extraer algunas conclusiones de valor para interpretar las observaciones que aporta el ecocardiograma fetal5:
- 1.
La VCI durante la vida fetal transporta el doble de flujo que la VCS (el 69 frente al 21%, respectivamente), como consecuencia, sus propios tamaños así lo reflejan.
- 2.
El VD y la AP administran el 66% del GVC, mientras que el VI y Ao solo el 34%, lo que explica por qué los primeros tienen mayor desarrollo que los segundos.
- 3.
El DA (59% del GVC), el tronco de la AP (66% del GVC) y la Ao descendente (69% del GVC) tienen en la vida fetal un tamaño similar, por distribuir en la vida fetal volúmenes muy parecidos.
- 4.
Los 2 ventrículos en la vida fetal trabajan en paralelo (eyectan ambos hacia la Ao) y no en serie como en el recién nacido.
- 5.
La Ao ascendente distribuye el 34% del GVC: el 24% es requerido por las arterias coronarias y los vasos del cuello, y el 10% restante es impulsado hacia la Ao descendente. Es por ello que la región comprendida entre la arteria subclavia izquierda y el DA es el segmento aórtico más estrecho (istmo aórtico).
El nacimiento acarrea una serie de cambios en la circulación fetal que abarcan fundamentalmente: la expansión pulmonar, la desaparición de la placenta, el cierre ductal (el oxígeno es un potente inhibidor de la síntesis de prostaglandinas que lo mantienen permeable en la vida intrauterina), la oclusión del ductus venoso y el cierre funcional del foramen ovale (la creciente circulación pulmonar aumenta el retorno venoso a la AI, elevando al tiempo su presión, de modo que ambos —septum pri-mumy secundum— se aproximan entre sí). Todo el proceso se traduce en la desaparición de la circulación en paralelo, y el inicio de su homónima en serie: AD > VD > AP > pulmones (hematosis) > AI > VI > Ao, de modo que cada ventrículo debe hacerse cargo por separado del 100% de gasto cardíaco estimado en 450ml/kg/min en el momento del nacimiento. La desaparición de la placenta, que constituía un lecho de baja resistencia arteriolar sistémica, provoca un incremento considerable de la misma luego del nacimiento. La vena umbilical se transformará en el ligamento redondo del hígado y el ductus venoso en el ligamento venoso7.
El miocardio y la función ventricular fetalExisten marcadas diferencias entre el sistema cardiovascular fetal respecto del posnatal («adulto»); entre ellas destacan: a) estructurales (los precursores miocitos del feto se replican e incrementan fundamentalmente en número —hiperplasia— y muy poco en tamaño [hipertrofia], menor organización miofibrilar, pobre presencia del sistema tubular-T y del retículo sarcoplásmico/mitocondrial, alta concentración de ADN y predominio de elementos no contráctiles); b) biológicas (menor captación de calcio sarcoplásmico y presencia disminuida de adrenorreceptores α-β, y c) metabólicas (utilización preferente de la glucosa en la vía energética miocárdica en detrimento de los ácidos grasos). Sobre la base de tales diferencias, el miocardio fetal es más rígido (predominio Doppler del llenado activo ventricular —contracción auricularl, onda «A»— respecto del llenado precoz pasivo —onda «E»—), menos eficiente en la utilización de los mecanismos de relajación activa, y desarrolla menor tensión sistólica respecto del miocardio adulto a similar longitud miofibrilar inicial. El gasto cardíaco combinado biventricular normal se afecta ante cambios significativos de precarga (llenado ventricular alterado), poscarga (incremento de impedancia a la eyección) y deficiente contractilidad intrínseca del miocardio; se altera asimismo si la frecuencia cardíaca fetal excede el rango de normalidad (< 50 o > 200lpm, respectivamente). Con todo, el mayor determinante del gasto cardíaco es la poscarga, de modo que cualquier factor que incremente el esfuerzo sistólico ventricular (aumento de la resistencia placentaria, oclusión prematura del ductus arterioso) puede limitar la capacidad funcional —sistodiastólica— del corazón. Como consecuencia de una reserva contráctil decreciente en respuesta a diferentes condiciones de estrés, la perfusión de los tejidos y órganos vitales se torna inadecuada, lo que en esencia define el concepto de insuficiencia cardíaca fetal. El feto expresa esta condición con la secuencia: ascitis, derrame pleural y/o pericárdico, edema de tejidos blandos e hidropesía8.
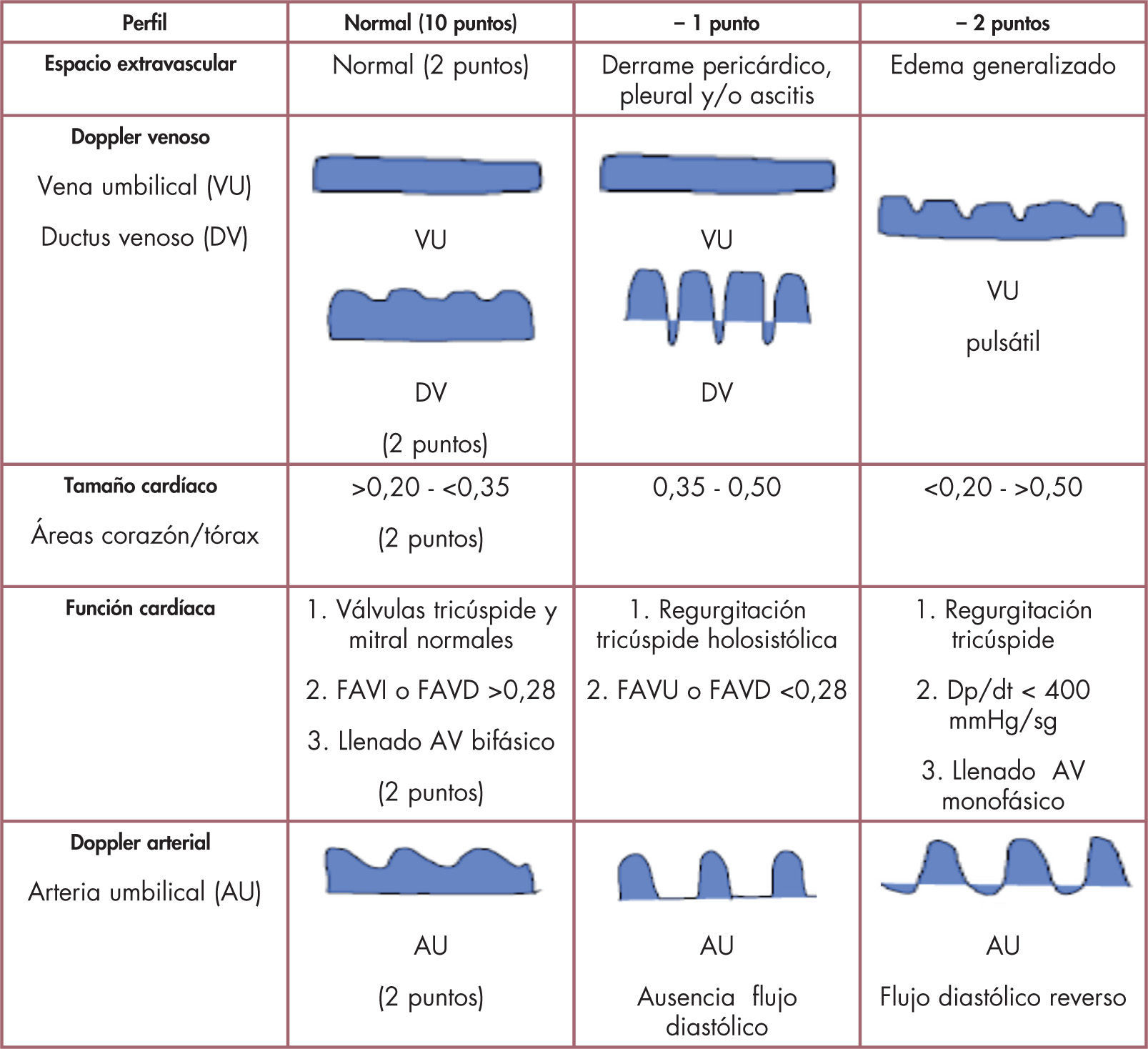
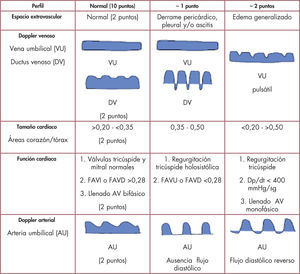
Desde la perspectiva hemodinámica, un aumento de la presión final diastólica ventricular y de la presión auricular/venosa sistémica, acaba por inducir una serie de fenómenos biopatológicos «en cascada» que conducen a la acumulación de fluidos extracelulares. Siendo la AD el centro hemodinámico de la circulación fetal, no debe extrañar que precozmente se detecte dilatada en el examen ecocardiográfico; al tiempo, la función sistémica que ejerce el VD se afecta de forma temprana ante un ascenso de la resistencia vascular placentaria. La hidropesía es tradicionalmente clasificada en inmunitaria (isoinmunización) o no inmunitaria; esta última es en la práctica cotidiana la más frecuente (> 90% de casos) y constituye un marcador de mal pronóstico fetal. Ante un feto con hidropesía debemos determinar si esta es cardíaca, inflamatoria o metabólica: a) arritmia fetal; b) cardiopatía estructural; c) anemia; d) síndrome de transfusión feto-fetal; e) malformaciones no cardíacas (hernia diafragmática, adenoma quístico pulmonar); f) infección fetal (parvovirus, adenovirus); g) malformación vascular (fístula arteriovenosa —fisiología de alto gasto cardíaco— y ausencia de ductus venoso, entre otras), y h) síndromes o cromosomopatías. Una guía de valor clínico fue propuesta por Huhta, quien desarrolla una puntuación o «score descendente» del perfil cardiovascular fetal (fig. 2)8,9. El perfil normal se puntúa con 10 puntos decreciendo ante la presencia de: a) derrame pleural/pericárdico o hidropesía; b) anormalidades del flujo Doppler en ductus venoso y/o vena umbilical y/o hepática; c) biometría cardíaca (alteración del tamaño del corazón); d) disfunción biventricular (con/sin regurgitación valvular auriculoventricular), y e) disturbio diastólico (patrón retrógrado) en flujo Doppler de la arteria umbilical. Este último parámetro se considera marcador de mala evolución fetal, del mismo modo que los son la hidropesía y el corazón pequeño (relación de área cardíaca/torácica < 0,20) — usualmente presentes en el adenoma quístico pulmonar10.
Esquema delperfil cardiovascular fetal. Tomado/modificado de Huhta8.
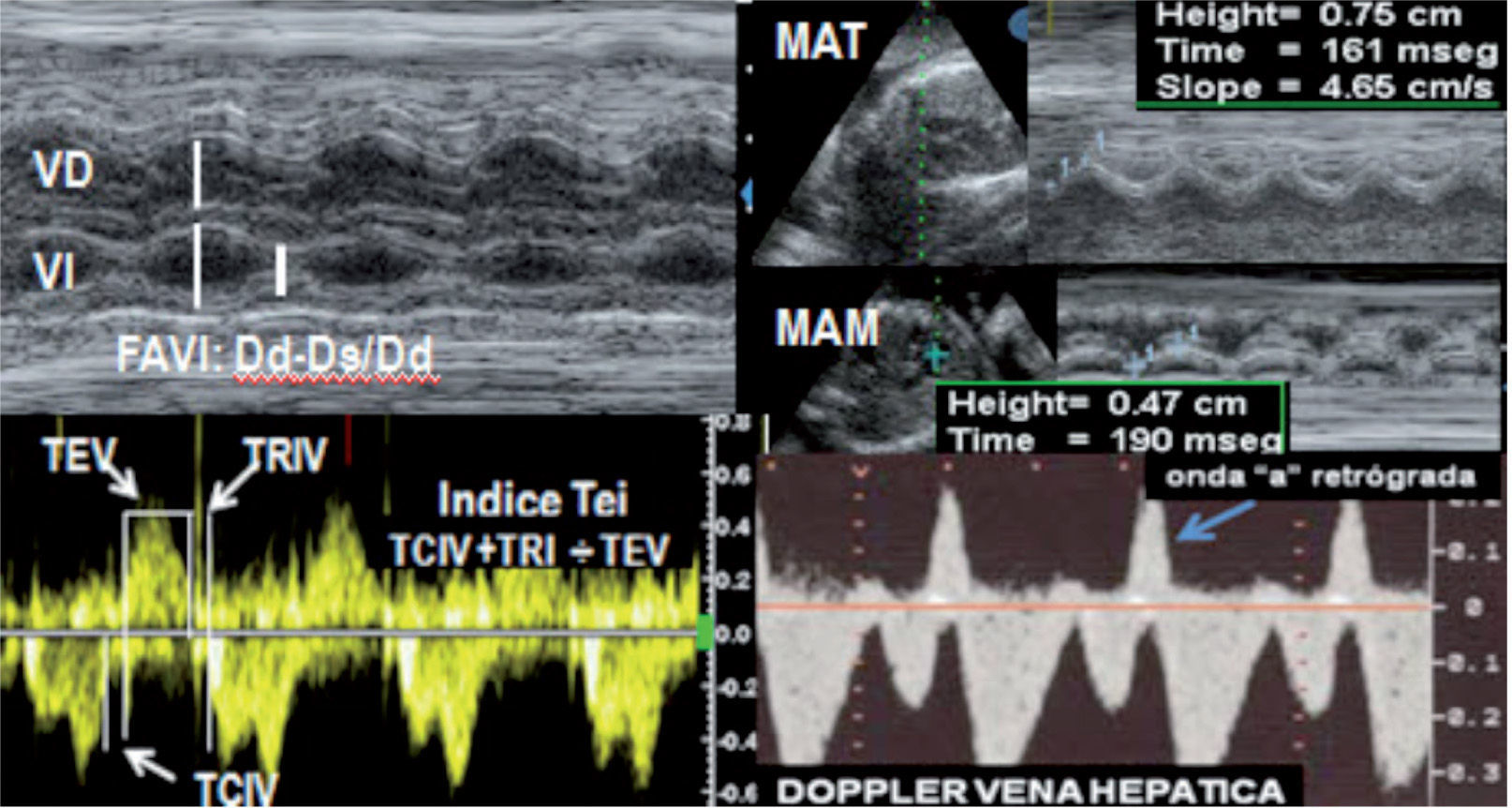
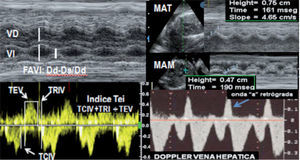
La función biventricular se evalúa cuantitativamente de forma sencilla con modo M al determinar la fracción de acortamiento de ambos ventrículos (normal > 0,26). Más recientemente, se incorporan a la valoración global otros parámetros (derivados de la determinación funcional del corazón en niños y adultos), entre ellos: el movimiento anular apical-longitudinal tricus-pídeo y mitral, y la determinación del índice de función miocárdica —índice Tei (Doppler flujo y Doppler tisular— los valores no son intercambiables entre sí) (fig. 3). Asimismo, otros parámetros específicos están representados por la velocidad inicial Doppler de la regurgitación tricúspide y/o mitral (dp/dt) y la fracción de eyección con técnica volumétrica 3D/4D9,11,12.
Composición de imágenes de las que se determinan diferentes parámetros defunción ventricular. Dd: diámetro diastólico; Ds: diámetro sistólico; FAVI:fracción de acortamiento ventricular izquierdo; MAM: movimiento anular mitral (cm/s); MAT: movimiento anular tricúspide (cm/sg); TCIV: tiempo contracción isovolumétrica; TEV: tiempo eyección ventricular; TRIV: tiempo de relajación isovolumétrica; VD: ventrículo derecho; VI: ventrículo izquierdo;. Abajo-derecha: imagen de la onda «a» retrógrada en la vena hepática como signo de severa disfunción ventricular.
El aparato cardiovascular fetal se evalúa morfológicamente mediante la ecocardiografía 2D, con el aporte adicional de la técnica Doppler y codificación en color para determinar dirección/velocidad de los flujos intracardía
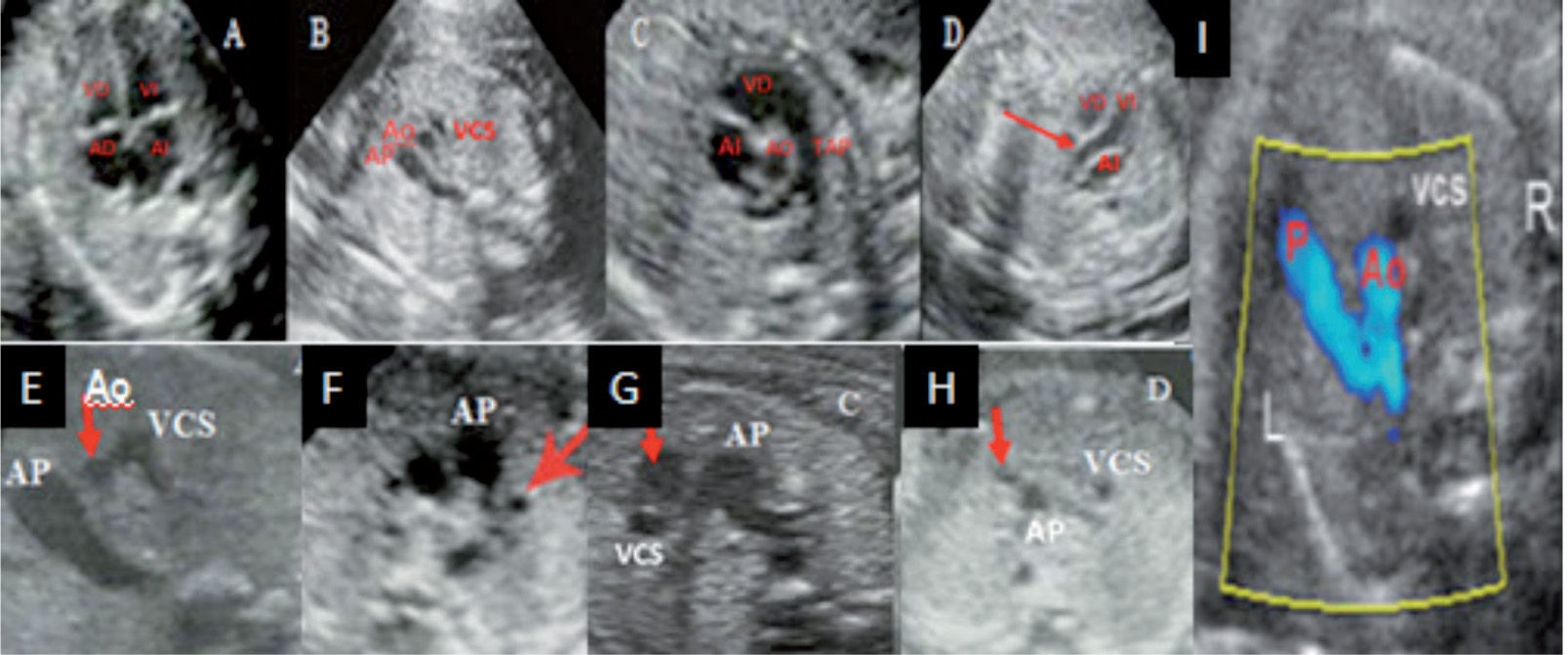
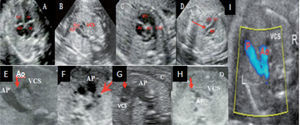
cos y vasculares. La edad gestacional propuesta como la más apropiada para realizar la exploración transabdominal se sitúa entre las semanas 18 y 20, pues en el inicio del segundo trimestre la ventana acústica resulta óptima para alcanzar una elevada confiabilidad diagnóstica. Las indicaciones para el estudio detallado del corazón fetal se exponen en la tabla 1 (gestantes con «alto riesgo materno-fetal»); sin embargo, dado que más del 70% de las CC se presentan en embarazos de «bajo riesgo», aquellas pautas deberían ampliarse4,13. Los planos de corte ecocardiográficos que no deben faltar en un examen de cribado aplicado con objetivo de aproximación diagnóstica segmentaria y secuencial son: el plano abdomino-transversal, la clásica proyección de 4 cámaras, la imagen de los tractos de salida de ambos ventrículos (eje largo del VI y VD, eje corto de Ao), y el corte de 3 vasos (fig. 4 A-D). Otros adicionales de utilidad son los sagitales y longitudinales, que reúnen corazón y grandes vasos simultáneamente4,7,14.
Factores de riesgo.
| Materno-familiares |
| Historia familiar de cardiopatía congénita |
| Síndrome cromosomopatías |
| Diabetes |
| Teratógenos (anticonvulsivos, litios, etc.) |
| Anticuerpos maternos (anti Ro/anti La) |
| Infecciones maternas (Cocksakie, parvovirus, etc.) |
| Fetales |
| Sospecha anomalía cardiovascular |
| Translucencia nucal aumentada |
| Derrame pericárdico/pleural, hidropesía |
| Anomalía no cardíaca (reconocida asociación con CC) |
| Cariotipo anormal |
| Arritmia |
CC: cardiopatía congénita.
Arriba. A) Corte de 4 cámaras. B) Corte de 3 vasos. C) Corte de eje corto de la aorta. D) Corte de eje largo del VI. La flecha señaliza laAo. Abajo: anormal vista de los 3 vasos. E) AP dilatada y Ao más pequeña que la VCS. F) Se observa un cuarto vaso (señalizado) a la izquierda de laAP que corresponde con la vena cava superior izquierda persistente. G) LaAo (señalizada) de ubicación más anterior que laAP. H) LaAo (señalizada) con localización antero-izquierda respecto dlaAP. I) Signo de la V (en color) que detecta la normal conexión entre AP, ductus y Ao descendente (primer trimestre). AD: aurícula derecha; AI: aurícula izquierda; AP: arteria pulmonar; Ao: aorta; VCS: vena cava superior; VD: ventrículo derecho; VI: ventrículo izquierdo. Tomado/modificado de Perez Pedregosa et al36.
El corte de 4 cámaras (considerado básico en la ecocardiografía de rutina) presenta anormalidades evidentes en el 50–60% de los defectos cardíacos mayores (aquellos que precisan tratamiento en el primer año de vida) o condiciones especiales (véase la tabla 2). Se tendrá en cuenta que el área cardíaca (ápex del corazón antero-izquierdo por ángulo de 45° entre el tabique interventricular y la línea media del tórax) debe ocupar normalmente alrededor de un tercio del área transversal del tórax fetal (normal: > 0,20−< 0,35)15–18.
Alcance del diagnóstico ecocardiográfic.
| Anomalías evidentes en corte de 4 cámaras |
| Hipoplasia ventrículo izquierdo (estenosis/atresia aórtica y/o mitral, coartación) |
| Hipoplasia ventrículo derecho (aislada, atresia tricuspídea, estenosis/atresia pulmonar) |
| Comunicación interventricular muscular grande |
| Corazón univentricular/doble entrada |
| Tumores (rabdomioma) |
| Discordancia auriculoventricular (transposición corregida grandes arterias) |
| Enfermedad de Ebstein |
| Derrame pericárdico. Hipertrofia miocárdica. |
| Asimetría ventricular |
| Anomalías con corte de 4 cámaras «normal», detectables con otros cortes |
| Transposición grandes arterias. Doble salida del ventrículo derecho |
| Tetralogía de Fallot/con o sin atresia pulmonar |
| Tronco arteria común |
| Coartación de aorta |
| Estenosis aórtica o pulmonar, formas leves |
| Anomalías de difícil diagnóstico |
| Conexiones venosas anómalas: pulmonar y/o sistémica |
| Anillos vasculares |
| Arteria subclavia derecha aberrante, con arco aórtico izquierdo |
| Coartación de aorta |
Los cortes específicos —tractos de salida y eje corto de aorta— combinados con las anteriores, amplían el porcentaje de CC detectables (alrededor del 90–92%), como ejemplo: las malformaciones troncoconales (tetralogía de Fallot, atresia pulmonar, tronco arterioso común, doble salida del VD) y la transposición de grandes arterias (presenta disposición paralela de los vasos contraria al entrecruzamiento normal)19.
La proyección de 3 vasos aporta una imagen «multivaso» con alineación en torno a un eje transversal común (de derecha a izquierda y de atrás hacia adelante): la VCS, la Ao en medio y «por encima» la AP. Esta vista es fácil de aprender y obtener, al tiempo evalúa otras estructuras del mediastino fetal: tráquea, bronquios, esófago y timo (si este último no está presente o es pequeño su tamaño sugiere el diagnóstico de microdeleción 22q11)20–26.
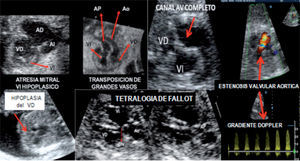
La sospecha de malformaciones en esta proyección se apoya en la visualización de anomalías del tamaño, alineación/disposición y el número de vasos observados (fig. 4 E-H). Se presenta anormal en la mayoría de las CC y permite asimismo la sospecha de anomalías de los grandes vasos mediastinales —tanto arteriales como venosos— (arco aórtico derecho, doble arco aórtico, anillos vasculares, arteria subclavia aberrante, doble sistema vena cava superior, etc.). Una VCS dilatada y pulsátil sugiere fístula arteriovenosa (aneurisma de la vena de Galeno)27–30. Entre las anomalías de difícil reconocimiento cabe destacar la coartación de la Ao debido a la singularidad morfológica que le acompaña; la confiabilidad diagnóstica aumenta al sumar observaciones precisas (asimetría ventricular, arco aórtico pequeño, AP dilatada, imagen obstructiva con disturbio flujo Doppler en istmo)31,32. En la figura 5 se exponen imágenes de diferentes malformaciones cardíacas obtenidas con los planos de corte definidos en apartados previos.
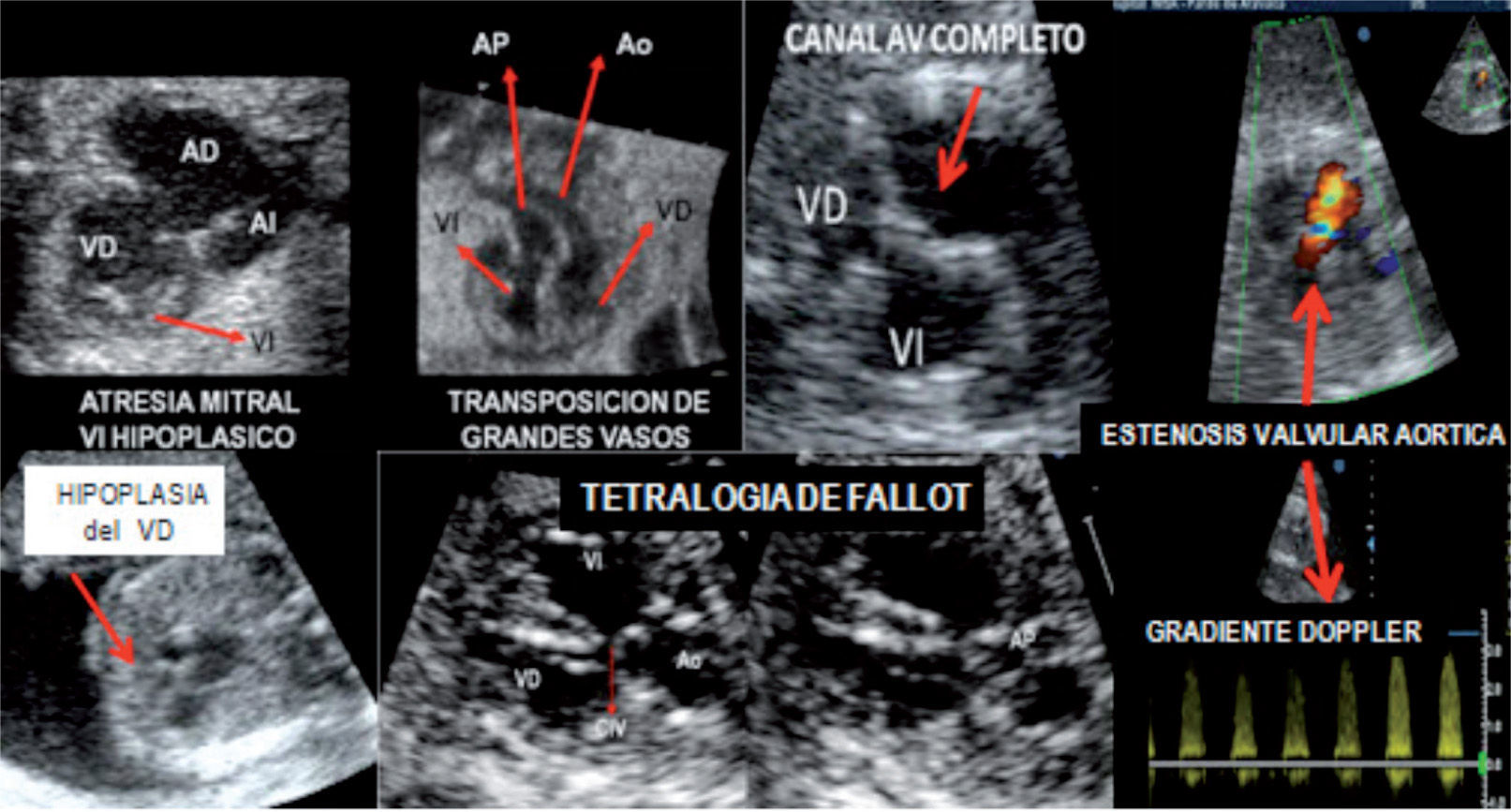
Composición fotográfica de diversas cardiopatías. Arriba, de izquierda a derecha: atresia mitral con hipoplasia de ventrículo izquierdo, transposición de grandes arterias, canal auriculoventricular completo y estenosis valvular aórtica (flujo Doppler color turbulento en aorta ascendente dilatada). Abajo, de izquierda a derecha: hipoplasia del ventrículo derecho, tetralogía de Fallot y gradiente Doppler en estenosis valvular aórtica.
El impacto clínico de la ecocardiografía fetal aporta utilidad sobre los siguientes apartados: conocimiento fisiopatológico evolutivo de las CC, esclarece su incidencia/prevalencia, estrategia de manejo perinatal (asesoramiento de la pareja, modalidad y centro especializado para el parto, terapéutica intraútero) y potencial beneficio del tratamiento neonatal (médico, intervencionista y/o quirúrgico) en términos de morbimortalidad. A partir de este último argumento, existe apreciable consenso en admitir
En los últimos años se acentúa el interés por una valoración ecográfica morfológica fetal completa en las semanas 11 a 14 de la gestación, validada por una elevada tasa de detección de anomalías estructurales35–37. La medición de la translucencia nucal (TN) es un marcador para cribado de aneuploidías que debería combinarse con la búsqueda de malformaciones estructurales (extracardíacas y cardiovasculares). Conviene puntualizar que las CC son 4 veces más frecuentes que los defectos del tubo neural y hasta 6 veces más respecto de las cromosomopatías; los programas de prevención materna (suplementos de ácido fólico y vitamina B12) procuran disminuir su incidencia y diagnosticarlos de forma precoz36.
La ecografía del primer trimestre permite examinar el corazón fetal de forma temprana en gestantes de riesgo alto (con antecedentes destacables, en fetos con incremento de TN y/o flujo anómalo en ductus venoso y/o presencia de regurgitación tricuspídea y ante la presencia de cualquier alteración estructural). Los beneficios del diagnóstico precoz son claros: a) planificación del nacimiento en centros adecuados y especializados en el manejo de las CC; b) asesoramiento genético multidisciplinario para que los futuros padres puedan comprender y contar con información actualizada (ya desde la etapa prenatal en relación con las características de la enfermedad, posible mecanismo hereditario, evolución y pronóstico, posibilidades de tratamiento y supervivencia en país de residencia, calidad de vida y riesgo de recurrencia para futuros embarazos); c) ofrecer la interrupción legal de la gestación en aquellos casos seleccionados de mal pronóstico con tiempo suficiente para tomar decisiones ponderadas, y d) y apoyar las decisiones (obstetra y cardiólogo) de los padres evitando modificarlas por motivo alguno (ideológico, religioso, intencionalidad médico/quirúrgica, entre otros). El diagnóstico de anomalías cardíacas en este periodo gestacional puede también explicar pérdidas fetales tempranas que de otra forma quedarían sin determinar causa aparente. Por otro lado, un examen cardíaco normal a las 11–14 semanas reducirá la ansiedad de los futuros padres con especial relevancia en aquellas familias de alto riesgo. Por todas estas razones, ha de considerarse si la exploración precoz del corazón fetal debería ser realizada en todas las gestantes, teniendo en cuenta que el 80% de las malformaciones cardíacas aparecen en población de bajo riesgo, o por el contrario en aquellos casos seleccionados de alto riesgo.
Cuándo y cómoEl abordaje transvaginal (ocasionalmente molesta e inconveniente) proporciona mayor resolución pero menor número de planos respecto del abdominal y es especialmente útil en gestaciones más cercanas a las 11–13 semanas o en aquellas pacientes con subóptimas condiciones para la valoración transabdominal (hábito materno, cicatrices abdominales, útero en retroversión). Un operador experto puede valorar el corazón en un tiempo de exploración aceptable (entre 10 y 20min), en cualquier caso, ambas opciones de abordaje combinadas aportan mejores resultados36,37.
El momento ideal para el examen precoz se sustenta en la tasa de evaluación cardíaca completa que se incrementa con la edad gestacional: el 20% entre las 11-11 + 6 semanas y el 92% entre 13-13 + 6 semanas por abordaje transvaginal38–41. También es importante considerar la posibilidad de lesiones evolutivas (anomalías valvulares severas y defectos septales) que modifican los hallazgos ecocardiográficos en el transcurso del embarazo, por lo que el seguimiento es necesario en la mayoría de los casos y la exploración cardíaca del segundo trimestre continúa siendo fundamental. El estudio morfológico básico extendido propuesto por el ISUOG debe complementarse con técnica Doppler pulsado/color, se describen diferentes signos útiles han que de ser evaluados ante la sospecha de anomalía (signo de la X que representa el cruzamiento normal de la Ao y la AP, y el signo de la V que muestra la conexión entre la arteria pulmonar con el duc-tus arterioso y la aorta descendente (fig. 4 I).
Translucencia nucal y cardiopa tías congénitasMúltiples estudios han demostrado que la presencia de TN aumentada es un hallazgo no específico, en fetos sin cromosomopatía, asociado a un amplio rango de defectos estructurales, síndromes genéticos y letalidad intraútero39. La prevalencia de defectos al nacimiento y evolución desfavorable incluyendo aborto y pérdida fetal aumenta con el incremento de la medida del grosor de la TN. Entre las anomalías estructurales, las CC son las más comunes tanto en fetos aneuploides como en aquellos con cariotipo normal40. Se ha demostrado una prevalencia mayor de CC que se incrementa de manera exponencial con el aumento del grosor de la TN (del 6 al 62‰ en aquellos con TN comprendida entre 2,5 a 3,4mm y del 23 al 122‰ en aquellos fetos con TN > 3,5mm).
Un metaanálisis reciente sobre el empleo de la determinación de la TN como método de cribado para la detección de CC precisó que el uso del percentil 95 y 99 puede identificar aproximadamente el 37 y 31%, respectivamente, de las cardiopatías41. Otros marcadores, como la presencia de flujo diastólico ausente o reverso en ductus venoso y la presencia de insuficiencia tricuspídea, también se han relacionado con un incremento del riesgo de CC, tanto en fetos aneuploides como en aquellos con cariotipo normal. La gran importancia del diagnóstico prenatal de estas anomalías y los grandes progresos —tanto técnicos como de conocimiento y experiencia— a los que asistimos en la última década van encaminados a que la valoración pormenorizada del corazón fetal durante la exploración de 11–14 semanas sea una obligación para con nuestros pacientes.
Arritmia fetalLas arritmias fetales se clasifican en 3 grandes grupos: ritmos cardíacos irregulares, taquicardias (> 180–200lpm) y bradicardias (< 80lpm). El diagnóstico prenatal de estos trastornos se basa en 4 técnicas de observación: a) eco cardiografía modo M de la pared auricular y ventricular; b) estudio Doppler a nivel de válvulas auriculoventriculares y semilunares; c) registro del Doppler tisular (aporta datos de los intervalos auriculoventriculares y ven-triculoauriculares), y d) magnetocardiografía (avance reciente que permite identificar determinados mecanismos electrofisiológicos de la arritmia)4,42–45.
La forma de presentación más frecuente de los ritmos cardíacos irregulares son los latidos ectópicos auriculares múltiples que se presentan entre el 1 y el 3% de los fetos, suelen ser esporádicos y benignos, si bien no se descarta que precedan a la taquicardia supraventricular posnatal.
Alrededor del 80% de las taquiarritmias son supraventriculares (con frecuencia cardíaca > 200lpm) y no se asocian habitualmente a cardiopatía estructural; suelen aparecer entre las semanas 25 y 32 de gestación. La taquicardia por reentrada puede ser intermitente y su frecuencia suele oscilar entre 190 y 220lpm. Una prolongada duración del trastorno del ritmo y su presencia en fetos más inmaduros condiciona la aparición de hidropesía.
Un 20% de las taquiarritmias se corresponden con flutter auricular, ocasionalmente precedidas de arritmia supraventricular45,46. Las taquiarritmias ventriculares o de la unión resultan de difícil diagnóstico, suelen tener una frecuencia de 200 a 240lpm y durante su identificación suele observarse de forma combinada periodos de alta y baja frecuencia (pueden asociarse a síndrome de QT largo o ser consecuencia de miocarditis). Las arritmias rápidas —previa identificación supra o ventricular— pueden tratarse farmacológicamente (por vía oral materna) con excelentes resultados, preferentemente antes de la aparición de hidropesía.
El bloqueo auriculoventricular completo (BAVC) es el mecanismo más común presente en fetos con frecuencia < 80lpm. Dos asociaciones son reconocidas: cardiopatía estructural (doble discordancia —transposición corregida de grandes vasos con o sin ventrículo único— y/o síndrome asplenia o poliesplenia) y presencia de anticuerpos maternos SSA, SSB o anti-Ro. Aproximadamente, el 7% de los fetos con BAVC cursan con hidropesía y/o muerte fetal, mientras que el 10–15% de los recién nacidos puede fallecer con insuficiencia cardíaca severa. Indicadores de mal pronóstico son: frecuencia cardíaca fetal < 50lpm, disfunción ventricular, insuficiencia de las válvulas auriculoventriculares o hidropesía. El tratamiento farmacológico materno es posible ante el BAVC —corticoides, salbutamol—, pero los resultados suelen ser inconsistentes47,48.
Intervencionismo fetalValiéndose de la teoría del flujo circulatorio alterado asociada a factores epigenéticos secundarios, existe acuerdo entre expertos en considerar que determinadas cardiopatías obstructivas fetales (estenosis pulmonar y estenosis aórtica) diagnosticadas entre las semanas 16–20 pueden afectar al desarrollo de las cámaras cardíacas hasta el extremo de impedir o detener su normal crecimiento evolucionando a la hipoplasia cavitaria durante el curso del embarazo. Ambas afecciones reducen inicialmente el flujo de salida ventricular y conforme avanza el embarazo alteran también el llenado ventricular; la consecuencia del disturbio circulatorio es un hipodesarrollo cavitario significativo y/o extremo. En otras malformaciones, ya diagnosticadas en ese periodo de gestación (síndrome de hipoplasia de cavidades izquierdas y la transposición de grandes vasos), la permeabilidad, la movilidad y la fisiología normal del foramen oval pueden alterarse hasta el extremo de influir en el pronóstico posnatal de la cardiopatía cualesquiera fueran los procedimientos intervencionistas o quirúrgicos a realizar después del nacimiento (foramen oval restrictivo). El talento de ambos —ecocardiografista y cardiólogo pediatra intervencionista—, sumado al desarrollo tecnológico (catéteres, guías y balones de bajo perfil), ha posibilitado el desarrollado de un campo de intervención cardíaca fetal aun en fase de experimentación clínica pero con un futuro promisorio aún por determinar. Con todo, las indicaciones para efectuar los procedimientos están sujetas en la actualidad a discusión por la comunidad médica. Las intervenciones propuestas son las siguientes: valvuloplastia valvular aórtica en la estenosis aórtica, valvuloplastia pulmonar en la estenosis pulmonar, y septostomía auricular con láser-balón en el síndrome de hipoplasia de cavidades izquierdas (excepcionalmente, en la transposición de grandes vasos) cuando el foramen oval se manifieste irrefutablemente restrictivo. Otras intervenciones cardiovasculares excepcionales son: marcapaso endocavitario en fetos con bloqueo auriculoventricular completo con frecuencia ventricular < 50lpm e hidropesía, ablación de comunicaciones arteriovenosas con láser en gestaciones gemelares monocoriales en el síndrome de transfusión feto-fetal, o pericardiocentesis en fetos severamente enfermos49–54.