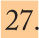La infección por Trypanosoma cruzi o enfermedad de Chagas es una enfermedad crónica endémica desde el sur de Estados Unidos hasta Chile y Argentina. Se transmite por la picadura de la vinchuca, vía transfusional o por trasplante de órganos y de madre a hijo en cualquiera de sus embarazos. La infección congénita podría pasar inadvertida pues la embarazada con infección por T. cruzi frecuentemente desconoce su infección y está asintomática.
EpidemiologíaLa enfermedad de Chagas es una infección parasitaria crónica muy compleja y con una elevada morbimortalidad. A pesar de las diferentes iniciativas promovidas por la Organización Panamericana de la Salud en los últimos años todavía constituye una amenaza permanente para casi la cuarta parte de toda la población de América Latina, pues se estima que 28 millones de personas se encuentran en riesgo de adquirir la infección1. Se ha estimado, además, que en el año 2006 la enfermedad era endémica en 21 países, el número de personas infectadas era de 8 millones, y se producían 41.200 nuevos casos anuales y 12.500 muertes. En cuanto a la infección congénita, se estima que en las Américas, habría cerca de 2 millones de mujeres en edad reproductiva infectadas por T. cruzi, de las que entre el 4 y el 8% transmitirían la infección al feto por vía transplancentaria y, consecuentemente, nacerían anualmente unos 15.000 niños con enfermedad de Chagas congénita2.
Puntos clave
Debido al aumento de la inmigración desde América al resto del mundo, la enfermedad de Chagas ha pasado de ser una endemia en América Latina a convertirse en una enfermedad global, ya que se describen casos en un gran número de países por todo el mundo3. España se ha convertido en los últimos años en un destino muy frecuente para los inmigrantes latinoamericanos. Los países que aportan mayor número de inmigrantes son: Ecuador (415.328), Colombia (260.989), Bolivia (196.656) y Argentina (186.032), todos ellos con enfermedad de Chagas endémica.
La tasa de seroprevalencia en gestantes de zonas endémicas en estudios realizados en España se sitúa entre el 1 y el 2%4, que puede alcanzar hasta el 16% en madres de origen boliviano5. El riesgo de transmisión vertical varía según la cepa de T. cruzi, la parasitemia de la madre, lesiones en la placenta y la región geográfica, pero se ha estimado que está en un promedio del 5%. En España ya se han publicado los primeros casos de infección congénita: el primero de una madre boliviana6 y el segundo de una madre argentina7.
Indicación del cribado en el embarazoActualmente, se debería realizar el cribado de la enfermedad de Chagas en las embarazadas procedentes de zonas endémicas que viven en nuestro entorno. Este cribado se justifica porque2:
- —
El riesgo de transmisión del parásito de la madre al hijo persiste, independientemente de que viva en zona endémica o no endémica.
- —
La tasa de prevalencia de enfermedad de Chagas en embarazadas es elevada en países como Bolivia, Argentina y Paraguay.
- —
La detección de anticuerpos anti-T. cruzi es sencilla y puede realizarse en el embarazo o el parto.
- —
Las tasas de curación en neonatos con el tratamiento específico alcanzan casi el 100%.
- —
No tratar conlleva la cronificación de la infección, el mantenimiento de portadores reservorios y la posibilidad de desarrollar la enfermedad en 30-40 años en un tercio de los casos; el corazón y el tracto gastrointestinal son los órganos más afectados.
Para la correcta elección de una herramienta diagnóstica es importante tener en cuenta la fase de la enfermedad, es decir, si se sospecha un caso agudo o crónico. Así, el neonato está en fase aguda y la madre en fase crónica.
La fase aguda se caracteriza por una parasitemia patente, generalmente en los primeros 2 meses tras la infección, por lo que el diagnóstico de la infección por T. cruzi se basa en la búsqueda de parásitos. Transcurrido este período, la parasitemia disminuye por debajo de los límites de detección, por lo que el diagnóstico se realiza mediante la determinación de anticuerpos anti-T. cruzi8.
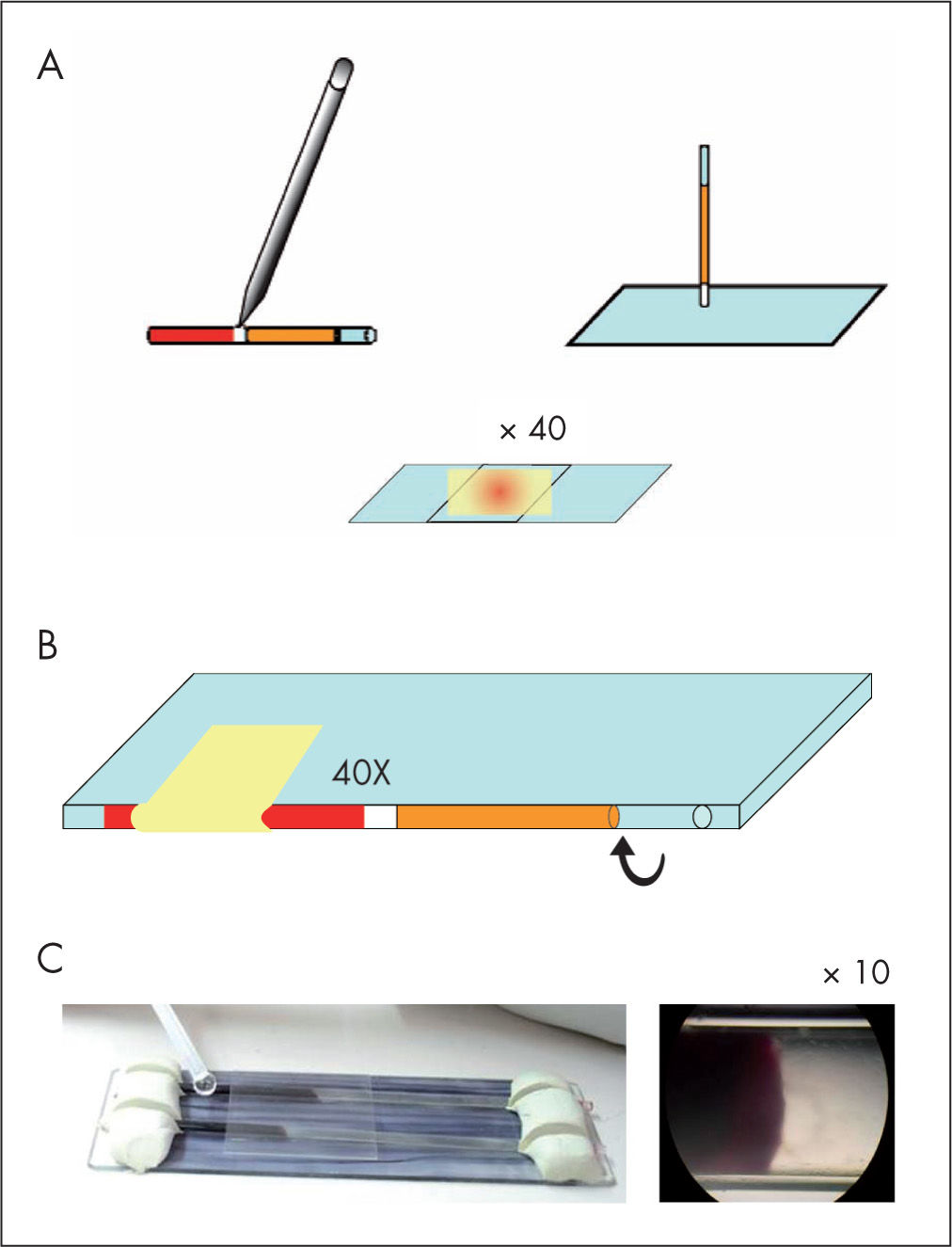
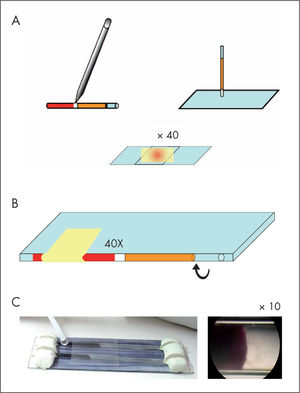
En edad temprana, se debe demostrar la presencia de los tripomastigotes en sangre de cordón o sangre periférica9; la prueba de elección es la técnica del microhematocrito o del tubo capilar heparinizado2. Esta prueba consiste en identificar el movimiento característico de los parásitos en la interfase entre el paquete de hematíes y el plasma de 4 a 6 capilares (50-80μl de sangre). La variante más recomendada es la descrita por Torrico et al10 (www.chagascongenito.org) que evita el riesgo que conlleva la rotura del capilar11. La sensibilidad de este procedimiento es próxima al 100%, y su límite de detección son 40 parásitos/ml de sangre10 (fig. 1).
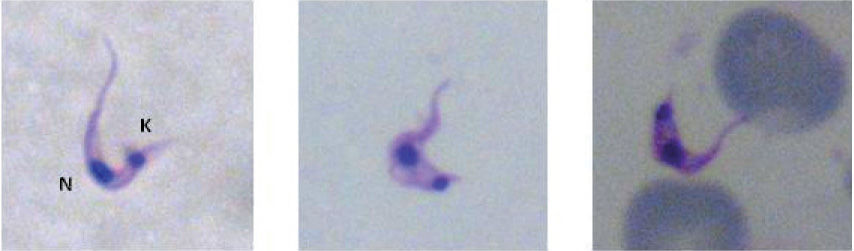
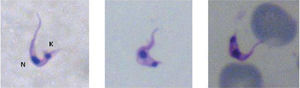
El examen en fresco y la observación de preparaciones teñidas suelen ser útiles cuando las parasitemias son mayores de 2.000 parásitos/ml de sangre12 (fig. 2). La muestra se debe procesar en las 4-8h posteriores a su obtención.
En países endémicos el diagnóstico molecular es muy discutido por su baja sensibilidad en la etapa crónica. Sin embargo, en la etapa aguda su sensibilidad también puede alcanzar el 100%13,14. En España, la técnica de la reacción en cadena de la polimerasa (PCR) es una herramienta sistemática para el diagnóstico de numerosas infecciones. La mayoría de los protocolos para la detección de ADN de T. cruzi tienen una sensibilidad analítica de una centésima a un milésima parte de un parásito y un nivel de detección de 1 parásito/ml de sangre. Parasitemias menores sólo son detectables cuando se analizan volúmenes mayores de 5ml de sangre12,15. Las parasitemias en la infección congénita están entre 6 y 55.000 parásitos/ml16.
Para confirmar la infección mediante la detección de anticuerpos IgG anti-T. cruzi se deben realizar al menos 2 pruebas serológicas de principios y antígenos diferentes8. En caso de discrepancias se debe recurrir a una tercera técnica. En España, existen numerosos ensayos comerciales convencionales que utilizan antígenos totales (ELISA e IFI). También se dispone de ensayos no convencionales, a excepción de los test de ELISA, en su mayoría son pruebas rápidas basadas en inmunocromatografía y aglutinación (tabla 1). Prácticamente, todos los ensayos de ELISA destacan por una sensibilidad > 97%, y son recomendados como técnicas de elección para realizar el cribado12,17. Menos estudiadas están las técnicas rápidas, aunque su utilidad es indiscutible por la sencillez de su ejecución y la rapidez (10min)18. La sensibilidad de estas pruebas es variable y continúa en evaluación.
Pruebas comerciales disponibles en España
| Tipo de prueba | Nombre de la prueba | Casa comercial | Tipo de antígeno |
|---|---|---|---|
| Convencional | ORTHO® T. cruzi ELISA Test System | Ortho-Clinical Diagnostics, Johnson & Johnson | Totales |
| CERTESTChagas ELISA Test | Bioschile (Abbott Diagnostic) | Total (Tulahuen, Mn) | |
| ELISAcruzi (enfermedad de Chagas) | bioMérieux S.A. | Total (Y) | |
| Kit Trypanosomiasis IFI | Tryniti-Mardx (Inverness Medical) | Total | |
| Inmunoflúor Chagas IFI | Biocientífica S.A. (Inverness Medical) | Total | |
| No convencional | BioELISA Chagas Biokit | Izaza | TcD, TcE, Pep2, TcLo1.2 |
| ID-PaGIA Chagas antibody test | DIAMED | Ag2, TcE, TcD | |
| Stick Chagas (ICT) | OPERON S.A. (TecLaim) | TcD, TcE, Pep2, SAPA | |
| On Site Chagas Ab Combo Rapid Test | CTK Biotech Inc. (Inverness Medical, BLK diagnostics) | Recombinante |
Un problema importante de los ensayos serológicos es la reactividad cruzada con otras enfermedades como la leishmaniasis. Los ensayos no convencionales suelen presentar un menor número de reacciones inespecíficas, pero no lo descartan al 100%.
Como en la etapa crónica las parasitemias son menores de 10 parásitos/ml16, la detección de ADN del parásito mediante PCR es una prueba complementaria al diagnóstico serológico, es definitoria sólo si es positiva. No obstante, como durante el embarazo la parasitemia suele aumentar, aporta información basal útil en la valoración de la madre.
Esquema diagnóstico a seguir ante todo hijo de madre con enfermedad de ChagasSe basa en la historia de exposición (estancia en zona endémica, hijos de madre con infección por Chagas), la clínica (en la mayoría de los casos ausente) y las pruebas de laboratorio.
Datos clínicos y exploratorios indicativos de enfermedad en el niñoMás del 75% de los niños estarán asintomáticos. Además, no parece que produzca anomalías en el desarrollo fetal, si bien pueden producirse abortos o muerte fetal. En ocasiones, el recién nacido puede presentar formas graves, sobre todo si coexiste con infección por el virus de la inmunodeficiencia humana. La aparición de algún signo clínico se ha observado hasta en el 47% de los casos en series bolivianas, si bien son inespecíficos y comunes a los del grupo TORCH (toxoplasma, rubéola, citomegalovirus y herpes). Los signos graves se observaron en el 27% de los casos, con una mortalidad del 10% en las primeras 48h19. Este hecho parece relacionarse con mayor carga parasitaria y una respuesta inmunitaria inadecuada20,21.
Signos clínicos más frecuentes:
- —
Recién nacido pretérmino o de bajo peso.
- —
Hepatoesplenomegalia, ictericia, fiebre y edemas.
- —
Alteraciones hematológicas: anemia microcítica e hipocroma, leucocitosis/leucopenia, neutropenia, trombocitopenia.
- —
Alteraciones pulmonares: neumonitis, insuficiencia respiratoria.
- —
Taquicardia persistente, aumento de los tiempos de conducción, insuficiencia cardíaca.
- —
Forma meningoencefalítica: convulsiones, rigidez, vómitos.
- —
Alteraciones neurológicas: irritabilidad, temblor, crisis convulsivas, encefalitis, meningitis, calcificaciones cerebrales, microcefalia.
- —
Coriorretinitis.
- —
Hidrocele, etc.
A la embarazada o la parturienta se les realizará el cribado mediante una técnica serológica, que en caso de ser positiva se confirmará con otra de principio diferente. Es conveniente realizar una PCR para evaluar su parasitemia y, posteriormente, valorar su tratamiento para prevenir el riesgo de transmisión en un subsiguiente embarazo.
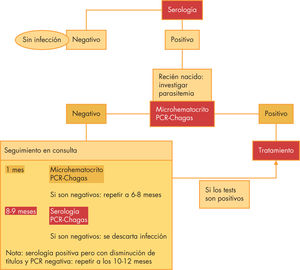
A todo hijo de madre con serología positiva se le solicitará en las primeras 48h de vida microhematocrito y PCR en sangre periférica. Si ambas pruebas son positivas, se ha producido la infección congénita y debe instaurarse el tratamiento específico (a veces si la transición se ha producido en el parto, puede ser difícil la detección en el primer microhematocrito realizado en las primeras 48 horas de vida). Si son negativas, se repetirán las 2 pruebas al mes de vida. Si son positivas, se tratará al niño. Si son negativas, se realizará la detección de anticuerpos IgG específicos a partir de los 8 meses de edad, ya que para entonces los anticuerpos maternos se habrán negativizado. Se han descrito algunos casos en los que la negativización de los anticuerpos no ocurre por encima de los 12 meses, por lo que es importante valorar el título de anticuerpos22 (fig. 3).
Hay que tener presente que:
- —
Los anticuerpos IgG tienen valor si persisten después de los 8 meses de vida.
- —
- —
Se considerará que todo niño hijo de madre con enfermedad de Chagas está infectado si el examen parasitológico es positivo para T. cruzi o se detectan anticuerpos anti-T. cruzi después de los 8-9 meses de edad, con independencia de que esté o no sintomático2 (es importante valorar títulos como ya se dicho por la persistencia de éstos mas tiempo en ocasiones).
Las pruebas complementarias que deben realizase en caso de que se confirme la transmisión de la infección son:
- —
Radiografía de tórax, electrocardiograma y ecocardiografía.
- —
Ecografía cerebral.
- —
Fondo de ojo.
- —
Potenciales evocados.
- —
Radiografía y ecografía abdominal.
No está contraindicada la lactancia materna salvo si hay grietas importantes con sangrado activo.
Tratamiento de la infección de Chagas congénitaEn la actualidad hay 2 tratamientos efectivos, el benznidazol (Rochagan® o Radanil®, Roche, comprimidos de 100mg y disponible como medicamento extranjero) y el nifurtimox (Lampit®, Bayer, comprimidos de 120mg)24,25.
El tratamiento en la fase aguda alcanza tasas de curación muy elevadas, no así en la fase crónica. Así, en menores de 3 años alcanza casi el 100%26, entre 6 y 12 años baja al 62-56%27 y en el adulto sólo alcanza el 8-25%28. Además, a mayor edad, peor tolerancia, que es muy buena en el período neonatal.
Pauta de tratamiento2,9- —
Benznidazol: 5-10mg/kg/día oral, dividido en 2 dosis durante 30-60 días (preferiblemente, 7,5mg/kg/día en 2 dosis 60 días o 10mg/kg/día 30 días) o nifurtimox 10-15mg/kg/día en 3-4 dosis durante 90 días vía oral (menos incidencia de exantemas, como segunda opción si aparecen efectos adversos con benznidazol).
- —
Para evitar los efectos adversos, como exantemas, debe comenzarse con la mitad de la dosis y subir progresivamente hasta alcanzar la máxima en 3-4 días.
- —
Seguimiento semanal para controlar los efectos adversos y el cumplimiento terapéutico.
- —
Realizar microhematocrito y PCR antes y después de finalizado el tratamiento. En el último control, ambas pruebas deben ser negativas, de lo contrario valorar su retratamiento.
- —
Al mismo tiempo realizar la detección de anticuerpos anti-T. cruzi finalizado el tratamiento cada 3-6 meses. La tendencia de la cinética de anticuerpos debe ser hacia la negativización, que es patente desde los 12-24 meses después del tratamiento. La persistencia de anticuerpos por más de 3 años, si se trata de una infección congénita tratada en el primer año, debe considerarse fracaso del tratamiento. Si esto sucede, habría que retratar, aunque este hecho es muy raro y debe valorarse cada caso en particular2,9.
Inusuales en neonatos. Más frecuentes en niños mayores. Benznidazol: leucopenia, reacciones dérmicas, trombocitopenia, alteraciones gastrointestinales, neuropatía periférica (dependiente de la dosis, a partir de 18g).
- —
Pueden aparecer hasta en el 5% de los casos.
- —
El exantema a veces se acompaña de fiebre, irritabilidad y artralgias. Si aparece, se debe bajar la dosis a la mitad y añadir antihistamínicos.
- —
Solicitar hemograma semanal para controlar la toxicidad hemática. En caso de leucopenia o trombocitopenia, suspender la medicación.
- —
Si se corrigen las alteraciones, reintroducirlo de forma progresiva. Si persisten o se reproducen al reiniciar el tratamiento, suspenderlo y probar con nifurtimox.
- —
Las complicaciones más graves son la agranulocitosis y el síndrome de Steven Johnson que son excepcionales y que obligan a la suspensión definitiva.
Nifurtimox: anorexia, pérdida de peso, irritabilidad, insomnio, náuseas, vómitos.
Curación- 1.
Antes de los 6 meses se determina por la negativización del microhematocrito y la PCR.
- 2.
A partir de los 8-9 meses requiere la negativización en la detección de anticuerpos, en 2 controles sucesivos.
La enfermedad de Chagas es, hoy en día, una infección presente en nuestro medio como consecuencia de los flujos migratorios. La Organización Mundial de la Salud en julio de 2007 patrocinó una reunión de expertos para valorar estrategias de control y tratamiento de la enfermedad en países no endémicos, entre los que se encuentra España. El establecimiento sistemático del cribado durante el embarazo de mujeres procedentes de zonas endémicas permitiría detectar precozmente el estado de infección en el neonato, lo que conduciría a su curación y además evitaría, en el caso de las niñas, la posible transmisión posterior a su descendencia. Esto, junto con los costes que supone la enfermedad crónica, apunta a que deberíamos considerar su cribado de forma sistemática en la embarazada procedente de zonas endémicas.
A Gema Guillén e Ignacio González-Granado por todas sus aportaciones directamente traídas de Bolivia. A los integrantes del Servicio de Parasitología del Instituto de Salud Carlos III (Teresa Gárate, Carmen Cañavate, Mercedes Rodriguez y Javier Nieto), así como a Efrén Salto del Servicio de Microbiología del Hospital 12 de Octubre. A los servicios de Ginecología y Neonatología del Hospital 12 de Octubre, en especial a Isabel Camaño y a Concha Alba. Por último, a María Teresa Fernández y a Jesús Ruiz Contreras del Servicio de Inmunodeficiencias del Hospital 12 de Octubre.