Puntos clave
- •
La enfermedad inflamatoria intestinal sigue habitualmente un curso crónico y su incidencia aumenta en la edad pediátrica
- •
El fenotipo inicial de la enfermedad inflamatoria en pediatría (EII-P) es diferente del fenotipo del adulto, con formas más extensas
- •
La nueva clasificación de París de la EII resalta peculiaridades de esta afectación y las diferencias entre niños pequeños y mayores o adolescentes, reconociendo la importancia del retraso de crecimiento en la enfermedad de Crohn (EC)
- •
El espectro de la EII-P va desde formas monogénicas precoces infrecuentes hasta formas poligénicas similares genéticamente a las formas del adulto
- •
La clínica de la EII es heterogénea, digestiva o extradigestiva, lo que puede producir retraso en el diagnóstico
- •
La EII-P puede complicarse con fallo de crecimiento, sobre todo en la EC, y condicionar una talla adulta inferior a la genética.
La enfermedad inflamatoria intestinal (EII) es una enfermedad que se diagnostica cada vez con más frecuencia en los niños y adolescentes, en los cuales se puede presentar con características clínicas especiales, sobre todo con la alteración del crecimiento y desarrollo puberal. La EII pediátrica (EII-P) puede ser una enfermedad severa con una repercusión médica, psicológica y sociofamiliar importante, que requiere idealmente un manejo en unidades multidisciplinares. El pediatra general debe reconocer sus formas de presentación digestivas y extradigestivas, contribuir a su diagnóstico precoz con criterios de derivación adecuados y colaborar en algunos aspectos importantes del manejo conjunto de estos pacientes, que debe hacerse en función de su larga evolución. Se exponen en este artículo aspectos novedosos de su clasificación y etiopatogenia junto a aspectos clínicos relevantes. En una segunda parte se expondrá su diagnóstico y tratamiento.
ConceptoLa EII incluye 2 tipos de procesos inflamatorios idiopáticos y crónicos intestinales: la colitis ulcerosa (CU) y la enfermedad de Crohn (EC). La CU afecta solo al colon, comenzando por el recto, con una extensión proximal continua, exclusivamente mucosa. La EC afecta preferentemente al íleon y el colon, pero puede aparecer en cualquier zona del tracto digestivo, de forma transmural y discontinua. Ambas siguen un curso intermitente con brotes de actividad y remisión. Cuando no se logra definir entre ambos tipos, en formas de afectación cólica exclusiva, se emplea el término de EII no clasificada (EII-noC), antes colitis indeterminada.
Historia natural y clasificación de la enfermedad inflamatoria intestinalEn los últimos años, se han publicado estudios importantes sobre la historia natural de la EII-P1,2. La EC presenta inicialmente un fenotipo inflamatorio (80–90%). Las formas complicadas, estenosantes o fistulizantes, menos frecuentes al inicio, aumentan al doble en los siguientes 5 a 10 años. La distribución de las lesiones es más extensa, ileocólica y del tracto digestivo superior con menos ileítis aisladas (más frecuentes en adultos). La CU también es más extensa (pancolitis) y severa que las formas de adulto (más proctitis o colitis izquierda), progresando de una forma más rápida. Un 30–50% de los pacientes requieren inmunomoduladores a los 12 meses. A los 10 años, un 10–30% de los casos de EII precisarán cirugía.
La clasificación de Montreal3 de la EII se basa en la extensión de la inflamación, en la severidad clínica y, en el caso de la EC, en el comportamiento biológico (inflamatorio, estenosante, fistulizante o penetrante). En ella se establece un solo grupo de edad pediátrica por debajo de los 17 años, pero recientemente se ha propuesto una modificación de la misma en la llamada clasificación de París4 (tabla 1), que atiende a la presencia de algunas de las diferencias fenotípicas anteriores y entre niños de distintas edades, por encima o debajo de los 10 años (en menores de 10 años más formas de colitis en la EC, diferente respuesta serológica, tasas de colectomía menores en la CU). Se amplía y especifica la clasificación de la afectación del tracto digestivo superior y el intestino delgado en la EC (formas que cursan con más afectación del crecimiento, repercusión nutricional y más riesgo de cirugía) y de la extensión y la severidad en la CU (la pancolitis se asocia a un mayor riesgo de cirugía), se introduce el retraso de crecimiento como elemento diferenciador, todo ello por sus implicaciones diagnósticas, terapéuticas y pronósticas en pediatría.
Lectura rápida
La enfermedad inflamatoria intestinal (EII) incluye la colitis ulcerosa (CU) y la enfermedad de Crohn (EC), enfermedades sin curación definitiva pero en las que se han conseguido importantes avances en los últimos años. Ambas siguen un curso crónico variable y heterogéneo, con periodos de actividad y remisión.
Cuando no se logra etiquetar fenotípicamente entre EC y CU se habla de enfermedad inflamatoria no clasificada. Al comienzo, presenta diferencias con la del adulto porque tiene mayor extensión y severidad de las lesiones.
Clasificación de París de la enfermedad inflamatoria intestinal.
| Enfermedad de Crohn | |
| Edad al diagnóstico | A1a: 0–9 años |
| A1b: 10–16 años | |
| A2: 17 a 40 años | |
| A3: > 40 años | |
| Localización | L1:1/3 distal íleon ± ciego |
| L2: colon | |
| L3: ileocolon | |
| L4a: enfermedad alta proximal al Treitz | |
| L4b: enfermedad alta distal al Treitz y proximal al tercio distal íleon | |
| Conducta | B1: no estenosante, no penetrante |
| B2: estenosante | |
| B3: penetrante | |
| B2B3: estenosante y penetrante | |
| P: enfermedad perianal | |
| Crecimiento | G0: sin evidencia de retraso de crecimiento |
| G1: retraso de crecimiento | |
| Colitis ulcerosa | |
| Extensión | E1: proctitis |
| E2: colitis izquierda (distal al ángulo esplénico) | |
| E3: colitis extensa (distal al ángulo hepático) | |
| E4: pancolitis | |
| Severidad | S0: nunca severa |
| S1: alguna vez severa (PUCAI > 65) |
La edad más frecuente de comienzo de la EII es entre la segunda y la cuarta décadas de la vida. Un 7–20% de todos los casos nuevos de EII aparecen por debajo de los 18 años5 Si bien globalmente es más prevalente la CU, en el niño predomina la EC6 La incidencia de la EII-P es variable entre países. Es más frecuente en los industrializados y en las latitudes nórdicas. En el Reino Unido la incidencia de la EII-P es de 5,2 /100.000 (3,1 EC; 1,9 CU; 0,6 EII-noC). En Francia, 5,2 y 0,8/100.000 para la EC y CU, respectivamente. En Norteamérica, la incidencia media es de 7,1/100.000 (4,5 EC). En una reciente revisión sistemática se ha puesto de manifiesto que las tasas de incidencia de la EC en estos países continúan en aumento7 En España se ha constatado un aumento de su prevalencia en los casos diagnosticados en hospitales de todo el país (Martin de Carpi, J. Registro SPIRIT). Es más frecuente en la raza caucásica y especialmente entre los judíos askenazíes. La mayoría de los casos de EII pediátrica aparece en los años de la adolescencia (edad media de 12 años), un 20% antes de los 10 años y 4% antes de los 5 años. La incidencia en estos 2 grupos de edad ha aumentado, sobre todo las formas de afectación cólica exclusiva8 En los niños, la EC es más frecuente en los varones (1,5:1) y no hay diferencias de sexo en la CU9
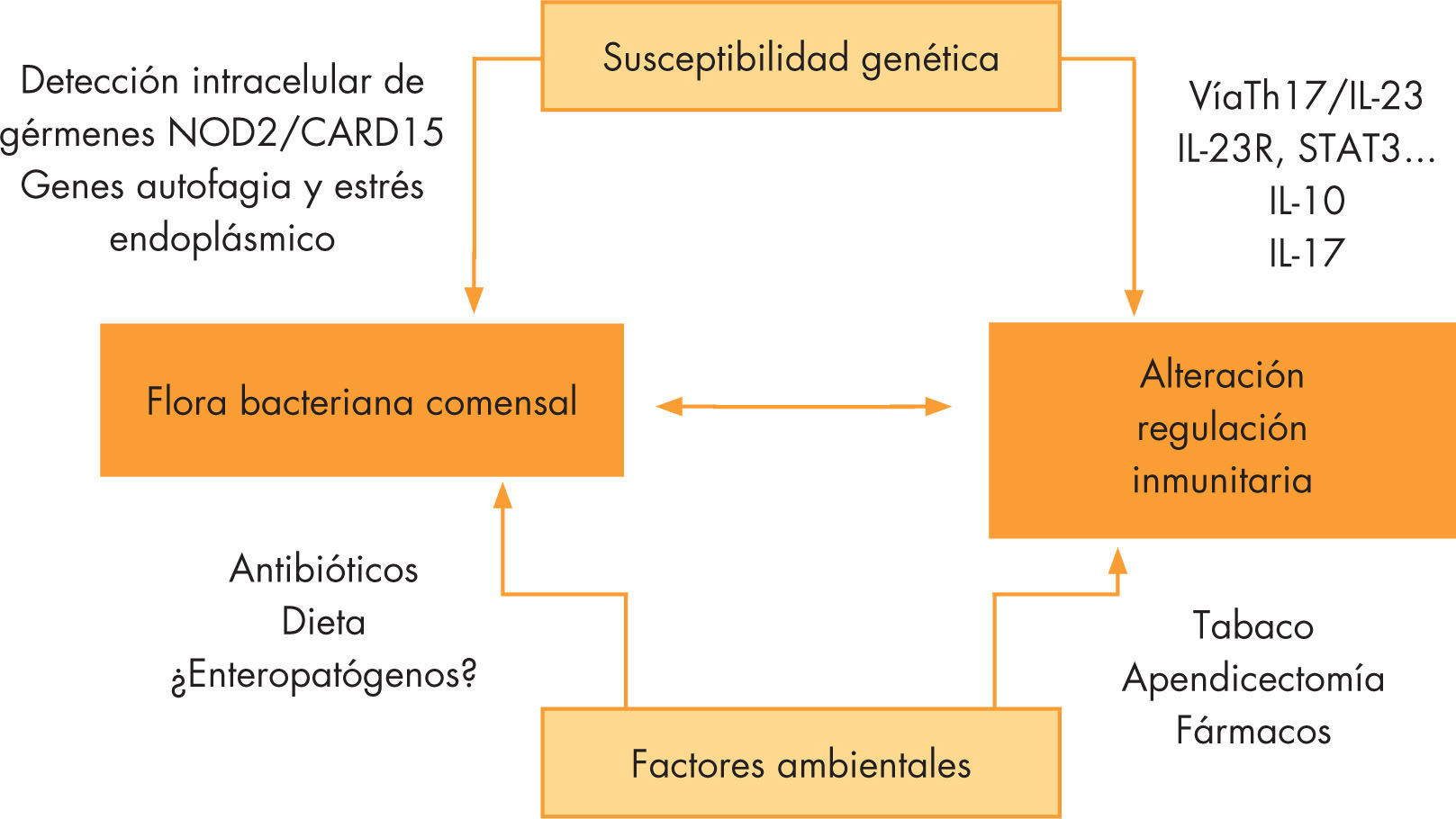
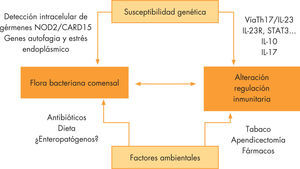
EtiologíaLas causas de la EII no se conocen con precisión, aunque en los últimos años ha habido progresos significativos en el conocimiento de su fisiopatología. Básicamente, existe una respuesta inflamatoria anómala frente a gérmenes de la microbiota intestinal en personas con predisposición genética. Determinados factores ambientales pueden afectar a la composición de la flora bacteriana o acelerar y modular dicha respuesta inmune (fig. 1).
Patogenia de la enfermedad inflamatoria intestinal. Relación entre los mecanismos de susceptibilidad genética y factores ambientales. Vía de señalización Th17 (T helper17)/IL-23 (interleucina 23). IL-10: interleucina 10; IL-17: interleucina 17; IL-23R: receptor interleucina 23; NOD2/CARD15: nucleotide-binding oligomerization domain protein 2. Caspase recruitment domain family 15; STAT3: signal transducer and activator of transcription 3.
La influencia de factores ambientales explica el aumento de la incidencia en las últimas décadas, no atribuible a modificaciones genéticas. Se pone de relieve en el hecho del aumento de casos entre inmigrantes de países subdesarrollados, especialmente cuando migran antes de los 15 años10
Mediante la alteración de los mecanismos de regulación inmunitaria intestinal actúan algunos factores ambientales claramente relacionados con la EII, como la apendicectomía, el tabaco o los fármacos anticonceptivos y antiinflamatorios, evidentemente de influencia dispar en pediatría. La apendicectomía es un factor protector para la CU, especialmente si se efectúa antes de los 20 años, y de riesgo para la EC. El tabaco, o en el caso de los niños la inhalación pasiva de humo, es un importante factor desencadenante y de mal curso de la EC.
Se han correlacionado marcadores de higiene como la falta de agua caliente sanitaria antes de los 11 años, compartir cuarto y baño, contacto con animales domésticos o el hacinamiento, como factores protectores11 Todos ellos se relacionan con la llamada teoría de la higiene, que intenta explicar el aumento de esta y otras enfermedades de base inmunitaria por la exposición a un medio con menos patógenos que tendría como consecuencia un sistema inmunológico menos preparado para el control de la inflamación. Determinados factores como las dietas occidentalizadas, más ricas en azúcares simples y grasas, el uso precoz de antibióticos en los niños12, la ausencia de alimentación con leche materna o determinadas infecciones podrían intervenir en la patogenia a través de la modificación de la microbiota. A pesar de implicarse a determinados agentes infecciosos (Mycobacterium tuberculosis, etc.), en ninguno de ellos ha podido demostrarse una relación causal clara.
Lectura rápida
La EC suele tener un fenotipo inflamatorio al inicio de predominio ileocecal, con mayor afectación gastrointestinal. La forma de la CU más frecuente es la pancolitis. La clasificación de Montreal de la EII de 2005 incluye criterios de edad pediátrica en un solo grupo por debajo de los 17 años, también tipo y extensión de la afectación.
Lectura rápida
En la nueva clasificación de París de la EII se han recogido aspectos peculiares de la EII pediátrica (EII-P), como la subdivisión de la edad pediátrica, ya que los menores de 10 años presentan características fenotípicas y pronósticas diferentes, la inclusión del retraso del crecimiento como un aspecto singular o la afectación diferenciada del intestino delgado según el tramo afectado.
Aunque se han descrito raras formas monogénicas de comienzo infantil13, como mutaciones del gen de la interleucina 10 (IL-10) o de su receptor (IL-10R), el espectro principal de la EC y CU pediátricas son formas genéticas complejas, poligénicas y de penetrancia variable. Apoyan la base genética de la EII la agregación familiar de casos y, especialmente, la concordancia en gemelos monocigóticos (37% para la EC y 10% para la CU). Se estima que el riesgo de presentar EII cuando un padre está afectado de EC es del 9,2% y del 6,2% cuando lo está de CU.
Se han identificado múltiples locus de susceptibilidad mediante estudios de ligamiento o de asociación genómica (genome-wide association studies). Los mecanismos genéticos alterados en la respuesta inmunitaria innata frente a la microbiota son:
- 1.
Reconocimiento de antígenos bacterianos: gen NOD2-CARD15 y otros; el gen NOD2-CARD15 codifica una proteína expresada en monocitos, macrófagos, células dendríticas, linfocitos y células epiteliales, que actúa como un receptor intracelular de reconocimiento de patrones (RRP) (antígenos bacterianos, en este caso el muramil dipéptido).
- 2.
Autofagia, proceso de reciclado de organelas o bacterias intracelulares: gen ATG16L1, IRGM y otros.
- 3.
Estrés endoplásmico, regulado por genes cuya alteración conduce a la formación excesiva de proteínas con plegamiento erróneo y a la apoptosis celular. En la respuesta inmunitaria adaptativa o adquirida, se han relacionado especialmente genes de la vía inflamatoria Th17-IL 23, tanto en la EC como en la CU, o genes de la vía de señalización de la IL-10 en la CU14 Otros genes implicados afectan a mecanismos de la permeabilidad intestinal (DLG5: gen que codifica una proteína relacionada con el mantenimiento de la integridad epitelial, relacionado con la EC) o también a moléculas del HLA.
En algunos estudios de asociación genómica se han identificado algunos locus específicos de la EII-P, entre otros: mutaciones de los genes que codifican la IL-27; gen MTMR3, que interviene en la autofagia, y gen CAPN10 uno, que interviene en el mecanismo de estrés endoplásmico. No obstante, en la mayoría de los estudios publicados, no se muestran unas diferencias significativas entre la EII de comienzo precoz o tardío y la influencia de dichas variantes puede además ser diferente entre poblaciones15 El avance en los conocimientos genéticos y en la relación genotipo-fenotipo permitirá mejorar el enfoque terapéutico en el futuro.
ClínicaLa EC y la CU tienen manifestaciones comunes, pero existen diferencias en la frecuencia de cada uno de los síntomas y signos; además, algunos son exclusivos de la EC, que tiene, en general, una mayor heterogeneidad en su presentación y curso clínico. Los síntomas dependerán de la localización de la inflamación y de su severidad. En muchos casos, la presencia de síntomas inespecíficos o solamente extradigestivos provoca un retraso considerable en el diagnóstico (de varios meses), en especial en la EC16 Debido al aumento de su incidencia, el papel del pediatra de atención primaria es clave en la sospecha diagnóstica de la enfermedad.
Enfermedad de CrohnLa forma más habitual de presentación es con un conjunto variable de manifestaciones digestivas, fundamentalmente dolor abdominal y diarrea, siendo el primero más frecuente en el niño, al contrario que en el adulto, en que predomina la diarrea9 Suele estar localizado en el cuadrante inferior derecho o bien ser periumbilical, intenso, a veces posprandial o nocturno, y repercutir en la calidad de vida. Todo ello, junto a la presencia de otros síntomas o signos digestivos o extradigestivos, serán datos de alarma que lo distinguirán del dolor funcional. En caso de afectación gastroduodenal, el dolor podrá ser epigástrico y tener características dispépticas. La diarrea puede variar en intensidad, ser nocturna y, en la enfermedad cólica, contener sangre o moco. Se estima que al diagnóstico al menos un 50% de los pacientes tienen pérdida de peso y alrededor de un 20% tiene un índice de masa corporal (IMC) bajo, sobre todo en la afectación de intestino delgado. Por otra parte, dado el aumento general de la obesidad, un 10% de los niños con EC (y un 20–30% con CU) tienen un IMC consistente con sobrepeso o riesgo de obesidad17
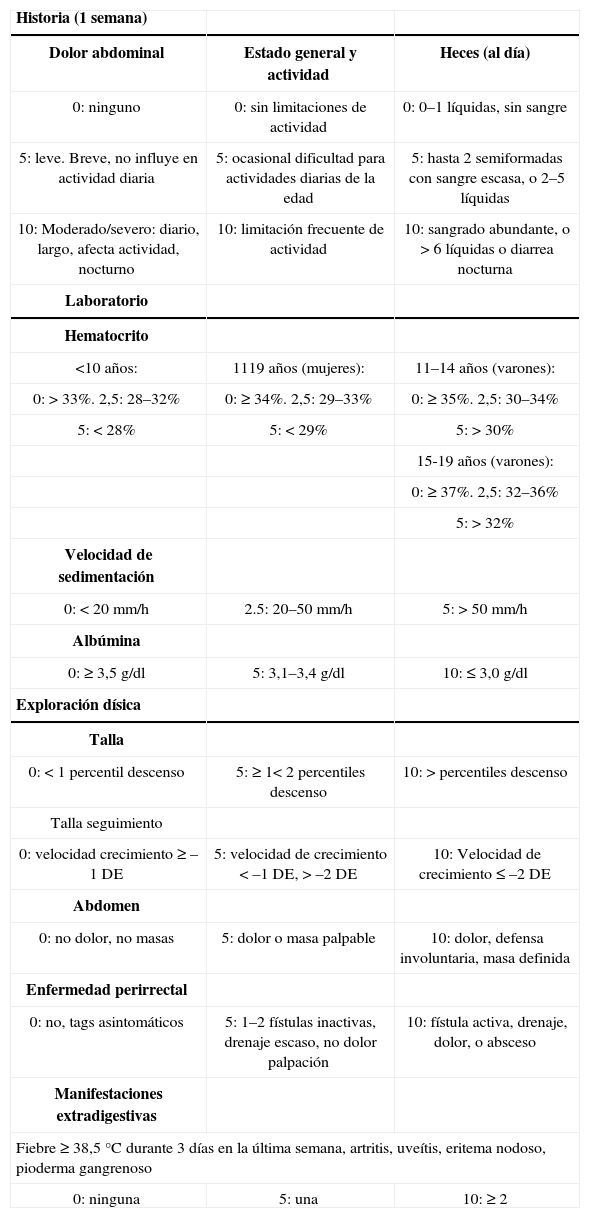
En otras ocasiones, el único síntoma puede ser la disminución de la velocidad de crecimiento, la enfermedad perianal (con una constelación variable de tags o repliegues carnosos, abscesos o fístulas más o menos complejas), o bien distintas manifestaciones extradigestivas. La exploración física puede mostrar palidez (anemia), malnutrición, retraso puberal, masa abdominal inflamatoria, dedos en palillo de tambor o enfermedad perianal. Para la valoración de la intensidad se utiliza el score Pediatric Crohn's Disease Activity Index (PCDAI), que incluye síntomas y signos clínicos, datos analíticos y del crecimiento (tabla 2).
Índice de actividad de la enfermedad de Crohn pediátrica
| Historia (1 semana) | ||
| Dolor abdominal | Estado general y actividad | Heces (al día) |
| 0: ninguno | 0: sin limitaciones de actividad | 0: 0–1 líquidas, sin sangre |
| 5: leve. Breve, no influye en actividad diaria | 5: ocasional dificultad para actividades diarias de la edad | 5: hasta 2 semiformadas con sangre escasa, o 2–5 líquidas |
| 10: Moderado/severo: diario, largo, afecta actividad, nocturno | 10: limitación frecuente de actividad | 10: sangrado abundante, o > 6 líquidas o diarrea nocturna |
| Laboratorio | ||
| Hematocrito | ||
| <10 años: | 1119 años (mujeres): | 11–14 años (varones): |
| 0: > 33%. 2,5: 28–32% | 0: ≥ 34%. 2,5: 29–33% | 0: ≥ 35%. 2,5: 30–34% |
| 5: < 28% | 5: < 29% | 5: > 30% |
| 15-19 años (varones): | ||
| 0: ≥ 37%. 2,5: 32–36% | ||
| 5: > 32% | ||
| Velocidad de sedimentación | ||
| 0: < 20 mm/h | 2.5: 20–50 mm/h | 5: > 50 mm/h |
| Albúmina | ||
| 0: ≥ 3,5 g/dl | 5: 3,1–3,4 g/dl | 10: ≤ 3,0 g/dl |
| Exploración dísica | ||
| Talla | ||
| 0: < 1 percentil descenso | 5: ≥ 1< 2 percentiles descenso | 10: > percentiles descenso |
| Talla seguimiento | ||
| 0: velocidad crecimiento ≥ –1 DE | 5: velocidad de crecimiento < –1 DE, > –2 DE | 10: Velocidad de crecimiento ≤ –2 DE |
| Abdomen | ||
| 0: no dolor, no masas | 5: dolor o masa palpable | 10: dolor, defensa involuntaria, masa definida |
| Enfermedad perirrectal | ||
| 0: no, tags asintomáticos | 5: 1–2 fístulas inactivas, drenaje escaso, no dolor palpación | 10: fístula activa, drenaje, dolor, o absceso |
| Manifestaciones extradigestivas | ||
| Fiebre ≥ 38,5°C durante 3 días en la última semana, artritis, uveítis, eritema nodoso, pioderma gangrenoso | ||
| 0: ninguna | 5: una | 10: ≥ 2 |
PCDAI > 30 brote moderado o severo. PCDAI 11-29 brote leve. PCDAI < 10 remisión clínica. Tomado de Hyams JS, Ferry GD, Mandel FS, Gryboski JD, Kibort PM, Kirschner BS, et al. Development and validation of a pediatric Crohn's disease activity index. J Pediatr Gastroenterol Nutr. 1991;12:439-47.
Los síntomas más frecuentes son diarrea y rectorragia, asociadas a dolor abdominal cólico y a síntomas de urgencia defecatoria o tenesmo. Las formas de presentación varían en gravedad según la severidad y la extensión de la afectación: proctitis, proctosigmoiditis, colitis izquierda o pancolitis.
Lectura rápida
La EII-P ha aumentado en frecuencia en las últimas décadas. Hasta un 20% de todos casos de EII se presentan en la edad pediátrica, sobre todo alrededor de la pubertad. La etiopatogenia es compleja y no bien conocida, relacionándose con una respuesta inflamatoria anómala a la microbiota, en la que participan factores genéticos y ambientales múltiples.
En los niños, la proctitis aislada es menos frecuente que en el adulto y se extiende a zonas proximales en un 30–50% de los casos18. La pancolitis es la forma más frecuente en pediatría. En la afectación leve no existen síntomas sistémicos y la exploración física es normal. En casos moderados, el número de deposiciones es mayor con malestar, fiebre o pérdida de peso y anemia. Al menos en un 10% de los casos la presentación es en forma de colitis severa, con más de 5 deposiciones con sangre abundante e importante repercusión sistémica. El score de actividad Pediatric Ulcerative Colitis Activity Index (PUCAI) es una herramienta sencilla que utiliza parámetros exclusivamente clínicos para valorar el grado de severidad (tabla 3).
Índice de actividad de la colitis ulcerosa pediátrica.
| Variable | Puntuación |
| 1. Dolor abdominal | |
| No | 0 |
| Puede ignorarse | 5 |
| No puede ignorarse | 10 |
| 2. Sangrado rectal | |
| No | 0 |
| Sangre escasa en < 50% deposiciones | 10 |
| Sangre escasa en la mayoría de las deposiciones | 20 |
| Sangre abundante (> 50% de las deposiciones) | 30 |
| 3. Consistencia de la mayoría de las heces | |
| Formadas | 0 |
| Parcialmente formadas | 5 |
| Completamente deshechas | 10 |
| 4. Número de heces al día | |
| 0–2 | 0 |
| 3–5 | 5 |
| 6–8 | 10 |
| > 8 | 15 |
| 5. Heces nocturnas | |
| No | 0 |
| Sí | 10 |
| 6. Nivel de actividad | |
| No limitada | 0 |
| Parcialmente limitada | 5 |
| Severamente limitada | 10 |
| Suma | 0–85 |
PUCAI < 10: remisión. PUCAI 10-34: brote leve. PUCAI 35-64: brote moderado. PUCAI > 65 brote severo. Turner D, Otley AR, Mack D, Hyams T, de Bruijne J, Uusove K, et al. Development and evaluation of a Pediatric Ulcerative Colitis Activity Index (PUCAI): a prospective multicenter study. Gastroenterology. 2007;133:423-32.
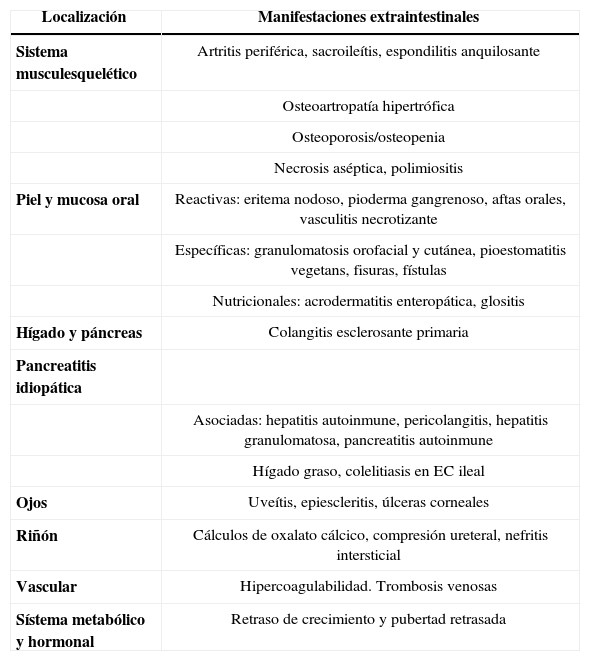
La EII se considera una enfermedad multisistémica de tal forma que hasta un 30% de los pacientes desarrolla algún tipo de manifestación extradigestiva a lo largo de la evolución (tabla 4). La mayoría se relacionan con la inflamación intestinal, aunque algunas, como la colangitis esclerosante primaria, la espondilitis anquilosante o la uveítis, puedan seguir un curso independiente de la actividad intestinal. Las más frecuentes son musculoesqueléticas (articulares, óseas), cutáneas, orales u oculares. Otras son consecuencia del daño intestinal por contigüidad (uropatía obstructiva, fístulas) o por malabsorción (hiperoxaluria, litiasis renal). En los pacientes con EII existe un estado de hipercoagulabilidad con tendencia trombótica debido a factores diversos como la inflamación, reposo, cirugía, trombocitosis, presencia de anticuerpos antifosfolípido, alteraciones genéticas (hiperhomocistinemia, factor V Leyden, etc.) o tratamientos (metotrexato). Un paciente con tromboembolismo y estudio hematológico negativo debe ser estudiado para el diagnóstico de EII19
Lectura rápida
El espectro de la EII-P va desde formas monogénicas precoces infrecuentes hasta formas poligénicas similares a las del adulto, aunque se han identificado algunos genes implicados en el debut precoz que se relacionan con la inmunidad innata o adquirida. La clínica de la EII-P incluye síntomas y signos digestivos, como diarrea, dolor abdominal o sangrado rectal, o manifestaciones inespecíficas o extraintestinales que dificultan y retrasan el diagnóstico, condicionando en ocasiones una mayor extensión de la enfermedad o la presencia de complicaciones.
Manifestaciones extraintestinales de la enfermedad inflamatoria intestinal.
| Localización | Manifestaciones extraintestinales |
| Sistema musculesquelético | Artritis periférica, sacroileítis, espondilitis anquilosante |
| Osteoartropatía hipertrófica | |
| Osteoporosis/osteopenia | |
| Necrosis aséptica, polimiositis | |
| Piel y mucosa oral | Reactivas: eritema nodoso, pioderma gangrenoso, aftas orales, vasculitis necrotizante |
| Específicas: granulomatosis orofacial y cutánea, pioestomatitis vegetans, fisuras, fístulas | |
| Nutricionales: acrodermatitis enteropática, glositis | |
| Hígado y páncreas | Colangitis esclerosante primaria |
| Pancreatitis idiopática | |
| Asociadas: hepatitis autoinmune, pericolangitis, hepatitis granulomatosa, pancreatitis autoinmune | |
| Hígado graso, colelitiasis en EC ileal | |
| Ojos | Uveítis, epiescleritis, úlceras corneales |
| Riñón | Cálculos de oxalato cálcico, compresión ureteral, nefritis intersticial |
| Vascular | Hipercoagulabilidad. Trombosis venosas |
| Sístema metabólico y hormonal | Retraso de crecimiento y pubertad retrasada |
Existe también una base genética en las manifestaciones extradigestivas, como lo demuestra la concordancia en gemelos y fundamentalmente la asociación con los HLA, por ejemplo HLA B27 con la espondilitis anquilosante y HLA B8/DR3 con la colangitis esclerosante.
Enfermedad mineral óseaLos niños y adolescentes con EII están expuestos a sufrir déficit óseos por el efecto negativo de las citocinas proinflamatorias (factor de necrosis tumoral alfa [TNF-α], IL-1, IL-6…) en la fase activa de la enfermedad, por el retraso puberal, la malnutrición y la malabsorción, o por ingesta reducida de nutrientes (vitamina D, calcio) y por los tratamientos con corticoides20 La prevalencia de este problema es variable (entre un 8 y 40%), mayor en la EC, sobre todo en casos de retraso de crecimiento, maduración sexual y bajo índice masa magra. La variabiliad de la prevalencia se debe, en parte, a la dificultad de interpretación de la densitometría ósea, que debe ser comparada con estándares adecuados según el sexo y la edad o el tamaño. Debe ajustarse a la edad ósea. Se define una baja densidad mineral ósea (DMO) como un Z score ≤ 2,0 desviaciones estándar (DE), frente al T score del adulto < 2,5 DE (comparación con la media de DMO de adultos jóvenes en momento del pico de masa ósea). La pérdida de DMO puede predisponer a fracturas, sobre todo en la vida adulta. Este aspecto de la enfermedad, clínicamente silente en la mayoría de los casos, debe ser valorado al diagnóstico y especialmente en niños con tratamiento esteroideo, mal control de la enfermedad o historia de fracturas. Precisa entonces tratamiento con vitamina D, calcio o en casos severos, bifosfonatos.
Retraso de crecimientoLa afectación del crecimiento y el desarrollo puberal es un aspecto específico de la EII pediátrica y su reconocimiento, prevención y tratamiento constituyen un objetivo básico en el manejo de esta enfermedad. Puede ocurrir entre el 15 y el 40% de los niños con EII en algún momento de su evolución. El principal factor implicado es la actividad inflamatoria intestinal y mal control de la enfermedad. Se caracteriza por una caída en la velocidad de crecimiento reflejada en el descenso del percentil de talla de una o más DE con respecto a la talla previa, o el cese del crecimiento en un periodo de 6 meses al menos. También puede ser definido al final del crecimiento como un Z score de talla por debajo de 1 DE con respecto a la talla genética. Se presenta sobre todo en la EC, puede preceder durante meses a la clínica digestiva tras una caída significativa del peso ideal para la talla y condicionar una pérdida de talla final en un subgrupo de riesgo (el 19% de los adultos con EC diagnosticada antes de los 16 años tendrán una talla final inferior a su potencial genético). La enfermedad yeyunal y el retraso en el diagnóstico influyen negativamente en la talla adulta21 Su etiología es multifactorial22: a) malnutrición (disminución de la ingesta, malabsorción, pérdidas incrementadas de nutrientes, aumento de requerimientos de energía); b) inflamación (influencia negativa de citocinas proinflamatorias), y c) corticoides. La malnutrición aumenta la resistencia periférica a la hormona de crecimiento y reduce la forma activa libre de la HC o insulin growth factor 1 (IGF-1). Las citocinas proinflamatorias tienen un efecto inhibidor directo sobre el cartílago de crecimiento (TNF-α) e influyen negativamente en la nutrición (disminución de leptina, anorexia). Las hormonas sexuales inducen la aceleración puberal del crecimiento dependiendo de la IGF-1 y de la hormona del crecimiento. Por ello, y por la inhibición directa de las hormonas hipofisarias liberadoras, el retraso del crecimiento se acompaña de retraso puberal. En las mujeres, la aceleración del crecimiento es anterior a la menarquia y en los varones es más tarde y más larga, por lo que los varones son más vulnerables a presentar alteraciones de crecimiento23 Además, en un reciente estudio, se ha comprobado que la correlación de los marcadores inflamatorios (proteína C reactiva) con los niveles de IGF-1 y las hormonas sexuales es mayor en varones en estadios 1 y 2 de Tanner que en mujeres, por lo que puede existir un mecanismo directo que explique la mayor incidencia del retraso del crecimiento en varones24 Los corticoides reducen los niveles de IGF-1, aumentan el catabolismo proteico y desvían la diferenciación de las células mesenquimales de osteoblastos a adipocitos.
Lectura rápida
El retraso de crecimiento y la enfermedad mineral ósea son consecuencia de la inflamación intestinal y junto a la valoración nutricional forman una parte especial de la evaluación de la EII-P. El retraso de crecimiento puede ser el único síntoma y condicionar una talla adulta inferior al potencial genético en situaciones de mal control de la enfermedad. Es más frecuente en varones. Junto a la enfermedad ósea, puede presentarse o a lo largo de la evolución, favorecido por los corticoides.
La medición de la velocidad de crecimiento, la valoración del estadio puberal y la edad ósea, el cálculo del score Z cada 3 a 6 meses, forman parte del control específico pediátrico de la EII, individualizado en cada caso según la talla genética. Debe tenerse en cuenta su repercusión psicosocial y la posible necesidad de tratamiento hormonal específico por el endocrinólogo infantil25
Los autores declaran no tener ningún conflicto de intereses.